From Wikipedia, the free encyclopedia
| Ferritin | |||||||
|---|---|---|---|---|---|---|---|

Structure of the murine ferritin complex[1] |
|||||||
| Identifiers | |||||||
| Symbol | Ferritin | ||||||
| Pfam | PF00210 | ||||||
| Pfam clan | CL0044 | ||||||
| InterPro | IPR008331 | ||||||
| SCOP2 | 1fha / SCOPe / SUPFAM | ||||||
|
| ferritin, light polypeptide | |||||
|---|---|---|---|---|---|
| Identifiers | |||||
| Symbol | FTL | ||||
| NCBI gene | 2512 | ||||
| HGNC | 3999 | ||||
| OMIM | 134790 | ||||
| RefSeq | NM_000146 | ||||
| UniProt | P02792 | ||||
| Other data | |||||
| Locus | Chr. 19 q13.3–13.4 | ||||
|
| ferritin, heavy polypeptide 1 | |||||
|---|---|---|---|---|---|
| Identifiers | |||||
| Symbol | FTH1 | ||||
| Alt. symbols | FTHL6 | ||||
| NCBI gene | 2495 | ||||
| HGNC | 3976 | ||||
| OMIM | 134770 | ||||
| RefSeq | NM_002032 | ||||
| UniProt | P02794 | ||||
| Other data | |||||
| Locus | Chr. 11 q13 | ||||
|
| ferritin mitochondrial | |||||
|---|---|---|---|---|---|

Crystallographic structure of mitochondrial ferritin.[2] |
|||||
| Identifiers | |||||
| Symbol | FTMT | ||||
| NCBI gene | 94033 | ||||
| HGNC | 17345 | ||||
| OMIM | 608847 | ||||
| RefSeq | NM_177478 | ||||
| UniProt | Q8N4E7 | ||||
| Other data | |||||
| Locus | Chr. 5 q23.1 | ||||
|
Ferritin is a universal intracellular protein that stores iron and releases it in a controlled fashion. The protein is produced by almost all living organisms, including archaea, bacteria, algae, higher plants, and animals. It is the primary intracellular iron-storage protein in both prokaryotes and eukaryotes, keeping iron in a soluble and non-toxic form. In humans, it acts as a buffer against iron deficiency and iron overload.[3]
Ferritin is found in most tissues as a cytosolic protein, but small amounts are secreted into the serum where it functions as an iron carrier. Plasma ferritin is also an indirect marker of the total amount of iron stored in the body; hence, serum ferritin is used as a diagnostic test for iron-deficiency anemia.[4] Aggregated ferritin transforms into a toxic form of iron called hemosiderin.[5]
Ferritin is a globular protein complex consisting of 24 protein subunits forming a hollow nanocage with multiple metal–protein interactions.[6] Ferritin that is not combined with iron is called apoferritin.[citation needed]
Gene[edit]
Ferritin genes are highly conserved between species. All vertebrate ferritin genes have three introns and four exons.[7] In human ferritin, introns are present between amino acid residues 14 and 15, 34 and 35, and 82 and 83; in addition, there are one to two hundred untranslated bases at either end of the combined exons.[8] The tyrosine residue at amino acid position 27 is thought to be associated with biomineralization.[9]
Protein structure[edit]
Ferritin is a hollow globular protein of mass 474 kDa and comprising 24 subunits. Typically it has internal and external diameters of about 8 and 12 nm, respectively.[10] The nature of these subunits varies by class of organism:
- In vertebrates, the subunits are of two types, light (L) and heavy (H), which have apparent molecular mass of 19 kDa and 21 kDa, respectively; their sequences are homologous (about 50% identical).[8]
- Amphibians have an additional («M») type of ferritin.[11]
- Plants and bacteria have a single ferritin; it most closely resembles the vertebrate H-type.[11]
- In the gastropods of the genus Lymnaea, two types have been recovered, from somatic cells and the yolk, respectively (see below).[11]
- In the pearl oyster Pinctada fucata, an additional subunit resembling Lymnaea soma ferritin is associated with shell formation.[12]
- In the parasite Schistosoma, two types are present: one in males, the other in females.[11]
All the aforementioned ferritins are similar, in terms of their primary sequence, with the vertebrate H-type.[11] In E. coli, a 20% similarity to human H-ferritin is observed.[11]
Some ferritin complexes in vertebrates are hetero-oligomers of two highly related gene products with slightly different physiological properties. The ratio of the two homologous proteins in the complex depends on the relative expression levels of the two genes.
Inside the ferritin shell, iron ions form crystallites together with phosphate and hydroxide ions. The resulting particle is similar to ferrihydrite. Each ferritin complex can store about 4500 iron (Fe3+) ions.[8][11]
A human mitochondrial ferritin, MtF, was found to express as a pro-protein.[13] When a mitochondrion takes it up, it processes it into a mature protein similar to the ferritins found in the cytoplasm, which it assembles to form functional ferritin shells. Unlike other human ferritins, it appears to have no introns in its genetic code. An X-ray diffraction study has revealed that its diameter is 1.70 angstroms (0.17 nm), it contains 182 residues, and is 67% helical. The mitochondrial ferritin’s Ramachandran plot[14] shows its structure to be mainly alpha helical with a low prevalence of beta sheets.
Function[edit]
Iron storage[edit]
Iron uptake through the 3-fold channel of ferritin
Ferritin is present in every cell type.[8] It serves to store iron in a non-toxic form, to deposit it in a safe form, and to transport it to areas where it is required.[15] The function and structure of the expressed ferritin protein varies in different cell types. This is controlled primarily by the amount and stability of messenger RNA (mRNA), but also by changes in how the mRNA is stored and how efficiently it is transcribed.[8] One major trigger for the production of many ferritins is the mere presence of iron;[8] an exception is the yolk ferritin of Lymnaea sp., which lacks an iron-responsive unit.[11]
Free iron is toxic to cells as it acts as a catalyst in the formation of free radicals from reactive oxygen species via the Fenton reaction.[16] Hence vertebrates have an elaborate set of protective mechanisms to bind iron in various tissue compartments[discuss]. Within cells, iron is stored in a protein complex as ferritin or the related complex hemosiderin. Apoferritin binds to free ferrous iron and stores it in the ferric state. As ferritin accumulates within cells of the reticuloendothelial system, protein aggregates are formed as hemosiderin. Iron in ferritin or hemosiderin can be extracted for release by the RE cells, although hemosiderin is less readily available. Under steady-state conditions, the level of ferritin in the blood serum correlates with total body stores of iron; thus, the serum ferritin FR5Rl is the most convenient laboratory test to estimate iron stores.[citation needed]
Because iron is an important mineral in mineralization, ferritin is employed in the shells of organisms such as molluscs to control the concentration and distribution of iron, thus sculpting shell morphology and colouration.[17][18] It also plays a role in the haemolymph of the polyplacophora, where it serves to rapidly transport iron to the mineralizing radula.[19]
Iron is released from ferritin for use by ferritin degradation, which is performed mainly by lysosomes.[20]
Ferroxidase activity[edit]
Vertebrate ferritin consists of two or three subunits which are named based on their molecular weight: L «light», H «heavy», and M «middle» subunits. The M subunit has only been reported in bullfrogs. In bacteria and archaea, ferritin consists of one subunit type.[21] H and M subunits of eukaryotic ferritin and all subunits of bacterial and archaeal ferritin are H-type and have ferroxidase activity, which is the conversion of iron from the ferrous (Fe2+) to ferric (Fe3+) forms. This limits the deleterious reaction which occurs between ferrous iron and hydrogen peroxide known as the Fenton reaction which produces the highly damaging hydroxyl radical. The ferroxidase activity occurs at a diiron binding site in the middle of each H-type subunits.[21][22] After oxidation of Fe(II), the Fe(III) product stays metastably in the ferroxidase center and is displaced by Fe(II),[22][23] a mechanism that appears to be common among ferritins of all three kingdoms of life.[21] The light chain of ferritin has no ferroxidase activity but may be responsible for the electron transfer across the protein cage.[24]
Immune response[edit]
Ferritin concentrations increase drastically in the presence of an infection or cancer. Endotoxins are an up-regulator of the gene coding for ferritin, thus causing the concentration of ferritin to rise. By contrast, organisms such as Pseudomonas, although possessing endotoxin, cause plasma ferritin levels to drop significantly within the first 48 hours of infection. Thus, the iron stores of the infected body are denied to the infective agent, impeding its metabolism.[25]
Stress response[edit]
The concentration of ferritin has been shown to increase in response to stresses such as anoxia;[26] this implies that it is an acute phase protein.[27]
Mitochondria[edit]
Mitochondrial ferritin has many roles pertaining to molecular function. It participates in ferroxidase activity, binding, iron ion binding, oxidoreductase activity, ferric iron binding, metal ion binding as well as transition metal binding. Within the realm of biological processes it participates in oxidation-reduction, iron ion transport across membranes and cellular iron ion homeostasis.[citation needed]
Yolk[edit]
In some snails, the protein component of the egg yolk is primarily ferritin;[28] this is a different ferritin, with a different genetic sequence, from the somatic ferritin. It is produced in the midgut glands and secreted into the haemolymph, whence it is transported to the eggs.[28]
Tissue distribution[edit]
In vertebrates, ferritin is usually found within cells, although it is also present in smaller quantities in the plasma.[25]
Diagnostic uses[edit]
Serum ferritin levels are measured in medical laboratories as part of the iron studies workup for iron-deficiency anemia.[6] They are measured in nanograms per milliliter (ng/mL) or micrograms per liter (μg/L); the two units are equivalent.
The ferritin levels measured usually have a direct correlation with the total amount of iron stored in the body. However, ferritin levels may be artificially high in cases of anemia of chronic disease, where ferritin is elevated in its capacity as an inflammatory acute phase protein and not as a marker for iron overload.[citation needed]
Normal ranges[edit]
A normal ferritin blood level, referred to as the reference interval is determined by many testing laboratories. The ranges for ferritin can vary between laboratories but typical ranges would be between 30 and 300 ng/mL (=μg/L) for males, and 30–160 ng/mL (=μg/L) for females.
| Men | 18–270 ng/mL (μg/L) |
| Women | 30–160 ng/mL (μg/L) |
| Children (6 months to 15 years) | 50–140 ng/mL (μg/L) |
| Infants (1 to 5 months) | 50–200 ng/mL (μg/L) |
| Neonates | 25–200 ng/mL (μg/L) |
Deficiency[edit]
According to a 2014 review in the New England Journal of Medicince stated that a ferritin level below 30 ng/mL indicates iron deficiency, while a level below 10 ng/mL indicates iron-deficiency anemia.[29] A 2020 World Health Organization guideline states that ferritin indicates iron deficiency below 12 ng/mL in apparently-healthy children under 5 and 15 ng/mL in apparently-healthy individuals of 5 and over.[30]
Some studies suggest that women with fatigue and ferritin below 50 ng/mL see reduced fatigue after iron supplementation.[31][32]
In the setting of anemia, low serum ferritin is the most specific lab finding for iron-deficiency anemia.[33] However it is less sensitive, since its levels are increased in the blood by infection or any type of chronic inflammation,[34] and these conditions may convert what would otherwise be a low level of ferritin from lack of iron, into a value in the normal range. For this reason, low ferritin levels carry more information than those in the normal range. A falsely low blood ferritin (equivalent to a false positive test) is very uncommon,[34] but can result from a hook effect of the measuring tools in extreme cases.[35]
Low ferritin may also indicate hypothyroidism, vitamin C deficiency or celiac disease.[citation needed]
Low serum ferritin levels are seen in some patients with restless legs syndrome, not necessarily related to anemia, but perhaps due to low iron stores short of anemia.[36][37]
Vegetarianism is not a cause of low serum ferritin levels, according to the American Dietetic Association’s position in 2009: «Incidence of iron-deficiency anemia among vegetarians is similar to that of non-vegetarians. Although vegetarian adults have lower iron stores than non-vegetarians, their serum ferritin levels are usually within the normal range.»[38]
Excess[edit]
If ferritin is high, there is iron in excess or else there is an acute inflammatory reaction in which ferritin is mobilized without iron excess. For example, ferritins may be high in infection without signaling body iron overload.
Ferritin is also used as a marker for iron overload disorders, such as hemochromatosis or hemosiderosis. Adult-onset Still’s disease, some porphyrias, and hemophagocytic lymphohistiocytosis/macrophage activation syndrome are diseases in which the ferritin level may be abnormally raised.
As ferritin is also an acute-phase reactant, it is often elevated in the course of disease. A normal C-reactive protein can be used to exclude elevated ferritin caused by acute phase reactions.[citation needed]
Ferritin has been shown to be elevated in some cases of COVID-19 and may correlate with worse clinical outcome.[39][40]
Ferritin and IL-6 are considered to be possible immunological biomarkers for severe and fatal cases of COVID-19. Ferritin and C-reactive protein may be possible screening tools for early diagnosis of systemic inflammatory response syndrome in cases of COVID-19.[41][42]
According to a study of anorexia nervosa patients, ferritin can be elevated during periods of acute malnourishment, perhaps due to iron going into storage as intravascular volume and thus the number of red blood cells falls.[43]
Another study suggests that due to the catabolic nature of anorexia nervosa, isoferritins may be released. Furthermore, ferritin has significant non-storage roles within the body, such as protection from oxidative damage. The rise of these isoferritins may contribute to an overall increase in ferritin concentration. The measurement of ferritin through immunoassay or immunoturbidimeteric methods may also be picking up these isoferritins thus not a true reflection of iron storage status.[44]
Studies reveal that a transferrin saturation (serum iron concentration ÷ total iron binding capacity) over 60 percent in men and over 50 percent in women identified the presence of an abnormality in iron metabolism (hereditary hemochromatosis, heterozygotes, and homozygotes) with approximately 95 percent accuracy. This finding helps in the early diagnosis of hereditary hemochromatosis, especially while serum ferritin still remains low. The retained iron in hereditary hemochromatosis is primarily deposited in parenchymal cells, with reticuloendothelial cell accumulation occurring very late in the disease. This is in contrast to transfusional iron overload in which iron deposition occurs first in the reticuloendothelial cells and then in parenchymal cells. This explains why ferritin levels remain relative low in hereditary hemochromatosis, while transferrin saturation is high.[45][46]
In chronic liver diseases[edit]
Hematological abnormalities often associate with chronic liver diseases. Both iron overload and iron deficient anemia have been reported in patients with liver cirrhosis.[47][48] The former is mainly due to reduced hepcidin level caused by the decreased synthetic capacity of the liver, while the latter is due to acute and chronic bleeding caused by portal hypertension. Inflammation is also present in patients with advanced chronic liver disease. As a consequence, elevated hepatic and serum ferritin levels are consistently reported in chronic liver diseases.[49][50][51]
Studies showed association between high serum ferritin levels and increased risk of short-term mortality in cirrhotic patients with acute decompensation[52] and acute-on-chronic liver failure.[53] An other study found association between high serum ferritin levels and increased risk of long-term mortality in compensated and stable decompensated cirrhotic patients.[54] The same study demonstrated that increased serum ferritin levels could predict the development of bacterial infection in stable decompensated cirrhotic patients, while in compensated cirrhotic patients the appearance of the very first acute decompensation episode showed higher incidence in patients with low serum ferritin levels. This latter finding was explaind by the association between chronic bleeding and increased portal pressure.[54]
Applications[edit]
Ferritin is used in materials science as a precursor in making iron nanoparticles for carbon nanotube growth by chemical vapor deposition.
Cavities formed by ferritin and mini-ferritins (Dps) proteins have been successfully used as the reaction chamber for the fabrication of metal nanoparticles (NPs).[55][56][57][58] Protein shells served as a template to restrain particle growth and as a coating to prevent coagulation/aggregation between NPs. Using various sizes of protein shells, various sizes of NPs can be easily synthesized for chemical, physical and bio-medical applications.[6][59]
Experimental COVID-19 vaccines have been produced that display the spike protein’s receptor binding domain on the surface of ferritin nanoparticles.[60]
Notes[edit]
The primary sequence of human ferritin is MTTASTSQVR QNYHQDSEAA INRQINLELY ASYVYLSMSY YFDRDDVALK NFAKYFLHQS HEEREHAEKL MKLQNQRGGR IFLQDIKKPD CDDWESGLNA MECALHLEKN VNQSLLEFPS PISPSPSCWH HYTTNRPQPQ HHLLRPRRRK RPHSIPTPIL IFRSP.[61]
See also[edit]
- Bacterioferritin
- DNA-binding protein from starved cells
- Ferritin light chain
- Transferrin
References[edit]
- ^ PDB: 1lb3; Granier T, Langlois d’Estaintot B, Gallois B, Chevalier JM, Précigoux G, Santambrogio P, Arosio P (January 2003). «Structural description of the active sites of mouse L-chain ferritin at 1.2 A resolution». Journal of Biological Inorganic Chemistry. 8 (1–2): 105–11. doi:10.1007/s00775-002-0389-4. PMID 12459904. S2CID 20756710.
- ^ PDB: 1r03; Langlois d’Estaintot B, Santambrogio P, Granier T, Gallois B, Chevalier JM, Précigoux G, Levi S, Arosio P (July 2004). «Crystal structure and biochemical properties of the human mitochondrial ferritin and its mutant Ser144Ala». Journal of Molecular Biology. 340 (2): 277–93. doi:10.1016/j.jmb.2004.04.036. PMID 15201052.
- ^ Casiday R, Frey R. «Iron Use and Storage in the Body: Ferritin and Molecular Representations». Department of Chemistry, Washington University in St. Louis.
- ^ Wang W, Knovich MA, Coffman LG, Torti FM, Torti SV (August 2010). «Serum ferritin: Past, present and future». Biochimica et Biophysica Acta (BBA) — General Subjects. 1800 (8): 760–9. doi:10.1016/j.bbagen.2010.03.011. PMC 2893236. PMID 20304033.
- ^ MacKenzie EL, Iwasaki K, Tsuji Y (June 2008). «Intracellular iron transport and storage: from molecular mechanisms to health implications». Antioxidants & Redox Signaling. 10 (6): 997–1030. doi:10.1089/ars.2007.1893. PMC 2932529. PMID 18327971.
- ^ a b c Theil EC (2012). «Ferritin protein nanocages-the story». Nanotechnology Perceptions. 8 (1): 7–16. doi:10.4024/N03TH12A.ntp.08.01. PMC 3816979. PMID 24198751.
- ^ Torti FM, Torti SV (May 2002). «Regulation of ferritin genes and protein». Blood. 99 (10): 3505–16. doi:10.1182/blood.V99.10.3505. PMID 11986201.
- ^ a b c d e f Theil EC (1987). «Ferritin: structure, gene regulation, and cellular function in animals, plants, and microorganisms». Annual Review of Biochemistry. 56 (1): 289–315. doi:10.1146/annurev.bi.56.070187.001445. PMID 3304136.
- ^ De Zoysa M, Lee J (September 2007). «Two ferritin subunits from disk abalone (Haliotis discus discus): cloning, characterization and expression analysis». Fish & Shellfish Immunology. 23 (3): 624–35. doi:10.1016/j.fsi.2007.01.013. PMID 17442591.
- ^ «Ferritin Structure and Its Biomedical Implications». Metallic BioNano Particles. Universidad de Granada. Archived from the original on 2016-08-27. Retrieved 2016-01-16.
- ^ a b c d e f g h Andrews SC, Arosio P, Bottke W, Briat JF, von Darl M, Harrison PM, Laulhère JP, Levi S, Lobreaux S, Yewdall SJ (1992). «Structure, function, and evolution of ferritins». Journal of Inorganic Biochemistry. 47 (3–4): 161–74. doi:10.1016/0162-0134(92)84062-R. PMID 1431878.
- ^ Zhang Y, Meng Q, Jiang T, Wang H, Xie L, Zhang R (May 2003). «A novel ferritin subunit involved in shell formation from the pearl oyster (Pinctada fucata)». Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 135 (1): 43–54. doi:10.1016/S1096-4959(03)00050-2. PMID 12781972.
- ^ Levi S, Corsi B, Bosisio M, Invernizzi R, Volz A, Sanford D, Arosio P, Drysdale J (July 2001). «A human mitochondrial ferritin encoded by an intronless gene». The Journal of Biological Chemistry. 276 (27): 24437–40. doi:10.1074/jbc.C100141200. PMID 11323407.
- ^ Lovell SC, Davis IW, Arendall WB, de Bakker PI, Word JM, Prisant MG, Richardson JS, Richardson DC (February 2003). «Structure validation by Calpha geometry: phi,psi and Cbeta deviation» (PDF). Proteins. 50 (3): 437–50. doi:10.1002/prot.10286. PMID 12557186. S2CID 8358424. Archived from the original (PDF) on 12 October 2012.
MolProbity Ramachandran analysis
- ^ Seckback J (1982). «Ferreting out the secrets of plant ferritin — A review». Journal of Plant Nutrition. 5 (4–7): 369–394. doi:10.1080/01904168209362966.
- ^ Orino K, Lehman L, Tsuji Y, Ayaki H, Torti SV, Torti FM (July 2001). «Ferritin and the response to oxidative stress». The Biochemical Journal. 357 (Pt 1): 241–7. doi:10.1042/0264-6021:3570241. PMC 1221947. PMID 11415455.
- ^ Jackson DJ, Wörheide G, Degnan BM (2007). «Dynamic expression of ancient and novel molluscan shell genes during ecological transitions». BMC Evolutionary Biology. 7: 160. doi:10.1186/1471-2148-7-160. PMC 2034539. PMID 17845714.
- ^ Yano M, Nagai K, Morimoto K, Miyamoto H (June 2006). «Shematrin: a family of glycine-rich structural proteins in the shell of the pearl oyster Pinctada fucata». Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 144 (2): 254–62. doi:10.1016/j.cbpb.2006.03.004. PMID 16626988.
- ^ Kyung-Suk K, Webb J, Macey D (1986). «Properties and role of ferritin in the hemolymph of the chiton Clavarizona hirtosa». Biochimica et Biophysica Acta (BBA) — General Subjects. 884 (3): 387–394. doi:10.1016/0304-4165(86)90188-1.
- ^ Zhang Y, Mikhael M, Xu D, Li Y, Soe-Lin S, Ning B, et al. (October 2010). «Lysosomal proteolysis is the primary degradation pathway for cytosolic ferritin and cytosolic ferritin degradation is necessary for iron exit». Antioxidants & Redox Signaling. 13 (7): 999–1009. doi:10.1089/ars.2010.3129. PMID 20406137.
- ^ a b c Honarmand Ebrahimi K, Hagedoorn PL, Hagen WR (January 2015). «Unity in the biochemistry of the iron-storage proteins ferritin and bacterioferritin». Chemical Reviews. 115 (1): 295–326. doi:10.1021/cr5004908. PMID 25418839.
- ^ a b Honarmand Ebrahimi K, Bill E, Hagedoorn PL, Hagen WR (November 2012). «The catalytic center of ferritin regulates iron storage via Fe(II)-Fe(III) displacement». Nature Chemical Biology. 8 (11): 941–8. doi:10.1038/nchembio.1071. PMID 23001032.
- ^ Watt RK (March 2013). «A unified model for ferritin iron loading by the catalytic center: implications for controlling «free iron» during oxidative stress». ChemBioChem. 14 (4): 415–9. doi:10.1002/cbic.201200783. PMID 23404831. S2CID 41485685.
- ^ Carmona U, Li L, Zhang L, Knez M (December 2014). «Ferritin light-chain subunits: key elements for the electron transfer across the protein cage». Chemical Communications. 50 (97): 15358–61. doi:10.1039/c4cc07996e. PMID 25348725.
- ^ a b Ong DS, Wang L, Zhu Y, Ho B, Ding JL (2005). «The response of ferritin to LPS and acute phase of Pseudomonas infection». Journal of Endotoxin Research. 11 (5): 267–80. doi:10.1179/096805105X58698. PMID 16262999.
- ^ Larade K, Storey KB (March 2004). «Accumulation and translation of ferritin heavy chain transcripts following anoxia exposure in a marine invertebrate». The Journal of Experimental Biology. 207 (Pt 8): 1353–60. doi:10.1242/jeb.00872. PMID 15010486.
- ^ Beck G, Ellis TW, Habicht GS, Schluter SF, Marchalonis JJ (January 2002). «Evolution of the acute phase response: iron release by echinoderm (Asterias forbesi) coelomocytes, and cloning of an echinoderm ferritin molecule». Developmental and Comparative Immunology. 26 (1): 11–26. doi:10.1016/S0145-305X(01)00051-9. PMID 11687259.
- ^ a b Bottke W, Burschyk M, Volmer J (1988). «On the origin of the yolk protein ferritin in snails». Roux’s Archives of Developmental Biology. 197 (7): 377–382. doi:10.1007/BF00398988. PMID 28305744. S2CID 34033340.
- ^ Camaschella, Clara (2015-05-07). Longo, Dan L. (ed.). «Iron-Deficiency Anemia». New England Journal of Medicine. 372 (19): 1832–1843. doi:10.1056/NEJMra1401038. ISSN 0028-4793.
- ^ World Health Organization (2020). WHO guideline on use of ferritin concentrations to assess iron status in individuals and populations. Geneva, Switzerland. ISBN 978-92-4-000012-4. OCLC 1265083396.
- ^ Verdon F, Burnand B, Stubi CL, Bonard C, Graff M, Michaud A, Bischoff T, de Vevey M, Studer JP, Herzig L, Chapuis C, Tissot J, Pécoud A, Favrat B (May 2003). «Iron supplementation for unexplained fatigue in non-anaemic women: double blind randomised placebo controlled trial». BMJ (Clinical Research Ed.). 326 (7399): 1124–0. doi:10.1136/bmj.326.7399.1124. PMC 156009. PMID 12763985.
- ^ Vaucher P, Druais PL, Waldvogel S, Favrat B (August 2012). «Effect of iron supplementation on fatigue in nonanemic menstruating women with low ferritin: a randomized controlled trial». CMAJ: Canadian Medical Association Journal. 184 (11): 1247–1254. doi:10.1503/cmaj.110950. PMC 3414597. PMID 22777991.
- ^ Guyatt GH, Patterson C, Ali M, Singer J, Levine M, Turpie I, Meyer R (March 1990). «Diagnosis of iron-deficiency anemia in the elderly». The American Journal of Medicine. 88 (3): 205–9. doi:10.1016/0002-9343(90)90143-2. PMID 2178409.
- ^ a b Firkin F, Rush B (1997). «Interpretation of biochemical tests for iron deficiency: diagnostic difficulties related to limitations of individual tests». Australian Prescriber. 20: 74–6. doi:10.18773/austprescr.1997.063. Archived from the original on 2012-03-25.
- ^ Burnett D, Crocker JR (1999). The Science of Laboratory Diagnosis. ISIS Medical Media. p. 341. ISBN 978-1-899066-62-9.
- ^ Kryger MH, Otake K, Foerster J (March 2002). «Low body stores of iron and restless legs syndrome: a correctable cause of insomnia in adolescents and teenagers». Sleep Medicine. 3 (2): 127–32. doi:10.1016/S1389-9457(01)00160-5. PMID 14592231.
- ^ Mizuno S, Mihara T, Miyaoka T, Inagaki T, Horiguchi J (March 2005). «CSF iron, ferritin and transferrin levels in restless legs syndrome». Journal of Sleep Research. 14 (1): 43–7. doi:10.1111/j.1365-2869.2004.00403.x. PMID 15743333. S2CID 12959227.
- ^ Craig WJ, Mangels AR (July 2009). «Position of the American Dietetic Association: vegetarian diets». Journal of the American Dietetic Association. 109 (7): 1266–82. doi:10.1016/j.jada.2009.05.027. PMID 19562864. S2CID 7906168.
- ^ Chen G, Wu D, Guo W, Cao Y, Huang D, Wang H, et al. (May 2020). «Clinical and immunological features of severe and moderate coronavirus disease 2019». The Journal of Clinical Investigation. 130 (5): 2620–2629. doi:10.1172/JCI137244. PMC 7190990. PMID 32217835.
- ^ Alkattan A, Alabdulkareem K, Kamel A, Abdelseed H, Almutairi Y, Alsalameen E (2021). «Correlation between Micronutrient plasma concentration and disease severity in COVID-19 patients». Alexandria Journal of Medicine. 57 (1): 21–27. doi:10.1080/20905068.2020.1870788. ISSN 2090-5068. PMC 8108185.
- ^ Melo AK, Milby KM, Caparroz AL, Pinto AC, Santos RR, Rocha AP, et al. (29 June 2021). «Biomarkers of cytokine storm as red flags for severe and fatal COVID-19 cases: A living systematic review and meta-analysis». PLOS ONE. 16 (6): e0253894. Bibcode:2021PLoSO..1653894M. doi:10.1371/journal.pone.0253894. PMC 8241122. PMID 34185801.
- ^ Dance A (10 April 2020). «What is a cytokine storm?». Knowable Magazine. Annual Reviews. Retrieved 9 August 2021.
- ^ Kennedy A, Kohn M, Lammi A, Clarke S (August 2004). «Iron status and haematological changes in adolescent female inpatients with anorexia nervosa». Journal of Paediatrics and Child Health. 40 (8): 430–2. doi:10.1111/j.1440-1754.2004.00432.x. PMID 15265182. S2CID 26269832.
- ^ Tran J, Story C, Moore D, Metz M (September 2013). «Unexpected increased ferritin concentration in patients with anorexia nervosa». Annals of Clinical Biochemistry. 50 (Pt 5): 504–6. doi:10.1177/0004563213490289. PMID 23897102. S2CID 9927714.
- ^ Bacon BR, Adams PC, Kowdley KV, Powell LW, Tavill AS (July 2011). «Diagnosis and management of hemochromatosis: 2011 practice guideline by the American Association for the Study of Liver Diseases». Hepatology. Baltimore, Md. 54 (1): 328–43. doi:10.1002/hep.24330. PMC 3149125. PMID 21452290.
- ^ «Hemochromatosis». guidelinecentral.com.
- ^ Cotler SJ, Bronner MP, Press RD, Carlson TH, Perkins JD, Emond MJ, Kowdley KV (August 1998). «End-stage liver disease without hemochromatosis associated with elevated hepatic iron index». Journal of Hepatology. 29 (2): 257–62. doi:10.1016/S0168-8278(98)80011-1. PMID 9722207.
- ^ Gkamprela E, Deutsch M, Pectasides D (2017). «Iron deficiency anemia in chronic liver disease: etiopathogenesis, diagnosis and treatment». Annals of Gastroenterology. 30 (4): 405–413. doi:10.20524/aog.2017.0152. PMC 5479992. PMID 28655976.
- ^ Guyader D, Thirouard AS, Erdtmann L, Rakba N, Jacquelinet S, Danielou H, et al. (April 2007). «Liver iron is a surrogate marker of severe fibrosis in chronic hepatitis C». Journal of Hepatology. 46 (4): 587–95. doi:10.1016/j.jhep.2006.09.021. PMID 17156889.
- ^ Adams PC (1998). «Iron overload in viral and alcoholic liver disease». Journal of Hepatology. 28 (Suppl 1): 19–20. doi:10.1016/S0168-8278(98)80370-X. PMID 9575444.
- ^ Eng SC, Taylor SL, Reyes V, Raaka S, Berger J, Kowdley KV (June 2005). «Hepatic iron overload in alcoholic end-stage liver disease is associated with iron deposition in other organs in the absence of HFE-1 hemochromatosis». Liver International. 25 (3): 513–7. doi:10.1111/j.1478-3231.2005.01004.x. PMID 15910487. S2CID 23125116.
- ^ Maiwall R, Kumar S, Chaudhary AK, Maras J, Wani Z, Kumar C, et al. (July 2014). «Serum ferritin predicts early mortality in patients with decompensated cirrhosis». Journal of Hepatology. 61 (1): 43–50. doi:10.1016/j.jhep.2014.03.027. PMID 24681346.
- ^ Maras JS, Maiwall R, Harsha HC, Das S, Hussain MS, Kumar C, et al. (April 2015). «Dysregulated iron homeostasis is strongly associated with multiorgan failure and early mortality in acute-on-chronic liver failure». Hepatology. 61 (4): 1306–20. doi:10.1002/hep.27636. PMID 25475192.
- ^ a b Tornai D, Antal-Szalmas P, Tornai T, Papp M, Tornai I, Sipeki N, et al. (March 2021). «Abnormal ferritin levels predict development of poor outcomes in cirrhotic outpatients: a cohort study». BMC Gastroenterology. 21 (1): 94. doi:10.1186/s12876-021-01669-w. PMC 7923668. PMID 33653274.
- ^ Kasyutich O, Ilari A, Fiorillo A, Tatchev D, Hoell A, Ceci P (March 2010). «Silver Ion Incorporation and Nanoparticle Formation inside the Cavity ofPyrococcus furiosusFerritin: Structural and Size-Distribution Analyses». Journal of the American Chemical Society. 132 (10): 3621–7. doi:10.1021/ja910918b. PMID 20170158.
- ^ Uchida M, Flenniken ML, Allen M, Willits DA, Crowley BE, Brumfield S, Willis AF, Jackiw L, Jutila M, Young MJ, Douglas T (December 2006). «Targeting of Cancer Cells with Ferrimagnetic Ferritin Cage Nanoparticles». Journal of the American Chemical Society. 128 (51): 16626–33. doi:10.1021/ja0655690. PMID 17177411.
- ^ Li M, Viravaidya C, Mann S (September 2007). «Polymer-Mediated Synthesis of Ferritin-Encapsulated Inorganic Nanoparticles». Small. 3 (9): 1477–81. doi:10.1002/smll.200700199. PMID 17768776.
- ^ Ueno T, Suzuki M, Goto T, Matsumoto T, Nagayama K, Watanabe Y (May 2004). «Size-Selective Olefin Hydrogenation by a Pd Nanocluster Provided in an Apo-Ferritin Cage». Angewandte Chemie. 43 (19): 2527–30. doi:10.1002/anie.200353436. PMID 15127443.
- ^ Stanford’s Single-Dose Nanoparticle Vaccine for COVID-19. On: SciTechDaily. January 10, 2021. Source: Stanford University
- ^ Wang W, Huang B, Zhu Y, Tan W, Zhu M (March 2021). «Ferritin nanoparticle-based SARS-CoV-2 RBD vaccine induces a persistent antibody response and long-term memory in mice». Cellular & Molecular Immunology. 18 (3): 749–751. doi:10.1038/s41423-021-00643-6. PMC 7880661. PMID 33580169.
- ^ «Ferritin — Homo sapiens (Human)».
External links[edit]
- Ferritins at the US National Library of Medicine Medical Subject Headings (MeSH)
- Ferritin at Lab Tests Online
- Overview of all the structural information available in the PDB for UniProt: P02792 (Ferritin light chain) at the PDBe-KB.
- Overview of all the structural information available in the PDB for UniProt: P02794 (Ferritin heavy chain) at the PDBe-KB.
- Overview of all the structural information available in the PDB for UniProt: Q8N4E7 (Ferritin, mitochondrial) at the PDBe-KB.
From Wikipedia, the free encyclopedia
| Ferritin | |||||||
|---|---|---|---|---|---|---|---|

Structure of the murine ferritin complex[1] |
|||||||
| Identifiers | |||||||
| Symbol | Ferritin | ||||||
| Pfam | PF00210 | ||||||
| Pfam clan | CL0044 | ||||||
| InterPro | IPR008331 | ||||||
| SCOP2 | 1fha / SCOPe / SUPFAM | ||||||
|
| ferritin, light polypeptide | |||||
|---|---|---|---|---|---|
| Identifiers | |||||
| Symbol | FTL | ||||
| NCBI gene | 2512 | ||||
| HGNC | 3999 | ||||
| OMIM | 134790 | ||||
| RefSeq | NM_000146 | ||||
| UniProt | P02792 | ||||
| Other data | |||||
| Locus | Chr. 19 q13.3–13.4 | ||||
|
| ferritin, heavy polypeptide 1 | |||||
|---|---|---|---|---|---|
| Identifiers | |||||
| Symbol | FTH1 | ||||
| Alt. symbols | FTHL6 | ||||
| NCBI gene | 2495 | ||||
| HGNC | 3976 | ||||
| OMIM | 134770 | ||||
| RefSeq | NM_002032 | ||||
| UniProt | P02794 | ||||
| Other data | |||||
| Locus | Chr. 11 q13 | ||||
|
| ferritin mitochondrial | |||||
|---|---|---|---|---|---|

Crystallographic structure of mitochondrial ferritin.[2] |
|||||
| Identifiers | |||||
| Symbol | FTMT | ||||
| NCBI gene | 94033 | ||||
| HGNC | 17345 | ||||
| OMIM | 608847 | ||||
| RefSeq | NM_177478 | ||||
| UniProt | Q8N4E7 | ||||
| Other data | |||||
| Locus | Chr. 5 q23.1 | ||||
|
Ferritin is a universal intracellular protein that stores iron and releases it in a controlled fashion. The protein is produced by almost all living organisms, including archaea, bacteria, algae, higher plants, and animals. It is the primary intracellular iron-storage protein in both prokaryotes and eukaryotes, keeping iron in a soluble and non-toxic form. In humans, it acts as a buffer against iron deficiency and iron overload.[3]
Ferritin is found in most tissues as a cytosolic protein, but small amounts are secreted into the serum where it functions as an iron carrier. Plasma ferritin is also an indirect marker of the total amount of iron stored in the body; hence, serum ferritin is used as a diagnostic test for iron-deficiency anemia.[4] Aggregated ferritin transforms into a toxic form of iron called hemosiderin.[5]
Ferritin is a globular protein complex consisting of 24 protein subunits forming a hollow nanocage with multiple metal–protein interactions.[6] Ferritin that is not combined with iron is called apoferritin.[citation needed]
Gene[edit]
Ferritin genes are highly conserved between species. All vertebrate ferritin genes have three introns and four exons.[7] In human ferritin, introns are present between amino acid residues 14 and 15, 34 and 35, and 82 and 83; in addition, there are one to two hundred untranslated bases at either end of the combined exons.[8] The tyrosine residue at amino acid position 27 is thought to be associated with biomineralization.[9]
Protein structure[edit]
Ferritin is a hollow globular protein of mass 474 kDa and comprising 24 subunits. Typically it has internal and external diameters of about 8 and 12 nm, respectively.[10] The nature of these subunits varies by class of organism:
- In vertebrates, the subunits are of two types, light (L) and heavy (H), which have apparent molecular mass of 19 kDa and 21 kDa, respectively; their sequences are homologous (about 50% identical).[8]
- Amphibians have an additional («M») type of ferritin.[11]
- Plants and bacteria have a single ferritin; it most closely resembles the vertebrate H-type.[11]
- In the gastropods of the genus Lymnaea, two types have been recovered, from somatic cells and the yolk, respectively (see below).[11]
- In the pearl oyster Pinctada fucata, an additional subunit resembling Lymnaea soma ferritin is associated with shell formation.[12]
- In the parasite Schistosoma, two types are present: one in males, the other in females.[11]
All the aforementioned ferritins are similar, in terms of their primary sequence, with the vertebrate H-type.[11] In E. coli, a 20% similarity to human H-ferritin is observed.[11]
Some ferritin complexes in vertebrates are hetero-oligomers of two highly related gene products with slightly different physiological properties. The ratio of the two homologous proteins in the complex depends on the relative expression levels of the two genes.
Inside the ferritin shell, iron ions form crystallites together with phosphate and hydroxide ions. The resulting particle is similar to ferrihydrite. Each ferritin complex can store about 4500 iron (Fe3+) ions.[8][11]
A human mitochondrial ferritin, MtF, was found to express as a pro-protein.[13] When a mitochondrion takes it up, it processes it into a mature protein similar to the ferritins found in the cytoplasm, which it assembles to form functional ferritin shells. Unlike other human ferritins, it appears to have no introns in its genetic code. An X-ray diffraction study has revealed that its diameter is 1.70 angstroms (0.17 nm), it contains 182 residues, and is 67% helical. The mitochondrial ferritin’s Ramachandran plot[14] shows its structure to be mainly alpha helical with a low prevalence of beta sheets.
Function[edit]
Iron storage[edit]
Iron uptake through the 3-fold channel of ferritin
Ferritin is present in every cell type.[8] It serves to store iron in a non-toxic form, to deposit it in a safe form, and to transport it to areas where it is required.[15] The function and structure of the expressed ferritin protein varies in different cell types. This is controlled primarily by the amount and stability of messenger RNA (mRNA), but also by changes in how the mRNA is stored and how efficiently it is transcribed.[8] One major trigger for the production of many ferritins is the mere presence of iron;[8] an exception is the yolk ferritin of Lymnaea sp., which lacks an iron-responsive unit.[11]
Free iron is toxic to cells as it acts as a catalyst in the formation of free radicals from reactive oxygen species via the Fenton reaction.[16] Hence vertebrates have an elaborate set of protective mechanisms to bind iron in various tissue compartments[discuss]. Within cells, iron is stored in a protein complex as ferritin or the related complex hemosiderin. Apoferritin binds to free ferrous iron and stores it in the ferric state. As ferritin accumulates within cells of the reticuloendothelial system, protein aggregates are formed as hemosiderin. Iron in ferritin or hemosiderin can be extracted for release by the RE cells, although hemosiderin is less readily available. Under steady-state conditions, the level of ferritin in the blood serum correlates with total body stores of iron; thus, the serum ferritin FR5Rl is the most convenient laboratory test to estimate iron stores.[citation needed]
Because iron is an important mineral in mineralization, ferritin is employed in the shells of organisms such as molluscs to control the concentration and distribution of iron, thus sculpting shell morphology and colouration.[17][18] It also plays a role in the haemolymph of the polyplacophora, where it serves to rapidly transport iron to the mineralizing radula.[19]
Iron is released from ferritin for use by ferritin degradation, which is performed mainly by lysosomes.[20]
Ferroxidase activity[edit]
Vertebrate ferritin consists of two or three subunits which are named based on their molecular weight: L «light», H «heavy», and M «middle» subunits. The M subunit has only been reported in bullfrogs. In bacteria and archaea, ferritin consists of one subunit type.[21] H and M subunits of eukaryotic ferritin and all subunits of bacterial and archaeal ferritin are H-type and have ferroxidase activity, which is the conversion of iron from the ferrous (Fe2+) to ferric (Fe3+) forms. This limits the deleterious reaction which occurs between ferrous iron and hydrogen peroxide known as the Fenton reaction which produces the highly damaging hydroxyl radical. The ferroxidase activity occurs at a diiron binding site in the middle of each H-type subunits.[21][22] After oxidation of Fe(II), the Fe(III) product stays metastably in the ferroxidase center and is displaced by Fe(II),[22][23] a mechanism that appears to be common among ferritins of all three kingdoms of life.[21] The light chain of ferritin has no ferroxidase activity but may be responsible for the electron transfer across the protein cage.[24]
Immune response[edit]
Ferritin concentrations increase drastically in the presence of an infection or cancer. Endotoxins are an up-regulator of the gene coding for ferritin, thus causing the concentration of ferritin to rise. By contrast, organisms such as Pseudomonas, although possessing endotoxin, cause plasma ferritin levels to drop significantly within the first 48 hours of infection. Thus, the iron stores of the infected body are denied to the infective agent, impeding its metabolism.[25]
Stress response[edit]
The concentration of ferritin has been shown to increase in response to stresses such as anoxia;[26] this implies that it is an acute phase protein.[27]
Mitochondria[edit]
Mitochondrial ferritin has many roles pertaining to molecular function. It participates in ferroxidase activity, binding, iron ion binding, oxidoreductase activity, ferric iron binding, metal ion binding as well as transition metal binding. Within the realm of biological processes it participates in oxidation-reduction, iron ion transport across membranes and cellular iron ion homeostasis.[citation needed]
Yolk[edit]
In some snails, the protein component of the egg yolk is primarily ferritin;[28] this is a different ferritin, with a different genetic sequence, from the somatic ferritin. It is produced in the midgut glands and secreted into the haemolymph, whence it is transported to the eggs.[28]
Tissue distribution[edit]
In vertebrates, ferritin is usually found within cells, although it is also present in smaller quantities in the plasma.[25]
Diagnostic uses[edit]
Serum ferritin levels are measured in medical laboratories as part of the iron studies workup for iron-deficiency anemia.[6] They are measured in nanograms per milliliter (ng/mL) or micrograms per liter (μg/L); the two units are equivalent.
The ferritin levels measured usually have a direct correlation with the total amount of iron stored in the body. However, ferritin levels may be artificially high in cases of anemia of chronic disease, where ferritin is elevated in its capacity as an inflammatory acute phase protein and not as a marker for iron overload.[citation needed]
Normal ranges[edit]
A normal ferritin blood level, referred to as the reference interval is determined by many testing laboratories. The ranges for ferritin can vary between laboratories but typical ranges would be between 30 and 300 ng/mL (=μg/L) for males, and 30–160 ng/mL (=μg/L) for females.
| Men | 18–270 ng/mL (μg/L) |
| Women | 30–160 ng/mL (μg/L) |
| Children (6 months to 15 years) | 50–140 ng/mL (μg/L) |
| Infants (1 to 5 months) | 50–200 ng/mL (μg/L) |
| Neonates | 25–200 ng/mL (μg/L) |
Deficiency[edit]
According to a 2014 review in the New England Journal of Medicince stated that a ferritin level below 30 ng/mL indicates iron deficiency, while a level below 10 ng/mL indicates iron-deficiency anemia.[29] A 2020 World Health Organization guideline states that ferritin indicates iron deficiency below 12 ng/mL in apparently-healthy children under 5 and 15 ng/mL in apparently-healthy individuals of 5 and over.[30]
Some studies suggest that women with fatigue and ferritin below 50 ng/mL see reduced fatigue after iron supplementation.[31][32]
In the setting of anemia, low serum ferritin is the most specific lab finding for iron-deficiency anemia.[33] However it is less sensitive, since its levels are increased in the blood by infection or any type of chronic inflammation,[34] and these conditions may convert what would otherwise be a low level of ferritin from lack of iron, into a value in the normal range. For this reason, low ferritin levels carry more information than those in the normal range. A falsely low blood ferritin (equivalent to a false positive test) is very uncommon,[34] but can result from a hook effect of the measuring tools in extreme cases.[35]
Low ferritin may also indicate hypothyroidism, vitamin C deficiency or celiac disease.[citation needed]
Low serum ferritin levels are seen in some patients with restless legs syndrome, not necessarily related to anemia, but perhaps due to low iron stores short of anemia.[36][37]
Vegetarianism is not a cause of low serum ferritin levels, according to the American Dietetic Association’s position in 2009: «Incidence of iron-deficiency anemia among vegetarians is similar to that of non-vegetarians. Although vegetarian adults have lower iron stores than non-vegetarians, their serum ferritin levels are usually within the normal range.»[38]
Excess[edit]
If ferritin is high, there is iron in excess or else there is an acute inflammatory reaction in which ferritin is mobilized without iron excess. For example, ferritins may be high in infection without signaling body iron overload.
Ferritin is also used as a marker for iron overload disorders, such as hemochromatosis or hemosiderosis. Adult-onset Still’s disease, some porphyrias, and hemophagocytic lymphohistiocytosis/macrophage activation syndrome are diseases in which the ferritin level may be abnormally raised.
As ferritin is also an acute-phase reactant, it is often elevated in the course of disease. A normal C-reactive protein can be used to exclude elevated ferritin caused by acute phase reactions.[citation needed]
Ferritin has been shown to be elevated in some cases of COVID-19 and may correlate with worse clinical outcome.[39][40]
Ferritin and IL-6 are considered to be possible immunological biomarkers for severe and fatal cases of COVID-19. Ferritin and C-reactive protein may be possible screening tools for early diagnosis of systemic inflammatory response syndrome in cases of COVID-19.[41][42]
According to a study of anorexia nervosa patients, ferritin can be elevated during periods of acute malnourishment, perhaps due to iron going into storage as intravascular volume and thus the number of red blood cells falls.[43]
Another study suggests that due to the catabolic nature of anorexia nervosa, isoferritins may be released. Furthermore, ferritin has significant non-storage roles within the body, such as protection from oxidative damage. The rise of these isoferritins may contribute to an overall increase in ferritin concentration. The measurement of ferritin through immunoassay or immunoturbidimeteric methods may also be picking up these isoferritins thus not a true reflection of iron storage status.[44]
Studies reveal that a transferrin saturation (serum iron concentration ÷ total iron binding capacity) over 60 percent in men and over 50 percent in women identified the presence of an abnormality in iron metabolism (hereditary hemochromatosis, heterozygotes, and homozygotes) with approximately 95 percent accuracy. This finding helps in the early diagnosis of hereditary hemochromatosis, especially while serum ferritin still remains low. The retained iron in hereditary hemochromatosis is primarily deposited in parenchymal cells, with reticuloendothelial cell accumulation occurring very late in the disease. This is in contrast to transfusional iron overload in which iron deposition occurs first in the reticuloendothelial cells and then in parenchymal cells. This explains why ferritin levels remain relative low in hereditary hemochromatosis, while transferrin saturation is high.[45][46]
In chronic liver diseases[edit]
Hematological abnormalities often associate with chronic liver diseases. Both iron overload and iron deficient anemia have been reported in patients with liver cirrhosis.[47][48] The former is mainly due to reduced hepcidin level caused by the decreased synthetic capacity of the liver, while the latter is due to acute and chronic bleeding caused by portal hypertension. Inflammation is also present in patients with advanced chronic liver disease. As a consequence, elevated hepatic and serum ferritin levels are consistently reported in chronic liver diseases.[49][50][51]
Studies showed association between high serum ferritin levels and increased risk of short-term mortality in cirrhotic patients with acute decompensation[52] and acute-on-chronic liver failure.[53] An other study found association between high serum ferritin levels and increased risk of long-term mortality in compensated and stable decompensated cirrhotic patients.[54] The same study demonstrated that increased serum ferritin levels could predict the development of bacterial infection in stable decompensated cirrhotic patients, while in compensated cirrhotic patients the appearance of the very first acute decompensation episode showed higher incidence in patients with low serum ferritin levels. This latter finding was explaind by the association between chronic bleeding and increased portal pressure.[54]
Applications[edit]
Ferritin is used in materials science as a precursor in making iron nanoparticles for carbon nanotube growth by chemical vapor deposition.
Cavities formed by ferritin and mini-ferritins (Dps) proteins have been successfully used as the reaction chamber for the fabrication of metal nanoparticles (NPs).[55][56][57][58] Protein shells served as a template to restrain particle growth and as a coating to prevent coagulation/aggregation between NPs. Using various sizes of protein shells, various sizes of NPs can be easily synthesized for chemical, physical and bio-medical applications.[6][59]
Experimental COVID-19 vaccines have been produced that display the spike protein’s receptor binding domain on the surface of ferritin nanoparticles.[60]
Notes[edit]
The primary sequence of human ferritin is MTTASTSQVR QNYHQDSEAA INRQINLELY ASYVYLSMSY YFDRDDVALK NFAKYFLHQS HEEREHAEKL MKLQNQRGGR IFLQDIKKPD CDDWESGLNA MECALHLEKN VNQSLLEFPS PISPSPSCWH HYTTNRPQPQ HHLLRPRRRK RPHSIPTPIL IFRSP.[61]
See also[edit]
- Bacterioferritin
- DNA-binding protein from starved cells
- Ferritin light chain
- Transferrin
References[edit]
- ^ PDB: 1lb3; Granier T, Langlois d’Estaintot B, Gallois B, Chevalier JM, Précigoux G, Santambrogio P, Arosio P (January 2003). «Structural description of the active sites of mouse L-chain ferritin at 1.2 A resolution». Journal of Biological Inorganic Chemistry. 8 (1–2): 105–11. doi:10.1007/s00775-002-0389-4. PMID 12459904. S2CID 20756710.
- ^ PDB: 1r03; Langlois d’Estaintot B, Santambrogio P, Granier T, Gallois B, Chevalier JM, Précigoux G, Levi S, Arosio P (July 2004). «Crystal structure and biochemical properties of the human mitochondrial ferritin and its mutant Ser144Ala». Journal of Molecular Biology. 340 (2): 277–93. doi:10.1016/j.jmb.2004.04.036. PMID 15201052.
- ^ Casiday R, Frey R. «Iron Use and Storage in the Body: Ferritin and Molecular Representations». Department of Chemistry, Washington University in St. Louis.
- ^ Wang W, Knovich MA, Coffman LG, Torti FM, Torti SV (August 2010). «Serum ferritin: Past, present and future». Biochimica et Biophysica Acta (BBA) — General Subjects. 1800 (8): 760–9. doi:10.1016/j.bbagen.2010.03.011. PMC 2893236. PMID 20304033.
- ^ MacKenzie EL, Iwasaki K, Tsuji Y (June 2008). «Intracellular iron transport and storage: from molecular mechanisms to health implications». Antioxidants & Redox Signaling. 10 (6): 997–1030. doi:10.1089/ars.2007.1893. PMC 2932529. PMID 18327971.
- ^ a b c Theil EC (2012). «Ferritin protein nanocages-the story». Nanotechnology Perceptions. 8 (1): 7–16. doi:10.4024/N03TH12A.ntp.08.01. PMC 3816979. PMID 24198751.
- ^ Torti FM, Torti SV (May 2002). «Regulation of ferritin genes and protein». Blood. 99 (10): 3505–16. doi:10.1182/blood.V99.10.3505. PMID 11986201.
- ^ a b c d e f Theil EC (1987). «Ferritin: structure, gene regulation, and cellular function in animals, plants, and microorganisms». Annual Review of Biochemistry. 56 (1): 289–315. doi:10.1146/annurev.bi.56.070187.001445. PMID 3304136.
- ^ De Zoysa M, Lee J (September 2007). «Two ferritin subunits from disk abalone (Haliotis discus discus): cloning, characterization and expression analysis». Fish & Shellfish Immunology. 23 (3): 624–35. doi:10.1016/j.fsi.2007.01.013. PMID 17442591.
- ^ «Ferritin Structure and Its Biomedical Implications». Metallic BioNano Particles. Universidad de Granada. Archived from the original on 2016-08-27. Retrieved 2016-01-16.
- ^ a b c d e f g h Andrews SC, Arosio P, Bottke W, Briat JF, von Darl M, Harrison PM, Laulhère JP, Levi S, Lobreaux S, Yewdall SJ (1992). «Structure, function, and evolution of ferritins». Journal of Inorganic Biochemistry. 47 (3–4): 161–74. doi:10.1016/0162-0134(92)84062-R. PMID 1431878.
- ^ Zhang Y, Meng Q, Jiang T, Wang H, Xie L, Zhang R (May 2003). «A novel ferritin subunit involved in shell formation from the pearl oyster (Pinctada fucata)». Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 135 (1): 43–54. doi:10.1016/S1096-4959(03)00050-2. PMID 12781972.
- ^ Levi S, Corsi B, Bosisio M, Invernizzi R, Volz A, Sanford D, Arosio P, Drysdale J (July 2001). «A human mitochondrial ferritin encoded by an intronless gene». The Journal of Biological Chemistry. 276 (27): 24437–40. doi:10.1074/jbc.C100141200. PMID 11323407.
- ^ Lovell SC, Davis IW, Arendall WB, de Bakker PI, Word JM, Prisant MG, Richardson JS, Richardson DC (February 2003). «Structure validation by Calpha geometry: phi,psi and Cbeta deviation» (PDF). Proteins. 50 (3): 437–50. doi:10.1002/prot.10286. PMID 12557186. S2CID 8358424. Archived from the original (PDF) on 12 October 2012.
MolProbity Ramachandran analysis
- ^ Seckback J (1982). «Ferreting out the secrets of plant ferritin — A review». Journal of Plant Nutrition. 5 (4–7): 369–394. doi:10.1080/01904168209362966.
- ^ Orino K, Lehman L, Tsuji Y, Ayaki H, Torti SV, Torti FM (July 2001). «Ferritin and the response to oxidative stress». The Biochemical Journal. 357 (Pt 1): 241–7. doi:10.1042/0264-6021:3570241. PMC 1221947. PMID 11415455.
- ^ Jackson DJ, Wörheide G, Degnan BM (2007). «Dynamic expression of ancient and novel molluscan shell genes during ecological transitions». BMC Evolutionary Biology. 7: 160. doi:10.1186/1471-2148-7-160. PMC 2034539. PMID 17845714.
- ^ Yano M, Nagai K, Morimoto K, Miyamoto H (June 2006). «Shematrin: a family of glycine-rich structural proteins in the shell of the pearl oyster Pinctada fucata». Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology. 144 (2): 254–62. doi:10.1016/j.cbpb.2006.03.004. PMID 16626988.
- ^ Kyung-Suk K, Webb J, Macey D (1986). «Properties and role of ferritin in the hemolymph of the chiton Clavarizona hirtosa». Biochimica et Biophysica Acta (BBA) — General Subjects. 884 (3): 387–394. doi:10.1016/0304-4165(86)90188-1.
- ^ Zhang Y, Mikhael M, Xu D, Li Y, Soe-Lin S, Ning B, et al. (October 2010). «Lysosomal proteolysis is the primary degradation pathway for cytosolic ferritin and cytosolic ferritin degradation is necessary for iron exit». Antioxidants & Redox Signaling. 13 (7): 999–1009. doi:10.1089/ars.2010.3129. PMID 20406137.
- ^ a b c Honarmand Ebrahimi K, Hagedoorn PL, Hagen WR (January 2015). «Unity in the biochemistry of the iron-storage proteins ferritin and bacterioferritin». Chemical Reviews. 115 (1): 295–326. doi:10.1021/cr5004908. PMID 25418839.
- ^ a b Honarmand Ebrahimi K, Bill E, Hagedoorn PL, Hagen WR (November 2012). «The catalytic center of ferritin regulates iron storage via Fe(II)-Fe(III) displacement». Nature Chemical Biology. 8 (11): 941–8. doi:10.1038/nchembio.1071. PMID 23001032.
- ^ Watt RK (March 2013). «A unified model for ferritin iron loading by the catalytic center: implications for controlling «free iron» during oxidative stress». ChemBioChem. 14 (4): 415–9. doi:10.1002/cbic.201200783. PMID 23404831. S2CID 41485685.
- ^ Carmona U, Li L, Zhang L, Knez M (December 2014). «Ferritin light-chain subunits: key elements for the electron transfer across the protein cage». Chemical Communications. 50 (97): 15358–61. doi:10.1039/c4cc07996e. PMID 25348725.
- ^ a b Ong DS, Wang L, Zhu Y, Ho B, Ding JL (2005). «The response of ferritin to LPS and acute phase of Pseudomonas infection». Journal of Endotoxin Research. 11 (5): 267–80. doi:10.1179/096805105X58698. PMID 16262999.
- ^ Larade K, Storey KB (March 2004). «Accumulation and translation of ferritin heavy chain transcripts following anoxia exposure in a marine invertebrate». The Journal of Experimental Biology. 207 (Pt 8): 1353–60. doi:10.1242/jeb.00872. PMID 15010486.
- ^ Beck G, Ellis TW, Habicht GS, Schluter SF, Marchalonis JJ (January 2002). «Evolution of the acute phase response: iron release by echinoderm (Asterias forbesi) coelomocytes, and cloning of an echinoderm ferritin molecule». Developmental and Comparative Immunology. 26 (1): 11–26. doi:10.1016/S0145-305X(01)00051-9. PMID 11687259.
- ^ a b Bottke W, Burschyk M, Volmer J (1988). «On the origin of the yolk protein ferritin in snails». Roux’s Archives of Developmental Biology. 197 (7): 377–382. doi:10.1007/BF00398988. PMID 28305744. S2CID 34033340.
- ^ Camaschella, Clara (2015-05-07). Longo, Dan L. (ed.). «Iron-Deficiency Anemia». New England Journal of Medicine. 372 (19): 1832–1843. doi:10.1056/NEJMra1401038. ISSN 0028-4793.
- ^ World Health Organization (2020). WHO guideline on use of ferritin concentrations to assess iron status in individuals and populations. Geneva, Switzerland. ISBN 978-92-4-000012-4. OCLC 1265083396.
- ^ Verdon F, Burnand B, Stubi CL, Bonard C, Graff M, Michaud A, Bischoff T, de Vevey M, Studer JP, Herzig L, Chapuis C, Tissot J, Pécoud A, Favrat B (May 2003). «Iron supplementation for unexplained fatigue in non-anaemic women: double blind randomised placebo controlled trial». BMJ (Clinical Research Ed.). 326 (7399): 1124–0. doi:10.1136/bmj.326.7399.1124. PMC 156009. PMID 12763985.
- ^ Vaucher P, Druais PL, Waldvogel S, Favrat B (August 2012). «Effect of iron supplementation on fatigue in nonanemic menstruating women with low ferritin: a randomized controlled trial». CMAJ: Canadian Medical Association Journal. 184 (11): 1247–1254. doi:10.1503/cmaj.110950. PMC 3414597. PMID 22777991.
- ^ Guyatt GH, Patterson C, Ali M, Singer J, Levine M, Turpie I, Meyer R (March 1990). «Diagnosis of iron-deficiency anemia in the elderly». The American Journal of Medicine. 88 (3): 205–9. doi:10.1016/0002-9343(90)90143-2. PMID 2178409.
- ^ a b Firkin F, Rush B (1997). «Interpretation of biochemical tests for iron deficiency: diagnostic difficulties related to limitations of individual tests». Australian Prescriber. 20: 74–6. doi:10.18773/austprescr.1997.063. Archived from the original on 2012-03-25.
- ^ Burnett D, Crocker JR (1999). The Science of Laboratory Diagnosis. ISIS Medical Media. p. 341. ISBN 978-1-899066-62-9.
- ^ Kryger MH, Otake K, Foerster J (March 2002). «Low body stores of iron and restless legs syndrome: a correctable cause of insomnia in adolescents and teenagers». Sleep Medicine. 3 (2): 127–32. doi:10.1016/S1389-9457(01)00160-5. PMID 14592231.
- ^ Mizuno S, Mihara T, Miyaoka T, Inagaki T, Horiguchi J (March 2005). «CSF iron, ferritin and transferrin levels in restless legs syndrome». Journal of Sleep Research. 14 (1): 43–7. doi:10.1111/j.1365-2869.2004.00403.x. PMID 15743333. S2CID 12959227.
- ^ Craig WJ, Mangels AR (July 2009). «Position of the American Dietetic Association: vegetarian diets». Journal of the American Dietetic Association. 109 (7): 1266–82. doi:10.1016/j.jada.2009.05.027. PMID 19562864. S2CID 7906168.
- ^ Chen G, Wu D, Guo W, Cao Y, Huang D, Wang H, et al. (May 2020). «Clinical and immunological features of severe and moderate coronavirus disease 2019». The Journal of Clinical Investigation. 130 (5): 2620–2629. doi:10.1172/JCI137244. PMC 7190990. PMID 32217835.
- ^ Alkattan A, Alabdulkareem K, Kamel A, Abdelseed H, Almutairi Y, Alsalameen E (2021). «Correlation between Micronutrient plasma concentration and disease severity in COVID-19 patients». Alexandria Journal of Medicine. 57 (1): 21–27. doi:10.1080/20905068.2020.1870788. ISSN 2090-5068. PMC 8108185.
- ^ Melo AK, Milby KM, Caparroz AL, Pinto AC, Santos RR, Rocha AP, et al. (29 June 2021). «Biomarkers of cytokine storm as red flags for severe and fatal COVID-19 cases: A living systematic review and meta-analysis». PLOS ONE. 16 (6): e0253894. Bibcode:2021PLoSO..1653894M. doi:10.1371/journal.pone.0253894. PMC 8241122. PMID 34185801.
- ^ Dance A (10 April 2020). «What is a cytokine storm?». Knowable Magazine. Annual Reviews. Retrieved 9 August 2021.
- ^ Kennedy A, Kohn M, Lammi A, Clarke S (August 2004). «Iron status and haematological changes in adolescent female inpatients with anorexia nervosa». Journal of Paediatrics and Child Health. 40 (8): 430–2. doi:10.1111/j.1440-1754.2004.00432.x. PMID 15265182. S2CID 26269832.
- ^ Tran J, Story C, Moore D, Metz M (September 2013). «Unexpected increased ferritin concentration in patients with anorexia nervosa». Annals of Clinical Biochemistry. 50 (Pt 5): 504–6. doi:10.1177/0004563213490289. PMID 23897102. S2CID 9927714.
- ^ Bacon BR, Adams PC, Kowdley KV, Powell LW, Tavill AS (July 2011). «Diagnosis and management of hemochromatosis: 2011 practice guideline by the American Association for the Study of Liver Diseases». Hepatology. Baltimore, Md. 54 (1): 328–43. doi:10.1002/hep.24330. PMC 3149125. PMID 21452290.
- ^ «Hemochromatosis». guidelinecentral.com.
- ^ Cotler SJ, Bronner MP, Press RD, Carlson TH, Perkins JD, Emond MJ, Kowdley KV (August 1998). «End-stage liver disease without hemochromatosis associated with elevated hepatic iron index». Journal of Hepatology. 29 (2): 257–62. doi:10.1016/S0168-8278(98)80011-1. PMID 9722207.
- ^ Gkamprela E, Deutsch M, Pectasides D (2017). «Iron deficiency anemia in chronic liver disease: etiopathogenesis, diagnosis and treatment». Annals of Gastroenterology. 30 (4): 405–413. doi:10.20524/aog.2017.0152. PMC 5479992. PMID 28655976.
- ^ Guyader D, Thirouard AS, Erdtmann L, Rakba N, Jacquelinet S, Danielou H, et al. (April 2007). «Liver iron is a surrogate marker of severe fibrosis in chronic hepatitis C». Journal of Hepatology. 46 (4): 587–95. doi:10.1016/j.jhep.2006.09.021. PMID 17156889.
- ^ Adams PC (1998). «Iron overload in viral and alcoholic liver disease». Journal of Hepatology. 28 (Suppl 1): 19–20. doi:10.1016/S0168-8278(98)80370-X. PMID 9575444.
- ^ Eng SC, Taylor SL, Reyes V, Raaka S, Berger J, Kowdley KV (June 2005). «Hepatic iron overload in alcoholic end-stage liver disease is associated with iron deposition in other organs in the absence of HFE-1 hemochromatosis». Liver International. 25 (3): 513–7. doi:10.1111/j.1478-3231.2005.01004.x. PMID 15910487. S2CID 23125116.
- ^ Maiwall R, Kumar S, Chaudhary AK, Maras J, Wani Z, Kumar C, et al. (July 2014). «Serum ferritin predicts early mortality in patients with decompensated cirrhosis». Journal of Hepatology. 61 (1): 43–50. doi:10.1016/j.jhep.2014.03.027. PMID 24681346.
- ^ Maras JS, Maiwall R, Harsha HC, Das S, Hussain MS, Kumar C, et al. (April 2015). «Dysregulated iron homeostasis is strongly associated with multiorgan failure and early mortality in acute-on-chronic liver failure». Hepatology. 61 (4): 1306–20. doi:10.1002/hep.27636. PMID 25475192.
- ^ a b Tornai D, Antal-Szalmas P, Tornai T, Papp M, Tornai I, Sipeki N, et al. (March 2021). «Abnormal ferritin levels predict development of poor outcomes in cirrhotic outpatients: a cohort study». BMC Gastroenterology. 21 (1): 94. doi:10.1186/s12876-021-01669-w. PMC 7923668. PMID 33653274.
- ^ Kasyutich O, Ilari A, Fiorillo A, Tatchev D, Hoell A, Ceci P (March 2010). «Silver Ion Incorporation and Nanoparticle Formation inside the Cavity ofPyrococcus furiosusFerritin: Structural and Size-Distribution Analyses». Journal of the American Chemical Society. 132 (10): 3621–7. doi:10.1021/ja910918b. PMID 20170158.
- ^ Uchida M, Flenniken ML, Allen M, Willits DA, Crowley BE, Brumfield S, Willis AF, Jackiw L, Jutila M, Young MJ, Douglas T (December 2006). «Targeting of Cancer Cells with Ferrimagnetic Ferritin Cage Nanoparticles». Journal of the American Chemical Society. 128 (51): 16626–33. doi:10.1021/ja0655690. PMID 17177411.
- ^ Li M, Viravaidya C, Mann S (September 2007). «Polymer-Mediated Synthesis of Ferritin-Encapsulated Inorganic Nanoparticles». Small. 3 (9): 1477–81. doi:10.1002/smll.200700199. PMID 17768776.
- ^ Ueno T, Suzuki M, Goto T, Matsumoto T, Nagayama K, Watanabe Y (May 2004). «Size-Selective Olefin Hydrogenation by a Pd Nanocluster Provided in an Apo-Ferritin Cage». Angewandte Chemie. 43 (19): 2527–30. doi:10.1002/anie.200353436. PMID 15127443.
- ^ Stanford’s Single-Dose Nanoparticle Vaccine for COVID-19. On: SciTechDaily. January 10, 2021. Source: Stanford University
- ^ Wang W, Huang B, Zhu Y, Tan W, Zhu M (March 2021). «Ferritin nanoparticle-based SARS-CoV-2 RBD vaccine induces a persistent antibody response and long-term memory in mice». Cellular & Molecular Immunology. 18 (3): 749–751. doi:10.1038/s41423-021-00643-6. PMC 7880661. PMID 33580169.
- ^ «Ferritin — Homo sapiens (Human)».
External links[edit]
- Ferritins at the US National Library of Medicine Medical Subject Headings (MeSH)
- Ferritin at Lab Tests Online
- Overview of all the structural information available in the PDB for UniProt: P02792 (Ferritin light chain) at the PDBe-KB.
- Overview of all the structural information available in the PDB for UniProt: P02794 (Ferritin heavy chain) at the PDBe-KB.
- Overview of all the structural information available in the PDB for UniProt: Q8N4E7 (Ferritin, mitochondrial) at the PDBe-KB.
Ферритин – белок, в составе которого железо запасается в тканях.
Синонимы русские
Депонированное железо, металлопротеид, индикатор запасов железа.
Синонимы английские
Ferritin.
Метод исследования
Иммунотурбидиметрия.
Единицы измерения
Мкг/л (микрограмм на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Прекратить прием лекарственных препаратов, содержащих железо, за 72 часа до исследования.
- В течение 30 минут перед исследованием исключить физическое и эмоциональное перенапряжение и не курить.
Общая информация об исследовании
Ферритин – белок, в форме которого в основном запасается железо в организме.
Оно всасывается из пищи и затем переносится трансферрином – специальным белком, который образуется в печени. Железо необходимо для образования эритроцитов и является важнейшей частью гемоглобина – белка, заполняющего эритроциты и позволяющего им переносить кислород от легких к органам и тканям. Кроме того, оно входит в состав мышечного белка миоглобина и некоторых ферментов.
В норме в организме содержится 4-5 граммов железа. Около 70 % от этого количества составляет как раз железо, «встроенное» в гемоглобин эритроцитов. Оставшееся главным образом запасается в тканях в составе белковых комплексов – ферритина и гемосидерина, – которые в основном содержатся в печени, а также в костном мозге, селезенке и мышцах. Хотя в крови ферритин присутствует в небольших количествах, его концентрация отражает запасы железа в организме.
Когда железа начинает не хватать, например в случае уменьшения приема его с пищей или частых кровотечений, организм начинает использовать резерв из тканей. Количество ферритина при этом, соответственно, уменьшается. Длительная нехватка поступающего железа может привести к анемии. Уровень ферритина же бывает сниженным задолго до появления симптомов железодефицита и позволяет вовремя диагностировать анемию.
С другой стороны, если железа поступает слишком много, это может приводить к его чрезмерному накоплению и, как следствие, к поражению печени, сердца и поджелудочной железы.
Стоит отметить, что использование разных анализов, отражающих обмен железа в организме, дает более полную и достоверную информацию о недостатке или переизбытке этого микроэлемента, чем только тест на ферритин.
Для чего используется исследование?
- Для оценки запасов железа в организме. Это необходимо, чтобы выявить дефицит железа или его избыток.
- Чтобы определить, вызвана ли анемия нехваткой железа или иными причинами, например хроническим заболеванием или нехваткой витамина B12.
Когда назначается исследование?
- Если выявлены отклонения в таких тестах, как общий анализ крови, гемоглобин, гематокрит, количество эритроцитов.
- При подозрении на дефицит или избыток железа в организме.
На ранних стадиях дефицит железа может протекать бессимптомно. Если человек в остальном здоров, то признаки заболевания иногда появляются только при снижении гемоглобина ниже 100 г/л. О развитии анемии свидетельствуют следующие жалобы: хроническая слабость/утомляемость, головокружение, головные боли.
При тяжелой анемии пациент может страдать от одышки, боли в грудной клетке, сильных головных болей, слабости в ногах. У детей появляются трудности с обучением.
Помимо основных, есть еще несколько признаков, характерных для дефицита железа: желание употреблять в пищу необычные продукты (мел, глину), жжение кончика языка, заеды – трещины в углах рта.
- При подозрении на перегрузку организма железом (гемохроматоз). Это состояние может проявляться по-разному, например болью в суставах, в животе, слабостью, усталостью, снижением сексуального влечения, нарушением сердечного ритма.
- При наблюдении за эффективностью лечения анемий и состояний, сопровождающихся перегрузкой организма железом.
Что означают результаты?
Референсные значения
|
Возраст |
Референсные значения |
|
1-2 месяца |
200 — 600 мкг/л |
|
2-5 месяцев |
50 — 200 мкг/л |
|
5 месяцев – 15 лет |
7 — 140 мкг/л |
|
Мужчины старше 15 лет |
20 — 250 мкг/л |
|
Женщины старше 15 лет |
10 — 120 мкг/л |
Причины понижения уровня ферритина
- Дефицит железа, в том числе скрытый. Снижение ферритина ниже 10 нг/мл, как правило, говорит о железодефицитной анемии.
- Третий триместр беременности. Уменьшение количества железа в таком случае является нормальным.
Причины повышения уровня ферритина
- Наследственный гемохроматоз. При этом заболевании из пищи всасывается слишком много железа, которое откладывается в различных органах, вызывая их повреждение.
- Множественные переливания крови, введение железа внутримышечно, назначение таблетированных препаратов железа.
- Воспаления, например инфекции верхних дыхательных путей, мочевыводящих путей, аутоиммунные заболевания. Причем повышение ферритина в острой фазе воспаления может маскировать имеющийся дефицит железа.
- Острые или хронические заболевания печени.
- Алкоголизм.
- Гемолитические анемии: связанные с разрушением эритроцитов, B12-дефицитная анемия, талассемия.
- Гипертиреоз – повышение функции щитовидной железы.
- Онкологические заболевания костного мозга, рак молочной железы, болезнь Ходжкина – злокачественное новообразование лимфоидной ткани. Уровень ферритина при этом будет повышен значительно.
Что может влиять на результат?
- К ложноповышенному результату могут приводить:
- голодание,
- алкоголь, эстрогены, оральные контрацептивы, препараты железа.
- Недавнее использование радиофармпрепаратов делает результат анализа недостоверным.
- Уровень ферритина повышается с возрастом.
- При интенсивной физической нагрузке концентрация ферритина увеличивается.
Важные замечания
- Организм в норме теряет железо за счет слущивания клеток кожи, а также с калом и потом. Для восполнения этих потерь требуется, чтобы с пищей поступало не менее 1 мг железа в день, женщинам во время менструации – в два раза больше. Нормальное сбалансированное питание обеспечивает поступление 10-15 мг железа в день, всасывается около 10 % от этого количества. Основные источники железа в пище: мясо, рыба, зелень и крупы.
- Уровень ферритина остается нормальным, если нехватка железа сопровождается воспалением. Поэтому для выявления дефицита железа в такой ситуации может использоваться совместное назначение анализов на ферритин и трансферрин.
Также рекомендуется
- Железо в сыворотке
- Железосвязывающая способность сыворотки
- Латентная железосвязывающая способность сыворотки
- Трансферрин
- Гемоглобин
- Гематокрит
- Эритроциты
Кто назначает исследование?
Врач общей практики, терапевт, гематолог, гастроэнтеролог, ревматолог, нефролог, хирург.
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача. У любых препаратов есть противопоказания. Необходима консультация специалиста, а также подробное изучение инструкции!

Из 20 – 30 миллиграммов железа усваивается только 10%, что составляет всего лишь 1 – 2 миллиграмма. У детей до года железо усваивается гораздо эффективнее – до 70%. У детей до 10 лет усваивается около 10% железа. Из мясных продуктов (гемовое железо) данный микроэлемент усваивается эффективнее на 20 – 30%, чем негемовое железо из овощей, фруктов, злаковых. Многие факторы влияют на его всасываемость. Так различные заболевания желудочно-кишечного тракта, употребление чая и кофе, препараты кальция, оральные контрацептивы (таблетированные противозачаточные) снижают усвоение железа. Витамин С, фолиевая кислота, витамины группы В, наоборот, способствуют усвоению железа. Взрослому человеку необходимо около 4 – 18 миллиграммов железа в сутки.
Всасывание железа в основном происходит в двенадцатиперстной кишке и в отделах тонкого кишечника (90%). При поступлении микроэлемента в энтероциты (клетки эпителия кишечника) часть его депонируется (откладывается про запас), а остальная часть попадает в кровь. Депонирование железа происходит в виде ферритина (водорастворимого белкового комплекса) и гемосидерина (пигмента, образующегося при распаде гемоглобина). Транспорт железа в организме человека осуществляется благодаря трансферрину (белку-переносчику железа в сыворотке крови), лактоферрину (белку-переносчику железа в молоке, слюне и других секретах), мобилферрину (белку-переносчику железа в клетках).
Содержание железа в организме очень четко регулируется. При его недостатке увеличивается площадь всасывания в кишечнике, а также не происходит его депонирование (откладывание про запас). То есть все поступающее железо связывается с белками-переносчиками и используется организмом для своих нужд. При избытке железа часть его связывается с белками-переносчиками, а большая часть депонируется в основном в виде ферритина. Остальная часть выводится из организма. Ежедневно человек теряет до 1 – 2 миллиграммов железа с выпадением волос, с выделением железа в составе желчи, в составе отмерших клеток кожи, а также при слущивании энтероцитов (эпителиальных клеток кишечника). Женщины теряют больше железа во время менструации и беременности, что относится к нормальным физиологическим потерям железа.
Заболевания (гастрит), образ жизни (диета), критические состояния (острые кровотечения), физиологические процессы (беременность, менструация) приводят к недостаточному поступлению железа в организм или его чрезмерной потере. Часто эти факторы присутствуют одновременно. Поэтому при достаточном поступлении железа в организм оно откладывается про запас в виде ферритина. При повышенной потребности организма в железе данный микроэлемент извлекается из запасов.
При диагностике заболеваний, для оценки запасов железа и его обмена в организме назначают биохимический анализ крови на ферритин.
Что такое ферритин?
Ферритин – это специфический белок, роль которого заключается в депонировании (запасе) свободного железа, который является токсичным для организма. Он представляет собой сложную водорастворимую белковую структуру. Молекула ферритина состоит из белковой полой оболочки – апоферритина и кристаллического ядра — гидроксида и фосфата железа. В ферритине железо находится в водорастворимом, нетоксичном и физиологически доступном состоянии.
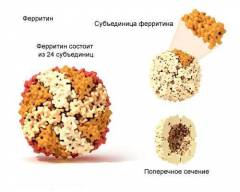
Синтез (выработка) ферритина осуществляется клетками печени, селезенки, тонкого кишечника, щитовидной железы, костного мозга, плаценты, почек. Он обеспечивает функции соответствующих органов. Также в выработке ферритина участвуют лейкоциты (белые клетки крови).
Ферритин находится в:
- плазме крови – ферритин в небольших количествах попадает в плазму крови, где определяют его концентрацию и оценивают запасы железа в организме;
- печени – ферритин печени является основным депо железа в организме;
- слизистой оболочке кишечника – ферритин выполняет функцию переноса всосавшегося железа в энтероциты (клетки слизистой кишечника) к трансферрину плазмы (белку-переносчику железа);
- красном костном мозге – ферритин в красном костном мозге обеспечивает поступление железа для синтеза гемоглобина (железосодержащего белка, транспортирующего кислород в организме);
- селезенке – селезенка является «кладбищем» эритроцитов (красных кровяных телец), так как в ней распадаются «старые» эритроциты, которым более 120 дней, а в результате их распада высвобождается железо, которое депонируется в ферритине;
- плаценте – плацентарный ферритин осуществляет абсорбцию (всасывание) и перенос железа от трансферрина (белка-переносчика железа) матери к плоду.
Синтезированный в различных органах ферритин в небольших количествах попадает в плазму крови. Плазма представляет собой жидкую часть крови с растворенными в ней минеральными и органическими веществами – витаминами, микроэлементами, белками, гормонами и др.
По происхождению ферритина в крови выделяют:
- плазменный ферритин – ферритин попадает в кровь при разрушении клеток плазмы;
- тканевой ферритин – ферритин попадает в кровь при разрушении клеток тканей, содержащих данный белок.
За что отвечает ферритин?
В физиологических условиях ферритин отражает содержание железа в крови. Так 1 мкг/л ферритина крови соответствует 8 мг депонированного железа. Основной функцией ферритина является откладывание железа про запас. Основным депо микроэлемента в организме является ферритин печени.
Также ферритин является белком острой фазы. Реакция острой фазы (преиммунный ответ) – является комплексной защитной реакцией организма, задачей которой является обезвреживание и снижение скорости размножения патогенных (болезнетворных) микроорганизмов. При попадании патогена в организм полноценный иммунный ответ, необходимый для защиты организма, развивается в течение 5 или 7 дней. Поэтому реакция острой фазы необходима, для того чтобы обеспечить организму неспецифическую защиту до развития иммунной реакции. Такую защиту обеспечивают более 30 белков, называемых белками острой фазы. При реакции острой фазы наблюдается лихорадка (жар и озноб), понижение уровня сывороточного железа и цинка, развитие воспаления и другие. Эти реакции направлены на уменьшение резистентности (устойчивости к воздействию внешних факторов) болезнетворных микроорганизмов.
Для нормальной жизнедеятельности микроорганизмам также необходимо железо. Оно используется для синтеза ферментов (белков, ускоряющих химические реакции). Поэтому при попадании патогена в организм в плазме крови концентрация железа уменьшается. Это обеспечивает ограничение доступа микроорганизмов к данному микроэлементу. Более того ионы железа способны повреждать собственные иммунные клетки организма.
Для того чтобы эффективно связывать сывороточное железо, синтез ферритина усиливается и его концентрация в плазме повышается. В реакции острой фазы большую роль играет Н – ферритин, так как он способен быстрее захватывать железо, чем стабильный L – ферритин. Также Н – ферритин защищает клетки организма от повреждения. В норме в плазме концентрация L – ферритина выше, чем Н – ферритина, а при реакции острой фазы — наоборот. Поэтому концентрация ферритина, как острофазного белка, повышается при любом воспалительном процессе инфекционного и неинфекционного характера. При этом его концентрация крайне редко превышает 1000 нг/мл (1000 мкг/л). Часто воспалительные процессы могут маскировать железодефицитную анемию.
Механизм регуляции синтеза ферритина железом
На обмен железа влияют пищевой фактор, запасы железа в организме и гемопоэз (кроветворение).
Необходимое количество железа в организме поддерживается благодаря:
- регуляции всасывания железа в кишечнике;
- регуляции поступления железа в клетки;
- рециркуляции железа эритроцитов после их разрушения.
Синтез ферритина зависит от концентрации железа в сыворотке. Регулирование поступления железа в клетку и синтез ферритина осуществляется специальной системой белков – IRE/IRP при их взаимодействии друг с другом.
При низкой концентрации внутриклеточного железа на поверхности клетки повышается количество рецепторов (молекул, способных присоединять только определенные химические вещества) трансферрина (белка-переносчика железа). Трансферрин взаимодействует с рецепторами и переносит железо в клетку. То есть при низкой концентрации внутриклеточного железа повышается захват железа из крови. Одновременно в клетке синтезируются молекулы ферритина для депонирования, поступившего в клетку, железа.
При высокой концентрации внутриклеточного железа синтез рецепторов трансферрина снижается и поток железа в клетку уменьшается. В ответ на это подавляется синтез ферритина.
Интересные факты о ферритине
- ферритин был открыт и исследован чешским ученым Вильгельмом Лауфбергером;
- в северной части России около 80% населения страдает от дефицита железа;
- ферритин накапливается в мозге человека при болезни Паркинсона (хроническом заболевании, при котором погибают двигательные нервные клетки, нарушается мышечный тонус и регуляция движений) и болезни Альцгеймера (хроническом заболевании, при котором нарушаются связи между клетками мозга и происходит их отмирание, «старческое слабоумие»).
Как узнать уровень ферритина в крови?
Как подготовиться к сдаче анализа на сывороточный ферритин?
Многие факторы влияют на концентрацию железа и впоследствии на концентрацию ферритина в крови. Поэтому для получения достоверных результатов необходимо соблюдать определенные правила. Перед сдачей анализа крови на ферритин врач должен объяснить пациенту, с какой целью проводится данное исследование, суть процедуры забора крови и необходимость соблюдения некоторых правил перед сдачей анализа.
Общими требованиями к сдаче анализа крови на уровень ферритина являются:
- отмена приема пищи за 12 часов до исследования;
- исключение физических и эмоциональных перегрузок за полчаса до забора крови;
- отказ от курения и алкоголя в течение 24 часов перед процедурой;
- отмена приема железосодержащих лекарственных препаратов за неделю до сдачи крови.
Не стоит забывать, что многие факторы приводят к изменению концентрации сывороточного железа и ферритина. Их также стоит учитывать при интерпретации анализов.
К ложному повышению ферритина в крови приводят:
- алкоголь;
- железосодержащие лекарственные препараты – сорбифер, тотема, гематоген;
- оральные контрацептивы (таблетированные противозачаточные);
- лекарственные препараты, содержащие эстроген (женский половой гормон);
- противоопухолевые средства — метотрексат;
- антибиотики — хлорамфеникол, цефотаксим;
- нестероидные противовоспалительные средства — ацетилсалициловая кислота (аспирин).
К ложному понижению ферритина в крови приводят:
- лекарственные препараты, содержащие тестостерон (мужской половой гормон);
- гиполипидемические средства (снижающие уровень сахара в крови) – метформин, холестирамин;
- противоопухолевое средство – аспарагиназа;
- глюкокортикоидные гормоны – кортизол;
- препараты, снижающие концентрацию мочевой кислоты – аллопуринол.
Можно ли сдавать анализ на сывороточный ферритин во время месячных?
Во время месячных не рекомендуется сдавать многие лабораторные анализы, так как это может привести к получению ложных результатов.
При менструации может наблюдаться снижение уровня гемоглобина, повышение уровня эритроцитов. В период перед и во время месячных концентрация сывороточного железа повышается, а после окончания возвращается к первоначальному значению.
Анализ на ферритин в крови во время месячных желательно не проводить для избегания получения неправильных результатов. Исследование лучше провести через неделю после окончания менструации.
Что показывает анализ крови на ферритин?

Исследование уровня ферритина в крови врач может назначить при наличии жалоб со стороны пациента и/или заболеваний, связанных с обменом железа.
Показаниями к анализу уровня ферритина в крови являются:
- оценка запасов железа в организме – исследование концентрации ферритина в крови позволяет оценить запасы железа в организме в норме, а также при различных патологиях (при хронической почечной недостаточности, при гемодиализе, хронических кровотечениях);
- дифференциальная диагностика анемий (патологических состояний, характеризующихся снижением уровня гемоглобина в крови) – анализ позволит оценить запасы железа в крови и отличить истинную железодефицитную анемию от анемии при хронических заболеваниях (при хронических воспалительных процессах, инфекциях, аутоиммунных заболеваниях и других);
- выявление латентного (скрытого) дефицита железа – исследование позволит выявить дефицит железа до того, как появится характерная симптоматика и снижение уровня гемоглобина;
- оценка эффективности лечения железосодержащими препаратами – после 3 – 5 дней приема железосодержащих препаратов уровень ферритина должен повыситься на 50 мг/дл и выше, если это не происходит, то возможно у пациента есть хроническое кровотечение с постоянной потерей железа, либо он не соблюдает режим приема и дозировку лекарств.
Врач может назначить анализ на уровень ферритина в крови при таких симптомах как:
- постоянное чувство усталости;
- повышенная утомляемость;
- бледные кожные покровы;
- выпадение волос;
- ломкость и слоение ногтей;
- раздражительность;
- тахикардия – учащенное сердцебиение;
- снижение иммунитета;
- тошнота, рвота, изжога;
- болезненные ощущения в мышцах при отсутствии повышенной физической нагрузки;
- снижение полового влечения – либидо;
- боль и отечность в области суставов;
- обильные менструации;
- хронические кровотечения (частые носовые кровотечения, кровоточивость десен);
- повышенная пигментация кожи, серо-коричневый оттенок кожи и слизистых оболочек.
Данные симптомы являются следствием повышенного или пониженного уровня ферритина в крови.
Оценка степени запасов железа по концентрации ферритина в крови
| Интерпретация результатов | Концентрация ферритина в крови | |||
| Возраст < 5 лет | Возраст > 5 лет | |||
| женщины | мужчины | женщины | мужчины | |
| Истощение запасов железа | < 12 мкг/л | < 12 мкг/л | < 15 мкг/л | < 15 мкг/л |
| Истощение запасов железа с сопутствующей инфекцией | < 30 мкг/л | < 30 мкг/л | — | — |
| Высокий риск перегрузки организма железом (взрослые) |
— | — | > 150 мкг/л | > 200 мкг/л |
Анализ на уровень ферритина в крови обычно назначают в сочетании с другими лабораторными анализами. Это поможет врачу определить причину изменений концентрации данного лабораторного показателя.
Совместно с анализом крови на уровень ферритина назначают анализ крови на:
- Сывороточное железо. Анализ на уровень ферритина в крови обычно назначают после анализа на сывороточное железо. Сывороточное железо – это концентрация железа в сыворотке крови, не включающее железо гемоглобина и ферритина. Если организм страдает от недостатка железа (при его недостаточном поступлении, большой потере при кровотечении), то он начинает использовать запасы железа из ферритина. При этом уровень сывороточного железа снижен, а уровень ферритина некоторое время может быть в норме или даже немного повышен, но с прогрессированием дефицита железа уровень ферритина значительно снижается.
- Трансферрин. Трансферрин представляет собой белок – переносчик железа в организме. Железо в чистом виде является токсичным для организма, поэтому оно всегда находится в составе трансферрина или ферритина. Для оценки концентрации сывороточного железа используют именно трансферрин. Путем специальных химических реакций из трансферрина выделяют железо и определяют его концентрацию. В норме только 1/3 часть трансферрина насыщена железом. Основная функция трансферрина является связывание и транспорт железа, а также усиленное накопление в случае избытка железа. Поэтому при высоких концентрациях сывороточного железа, трансферрина, ферритина можно судить об избытке железа в организме.
- Общую железосвязывающую способность сыворотки (ОЖСС). Общая железосвязывающая способность сыворотки (ОЖСС) – это лабораторный показатель, отражающий способность связывания и транспортировки железа в сыворотке крови при помощи трансферрина – белка-переносчика железа. Данный анализ позволит определить избыток или дефицит железа в организме. При избытке железа железосвязывающая способность сыворотки снижается, а при недостатке – повышается. Норма общей железосвязывающей способности сыворотки – 40 – 75 мкмоль/л.
- Гемоглобин. Гемоглобин – это железосодержащий белок в составе эритроцитов (красных клеток крови), обеспечивающий связывание и транспорт кислорода в организме. В норме он составляет для женщин — 120 – 140 г/л, для мужчин – 140 – 160 г/л. Многие причины приводят к снижению уровня гемоглобина в крови – острое или хроническое кровотечение, чрезмерное разрушение эритроцитов (гемолитическая анемия), а также дефицит железа в организме. Недостаток железа в организме приводит к железодефицитной анемии (патологическому состоянию, при котором наблюдается снижение гемоглобина и эритроцитов в крови).
- Эритроциты. Эритроциты – красные клетки крови, обеспечивающие транспорт кислорода к органам и тканям. Норма эритроцитов для мужчин – 4,5 – 6,5 х 1012/л, для женщин – 3,9 – 5,6 х 1012/л. Если количество эритроцитов ниже данных показателей, а также низкий уровень сывороточного железа – то у пациента диагностируется железодефицитная анемия. А если уровень эритроцитов низкий, а концентрация железа в крови высокая – то речь идет о гемолитической анемии. При гемолитической анемии наблюдается повышенное разрушение эритроцитов, при этом железо, содержащееся в них, высвобождается в кровь.
- Фолиевую кислоту. Фолиевая кислота (витамин В9) – это водорастворимый витамин, незначительная часть которого производится клетками кишечника, а основная часть поступает с продуктами питания. В сутки человеку необходимо 200 – 400 микрограммов витамина В9. Анализ на фолиевую кислоту проводят для дифференциальной диагностики (отличительной диагностики одной патологии от другой со сходными симптомами) фолиеводефицитной анемии от железодефицитной анемии. Также недостаток фолиевой кислоты приводит к снижению усвоения железа, что впоследствии приведет к недостатку железа в организме и истощению его депо – ферритина.
- Цианокобаламин. Цианокобаламин или витамин В12 также, как и фолиевая кислота, влияет на усвоение и депонирование железа. При его недостатке предшествующий дефицит железа прогрессирует. Цианокобаламин поступает в организм с продуктами питания. Суточная норма витамина составляет 3 микрограмма. При недостатке цианокобаламина развивается В12 – дефицитная анемия, при которой также наблюдается снижение количество эритроцитов и гемоглобина в крови. Поэтому для дифференциального диагноза анемий врач может дополнительно назначить данный анализ.
- Гормоны щитовидной железы. Гормоны щитовидной железы влияют на образование эритроцитов (эритропоэз), на процесс всасывания железа в желудке и усвоение витаминов В12 (цианокобаламина) и В9 (фолиевой кислоты). Поэтому при гипотиреозе (патологии щитовидной железы, при которой вырабатывается малое количество гормонов) или тиреотоксикозе (гиперфункции щитовидной железы, при которой повышается выработка гормонов) нарушается концентрация сывороточного железа, ферритина, трансферрина, а также эритроцитов в крови. При гипотиреозе уровень ферритина остается в пределах нормы, а при тиреотоксикозе уровень ферритина повышается при сопутствующей нормальной или сниженной концентрации сывороточного железа и сниженной концентрации трансферрина.
- Печеночные пробы. Печеночные пробы представляют собой группу лабораторных анализов, оценивающих функции печени. В эту группу входит анализ концентрации общего билирубина и четырех ферментов (химических веществ, ускоряющих течение химических реакций в организме) – аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ), гамма-глутамилтрансферазы (ГГТ). При заболеваниях печени происходит разрушение гепатоцитов (печеночных клеток), что приводит к повышению концентрации билирубина и ферментов. Печень является основным депо железа, поэтому при разрушении гепатоцитов в кровь высвобождается большое количество ферритина.
- Почечные пробы. Почечные пробы – это группа лабораторных анализов, включающая анализ концентрации мочевой кислоты, мочевины, креатинина. Проводят данные анализы для диагностики почечной недостаточности – патологического состояния, при котором нарушаются функции почек. При почечной недостаточности нарушается синтез эритропоэтина – белка, регулирующего образование и созревание эритроцитов. Это приводит к уменьшению количества эритроцитов в крови и анемии. Также почечная недостаточность терминальной стадии вызывает поражение слизистой кишечника, где происходит всасывание железа и фолиевой кислоты, что приведет к снижению концентрации сывороточного железа и ферритина, а впоследствии — к железодефицитной и фолиеводефицитной анемии соответственно.
- С — реактивный белок. С – реактивный белок является одним из белков острой фазы, концентрация которых повышается в плазме крови при наличии воспалительных процессов в организме. Ферритин также является белком острой фазы, поэтому повышение его концентрации в крови не всегда означает избыток железа в организме, повышенное разрушение эритроцитов при гемолитической анемии, наличие болезни печени и других патологий, не связанных с воспалительными процессами. Поэтому если при проведении дополнительных исследований (анализа уровня гемоглобина, эритроцитов, трансферрина, сывороточного железа) причину повышения концентрации ферритина в крови не удалось, то проводят анализ на острофазные белки. Если концентрация данных белков повышена, то причиной повышения ферритина в крови стали воспалительные процессы в организме.
На результат анализа влияет:
- возраст пациента – при рождении уровень ферритина в норме достаточно высокий (до 200 мкг/л), в следующие полгода жизни уровень повышается до 600 мкг/л, а после 14 лет показатели уровня ферритина почти не меняются;
- пол пациента – у мужчин уровень ферритина выше, чем у женщин (у мужчин – 20 – 250 мкг/л, у женщин – 10 – 120 мкг/л), в период менопаузы уровень ферритина в крови у женщин приравнивается к показателям уровня ферритина у мужчин – 15 – 200 мкг/л;
- химиотерапия (основной метод лечения онкологических заболеваний, заключающийся в приеме препаратов, подавляющих рост раковых клеток) – при химиотерапии происходит повышенное разрушение клеток, при этом ферритин из этих клеток попадает в кровь и повышается его концентрация;
- прием железосодержащих лекарственных препаратов – при приеме железосодержащих препаратов происходит повышенное поступление железа в организм и его связывание с ферритином, что вызывает повышение его уровня в крови;
- наличие воспалительных процессов в организме – ферритин является белком острой фазы, то есть его уровень повышается при воспалительных процессах;
- наличие онкологических заболеваний – ферритин является онкомаркером, то есть повышается при наличии раковых заболеваний.
Какова норма ферритина крови?
У новорожденного концентрация ферритина в крови высокая, и в последующие два месяца она еще повышается. В более поздний период грудного возраста уровень ферритина понижается. В возрасте около года уровень ферритина вновь повышается и остается высоким до достижения взрослого возраста.
У мужчин, начиная с подросткового возраста, уровень ферритина в крови выше, чем у женщин. Такие различия наблюдаются вплоть до зрелого возраста. Наиболее высокая концентрация ферритина у мужчин наблюдается в возрасте от 30 до 39 лет.
У женщин концентрация ферритина в крови ниже, чем у мужчин. До наступления менопаузы уровень ферритина остается относительно низким. Но после менопаузы концентрация ферритина в крови увеличивается, постепенно достигая значений ферритина у мужчин.
Такие различия значений уровня ферритина у мужчин и женщин обоснованы их физиологическими особенностями. Организм женщины нуждается в большем количестве железа, так как железо теряется с менструальной кровью, во время родов, используется в большом количестве при беременности. Поэтому большая часть железа, поступающего в организм женщины, используется на нужды организма, а меньшая его часть откладывается про запас в виде ферритина.
Содержание ферритина в крови в зависимости от возраста и пола
| Возраст и пол | Содержание ферритина (нг/мл = мкг/л) |
| Новорожденные | 25 — 200 |
| 1 месяц | 200 — 600 |
| От 1 до 6 месяцев | 6 — 410 |
| От 6 месяцев до 1 года | 6 — 80 |
| От 1 года до 5 лет | 6 – 60 |
| От 5 лет до 14 лет | 6 — 320 |
| Старше 14 лет – мужской пол | 20 — 250 |
| Старше 14 лет – женский пол | 10 — 120 |
| Женщины после менопаузы | 15 — 200 |
На концентрацию ферритина в крови, в отличие от гемоглобина, не влияет ни место проживания, ни вредные привычки (курение). Гемоглобин – это белок, который входит в состав эритроцитов (красных клеток крови). Он содержит железо, которое способно присоединять и отдавать кислород, чем обеспечивается транспорт кислорода в организме. В случае если организм человека страдает от недостатка кислорода, то компенсаторно повышается уровень гемоглобина, переносящего кислород к органам и тканям. Такие изменения наблюдаются у курящих людей и людей, живущих в высокогорных местностях с разреженным воздухом.
Каким должен быть уровень ферритина при беременности?
Железо особенно важно для нормального течения беременности и развития плода. В этот период потребности организма в железе повышаются. Объем циркулирующей крови у беременной увеличивается на 50%, а, следовательно, происходит больше выработки гемоглобина и эритроцитов. Эти процессы зависят от уровня железа в крови.
Также железо используется для развития плаценты, эритропоэза (образования эритроцитов) плода, транспорта кислорода к плоду, поддержания иммунной системы женщины и других процессов.
Суточная потребность в железе у беременных возрастает и составляет 31 – 39 миллиграммов. Также увеличивается дополнительный расход железа в течение I, II и III триместра. В целом будущей маме необходимо 800 миллиграммов железа дополнительно, так как во время беременности и родов расходуется до 700 миллиграммов железа.
Уровень ферритина в крови беременной женщины понижен, что является нормой. Обусловлено это повышенным использованием железа. Поэтому на нужды организма расходуется и депонированное железо. В срок 20 недель уровень ферритина может снижаться на 50% от нормы, а в III триместре — на целых 70%. Здоровое полноценное питание крайне важно для беременной женщины, так как запасы железа в организме должны постоянно пополняться.
Уровень ферритина при беременности
| Срок беременности | Норма ферритина в крови |
| Первый триместр | 55 – 90 мкг/л |
| Второй триместр | 25 – 75 мкг/л |
| Третий триместр | 10 – 16 мкг/л |
Недостаток железа может привести к опасным осложнениям – преждевременным родам, выкидышу, развитию аномалий и гибели плода. Во время беременности необходимо контролировать уровень сывороточного железа, трансферрина, ферритина, для того чтобы избежать дефицита железа. Усугубляет ситуацию предшествующая беременности железодефицитная анемия.
Для профилактики и лечения железодефицитных состояний беременным назначают препараты железа со строгим контролем лабораторных показателей. Также следует включить в рацион мясные продукты, сухофрукты, бобовые, зелень, орехи.
Перед планированием беременности необходимо пройти обследование и сдать анализ крови на сывороточное железо и ферритин. Железо влияет на качество яйцеклеток и повышает вероятность оплодотворения. Часто при бесплодии диагностируется его дефицит.
Какие заболевания приводят к снижению уровня ферритина в крови?

К снижению уровня ферритина в крови приводит:
- Гипотиреоз. Недостаток гормонов щитовидной железы приводит к снижению кислотности желудка, что препятствует превращению трехвалентного железа в двухвалентное, которое усваивается организмом. Также при гипотиреозе снижается усвоение витамина В12 и фолиевой кислоты, необходимых для всасывания железа в желудочно-кишечном тракте. Железо, в свою очередь, участвует в синтезе гормонов щитовидной железы. Таким образом, получается замкнутый круг – дефицит железа приводит к гипотиреозу, а гипотиреоз к дефициту железа.
- Повышенный расход железа. Снижение концентрации ферритина наблюдается при повышенном расходе железа. Организм нуждается в большем количестве железа при росте, беременности, во время активной умственной и физической деятельности, неконтролируемом донорстве крови.
- Кровопотеря. При кровопотере организм теряет железо, которое содержится в гемоглобине. К дефициту ферритина приводит хроническое, повторяющееся кровотечение – обильные менструации, частые носовые кровотечения, кровотечения из десен. При недостаточном поступлении железа в организм истощаются его запасы в виде ферритина.
- Заболевания желудочно-кишечного тракта. Всасывание железа и преобразование его в усвояемую форму происходит в желудочно-кишечном тракте. Поэтому при атрофическом гастрите (воспалении слизистой желудка с уменьшением количества функционирующих клеток), энтероколите (одновременном воспалительном процессе тонкого и толстого кишечника), целиакии (врожденном заболевании, при котором повреждаются ворсинки кишечника и не усваиваются белки – глютен, авенин, гордеин) и других заболеваниях снижается усвоение железа и истощаются его запасы.
- Неполноценное питание и гиповитаминоз. Железо не производится организмом. Единственным его источником являются продукты питания. Поэтому при неполноценном, однообразном питании в организм не поступает достаточное количество железа. Также при неполноценном питании организм страдает от недостатка витаминов (гиповитаминоза), которые способствуют усвоению железа. Организм использует на свои нужды железо из депо, что со временем приводит к снижению уровня ферритина в крови.
- Климакс (угасание репродуктивной функции женщины). Во время климакса нарушается обмен веществ, в том числе и железа.
- Беременность (III триместр) и кормление грудью. Во время беременности и кормления грудью расходуется гораздо большее количество железа. Если его уровень не восполняется с продуктами питания, то это может привести к дефициту железа и истощению его запасов.
Снижение уровня ферритина отражает дефицит железа. Поэтому симптомы снижения уровня ферритина идентичны симптомам при дефиците железа.
Симптомами снижения уровня ферритина в крови являются:
- снижение работоспособности;
- частая смена настроения – раздражительность, плаксивость;
- выпадение волос;
- ломкость ногтей;
- снижение полового влечения (либидо);
- снижение концентрации внимания, ухудшение памяти;
- бледность, сухость и шелушение кожных покровов;
- диспептические расстройства (расстройства пищеварения);
- частые головокружения;
- учащение сердцебиения.
Как нормализовать сниженный уровень ферритина крови?

Если уровень ферритина понизился на фоне гипотиреоза, то необходимо пройти курс лечения препаратами йода, а также вылечить воспалительный процесс щитовидной железы. В случае заболеваний ЖКТ необходимо пройти курс лечения противовоспалительными, гормональными, стимулирующими секрецию желудка препаратами.
Но основной причиной снижения уровня плазменного ферритина является дефицит железа. Поэтому, в первую очередь, необходимо восполнить запасы железа в организме. Для этого применяют препараты железа и соблюдают специальную диету.
При дефиците железа необходимо придерживаться диеты, содержащей большое количество железа. С пищей поступает гемовое и негемовое железо. Гемовое железо гораздо легче усваивается организмом. Его источником являются мясные продукты. Растительные продукты – источники негемового железа.
Источниками гемового железа являются:
- печень свиная – 18,9 мг железа в 100 г;
- печень телячья – 10,9 мг железа в 100 г;
- сердце – 6,1 мг железа в 100 г;
- говяжий язык – 4,9 мг железа в 100 г;
- мидии – 4,4 мг железа в 100 г;
- мясо кролика – 4,3 мг железа в 100 г;
- устрицы – 4 мг железа в 100 г;
- мясо индейки – 4 мг железа в 100 г;
- мясо курицы – 3 мг железа в 100 г;
- телятина – 2,7 мг железа в 100 г;
- говядина – 2,6 мг железа в 100 г;
- скумбрия – 2,3 мг железа в 100 г.
Источниками негемового железа являются:
- грибы сушеные – 34 мг железа в 100 г;
- морская капуста – 15,9 мг железа в 100 г;
- семечки тыквы – 15,1 мг железа в 100 г;
- яблоки сушеные – 14,9 мг железа в 100 г;
- груша сушеная – 12,9 мг железа в 100 г;
- фасоль – 12,3 мг железа в 100 г;
- шиповник – 10,9 мг железа в 100 г;
- горох – 9,4 мг железа в 100 г;
- гречка – 7,9 мг железа в 100 г;
- орехи – 6 мг железа в 100 г.
Препараты железа классифицируются по способу введения на пероральные и парентеральные. Пероральное ведение – это введение препарата через рот. Такие препараты могут быть в виде таблеток, капсул, сиропов, растворов, жевательных пастилок. Пероральные препараты могут содержать двухвалентное или трехвалентное железо. Двухвалентное железо легче усваивается организмом, поэтому такие препараты эффективнее по сравнению с препаратами, содержащими трехвалентное железо. Парентеральное введение представляет собой внутривенное, внутримышечное, подкожное введение лекарственного препарата, минуя желудочно-кишечный тракт. Внутривенное введение железосодержащих препаратов должно проводиться только в условиях стационара, под контролем врача и с набором противошоковой терапии. Вначале необходимо ввести тест – дозу (небольшое количество лекарства). В случае отсутствия патологической реакции на препарат вводят полную дозу.
Препараты железа, применяемые при низком уровне ферритина
| Препарат | Доза, форма выпуска |
| Пероральные препараты, содержащие двухвалентное железо | |
| Тотема | Раствор. Принимают по 100 – 200 миллиграммов в сутки в 2 или 4 приема. Длительность лечения — до полугода. |
| Сорбифер | Таблетки. Принимают по 1 таблетке (100 мг железа) до 2 раз в день. Длительность лечения контролируется по лабораторным показателям. |
| Актиферрин | Капли. Дозу рассчитывают по формуле — 5 капель Х кг массы тела. Принимать по 2 – 3 раза в сутки. Длительность лечения устанавливает врач. |
| Гемофер | Раствор. Принимать по 2 миллилитра (55 капель) 2 раза в сутки в течение 2 – 3 месяцев. |
| Ферроплекс | Драже. Принимают по 2 драже трижды в сутки за два часа до приема пищи или через час после. Длительность курса лечения устанавливается индивидуально. |
| Пероральные препараты, содержащие трехвалентное железо | |
| Ферлатум | Раствор. Принимать внутрь по 1 – 2 флакона до 2 раз в сутки. Курс лечения — не больше 6 месяцев. |
| Биофер | Жевательная таблетка. Принимают внутрь, разжевывая и запивая водой. По 1 таблетке (100 мг железа) дважды в день в течение 1 – 2 месяцев. |
| Мальтофер | Жевательные таблетки, сироп. Принимать по 1 (100 мг железа) – 3 таблетки в сутки во время или после приема пищи. Длительность лечения – до 5 месяцев. |
| Феррум лек | Жевательные таблетки, сироп. Принимают по 1 – 3 жевательные таблетки в сутки (100 – 300 мг железа), в виде сиропа – по 10 – 30 мл (100 – 300 мг железа). |
| Фенюльс | Капсулы. Принимают по 1 капсуле дважды в день в течение 3 месяцев. |
| Парентеральные препараты | |
| КосмоФер | Раствор для внутримышечного и внутривенного введения. Принимают внутривенно медленно по 2 – 4 мл (100 – 200 мг железа) до 3 раз в неделю. Препарат применяют в разбавленном виде. Внутримышечно – по 2 мл 1 – 2 раза в неделю. Принимают в неразбавленном виде. |
| Венофер | Раствор для внутривенного введения (не вводится внутримышечно). Доза рассчитывается индивидуально с учетом массы тела и уровня гемоглобина в крови. |
| Феринжект | Раствор для внутривенного введения. Вводят однократно 20 мл препарата (1000 мг железа) 1 раз в неделю. |
| Феррум лек | Раствор для внутримышечных инъекций (не вводится внутривенно). Вводят внутримышечно по 100 мг (1 ампула) в сутки. |
При лечении препаратами железа следует:
- избегать одновременного приема лекарств, ухудшающих усвоение железа – препаратов кальция, антибиотиков, препаратов, содержащих тестостерон;
- употреблять чай и кофе в небольших количествах, так как эти напитки снижают всасывание железа;
- принимать дополнительно витамины группы В, витамин С, А, Е, которые способствуют усвоению железа;
- принимать ферментные препараты (панкреатин) с целью профилактики нарушения пищеварения (побочный эффект приема железосодержащих препаратов);
- заменить препарат в случае появления побочных реакций;
- индивидуально подбирать препарат, дозу и путь введения для каждого пациента;
- назначать длительные курсы лечения – в первые 2 месяца назначать лечебные дозировки, а в последующие 3 – профилактические;
- контролировать уровень сывороточного железа, ферритина, трансферрина;
- назначать внутривенное введение препаратов при заболеваниях органов желудочно-кишечного тракта;
- назначать в виде пероральных средств (при отсутствии противопоказаний), так как такой метод введения способствует лучшему усвоению железа;
- избегать самолечения, так как передозировка опасна для здоровья.
К побочным эффектам препаратов железа относятся:
- аллергические реакции (крайне редко);
- раздражение слизистой ЖКТ с диспептическими явлениями – рвота, запор, диарея, боли в животе, тошнота;
- при внутривенном введении (побочные эффекты развиваются крайне редко) – учащение сердцебиения, спазм бронхов, анафилактоидные реакции.
О чем говорит повышенный уровень ферритина крови?

Так как ферритин является белком острой фазы, то его уровень повышается при многих воспалительных заболеваниях, а также при онкологических (раковых) заболеваниях, при инфицировании вирусом иммунодефицита человека (ВИЧ), заболеваниях щитовидной железы с ее гиперфункцией.
Причины повышения уровня ферритина в крови
| Группа заболеваний или патологические процессы | Заболевания или условия, образ жизни | Причины повышения уровня ферритина |
| Нарушение обмена железа, избыточное поступление железа в организм | Гемохроматоз – наследственное генетическое заболевание, при котором нарушается обмен железа, и оно накапливается в органах и тканях. | В норме в организме человека содержится 3 – 4 грамма железа, а при гемохроматозе – 20 – 60 граммов. Избыток железа начинает накапливаться в органах и тканях в виде гемосидерина и ферритина, при этом концентрация ферритина в крови существенно повышается. |
| Диеты с избыточным содержанием железа. Передозировка железосодержащих препаратов. | При чрезмерном употреблении пищи, богатой железом (в основном мясных продуктов), избыточное количество железа переходит в ферритин про запас. Также при самостоятельном лечении препаратами железа или превышении назначенных доз повышается поступление железа в организм и его депонирование. | |
| Острая перемежающаяся порфирия – наследственное заболевание, при котором нарушается биосинтез гема (небелковой части гемоглобина, содержащей двухвалентное железо). | При острой перемежающейся порфирии наблюдается аномально повышенный уровень сывороточного железа, которое накапливается в виде ферритина. | |
| Частые переливания крови. | Частые переливания крови приводят к периодическому поступлению сывороточного железа в кровь пациента. Это приводит к избытку сывороточного железа и, следовательно, ферритина. | |
| Гемолитическая анемия – группа заболеваний, при которых происходит интенсивное разрушение эритроцитов. | При гемолитической анемии в кровь попадают продукты распада эритроцитов. Одним из продуктов распада является сывороточное железо, которое откладывается в виде ферритина. | |
| Талассемия – наследственное заболевание, при котором нарушается синтез структур гемоглобина. | При талассемии и сфероцитозе происходит повышенное разрушение эритроцитов и попадание в кровь железа. А это, в свою очередь, приводит к избытку ферритина. | |
| Сфероцитоз – это заболевание, при котором наблюдается аномальное развитие мембран эритроцитов. В норме эритроциты плоские двояковогнутые, а при сфероцитозе – сферической формы, что приводит к их повышенному разрушению. | ||
| Мегалобластная анемия – заболевание, характеризующееся неполноценным формированием красных кровяных телец (эритроцитов) вследствие недостатка фолиевой кислоты и/или витамина В12. | При мегалобластной анемии нарушается синтез эритроцитов, поэтому затраты железа на синтез эритроцитов значительно уменьшаются, что ведет к избыточному накоплению железа в виде ферритина. | |
| Заболевания печени | Стеатоз печени (жировое перерождение печени, жировой гепатоз, жировая инфильтрация печени) – патологическое состояние, при котором нарушается обмен веществ в клетках печени (гепатоцитах), что приводит к избыточному накоплению в них жира. | При стеатозе печени в гепатоцитах накапливается жир в виде капелек. Жир может накапливаться в клетках печени в избыточном количестве, что приводит к разрушению гепатоцита. Так как печень является основным депо железа, то после разрушения гепатоцита ферритин попадает в кровь. Чем больше гепатоцитов разрушается, тем выше концентрация ферритина к плазме. |
| Хронический вирусный гепатит В или С – воспалительный процесс в тканях печени, вызванный вирусами. | При попадании вируса гепатита В или С в клетки печени он начинает активно размножаться. При этом на внешней поверхности гепатоцита появляется антиген вируса – чужеродные структуры, вызывающие иммунный ответ организма. Такая клетка с антигеном на своей поверхности атакуется иммунной системой. Таким образом, большое количество клеток печени разрушается иммунной системой и непосредственно вирусом. При разрушении гепатоцитов в кровь высвобождается ферритин. | |
| Хронический алкоголизм, алкогольный гепатит – алкоголизмом называется первичное хроническое заболевание, характеризующееся пристрастием к алкоголю, нарушением контроля над его употреблением и игнорирование последствий. Алкогольный гепатит – воспалительное заболевание печени на фоне чрезмерного приема алкоголя. | Алкоголь метаболизируется в печени до ацетальдегида, который является очень токсичным для печени и приводит к повреждению гепатоцитов. Под влиянием данного вещества гепатоциты страдают от недостатка кислорода и впоследствии разрушаются. Это сопровождается попаданием в кровь ферритина. Длительное употребление алкоголя приводит к воспалительному процессу печени – гепатиту с дальнейшим разрушением клеток печени. | |
| Нарушение кровообращения печени при пороках сердца, застойной сердечной недостаточности и других заболеваниях сердца. | Нарушение кровообращения приводит к недостаточному поступлению кислорода и питательных веществ к клеткам печени, что приводит к разрушению и гибели. В результате ферритин клеток печени попадает в кровь. | |
| Цирроз печени – хроническое заболевание печени, при котором происходит необратимое замещение нормальной ткани печени на соединительную ткань (рубцовую). | Цирроз печени является следствием многих заболеваний – стеатоза печени, алкогольного и вирусного гепатита, генетических аномалий, чрезмерного и длительного приема лекарств и др. При циррозе печени также происходит разрушение гепатоцитов с их замещением на соединительную ткань. | |
| Онкологические заболевания | Острый лимфолейкоз, острый миелолейкоз – злокачественные болезни системы кроветворения. | Исследования показали, что Н – формы ферритина способны подавлять деление клеток крови (миелоидных и лимфоидных), что приводит к подавлению их злокачественного роста при лимфолейкозе и миелолейкозе. Ферритин является онкомаркером. Онкомаркер – продукт жизнедеятельности опухоли или вещество, выделяемое здоровыми тканями в результате внедрения раковых клеток, который обнаруживается в большой концентрации в крови или моче онкобольных. |
| Рак легкого. | ||
| Рак молочной железы. | ||
| Миеломная болезнь – это опухоль системы клеток иммунной системы – В-лимфоцитов. | ||
| Болезнь Ходжкина (лимфогранулематоз) – онкологическое заболевание, при котором происходит патологическое разрастание лимфоидной ткани. | ||
| Гепатома – рак печени. | ||
| Рак поджелудочной железы. | ||
| Хронические воспалительные процессы | Болезнь Стилла – ювенильный (детский) ревматоидный артрит (воспаление суставов). | Ферритин является белком острой фазы. Реактивная острая фаза – это неспецифическая защитная реакция организма от неблагоприятного воздействия патогенного микроорганизма до развития иммунного ответа. Для поддержания жизнедеятельности микроорганизмам необходимо железо. Поэтому для снижения резистентности (сопротивляемости) патогенов организм ограничивает количество сывороточного железа, включая его в ферритин. При этом уровень ферритина в плазме крови повышается. |
| Хронические бактериальные инфекции – инфекции дыхательных путей (бронхит, трахеит), мочевыводящих путей (цистит, уретрит). | ||
| Системная красная волчанка – аутоиммунное хроническое системное заболевание, при котором собственные клетки организма распознаются иммунной системой как чужеродные и атакуются. | ||
| Ревматоидный артрит – аутоиммунное системное заболевание соединительной ткани, при котором преимущественно поражаются мелкие суставы. | ||
| Остеомиелит – гнойно-некротическое поражение костей и костного мозга, а также окружающих мягких тканей, вызванное бактериями, способствующими появлению гноя. | ||
| Болезнь Крона – хроническое воспаление желудочно-кишечного тракта, при котором появляются гранулемы (узелки). | ||
| Неспецифический язвенный колит – хроническое заболевание иммунного характера, характеризующееся воспалением слизистой оболочки толстого отдела кишечника. | ||
| Заболевания щитовидной железы | Тиреотоксикоз — патология, при которой наблюдается гиперфункция щитовидной железы с повышением концентрации гормонов. | Гормоны щитовидной железы влияют на образование эритроцитов, усвоение железа в кишечнике, усвоение фолиевой кислоты и витамина В12. При дефиците гормонов щитовидной железы нарушается усвоение железа, а при избытке – наоборот. |
Повышение уровня ферритина не проявляется никакими симптомами, но могут наблюдаться специфические симптомы патологии, которая стала причиной повышения ферритина. При воспалительных процессах это может быть лихорадка, локализованная или диффузная (распространенная) боль, плохое самочувствие, общая слабость и другие.
При повышенном ферритине на фоне избытка железа характерны:
- головокружение;
- нарушение ритма сердца;
- нарушение пищеварения (рвота, изжога, диарея, отсутствие аппетита);
- развитие заболеваний печени;
- зуд;
- снижение массы тела.
Как нормализовать повышенный уровень ферритина крови?
В случае если причиной повышенного ферритина является избыток железа в организме, то данное состояние требует лечения. Железо характеризуется свойством быстро накапливаться при его постоянном поступлении в организм. Физиологический период полувыведения (время, за которое концентрация железа в организме уменьшается на 50%) составляет 1800 суток. Избыток железа может стать причиной развития серьезных заболеваний – инфаркта миокарда (отмирания участка сердечной мышцы из-за нарушения ее кровоснабжения), артрита (воспаления суставов), сахарного диабета, печеночной недостаточности, раковых заболеваний.
Для снижения уровня ферритина при избытке железа рекомендуется:
- исключение из рациона продуктов, богатых железом – исключаются все виды мясных продуктов, морепродукты, сушеные фрукты, бобовые и другие;
- отмена приема препаратов железа – сорбифер, венофер, тотема, феринжект и другие;
- применение лекарственных препаратов, ускоряющих выведение железа – препараты, связывающие железо (десферал, тетацин кальция), препараты цинка, гепатопротекторы (урсодекс, эссенциале, тиогамма);
- употребление продуктов, ухудшающих всасывание железа – продукты, содержащие кальций, а также чай, кофе, рис;
- кровопускание – еженедельный забор крови в объеме до 400 миллилитров;
- донорство крови – добровольная сдача крови и ее компонентов;
- обменное переливание крови – процесс изъятия крови пациента с одновременной трансфузией крови донора.
Лечебные мероприятия проводятся под контролем лечащего врача. В этот период необходимо исследовать уровень сывороточного железа, ферритина, трансферрина, общую железосвязывающую способность сыворотки (ОЖСС), процент насыщения трансферрина и других лабораторных показателей.
Почему уровень ферритина в крови повышен при низких концентрациях сывороточного железа?

Повышение уровня ферритина при низках концентрациях железа встречается при:
- онкологических заболеваниях – раке яичника, раке прямой кишки, раке легких;
- воспалительных процессах инфекционной и неинфекционной природы – туберкулезе, бронхите, неспецифическом язвенном колите;
- тиреотоксикозе – гиперфункции щитовидной железы с повышением уровня гормонов – тироксина и трийодтиронина;
- инфицировании вирусом иммунодефицита человека (ВИЧ) – вирус поражает клетки иммунной системы человека, вследствие чего развивается синдром приобретенного иммунодефицита человека (СПИД).
Для того чтобы диагностировать причину повышения ферритина в крови при низком уровне сывороточного железа, врач может назначить дополнительные лабораторные (общий анализ крови, трансферрин, С – реактивный белок) и инструментальные анализы (компьютерную томографию, рентген).
Какой уровень ферритина при неспецифическом язвенном колите (НЯК)?
К симптомам неспецифического язвенного колита относятся:
- частый жидкий стул (до 20 раз в день) с примесью алой крови, гноя, слизи;
- позывы к дефекации, сопровождающиеся болезненными ощущениями;
- диффузная боль в животе;
- лихорадка (болезненное состояние, проявляющееся жаром и ознобом);
- потеря аппетита;
- выраженная слабость;
- повышенная утомляемость;
- потеря массы тела;
- бледность кожных покровов.
Причиной развития неспецифического язвенного колита считается генетическая предрасположенность, чрезмерный иммунный ответ на микрофлору кишечника, болезнетворное воздействие на кишечник вирусов и бактерий. Вначале поражается прямая кишка, затем воспалительный процесс распространяется в верхние отделы кишечника. При этом практически вся слизистая толстого кишечника воспалена. На его поверхности появляются язвы различной формы (чаще встречаются узкие, длинные, с ровными краями). Пациенты с язвенным колитом страдают от хронического кровотечения из язв и воспаленных участков кишечника. У небольшой части пациентов (около 1%) болезнь осложняется массивным кровотечением. У 10 – 20% больных, страдающих неспецифическим язвенным колитом в течение длительного периода, развивается рак.
Ферритин является острофазным белком, концентрация которого повышается при наличии воспалений различного характера. Поэтому при неспецифическом язвенном колите ферритин будет повышен даже на фоне дефицита железа. Также при развитии рака на фоне язвенного колита уровень ферритина в крови будет повышен (ферритин является онкомаркером).
При ремиссии заболевания (в отсутствии реакции острой фазы) уровень ферритина может быть снижен. При неспецифическом язвенном колите развивается дефицит железа. Связано это с нарушением всасывания железа, а также с постоянной его потерей при кровотечениях из язв.
Для оценки запасов железа в организме при язвенном колите не стоит полагаться только на уровень ферритина в крови. Так как, будучи острофазным белком и онкомаркером, его высокая концентрация в крови может маскировать прогрессирование дефицита железа, что приведет к развитию железодефицитной анемии. Поэтому необходимо провести дополнительные анализы на концентрацию сывороточного железа, трансферрина, процент насыщения трансферрина, общей железосвязывающей способности сыворотки.
Какой уровень ферритина при железодефицитной анемии (ЖДА)?
Железодефицитная анемия составляет 80% от всех анемий. По данным Всемирной Организации Здравоохранения около 1,8 миллиардов человек страдают анемией. Около 2 миллиардов человек страдают латентным (скрытым) дефицитом железа. Часто анемия встречается у беременных, у подростков лет 12 – 17, у людей с заболеваниями органов желудочно-кишечного тракта и с хроническими кровотечениями.
Симптомами железодефицитной анемии являются:
- бледность кожных покровов;
- выпадение волос, слоение ногтей;
- ангулит (трещинки в уголках рта, заеды);
- общая слабость, частое переутомление;
- извращение вкуса (желание есть мел, землю);
- пристрастие к необычным запахам (к запаху бензина);
- низкое артериальное давление (артериальная гипотензия);
- глоссит (воспаление языка);
- учащенное сердцебиение (тахикардия).
Одного анализа на уровень ферритина в крови недостаточно для установления диагноза железодефицитной анемии. Врач дополнительно назначит анализ на уровень гемоглобина, эритроцитов, сывороточного железа, общей железосвязывающей способности сыворотки (ОЖСС), трансферрина и других показателей. В начальной стадии появляется скрытый (латентный) дефицит железа, при котором еще нет лабораторных и симптоматических признаков. При прогрессировании дефицита железа изменяются и другие лабораторные показатели.
Лабораторные параметры при железодефицитной анемии (ЖДА)
| Показатель | Значение при ЖДА | Норма |
| Гемоглобин |
Снижен Анемия I степени – 90 – 110 г/л |
Женщины – 120 – 140 г/л Мужчины – 130 – 160 г/л |
| Эритроциты |
Умеренное снижение Женщины < 3,7 х 1012/л, но не ниже 2 х 1012/л |
Женщины – 3,7 – 4,7 х 1012/л Мужчины – 4,0 – 5,0 х 1012/л |
| Сывороточное железо |
Снижено У женщин < 11 мкмоль/л |
Женщины – 8,9 – 30,4 мкмоль/л Мужчины – 11,6 – 30,4 мкмоль/л |
| ОЖСС |
Повышена > 75 мкмоль/л |
45 – 75 мкмоль/л |
| Ферритин |
Снижен Женщины < 20 мкг/л |
Женщины — 10 – 120 мкг/л Мужчины — 20 – 250 мкг/л |
| Трансферрин |
Повышен Женщины > 3,7 г/л |
Женщины – 1,86 – 3,7 г/л Мужчины – 2,0 – 4,0 г/л |
| процент насыщения трансферрина |
Снижено < 15% |
> 17% |
При железодефицитной анемии ткани и органы страдают от недостатка кислорода. Поэтому данное заболевание необходимо лечить. Лечение проводят препаратами железа. Доза и метод введения (внутривенно или в виде таблеток, сиропа) определяются лечащим врачом и зависят от степени анемии. Во время лечения необходимо контролировать уровень сывороточного железа для избегания перегрузки организма железом.
Может ли низкий уровень ферритина приводить к бесплодию и влияет ли уровень ферритина на зачатие?

Вероятность забеременеть при дефиците железа снижается на 60%. В случае если зачатие произошло, дефицит железа может нарушить нормальное деление клеток плода и привести к аномалиям развития. Более чем в половине случаев скрытый дефицит железа приводит к железодефицитной анемии во время I триместра беременности. Извращение пищевого поведения беременной (желание съесть мел), пристрастие к странным запахам часто говорит о дефиците железа.
У женщин, страдающих бесплодием, латентный (скрытый) дефицит железа обнаруживался в 40% случаев. Результаты исследований показали, что при скрытом дефиците железа частота наступления беременности при экстракорпоральном оплодотворении (ЭКО) гораздо ниже. Также наблюдается высокая частота осложнений – ранние репродуктивные потери, угроза выкидыша, дисбиоз влагалища (нарушение нормальной микрофлоры). Дефицит железа является негативным фактором для наступления беременности при экстракорпоральном оплодотворении. Это связано с тем, что нарушается нормальная функция железосодержащих энзимов (белков, ускоряющих химические реакции в организме), которые принимают участие в имплантации эмбриона (прикреплении плодного яйца к матке).
Перед планированием беременности, проведением процедуры экстракорпорального оплодотворения (ЭКО) необходимо пройти ряд обследований. Очень важно сдать кровь на сывороточное железо, ферритин крови, общую железосвязывающую способность сыворотки. При обнаружении дефицита железа врач назначит соответствующее лечение препаратами железа.
Как повысить уровень ферритина в крови народными средствами?

Самым эффективным лечением железодефицитных состояний является прием лекарственных препаратов.
Побочные эффекты от приема железосодержащих препаратов незначительны, а серьезных противопоказаний практически нет. Поэтому не стоит бояться принимать лекарства, а тем более заменять их приемом народных средств. Также лечение должно проводиться под контролем врача и лабораторных показателей — концентрации сывороточного железа, общей железосвязывающей способности сыворотки, уровня ферритина в крови. Это необходимо, для того чтобы избежать усугубления дефицита железа либо его избытка.
Применение народных средств для повышения уровня ферритина в крови не должно стать основным лечением, но может быть хорошим дополнением к основному лечению. Перед применением каких-либо трав, настоек, отваров необходимо проконсультироваться с врачом, так как при многих заболеваниях (болезнях желудочно-кишечного тракта, почек, сердечно-сосудистой системы) они могут быть противопоказаны.
Для повышения уровня ферритина в крови применяют:
- Сок из моркови и фенхеля. Для приготовления сока смешивают 270 миллилитров морковного сока и 30 граммов фенхеля. Употребляют в течение суток независимо от приема пищи.
- Смесь из гречки, грецкого ореха и меда. Для приготовления смеси 200 граммов сырой гречки и 200 граммов грецких орехов измельчают в кофемолке и смешивают. В полученную смесь добавляют ложку меда. Применять по 1 ложке 3 – 5 раз в день в течение недели.
- Сок из моркови, свеклы и редьки. Морковь, свеклу и редьку в равных пропорциях пропускают через соковыжималку. Сок принимают по 1 столовой ложке перед каждым приемом пищи в течение 3 месяцев.
- Настой из земляники. Две столовые ложки измельченных сушеных корней и листьев земляники помещают в термос и добавляют 500 миллилитров кипятка. Настаивают в течение 12 часов. Настой применяют по 100 миллилитров 3 раза в день.
- Чай из медуницы. Высушенные цветки медуница заливают 200 миллилитрами кипятка и настаивают 5 – 10 минут. Употребляют как чай после приема пищи 1 – 2 раза в день.
- Сок из моркови, свеклы и яблока. Ингредиенты в пропорции 2:1:1 отжимают в соковыжималке. Применяют сразу же после отжима, чтобы сохранить полезные вещества. Перед употреблением необходимо съесть ложку сметаны, так как жиры способствуют лучшему усвоению каротина (витамина А). Рекомендуется принимать по 500 миллилитров свежевыжатого сока за полчаса до приема пищи или через час после приема пищи.
Какие причины низкого уровня ферритина у детей?
Причиной низкого ферритина у детей могут быть железодефицитные состояния, вызванные:
- осложнениями беременности и родов – отслойка плаценты, кровотечение, инфекционные заболевания матери, угроза выкидыша приводят к дефициту железа у новорожденных;
- хроническими кровотечениями – частые носовые кровотечения могут привести к постоянной потере железа с кровью и снижению ферритина;
- инфекционными заболеваниями (туберкулез), микозами (поражением внутренних органов и кожи грибком), глистными инвазиями – при данных патологиях наблюдается дефицит железа вследствие значительного снижения его усвоения;
- несбалансированным питанием – неправильное, однообразное питание приводит к тому, что ребенок не получает достаточное количество железа с пищей, а также витаминов, необходимых для его усвоения;
- заболеваниями органов пищеварительного тракта – всасывание железа происходит в кишечнике, а под действием желудочного сока трехвалентное железо переходит в двухвалентное, которое усваивается организмом, поэтому при заболеваниях органов желудочно-кишечного тракта нарушаются данные процессы, что приводит к дефициту железа, а впоследствии и истощению его запасов.
Признаками недостатка железа и низкого ферритина у детей являются:
- бледные кожные покровы;
- ломкость ногтей;
- выпадение волос;
- вялость, сонливость;
- плаксивость, раздражительность;
- нарушение сна;
- головная боль, головокружение;
- диспепсические явления – тошнота, рвота, запор, понос;
- снижение иммунитета — частые простуды, кишечные инфекции.
Для детей дефицит железа является опасным состоянием, так как это может привести к задержке умственного и физического развития. При первых появлениях симптомов либо при наличии факторов, способных вызвать дефицит железа в организме ребенка, необходимо обратиться к лечащему врачу и сдать необходимые анализы. При диагностике дефицита железа необходимо пройти курс лечения железосодержащими препаратами (сорбифер, гематоген). Важно соблюдать правильное питание и принимать в пищу продукты, богатые железом (мясо, бобовые, какао, сухофрукты), витамином С (шиповник, брюссельская капуста, шпинат, брокколи, киви), витамином В12 (морепродукты).
Какие последствия низкого уровня ферритина в крови?
Последствиями низкого уровня ферритина в крови являются:
- кислородное голодание тканей и органов (особенно страдает сердце и головной мозг);
- снижение иммунитета (риск кишечных инфекций и острых респираторных заболеваний повышается в 1,5 – 2 раза);
- снижение работоспособности, способности к обучению, что сказывается на качестве работы и обучения;
- задержка умственного и физического развития детей;
- у беременных повышается риск выкидыша, мертворождения, преждевременных родов, различных патологий у плода;
- появление различных кожных заболеваний (дерматитов, экзем);
- постоянная усталость, вялость, раздражительность, плаксивость, что приводит к ухудшению качества жизни.
Для организма одинаково негативно как снижение, так и увеличение концентрации железа. При увеличении концентрации железа повышается и уровень ферритина в крови. Железо накапливается чаще в сердечной мышце, печени и поджелудочной железе.
Последствиями высокого уровня ферритина в крови, вызванного избытком железа, являются:
- развитие онкологических заболеваний;
- сахарный диабет (повышение уровня сахара в крови в результате абсолютной или относительной недостаточности инсулина);
- цирроз печени (замещение здоровой ткани печени на соединительную ткань);
- гепатит (воспалительный процесс в печени);
- заболевания суставов (артрит);
- заболевания сердечно-сосудистой системы (ишемическая болезнь сердца, аритмии, инфаркт миокарда, сердечная недостаточность, внезапная остановка сердца).
Чем отличается железо и трансферрин от ферритина?
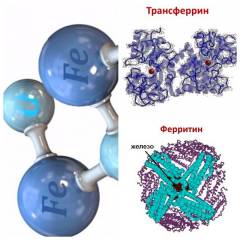
Железо попадает в организм с продуктами питания. В свободном виде железо очень токсично, поэтому оно находится только в связанном состоянии с трансферрином или ферритином. При попадании железа в организм оно всасывается в верхних отделах кишечника. Далее часть железа депонируется в виде ферритина, часть транспортируется ко всем клеткам организма в составе трансферрина, а остальная часть выводится из организма. Для того чтобы определить уровень железа в крови, назначают анализ на сывороточное железо. Сыворотка крови представляет собой плазму (жидкую часть крови с растворенными в ней органическими и минеральными элементами и не содержащую форменные элементы – эритроциты, лейкоциты и другие), лишенную фибриногена (белка, участвующего в свертывании крови). Так как железо в сыворотке крови находится в составе трансферрина, то для определения его концентрации путем химических реакций данный микроэлемент выделяют из белка-переносчика.
Трансферрин является белком-переносчиком железа в организме. Он на одну треть насыщен железом. Трансферрин осуществляет доставку железа ко всем органам и тканям организма, а также захватывает железо, высвободившееся при разрушении клеток. В группу белков-переносчиков железа (трансферринов) входят также лактоферрин и мобилферрин. Лактоферрин содержится в секреторных жидкостях организма – слюне, слезах, молозиве, грудном молоке. Мобилферрин обеспечивает внутриклеточный транспорт железа.
Ферритин является белком, ответственным за депонирование железа в организме. Только небольшая часть железа, поступающего с пищей, усваивается организмом. Железо выполняет жизненно важные функции – участвует в транспортировке кислорода в организме, синтезе новых клеток и гормонов, дезинтоксикации организма, обеспечении клеток энергией и многих других. Поэтому для поддержания функции органов и систем для нормальной жизнедеятельности железо должно быть в достаточном количестве. Для того чтобы избежать его дефицит при больших кровопотерях, строгой диете с низким содержанием железа, повышенном расходе железа (при беременности, кормлении грудью), организм запасает избыток железа в виде ферритина в печени, селезенке, костном мозге и других органах. При недостатке этого микроэлемента организм получает его из своих запасов – ферритина. При поступлении железа с пищей пополняются его запасы. В случае если дефицит микроэлемента не восполняется извне, то его запасы в виде ферритина тоже истощаются. Это приводит к тяжелым последствиям, вплоть до летального исхода.
Ферритин и Трансферрин: железодефицит и показатели биохимии крови — видео
Железо – в списке самых востребованных минералов. Оно берет участие в транспортировке кислорода, образовании кровяных телец и гемоглобина, формировании уровня энергии и других жизненно важных биохимических процессах в организме. При нехватке железа развиваются такие опасные патологии, как микроцитарная анемия, синдром беспокойных ног, частые мышечные и головные боли неизвестной этиологии, ухудшение мозговой деятельности.
Содержание
- Ферритин – что это такое?
- Что показывает Ферритин?
- Почему может быть низкий ферритин?
- Низкий ферритин – что это значит у женщин?
- Как правильно подготовиться к анализу?
- Высокий ферритин – это плохо?
- Диагностика анемии
- Как повысить ферритин?
Но железо в чистом виде является токсичным для нас. Транспорт и хранение этого минерала должно происходить в связанной форме. И отвечают за этот процесс специфические белки.
Ферритин – что это такое?
Не что иное, как депо железа в организме. Ферритин – это безопасный метод хранения минерала. Пока ионы железа пребывают в связанном виде, они не провоцируют хроническую интоксикацию. И организм свободно может брать аккумулированное железо в случаях, когда минерал поступает извне в сниженном количестве.
Что означает ферритин с точки зрения биохимии? Это комплекс, в состав которого входит фосфат железа и молекулы белка.
У ферритина есть ровно две важные функции:
- складировать железо;
- защищать клетки от его токсического воздействия.
Что показывает Ферритин?
Организм человека нуждается в ежедневном использовании железа. Но сам не способен синтезировать этот элемент, поэтому требуется постоянное поступление ценного вещества извне. Депонирование железа – это важнейший процесс, который длится всю жизнь. Ведь с возрастом ухудшается способность к ферментации и уровень усвоения железа из пищи резко падает. Поэтому, чем выше ферритин, тем больше шансов не пострадать от железодефицита.
Уровень ферритина определяет, как много железа находится в организме в виде запаса. Контрольный анализ на ферритин важен независимо от наличия или отсутствия жалоб у пациента. Это базовый показатель, который должен входить в список ежегодного чекапа. Наблюдая постоянную тенденцию к снижению ферритина, можно заблаговременно спрогнозировать железодефицитную анемию и избежать развития патологии.
Чем старше человек, тем большее значение для здоровья и профилактики заболеваний имеет анализ на уровень ферритина. Важная статистика об усвоении железа:
- дети в возрасте до 1 года усваивают до 75% железа из пищи;
- в возрасте 10 лет ребенок уже усваивает не более 25% железа;
- люди старше 35 лет способны извлечь максимум 10% минерала из еды.
Почему может быть низкий ферритин?
Уровень ферритина в организме напрямую зависит от количества получаемого железа извне. Но важен не только факт присутствия железосодержащих продуктов в ежедневном меню, но и способность организма усваивать этот элемент. При любых воспалительных процессах в ЖКТ биодоступность железа падает. А значит – организм не сможет откладывать его в депо. Железа будет так мало, что придется использовать запасы и постепенно уменьшать ферритин.
Главные причины низкого ферритина:
- рацион, бедный на продукты с гемовым железом (например, вегетарианство и веганство);
- плохое состояние зубов, вследствие чего пища некачественно пережевывается и происходит лишь ее частичное переваривание;
- низкая кислотность желудка;
- недостаточность пищевых ферментов;
- запущенные хронические заболевания;
- чрезмерное курение;
- частые кровопотери.
Низкий ферритин – что это значит у женщин?
Женский организм нуждается в гораздо большем потреблении железа, чем мужской. И это связано с природным менструальным циклом. Ежемесячная потеря крови существенно снижает уровень железа в организме. И если минерал не поступает в достаточном количестве с едой или биодобавками, то расходуется ферритин. В группу риска также попадают беременные женщины, у которых организм должен обеспечить двойную циркуляцию крови. Большие объемы железа нужны для образования новых кровяных телец и поддержания физического, умственного развития плода.
По статистике, женщины в возрасте 25-40 лет чаще всего прибегают к экспериментам в питании. Придерживаясь разнообразных монодиет с целью коррекции веса, они лишает свою пищу нутритивной ценности. Продукты лишены базовых минералов и витаминов, включая железо. Железо и ферритин – в чем проверяются? С целью профилактики железодефицита или лечения при появлении характерной симптоматики, назначается проверка уровня ферритина. Это разновидность биохимического анализа крови. Для диагностики делают забор венозной крови и определяют суммарное присутствие железа (мкг) в 1 л плазмы.
На какие референтные значения нормы нужно ориентироваться:
- новорожденные и дети до 8-недельного возраста – от 20 до 600 мкг/л;
- пациенты с 2 месяцев до полугода – в пределах 50-200 мкг/л;
- с 6 месяцев до 12 месяцев – в норме 70-140 мкг/л;
- для девочек с 12 лет и женщин до менопаузы – в пределах 22-180 мкг/л;
- для мужчин и мальчиков-подростков – в пределах 30-310 мкг/л.
Референтные значения на 5-10% могут отличаться в зависимости от лаборатории. Ориентироваться нужно именно на данные медучреждения, в котором проводилось исследование. Для беременных показатели ферритина определяются иными нормами. Ведь по мере роста плода уровень депонированного железа стремительно падает – это и является причиной массовой анемии среди беременных.
На какие показатели ориентироваться:
- в период I триместра ферритин должен составлять 90-100 мкг/л;
- во II триместре его показатель падает до 75 мкг/л;
- в III триместре для беременных характерный показатель нормы всего в пределах 15 мкг/л.
Как правильно подготовиться к анализу?
На любые биохимические анализы крови влияют физиопроцедуры. Также нельзя проверять ферритин в течение 3 суток после УЗИ, рентгенодиагностики и флюорографии. С момента последнего приема еды до посещения лаборатории должно пройти 8-12 часов. Сдавать анализы оптимально утром натощак. Пить воду можно, но нельзя чай, кофе, соки. Ужин накануне не должен содержать высокожировые продукты.
За 1 день до сдачи анализов нужно отказаться от спортивных тренировок. И исключить прием алкогольных напитков. Непосредственно перед забором крови нельзя курить.
Высокий ферритин – это плохо?
Любые отклонения от нормы свидетельствуют о патологиях. Если ферритина в крови больше, чем 400 мкг/л, врачи констатируют факт чрезмерной нагрузки железом. Зачастую она связана с серьезными заболеваниями печени и онкопроцессами.
В каких случаях повышается ферритин:
- острая почечная недостаточность;
- легочная карцинома;
- злокачественные образования в простате;
- болезнь Ходжкина;
- печеночные метастазы.
Диагностика анемии
У пациентов часто возникает вопрос: что лучше проверить – ферритин или гемоглобин? На самом деле эти показатели нельзя разделять. Более информативным является анализ на уровень ферритина. Если он низкий, то это гарантировано демонстрирует анемию и указывает на ее конкретный вид – микроцитарный (железодефицитный). В то время как гемоглобин в паре с показателем эритроцитов лишь указывают на возможные патологические изменения в организме. Они свидетельствуют о гипоксии и анемии, но не дают детализированного ответа.
Поэтому для определения малокровия ферритин важнее гемоглобина. Но для адекватной оценки состояния пациента врач должен назначить целый перечень анализов и оценить показатели комплексно. Значения ферритина помогут определить, какая степень анемии, как долго нужно заниматься восстановлением дефицитов.
Важно понимать, что гемоглобин у пациента может быть в норме, а ферритин уже понижен. И это главный сигнал, свидетельствующий о развитии анемии в будущем. Учитывая, что 70-80% случаев малокровия приходится именно на железодефицитную анемию, то проверка ферритина – обязательный и важнейший анализ. Один лишь показатель гемоглобина не даст точной картины и не является причиной для назначения терапии.
Как повысить ферритин?
Первый шаг – это коррекция привычного рациона питания. Требуется введение продуктов, содержащие гемовое железо, которое хорошо усваивается нашим организмом. К этому списку относятся печень, морепродукты, рыба, красное мясо, органические фермерские или домашние яйца. Дополнительными источниками растительного железа считаются гречиха, бобовые, орехи, сухофрукты.
Второй важный момент – работа с кислотностью желудка и пищеварительными ферментами. Врач-гастроэнтеролог проводит лечение, направленное на улучшение моторики и процесса пищеварения. Это позволит повысить уровень усвоения ценных элементов из пищи, включая железо. Также обязательным моментом в процессе восполнения дефицита является прием препаратов.
Рекомендованные безрецептурные лекарства для повышения ферритина:
- двухвалентные формы (“Фенюльс”, “Омнифер”);
- трехвалентные формы (“Витаферр”, “Компливит Железо”);
- витаминно-минеральные комплексы (“СидерАЛ Форте”, “Орихиро железо”).
Имеются противопоказания. Необходима консультация специалиста.
Двухвалентные препараты более концентрированные. В них железо представлено в той готовой форме, которая необходима для синтеза гемоглобина. Из-за высокой концентрации у пациентов часто наблюдаются побочные эффекты в виде тошноты, диареи. Такой симптоматики нет при приеме трехвалентных форм. Это значит, что к железу присоединена аминокислота. То есть железо в связанной форме, поэтому легко переносится организмом. Но такие препараты нужно пить гораздо дольше – в течение нескольких месяцев.
Если стоит вопрос об экстренном восполнении дефицитов, например, после сильного кровотечения, то пациентам рекомендуются инъекционные формы препаратов с железом. Та группа людей, которая плохо переносит прием железа перорально, может использовать трансдермальные пластыри. Железо проникает в кровоток через кожный покров, минуя ЖКТ. И побочные эффекты в таком случае также минимальны.
Источники
- ПотеминаТ.Е., Волкова С. А., КузнецоваС.В., ПерешеинА.В. // Общие вопросы метаболизма железа и патогенеза железодефи-цитной анемии. // Вестник медицинского института «Реавиз». Реабилитация, Врач и Здоровье — 2020;
- Шамов И.А., Гасанова П.О. // Железо, абсорбция, транспорт. Вестник гематологии — 2016.
Информация представлена в ознакомительных целях и не является медицинской консультацией или руководством к лечению со стороны uteka.ru.
Ферритин — это белок, присутствующий во всех клетках организма. В основном он содержится в печени, костном мозге и селезенке. Его наиболее важной функцией является надежное связывание атомов железа. Он также сохраняет железо в организме и защищает клетки от вредного воздействия этого элемента. Чтобы определить концентрацию этого белка в организме, необходимо сдать анализы сыворотки крови. Его концентрация увеличивается при воспалениях и инфекциях (например, при гепатитах В и С).
Анализы, которые можно сдать в нашей лаборатории:
-
1 к. д.
код: A09.05.076.010
Ферритин и железо
70% железа, всасываемого желудочно-кишечным трактом, переносится в костный мозг и включается в состав гемоглобина – белка, отвечающего за транспорт кислорода в организме. Остальная часть (около 30%) запасается в белковых комплексах, таких как вышеупомянутый ферритин и трансферрин.
Что означает ферритин в анализе крови?
Когда количество поставляемого железа ниже, чем потребность в этом питательном веществе, организм «берет» железо из запасенных ресурсов. Затем концентрация ферритина в крови падает. Такая ситуация может иметь место в результате:
- дефицита железа в рационе;
- нарушения всасывания;
- повышенной потребности (например, во время беременности);
- потери большого количества крови.
И наоборот, когда количество поглощаемого железа превышает потребности организма, уровень ферритина увеличивается. Затем в тканях образуются отложения, способные вызвать поражение органов. Это то, что происходит, среди прочего при гемохроматозе. Это генетически детерминированное заболевание, при котором, несмотря на нормальный уровень железа в рационе, происходит избыточное всасывание этого элемента из пищи.
Некоторые люди испытывают так называемое скрытый дефицит этого вещества. Это состояние, при котором железо есть в организме только для его текущих потребностей и запасов этого элемента нет. Единственный способ выявить такую проблему, – это определение уровня ферритина с помощью лабораторного теста.
Низкий уровень ферритина может быть следствием несбалансированной диеты (например, для похудения), которая не обеспечивает организм необходимым количеством питательных веществ. Кроме того, люди с повышенным риском дефицита ферритина:
- Принимают лекарства, относящиеся к ингибиторам протонной помпы (ИПП). В результате их применения снижается кислотность желудочного сока, что снижает всасывание железа.
- Страдают заболеваниями, препятствующими всасыванию железа, например, болезнь Крона.
- Теряют большое количество крови (в результате травм, обильных месячных).
Почему стоит сдать анализ на ферритин?
Это позволяет выявить нарушения всасывания железа и проверить, сколько этого элемента содержится в организме. Результат исследования играет важную роль в диагностике и дифференцировке анемии. Он также позволяет контролировать эффективность лечения.
В то время как дефицит ферритина обычно связан со слишком низким уровнем железа, его избыток может свидетельствовать о различных заболеваниях. Повышенный уровень ферритина появляется при воспалениях различного происхождения, включая проблемы с печенью (повреждение клеток, некроз), повреждение селезенки, клеток костного мозга и ревматоидный артрит.
Как подготовиться к анализу на ферритин?
Определение ферритина проводят на основании образца венозной крови. Как и в случае с другими анализами крови, его следует проводить натощак, желательно утром.
Нормы ферритина различаются в зависимости от пола и составляют:
- для мужчин: 22 – 322 нг/мл;
- для женщин: 10 – 291 нг/мл.
Дефицит ферритина вызывает ряд неприятных недомоганий, в том числе:
- хроническую усталость, сонливость;
- нарушение концентрации;
- ослабление иммунитета, подверженность инфекциям;
- выпадение волос, ломкость ногтей;
- сухость кожи;
- кровоточивость десен.
У нас вы можете сделать все необходимые анализы в комфортных условиях. Мы также делаем высокоточный тест на коронавирус.
Определение
Ферритины представляют собой суперсемейство сфеических , внутриклеточных белков окисления, хранения, минерализации железа и трансфере в макрофагах. Несмотря на то, что различные члены суперсемейства имеют общую структуру, между ними часто мало идентичности аминокислотной последовательности. Даже при высокой степени идентичности последовательности между двумя ферритинами могут быть большие различия в том, как белки взаимодействуют с железом.
История
В 1937 году V. Laufberg впервые выделил ферритин из селезенки лошади, а позже этот белок был также обнаружен у людей, животных, растений, грибов и бактерий (Theil E., 1987). Название ферритин, происходит от латинского ferratus (означающего снабженный, покрытый или «обутый железом») предложил V. Laufberg , который кристаллизовал богатый железом белок. За более чем 80 лет, прошедших с тех пор, как был описан ферритин, большинство химиков, столкнувшихся с ним впервые, должно было поразиться тому факту, что целых 24 % белка по весу — это Fe 3+ и, тем не менее, он хорошо растворим в воде при pH 7. Для многих исследователей это главная особенность ферритинов, и это наблюдение, вероятно, объясняет описание ферритина как белка-запаса железа.
Структура ферритина
Аминокислотная последовательность ферритина разных видов сильно различается, в то время как структура белка остается неизменной. Представляет интерес тот факт, что 24 субъединицы ферритина самостоятельно собраны в сферическую белковую клетку с внутренним и внешним диаметром 8 и 12 нм соответственно. Белковая клетка ферритина инкапсулирует в свою полость до 4500 атомов Fe 3+ в виде железного ядра. Железное ядро ферритина состоит из комплекса железа-оксигидроксид-фосфата. Обычно фосфат, содержащийся в комплексе, растворяется, когда его выделяют из белковой клетки с помощью нагревания или обработки денатурирующими веществами, а оставшийся продукт представляет собой ферригидрит, 5Fe 2 O 3 ·9H 2 O. После удаления минерального ядра, находящегося в полости, мы можем получить белковую оболочку ферритина, называемую апоферритином.
Является ли основная функция всех ферритинов запасанием железа? Исследователи предоставили впечатляюще длинные списки физиологических функций в дополнение к переносу и хранению железа. Однако большинство дополнительных функций, которые они перечисляют, можно свести к химическому свойству антиоксиданта (Arosio P., et.al., 2015). Действительно, ясно, что гены, кодирующие некоторые прокариотические ферритины, индуцируются только в условиях окислительного стресса.
Несмотря на то, что потребовались десятилетия, чтобы прийти к выводу, что ферритин — это больше, чем показатель уровня запасов железа, потребовался короткий период времени во время пандемии COVID-19, чтобы задаться вопросом, в чем причина высоких уровней ферритина у пациентов с тяжелой формой этой вирусной инфекции. Первоначально было описано, что ферритин сопровождает различные острые инфекции, как вирусные, так и бактериальные, что указывает на острую реакцию на воспаление. Однако, с введением понятия «гиперферритинемического синдрома», объединяющего четыре тяжелых патологических состояния, таких как болезнь Стилла у взрослых, синдром активации макрофагов, катастрофический антифосфолипидный синдром и септический шок, добавлен еще один аспект ферритина, в котром он может играть патогенетическую роль, а не только говорить о чрезвычайном повышеннии уровня этого белка.
Диагностическое значение ферритина
Хорошо известно, что низкий уровень ферритина указывает на снижение уровня железа в организме, тогда как высокий — на нормальный или повышенный уровень железа, причем, повышение уровня ферритина предшествует снижению сывороточного железа. Следовательно, ферритин упоминается в медицинских учебниках в качестве маркера, позволяющего дифференцировать железодефицитную анемию и анемию хронических заболеваний, поскольку в последней он выше из-за воспаления и низок в первой вторично по отношению к снижению уровня железа. Позже было показано, что повышенные уровни ферритина, которые ранее были связаны с острыми или хроническими воспалительными состояниями, независимо от того, были они вызваны инфекцией или нет, играют центральную роль в патогенезе различных воспалительных и аутоиммунных заболеваний (Recalcati S., et.al., 2008). По сути, описание гиперферритинемии, синдрома Шенфельда (Shoenfield” syndrome ), как «железного меча аутоиммунитета» (Giemza-Stoklosa J., et.al., 2019) , подводит итог многолетним поискам ответа на значения ферритина при тяжелых заболеваниях.
С точки зрения гомеостаза железа как дефицит железа, так и перегрузка могут привести к пагубным последствиям, поэтому роль ферритина в балансировке концентрации железа нельзя переоценить. Патологические проявления избытка железа коррелируют с органами, в котором происходит накопление железа. Например, отложение ферритина в поджелудочной железе приводит к диабету, в гипофизе — к гипогонадизму, в коже — к гиперпигментации, а накопление в печени приводит к ее заболеванию, которое может прогрессировать до цирроза. При избыточном уровне железа железо образует токсичные свободные радикалы, которые могут напрямую повредить гепатоциты.
Ферритин , как реагент острой фазы
Реагенты острой фазы на самом деле представляют собой белки острой фазы, которые в основном продуцируются и секретируются гепатоцитами. Установлено, что цитокины играют важную роль в регуляции синтеза белков острой фазы. Интерлейкин-1β (IL-1β), фактор некроза опухоли-альфа (TNF-α) и интерлейкин-6 (IL-6) являются провоспалительными цитокинами, стимулируя таким образом выработку белков острой фазы. В свою очередь, интерлейкин-10 (IL-10) и трансформирующий фактор роста бета (TGF-β) являются примерами противовоспалительных цитокинов, подавляющих синтез белков острой фазы.
Реактанты острой фазы, синтезируемые печенью в относительно больших количествах (сверхэкспрессированные), обозначаются как «положительные» белки острой фазы (АРР) и включают Hp, SA, фибриноген, Cp, AGP, α-1-антитрипсин, лактоферрин и CRP. АРР, синтезированные на более низком уровне, называются «негативными» и включают такие белки, как альбумин, трансферрин и транстиретин. Ферритин, как положительный реагент острой фазы, присутствует в высоких концентрациях как во внутриклеточной, так и во внеклеточной среде и имеет несколько форм в зависимости от соотношения между двумя H- и L-субъединицами. Действуя как реагент острой фазы, ферритин связывает и хранит железо внутриклеточно.
Роль ферритина в гомеостазе железа в контексте воспаления имеет большое значение для защиты организма от инфекций, травм и рака. Например, реакция Фентона включает взаимодействие двухвалентного железа (Fe+2) с H2O2 с образованием гидроксильного радикала, одного из наиболее активных кислородных радикалов. Кислородные радикалы помогают нейтрофилам и макрофагам во время фагоцитоза, реагируя с клеточными компонентами фагоцитированных материалов. Во время воспалительных и инфекционных состояний вырабатывается большое количество кислородных радикалов. Впоследствии кислородные радикалы проникают в жидкости и ткани вокруг воспаления, что приводит к значительному повреждению клеток за счет реакции с клеточными компонентами. Таким образом, снижение количества доступного железа за счет повышения уровня ферритина защищает от повреждений, которые свободные радикалы могут нанести в месте воспаления.
Кроме того, последние исследования показали, что накопление железа также связано с онкогенезом, старением и прогрессированием хронических нейродегенеративных состояний, таких как болезнь Альцгеймера и Паркинсона. Повышенные уровни ферритина описаны при различных аутоиммунных заболеваниях. Считается, что механизм высокого уровня ферритина при аутоиммунных заболеваниях является вторичным по отношению к иммунной стимуляции синтеза ферритина цитокинами. Концентрации ферритина были в значительной степени связаны с метаболическим синдромом и ожирением в исследовании, проведенном среди мексиканских американских мужчин (Gillum R., et.al., 2001).
Ферритин является эволюционно консервативным белком, и было высказано предположение, что он участвует в реакции на инфекцию у различных организмов, включая рыб и морских беспозвоночных. Действительно, экспрессия белков ферритина или гомологов ферритина повышалась в различных тканях в ответ на бактериальные инфекции или стимуляцию LPS. Сегодня повышенный уровень ферритина при инфекциях рассматривается как маркер воспаления, однако, его высокие уровни на самом деле являются важным защитным механизмом хозяина из-за токсичности железа для бактерий, что приводит к ингибированию их роста.
В то время как ферритин может хранить железо и высвобождать его при снижении уровня, внутриклеточное железо является первым и основным регулирующим фактором синтеза ферритина как на уровне транскрипции, так и на уровне трансляции
Уровни ферритина повышены при многих злокачественных новообразованиях. Фактически, медицинская литература изобилует статьями, описывающими связь между уровнями ферритина и различными злокачественными новообразованиями. Например, в старых и новых исследованиях сообщалось о высоких уровнях ферритина в солидных опухолях, таких как рак молочной железы, что указывает на корреляцию с патогенезом заболеваний наряду с маркером прогноза
В 1998 году А. Piperno проанализировал заболевания, общим механизмом которых является повышенный уровень ферритина, причем, назвал эти заболевания «гиперферритинемическими состояниями». В 2013 году группа Shoenfeld et al. представили гиперферритинемию как продолжение спектра нарушений, названных «гиперферритинемическим синдромом»
Влияние старения на уровень ферритина до конца не изучено, и в нескольких исследованиях сообщаются противоречивые результаты. Сообщалось, что уровни ферритина в сыворотке в возрасте 65–70 лет в два раза выше, чем у пациентов в возрасте 45–50 лет.
Поддающийся измерению ферритин в сыворотке в значительной степени образуется из макрофагов, а низкие концентрации ферритина в сыворотке в некоторой степени отражают степень истощения запасов железа в организме.
За последние несколько лет среди неспециалистов возрос интерес к связи между низким уровнем ферритина и различными клиническими симптомами. Это подтверждается недавними исследованиями у взрослых и детей, которые обнаружили связь между низким уровнем ферритина и такими симптомами, как утомляемость, беспокойство, проблемы с поведением и когнитивные расстройства, , причем, эти симптомы в некоторой степени облегчались добавками железа. Более низкие уровни ферритина связаны с более высокими показателями гиперактивности и дефицита внимания. Низкие запасы железа могут помочь уменьшить размер хвостатого ядра и ядра скорлупы, тем самым увеличивая восприимчивость к тикам. 8,3% детей с аутизмом в возрасте от 1 до 2 лет, 14,2% детей с аутизмом в возрасте от 3 до 5 лет и 20% детей с аутизмом в возрасте от 6 до 10 лет имели уровни ферритина в сыворотке крови ниже нормы ( Dosman C., et.al., 2006).
Увеличение массы тела, связанное с рисперидоном, связано со снижением запасов железа в организме, которое, по-видимому, улучшается с потерей массы тела после прекращения приема рисперидона. Предварительные данные свидетельствуют о том, что рисперидон может также непосредственно ингибировать всасывание железа. Более того, после поправки на соответствующие факторы, включая концентрацию рисперидона и 9-гидроксирисперидона, исследователи обнаружили, что концентрация железа в организме была обратно пропорциональна концентрации пролактина (Сalarge Ch., et.al., 2015).
Всемирная организация здравоохранения (ВОЗ) в настоящее время определяет дефицит железа у взрослых как уровень ферритина ниже 15 мкг/л, а у детей в возрасте до пяти лет — при уровне ферритина ниже 12 мкг/л, если не сопутствует воспаление, и в этом случае дефицит железа может существовать, когда ферритин ниже 30 мкг/л . Считается, что перегрузка железом имеет место, когда ферритин превышает 200 мкг/л у мужчин и 150 мкг/л у женщин.
Общий анализ крови и ферритин
Эритроциты
У здоровых людей не было обнаружено статистически значимой корреляции между RBC, HB, HCT и ферритином в сыворотке крови. В то же время, высокие уровни сывороточного ферритина, обнаруженные у пациентов с болезнями Альцгеймера и Паркинсона, свидетельствуют о том, что здесь возможно изменения функции и структуры эритроцитов (Pretorius E., et.al., 2014).
В настоящее время установлено, что Fe 2+ вызывает эриптоз. Этот эффект железа может объяснить значительное нарушение деформируемости эритроцитов при гемохроматозе и гиперферритинемии (Mcnamee A., et.al., 2016).
Ферритин имеет положительную корреляцию как с уровнями СRP, так и с индексом массы тела, однако сообщалось об отрицательной связи в отношении корреляций с уровнями гемоглобина, железа и трансферрина.
Несмотря на то, что высокое значение ферритина в сыворотке крови не может исключить наличие дефицита Fe, низкое значение ферритина хорошо известно как очень специфичное для Fe. Экспериментальные исследования на крысах с дефицитом Fe показали более низкую деформируемость эритроцитов, что, по-видимому, связано, по крайней мере частично, с более низким содержанием гемоглобина в эритроцитах (Gelmini G., et.al., 1989).
Обнаружены более низкие уровни ферритина и более высокие значения MCV в группе расстройств аутистического спектра ( De Giacomo et.al., 2022).
Повышенные уровни cывороточного ферритина представляют собой обычное состояние среди пациентов с миелодиспластическими синдромами и, по-видимому, в значительной степени связаны с зависимостью от переливания эритроцитов. Однако перегрузка железом также присутствует у многих пациентов после постановки диагноза этого синдрома и до переливания эритроцитов, что в основном связано с неэффективным эритропоэзом и/или повышенной абсорбцией железа в кишечнике. Связь была более сильной и достигала статистической значимости, когда рассматривались предварительно заданные пороговые значения сывороточного ферритина 1000 нг/мл и SF 500 нг/мл. ( Pileggi C., et.al., 2017).
Лейкоциты
Нейтрофилы и лимфоциты крови, скорее всего, не способствуют повышению уровня ферритина в сыворотке. Однако, уровень ферритина в моноцитах коррелирует с уровнями этого белка в сыворотке и запасами Fe в костном мозге у некоторых, например, диализных пациентов.
Ферритин может быть полезным ранним прогностическим фактором при лекарственной сыпи и лекарственными реакциями с эозинофилией и системными симптомами (DRESS).
Резкое повышение уровня ферритина наряду с лимфопенией, снижением количества и активности NK-клеток, аномальными функциональными тестами печени и коагулопатией заставило исследователей предположить, а позже согласиться с тем, что COVID-19 может быть новейшим членом в группе гиперферритинемических синдромов. На третьей и наиболее тяжелой стадии этой инфекции ранее локализованное воспаление легких переходит в синдром системного и внелегочного гипервоспаления. В образцах крови на этой стадии наблюдается снижение количества Т-лимфоцитов и огромное увеличение воспалительных цитокинов и биомаркеров, включая ферритин. Важно отметить, что ферритин способствует дальнейшему высвобождению провоспалительных медиаторов, увеличивая воспалительную нагрузку и приводя к порочному кругу. Ферритин достигает этого путем активации NF-ԟB, что приводит к усилению транскрипции гена ферритина.
Таким образом , ферритин является ключевым медиатором иммунной дисрегуляции, особенно при крайней гиперферритинемии, благодаря его иммуносупрессивному и провоспалительному действию, которое способствует цитокиновым штормам (Abbaspour et al., 2014). Железо оказывает разрушительное действие из-за воспаления и ферроптоза, что запускает выработку ферритина для связывания со свободным железом в качестве защитного механизма для уменьшения повреждения тканей.
Тромбоциты
PLT увеличивается, когда MPV , железо и ферритин уменьшаются, однако, нет корреляции двух последних показателей с PCT.
Комплексные показатели
Ферритин и NLR являются биомаркерами, используемыми для оценки тяжести заболевания и смертности при многих заболеваниях, и недавно сообщалось, что они являются воспалительными маркерами для оценки риска у пациентов с COVID-19 (Imran et al., 2020).
Категория сообщения в блог:


