From Wikipedia, the free encyclopedia
This article is about a molecule of one nitrogen atom and one oxygen atom. For other chemical combinations of nitrogen and oxygen, see nitrogen oxide. For the use of nitric oxide as a medication or in biology, see Biological functions of nitric oxide.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Nitrogen monoxide[1] |
||
| Systematic IUPAC name
Oxidonitrogen(•)[2] (additive) |
||
| Other names
Nitrogen oxide |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.030.233 |
|
| EC Number |
|
|
|
Gmelin Reference |
451 | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1660 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NO | |
| Molar mass | 30.006 g·mol−1 | |
| Appearance | Colourless gas | |
| Density | 1.3402 g/L | |
| Melting point | −164 °C (−263 °F; 109 K) | |
| Boiling point | −152 °C (−242 °F; 121 K) | |
|
Solubility in water |
0.0098 g / 100 ml (0 °C) 0.0056 g / 100 ml (20 °C) |
|
|
Refractive index (nD) |
1.0002697 | |
| Structure | ||
|
Molecular shape |
linear (point group C∞v) | |
| Thermochemistry | ||
|
Std molar |
210.76 J/(K·mol) | |
|
Std enthalpy of |
90.29 kJ/mol | |
| Pharmacology | ||
|
ATC code |
R07AX01 (WHO) | |
| License data |
|
|
|
Routes of |
Inhalation | |
| Pharmacokinetics: | ||
|
Bioavailability |
good | |
|
Metabolism |
via pulmonary capillary bed | |
|
Biological half-life |
2–6 seconds | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
[4] |
|
| GHS labelling: | ||
|
Pictograms |
    [3][4] [3][4]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H270, H280, H314, H330[3][4] | |
|
Precautionary statements |
P220, P244, P260, P280, P303+P361+P353+P315, P304+P340+P315, P305+P351+P338+P315, P370+P376, P403, P405[3][4] | |
| NFPA 704 (fire diamond) |
3 0 3 OX |
|
| Lethal dose or concentration (LD, LC): | ||
|
LC50 (median concentration) |
315 ppm (rabbit, 15 min) 854 ppm (rat, 4 h) 2500 ppm (mouse, 12 min)[5] |
|
|
LCLo (lowest published) |
320 ppm (mouse)[5] | |
| Safety data sheet (SDS) | External SDS | |
| Related compounds | ||
|
Related nitrogen oxides |
Dinitrogen pentoxide
Dinitrogen tetroxide |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
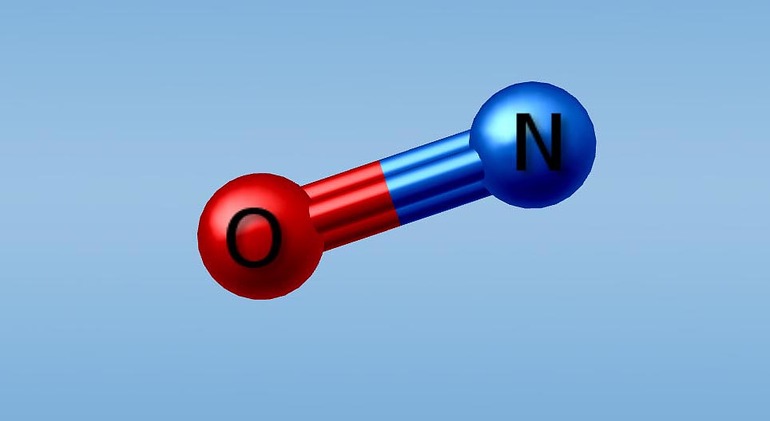
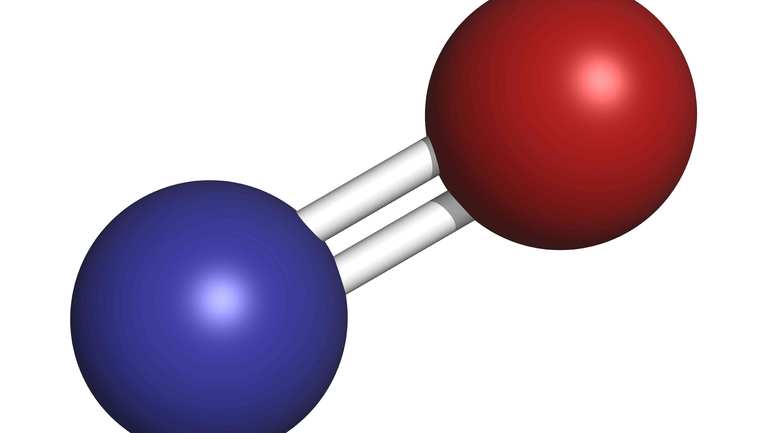
Nitric oxide (nitrogen oxide or nitrogen monoxide[1]) is a colorless gas with the formula NO. It is one of the principal oxides of nitrogen. Nitric oxide is a free radical: it has an unpaired electron, which is sometimes denoted by a dot in its chemical formula (•N=O or •NO). Nitric oxide is also a heteronuclear diatomic molecule, a class of molecules whose study spawned early modern theories of chemical bonding.[6]
An important intermediate in industrial chemistry, nitric oxide forms in combustion systems and can be generated by lightning in thunderstorms. In mammals, including humans, nitric oxide is a signaling molecule in many physiological and pathological processes.[7] It was proclaimed the «Molecule of the Year» in 1992.[8] The 1998 Nobel Prize in Physiology or Medicine was awarded for discovering nitric oxide’s role as a cardiovascular signalling molecule.[9]
Nitric oxide should not be confused with nitrogen dioxide (NO2), a brown gas and major air pollutant, or with nitrous oxide (N2O), an anesthetic gas.[6]
Reactions[edit]
With di- and triatomic molecules[edit]
Upon condensing to a liquid, nitric oxide dimerizes to dinitrogen dioxide, but the association is weak and reversible. The N–N distance in crystalline NO is 218 pm, nearly twice the N–O distance.[6]
Since the heat of formation of •NO is endothermic, NO can be decomposed to the elements. Catalytic converters in cars exploit this reaction:
- 2 NO → O2 + N2
When exposed to oxygen, nitric oxide converts into nitrogen dioxide:
- 2 NO + O2 → 2 NO2
This reaction is thought to occur via the intermediates ONOO• and the red compound ONOONO.[10]
In water, nitric oxide reacts with oxygen to form nitrous acid (HNO2). The reaction is thought to proceed via the following stoichiometry:
- 4 NO + O2 + 2 H2O → 4 HNO2
Nitric oxide reacts with fluorine, chlorine, and bromine to form the nitrosyl halides, such as nitrosyl chloride:
- 2 NO + Cl2 → 2 NOCl
With NO2, also a radical, NO combines to form the intensely blue dinitrogen trioxide:[6]
- NO + NO2 ⇌ ON−NO2
Organic chemistry[edit]
The addition of a nitric oxide moiety to another molecule is often referred to as nitrosylation. The Traube reaction[11] is the addition of a two equivalents of nitric oxide onto an enolate, giving a diazeniumdiolate (also called a nitrosohydroxylamine).[12] The product can undergo a subsequent retro-aldol reaction, giving an overall process similar to the haloform reaction. For example, nitric oxide reacts with acetone and an alkoxide to form a diazeniumdiolate on each α position, with subsequent loss of methyl acetate as a by-product:[13]
This reaction, which was discovered around 1898, remains of interest in nitric oxide prodrug research. Nitric oxide can also react directly with sodium methoxide, ultimately forming sodium formate and nitrous oxide by way of an N-methoxydiazeniumdiolate.[14]
Coordination complexes[edit]
Nitric oxide reacts with transition metals to give complexes called metal nitrosyls. The most common bonding mode of nitric oxide is the terminal linear type (M−NO).[6] Alternatively, nitric oxide can serve as a one-electron pseudohalide. In such complexes, the M−N−O group is characterized by an angle between 120° and 140°. The NO group can also bridge between metal centers through the nitrogen atom in a variety of geometries.
Production and preparation[edit]
In commercial settings, nitric oxide is produced by the oxidation of ammonia at 750–900 °C (normally at 850 °C) with platinum as catalyst in the Ostwald process:
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
The uncatalyzed endothermic reaction of oxygen (O2) and nitrogen (N2), which is effected at high temperature (>2000 °C) by lightning has not been developed into a practical commercial synthesis (see Birkeland–Eyde process):
- N2 + O2 → 2 NO
Laboratory methods[edit]
In the laboratory, nitric oxide is conveniently generated by reduction of dilute nitric acid with copper:
- 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO
An alternative route involves the reduction of nitrous acid in the form of sodium nitrite or potassium nitrite:
- 2 NaNO2 + 2 NaI + 2 H2SO4 → I2 + 2 Na2SO4 + 2 H2O + 2 NO
- 2 NaNO2 + 2 FeSO4 + 3 H2SO4 → Fe2(SO4)3 + 2 NaHSO4 + 2 H2O + 2 NO
- 3 KNO2 + KNO3 + Cr2O3 → 2 K2CrO4 + 4 NO
The iron(II) sulfate route is simple and has been used in undergraduate laboratory experiments. So-called NONOate compounds are also used for nitric oxide generation.
Detection and assay[edit]
Nitric oxide (white) in conifer cells, visualized using DAF-2 DA (diaminofluorescein diacetate)
Nitric oxide concentration can be determined using a chemiluminescent reaction involving ozone.[15] A sample containing nitric oxide is mixed with a large quantity of ozone. The nitric oxide reacts with the ozone to produce oxygen and nitrogen dioxide, accompanied with emission of light (chemiluminescence):
- NO + O3 → NO2 + O2 + hν
which can be measured with a photodetector. The amount of light produced is proportional to the amount of nitric oxide in the sample.
Other methods of testing include electroanalysis (amperometric approach), where ·NO reacts with an electrode to induce a current or voltage change. The detection of NO radicals in biological tissues is particularly difficult due to the short lifetime and concentration of these radicals in tissues. One of the few practical methods is spin trapping of nitric oxide with iron-dithiocarbamate complexes and subsequent detection of the mono-nitrosyl-iron complex with electron paramagnetic resonance (EPR).[16][17]
A group of fluorescent dye indicators that are also available in acetylated form for intracellular measurements exist. The most common compound is 4,5-diaminofluorescein (DAF-2).[18]
Environmental effects[edit]
Main article: NOx
Acid rain deposition[edit]
Nitric oxide reacts with the hydroperoxyl radical (HO•
2) to form nitrogen dioxide (NO2), which then can react with a hydroxyl radical (•OH) to produce nitric acid (HNO3):
- •NO + HO•
2 → •NO2 + •OH - •NO2 + •OH → HNO3
Nitric acid, along with sulfuric acid, contributes to acid rain deposition.
Ozone depletion[edit]
•NO participates in ozone layer depletion. Nitric oxide reacts with stratospheric ozone to form O2 and nitrogen dioxide:
- •NO + O3 → NO2 + O2
This reaction is also utilized to measure concentrations of •NO in control volumes.
Precursor to NO2[edit]
As seen in the acid deposition section, nitric oxide can transform into nitrogen dioxide (this can happen with the hydroperoxy radical, HO•
2, or diatomic oxygen, O2). Symptoms of short-term nitrogen dioxide exposure include nausea, dyspnea and headache. Long-term effects could include impaired immune and respiratory function.[19]
Biological functions[edit]
NO is a gaseous signaling molecule.[20] It is a key vertebrate biological messenger, playing a role in a variety of biological processes.[21] It is a bioproduct in almost all types of organisms, including bacteria, plants, fungi, and animal cells.[22]
Nitric oxide, an endothelium-derived relaxing factor (EDRF), is biosynthesized endogenously from L-arginine, oxygen, and NADPH by various nitric oxide synthase (NOS) enzymes.[23] Reduction of inorganic nitrate may also make nitric oxide.[24] One of the main enzymatic targets of nitric oxide is guanylyl cyclase.[25] The binding of nitric oxide to the heme region of the enzyme leads to activation, in the presence of iron.[25] Nitric oxide is highly reactive (having a lifetime of a few seconds), yet diffuses freely across membranes. These attributes make nitric oxide ideal for a transient paracrine (between adjacent cells) and autocrine (within a single cell) signaling molecule.[24] Once nitric oxide is converted to nitrates and nitrites by oxygen and water, cell signaling is deactivated.[25]
The endothelium (inner lining) of blood vessels uses nitric oxide to signal the surrounding smooth muscle to relax, resulting in vasodilation and increasing blood flow.[24] Sildenafil (Viagra) is a drug that uses the nitric oxide pathway. Sildenafil does not produce nitric oxide, but enhances the signals that are downstream of the nitric oxide pathway by protecting cyclic guanosine monophosphate (cGMP) from degradation by cGMP-specific phosphodiesterase type 5 (PDE5) in the corpus cavernosum, allowing for the signal to be enhanced, and thus vasodilation.[23] Another endogenous gaseous transmitter, hydrogen sulfide (H2S) works with NO to induce vasodilation and angiogenesis in a cooperative manner.[26][27]
Nasal breathing produces nitric oxide within the body, while oral breathing does not.[28][29]
Occupational safety and health[edit]
In the U.S., the Occupational Safety and Health Administration (OSHA) has set the legal limit (permissible exposure limit) for nitric oxide exposure in the workplace as 25 ppm (30 mg/m3) over an 8-hour workday. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 25 ppm (30 mg/m3) over an 8-hour workday. At levels of 100 ppm, nitric oxide is immediately dangerous to life and health.[30]
Explosion hazard[edit]
Liquid nitrogen oxide is very sensitive to detonation even in the absence of fuel, and can be initiated as readily as nitroglycerin. Detonation of the endothermic liquid oxide close to its b.p. (-152°C) generated a 100 kbar pulse and fragmented the test equipment. It is the simplest molecule that is capable of detonation in all three phases. The liquid oxide is sensitive and may explode during distillation, and this has been the cause of industrial accidents.[31] Gaseous nitric oxide detonates at about 2300 m/s, but as a solid it can reach a detonation velocity of 6100 m/s.[32]
References[edit]
Notes
- ^ a b Nomenclature of Inorganic Chemistry, IUPAC Recommendations (PDF). International Union of Pure and Applied Chemistry. 2005. p. 69.
- ^ «Nitric Oxide (CHEBI:16480)». Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute.
- ^ a b c «Nitrogen monoxide — Registration Dossier — ECHA». Retrieved 2020-11-02.
- ^ a b c d «Safety Data Sheet — Nitric Oxide, compressed — Registration Dossier» (PDF). Retrieved 2020-11-02.
- ^ a b «Nitric oxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Hou, Y. C.; Janczuk, A.; Wang, P. G. (1999). «Current trends in the development of nitric oxide donors». Current Pharmaceutical Design. 5 (6): 417–441. doi:10.2174/138161280506230110111042. PMID 10390607.
- ^ Culotta, Elizabeth; Koshland, Daniel E. Jr. (1992). «NO news is good news». Science. 258 (5090): 1862–1864. Bibcode:1992Sci…258.1862C. doi:10.1126/science.1361684. PMID 1361684.
- ^ «The Nobel Prize in Physiology or Medicine 1998». NobelPrize.org. Retrieved 2022-06-17.
- ^ Galliker, Benedikt; et al. (2009). «Intermediates in the Autoxidation of Nitrogen Monoxide». Chemistry — A European Journal. 15 (25): 6161–6168. doi:10.1002/chem.200801819. ISSN 0947-6539. PMID 19437472.
- ^
- ^ Arulsamy, Navamoney; Bohle, D. Scott (2006). «Synthesis of Diazeniumdiolates from the Reactions of Nitric Oxide with Enolates». J. Org. Chem. 71 (2): 572–581. doi:10.1021/jo051998p. PMID 16408967.
- ^ Traube, Wilhelm (1898). «Ueber Synthesen stickstoffhaltiger Verbindungen mit Hülfe des Stickoxyds». Justus Liebig’s Annalen der Chemie (in German). 300: 81–128. doi:10.1002/jlac.18983000108.
- ^ Derosa, Frank; Keefer, Larry K.; Hrabie, Joseph A. (2008). «Nitric Oxide Reacts with Methoxide». The Journal of Organic Chemistry. 73 (3): 1139–1142. doi:10.1021/jo7020423. PMID 18184006.
- ^ Fontijn, Arthur; Sabadell, Alberto J.; Ronco, Richard J. (1970). «Homogeneous chemiluminescent measurement of nitric oxide with ozone. Implications for continuous selective monitoring of gaseous air pollutants». Analytical Chemistry. 42 (6): 575–579. doi:10.1021/ac60288a034.
- ^ Vanin, A; Huisman, A; Van Faassen, E (2002). Iron dithiocarbamate as spin trap for nitric oxide detection: Pitfalls and successes. Methods in Enzymology. Vol. 359. pp. 27–42. doi:10.1016/S0076-6879(02)59169-2. ISBN 9780121822620. PMID 12481557.
- ^ Nagano, T; Yoshimura, T (2002). «Bioimaging of nitric oxide». Chemical Reviews. 102 (4): 1235–1270. doi:10.1021/cr010152s. PMID 11942795.
- ^ Kojima H, Nakatsubo N, Kikuchi K, Kawahara S, Kirino Y, Nagoshi H, Hirata Y, Nagano T (1998). «Detection and imaging of nitric oxide with novel fluorescent indicators: diaminofluoresceins». Anal. Chem. 70 (13): 2446–2453. doi:10.1021/ac9801723. PMID 9666719.
- ^ «Centers for Disease Control and Prevention». NIOSH. 1 July 2014. Retrieved 10 December 2015.
- ^ Liu, Hongying; Weng, Lingyan; Yang, Chi (2017-03-28). «A review on nanomaterial-based electrochemical sensors for H2O2, H2S and NO inside cells or released by cells». Microchimica Acta. 184 (5): 1267–1283. doi:10.1007/s00604-017-2179-2. ISSN 0026-3672. S2CID 21308802.
- ^ Weller, Richard, Could the sun be good for your heart? TedxGlasgow. Filmed March 2012, posted January 2013
- ^ Roszer, T (2012) The Biology of Subcellular Nitric Oxide. ISBN 978-94-007-2818-9
- ^ a b Perez, Krystle M.; Laughon, Matthew (November 2015). «Sildenafil in Term and Premature Infants: A Systematic Review». Clinical Therapeutics. 37 (11): 2598–2607.e1. doi:10.1016/j.clinthera.2015.07.019. ISSN 0149-2918. PMID 26490498.
- ^ a b c Stryer, Lubert (1995). Biochemistry (4th ed.). W.H. Freeman and Company. p. 732. ISBN 978-0-7167-2009-6.
- ^ a b c T., Hancock, John (2010). Cell signalling (3rd ed.). Oxford: Oxford University Press. ISBN 9780199232109. OCLC 444336556.
- ^ Szabo, Csaba; Coletta, Ciro; Chao, Celia; Módis, Katalin; Szczesny, Bartosz; Papapetropoulos, Andreas; Hellmich, Mark R. (2013-07-23). «Tumor-derived hydrogen sulfide, produced by cystathionine-β-synthase, stimulates bioenergetics, cell proliferation, and angiogenesis in colon cancer». Proceedings of the National Academy of Sciences of the United States of America. 110 (30): 12474–12479. Bibcode:2013PNAS..11012474S. doi:10.1073/pnas.1306241110. ISSN 1091-6490. PMC 3725060. PMID 23836652.
- ^ Altaany, Zaid; Yang, Guangdong; Wang, Rui (July 2013). «Crosstalk between hydrogen sulfide and nitric oxide in endothelial cells». Journal of Cellular and Molecular Medicine. 17 (7): 879–888. doi:10.1111/jcmm.12077. ISSN 1582-4934. PMC 3822893. PMID 23742697.
- ^ Yasuda, Yoshifumi; Itoh, Tomonori; Miyamura, Miharu; Nishino, Hitoo (1997). «Comparison of Exhaled Nitric Oxide and Cardiorespiratory Indices between Nasal and Oral Breathing during Submaximal Exercise in Humans». Japanese Journal of Physiology. 47 (5): 465–470. doi:10.2170/jjphysiol.47.465. ISSN 0021-521X. PMID 9504133. Retrieved 2022-11-17.
- ^ Dahl, Melissa (2011-01-11). «‘Mouth-breathing’ gross, harmful to your health». NBC News. Retrieved 2021-09-06.
{{cite web}}: CS1 maint: url-status (link) - ^ «Nitric oxide». National Institute for Occupational Safety and Health. Retrieved 2015-11-20.
- ^ «Bretherick’s Handbook of Reactive Chemical Hazards | ScienceDirect». www.sciencedirect.com. Retrieved 2022-02-23.
- ^ Ribovich, John; Murphy, John; Watson, Richard (1975-01-01). «Detonation studies with nitric oxide, nitrous oxide, nitrogen tetroxide, carbon monoxide, and ethylene». Journal of Hazardous Materials. 1 (4): 275–287. doi:10.1016/0304-3894(75)80001-X. ISSN 0304-3894.
Further reading
- Butler A. and Nicholson R.; «Life, death and NO.» Cambridge 2003. ISBN 978-0-85404-686-7.
- van Faassen, E. E.; Vanin, A. F. (eds); «Radicals for life: The various forms of Nitric Oxide.» Elsevier, Amsterdam 2007. ISBN 978-0-444-52236-8.
- Ignarro, L. J. (ed.); «Nitric oxide:biology and pathobiology.» Academic Press, San Diego 2000. ISBN 0-12-370420-0.
External links[edit]
- International Chemical Safety Card 1311
- «Nitric oxide and its role in health and diabetes». 21 October 2015.
- Microscale Gas Chemistry: Experiments with Nitrogen Oxides
- Your Brain Boots Up Like a Computer – new insights about the biological role of nitric oxide.
- Assessing The Potential of Nitric Oxide in the Diabetic Foot
- New Discoveries About Nitric Oxide Can Provide Drugs For Schizophrenia
- Nitric Oxide at the Chemical Database
- «Immediately Dangerous to Life or Health Concentrations (IDLH): Nitric oxide». National Institute for Occupational Safety and Health. 2 November 2018.
From Wikipedia, the free encyclopedia
This article is about a molecule of one nitrogen atom and one oxygen atom. For other chemical combinations of nitrogen and oxygen, see nitrogen oxide. For the use of nitric oxide as a medication or in biology, see Biological functions of nitric oxide.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Nitrogen monoxide[1] |
||
| Systematic IUPAC name
Oxidonitrogen(•)[2] (additive) |
||
| Other names
Nitrogen oxide |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.030.233 |
|
| EC Number |
|
|
|
Gmelin Reference |
451 | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1660 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NO | |
| Molar mass | 30.006 g·mol−1 | |
| Appearance | Colourless gas | |
| Density | 1.3402 g/L | |
| Melting point | −164 °C (−263 °F; 109 K) | |
| Boiling point | −152 °C (−242 °F; 121 K) | |
|
Solubility in water |
0.0098 g / 100 ml (0 °C) 0.0056 g / 100 ml (20 °C) |
|
|
Refractive index (nD) |
1.0002697 | |
| Structure | ||
|
Molecular shape |
linear (point group C∞v) | |
| Thermochemistry | ||
|
Std molar |
210.76 J/(K·mol) | |
|
Std enthalpy of |
90.29 kJ/mol | |
| Pharmacology | ||
|
ATC code |
R07AX01 (WHO) | |
| License data |
|
|
|
Routes of |
Inhalation | |
| Pharmacokinetics: | ||
|
Bioavailability |
good | |
|
Metabolism |
via pulmonary capillary bed | |
|
Biological half-life |
2–6 seconds | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
[4] |
|
| GHS labelling: | ||
|
Pictograms |
    [3][4] [3][4]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H270, H280, H314, H330[3][4] | |
|
Precautionary statements |
P220, P244, P260, P280, P303+P361+P353+P315, P304+P340+P315, P305+P351+P338+P315, P370+P376, P403, P405[3][4] | |
| NFPA 704 (fire diamond) |
3 0 3 OX |
|
| Lethal dose or concentration (LD, LC): | ||
|
LC50 (median concentration) |
315 ppm (rabbit, 15 min) 854 ppm (rat, 4 h) 2500 ppm (mouse, 12 min)[5] |
|
|
LCLo (lowest published) |
320 ppm (mouse)[5] | |
| Safety data sheet (SDS) | External SDS | |
| Related compounds | ||
|
Related nitrogen oxides |
Dinitrogen pentoxide
Dinitrogen tetroxide |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Nitric oxide (nitrogen oxide or nitrogen monoxide[1]) is a colorless gas with the formula NO. It is one of the principal oxides of nitrogen. Nitric oxide is a free radical: it has an unpaired electron, which is sometimes denoted by a dot in its chemical formula (•N=O or •NO). Nitric oxide is also a heteronuclear diatomic molecule, a class of molecules whose study spawned early modern theories of chemical bonding.[6]
An important intermediate in industrial chemistry, nitric oxide forms in combustion systems and can be generated by lightning in thunderstorms. In mammals, including humans, nitric oxide is a signaling molecule in many physiological and pathological processes.[7] It was proclaimed the «Molecule of the Year» in 1992.[8] The 1998 Nobel Prize in Physiology or Medicine was awarded for discovering nitric oxide’s role as a cardiovascular signalling molecule.[9]
Nitric oxide should not be confused with nitrogen dioxide (NO2), a brown gas and major air pollutant, or with nitrous oxide (N2O), an anesthetic gas.[6]
Reactions[edit]
With di- and triatomic molecules[edit]
Upon condensing to a liquid, nitric oxide dimerizes to dinitrogen dioxide, but the association is weak and reversible. The N–N distance in crystalline NO is 218 pm, nearly twice the N–O distance.[6]
Since the heat of formation of •NO is endothermic, NO can be decomposed to the elements. Catalytic converters in cars exploit this reaction:
- 2 NO → O2 + N2
When exposed to oxygen, nitric oxide converts into nitrogen dioxide:
- 2 NO + O2 → 2 NO2
This reaction is thought to occur via the intermediates ONOO• and the red compound ONOONO.[10]
In water, nitric oxide reacts with oxygen to form nitrous acid (HNO2). The reaction is thought to proceed via the following stoichiometry:
- 4 NO + O2 + 2 H2O → 4 HNO2
Nitric oxide reacts with fluorine, chlorine, and bromine to form the nitrosyl halides, such as nitrosyl chloride:
- 2 NO + Cl2 → 2 NOCl
With NO2, also a radical, NO combines to form the intensely blue dinitrogen trioxide:[6]
- NO + NO2 ⇌ ON−NO2
Organic chemistry[edit]
The addition of a nitric oxide moiety to another molecule is often referred to as nitrosylation. The Traube reaction[11] is the addition of a two equivalents of nitric oxide onto an enolate, giving a diazeniumdiolate (also called a nitrosohydroxylamine).[12] The product can undergo a subsequent retro-aldol reaction, giving an overall process similar to the haloform reaction. For example, nitric oxide reacts with acetone and an alkoxide to form a diazeniumdiolate on each α position, with subsequent loss of methyl acetate as a by-product:[13]
This reaction, which was discovered around 1898, remains of interest in nitric oxide prodrug research. Nitric oxide can also react directly with sodium methoxide, ultimately forming sodium formate and nitrous oxide by way of an N-methoxydiazeniumdiolate.[14]
Coordination complexes[edit]
Nitric oxide reacts with transition metals to give complexes called metal nitrosyls. The most common bonding mode of nitric oxide is the terminal linear type (M−NO).[6] Alternatively, nitric oxide can serve as a one-electron pseudohalide. In such complexes, the M−N−O group is characterized by an angle between 120° and 140°. The NO group can also bridge between metal centers through the nitrogen atom in a variety of geometries.
Production and preparation[edit]
In commercial settings, nitric oxide is produced by the oxidation of ammonia at 750–900 °C (normally at 850 °C) with platinum as catalyst in the Ostwald process:
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
The uncatalyzed endothermic reaction of oxygen (O2) and nitrogen (N2), which is effected at high temperature (>2000 °C) by lightning has not been developed into a practical commercial synthesis (see Birkeland–Eyde process):
- N2 + O2 → 2 NO
Laboratory methods[edit]
In the laboratory, nitric oxide is conveniently generated by reduction of dilute nitric acid with copper:
- 8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO
An alternative route involves the reduction of nitrous acid in the form of sodium nitrite or potassium nitrite:
- 2 NaNO2 + 2 NaI + 2 H2SO4 → I2 + 2 Na2SO4 + 2 H2O + 2 NO
- 2 NaNO2 + 2 FeSO4 + 3 H2SO4 → Fe2(SO4)3 + 2 NaHSO4 + 2 H2O + 2 NO
- 3 KNO2 + KNO3 + Cr2O3 → 2 K2CrO4 + 4 NO
The iron(II) sulfate route is simple and has been used in undergraduate laboratory experiments. So-called NONOate compounds are also used for nitric oxide generation.
Detection and assay[edit]
Nitric oxide (white) in conifer cells, visualized using DAF-2 DA (diaminofluorescein diacetate)
Nitric oxide concentration can be determined using a chemiluminescent reaction involving ozone.[15] A sample containing nitric oxide is mixed with a large quantity of ozone. The nitric oxide reacts with the ozone to produce oxygen and nitrogen dioxide, accompanied with emission of light (chemiluminescence):
- NO + O3 → NO2 + O2 + hν
which can be measured with a photodetector. The amount of light produced is proportional to the amount of nitric oxide in the sample.
Other methods of testing include electroanalysis (amperometric approach), where ·NO reacts with an electrode to induce a current or voltage change. The detection of NO radicals in biological tissues is particularly difficult due to the short lifetime and concentration of these radicals in tissues. One of the few practical methods is spin trapping of nitric oxide with iron-dithiocarbamate complexes and subsequent detection of the mono-nitrosyl-iron complex with electron paramagnetic resonance (EPR).[16][17]
A group of fluorescent dye indicators that are also available in acetylated form for intracellular measurements exist. The most common compound is 4,5-diaminofluorescein (DAF-2).[18]
Environmental effects[edit]
Main article: NOx
Acid rain deposition[edit]
Nitric oxide reacts with the hydroperoxyl radical (HO•
2) to form nitrogen dioxide (NO2), which then can react with a hydroxyl radical (•OH) to produce nitric acid (HNO3):
- •NO + HO•
2 → •NO2 + •OH - •NO2 + •OH → HNO3
Nitric acid, along with sulfuric acid, contributes to acid rain deposition.
Ozone depletion[edit]
•NO participates in ozone layer depletion. Nitric oxide reacts with stratospheric ozone to form O2 and nitrogen dioxide:
- •NO + O3 → NO2 + O2
This reaction is also utilized to measure concentrations of •NO in control volumes.
Precursor to NO2[edit]
As seen in the acid deposition section, nitric oxide can transform into nitrogen dioxide (this can happen with the hydroperoxy radical, HO•
2, or diatomic oxygen, O2). Symptoms of short-term nitrogen dioxide exposure include nausea, dyspnea and headache. Long-term effects could include impaired immune and respiratory function.[19]
Biological functions[edit]
NO is a gaseous signaling molecule.[20] It is a key vertebrate biological messenger, playing a role in a variety of biological processes.[21] It is a bioproduct in almost all types of organisms, including bacteria, plants, fungi, and animal cells.[22]
Nitric oxide, an endothelium-derived relaxing factor (EDRF), is biosynthesized endogenously from L-arginine, oxygen, and NADPH by various nitric oxide synthase (NOS) enzymes.[23] Reduction of inorganic nitrate may also make nitric oxide.[24] One of the main enzymatic targets of nitric oxide is guanylyl cyclase.[25] The binding of nitric oxide to the heme region of the enzyme leads to activation, in the presence of iron.[25] Nitric oxide is highly reactive (having a lifetime of a few seconds), yet diffuses freely across membranes. These attributes make nitric oxide ideal for a transient paracrine (between adjacent cells) and autocrine (within a single cell) signaling molecule.[24] Once nitric oxide is converted to nitrates and nitrites by oxygen and water, cell signaling is deactivated.[25]
The endothelium (inner lining) of blood vessels uses nitric oxide to signal the surrounding smooth muscle to relax, resulting in vasodilation and increasing blood flow.[24] Sildenafil (Viagra) is a drug that uses the nitric oxide pathway. Sildenafil does not produce nitric oxide, but enhances the signals that are downstream of the nitric oxide pathway by protecting cyclic guanosine monophosphate (cGMP) from degradation by cGMP-specific phosphodiesterase type 5 (PDE5) in the corpus cavernosum, allowing for the signal to be enhanced, and thus vasodilation.[23] Another endogenous gaseous transmitter, hydrogen sulfide (H2S) works with NO to induce vasodilation and angiogenesis in a cooperative manner.[26][27]
Nasal breathing produces nitric oxide within the body, while oral breathing does not.[28][29]
Occupational safety and health[edit]
In the U.S., the Occupational Safety and Health Administration (OSHA) has set the legal limit (permissible exposure limit) for nitric oxide exposure in the workplace as 25 ppm (30 mg/m3) over an 8-hour workday. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 25 ppm (30 mg/m3) over an 8-hour workday. At levels of 100 ppm, nitric oxide is immediately dangerous to life and health.[30]
Explosion hazard[edit]
Liquid nitrogen oxide is very sensitive to detonation even in the absence of fuel, and can be initiated as readily as nitroglycerin. Detonation of the endothermic liquid oxide close to its b.p. (-152°C) generated a 100 kbar pulse and fragmented the test equipment. It is the simplest molecule that is capable of detonation in all three phases. The liquid oxide is sensitive and may explode during distillation, and this has been the cause of industrial accidents.[31] Gaseous nitric oxide detonates at about 2300 m/s, but as a solid it can reach a detonation velocity of 6100 m/s.[32]
References[edit]
Notes
- ^ a b Nomenclature of Inorganic Chemistry, IUPAC Recommendations (PDF). International Union of Pure and Applied Chemistry. 2005. p. 69.
- ^ «Nitric Oxide (CHEBI:16480)». Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute.
- ^ a b c «Nitrogen monoxide — Registration Dossier — ECHA». Retrieved 2020-11-02.
- ^ a b c d «Safety Data Sheet — Nitric Oxide, compressed — Registration Dossier» (PDF). Retrieved 2020-11-02.
- ^ a b «Nitric oxide». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Hou, Y. C.; Janczuk, A.; Wang, P. G. (1999). «Current trends in the development of nitric oxide donors». Current Pharmaceutical Design. 5 (6): 417–441. doi:10.2174/138161280506230110111042. PMID 10390607.
- ^ Culotta, Elizabeth; Koshland, Daniel E. Jr. (1992). «NO news is good news». Science. 258 (5090): 1862–1864. Bibcode:1992Sci…258.1862C. doi:10.1126/science.1361684. PMID 1361684.
- ^ «The Nobel Prize in Physiology or Medicine 1998». NobelPrize.org. Retrieved 2022-06-17.
- ^ Galliker, Benedikt; et al. (2009). «Intermediates in the Autoxidation of Nitrogen Monoxide». Chemistry — A European Journal. 15 (25): 6161–6168. doi:10.1002/chem.200801819. ISSN 0947-6539. PMID 19437472.
- ^
- ^ Arulsamy, Navamoney; Bohle, D. Scott (2006). «Synthesis of Diazeniumdiolates from the Reactions of Nitric Oxide with Enolates». J. Org. Chem. 71 (2): 572–581. doi:10.1021/jo051998p. PMID 16408967.
- ^ Traube, Wilhelm (1898). «Ueber Synthesen stickstoffhaltiger Verbindungen mit Hülfe des Stickoxyds». Justus Liebig’s Annalen der Chemie (in German). 300: 81–128. doi:10.1002/jlac.18983000108.
- ^ Derosa, Frank; Keefer, Larry K.; Hrabie, Joseph A. (2008). «Nitric Oxide Reacts with Methoxide». The Journal of Organic Chemistry. 73 (3): 1139–1142. doi:10.1021/jo7020423. PMID 18184006.
- ^ Fontijn, Arthur; Sabadell, Alberto J.; Ronco, Richard J. (1970). «Homogeneous chemiluminescent measurement of nitric oxide with ozone. Implications for continuous selective monitoring of gaseous air pollutants». Analytical Chemistry. 42 (6): 575–579. doi:10.1021/ac60288a034.
- ^ Vanin, A; Huisman, A; Van Faassen, E (2002). Iron dithiocarbamate as spin trap for nitric oxide detection: Pitfalls and successes. Methods in Enzymology. Vol. 359. pp. 27–42. doi:10.1016/S0076-6879(02)59169-2. ISBN 9780121822620. PMID 12481557.
- ^ Nagano, T; Yoshimura, T (2002). «Bioimaging of nitric oxide». Chemical Reviews. 102 (4): 1235–1270. doi:10.1021/cr010152s. PMID 11942795.
- ^ Kojima H, Nakatsubo N, Kikuchi K, Kawahara S, Kirino Y, Nagoshi H, Hirata Y, Nagano T (1998). «Detection and imaging of nitric oxide with novel fluorescent indicators: diaminofluoresceins». Anal. Chem. 70 (13): 2446–2453. doi:10.1021/ac9801723. PMID 9666719.
- ^ «Centers for Disease Control and Prevention». NIOSH. 1 July 2014. Retrieved 10 December 2015.
- ^ Liu, Hongying; Weng, Lingyan; Yang, Chi (2017-03-28). «A review on nanomaterial-based electrochemical sensors for H2O2, H2S and NO inside cells or released by cells». Microchimica Acta. 184 (5): 1267–1283. doi:10.1007/s00604-017-2179-2. ISSN 0026-3672. S2CID 21308802.
- ^ Weller, Richard, Could the sun be good for your heart? TedxGlasgow. Filmed March 2012, posted January 2013
- ^ Roszer, T (2012) The Biology of Subcellular Nitric Oxide. ISBN 978-94-007-2818-9
- ^ a b Perez, Krystle M.; Laughon, Matthew (November 2015). «Sildenafil in Term and Premature Infants: A Systematic Review». Clinical Therapeutics. 37 (11): 2598–2607.e1. doi:10.1016/j.clinthera.2015.07.019. ISSN 0149-2918. PMID 26490498.
- ^ a b c Stryer, Lubert (1995). Biochemistry (4th ed.). W.H. Freeman and Company. p. 732. ISBN 978-0-7167-2009-6.
- ^ a b c T., Hancock, John (2010). Cell signalling (3rd ed.). Oxford: Oxford University Press. ISBN 9780199232109. OCLC 444336556.
- ^ Szabo, Csaba; Coletta, Ciro; Chao, Celia; Módis, Katalin; Szczesny, Bartosz; Papapetropoulos, Andreas; Hellmich, Mark R. (2013-07-23). «Tumor-derived hydrogen sulfide, produced by cystathionine-β-synthase, stimulates bioenergetics, cell proliferation, and angiogenesis in colon cancer». Proceedings of the National Academy of Sciences of the United States of America. 110 (30): 12474–12479. Bibcode:2013PNAS..11012474S. doi:10.1073/pnas.1306241110. ISSN 1091-6490. PMC 3725060. PMID 23836652.
- ^ Altaany, Zaid; Yang, Guangdong; Wang, Rui (July 2013). «Crosstalk between hydrogen sulfide and nitric oxide in endothelial cells». Journal of Cellular and Molecular Medicine. 17 (7): 879–888. doi:10.1111/jcmm.12077. ISSN 1582-4934. PMC 3822893. PMID 23742697.
- ^ Yasuda, Yoshifumi; Itoh, Tomonori; Miyamura, Miharu; Nishino, Hitoo (1997). «Comparison of Exhaled Nitric Oxide and Cardiorespiratory Indices between Nasal and Oral Breathing during Submaximal Exercise in Humans». Japanese Journal of Physiology. 47 (5): 465–470. doi:10.2170/jjphysiol.47.465. ISSN 0021-521X. PMID 9504133. Retrieved 2022-11-17.
- ^ Dahl, Melissa (2011-01-11). «‘Mouth-breathing’ gross, harmful to your health». NBC News. Retrieved 2021-09-06.
{{cite web}}: CS1 maint: url-status (link) - ^ «Nitric oxide». National Institute for Occupational Safety and Health. Retrieved 2015-11-20.
- ^ «Bretherick’s Handbook of Reactive Chemical Hazards | ScienceDirect». www.sciencedirect.com. Retrieved 2022-02-23.
- ^ Ribovich, John; Murphy, John; Watson, Richard (1975-01-01). «Detonation studies with nitric oxide, nitrous oxide, nitrogen tetroxide, carbon monoxide, and ethylene». Journal of Hazardous Materials. 1 (4): 275–287. doi:10.1016/0304-3894(75)80001-X. ISSN 0304-3894.
Further reading
- Butler A. and Nicholson R.; «Life, death and NO.» Cambridge 2003. ISBN 978-0-85404-686-7.
- van Faassen, E. E.; Vanin, A. F. (eds); «Radicals for life: The various forms of Nitric Oxide.» Elsevier, Amsterdam 2007. ISBN 978-0-444-52236-8.
- Ignarro, L. J. (ed.); «Nitric oxide:biology and pathobiology.» Academic Press, San Diego 2000. ISBN 0-12-370420-0.
External links[edit]
- International Chemical Safety Card 1311
- «Nitric oxide and its role in health and diabetes». 21 October 2015.
- Microscale Gas Chemistry: Experiments with Nitrogen Oxides
- Your Brain Boots Up Like a Computer – new insights about the biological role of nitric oxide.
- Assessing The Potential of Nitric Oxide in the Diabetic Foot
- New Discoveries About Nitric Oxide Can Provide Drugs For Schizophrenia
- Nitric Oxide at the Chemical Database
- «Immediately Dangerous to Life or Health Concentrations (IDLH): Nitric oxide». National Institute for Occupational Safety and Health. 2 November 2018.
АЗОТА ОКСИДЫ
- АЗОТА ОКСИДЫ
- АЗОТА ОКСИДЫ
АЗО́ТА ОКСИ́ДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO — несолеобразующие оксиды, N2O3 с водой дает азотистую кислоту, N2O5 — азотную, NO2 — их смесь. Все оксиды азота физиологически активны. N2O — средство для наркоза («веселящий газ»), NO и NO2 — промежуточные продукты в производстве азотной кислоты, NO2 — окислитель в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
Энциклопедический словарь.
2009.
Смотреть что такое «АЗОТА ОКСИДЫ» в других словарях:
-
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы) сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3 с … Большой Энциклопедический словарь
-
Азота оксиды — N0, Оксиды азота NO, N02 в сумме в пересчете на NOj, относящиеся к классу опасности III Источник: ГОСТ Р 51206 98: Автотранспортные средства. Содержание вредных веществ в воздух … Словарь-справочник терминов нормативно-технической документации
-
азота оксиды{:} — гемиоксид N2О и монооксид NO (бесцветные газы), сесквиоксид N2О3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2О4), оксид N2О5 (бесцветные кристаллы). N2О и NO несолеобразующие оксиды, N2O3 с водой даёт… … Энциклопедический словарь
-
АЗОТА ОКСИДЫ — гемиоксид N2O и монооксид NO (бесцв. газы), сесквиоксид N203 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2О4), оксид N2О5 (бесцв. кристаллы). N2О и NO несолеобразующие оксиды, N2О3 с водой даёт азотистую … Естествознание. Энциклопедический словарь
-
АЗОТА ОКСИДЫ — соединения азота с кислородом. Гемиоксид (веселящий газ) N2O газ с приятным запахом; хорошо растворим в воде; tкип 88,5 оС; применяется как анестезирующее средство. Оксид NO газ, плохо растворимый в воде; tкип 151,6 оС; промежуточный продукт в… … Большой энциклопедический политехнический словарь
-
АЗОТА ОКСИДЫ — Гемиоксид N2O (оксид диазота, веселящий газ ) имеет слабый приятный запах и сладковатый вкус (см. табл.). Молекула линейна (длины связей в нм): Для N2O 0,51 10 30 Кл м. Р римость в воде (г на 100 г): 0,257 (0 … Химическая энциклопедия
-
Азота оксиды — … Википедия
-
АЗОТА — ОКСИДЫ: N2O (газ, tкип 88,5шС), NO (газ, tкип 151,6шС), NO2 (красно бурый), N2O4 (газ, tкип 20,6шС, tпл 11,2шС), N2O3 (газ, tкип 40шС), N2O5 (кристаллы, tпл 41шС, возгоняется при 33шС). NO2 промежуточный продукт при получении азотной кислоты, NO2 … Современная энциклопедия
-
оксиды азота — оксиды азота: Смесь различных оксидов азота, образовавшихся в процессе горения топлива в цилиндре дизеля, обозначаемая символом NOx. Источник … Словарь-справочник терминов нормативно-технической документации
-
оксиды азота — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN nitrogen oxides Oxides formed and released in all common types of combustion; they are formed by the oxidation of atmospheric nitrogen at high temperatures. Introduced into the … Справочник технического переводчика
Виды и свойства
Азот — вещество, которое образует несколько групп оксидов. Все они обладают разной молярной массой и физическими характеристиками. В группу солеобразующих входят:
- Триоксид диазота (III). Химическая формула N2O3, кратность связи равна 3. Вещество имеет вид жидкости тёмно-синего цвета, плотность которой меньше плотности воды. Кристаллизуется при температуре -100 градусов. Этот кислотный оксид реагирует со щелочами, образуя соли. С водой образует азотистую кислоту: N2O3+H2O = 2HNO2.
- Двуокись азота (IV) — NO2. Атомы в молекуле расположены под углом к друг другу. Вещество является ядовитым газом бурого цвета, имеет характерный запах. Легко растворимо в воде. Оксид образует 2 кислоты — азотную и азотистую. Азотная кислота образуется в присутствии воздуха и воды. Со щелочами образует 2 соли — нитрат и нитрит. При температуре меньше 22 градусов молекулы димеризуются и образуется N2O4. Образуется жидкость, которая при дальнейшем охлаждении превращается в кристаллы.
- Пентаоксид (V) — N2O5. Другое название — азотный ангидрид. Представляет собой кристаллы, имеющие белую окраску. При нормальной температуре и давлении легко разлагается. При низких температурах сохраняет высокую степень устойчивости. Обладает свойствами окислителя и восстановителя.
Связи атомов происходят по механизму «донор-акцептор». Атом азота отдаёт электрон и приобретает заряд со знаком «плюс». Кислород присоединяет электрон, приобретая отрицательный заряд.
Несолеобразующие соединения
Второй класс соединений — несолеобразующие. В неё входят оксид одновалентного и двухвалентного азота. Вещество с формулой N2O имеет линейное строение молекулы. Представляет собой газ, не имеющий цвета. В нормальных условиях вещество инертно. Обладает сладковатым вкусом и слабым запахом. Легко растворяется в воде, однако не вступает с ней в химические реакции. С водородом реагирует со взрывом. Не вступает в химические реакции с кислотами и основаниями.
При небольшом нагревании быстро разлагается, проявляет свойства окислителя. Окисляет металлы, водород, сернистый газ и прочее. Растворяясь в воде, образует азотную кислоту. В результате таких реакций образуется свободная форма азота.
Вступая в контакт с окислителями, N2O выступает в роли восстановителя. К примеру, раствор перманганата в серной кислоте окисляет закись азота до образования монооксида. В водном растворе окисляет диоксид серы до серной кислоты.
Монооксид (II) — NO. При низких температурах молекулы димеризуются и образуют новое вещество. Окись азота представляет собой газ без цвета и запаха, малорастворимый в воде. В присутствии кислорода загорается, образуется диоксид — вещество коричневого цвета. Под действием хлора или озона легко окисляется. Жидкая и твёрдая форма имеет голубую окраску. Вступает во взаимодействие с основаниями и основными оксидами.
Вступает в химические связи с окислителями, водородом, активными металлами. Входит в состав выхлопных газов автомобилей в качестве побочного продукта.
Получение в природе и промышленности
В природе азот встречается преимущественно в чистом виде. Во время грозы азот и кислород вступают во взаимодействие при высокой температуре. Образуется монооксид: N2+O2 = 2NO.
В промышленных условиях получают следующие соединения:
- При разложении нитрата аммония образуется оксид азота, формула которого выглядит как N2O. Уравнение химической реакции записывается следующим образом: NH4NO3 → N2O+2H2O.
- На производстве получение оксида азота (I) происходит путём окисления аммиака. Химический процесс нуждается в присутствии катализатора, в роли которого выступает платина.
- В лабораторных условиях монооксид получают путём взаимодействия меди и разбавленной азотной кислоты. Другой способ получения — окисление хлорида железа или йодоводорода в результате взаимодействия с азотной кислотой.
- Двуокись получается в результате взаимодействия монооксида с атомами кислорода.
- Лабораторным путём NO2 (IV) получается при взаимодействии концентрированной азотной кислоты с медью. Второй вариант — разложение нитрата меди или свинца.
- Азотистый ангидрид можно получить из оксидов при низкой температуре.
Живые организмы также вырабатывают соединения азота. Растения способны вырабатывать монооксид азота несколькими способами:
- С помощью фермента синтазы и аминокислоты аргинина. Хотя некоторые учёные считают, что в растительных клетках нет прямых аналогов этого фермента.
- С помощью фермента нитрат-редуктазы, который находится в клеточных оболочках. Вещество способно восстанавливать нитраты и нитриты, которые растение получает из почвы.
- Посредством транспортировки электронов в митохондриях.
- Путём окисления аммиака или восстановления нитратов и нитритов без участия катализаторов.
Практическое применение
Химические свойства оксида азота нашли практическое применение. Их используют в медицинской практике, военной, пищевой и химической промышленности. Наиболее часто соединения используются в следующих целях:
- Влияние оксида азота на организм человека используется в медицинской практике. В хирургии применяется для дачи ингаляционного наркоза в смеси с кислородом (2 части кислорода на 8 частей закиси азота).
- Поскольку NO2 обладает свойствами сильного окислителя, он используется в производстве ракетного топлива. Когда вещество взаимодействует с гидразином, образуется колоссальное количество энергии. Кроме того, оно используется для изготовления взрывчатых смесей.
- Соединение NO2 применяется в химии для производства серной и азотной кислоты.
- С помощью NO улучшают технические качества двигателей внутреннего сгорания у автомобилей.
- В пищевой промышленности вещество применяется в качестве добавки для улучшения вкуса готовых продуктов. На упаковках ему соответствует символ Е942.
- Монооксид и оксид трёхвалентного азота используется в химической промышленности в качестве сырья для производства азотной кислоты и её солей.
Влияние на живые организмы
В смеси с кислородом закись азота в малых концентрациях воздействует на нервную систему человека. Эффект напоминает опьянение лёгкой степени и сопровождается эйфорией. За это веществу дали название — «веселящий газ». В чистом виде вещество вызывает состояние опьянения и выраженную сонливость. При передозировке вначале вызывает приступ судорожного смеха, затем потерю сознания.
Монооксид азота — высокотоксичное соединение. Поступая в организм в больших концентрациях, способен изменить структуру гемоглобина, что взывает кислородное голодание. Оксид азота (IV) — крайне ядовитое вещество, представляющее опасность для здоровья и жизни.
Монооксид азота — вторичный посредник, который участвует в механизмах внутриклеточной и межклеточной передачи импульсов. Это вещество вырабатывают практически все живые организмы, от одноклеточных до млекопитающих.
Изначально окись азота была известна как эндотелиальный сосудорасширяющий фактор. Она образовалась в организме из аминокислоты аргинина. В химическом процессе участвуют молекулы кислорода, НАДФ и синтаза оксида азота. Другой способ образования вещества — восстановление неорганических солей азотной кислоты.
Эндотелиальные клетки сосудов передают сигнал гладкомышечным элементам, в результате сосуды расширяются и усиливается местный кровоток. Молекула оксида азота обладает способностью легко проникать через мембраны клеток. Благодаря этому она служит для обмена сигналами. Это благотворно влияет на состояние сердечно-сосудистой системы. Снижается риск ишемии миокарда и развития гипертонической болезни.
Уровень эндогенной окиси азота могут повышать растительные продукты — руккола, шпинат, свёкла, петрушка и прочие. Получение вещества из растительных продуктов требует присутствия сапрофитных микроорганизмов. В норме они живут в ротовой полости человека.
Толковый словарь русского языка. Поиск по слову, типу, синониму, антониму и описанию. Словарь ударений.
азота оксиды
ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
АЗОТА ОКСИДЫ — АЗО́ТА ОКСИ́ДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO — несолеобразующие оксиды, N2O3 с водой дает азотистую кислоту, N2O5 — азотную, NO2 — их смесь. Все оксиды азота физиологически активны. N2O — средство для наркоза («веселящий газ»), NO и NO2 — промежуточные продукты в производстве азотной кислоты, NO2 — окислитель в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
БОЛЬШОЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы) — сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO — несолеобразующие оксиды, N2O3 с водой дает азотистую кислоту, N2O5 — азотную, NO2 — их смесь. Все оксиды азота физиологически активны. N2O — средство для наркоза («веселящий газ»), NO и NO2 — промежуточные продукты в производстве азотной кислоты, NO2 — окислитель в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
ПОЛЕЗНЫЕ СЕРВИСЫ
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 304.
Показано записей: 20.
1. Оксид азота(I)
Брутто-формула:
N2O
CAS# 10024-97-2
Названия
Русский:
- Оксид азота(I) [Wiki]
- Оксонитрид азота(I)
- веселящий газ
- закись азота
- окись азота
- оксид диазота
;
;
;
;
;
;
English:
- Dinitrogen monoxide
- Dinitrogen oxide
- Dinitrogen oxide (N2O)
- E 942 [Wiki]
- E-942
- Factitious air
- Hyponitrous acid anhydride
- Laughing gas
- Nitrogen hypoxide
- Nitrogen oxide (N2O)
- Nitrogen oxide, (N2O)(CAS)
- Nitrous oxide(IUPAC) [Wiki]
- R 744A
- UN 1070
- UN 2201
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
N///N`^+/O^- <-> N^-\N^+\O
2. Оксид азота(II)
Брутто-формула:
NO
CAS# 10102-43-9
Названия
Русский:
- Оксид азота(II)
- моноксид азота
- монооксид азота
- нитрозил-радикал
- окись азота
;
;
;
;
;
English:
- Amidogen, oxo-
- INOmax
- Mononitrogen monoxide
- Nitric oxide(IUPAC)
- Nitric oxide trimer
- Nitrogen monoxide
- Nitrogen oxide, (NO)(CAS)
- Nitrogen(II) oxide
- Nitrosyl radical
- nitrogen monooxide
- nitrosyl
- oxoazanyl
- oxyde azotique
;
;
;
;
;
;
;
;
;
;
;
;
;
$dashes(/)$dots(Bl)N_(x1,N2)$dashes(>)O
3. Оксид азота(III)
Брутто-формула:
N2O3
CAS# 10544-73-7
Названия
Русский:
- Оксид азота(III) [Wiki]
- азотистый ангидрид
- сесквиоксид азота
;
;
;
English:
- AC1L1VF2
- AC1Q21V6
- Dinitrogen trioxide [Wiki]
- Dinitrogentrioxide
- EINECS 234-128-5
- N-oxonitramide
- NITROGEN TRIOXIDE
- Nitrogen oxide (N2O3)
- Nitrogen sesquioxide
- Nitrogen trioxide (N2O3)
- Nitrous anhydride
- UN2421
- asym-Dinitrogen trioxide
;
;
;
;
;
;
;
;
;
;
;
;
;
4. Оксид азота(IV)
Брутто-формула:
NO2
CAS# 10102-44-0
Названия
Русский:
- Оксид азота(IV)
- бурый газ
- диоксид азота
;
;
;
English:
- Nitrogen dioxide(IUPAC)
- Nitrogen oxide, (NO2)(CAS)
- Nitrogen peroxide
- Nitrogen(IV) oxide
- UN 1067
;
;
;
;
;
5. Оксид азота(V)
Брутто-формула:
N2O5
CAS# 10102-03-1
Названия
Русский:
- Оксид азота(V)
- азотный ангидрид
- нитрат нитроила
- пентаоксид диазота
;
;
;
;
English:
- 1,3-dioxodiazoxane 1,3-dioxide
- DNPO
- Dinitrogen pentaoxide
- Dinitrogen pentoxide
- Distickstoffpentaoxid
- Nitric acid, dioxidoazanyl ester
- Nitric anhydride
- Nitrogen oxide (N2O5)
- Nitrogen oxide, (N2O5)(CAS)
- Nitrogen pentoxide
- Nitronium nitrate
- Nitryl nitrate
- STICKSTOFF(V)-OXID
- dinitrooxidane
- nitro nitrate(IUPAC)
- pentaoxido de dinitrogeno
- pentaoxyde de diazote
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
O_(A-30,S:|)N<_(A-80,S:|)O>O/N<_(A-100,S|:)O>_(A30,S:|)O
O`^-/N^+`|O|O/N^+`|O|O^-
$dots(LUD)O/N`|$dots(LR)O|$dots(UD)O/N`|$dots(LR)O|$dots(UDR)O
6. Трифторид-оксид азота
Брутто-формула:
F3NO
CAS# 13847-65-9
Названия
Русский:
- Трифторид нитрозила
- Трифторид-оксид азота [Wiki]
;
;
English:
- AMOX
- Azane, trifluoro-, oxide(CAS)
- Nitrogen oxide trifluoride
- Trifluoroamine oxide
- Trifluoroazane oxide(IUPAC)
;
;
;
;
;
7. Тетраоксид диазота
Брутто-формула:
N2O4
CAS# 10544-72-6
Названия
Русский:
- АТ
- Тетраоксид диазота [Wiki]
- азотный тетраоксид
- амил
;
;
;
;
English:
- Di-nitrogen dioxide
- Dinitrogen tetraoxide
- Dinitrogen tetroxide [Wiki]
- Dinitrogen(II) oxide(-I)
- HSDB 1067
- NITROGEN TETROXIDE
- Nitrogen dioxide, di-
- Nitrogen oxide (N2O4)
- Nitrogen oxide NO2
- Nitrogen oxide, (N2O4)(CAS)
- Nitrogen tetraoxide
- RCRA waste no. P078
- UN 1067
;
;
;
;
;
;
;
;
;
;
;
;
;
O_(A60,S|:)N<_(A120,S|:)O>_(x1)N<_(A-60,S|:)O>_(A60,S:|)O
8. Хлорид нитрозила
Брутто-формула:
ClNO
CAS# 2696-92-6
Названия
Русский:
- Хлорид нитрозила(IUPAC) [Wiki]
- оксид-хлорид азота
- хлористый нитрозил
;
;
;
English:
- E919
- EINECS:220-273-1
- Nitrosyl chloride(IUPAC) [Wiki]
- UN1069
;
;
;
;
9. метиловый спирт
Брутто-формула:
CH4O
CAS# 67-56-1
Названия
Русский:
- Метанол(IUPAC) [Wiki]
- гидроксид метила
- древесный спирт
- карбинол
- метилгидрат
- метиловый спирт
;
;
;
;
;
;
English:
- Colonial Spirit
- EINECS:212-378-6
- Hydroxymethane
- Methanol(IUPAC)(CAS) [Wiki]
- Methyl hydrate
- Methyl hydroxide
- Methylic alcohol
- Methylol
- Pyroxylic spirit
- Wood alcohol
- Wood naphtha
- Wood spirit
- carbinol
- methyl alcohol
;
;
;
;
;
;
;
;
;
;
;
;
;
;
$slope(55)H/C<_(A-160,w+)H><_(A-100,d+)H>-O/H
10. Этиленоксид
Брутто-формула:
C2H4O
CAS# 75-21-8
Названия
Русский:
- 1,2-эпоксиэтан
- Окись этилена(IUPAC) [Wiki]
- Этиленоксид
- оксиран
;
;
;
;
English:
- Ethylene oxide(IUPAC) [Wiki]
- Oxirane(CAS)
- dimethylene oxide
- epoxyethane
- oxacyclopropane
;
;
;
;
;
C_(x1.4)C_q3O_q3; H_(A-15,d-)#1_(A110,w+)H; H_(A-165,d-)#2_(A70,w+)H;
$L(1.4)C_(A0)C_q3O_q3; H_(x1)#1_p3H;H_(x-1)#2_q3H
11. Триметиленоксид
Брутто-формула:
C3H6O
Названия
Русский:
- Оксетан(IUPAC)
- Триметиленоксид
;
;
English:
- 1,3-epoxypropane
- 1,3-propylene oxide
- Oxetane(IUPAC)
- oxacyclobutane
- trimethylene oxide
;
;
;
;
;
H|C|C|H; H|C|$atomColor1(blue)O; H-#2-#6-H; H-#3-#O
12. Гексаметиленоксид
Брутто-формула:
C6H12O
Названия
Русский:
- Гексаметиленоксид
- Оксепан(IUPAC)
;
;
English:
- Oxepane
;
13. Вода
Брутто-формула:
H2O
CAS# 7732-18-5
Названия
Русский:
- Вода [Wiki]
- Оксид водорода(IUPAC)
;
;
English:
- Dihydrogen oxide
- Water(CAS) [Wiki]
- oxidane(IUPAC)
;
;
;
14. Углекислый газ
Брутто-формула:
CO2
Названия
Русский:
- Оксид углерода(IV)(IUPAC)
- Углекислый газ
- двуокись углерода
- диоксид углерода
- угольный ангидрид
;
;
;
;
;
English:
- Carbon dioxide
- Carbon oxide
- Carbon(IV) oxide
- Carbonic acid gas
- Carbonic anhydride
- Carbonic oxide
- Dry ice
;
;
;
;
;
;
;
15. Оксид фосфора(V)
Брутто-формула:
O10P4
Названия
Русский:
- Оксид фосфора(V)
- Пентаоксид фосфора
- пятиокись фосфора
- фосфорный ангидрид
;
;
;
;
English:
- Diphosphorus pentoxide
- Phosphoric anhydride
- Phosphoric oxide
- Phosphoric pentoxide
- Phosphorus oxide
- Phosphorus pentaoxide
- Phosphorus pentoxide
;
;
;
;
;
;
;
$slope(15)$L(1.5)O||P`/O|P:l`/O/O/P:rO«|O`_(A120)O|P<`/O_#l><O_#r>_(A120,N2)O
16. Гидроксид калия
Брутто-формула:
HKO
CAS# 1310-58-3
Названия
Русский:
- Гидроксид калия(IUPAC) [Wiki]
- Кали едкое
- гидроокись калия
- калия гидроксид
- каустический поташ
;
;
;
;
;
English:
- Caustic potash
- E525
- Potash lye
- Potassia
- Potassium hydrate
- Potassium hydroxide(IUPAC) [Wiki]
;
;
;
;
;
;
17. Гидроксид натрия
Брутто-формула:
HNaO
CAS# 1310-73-2
Названия
Русский:
- Гидроксид натрия(IUPAC) [Wiki]
- гидроокись натрия
- едкая щелочь
- едкий натр
- каустик
- каустическая сода
- натрия гидроксид
;
;
;
;
;
;
;
English:
- Ascarite
- Caustic soda
- E524
- Lye
- Sodium hydrate
- Sodium hydroxide(IUPAC) [Wiki]
- Sodium oxidanide
- White caustic
;
;
;
;
;
;
;
;
18. Гидроксид кальция
Брутто-формула:
H2CaO2
CAS# 1305-62-0
Названия
Русский:
- Гидроксид кальция(IUPAC) [Wiki]
- гашёная известь
- гидроокись кальция
- кальция гидроксид
;
;
;
;
English:
- Calcium hydroxide(IUPAC) [Wiki]
- Calcium(II) hydroxide
- E526
- Hydrated lime
- Milk of lime
- Pickling lime
- Slaked lime
;
;
;
;
;
;
;
$L(1.5)HO^-Ca^2+/0`HO^-
19. Оксид кальция
Брутто-формула:
CaO
CAS# 1305-78-8
Названия
Русский:
- Оксид кальция(IUPAC) [Wiki]
- кальция оксид
- окись кальция, негашёная и́звесть
;
;
;
English:
- Calcia
- Calciogreen
- Calcium oxide(IUPAC) [Wiki]
- Calciumoxide (CaO)
- EINECS:215-138-9
- Oxocalcium(IUPAC)
- Quicklime
- burnt lime
- unslaked lime
;
;
;
;
;
;
;
;
;
20. Оксид магния
Брутто-формула:
MgO
Названия
Русский:
- Жжёная магнезия
- Оксид магния(IUPAC)
- магния окись
- магния оксид
- периклаз
;
;
;
;
;
English:
- Magnesia
- Magnesium oxide(IUPAC)
- Periclase
;
;
;
Азот проявляет положительные степени окисления от (+1) до (+5) и образует соединения с кислородом:
N2O
— оксид азота((I)),
NO
— оксид азота((II)),
N2O3
— оксид азота((III)),
NO2
— оксид азота((IV)),
N2O5
— оксид азота((V)).
Первые четыре вещества при обычных условиях представляют собой газы, а
N2O5
— твёрдое вещество. Все оксиды азота ядовиты.
Бесцветный оксид азота((II)) образуется в реакции азота с кислородом при высоких температурах:
Этот оксид является также продуктом каталитического окисления аммиака:
Oксид азота((II)) легко окисляется при комнатной температуре. При этом образуется бурый газ с неприятным запахом — оксид азота((IV)):
Обрати внимание!
Оксид азота((I)) и оксид азота((II)) относятся к несолеобразующим оксидам. Они не реагируют с водой, кислотами и основаниями.
Другие оксиды являются солеобразующими (кислотными). Оксиду азота((III)) соответствует слабая азотистая кислота
HNO2
, оксиду азота((V)) — сильная азотная кислота
HNO3
. Oксид азота((IV)) при растворении в воде образует две кислоты одновременно — азотную и азотистую:
В присутствии кислорода реакция между оксидом азота((IV)) и водой протекает иначе, и образуется только азотная кислота:
Оксид азота((II)) и оксид азота((IV)) — промежуточные вещества при получении азотной кислоты.