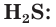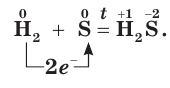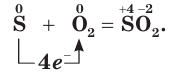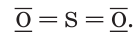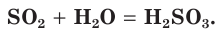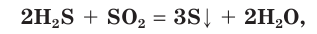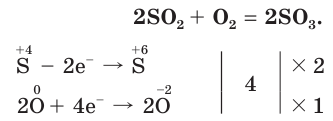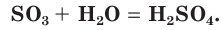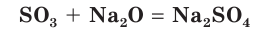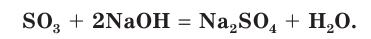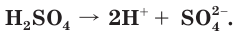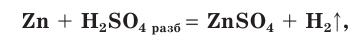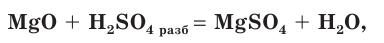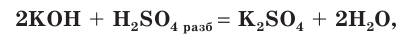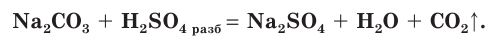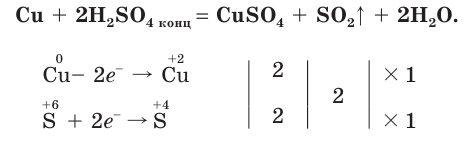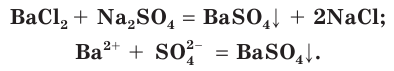Сероводород
Получение
сероводорода
- Получение из простых веществ:
S + Н2 = H2S
- Взаимодействие минеральных кислот и сульфидов металлов, расположенных в ряду напряжений левее железа:
FeS + 2HCI = H2S↑ + FeCl2
- Действие концентрированной H2SO4 (без избытка) на щелочные и щелочно-земельные металлы:
5H2SO4(конц.) + 8Na = H2S↑ + 4Na2SO4 + 4H2О
- Гидролиз некоторых сульфидов:
AI2S3 + 6Н2О = 3H2S↑ + 2Аl(ОН)3↓
- Нагревание парафина с серой:
C40H82
+ 41S = 41Н2S+40С
Видео Получение и обнаружение сероводорода
Физические
свойства и строение сероводорода
Сероводород H2S – это бинарное летучее водородное соединение соединение с серой. H2S
— бесцветный ядовитый газ, с неприятным удушливым
запахом тухлых яиц. При концентрации > 3 г/м3 вызывает смертельное отравление.
Сероводород тяжелее воздуха и легко конденсируется в бесцветную жидкость. Растворимость в воде H2S при обычной температуре составляет 2,5.
В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода представляет собой сцепленные между собой атомы H-S-H с валентным углом 92,1о.
Качественная реакция для обнаружения сероводорода
Для
обнаружения анионов S2- и сероводорода используют
реакцию газообразного H2S с Pb(NO3)2:
H2S + Pb(NO3)2 = 2HNO3 + PbS↓ черный
осадок.
Влажная бумага, смоченная в растворе Pb(NO3)2 чернеет в присутствии H2S из-за получения черного осадка PbS.
Химические свойства серы
H2S является сильным восстановителем
При взаимодействии H2S с окислителями образуются различные вещества — S, SО2, H2SO4
- Окисление кислородом воздуха:
2H2S + 3О2(избыток) = 2SО2↑ + 2Н2О
2H2S + О2(недостаток) = 2S↓ + 2Н2О
- Окисление галогенами:
H2S + Br2 = S↓ + 2НВr
H2S + Cl2 → 2HCl + S↓
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
- Взаимодействие с кислотами-окислителями:
3H2S + 8HNО3(разб.) = 3H2SO4 + 8NO + 4Н2О
H2S + 8HNО3(конц.) = H2SO4 + 8NО2↑ + 4Н2О
H2S + H2SO4(конц.) = S↓ + SО2↑ + 2Н2О
- Взаимодействие со сложными окислителями:
5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8Н2О
5H2S + 6KMnO4 + 9H2SO4 = 5SО2 + 6MnSO4 + 3K2SO4 + 14Н2О
H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
2H2S + SO2 = 2H2O + 3S
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
- Сероводородная кислота H2S двухосновная кислота и диссоциирует по двум ступеням:
1-я ступень:
H2S → Н+ + HS—
2-я ступень:
HS— → Н+ + S2-
H2S очень слабая
кислота, несмотря на это имеет характерные для кислот химические свойства. Взаимодействует:
- с активными металлами
H2S + Mg = Н2↑ + MgS
- с малоактивными металлами (Аg, Си, Нg) при совместном присутствии окислителей:
2H2S + 4Аg + O2 = 2Ag2S↓ + 2Н2O
- с основными оксидами:
H2S + ВаО = BaS + Н2O
- со щелочами:
H2S + NaOH(недостаток) = NaHS + Н2O
H2S + 2NaOH(избыток) → Na2S + 2H2O
- с аммиаком:
H2S + 2NH3(избыток) = (NH4)2S
- с некоторыми солями сильных кислот, если образующийся сульфид металла нерастворим в воде и в сильных кислотах:
CuSO4 + H2S = CuS↓ + H2SO4
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Реакция
с нитратом свинца в растворе – это качественная реакция
на сероводород и сульфид-ионы.
Видео Взаимодействие сероводорода с нитратом свинца
Сульфиды
Получение сульфидов
- Непосредственно из простых веществ:
S + Fe → FeS
S + Mg → MgS
S + Ca → CaS
- Взаимодействие H2S с растворами щелочей:
H2S + 2NaOH = 2H2O + Na2S
H2S + NaOH = H2O + NaHS
- Взаимодействие H2S или (NH4)2S с растворами солей:
H2S + CuSO4 = CuS↓ + H2SO4
H2S + 2AgNO3 = Ag2S↓ + 2HNO3
Pb(NO3)2 + Н2S → PbS↓ + 2НNO3
ZnSO4 + Na2S → ZnS↓ + Na2SO4
- Восстановление сульфатов при прокаливании с углем:
Na2SO4 + 4С = Na2S + 4СО
Физические свойства сульфидов
Сульфиды – это бинарные соединения серы с элементами с меньшей электроотрицательностью, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
По растворимости
в воде и кислотах сульфиды классифицируют
на:
- растворимые в воде — сульфиды щелочных металлов и аммония;
- нерастворимые в воде, но растворимые в минеральных кислотах — сульфиды металлов, расположенных до железа в ряду активности (белые и цветные сульфиды ZnS, MnS, FeS, CdS);
- нерастворимые ни в воде, ни в минеральных кислотах — черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS)
- гидролизуемые водой — сульфиды трехвалентных металлов (алюминия и хрома (III))
По цвету сульфиды можно разделить на:
- Чёрные – HgS, Ag2S, PbS, CuS, FeS,
NiS; - Коричневые – SnS, Bi2S3;
- Оранжевые – Sb2S3, Sb2S5;
- Жёлтые – As2S3, As2S5,
SnS2, CdS; - Розовые — MnS
- Белые – ZnS, Al2S3, BaS,
CaS;
Химические свойства сульфидов
Обратимый гидролиз сульфидов
- Хорошо растворимыми в воде являются сульфиды щелочных металлов и аммония, но в водных растворах они в значительной степени подвергаются гидролизу. Реакция среды — сильнощелочная:
K2S + H2O ⇄ KHS + KOH
S2- + H2O → HS— + ОН—
- Сульфиды щелочно-земельных металлов и Mg, при взаимодействии с водой подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
2CaS + 2НОН
= Ca(HS)2 + Са(ОН)2
При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
HS— + H2O → H2S↑ + ОН—
Необратимый
гидролиз сульфидов
- Сульфиды некоторых металлов (Cr2S3, Fe2S3, Al2S3) подвергаются необратимому гидролизу, полностью разлагаясь в водных растворах:
Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
Нерастворимые
сульфиды гидролизу не подвергаются
NiS + HСl ≠
- Некоторые из сульфидов растворяются в сильных кислотах:
FeS + 2HCI =
FeCl2 + H2S↑
ZnS + 2HCI =
ZnCl2 + H2S↑
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
CuS + 4H2SO4(конц. гор.) → CuSO4 + 4SO2 + 4H2O
MnS + 3HNO3 = MnSO4 + 8NO2 + 4H2O
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
- Сульфиды обладают восстановительными свойствами и вступают в реакции с окислителями:
PbS + 4H2O2 → PbSO4 + 4H2O
СuS + Cl2 → CuCl2 + S
-
Окислительный обжиг сульфидов является
важной стадией переработки сульфидного сырья в различных производствах
2ZnS + 3O2 = 2ZnO + 2SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
2CuS + 3O2 → 2CuO + 2SO2
2Cr2S3 + 9O2 → 2Cr2O3 + 6SO2
Взаимодействия
сульфидов с растворимыми солями свинца, серебра, меди являются качественными на ион S2−:
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Na2S + 2AgNO3 → Ag2S↓ + 2NaNO3
Na2S + Cu(NO3)2 → CuS↓ + 2NaNO3
Оксид серы
(IV), диоксид серы, сернистый газ, сернистый ангидрид (SO2)
Способы получения сернистого газа
- Окисление серы, сероводорода и сульфидов кислородом воздуха:
S + O2 → SO2
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
- Действие высокой температуры на сульфиты (термическое разложение):
CaSO3 = СаО + SO2↑
- Действие сильных кислот на сульфиты:
Na2SO3 + 2HCl = SO2 + Н2O + 2NaCI
- Взаимодействие концентрированной H2SO4 с восстановителями, например с неактивными металлами:
2H2SO4 + Сu = SO2↑ + CuSO4 + 2Н2O
Физические
свойства сернистого газа
При обычной температуре SO2 — газ с резким запахом без цвета. В воде растворим хорошо — при 20°С в 1 л воды растворяется 40 л SO2.
Химические свойства сернистого газа
SO2 – типичный кислотный оксид. За счет того, что сера находится в промежуточной степени окисления (+4) SO2 может проявлять свойства как окислителя так и восстановителя.
- При растворении в воде SO2 частично соединяется с молекулами воды с образованием слабой сернистой кислоты.
SO2 + H2O ↔ H2SO3
- Как
кислотный оксид, SO2 вступает
в реакции с щелочами и оксидами щелочных и щелочноземельных металлов:
SO2 + СаО = CaSO3
SO2 + Na2O → Na2SO3
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Н2O + Na2SO3
- При взаимодействии с окислителями SO2 проявляет восстановительные свойства. При этом степень окисления серы повышается:
2SO2 + O2 ↔ 2SO3
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
SO2 + 2HNO3 → H2SO4 + 2NO2
SO2 + O3 → SO3 + O2
SO2 + PbO2 → PbSO4
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Обесцвечивание раствора перманганата калия KMnO4 является качественной реакцией для обнаружения сернистого газа и сульфит-иона
- SO2 проявляет окислительные свойства при взаимодействии с сильными восстановителями, восстанавливаясь чаще всего до свободной серы:
SO2 + 2Н2S → 3S↓ + 2H2O
SO2 + 2CO → S↓ +2СО2
SO2 + С → S↓ + СO2
Оксид серы (VI), триоксид серы, серный ангидрид (SO3)
Способы получения серного ангидрида
- SO3 можно получить из SO2 путем каталитического окисления последнего кислородом:
2SO2 + O2 ↔ 2SO3
- Окислением SO2 другими окислителями:
SO2 + O3 → SO3 + O2
SO2 + NO2 → SO3 + NO
- Разложением сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
Физические
свойства серного ангидрида
При обычных условиях SO3 представляет собой бесцветную жидкость с характерным резким
запахом. На воздухе SO3 «дымит» и сильно
поглощает влагу.
SO3 – тяжелее
воздуха, хорошо растворим в воде.
SO3 ядовит!
Химические свойства серного
ангидрида
Оксид серы (VI) – это кислотный оксид.
- Хорошо поглощает влагу и реагирует с водой образуя серную кислоту:
SO3 + H2O → H2SO4
- Как
кислотный оксид, SO3 взаимодействует с щелочами и
основными оксидами, образуются средние или кислые соли:
SO3 + 2NaOH(избыток) → Na2SO4 + H2O
SO3 + NaOH(избыток) → NaHSO4
SO3 + MgO → MgSO4 (при сплавлении):
SO3 + ZnO = ZnSO4
-
SO3 проявляет
сильные окислительные свойства, так
как сера в находится в максимальной степени окисления (+6).
Вступает в реакции с восстановителями:
SO3 + 2KI → I2 + K2SO3
3SO3 + H2S → 4SO2 + H2O
5SO3 + 2P → P2O5 + 5SO2
- При растворении в концентрированной
серной кислоте образует олеум (раствор
SO3 в H2SO4).
Сернистая кислота (H2SO3)
Способы
получения сернистой кислоты
При растворении в воде SO2 образует слабую сернистую кислоту, которая сразу частично разлагается:
SO2 + H2O ↔ H2SO3
Физические
свойства сернистой кислоты
Сернистая кислота H2SO3 – двухосновная кислородсодержащая кислота. При обычных условиях неустойчива.
Валентность серы
в сернистой кислоте равна IV, а степень окисления
+4.
Химические свойства сернистой кислоты
Общие свойства
кислот
- Сернистая кислота – слабая кислота, диссоциирует в две стадии. Образует два типа солей:
- кислые – гидросульфиты
H2SO3 ↔ HSO3— + H+
- средние – сульфиты
HSO3—↔ SO32- + H+
- Сернистая кислота самопроизвольно распадается на SO2 и H2O:
H2SO3 ↔ SO2 + H2O
Соли сернистой кислоты, сульфиты и гидросульфиты
Способы
получения сульфитов
Соли сернистой кислоты получаются при взаимодействии SO2 с щелочами и оксидами щелочных и щелочноземельных металлов:
SO2 + СаО = CaSO3
SO2 + Na2O → Na2SO3
SO2 + NaOH = NaHSO3
SO2 + 2NaOH = Н2O + Na2SO3
Физические
свойства сульфитов
Сульфиты
щелочных металлов и аммония растворимы в воде, сульфиты остальных металлов — нерастворимы
или не существуют.
Гидросульфиты
металлов хорошо растворимы в Н2O, а некоторые из
них, такие как Ca(HSO3)2 существуют
только в растворе.
Химические свойства сульфитов
Cернистая кислота – двухосновная, образует нормальные (средние) соли — сульфиты Mex(SO3)y и кислые соли — гидросульфиты Me(HSO3)x.
- Водные растворы сульфитов подвергаются гидролизу. Реакция среды – щелочная (окрашивают лакмус в синий цвет):
SO3— + Н2O = HSO3— + ОН—
Na2SO3 + Н2O = NaHSO3 + NaOH
Реакции, протекающие без изменения степени окисления:
- Реакция с сильными кислотами:
Na2SO3 + 2HCl = 2NaCl +
SO2↑ + Н2O
NaHSO3 + HCl = NaCl + SO2↑ + Н2O
- Термическое разложение сульфитов:
CaSO3 = СаО + SO2↑
- Нормальные сульфиты в водных растворах, при избытке SO2, переходят в гидросульфиты:
CaSO3 + SO2 + Н2O = Ca(HSO3)2
- Ионно-обменные реакции с другими солями, протекающие с образованием нерастворимых сульфитов:
Na2SO3 + ZnCl2 = ZnSO3↓ + 2NaCl
Окислительно-восстановительные реакции
Сульфиты, также как и SO2, могут быть как восстановителями, так и окислителями, т.к. атомы серы в анионах находятся в промежуточной степени окисления +4
- Окисление водных растворов сульфитов, и гидросульфитов до сульфатов:
Na2SO3 + Вr2 + Н2O = Na2SO4 + 2НВr
5K2SO3 + 2КМnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3Н2O
Na2SO3 + HNO3 = 2NaNO3 + SO2 + H2O
- Твердые сульфиты при хранении на воздухе также медленно окисляются до сульфатов:
2Na2SO3 + O2 = 2Na2SO4
- При нагревании сухих сульфитов с активными восстановителями (С, Mg, Al, Zn) сульфиты превращаются в сульфиды:
Na2SO3 + ЗС = Na2S + ЗСО
- При нагревании сухих сульфитов до высоких температур сульфиты диспропорционируют, превращаются в смесь сульфатов и сульфидов:
4K2SO3 = 3K2SO4 + K2S
Серная кислота (H2SO4)
Способы
получения серной кислоты
В промышленности серную кислоту производят из серы, сульфидов
металлов, сероводорода и др.
Наиболее часто серную кислоту получают из пирита FeS2.
Основные стадии получения серной кислоты включают:
1.Обжиг пирита в кислороде в печи для обжига с получением сернистого газа:
4FeS2 +
11O2 → 2Fe2O3 +
8SO2 + Q
2. Очистка полученного сернистого газа от примесей в циклоне, электрофильтре.
3. Осушка сернистого газа в сушильной башне
4. Нагрев очищенного газа в теплообменнике.
5. Окисление сернистого газа в серный ангидрид в контактном аппарате:
2SO2 + O2 ↔ 2SO3 + Q
6. Поглощение серного ангидрида серной кислотой в поглотительной башне – получение олеума.
Физические
свойства, строение серной кислоты
При обычных условиях серная кислота – тяжелая бесцветная маслянистая жидкость, хорошо растворимая в воде. Максимальная плотность равна 1,84 г/мл
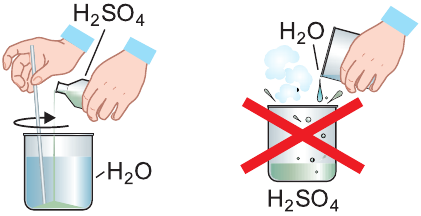
При растворении серной кислоты в воде выделяется большое количество теплоты. Поэтому, по правилам безопасности в лаборатории при приготовлении разбавленного раствора серной кислоты во избежание разбрызгивания необходимо наливать серную кислоту в воду тонкой струйкой по стеклянной палочке при постоянном перемешивании. Но не наоборот!
Валентность серы в серной кислоте равна VI.
Качественные
реакции для обнаружения серной кислоты и сульфат ионов
Для обнаружения сульфат-ионов используют реакцию с растворимыми солями бария. В результате взаимодействия, образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видео Взаимодействие хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион).
Химические свойства серной кислоты
Серная кислота — сильная двухосновная кислота, образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
- Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени и достаточно по второй ступени:
H2SO4 ⇄ H+ + HSO4–
HSO4– ⇄ H+ + SO42–
Характерны все свойства кислот:
- Реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами и аммиаком:
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
H2SO4 + NH3 → NH4HSO4
- Вытесняет более слабые кислоты из их солей в растворе (карбонаты, сульфиды и др.) и летучие кислоты из их солей (кроме солей HBr и HI):
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
- Концентрированная серная кислота реагирует с твердыми солями, например нитратом натрия, хлорида натрия.
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
- Вступает в обменные реакции с солями:
H2SO4 + BaCl2 → BaSO4 + 2HCl
- Взаимодействует с металлами:
Разбавленная серная кислота взаимодействует с металлами, расположенными в ряду напряжения металлов до водорода. В результате реакции образуются соль и водород:
H2SO4(разб.) + Fe → FeSO4 + H2
H2SO4 + Zn = ZnSO4
+ H2
Концентрированная серная кислота — сильный окислитель. Реакция с металлами протекает без вытеснения водорода из кислоты. В зависимости от активности металла образуются различные продукты реакции:
- Активные металлы и цинк при обычной температуре с концентрированной серной кислотой образуют соль, сероводород (или серу) и воду:
H2SO4 + Na = Na2SO4 + Н2S↑ + H2O
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
- Металлы средней активности с концентрированной H2SO4 образуют соль, серу и воду:
4H2SO4 + 3Mg → 3MgSO4 + S + 4H2O
-
Такие металлы, как железо Fe,
алюминий Al, хром Cr пассивируются концентрированной
серной кислотой на холоде. При нагревании,
при удалении оксидной пленки реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2 (SO4)3 + Н2S↑ + 6H2O
- Неактивные металлы восстанавливают концентрированную серную кислоту до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
- В реакциях с неметаллами концентрированная серная кислота также проявляет окислительные свойства:
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O (комнатная температура)
H2SO4(конц.) + H2S = S↓ + SО2↑ + 2Н2О (при нагревании)
H2SO4(конц.) + 2HBr = Br2 + SO2 + 2H2O
- Концентрированная серная кислота широко используется в химических процессах как водоотнимающий агент, т.к. проявляет сильное водоотнимающее действие. В органической химии ее используют при получении спиртов, простых и сложных эфиров, альдегидов и т.д.
Соли серной кислоты, сульфаты, гидросульфаты
Способы
получения солей серной кислоты
Сульфаты можно получить при взаимодействии серной кислоты с металлами,
оксидами, гидроксидами (см. Химические свойства серной кислоты). А также при
взаимодействии с другими солями, если продуктом реакции является нерастворимое
соединение.
Физические
свойства солей серной кислоты
Кристаллы разного цвета. Многие средние и кислые сульфаты растворимы
в воде. Плохо растворяются или не растворяются в воде сульфаты многозарядных
щёлочноземельных металлов (BaSO4, RaSO4), сульфаты лёгких
щёлочноземельных металлов (CaSO4, SrSO4) и сульфат свинца.
Средние сульфаты щелочных металлов термически устойчивы. Кислые
сульфаты щелочных металлов при нагревании разлагаются.
Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова
соль
CaSO4 ∙ 2H2O − гипс
2CaSO4 xH2O –
алебастр
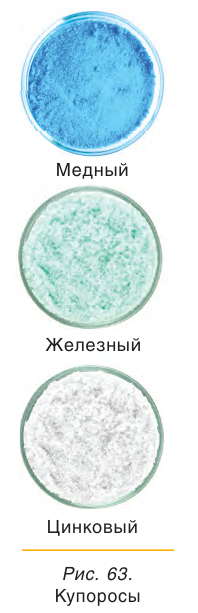
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Na2CO3 ∙ 10H2O −
кристаллическая сода
KАl(SO4)2 x 12H2O
– алюмокалиевые квасцы.
Химические свойства солей серной кислоты
Разложение сульфатов на различные классы соединений в зависимости от металла, входящего в состав соли.
- Сульфаты щелочных металлов плавятся без разложения.
- Кислые сульфаты щелочных металлов разлагаются с отщеплением воды:
2KHSO4 → K2S2O7
+ H2O↑.
- Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4
= ZnO + SO3
FeSO4
= 2Fe2O3 + 4SO2 + O2
2CuSO4 → 2CuO + SO2 + O2 (SO3)
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Cr2(SO4)3 → 2Cr2O3 + 6SO2 + 3O2
- Сульфаты тяжёлых или малоактивных металлов разлагаются с образованием металла и кислорода:
HgSO4 = Hg + SO2 + O2
- Некоторые сульфаты проявляют окислительные свойства и вступают в реакции с простыми веществами:
CaSO4 +
C = CaO + SO2 + CO
BaSO4 +
4C = BaS + 4CO
Сера распространена в земной коре, среди других элементов занимает шестнадцатое место. Она встречается как в свободном состоянии, так и в связанном виде. Неметаллические свойства характерны для этого химического элемента. Ее латинское название «Sulfur», обозначается символом S. Элемент входит в состав различных ионов соединений, содержащих кислород и/или водород, образует много веществ, относящихся к классам кислот, солей и несколько окислов, каждый из которых может быть назван оксид серы с добавлением символов, обозначающих валентность. Степени окисления, которые она проявляет в различных соединениях +6, +4, +2, 0, −1, −2. Известны окислы серы с различной степенью окисления. Самые распространенные — это диоксид и триоксид серы. Менее известными являются монооксид серы, а также высшие (кроме SO3) и низшие окислы этого элемента.
Монооксид серы
Неорганическое соединение, называемое оксид серы II, SO, по внешнему виду это вещество является бесцветным газом. При контакте с водой он не растворяется, а реагирует с ней. Это очень редкое соединение, которое встречается только в разреженной газовой среде. Молекула SO термодинамически неустойчива, превращается изначально в S2O2, (называют disulfur газ или пероксид серы). Из-за редкого появления монооксида серы в нашей атмосфере и низкой стабильности молекулы трудно в полной мере определить опасности этого вещества. Но в сконденсированном или более концентрированном виде окисел превращается в пероксид, который является относительно токсичным и едким. Это соединение также легко воспламеняется (напоминает этим свойством метан), при сжигании получается диоксид серы — ядовитый газ. Оксид серы 2 был обнаружен около Ио (одного из спутников Юпитера), в атмосфере Венеры и в межзвездной среде. Предполагается, что на Ио он получается в результате вулканических и фотохимических процессов. Основные фотохимические реакции выглядят следующим образом: O + S2 → S + SO и SO2 → SO + O.
Сернистый газ
Оксид серы IV, или двуокись серы (SO2) является бесцветным газом с удушливым резким запахом. При температуре минус 10 С он переходит в жидкое состояние, а при температуре минус 73 С затвердевает. При 20С в 1 литре воды растворяется около 40 объемов SO2.
Этот оксид серы, растворяясь в воде, образует сернистую кислоту, так как является ее ангидридом: SO2 + H2O ↔ H2SO3.
Он взаимодействует с основаниями и основными оксидами: 2NaOH + SO2 → Na2SO3 + H2O и SO2 + CaO → CaSO3.
Для сернистого газа характерны свойства и окислителя, и восстановителя. Он окисляется кислородом воздуха до серного ангидрида в присутствии катализатора: SO2 + O2 → 2SO3. С сильными восстановителями, такими как сероводород, играет роль окислителя: H2S + SO2 → S + H2O.
Сернистый газ в промышленности используют в основном для получения серной кислоты. Диоксид серы получают сжиганием серы или железного колчедана: 11O2 + 4FeS2 → 2Fe2O3 + 8SO2.
Серный ангидрид
Оксид серы VI, или трехокись серы (SO3) является промежуточным продуктом и самостоятельного значения не имеет. По внешнему виду это бесцветная жидкость. Она кипит при температуре 45 С, а ниже 17 С превращается в белую кристаллическую массу. Этот высший оксид серы (со степенью окисления атома серы + 6) отличается крайней гигроскопичностью. С водой он образует кислоту серную: SO3 + H2O ↔ H2SO4. Растворяясь в воде, выделяет большое количество тепла и, если прибавлять не постепенно, а сразу большое количество оксида, то может произойти взрыв. Триоксид серы хорошо растворяется в концентрированной кислоте серной с образованием олеума. Содержание SO3 в олеуме достигает 60 %. Для этого соединения серы характерны все свойства кислотного оксида.
Высшие и низшие оксиды серы
Высшие оксиды серы представляют собой группу химических соединений с формулой SO3 + х, где х может быть 0 или 1. Мономерный окисел SO4 содержат пероксогруппу (O-O) и характеризуется, как и окисел SO3, степенью окисления серы +6. Этот оксид серы может быть получен при низких температурах (ниже 78 К) в результате реакции SO3 и атомарного кислорода или фотолизе SO3 в смеси с озоном.
Низшие оксиды серы представляют собой группу химических соединений, в которую входят:
- SO (оксид серы и его димер S2O2);
- S2O;
- монооксиды серы SnO (представляют собой циклические соединения, состоящие из колец, образованных атомами серы, при этом n может быть от 5 до 10);
- S7O2;
- полимерные оксиды серы.
Интерес к низшим оксидам серы увеличился. Это связано с необходимостью изучения их содержания в наземной и внеземной атмосферах.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 марта 2020 года; проверки требуют 32 правки.
Содержание:
Сера — химический элемент и простое вещество:
Сера, так же как и кислород, является элементом VIA-группы периодической системы, она находится в третьем периоде. Рассмотрим свойства этого химического элемента и образуемых им простых веществ.
Сера в природе
Массовая доля серы в земной коре составляет около 0,05 %, она является распространенным элементом. В природе сера встречается как в виде самородной серы (рис. 49), так и в составе различных минералов и горных пород (рис. 50): сульфидов
Строение атома серы
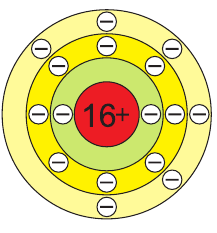
В атоме серы 16 электронов (рис. 51), из них 6 электронов — на внешнем электронном слое:
В соединениях с металлами и водородом сера обычно проявляет степень окисления, равную –2, например 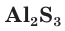
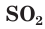
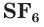
Строение и физические свойства простых веществ
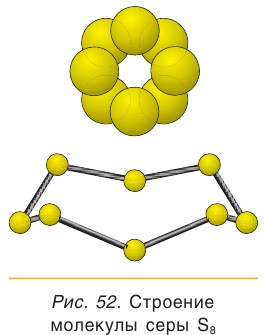
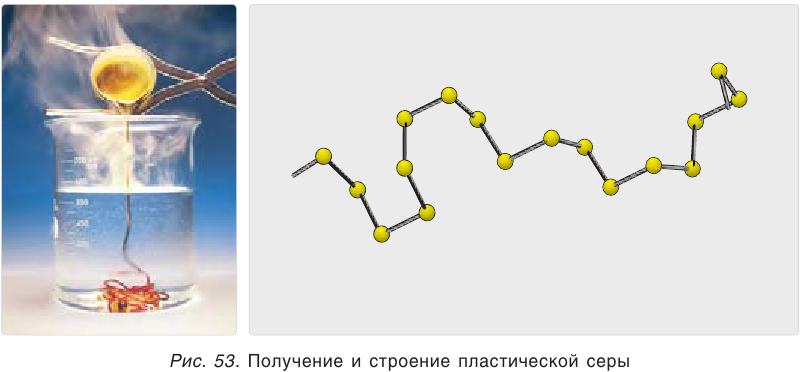
Простое вещество сера существует в виде нескольких аллотропных модификаций, отличающихся составом и строением. Кристаллическая сера — твердое, легкоплавкое вещество желтого цвета. Кристаллическая сера имеет молекулярное строение — состоит из циклических молекул 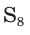
Сера в воде не растворяется и даже не смачивается ею. Если бросить в воду немного порошка серы, то частички серы не осядут на дно, а будут плавать на поверхности воды, образуя желтую пленку (рис. 54).
Химические свойства серы
Сера взаимодействует со многими простыми и сложными веществами, хотя ее реакционная способность ниже, чем у кислорода.
Сера реагирует со многими металлами, кроме золота и платины, проявляя при этом окислительные свойства, например (рис. 55):
Продуктами такого взаимодействия являются сульфиды металлов.
Реакция с серой является основой способа удаления и обезвреживания разлитой ртути, например, из разбитого термометра. Ртуть, которая попала в щели и другие труднодоступные места, засыпают порошком серы. Такой процесс называют демеркуризацией.
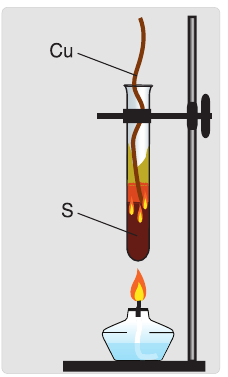
Окислительные свойства серы проявляются и в реакциях с некоторыми неметаллами. Сера взаимодействует с водородом при нагревании, образуя летучее соединение — сероводород
Сероводород — бесцветный газ с резким запахом тухлых яиц. Правильнее сказать, что это тухлые яйца пахнут сероводородом, так как этот газ образуется при гниении растительных и животных остатков. Сероводород ядовит. Поэтому его вдыхание может привести к тяжелому отравлению. Однако в небольших количествах сероводород оказывает целебное действие. Он содержится в водах некоторых минеральных источников.
Сера окисляется кислородом, проявляя при этом восстановительные свойства (рис. 56):
Применение серы
Больше половины добытой серы расходуется для получения серной кислоты, одного из самых важных химических продуктов. Нагреванием серы с каучуком получают резину. Как горючее вещество сера входит в состав черного пороха, спичечных головок. Широко применяется сера в сельском хозяйстве для борьбы с вредителями растений. В медицине серу используют для лечения кожных заболеваний.
Сера в соединениях с металлами и менее электроотрицательными элементами проявляет степень окисления –2, а в соединениях с более электроотрицательными элементами — +4 и +6.
Простое вещество сера существует в виде нескольких аллотропных модификаций.
Сера при взаимодействии с металлами, водородом и некоторыми неметаллами ведет себя как окислитель.
В реакции с кислородом сера является восстановителем.
Оксид серы(IV) и оксид серы(VI)
Сера образует с кислородом два оксида: оксид серы(IV), или сернистый газ, 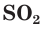
Оксид серы(IV)
Оксид серы(IV) — это бесцветный газ с характерным запахом. Графическая формула его молекулы:
Оксид серы(IV) является кислотным оксидом, проявляя все соответствующие химические свойства: взаимодействует с водой, щелочами и осно Ђвными оксидами.
При растворении оксида серы(IV) в воде образуется слабая двухосновная сернистая кислота:
В этом легко убедиться по изменению окраски лакмуса с фиолетовой на красную в водном растворе оксида серы(IV). Сернистая кислота неустойчива и существует только в растворе. Соли этой кислоты называются сульфитами.
Сернистый газ обладает бактерицидным действием. Поэтому его широко используют для обработки овощехранилищ, плодов и фруктов, чтобы предотвратить их загнивание. Сернистый газ, как и соли сернистой кислоты, применяют для отбеливания соломы, шерсти, бумаги, тканей.
В оксиде серы(IV) сера находится в промежуточной степени окисления +4. Поэтому сернистый газ может проявлять как окислительные свойства, реагируя с восстановителями:
так и восстановительные свойства, взаимодействуя с сильными окислителями:
Реакция взаимодействия сернистого газа с сероводородом — один из важных процессов, протекающих в природе. При извержении вулканов выделяются SO2 и H2S, а при их взаимодействии образуется сера в виде кристаллов. На рисунке вы видите извержение вулкана Килауэа.
Оксид серы(VI)
Оксид серы(VI) SO3 представляет собой бесцветную жидкость, которая при температуре ниже 17 °С превращается в белое твердое вещество. Графическая формула его молекулы представлена на рисунке 58.
Это типичный кислотный оксид. Он реагирует с водой с выделением теплоты, образуя серную кислоту:
Оксид серы(VI) реагирует с основными оксидами:
и щелочами:
Оксид серы(VI) применяется для промышленного получения серной кислоты.
Попадание оксидов серы в атмосферу при сжигании топлива приводит к образованию в облаках кислот и выпадению кислотных дождей. Они губительно действуют на все живое: разрушается почва, изменяется состав почвенных организмов, гибнут ценные виды рыб, исчезает растительность (см. рис.).
Оксид серы(IV) и оксид серы(VI) представляют собой типичные кислотные оксиды.
При взаимодействии с водой оксид серы(IV) и оксид серы(VI) образуют соответственно сернистую и серную кислоты.
Серная кислота
Серная кислота 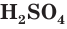
Строение молекулы серной кислоты
Модель молекулы серной кислоты представлена на рисунке 59. В молекуле 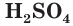
Связи 
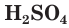
Физические свойства серной кислоты
Чистая серная кислота — бесцветная маслянистая нелетучая жидкость без запаха, примерно в 2 раза тяжелее воды. Она смешивается с водой в любых соотношениях. При приготовлении водных растворов серной кислоты выделяется большое количество теплоты, происходит разогревание смеси, которое может сопровождаться ее разбрызгиванием.
Помните!
Кислоту осторожно тонкой струйкой вливают в воду при непрерывном перемешивании раствора.
Обычно водный раствор серной кислоты с массовой долей 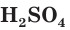
Концентрированная серная кислота используется как водоотнимающий агент, например для осушения газов (см. рис. слева).
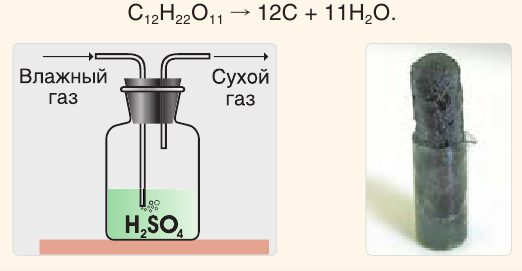
Она способна отнимать воду и у сложных веществ, в состав которых входят водород и кислород. Так, под действием концентрированной серной кислоты сахар обугливается и реакционная масса чернеет и вспучивается (см. рис. справа):
Химические свойства серной кислоты
Разбавленная серная кислота, как и соляная, проявляет все характерные для кислот свойства. Она изменяет окраску индикаторов: лакмус и метилоранж в растворе 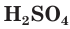
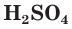
являясь окислителем за счет ионов водорода Н+ .
Разбавленная серная кислота реагирует также с оксидами металлов:
с основаниями:
с солями:
Концентрированная серная кислота по своим свойствам отличается от разбавленной. Она является более сильным окислителем за счет атомов серы, имеющих степень окисления +6. Концентрированная 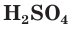
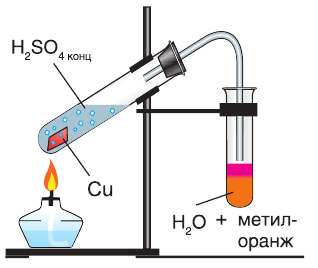
Продемонстрируем действие концентрированной серной кислоты на медь. При приливании концентрированной серной кислоты в пробирку с медью и нагревании смеси раствор окрашивается в серовато-синий цвет и наблюдается выделение газа 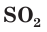
Железо, алюминий и некоторые другие металлы при обычных условиях не реагируют с концентрированной серной кислотой из-за образования защитной пленки на поверхности металла. Поэтому концентрированную серную кислоту можно хранить и перевозить в стальных цистернах (рис. 61).
Концентрированная серная кислота способна взаимодействовать с простыми веществами — неметаллами, а также со многими сложными, в том числе органическими соединениями. Серная кислота обугливает бумагу и древесину, разрушает одежду и кожу — это очень опасное вещество, способное вызывать труднозаживающие химические ожоги.
- Серная кислота — бесцветная, маслянистая жидкость. В водных растворах является сильным электролитом.
- Разбавленная серная кислота проявляет все характерные для кислот свойства: взаимодействует с металлами, стоящими в ряду активности до водорода, с выделением водорода; с оксидами металлов; с основаниями; с солями.
- При взаимодействии концентрированной серной кислоты с медью выделяется оксид серы(IV).
Сульфаты — соли серной кислоты
Серная кислота — один из главных продуктов химической промышленности. Об этом говорят и масштабы мирового производства, достигающие 200 млн т в год.
Соли серной кислоты
Как вы уже знаете из предыдущего параграфа, соли серной кислоты — сульфаты могут образовываться при ее взаимодействии с металлами, оксидами металлов, основаниями и солями.
Большинство сульфатов хорошо растворимы в воде. Растворимые сульфаты, главным образом сульфат магния, содержатся в морской воде и обуславливают ее горький вкус.
Многие сульфаты способны связывать воду, образуя кристаллогидраты. Кристаллогидраты солей серной кислоты часто называют купоросами, например: 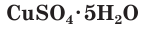
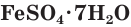
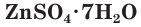
Плохо растворимы сульфаты металлов IIА-группы (кроме сульфатов бериллия и магния), меньше других растворим сульфат бария. При добавлении раствора соли бария, например хлорида бария 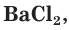
Поэтому для обнаружения серной кислоты и ее солей в водных растворах используют растворимые соли бария.
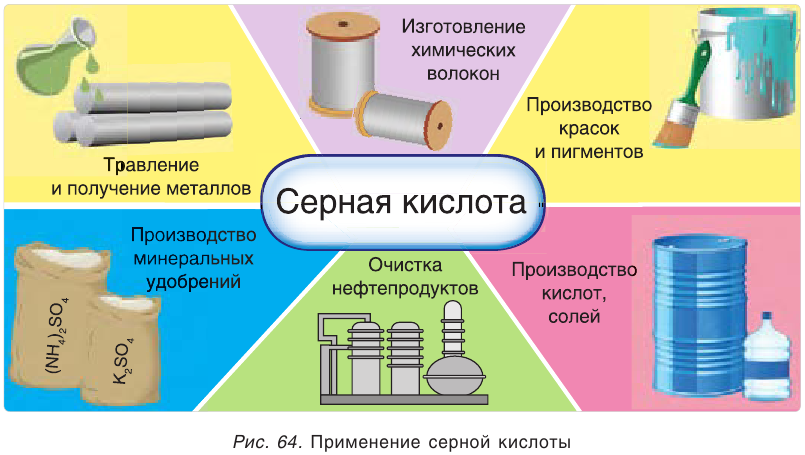
Применение серной кислоты и сульфатов
Серная кислота — один из важнейших продуктов, широко используемых в различных областях промышленности (рис. 64). Основными ее потребителями являются производства минеральных удобрений, соляной, уксусной и других кислот, моющих средств, взрывчатых веществ, красителей, лекарств. Серная кислота применяется также в металлургии, для очистки нефтепродуктов, в качестве электролита в кислотных аккумуляторах и т. д.
Соли серной кислоты используются в качестве минеральных удобрений, в строительстве, в медицине, для борьбы с вредителями растений, в производстве соды и стекла. Например, кристаллогидраты сульфата меди(II) 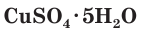
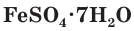
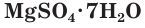
Природный гипс 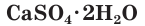
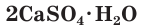
- Серная кислота — один из главных продуктов химической промышленности.
- Большинство сульфатов хорошо растворимы в воде.
- Для обнаружения серной кислоты и ее солей в водных растворах используют растворимые соли бария.
Как пишется оксид серы 6?
Оксид серы(VI)
| Оксид серы(VI) | |
|---|---|
| Систематическое наименование | Оксид серы (VI) |
| Хим. формула | SO3 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
Какие свойства у оксида серы 4?
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1 объёме H2O растворяется 40 объёмов SO2 при н. у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип.
Как можно получить оксид серы 4?
Сернистый газ, или оксид серы(IV), образуется при сгорании серы, сероводорода или обжиге сульфидов: 4Fe S 2 + 11O 2 = 2Fe 2 O 3 + 8S O 2 ↑ . При обычных условиях это бесцветный газ с характерным запахом. Ядовит.
Как получить серный ангидрид?
сернистый ангидрид получают в процессе сжигания серы в специальных печах; очистка диоксида серы от имеющихся примесей; окисление посредством применения катализатора; абсорбция триоксида серы с использованием воды.
Какой это оксид so2?
Окси́д се́ры(IV) (диокси́д се́ры, двуокись серы, серни́стый газ, серни́стый ангидри́д) — соединение серы с кислородом состава SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички).
Как пишется оксид?
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия.
Какая кислота соответствует оксиду серы 4?
Например, оксиду серы (IV) соответствует сернистая кислота H2SO3. 1.
Чем опасен оксид серы?
КАКИЕ ЗАБОЛЕВАНИЯ ВЫЗЫВАЕТ ИЛИ ОБОСТРЯЕТ ДИОКСИД СЕРЫ В ВОЗДУХЕ? По информации ВОЗ, воздействие диоксида серы в концентрациях выше ПДК может вызвать нарушение функций дыхания. Не исключено действие на слизистые оболочки, воспаление носоглотки, трахеи, бронхиты, кашель, хрипота и боль в горле.
Как получить оксид серы формула?
SO₂Оксид серы / Формула
Что нужно смешать чтобы получить оксид серы?
Oксид серы(VI) образуется при каталитическом окислении сернистого газа: 2SO 2 + O 2 ⇄ t , k 2S O 3 . При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты: S O 3 + H 2 O = H 2 S O 4 .
Как можно получить оксид серы 6?
Oксид серы(VI) образуется при каталитическом окислении сернистого газа: 2SO 2 + O 2 ⇄ t , k 2S O 3 . При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты: S O 3 + H 2 O = H 2 S O 4 .
Чем опасна сера в воздухе?
КАКИЕ ЗАБОЛЕВАНИЯ ВЫЗЫВАЕТ ИЛИ ОБОСТРЯЕТ ДИОКСИД СЕРЫ В ВОЗДУХЕ? По информации ВОЗ, воздействие диоксида серы в концентрациях выше ПДК может вызвать нарушение функций дыхания. Не исключено действие на слизистые оболочки, воспаление носоглотки, трахеи, бронхиты, кашель, хрипота и боль в горле.
Что значит so2?
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички).
Какой это оксид SO3?
Оксид серы (VI) (серный ангидрид, трёхокись серы, серный газ) SO3 — высший оксид серы. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом.
Как классифицировать оксиды?
Оксиды – бинарные неорганические соединения, в состав которых входит кислород. Оксиды подразделяют на основные и кислотные. Оксиды, которым соответствуют основания, называют основными. Оксиды, которым соответствуют кислоты, называют кислотными.
Как понять что вещество является оксидом?
Оксидом называется сложное вещество, состоящее из атомов двух элементов, один из которых — кислород. Поскольку кислород соединяется почти со всеми элементами, существуют оксиды как металлов, так и неметаллов. Оксиды металлов, подобно CuO, Fe2O3, СаО – твердые вещества.
Что называют кислотными оксидами?
Кисло́тные окси́ды (ангидри́ды) — солеобразующие оксиды неметаллов или переходных металлов в высоких степенях окисления (от +5 до +7). У всех кислотных оксидов есть соответствующая кислородсодержащая кислота.
| Оксид серы(IV) | |
 |
|
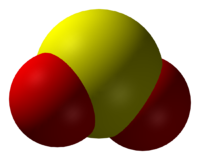 |
|
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(IV) |
| Химическая формула | SO2 |
| Отн. молек. масса | 64.054 а. е. м. |
| Молярная масса | 64.054 г/моль |
| Физические свойства | |
| Плотность вещества | 2,927 г/л г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −75,5 °C |
| Температура кипения | −10,01 °C |
| Химические свойства | |
| Растворимость в воде | 11,5 г/100 мл |
| Классификация | |
| номер CAS | [7446-09-5] |
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
- 1 Получение
- 2 Химические свойства
- 3 Применение
- 4 Физиологическое действие
- 4.1 Дополнительные сведения о токсичности
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ + Q.
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
Na2SO3 + H2SO4 → Na2SO4 + H2SO3.
Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑.
Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
2H2SO4 (конц.) + Cu → CuSO4 + SO2↑ + 2H2O.
Химические свойства
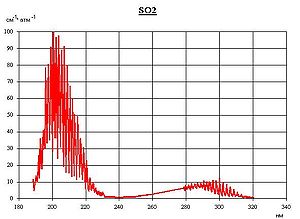
Спектр поглощения SO2 в ультрафиолетовом диапазоне
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
Последняя реакция является качественной реакцией на сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation.
2010.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 299.
Показано записей: 20.
1. Оксид серы(IV)
Брутто-формула:
O2S
CAS# 7446-09-5
Названия
Русский:
- Оксид серы(IV)(IUPAC) [Wiki]
- двуокись серы
- диоксид серы
- сернистый ангидрид
- сернистый газ
;
;
;
;
;
English:
- Caswell No. 813
- E 220
- EINECS:231-195-2
- Fermenicide liquid
- Fermenicide powder
- Fermenticide liquid
- Schwefeldioxid
- Sulfur dioxide(IUPAC) [Wiki]
- Sulfur dioxide (SO2)
- Sulfur oxide (SO2)
- Sulfur superoxide
- Sulfur(IV) oxide
- Sulfurous acid anhydride
- Sulfurous anhydride
- Sulfurous oxide
- Sulfuroxide
- Sulfursuperoxide (6CI)
- UN 1079
- sulphur dioxide
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
2. Оксид серы(VI)
Брутто-формула:
O3S
CAS# 7446-11-9
Названия
Русский:
- Оксид серы(VI) [Wiki]
- серный ангидрид
- серный газ
- треокись серы
- триоксид серы
;
;
;
;
;
English:
- 227692_ALDRICH
- 425478_ALDRICH
- AC1Q6YFD
- Sulfan
- Sulfite radical anion
- Sulfonylideneoxidane
- Sulfur trioxide(CAS) [Wiki]
- Sulfuric anhydride
- Sulphur trioxide
- UN 1829
- oxosulfane dioxide
;
;
;
;
;
;
;
;
;
;
;
3. Пиросульфурил хлористый
Брутто-формула:
Cl2O5S2
CAS# 7791-27-7
Названия
Русский:
- Пиросульфурил хлористый
- дисеры(VI) пентаоксид-дихлорид
- хлорангидрид пиросерной кислоты
;
;
;
English:
- Chlorosulfonic anhydride
- Disulfur pentoxydichloride
- Disulfuryl chloride
- PYROSULFURYL CHLORIDE
- Sulfur pentoxydichloride
- UN1817
;
;
;
;
;
;
Cl/S<_qq4O><_pp4O>/OS<_qq4O><_pp4O>Cl
4. метиловый спирт
Брутто-формула:
CH4O
CAS# 67-56-1
Названия
Русский:
- Метанол(IUPAC) [Wiki]
- гидроксид метила
- древесный спирт
- карбинол
- метилгидрат
- метиловый спирт
;
;
;
;
;
;
English:
- Colonial Spirit
- EINECS:212-378-6
- Hydroxymethane
- Methanol(IUPAC)(CAS) [Wiki]
- Methyl hydrate
- Methyl hydroxide
- Methylic alcohol
- Methylol
- Pyroxylic spirit
- Wood alcohol
- Wood naphtha
- Wood spirit
- carbinol
- methyl alcohol
;
;
;
;
;
;
;
;
;
;
;
;
;
;
$slope(55)H/C<_(A-160,w+)H><_(A-100,d+)H>-O/H
5. Этиленоксид
Брутто-формула:
C2H4O
CAS# 75-21-8
Названия
Русский:
- 1,2-эпоксиэтан
- Окись этилена(IUPAC) [Wiki]
- Этиленоксид
- оксиран
;
;
;
;
English:
- Ethylene oxide(IUPAC) [Wiki]
- Oxirane(CAS)
- dimethylene oxide
- epoxyethane
- oxacyclopropane
;
;
;
;
;
C_(x1.4)C_q3O_q3; H_(A-15,d-)#1_(A110,w+)H; H_(A-165,d-)#2_(A70,w+)H;
$L(1.4)C_(A0)C_q3O_q3; H_(x1)#1_p3H;H_(x-1)#2_q3H
6. Триметиленоксид
Брутто-формула:
C3H6O
Названия
Русский:
- Оксетан(IUPAC)
- Триметиленоксид
;
;
English:
- 1,3-epoxypropane
- 1,3-propylene oxide
- Oxetane(IUPAC)
- oxacyclobutane
- trimethylene oxide
;
;
;
;
;
H|C|C|H; H|C|$atomColor1(blue)O; H-#2-#6-H; H-#3-#O
7. Гексаметиленоксид
Брутто-формула:
C6H12O
Названия
Русский:
- Гексаметиленоксид
- Оксепан(IUPAC)
;
;
English:
- Oxepane
;
8. Вода
Брутто-формула:
H2O
CAS# 7732-18-5
Названия
Русский:
- Вода [Wiki]
- Оксид водорода(IUPAC)
;
;
English:
- Dihydrogen oxide
- Water(CAS) [Wiki]
- oxidane(IUPAC)
;
;
;
9. Углекислый газ
Брутто-формула:
CO2
Названия
Русский:
- Оксид углерода(IV)(IUPAC)
- Углекислый газ
- двуокись углерода
- диоксид углерода
- угольный ангидрид
;
;
;
;
;
English:
- Carbon dioxide
- Carbon oxide
- Carbon(IV) oxide
- Carbonic acid gas
- Carbonic anhydride
- Carbonic oxide
- Dry ice
;
;
;
;
;
;
;
10. Оксид фосфора(V)
Брутто-формула:
O10P4
Названия
Русский:
- Оксид фосфора(V)
- Пентаоксид фосфора
- пятиокись фосфора
- фосфорный ангидрид
;
;
;
;
English:
- Diphosphorus pentoxide
- Phosphoric anhydride
- Phosphoric oxide
- Phosphoric pentoxide
- Phosphorus oxide
- Phosphorus pentaoxide
- Phosphorus pentoxide
;
;
;
;
;
;
;
$slope(15)$L(1.5)O||P`/O|P:l`/O/O/P:rO«|O`_(A120)O|P<`/O_#l><O_#r>_(A120,N2)O
11. Гидроксид калия
Брутто-формула:
HKO
CAS# 1310-58-3
Названия
Русский:
- Гидроксид калия(IUPAC) [Wiki]
- Кали едкое
- гидроокись калия
- калия гидроксид
- каустический поташ
;
;
;
;
;
English:
- Caustic potash
- E525
- Potash lye
- Potassia
- Potassium hydrate
- Potassium hydroxide(IUPAC) [Wiki]
;
;
;
;
;
;
12. Гидроксид натрия
Брутто-формула:
HNaO
CAS# 1310-73-2
Названия
Русский:
- Гидроксид натрия(IUPAC) [Wiki]
- гидроокись натрия
- едкая щелочь
- едкий натр
- каустик
- каустическая сода
- натрия гидроксид
;
;
;
;
;
;
;
English:
- Ascarite
- Caustic soda
- E524
- Lye
- Sodium hydrate
- Sodium hydroxide(IUPAC) [Wiki]
- Sodium oxidanide
- White caustic
;
;
;
;
;
;
;
;
13. Гидроксид кальция
Брутто-формула:
H2CaO2
CAS# 1305-62-0
Названия
Русский:
- Гидроксид кальция(IUPAC) [Wiki]
- гашёная известь
- гидроокись кальция
- кальция гидроксид
;
;
;
;
English:
- Calcium hydroxide(IUPAC) [Wiki]
- Calcium(II) hydroxide
- E526
- Hydrated lime
- Milk of lime
- Pickling lime
- Slaked lime
;
;
;
;
;
;
;
$L(1.5)HO^-Ca^2+/0`HO^-
14. Оксид кальция
Брутто-формула:
CaO
CAS# 1305-78-8
Названия
Русский:
- Оксид кальция(IUPAC) [Wiki]
- кальция оксид
- окись кальция, негашёная и́звесть
;
;
;
English:
- Calcia
- Calciogreen
- Calcium oxide(IUPAC) [Wiki]
- Calciumoxide (CaO)
- EINECS:215-138-9
- Oxocalcium(IUPAC)
- Quicklime
- burnt lime
- unslaked lime
;
;
;
;
;
;
;
;
;
15. Оксид магния
Брутто-формула:
MgO
Названия
Русский:
- Жжёная магнезия
- Оксид магния(IUPAC)
- магния окись
- магния оксид
- периклаз
;
;
;
;
;
English:
- Magnesia
- Magnesium oxide(IUPAC)
- Periclase
;
;
;
16. Гидроксид магния
Брутто-формула:
H2MgO2
CAS# 1309-42-8
Названия
Русский:
- Гидроксид магния(IUPAC)
- магния гидроксид
;
;
English:
- Magnesium hydroxide(IUPAC)
- Magnesium hydroxide, (Mg(OH)2)(CAS)
- Milk of magnesia
;
;
;
H/O^-$L(1.4)hMg^++/hO^-$L()H
17. Гидроксид аммония
Брутто-формула:
H5NO
CAS# 1336-21-6
Названия
Русский:
- Аммония гидрооксид
- Гидрат аммиака(IUPAC) [Wiki]
- Гидроксид аммония
- аммиачная вода
- едкий аммиак
- едкий аммоний
;
;
;
;
;
;
English:
- Ammonium hydroxide [Wiki]
- E527
- EINECS:215-647-6
- ammonia liquor
- ammonia water
- ammonical liquor
- aqua ammonia
- aqueous ammonia
;
;
;
;
;
;
;
;
H/N^+<`|H><_(A80,w+)H>_(A15,d+)H`|0O`^-# -H
18. Оксид бора
Брутто-формула:
B2O3
CAS# 1303-86-2
Названия
Русский:
- Борный ангидрид
- Оксид бора [Wiki]
- ангидрид борной кислоты
;
;
;
English:
- Boracicanhydride
- Boria (B2O3)
- Boric acid (HBO2), anhydride
- Boric acid anhydride
- Boric acidanhydride
- Boric anhydride
- Boron trioxide [Wiki]
- Boron(III) oxide
- Boronsesquioxide
- EINECS:215-125-8
- Fused boricacid
- boria
- boric oxide
- boron oxide
- boron sesquioxide
- diboron trioxide
- oxo(oxoboranyloxy)borane(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
19. Диоксан
Брутто-формула:
C4H8O2
CAS# 123-91-1
Названия
Русский:
- 1,4-диоксан(IUPAC)
- Диоксан
- диэтилендиоксид
;
;
;
English:
- 1,4-Diethylene dioxide
- 1,4-Diethyleneoxide
- 1,4-Dioxacyclohexane(IUPAC)
- 1,4-Dioxan
- 1,4-Dioxane(IUPAC)
- Dioxane
- [1,4]Dioxane
- [6]-crown-2
- p-Dioxane
;
;
;
;
;
;
;
;
;
$slope(15)O<_(A-120)H><|H>/<`|H><H>_(A60)O_(A-165,W+)<`|H><_(A60,w1)H>_(A165)<|H><`H>_(W-)#1
20. Пероксид водорода
Брутто-формула:
H2O2
CAS# 7722-84-1
Названия
Русский:
- Пероксид водорода
- перекись водорода
;
;
English:
- Albone
- Dioxidane
- Hioxyl
- Hydrogen dioxide
- Hydrogen peroxide(IUPAC)
- Inhibine
- Oxidanyl
- Peroxaan
- Superoxol
- dihydrogen dioxide(IUPAC)
- hydroperoxide
- oxydol
- perhydrol
;
;
;
;
;
;
;
;
;
;
;
;
;
Оксид серы (IV) – это кислотный оксид. Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе:
S + O2 → SO2
2. Горение сульфидов и сероводорода:
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например, сульфит натрия взаимодействует с серной кислотой:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
4. Обработка концентрированной серной кислотой неактивных металлов.
Например, взаимодействие меди с концентрированной серной кислотой:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя.
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов.
Например, оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2 + 2NaOH(изб) → Na2SO3 + H2O
SO2(изб) + NaOH → NaHSO3
Еще пример: оксид серы (IV) реагирует с основным оксидом натрия:
SO2 + Na2O → Na2SO3
2. При взаимодействии с водой SO2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
SO2 + H2O ↔ H2SO3
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например, оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
2SO2 + O2 ↔ 2SO3
Сернистый ангидрид обесцвечивает бромную воду:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Азотная кислота очень легко окисляет сернистый газ:
SO2 + 2HNO3 → H2SO4 + 2NO2
Озон также окисляет оксид серы (IV):
SO2 + O3 → SO3 + O2
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Оксид свинца (IV) также окисляет сернистый газ:
SO2 + PbO2 → PbSO4
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
SO2 + 2Н2S → 3S + 2H2O
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
SO2 + С → S + СO2
Таблица оксидов.
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
CO2 (оксид углерода (IV), диоксид углерода, углекислый газ), C3O2 (диоксид триуглерода), (C3O2)n (политрикарбодиоксид), C5O2 (1,2,3,4-пентатетраен-1,5-дион), C6O6 (диангидрид этилентетракарбоновой кислоты) C12O9 (меллитовый ангидрид), C12O12 (гексагидроксибензол трисоксалат), и др. |
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
NO (оксид азота (II), мон(о)оксид азота, окись азота, нитрозил-радикал), N2O3 (оксид азота (III), азотистый ангидрид, сесквиоксид азота), NO2 (диоксид азота, оксид азота (IV), двуокись азота), N2O5 (оксид азота (V), пентаоксид азота, пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид), N2O4 (димер диоксида азота, тетраоксид диазота, азотный тетраоксид), и др. |
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния),
SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
P4O2 (диоксид тетрафосфора), P2O3 или P4O6 (оксид фосфора (III), фосфористый ангидрид, гексаоксид тетрафосфора), P4O8 (оксид фосфора (IV), октаоксид тетрафосфора), P2O5 или P4O10 (оксид фосфора (V), пентаоксид фосфора, фосфористый ангидрид, гексаоксид тетрафосфора) |
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы),
SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
ClO2 (диоксид хлора, оксид хлора (IV), двуокись хлора), ClOClO3 (перхлорат хлора ), Cl2O6 (дихлоргексаоксид, оксид хлора (V, VII), перхлорат хлорила), Cl2O7 (оксид хлора (VII), дихлорогептаоксид, хлорный ангидрид), и др. |
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)),
Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
V2O3 (оксид ванадия (III), трехокись ванадия), VO2 (оксид ванадия (IV), диоксид ванадия, двуокись ванадия), V2O5 (оксид ванадия (V), пентаоксид диванадия) |
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
Cr2O3 (оксид хрoма (III), сесквиоксид хрома, хромовая зелень, эсколаит), CrO2 (оксид хрома (IV), диоксид хрома, двуокись хрома), CrO3 (оксид хрома (VI), триоксид хрома, трёхокись хрома, хромовый ангидрид) |
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
Mn3O4 (оксид марганца (II,III), окисел марганца), Mn5O8 (оксид марганца (II,IV), окисел марганца), Mn2O3 (оксид марганца (III), окисел марганца), MnO2 (оксид марганца (IV), диоксид марганца), MnO3 (оксид марганца (VI), окисел марганца), Mn2O7 (оксид марганца (VII)) |
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
Fe2O3 (оксид железа (III), окись железа, колькотар, крокус, железный сурик, гематит), Fe3O4 (оксид железа (II,III), закись-окись железа, железная окалина, магнетит, магнитный железняк), и др. |
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
Co3O4 (оксид кобальта (II,III), окись кобальта), Co2O3 (оксид кобальта (III), окись кобальта), CoO2•H2O (оксид кобальта (IV), гидрат оксида кобальта) |
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит),
Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт),
CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия),
Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия),
GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка),
As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит),
SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
Nb2O3 (оксид ниобия (III), окись ниобия), NbO2 (оксид ниобия (IV), окись ниобия), Nb2O5 (оксид ниобия (V), окись ниобия) |
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
MoO2 (оксид молибдена (IV), окись молибдена), Mo2O5 (оксид молибдена (V), окись молибдена), MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит) |
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)),
Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения),
RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия),
Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия),
Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)),
Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)),
CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия),
InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись),
SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид),
Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
TeO3 (оксид теллура (VI), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты), Te2O5, Te4O9 |
| 53 | Йод | I | I+12O (монооксид дийода),
I+2O (монооксид йода), I+4O2 (диоксид йода), I+3, +52O4 или I+3O(I+5O3) или (I+3, +5O2)2 (тетраоксид дийода, иодноватокислый йод), I+52O5 или O(IO2)2 (оксид йода (V), пентаоксид дийода, иодноватый ангидрид), I+3, +54O9 или I+3(I+5O3)3 или I+3(OI+5O2)3 (иодат йода (III), иодноватокислый йод, нонаоксид тетрайода) |
| 54 | Ксенон | Xe | XeO2 (оксид ксенона (IV), диоксид ксенона),
XeO3 (триоксид ксенона), XeO4 (тетраоксид ксенона) |
| 55 | Цезий | Cs | Cs2O (оксид цезия, окись цезия) |
| 56 | Барий | Ba | BaO (оксид бария, окись бария, безводный барит) |
| 57 | Лантан | La | La2O3 (оксид лантана (III), сесквиоксид лантана) |
| 58 | Церий | Ce | Ce2O3 (оксид церия (III)),
CeO2 (оксид церия (IV), диоксид церия, двуокись церия) |
| 59 | Празеодим | Pr | PrO (оксид празеодима (II), монооксид празеодима),
Pr2O3 (оксид празеодима (III), сесквиоксид празеодима), PrO2 (оксид празеодима (IV), окись празеодима), Pr6O11 (оксид празеодима (III, IV), ундекаоксид гексапразеодима) |
| 60 | Неодим | Nd | NdO (оксид неодима (II), окисел неодима),
Nd2O3 (оксид неодима (III), сесквиоксид неодима) |
| 61 | Прометий | Pm | Pm2O3 (оксид прометия (III), сесквиоксид прометия) |
| 62 | Самарий | Sm | SmO (оксид самария (II), монооксид самария, окись самария),
Sm2O3 (оксид самария (III), сесквиоксид самария, окись самария) |
| 63 | Европий | Eu | EuO (оксид европия (II), монооксид европия, окись европия),
Eu3O4 или или EuO•Eu2O3 (оксид европия (II,III)), Eu2O3 (оксид европия (III)) |
| 64 | Гадолиний | Gd | Gd2O3 (оксид гадолиния (III), окись гадолиния) |
| 65 | Тербий | Tb | Tb2O3 (оксид тербия (III), трехокись тербия, триоксид тербия),
Tb4O7 (оксид тербия (III, IV), гептаоксид тетратербия), TbO2 (оксид тербия (IV), диоксид тербия), Tb6O11 |
| 66 | Диспрозий | Dy | Dy2O3 (оксид диспрозия (III), окись диспрозия, триоксид диспрозия) |
| 67 | Гольмий | Ho | Ho2O3 (оксид гольмия (III), окись гольмия) |
| 68 | Эрбий | Er | Er2O3 (оксид эрбия (III), окись эрбия, триоксид эрбия) |
| 69 | Тулий | Tm | Tm2O3 (оксид тулия (III), сесквиоксид тулия) |
| 70 | Иттербий | Yb | Yb2O3 (оксид иттербия (III), окись иттербия , сесквиоксид иттербия) |
Таблица оксидов (3 часть):
| 71 | Лютеций | Lu | Lu2O3 (оксид лютеция (III), окисел лютеция) |
| 72 | Гафний | Hf | HfO2 (оксид гафния (IV), окись гафния) |
| 73 | Тантал | Ta | Ta2O (оксид тантала (I), закись тантала),
TaO (оксид тантала (II), окись тантала), TaO2 (оксид тантала (IV), окись тантала), Ta2O5 (оксид тантала (V), окись тантала, пентаоксид тантала) |
| 74 | Вольфрам | W | WO2 (оксид вольфрама (IV), окись вольфрама, двуокись вольфрама, диоксид вольфрама),
WO3 (оксид вольфрама (VI), триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид, ангидрид вольфрамовой кислоты) |
| 75 | Рений | Re | Re2O (оксид рения (I), окись рения),
ReO (оксид рения (II), окись рения), Re2O3 (оксид рения (III), окисел рения), ReO2 (оксид рения (IV), окись рения (IV)), Re2O5 (оксид рения (V), окисел рения), ReO3 (оксид рения (VI), окись рения (VI)), Re2O7 (оксид рения (VII), окись рения (VII), рениевый ангидрид) |
| 76 | Осмий | Os | |
| 77 | Иридий | Ir | |
| 78 | Платина | Pt | |
| 79 | Золото | Au | |
| 80 | Ртуть | Hg | |
| 81 | Таллий | Tl | |
| 82 | Свинец | Pb | |
| 83 | Висмут | Bi | |
| 84 | Полоний | Po | |
| 85 | Астат | At | |
| 86 | Радон | Rn | |
| 87 | Франций | Fr | |
| 88 | Радий | Ra | |
| 89 | Актиний | Ac | |
| 90 | Торий | Th | |
| 91 | Протактиний | Pa | |
| 92 | Уран | U | |
| 93 | Нептуний | Np | |
| 94 | Плутоний | Pu | |
| 95 | Америций | Am | |
| 96 | Кюрий | Cm | |
| 97 | Берклий | Bk | |
| 98 | Калифорний | Cf | |
| 99 | Эйнштейний | Es | |
| 100 | Фермий | Fm | |
| 101 | Менделевий | Md | |
| 102 | Нобелий | No | |
| 103 | Лоуренсий | Lr | |
| 104 | Резерфордий (Курчатовий) | Rf | |
| 105 | Дубний (Нильсборий) | Db | |
| 106 | Сиборгий | Sg | |
| 107 | Борий | Bh | |
| 108 | Хассий | Hs | |
| 109 | Мейтнерий | Mt | |
| 110 | Дармштадтий | Ds |
Коэффициент востребованности
27 511