Прогестерон (P4) — эндогенный стероид и прогестогенный половой гормон, оказывающий влияние на менструальный цикл, беременность и эмбриональное развитие у человека и других видов. Он принадлежит к группе стероидных гормонов, называющихся прогестогенами, и является главным прогестогеном в организме. Прогестерон также ключевое метаболическое промежуточное звено в производстве других эндогенных стероидов, включая половые гормоны и кортикостероиды, и играет ключевую роль в функционировании мозга как нейростероид.
Все значения слова «прогестерон»
-
Так, было установлено, что женские половые гормоны эстроген и прогестерон необходимы для возникновения у самок крыс материнского инстинкта.
-
Кроме того, плацента является железой, в которой образуется гормон прогестерон, «следящий» за тем, чтобы беременность женщины развивалась нормально.
-
Для этой цели внутримышечно вводят прогестерон из расчёта 0,3 мг на голову (1–2%-ный в масле).
- (все предложения)
- плацентарный лактоген
- кора надпочечников
- фолликул яичника
- эндокринная железа
- плодное яйцо
- (ещё синонимы…)
This article is about progesterone as a hormone. For its use as a medication, see progesterone (medication).

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
(1S,3aS,3bS,9aR,9bS,11aS)-1-Acetyl-9a,11a-dimethyl-1,2,3,3a,3b,4,5,8,9,9a,9b,10,11,11a-tetradecahydro-7H-cyclopenta[a]phenanthren-7-one |
|
| Other names
P4;[1] Pregnenedione; Pregn-4-ene-3,20-dione[2][3] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.000.318 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C21H30O2 |
| Molar mass | 314.469 g/mol |
| Melting point | 126 |
| log P | 4.04[4] |
| Pharmacology | |
|
ATC code |
G03DA04 (WHO) |
|
Routes of |
By mouth, topical/transdermal, vaginal, intramuscular injection, subcutaneous injection, subcutaneous implant |
| Pharmacokinetics: | |
|
Bioavailability |
OMP: <10%[5][6] |
|
Protein binding |
• Albumin: 80% • CBG: 18% • SHBG: <1% • Free: 1–2%[7][8] |
|
Metabolism |
Hepatic (CYP2C19, CYP3A4, CYP2C9, 5α-reductase, 3α-HSD, 17α-hydroxylase, 21-hydroxylase, 20α-HSD)[9][10] |
|
Biological half-life |
OMP: 16–18 hours[5][6][11] IM: 22–26 hours[6][12] SC: 13–18 hours[12] |
|
Excretion |
Renal |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Progesterone (P4) is an endogenous steroid and progestogen sex hormone involved in the menstrual cycle, pregnancy, and embryogenesis of humans and other species.[1][13] It belongs to a group of steroid hormones called the progestogens[13] and is the major progestogen in the body. Progesterone has a variety of important functions in the body. It is also a crucial metabolic intermediate in the production of other endogenous steroids, including the sex hormones and the corticosteroids, and plays an important role in brain function as a neurosteroid.[14]
In addition to its role as a natural hormone, progesterone is also used as a medication, such as in combination with estrogen for contraception, to reduce the risk of uterine or cervical cancer, in hormone replacement therapy, and in feminizing hormone therapy.[15] It was first prescribed in 1934.[16]
Biological activity[edit]
Progesterone is the most important progestogen in the body. As a potent agonist of the nuclear progesterone receptor (nPR) (with an affinity of KD = 1 nM) the resulting effects on ribosomal transcription plays a major role in regulation of female reproduction.[13][17][18] In addition, progesterone is an agonist of the more recently discovered membrane progesterone receptors (mPRs),[19] of which the expression has regulation effects in reproduction function (oocyte maturation, labor, and sperm motility) and cancer although additional research is required to further define the roles.[20] It also functions as a ligand of the PGRMC1 (progesterone receptor membrane component 1) which impacts tumor progression, metabolic regulation, and viability control of nerve cells.[21][22][23] Moreover, progesterone is also known to be an antagonist of the sigma σ1 receptor,[24][25] a negative allosteric modulator of nicotinic acetylcholine receptors,[14] and a potent antagonist of the mineralocorticoid receptor (MR).[26] Progesterone prevents MR activation by binding to this receptor with an affinity exceeding even those of aldosterone and glucocorticoids such as cortisol and corticosterone,[26] and produces antimineralocorticoid effects, such as natriuresis, at physiological concentrations.[27] In addition, progesterone binds to and behaves as a partial agonist of the glucocorticoid receptor (GR), albeit with very low potency (EC50 >100-fold less relative to cortisol).[28][29]
Progesterone, through its neurosteroid active metabolites such as 5α-dihydroprogesterone and allopregnanolone, acts indirectly as a positive allosteric modulator of the GABAA receptor.[30]
Progesterone and some of its metabolites, such as 5β-dihydroprogesterone, are agonists of the pregnane X receptor (PXR),[31] albeit weakly so (EC50 >10 μM).[32] In accordance, progesterone induces several hepatic cytochrome P450 enzymes,[33] such as CYP3A4,[34][35] especially during pregnancy when concentrations are much higher than usual.[36] Perimenopausal women have been found to have greater CYP3A4 activity relative to men and postmenopausal women, and it has been inferred that this may be due to the higher progesterone levels present in perimenopausal women.[34]
Progesterone modulates the activity of CatSper (cation channels of sperm) voltage-gated Ca2+ channels. Since eggs release progesterone, sperm may use progesterone as a homing signal to swim toward eggs (chemotaxis). As a result, it has been suggested that substances that block the progesterone binding site on CatSper channels could potentially be used in male contraception.[37][38]
Biological function[edit]
During the menstrual cycle, levels of estradiol (an estrogen) vary by 200 percent. Levels of progesterone vary by over 1200 percent.[39]
Hormonal interactions[edit]
Progesterone has a number of physiological effects that are amplified in the presence of estrogens. Estrogens through estrogen receptors (ERs) induce or upregulate the expression of the PR.[40] One example of this is in breast tissue, where estrogens allow progesterone to mediate lobuloalveolar development.[41][42][43]
Elevated levels of progesterone potently reduce the sodium-retaining activity of aldosterone, resulting in natriuresis and a reduction in extracellular fluid volume. Progesterone withdrawal, on the other hand, is associated with a temporary increase in sodium retention (reduced natriuresis, with an increase in extracellular fluid volume) due to the compensatory increase in aldosterone production, which combats the blockade of the mineralocorticoid receptor by the previously elevated level of progesterone.[44]
Reproductive system[edit]
Progesterone has key effects via non-genomic signalling on human sperm as they migrate through the female tract before fertilization occurs, though the receptor(s) as yet remain unidentified.[45] Detailed characterisation of the events occurring in sperm in response to progesterone has elucidated certain events including intracellular calcium transients and maintained changes,[46] slow calcium oscillations,[47] now thought to possibly regulate motility.[48] It is produced by the ovaries.[49] Progesterone has also been shown to demonstrate effects on octopus spermatozoa.[50]
Progesterone is sometimes called the «hormone of pregnancy»,[51] and it has many roles relating to the development of the fetus:
- Progesterone converts the endometrium to its secretory stage to prepare the uterus for implantation. At the same time progesterone affects the vaginal epithelium and cervical mucus, making it thick and impenetrable to sperm. Progesterone is anti-mitogenic in endometrial epithelial cells, and as such, mitigates the tropic effects of estrogen.[52] If pregnancy does not occur, progesterone levels will decrease, leading to menstruation. Normal menstrual bleeding is progesterone-withdrawal bleeding. If ovulation does not occur and the corpus luteum does not develop, levels of progesterone may be low, leading to anovulatory dysfunctional uterine bleeding.
- During implantation and gestation, progesterone appears to decrease the maternal immune response to allow for the acceptance of the pregnancy.[53]
- Progesterone decreases contractility of the uterine smooth muscle.[51] This effect contributes to prevention of preterm labor.[53]
- A drop in progesterone levels is possibly one step that facilitates the onset of labor.
- In addition, progesterone inhibits lactation during pregnancy. The fall in progesterone levels following delivery is one of the triggers for milk production.
The fetus metabolizes placental progesterone in the production of adrenal steroids.
Breasts[edit]
Lobuloalveolar development[edit]
Progesterone plays an important role in breast development in women. In conjunction with prolactin, it mediates lobuloalveolar maturation of the mammary glands during pregnancy to allow for milk production and thus lactation and breastfeeding of offspring following parturition (childbirth).[54] Estrogen induces expression of the PR in breast tissue and hence progesterone is dependent on estrogen to mediate lobuloalveolar development.[41][42][43] It has been found that RANKL is a critical downstream mediator of progesterone-induced lobuloalveolar maturation.[55] RANKL knockout mice show an almost identical mammary phenotype to PR knockout mice, including normal mammary ductal development but complete failure of the development of lobuloalveolar structures.[55]
Ductal development[edit]
Though to a far lesser extent than estrogen, which is the major mediator of mammary ductal development (via the ERα),[56][57] progesterone may be involved in ductal development of the mammary glands to some extent as well.[58] PR knockout mice or mice treated with the PR antagonist mifepristone show delayed although otherwise normal mammary ductal development at puberty.[58] In addition, mice modified to have overexpression of PRA display ductal hyperplasia,[55] and progesterone induces ductal growth in the mouse mammary gland.[58] Progesterone mediates ductal development mainly via induction of the expression of amphiregulin, the same growth factor that estrogen primarily induces the expression of to mediate ductal development.[58] These animal findings suggest that, while not essential for full mammary ductal development, progesterone seems to play a potentiating or accelerating role in estrogen-mediated mammary ductal development.[58]
Breast cancer risk[edit]
Progesterone also appears to be involved in the pathophysiology of breast cancer, though its role, and whether it is a promoter or inhibitor of breast cancer risk, has not been fully elucidated.[59][60] Most progestins, or synthetic progestogens, like medroxyprogesterone acetate, have been found to increase the risk of breast cancer in postmenopausal women in combination with estrogen as a component of menopausal hormone therapy.[61][60] The combination of natural oral progesterone or the atypical progestin dydrogesterone with estrogen has been associated with less risk of breast cancer than progestins plus estrogen.[62][63][64] However, this may simply be an artifact of the low progesterone levels produced with oral progesterone.[59][65] More research is needed on the role of progesterone in breast cancer.[60]
Skin health[edit]
The estrogen receptor, as well as the progesterone receptor, have been detected in the skin, including in keratinocytes and fibroblasts.[66][67] At menopause and thereafter, decreased levels of female sex hormones result in atrophy, thinning, and increased wrinkling of the skin and a reduction in skin elasticity, firmness, and strength.[66][67] These skin changes constitute an acceleration in skin aging and are the result of decreased collagen content, irregularities in the morphology of epidermal skin cells, decreased ground substance between skin fibers, and reduced capillaries and blood flow.[66][67] The skin also becomes more dry during menopause, which is due to reduced skin hydration and surface lipids (sebum production).[66] Along with chronological aging and photoaging, estrogen deficiency in menopause is one of the three main factors that predominantly influences skin aging.[66]
Hormone replacement therapy, consisting of systemic treatment with estrogen alone or in combination with a progestogen, has well-documented and considerable beneficial effects on the skin of postmenopausal women.[66][67] These benefits include increased skin collagen content, skin thickness and elasticity, and skin hydration and surface lipids.[66][67] Topical estrogen has been found to have similar beneficial effects on the skin.[66] In addition, a study has found that topical 2% progesterone cream significantly increases skin elasticity and firmness and observably decreases wrinkles in peri- and postmenopausal women.[67] Skin hydration and surface lipids, on the other hand, did not significantly change with topical progesterone.[67] These findings suggest that progesterone, like estrogen, also has beneficial effects on the skin, and may be independently protective against skin aging.[67]
Sexuality[edit]
Libido[edit]
Progesterone and its neurosteroid active metabolite allopregnanolone appear to be importantly involved in libido in females.[68]
Homosexuality[edit]
Dr. Diana Fleischman, of the University of Portsmouth, and colleagues looked for a relationship between progesterone and sexual attitudes in 92 women. Their research, published in the Archives of Sexual Behavior found that women who had higher levels of progesterone scored higher on a questionnaire measuring homoerotic motivation. They also found that men who had high levels of progesterone were more likely to have higher homoerotic motivation scores after affiliative priming compared to men with low levels of progesterone.[69][70][71][72]
Nervous system[edit]
Progesterone, like pregnenolone and dehydroepiandrosterone (DHEA), belongs to an important group of endogenous steroids called neurosteroids. It can be metabolized within all parts of the central nervous system.[73]
Neurosteroids are neuromodulators, and are neuroprotective, neurogenic, and regulate neurotransmission and myelination.[74] The effects of progesterone as a neurosteroid are mediated predominantly through its interactions with non-nuclear PRs, namely the mPRs and PGRMC1, as well as certain other receptors, such as the σ1 and nACh receptors.[medical citation needed]
Brain damage[edit]
Previous studies have shown that progesterone supports the normal development of neurons in the brain, and that the hormone has a protective effect on damaged brain tissue. It has been observed in animal models that females have reduced susceptibility to traumatic brain injury and this protective effect has been hypothesized to be caused by increased circulating levels of estrogen and progesterone in females.[75]
Proposed mechanism[edit]
The mechanism of progesterone protective effects may be the reduction of inflammation that follows brain trauma and hemorrhage.[76][77]
Damage incurred by traumatic brain injury is believed to be caused in part by mass depolarization leading to excitotoxicity. One way in which progesterone helps to alleviate some of this excitotoxicity is by blocking the voltage-dependent calcium channels that trigger neurotransmitter release.[78] It does so by manipulating the signaling pathways of transcription factors involved in this release. Another method for reducing the excitotoxicity is by up-regulating the GABAA, a widespread inhibitory neurotransmitter receptor.[79]
Progesterone has also been shown to prevent apoptosis in neurons, a common consequence of brain injury.[80] It does so by inhibiting enzymes involved in the apoptosis pathway specifically concerning the mitochondria, such as activated caspase 3 and cytochrome c.
Not only does progesterone help prevent further damage, it has also been shown to aid in neuroregeneration.[81] One of the serious effects of traumatic brain injury includes edema. Animal studies show that progesterone treatment leads to a decrease in edema levels by increasing the concentration of macrophages and microglia sent to the injured tissue.[78][82] This was observed in the form of reduced leakage from the blood brain barrier in secondary recovery in progesterone treated rats. In addition, progesterone was observed to have antioxidant properties, reducing the concentration of oxygen free radicals faster than without.[79] There is also evidence that the addition of progesterone can also help remyelinate damaged axons due to trauma, restoring some lost neural signal conduction.[79] Another way progesterone aids in regeneration includes increasing the circulation of endothelial progenitor cells in the brain.[83] This helps new vasculature to grow around scar tissue which helps repair the area of insult.
Addiction[edit]
Progesterone enhances the function of serotonin receptors in the brain, so an excess or deficit of progesterone has the potential to result in significant neurochemical issues. This provides an explanation for why some people resort to substances that enhance serotonin activity such as nicotine, alcohol, and cannabis when their progesterone levels fall below optimal levels.[84]
- Sex differences in hormone levels may induce women to respond differently than men to nicotine. When women undergo cyclic changes or different hormonal transition phases (menopause, pregnancy, adolescence), there are changes in their progesterone levels.[85] Therefore, females have an increased biological vulnerability to nicotine’s reinforcing effects compared to males and progesterone may be used to counter this enhanced vulnerability. This information supports the idea that progesterone can affect behavior.[84]
- Similar to nicotine, cocaine also increases the release of dopamine in the brain. The neurotransmitter is involved in the reward center and is one of the main neurotransmitters involved with substance abuse and reliance. In a study of cocaine users, it was reported that progesterone reduced craving and the feeling of being stimulated by cocaine. Thus, progesterone was suggested as an agent that decreases cocaine craving by reducing the dopaminergic properties of the drug.[86]
Societal[edit]
In a 2012 University of Amsterdam study of 120 women, women’s luteal phase (higher levels of progesterone, and increasing levels of estrogen) was correlated with lower level of competitive behavior in gambling and math contest scenarios, while their premenstrual phase (sharply-decreasing levels of progesterone, and decreasing levels of estrogen) was correlated with a higher level of competitive behavior.[87]
Other effects[edit]
- Progesterone also has a role in skin elasticity and bone strength, in respiration, in nerve tissue and in female sexuality, and the presence of progesterone receptors in certain muscle and fat tissue may hint at a role in sexually dimorphic proportions of those.[88][infringing link?]
- During pregnancy, progesterone is said to decrease uterine irritability.[89]
- During pregnancy, progesterone helps to suppress immune responses of the mother to fetal antigens, which prevents rejection of the fetus.[89]
- Progesterone raises epidermal growth factor-1 (EGF-1) levels, a factor often used to induce proliferation, and used to sustain cultures, of stem cells.[90]
- Progesterone increases core temperature (thermogenic function) during ovulation.[91][92]
- Progesterone reduces spasm and relaxes smooth muscle. Bronchi are widened and mucus regulated. (PRs are widely present in submucosal tissue.)
- Progesterone acts as an antiinflammatory agent and regulates the immune response.
- Progesterone reduces gall-bladder activity.[93]
- Progesterone normalizes blood clotting and vascular tone, zinc and copper levels, cell oxygen levels, and use of fat stores for energy.
- Progesterone may affect gum health, increasing risk of gingivitis (gum inflammation).[94]
- Progesterone appears to prevent endometrial cancer (involving the uterine lining) by regulating the effects of estrogen.
- Progesterone plays an important role in the signaling of insulin release and pancreatic function, and may affect the susceptibility to diabetes or gestational diabetes.[95][96]
Biochemistry[edit]
Biosynthesis[edit]
In mammals, progesterone, like all other steroid hormones, is synthesized from pregnenolone, which itself is derived from cholesterol.
Cholesterol undergoes double oxidation to produce 22R-hydroxycholesterol and then 20α,22R-dihydroxycholesterol. This vicinal diol is then further oxidized with loss of the side chain starting at position C22 to produce pregnenolone. This reaction is catalyzed by cytochrome P450scc.
The conversion of pregnenolone to progesterone takes place in two steps. First, the 3β-hydroxyl group is oxidized to a keto group and second, the double bond is moved to C4, from C5 through a keto/enol tautomerization reaction.[98] This reaction is catalyzed by 3β-hydroxysteroid dehydrogenase/δ5-4-isomerase.
Progesterone in turn is the precursor of the mineralocorticoid aldosterone, and after conversion to 17α-hydroxyprogesterone, of cortisol and androstenedione. Androstenedione can be converted to testosterone, estrone, and estradiol, highlighting the critical role of progesterone in testosterone synthesis.
Pregnenolone and progesterone can also be synthesized by yeast.[99]
Approximately 25 mg of progesterone is secreted from the ovaries per day in women, while the adrenal glands produce about 2 mg of progesterone per day.[100]
| Sex | Sex hormone | Reproductive phase |
Blood production rate |
Gonadal secretion rate |
Metabolic clearance rate |
Reference range (serum levels) | |
|---|---|---|---|---|---|---|---|
| SI units | Non-SI units | ||||||
| Men | Androstenedione |
– |
2.8 mg/day | 1.6 mg/day | 2200 L/day | 2.8–7.3 nmol/L | 80–210 ng/dL |
| Testosterone |
– |
6.5 mg/day | 6.2 mg/day | 950 L/day | 6.9–34.7 nmol/L | 200–1000 ng/dL | |
| Estrone |
– |
150 μg/day | 110 μg/day | 2050 L/day | 37–250 pmol/L | 10–70 pg/mL | |
| Estradiol |
– |
60 μg/day | 50 μg/day | 1600 L/day | <37–210 pmol/L | 10–57 pg/mL | |
| Estrone sulfate |
– |
80 μg/day | Insignificant | 167 L/day | 600–2500 pmol/L | 200–900 pg/mL | |
| Women | Androstenedione |
– |
3.2 mg/day | 2.8 mg/day | 2000 L/day | 3.1–12.2 nmol/L | 89–350 ng/dL |
| Testosterone |
– |
190 μg/day | 60 μg/day | 500 L/day | 0.7–2.8 nmol/L | 20–81 ng/dL | |
| Estrone | Follicular phase | 110 μg/day | 80 μg/day | 2200 L/day | 110–400 pmol/L | 30–110 pg/mL | |
| Luteal phase | 260 μg/day | 150 μg/day | 2200 L/day | 310–660 pmol/L | 80–180 pg/mL | ||
| Postmenopause | 40 μg/day | Insignificant | 1610 L/day | 22–230 pmol/L | 6–60 pg/mL | ||
| Estradiol | Follicular phase | 90 μg/day | 80 μg/day | 1200 L/day | <37–360 pmol/L | 10–98 pg/mL | |
| Luteal phase | 250 μg/day | 240 μg/day | 1200 L/day | 699–1250 pmol/L | 190–341 pg/mL | ||
| Postmenopause | 6 μg/day | Insignificant | 910 L/day | <37–140 pmol/L | 10–38 pg/mL | ||
| Estrone sulfate | Follicular phase | 100 μg/day | Insignificant | 146 L/day | 700–3600 pmol/L | 250–1300 pg/mL | |
| Luteal phase | 180 μg/day | Insignificant | 146 L/day | 1100–7300 pmol/L | 400–2600 pg/mL | ||
| Progesterone | Follicular phase | 2 mg/day | 1.7 mg/day | 2100 L/day | 0.3–3 nmol/L | 0.1–0.9 ng/mL | |
| Luteal phase | 25 mg/day | 24 mg/day | 2100 L/day | 19–45 nmol/L | 6–14 ng/mL | ||
|
Notes and sources Notes: «The concentration of a steroid in the circulation is determined by the rate at which it is secreted from glands, the rate of metabolism of precursor or prehormones into the steroid, and the rate at which it is extracted by tissues and metabolized. The secretion rate of a steroid refers to the total secretion of the compound from a gland per unit time. Secretion rates have been assessed by sampling the venous effluent from a gland over time and subtracting out the arterial and peripheral venous hormone concentration. The metabolic clearance rate of a steroid is defined as the volume of blood that has been completely cleared of the hormone per unit time. The production rate of a steroid hormone refers to entry into the blood of the compound from all possible sources, including secretion from glands and conversion of prohormones into the steroid of interest. At steady state, the amount of hormone entering the blood from all sources will be equal to the rate at which it is being cleared (metabolic clearance rate) multiplied by blood concentration (production rate = metabolic clearance rate × concentration). If there is little contribution of prohormone metabolism to the circulating pool of steroid, then the production rate will approximate the secretion rate.» Sources: See template. |
Distribution[edit]
Progesterone binds extensively to plasma proteins, including albumin (50–54%) and transcortin (43–48%).[101] It has similar affinity for albumin relative to the PR.[17]
Metabolism[edit]
The metabolism of progesterone is rapid and extensive and occurs mainly in the liver,[102][103][104] though enzymes that metabolize progesterone are also expressed widely in the brain, skin, and various other extrahepatic tissues.[73][105] Progesterone has an elimination half-life of only approximately 5 minutes in circulation.[102] The metabolism of progesterone is complex, and it may form as many as 35 different unconjugated metabolites when it is ingested orally.[104][106] Progesterone is highly susceptible to enzymatic reduction via reductases and hydroxysteroid dehydrogenases due to its double bond (between the C4 and C5 positions) and its two ketones (at the C3 and C20 positions).[104]
The major metabolic pathway of progesterone is reduction by 5α-reductase[73] and 5β-reductase into the dihydrogenated 5α-dihydroprogesterone and 5β-dihydroprogesterone, respectively.[103][104][107][108] This is followed by the further reduction of these metabolites via 3α-hydroxysteroid dehydrogenase and 3β-hydroxysteroid dehydrogenase into the tetrahydrogenated allopregnanolone, pregnanolone, isopregnanolone, and epipregnanolone.[109][103][104][107] Subsequently, 20α-hydroxysteroid dehydrogenase and 20β-hydroxysteroid dehydrogenase reduce these metabolites to form the corresponding hexahydrogenated pregnanediols (eight different isomers in total),[103][108] which are then conjugated via glucuronidation and/or sulfation, released from the liver into circulation, and excreted by the kidneys into the urine.[102][104] The major metabolite of progesterone in the urine is the 3α,5β,20α isomer of pregnanediol glucuronide, which has been found to constitute 15 to 30% of an injection of progesterone.[17][110] Other metabolites of progesterone formed by the enzymes in this pathway include 3α-dihydroprogesterone, 3β-dihydroprogesterone, 20α-dihydroprogesterone, and 20β-dihydroprogesterone, as well as various combination products of the enzymes aside from those already mentioned.[17][104][110][111] Progesterone can also first be hydroxylated (see below) and then reduced.[104] Endogenous progesterone is metabolized approximately 50% into 5α-dihydroprogesterone in the corpus luteum, 35% into 3β-dihydroprogesterone in the liver, and 10% into 20α-dihydroprogesterone.[112]
Relatively small portions of progesterone are hydroxylated via 17α-hydroxylase (CYP17A1) and 21-hydroxylase (CYP21A2) into 17α-hydroxyprogesterone and 11-deoxycorticosterone (21-hydroxyprogesterone), respectively,[106] and pregnanetriols are formed secondarily to 17α-hydroxylation.[113][114] Even smaller amounts of progesterone may be also hydroxylated via 11β-hydroxylase (CYP11B1) and to a lesser extent via aldosterone synthase (CYP11B2) into 11β-hydroxyprogesterone.[115][116] In addition, progesterone can be hydroxylated in the liver by other cytochrome P450 enzymes which are not steroid-specific.[117] 6β-Hydroxylation, which is catalyzed mainly by CYP3A4, is the major transformation, and is responsible for approximately 70% of cytochrome P450-mediated progesterone metabolism.[117] Other routes include 6α-, 16α-, and 16β-hydroxylation.[104] However, treatment of women with ketoconazole, a strong CYP3A4 inhibitor, had minimal effects on progesterone levels, producing only a slight and non-significant increase, and this suggests that cytochrome P450 enzymes play only a small role in progesterone metabolism.[118]
Levels[edit]
Progesterone levels across the menstrual cycle in normally cycling and ovulatory women.[120] The horizontal lines are the mean integrated levels for each curve. The vertical line is mid-cycle.
In women, progesterone levels are relatively low during the preovulatory phase of the menstrual cycle, rise after ovulation, and are elevated during the luteal phase, as shown in the diagram above. Progesterone levels tend to be less than 2 ng/mL prior to ovulation and greater than 5 ng/mL after ovulation. If pregnancy occurs, human chorionic gonadotropin is released, maintaining the corpus luteum and allowing it to maintain levels of progesterone. Between 7 and 9 weeks, the placenta begins to produce progesterone in place of the corpus luteum in a process called the luteal-placental shift.[121]
After the luteal-placental shift, progesterone levels start to rise further and may reach 100 to 200 ng/mL at term. Whether a decrease in progesterone levels is critical for the initiation of labor has been argued and may be species-specific. After delivery of the placenta and during lactation, progesterone levels are very low.
Progesterone levels are low in children and postmenopausal women.[122] Adult males have levels similar to those in women during the follicular phase of the menstrual cycle.
| Group | P4 production | P4 levels |
|---|---|---|
| Prepubertal children | ND | 0.06–0.5 ng/mL |
| Pubertal girls Tanner stage I (childhood) Tanner stage II (ages 8–12) Tanner stage III (ages 10–13) Tanner stage IV (ages 11–14) Tanner stage V (ages 12–15) Follicular phase (days 1–14) Luteal phase (days 15–28) |
ND ND ND ND ND |
0.22 (<0.10–0.32) ng/mL 0.30 (0.10–0.51) ng/mL 0.36 (0.10–0.75) ng/mL 1.75 (<0.10–25.0) ng/mL 0.35 (0.13–0.75) ng/mL |
| Premenopausal women Follicular phase (days 1–14) Luteal phase (days 15–28) Oral contraceptive (anovulatory) |
0.75–5.4 mg/day 15–50 mg/day ND |
0.02–1.2 ng/mL 4–30 ng/mL 0.1–0.3 ng/mL |
| Postmenopausal women Oophorectomized women Oophorectomized and adrenalectomized women |
ND 1.2 mg/day <0.3 mg/day |
0.03–0.3 ng/mL 0.39 ng/mL ND |
| Pregnant women First trimester (weeks 1–12) Second trimester (weeks 13–26) Third trimester (weeks 27–40) Postpartum (at 24 hours) |
55 mg/day 92–100 mg/day 190–563 mg/day ND |
9–75 ng/mL 17–146 ng/mL 55–255 ng/mL 19 ng/mL |
| Men | 0.75–3 mg/day | 0.1–0.3 ng/mL |
| Notes: Mean levels are given as a single value and ranges are given after in parentheses. Sources: See template. |
Ranges[edit]
Blood test results should always be interpreted using the reference ranges provided by the laboratory that performed the results. Example reference ranges are listed below.
| Person type | Reference range for blood test | ||
|---|---|---|---|
| Lower limit | Upper limit | Unit | |
| Female — menstrual cycle | (see diagram below) | ||
| Female — postmenopausal | <0.2[123] | 1[123] | ng/mL |
| <0.6[124] | 3[124] | nmol/L | |
| Female on oral contraceptives | 0.34[123] | 0.92[123] | ng/mL |
| 1.1[124] | 2.9[124] | nmol/L | |
| Males ≥16 years | 0.27[123] | 0.9[123] | ng/mL |
| 0.86[124] | 2.9[124] | nmol/L | |
| Female or male 1–9 years | 0.1[123] | 4.1[123] or 4.5[123] | ng/mL |
| 0.3[124] | 13[124] | nmol/L |
Sources[edit]
Animal[edit]
Progesterone is produced in high amounts in the ovaries (by the corpus luteum) from the onset of puberty to menopause, and is also produced in smaller amounts by the adrenal glands after the onset of adrenarche in both males and females. To a lesser extent, progesterone is produced in nervous tissue, especially in the brain, and in adipose (fat) tissue, as well.
During human pregnancy, progesterone is produced in increasingly high amounts by the ovaries and placenta. At first, the source is the corpus luteum that has been «rescued» by the presence of human chorionic gonadotropin (hCG) from the conceptus. However, after the 8th week, production of progesterone shifts to the placenta. The placenta utilizes maternal cholesterol as the initial substrate, and most of the produced progesterone enters the maternal circulation, but some is picked up by the fetal circulation and used as substrate for fetal corticosteroids. At term the placenta produces about 250 mg progesterone per day.
An additional animal source of progesterone is milk products. After consumption of milk products the level of bioavailable progesterone goes up.[126]
Plants[edit]
In at least one plant, Juglans regia, progesterone has been detected.[127] In addition, progesterone-like steroids are found in Dioscorea mexicana. Dioscorea mexicana is a plant that is part of the yam family native to Mexico.[128] It contains a steroid called diosgenin that is taken from the plant and is converted into progesterone.[129] Diosgenin and progesterone are also found in other Dioscorea species, as well as in other plants that are not closely related, such as fenugreek.
Another plant that contains substances readily convertible to progesterone is Dioscorea pseudojaponica native to Taiwan. Research has shown that the Taiwanese yam contains saponins — steroids that can be converted to diosgenin and thence to progesterone.[130]
Many other Dioscorea species of the yam family contain steroidal substances from which progesterone can be produced. Among the more notable of these are Dioscorea villosa and Dioscorea polygonoides. One study showed that the Dioscorea villosa contains 3.5% diosgenin.[131] Dioscorea polygonoides has been found to contain 2.64% diosgenin as shown by gas chromatography-mass spectrometry.[132] Many of the Dioscorea species that originate from the yam family grow in countries that have tropical and subtropical climates.[133]
Medical use[edit]
Progesterone is used as a medication. It is used in combination with estrogens mainly in hormone therapy for menopausal symptoms and low sex hormone levels in women.[106][134] It is also used in women to support pregnancy and fertility and to treat gynecological disorders.[135][136][137][138] Progesterone has been shown to prevent miscarriage in women with 1) vaginal bleeding early in their current pregnancy and 2) a previous history of miscarriage.[139] Progesterone can be taken by mouth, through the vagina, and by injection into muscle or fat, among other routes.[106]
Chemistry[edit]
A sample of progesterone.
Progesterone is a naturally occurring pregnane steroid and is also known as pregn-4-ene-3,20-dione.[140][141] It has a double bond (4-ene) between the C4 and C5 positions and two ketone groups (3,20-dione), one at the C3 position and the other at the C20 position.[140][141]
Synthesis[edit]
Progesterone is commercially produced by semisynthesis. Two main routes are used: one from yam diosgenin first pioneered by Marker in 1940, and one based on soy phytosterols scaled up in the 1970s. Additional (not necessarily economical) semisyntheses of progesterone have also been reported starting from a variety of steroids. For the example, cortisone can be simultaneously deoxygenated at the C-17 and C-21 position by treatment with iodotrimethylsilane in chloroform to produce 11-keto-progesterone (ketogestin), which in turn can be reduced at position-11 to yield progesterone.[142]
Marker semisynthesis[edit]
An economical semisynthesis of progesterone from the plant steroid diosgenin isolated from yams was developed by Russell Marker in 1940 for the Parke-Davis pharmaceutical company.[143] This synthesis is known as the Marker degradation.
The 16-DPA intermediate is important to the synthesis of many other medically important steroids. A very similar approach can produce 16-DPA from solanine.[144]
Soy semisynthesis[edit]
Progesterone can also be made from the stigmasterol found in soybean oil also. c.f. Percy Julian.
Total synthesis[edit]
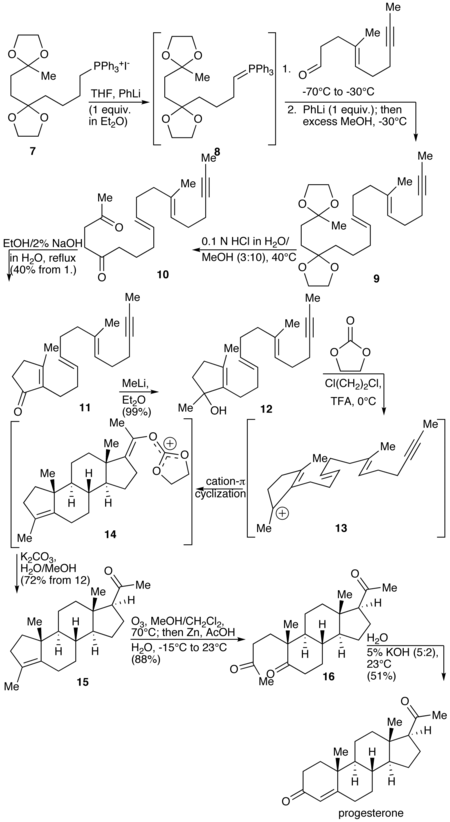
The Johnson total synthesis of progesterone.[150]
A total synthesis of progesterone was reported in 1971 by W.S. Johnson.[150] The synthesis begins with reacting the phosphonium salt 7 with phenyl lithium to produce the phosphonium ylide 8. The ylide 8 is reacted with an aldehyde to produce the alkene 9. The ketal protecting groups of 9 are hydrolyzed to produce the diketone 10, which in turn is cyclized to form the cyclopentenone 11. The ketone of 11 is reacted with methyl lithium to yield the tertiary alcohol 12, which in turn is treated with acid to produce the tertiary cation 13. The key step of the synthesis is the π-cation cyclization of 13 in which the B-, C-, and D-rings of the steroid are simultaneously formed to produce 14. This step resembles the cationic cyclization reaction used in the biosynthesis of steroids and hence is referred to as biomimetic. In the next step the enol orthoester is hydrolyzed to produce the ketone 15. The cyclopentene A-ring is then opened by oxidizing with ozone to produce 16. Finally, the diketone 17 undergoes an intramolecular aldol condensation by treating with aqueous potassium hydroxide to produce progesterone.[150]
History[edit]
George W. Corner and Willard M. Allen discovered the hormonal action of progesterone in 1929.[17][151][152][153] By 1931–1932, nearly pure crystalline material of high progestational activity had been isolated from the corpus luteum of animals, and by 1934, pure crystalline progesterone had been refined and obtained and the chemical structure of progesterone was determined.[17][152] This was achieved by Adolf Butenandt at the Chemisches Institut of Technical University in Danzig, who extracted this new compound from several thousand liters of urine.[154]
Chemical synthesis of progesterone from stigmasterol and pregnanediol was accomplished later that year.[152][155] Up to this point, progesterone, known generically as corpus luteum hormone, had been being referred to by several groups by different names, including corporin, lutein, luteosterone, and progestin.[17][156] In 1935, at the time of the Second International Conference on the Standardization of Sex Hormones in London, England, a compromise was made between the groups and the name progesterone (progestational steroidal ketone) was created.[17][157]
Veterinary use[edit]
The use of progesterone tests in dog breeding to pinpoint ovulation is becoming more widely used. There are several tests available but the most reliable test is a blood test with blood drawn by a veterinarian and sent to a lab for processing. Results can usually be obtained with 24 to 72 hours. The rationale for using progesterone tests is that increased numbers begin in close proximity to preovulatory surge in gonadotrophins and continue through ovulation and estrus. When progesterone levels reach certain levels they can signal the stage of estrus the female is. Prediction of birth date of the pending litter can be very accurate if ovulation date is known. Puppies deliver with a day or two of 9 weeks gestation in most cases. It is not possible to determine pregnancy using progesterone tests once a breeding has taken place, however. This is due to the fact that, in dogs, progesterone levels remain elevated throughout the estrus period.[158]
References[edit]
- ^ a b Jameson JL, De Groot LJ (25 February 2015). Endocrinology: Adult and Pediatric E-Book. Elsevier Health Sciences. p. 2179. ISBN 978-0-323-32195-2.
- ^ Adler N, Pfaff D, Goy RW (6 Dec 2012). Handbook of Behavioral Neurobiology Volume 7 Reproduction (1st ed.). New York: Plenum Press. p. 189. ISBN 978-1-4684-4834-4. Retrieved 4 July 2015.
- ^ «progesterone (CHEBI:17026)». ChEBI. European Molecular Biology Laboratory-EBI. Retrieved 4 July 2015.
- ^ «Progesterone_msds».
- ^ a b Stanczyk FZ (September 2002). «Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception». Reviews in Endocrine & Metabolic Disorders. 3 (3): 211–24. doi:10.1023/A:1020072325818. PMID 12215716. S2CID 27018468.
- ^ a b c Simon JA, Robinson DE, Andrews MC, Hildebrand JR, Rocci ML, Blake RE, Hodgen GD (July 1993). «The absorption of oral micronized progesterone: the effect of food, dose proportionality, and comparison with intramuscular progesterone». Fertility and Sterility. 60 (1): 26–33. doi:10.1016/S0015-0282(16)56031-2. PMID 8513955.
- ^ Fritz MA, Speroff L (28 March 2012). Clinical Gynecologic Endocrinology and Infertility. Lippincott Williams & Wilkins. pp. 44–. ISBN 978-1-4511-4847-3.
- ^ Marshall WJ, Bangert SK (2008). Clinical Chemistry. Elsevier Health Sciences. pp. 192–. ISBN 978-0-7234-3455-9.
- ^ Yamazaki H, Shimada T (October 1997). «Progesterone and testosterone hydroxylation by cytochromes P450 2C19, 2C9, and 3A4 in human liver microsomes». Archives of Biochemistry and Biophysics. 346 (1): 161–9. doi:10.1006/abbi.1997.0302. PMID 9328296.
- ^ McKay GA, Walters MR (6 February 2013). Lecture Notes: Clinical Pharmacology and Therapeutics. John Wiley & Sons. p. 33. ISBN 978-1-118-34489-7.
- ^ Zutshi (1 January 2005). Hormones in Obstetrics and Gynaecology. Jaypee Brothers Publishers. p. 74. ISBN 978-81-8061-427-9.[permanent dead link]
- ^ a b Cometti B (November 2015). «Pharmaceutical and clinical development of a novel progesterone formulation». Acta Obstetricia et Gynecologica Scandinavica. 94 (Suppl 161): 28–37. doi:10.1111/aogs.12765. PMID 26342177. S2CID 31974637.
- ^ a b c King TL, Brucker MC (25 October 2010). Pharmacology for Women’s Health. Jones & Bartlett Publishers. pp. 372–373. ISBN 978-1-4496-5800-7.
- ^ a b Baulieu E, Schumacher M (2000). «Progesterone as a neuroactive neurosteroid, with special reference to the effect of progesterone on myelination». Steroids. 65 (10–11): 605–12. doi:10.1016/s0039-128x(00)00173-2. PMID 11108866. S2CID 14952168.
- ^ Prior JC (2019). «Progesterone Is Important for Transgender Women’s Therapy — Applying Evidence for the Benefits of Progesterone in Ciswomen». The Journal of Clinical Endocrinology & Metabolism. 104 (4): 1181–1186. doi:10.1210/jc.2018-01777. PMID 30608551. S2CID 58620122.
Evidence has accrued that normal progesterone (and ovulation), as well as physiological estradiol levels, is necessary during ciswomen’s premenopausal menstrual cycles for current fertility and long-term health; transgender women may require progesterone therapy and similar potential physiological benefits
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 47X. ISBN 9783527607495.
- ^ a b c d e f g h Josimovich JB (11 November 2013). Gynecologic Endocrinology. Springer Science & Business Media. pp. 9, 25–29. ISBN 978-1-4613-2157-6.
- ^ Taraborrelli S (November 2015). «Physiology, production and action of progesterone». Acta Obstetricia et Gynecologica Scandinavica. 94 Suppl 161: 8–16. doi:10.1111/aogs.12771. PMID 26358238. S2CID 40213725.
- ^ Thomas P, Pang Y (2012). «Membrane progesterone receptors: evidence for neuroprotective, neurosteroid signaling and neuroendocrine functions in neuronal cells». Neuroendocrinology. 96 (2): 162–71. doi:10.1159/000339822. PMC 3489003. PMID 22687885.
- ^ Valadez-Cosmes P, Vázquez-Martínez ER, Cerbón M, Camacho-Arroyo I (October 2016). «Membrane progesterone receptors in reproduction and cancer». Molecular and Cellular Endocrinology. 434: 166–75. doi:10.1016/j.mce.2016.06.027. PMID 27368976. S2CID 3826650.
- ^ Meyer C, Schmid R, Schmieding K, Falkenstein E, Wehling M (February 1998). «Characterization of high affinity progesterone-binding membrane proteins by anti-peptide antiserum». Steroids. 63 (2): 111–6. doi:10.1016/s0039-128x(97)00143-8. PMID 9516722. S2CID 40096058.
- ^ Kabe Y, Handa H, Suematsu M (July 2018). «Function and structural regulation of the carbon monoxide (CO)-responsive membrane protein PGRMC1». Journal of Clinical Biochemistry and Nutrition. 63 (1): 12–17. doi:10.3164/jcbn.17-132. PMC 6064819. PMID 30087538.
- ^ Ryu CS, Klein K, Zanger UM (2017-03-27). «Membrane Associated Progesterone Receptors: Promiscuous Proteins with Pleiotropic Functions — Focus on Interactions with Cytochromes P450». Frontiers in Pharmacology. 8: 159. doi:10.3389/fphar.2017.00159. PMC 5366339. PMID 28396637.
- ^ Maurice T, Urani A, Phan VL, Romieu P (November 2001). «The interaction between neuroactive steroids and the sigma1 receptor function: behavioral consequences and therapeutic opportunities». Brain Research. Brain Research Reviews. 37 (1–3): 116–32. doi:10.1016/s0165-0173(01)00112-6. PMID 11744080. S2CID 44931783.
- ^ Johannessen M, Fontanilla D, Mavlyutov T, Ruoho AE, Jackson MB (February 2011). «Antagonist action of progesterone at σ-receptors in the modulation of voltage-gated sodium channels». American Journal of Physiology. Cell Physiology. 300 (2): C328-37. doi:10.1152/ajpcell.00383.2010. PMC 3043630. PMID 21084640.
- ^ a b Rupprecht R, Reul JM, van Steensel B, Spengler D, Söder M, Berning B, et al. (October 1993). «Pharmacological and functional characterization of human mineralocorticoid and glucocorticoid receptor ligands». European Journal of Pharmacology. 247 (2): 145–54. doi:10.1016/0922-4106(93)90072-H. PMID 8282004.
- ^ Elger W, Beier S, Pollow K, Garfield R, Shi SQ, Hillisch A (November 2003). «Conception and pharmacodynamic profile of drospirenone». Steroids. 68 (10–13): 891–905. doi:10.1016/j.steroids.2003.08.008. PMID 14667981. S2CID 41756726.
- ^ Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (December 2007). «Comparison of progesterone and glucocorticoid receptor binding and stimulation of gene expression by progesterone, 17-alpha hydroxyprogesterone caproate, and related progestins». American Journal of Obstetrics and Gynecology. 197 (6): 599.e1–7. doi:10.1016/j.ajog.2007.05.024. PMC 2278032. PMID 18060946.
- ^ Lei K, Chen L, Georgiou EX, Sooranna SR, Khanjani S, Brosens JJ, et al. (2012). «Progesterone acts via the nuclear glucocorticoid receptor to suppress IL-1β-induced COX-2 expression in human term myometrial cells». PLOS ONE. 7 (11): e50167. Bibcode:2012PLoSO…750167L. doi:10.1371/journal.pone.0050167. PMC 3509141. PMID 23209664.
- ^ Paul SM, Purdy RH (March 1992). «Neuroactive steroids». FASEB Journal. 6 (6): 2311–22. doi:10.1096/fasebj.6.6.1347506. PMID 1347506. S2CID 221753076.
- ^ Kliewer SA, Goodwin B, Willson TM (2002). «The nuclear pregnane X receptor: a key regulator of xenobiotic metabolism». Endocr. Rev. 23 (5): 687–702. doi:10.1210/er.2001-0038. PMID 12372848.
- ^ Lehmann JM, McKee DD, Watson MA, Willson TM, Moore JT, Kliewer SA (1998). «The human orphan nuclear receptor PXR is activated by compounds that regulate CYP3A4 gene expression and cause drug interactions». J. Clin. Invest. 102 (5): 1016–23. doi:10.1172/JCI3703. PMC 508967. PMID 9727070.
- ^ Meanwell NA (8 December 2014). Tactics in Contemporary Drug Design. Springer. pp. 161–. ISBN 978-3-642-55041-6.
- ^ a b Legato MJ, Bilezikian JP (2004). Principles of Gender-specific Medicine. Gulf Professional Publishing. pp. 146–. ISBN 978-0-12-440906-4.
- ^ Lemke TL, Williams DA (24 January 2012). Foye’s Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. p. 164. ISBN 978-1-60913-345-0.
- ^ Estrogens—Advances in Research and Application: 2013 Edition: ScholarlyBrief. ScholarlyEditions. 21 June 2013. pp. 4–. ISBN 978-1-4816-7550-5.
- ^ Strünker T, Goodwin N, Brenker C, Kashikar ND, Weyand I, Seifert R, Kaupp UB (March 2011). «The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm». Nature. 471 (7338): 382–6. Bibcode:2011Natur.471..382S. doi:10.1038/nature09769. PMID 21412338. S2CID 4431334.
- ^ Lishko PV, Botchkina IL, Kirichok Y (March 2011). «Progesterone activates the principal Ca2+ channel of human sperm». Nature. 471 (7338): 387–91. Bibcode:2011Natur.471..387L. doi:10.1038/nature09767. PMID 21412339. S2CID 4340309.
- ^ Prior JC (2020). «Women’s reproductive system as balanced estradiol and progesterone actions—A revolutionary, paradigm-shifting concept in women’s health». Drug Discovery Today: Disease Models. 32, Part B: 31–40. doi:10.1016/j.ddmod.2020.11.005.
- ^ Kastner P, Krust A, Turcotte B, Stropp U, Tora L, Gronemeyer H, Chambon P (May 1990). «Two distinct estrogen-regulated promoters generate transcripts encoding the two functionally different human progesterone receptor forms A and B». The EMBO Journal. 9 (5): 1603–14. doi:10.1002/j.1460-2075.1990.tb08280.x. PMC 551856. PMID 2328727.
- ^ a b Hallam SZ, Osuch JR (1 January 2006). Hormones and Breast Cancer in Post-Menopausal Women. IOS Press. p. 69. ISBN 978-1-58603-653-9.
- ^ a b Johnson LR (2003). Essential Medical Physiology. Academic Press. p. 770. ISBN 978-0-12-387584-6.
- ^ a b Coad J, Dunstall M (2011). Anatomy and Physiology for Midwives, with Pageburst online access,3: Anatomy and Physiology for Midwives. Elsevier Health Sciences. p. 413. ISBN 978-0-7020-3489-3.
- ^ Landau RL, Bergenstal DM, Lugibihl K, Kascht ME (October 1955). «The metabolic effects of progesterone in man». The Journal of Clinical Endocrinology and Metabolism. 15 (10): 1194–215. doi:10.1210/jcem-15-10-1194. PMID 13263410.
- ^ Correia JN, Conner SJ, Kirkman-Brown JC (May 2007). «Non-genomic steroid actions in human spermatozoa. «Persistent tickling from a laden environment»«. Seminars in Reproductive Medicine. 25 (3): 208–19. doi:10.1055/s-2007-973433. PMID 17447210.
- ^ Kirkman-Brown JC, Bray C, Stewart PM, Barratt CL, Publicover SJ (June 2000). «Biphasic elevation of [Ca(2+)](i) in individual human spermatozoa exposed to progesterone». Developmental Biology. 222 (2): 326–35. doi:10.1006/dbio.2000.9729. PMID 10837122.
- ^ Kirkman-Brown JC, Barratt CL, Publicover SJ (March 2004). «Slow calcium oscillations in human spermatozoa». The Biochemical Journal. 378 (Pt 3): 827–32. doi:10.1042/BJ20031368. PMC 1223996. PMID 14606954.
- ^ Harper CV, Barratt CL, Publicover SJ (October 2004). «Stimulation of human spermatozoa with progesterone gradients to simulate approach to the oocyte. Induction of [Ca(2+)](i) oscillations and cyclical transitions in flagellar beating». The Journal of Biological Chemistry. 279 (44): 46315–25. doi:10.1074/jbc.M401194200. PMID 15322137.
- ^ Marieb, Elaine (2013). Anatomy & physiology. Benjamin-Cummings. p. 903. ISBN 9780321887603.
- ^ Tosti E, Di Cosmo A, Cuomo A, Di Cristo C, Gragnaniello G (May 2001). «Progesterone induces activation in Octopus vulgaris spermatozoa». Molecular Reproduction and Development. 59 (1): 97–105. doi:10.1002/mrd.1011. PMID 11335951. S2CID 28390608.
- ^ a b Bowen R (2000-08-06). «Placental Hormones». Retrieved 2008-03-12.
- ^ Patel B, Elguero S, Thakore S, Dahoud W, Bedaiwy M, Mesiano S (2014). «Role of nuclear progesterone receptor isoforms in uterine pathophysiology». Human Reproduction Update. 21 (2): 155–73. doi:10.1093/humupd/dmu056. PMC 4366574. PMID 25406186.
- ^ a b Di Renzo GC, Giardina I, Clerici G, Brillo E, Gerli S (July 2016). «Progesterone in normal and pathological pregnancy». Hormone Molecular Biology and Clinical Investigation. 27 (1): 35–48. doi:10.1515/hmbci-2016-0038. PMID 27662646. S2CID 32239449.
- ^ Macias H, Hinck L (2012). «Mammary gland development». Wiley Interdisciplinary Reviews: Developmental Biology. 1 (4): 533–57. doi:10.1002/wdev.35. PMC 3404495. PMID 22844349.
- ^ a b c Hilton HN, Graham JD, Clarke CL (September 2015). «Minireview: Progesterone Regulation of Proliferation in the Normal Human Breast and in Breast Cancer: A Tale of Two Scenarios?». Molecular Endocrinology. 29 (9): 1230–42. doi:10.1210/me.2015-1152. PMC 5414684. PMID 26266959.
- ^ Strauss JF, Barbieri RL (13 September 2013). Yen and Jaffe’s Reproductive Endocrinology. Elsevier Health Sciences. pp. 236–. ISBN 978-1-4557-2758-2.
- ^ Scaling AL, Prossnitz ER, Hathaway HJ (June 2014). «GPER mediates estrogen-induced signaling and proliferation in human breast epithelial cells and normal and malignant breast». Hormones & Cancer. 5 (3): 146–160. doi:10.1007/s12672-014-0174-1. PMC 4091989. PMID 24718936.
- ^ a b c d e Aupperlee MD, Leipprandt JR, Bennett JM, Schwartz RC, Haslam SZ (May 2013). «Amphiregulin mediates progesterone-induced mammary ductal development during puberty». Breast Cancer Research. 15 (3): R44. doi:10.1186/bcr3431. PMC 3738150. PMID 23705924.
- ^ a b Kuhl H, Schneider HP (August 2013). «Progesterone—promoter or inhibitor of breast cancer». Climacteric. 16 Suppl 1: 54–68. doi:10.3109/13697137.2013.768806. PMID 23336704. S2CID 20808536.
- ^ a b c Trabert B, Sherman ME, Kannan N, Stanczyk FZ (April 2020). «Progesterone and Breast Cancer». Endocr Rev. 41 (2): 320–344. doi:10.1210/endrev/bnz001. PMC 7156851. PMID 31512725.
- ^ Collaborative Group on Hormonal Factors in Breast Cancer (September 2019). «Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence». Lancet. 394 (10204): 1159–1168. doi:10.1016/S0140-6736(19)31709-X. PMC 6891893. PMID 31474332.
- ^ Stute P, Wildt L, Neulen J (April 2018). «The impact of micronized progesterone on breast cancer risk: a systematic review». Climacteric. 21 (2): 111–122. doi:10.1080/13697137.2017.1421925. PMID 29384406. S2CID 3642971.
- ^ Asi N, Mohammed K, Haydour Q, Gionfriddo MR, Vargas OL, Prokop LJ, Faubion SS, Murad MH (July 2016). «Progesterone vs. synthetic progestins and the risk of breast cancer: a systematic review and meta-analysis». Syst Rev. 5 (1): 121. doi:10.1186/s13643-016-0294-5. PMC 4960754. PMID 27456847.
- ^ Gompel A, Plu-Bureau G (August 2018). «Progesterone, progestins and the breast in menopause treatment». Climacteric. 21 (4): 326–332. doi:10.1080/13697137.2018.1476483. PMID 29852797. S2CID 46922084.
- ^ Davey DA (October 2018). «Menopausal hormone therapy: a better and safer future». Climacteric. 21 (5): 454–461. doi:10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ a b c d e f g h Raine-Fenning NJ, Brincat MP, Muscat-Baron Y (2003). «Skin aging and menopause : implications for treatment». American Journal of Clinical Dermatology. 4 (6): 371–8. doi:10.2165/00128071-200304060-00001. PMID 12762829. S2CID 20392538.
- ^ a b c d e f g h Holzer G, Riegler E, Hönigsmann H, Farokhnia S, Schmidt JB, Schmidt B (September 2005). «Effects and side-effects of 2% progesterone cream on the skin of peri- and postmenopausal women: results from a double-blind, vehicle-controlled, randomized study». The British Journal of Dermatology. 153 (3): 626–34. doi:10.1111/j.1365-2133.2005.06685.x. PMID 16120154. S2CID 6077829.
- ^ King SR (9 November 2012). Neurosteroids and the Nervous System. Springer Science & Business Media. pp. 44–46. ISBN 978-1-4614-5559-2.
- ^ Fleischman DS, Fessler DM, Cholakians AE (July 2015). «Testing the Affiliation Hypothesis of Homoerotic Motivation in Humans: The Effects of Progesterone and Priming». Archives of Sexual Behavior. 44 (5): 1395–404. doi:10.1007/s10508-014-0436-6. PMID 25420899. S2CID 9864224.
- ^ «Homosexuality may help us bond | UoP News». Archived from the original on 2019-07-02. Retrieved 2019-07-02.
- ^ Having homosexual thoughts ‘is an essential part of human evolution’ study suggests The Telegraph
- ^ Homosexuality May Have Evolved In Humans Because It Helps Us Bond, Scientists Say Huff Post
- ^ a b c Hanukoglu I, Karavolas HJ, Goy RW (April 1977). «Progesterone metabolism in the pineal, brain stem, thalamus and corpus callosum of the female rat». Brain Research. 125 (2): 313–24. doi:10.1016/0006-8993(77)90624-2. PMID 558037. S2CID 35814845.
- ^ Schumacher M, Guennoun R, Robert F, Carelli C, Gago N, Ghoumari A, Gonzalez Deniselle MC, Gonzalez SL, Ibanez C, Labombarda F, Coirini H, Baulieu EE, De Nicola AF (June 2004). «Local synthesis and dual actions of progesterone in the nervous system: neuroprotection and myelination». Growth Hormone & IGF Research. 14 Suppl A: S18-33. doi:10.1016/j.ghir.2004.03.007. PMID 15135772.
- ^ Roof RL, Hall ED (May 2000). «Gender differences in acute CNS trauma and stroke: neuroprotective effects of estrogen and progesterone». Journal of Neurotrauma. 17 (5): 367–88. doi:10.1089/neu.2000.17.367. PMID 10833057.
- ^ Pan DS, Liu WG, Yang XF, Cao F (October 2007). «Inhibitory effect of progesterone on inflammatory factors after experimental traumatic brain injury». Biomedical and Environmental Sciences. 20 (5): 432–8. PMID 18188998.
- ^ Jiang C, Zuo F, Wang Y, Wan J, Yang Z, Lu H, Chen W, Zang W, Yang Q, Wang J (June 2016). «Progesterone exerts neuroprotective effects and improves long-term neurologic outcome after intracerebral hemorrhage in middle-aged mice». Neurobiology of Aging. 42: 13–24. doi:10.1016/j.neurobiolaging.2016.02.029. PMC 4857017. PMID 27143417.
- ^ a b Luoma JI, Stern CM, Mermelstein PG (August 2012). «Progesterone inhibition of neuronal calcium signaling underlies aspects of progesterone-mediated neuroprotection». The Journal of Steroid Biochemistry and Molecular Biology. 131 (1–2): 30–6. doi:10.1016/j.jsbmb.2011.11.002. PMC 3303940. PMID 22101209.
- ^ a b c Stein DG (March 2008). «Progesterone exerts neuroprotective effects after brain injury». Brain Research Reviews. 57 (2): 386–97. doi:10.1016/j.brainresrev.2007.06.012. PMC 2699575. PMID 17826842.
- ^ Espinoza TR, Wright DW (2011). «The role of progesterone in traumatic brain injury». The Journal of Head Trauma Rehabilitation. 26 (6): 497–9. doi:10.1097/HTR.0b013e31823088fa. PMC 6025750. PMID 22088981.
- ^ Jiang C, Zuo F, Wang Y, Lu H, Yang Q, Wang J (January 2017). «Progesterone Changes VEGF and BDNF Expression and Promotes Neurogenesis After Ischemic Stroke». Mol Neurobiol. 54 (1): 571–581. doi:10.1007/s12035-015-9651-y. PMC 4938789. PMID 26746666.
- ^ Herson PS, Koerner IP, Hurn PD (May 2009). «Sex, sex steroids, and brain injury». Seminars in Reproductive Medicine. 27 (3): 229–39. doi:10.1055/s-0029-1216276. PMC 2675922. PMID 19401954.
- ^ Li Z, Wang B, Kan Z, Zhang B, Yang Z, Chen J, Wang D, Wei H, Zhang JN, Jiang R (January 2012). «Progesterone increases circulating endothelial progenitor cells and induces neural regeneration after traumatic brain injury in aged rats». Journal of Neurotrauma. 29 (2): 343–53. doi:10.1089/neu.2011.1807. PMC 3261789. PMID 21534727.
- ^ a b Lynch WJ, Sofuoglu M (December 2010). «Role of progesterone in nicotine addiction: evidence from initiation to relapse». Experimental and Clinical Psychopharmacology. 18 (6): 451–61. doi:10.1037/a0021265. PMC 3638762. PMID 21186920.
- ^ Cosgrove KP, Esterlis I, McKee SA, Bois F, Seibyl JP, Mazure CM, Krishnan-Sarin S, Staley JK, Picciotto MR, O’Malley SS (April 2012). «Sex differences in availability of β2*-nicotinic acetylcholine receptors in recently abstinent tobacco smokers». Archives of General Psychiatry. 69 (4): 418–27. doi:10.1001/archgenpsychiatry.2011.1465. PMC 3508698. PMID 22474108.
- ^ Mello NK, Knudson IM, Kelly M, Fivel PA, Mendelson JH (October 2011). «Effects of progesterone and testosterone on cocaine self-administration and cocaine discrimination by female rhesus monkeys». Neuropsychopharmacology. 36 (11): 2187–99. doi:10.1038/npp.2011.130. PMC 3176575. PMID 21796112.
- ^ Buser, Thomas (2012-06-01). «The impact of the menstrual cycle and hormonal contraceptives on competitiveness». Journal of Economic Behavior & Organization. Gender Differences in Risk Aversion and Competition. 83 (1): 1–10. doi:10.1016/j.jebo.2011.06.006. ISSN 0167-2681.
- ^ Sriram, D (2007). Medicinal Chemistry. New Delhi: Dorling Kindersley India Pvt. Ltd. p. 432. ISBN 978-81-317-0031-0.
- ^ a b Blackburn S (14 April 2014). Maternal, Fetal, & Neonatal Physiology. Elsevier Health Sciences. pp. 92–. ISBN 978-0-323-29296-2.
- ^ Faivre EJ, Lange CA (January 2007). «Progesterone receptors upregulate Wnt-1 to induce epidermal growth factor receptor transactivation and c-Src-dependent sustained activation of Erk1/2 mitogen-activated protein kinase in breast cancer cells». Molecular and Cellular Biology. 27 (2): 466–80. doi:10.1128/MCB.01539-06. PMC 1800800. PMID 17074804.
- ^ Nosek, Thomas M. «Section 5/5ch9/s5ch9_13». Essentials of Human Physiology. Archived from the original on 2016-03-24.
- ^ Rothchild, Irving (1969), Salhanick, Hilton A.; Kipnis, David M.; Wiele, Raymond L. Vande (eds.), «The Physiologic Basis for the Temperature Raising Effect of Progesterone», Metabolic Effects of Gonadal Hormones and Contraceptive Steroids, Boston, MA: Springer US, pp. 668–675, doi:10.1007/978-1-4684-1782-1_49, ISBN 978-1-4684-1782-1, retrieved 2021-03-22
- ^ Hould FS, Fried GM, Fazekas AG, Tremblay S, Mersereau WA (December 1988). «Progesterone receptors regulate gallbladder motility». The Journal of Surgical Research. 45 (6): 505–12. doi:10.1016/0022-4804(88)90137-0. PMID 3184927.
- ^ «Hormones and Oral Health». WebMD.
- ^ Picard F, Wanatabe M, Schoonjans K, Lydon J, O’Malley BW, Auwerx J (November 2002). «Progesterone receptor knockout mice have an improved glucose homeostasis secondary to beta -cell proliferation». Proceedings of the National Academy of Sciences of the United States of America. 99 (24): 15644–8. doi:10.1073/pnas.202612199. PMC 137770. PMID 12438645.
- ^ Brănişteanu DD, Mathieu C (March 2003). «Progesterone in gestational diabetes mellitus: guilty or not guilty?». Trends in Endocrinology and Metabolism. 14 (2): 54–6. doi:10.1016/S1043-2760(03)00003-1. PMID 12591170. S2CID 38209977.
- ^ Häggström M, Richfield D (2014). «Diagram of the pathways of human steroidogenesis». WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436.
- ^ Bewick PM (2002). Medicinal natural products: a biosynthetic approach. New York: Wiley. p. 244. ISBN 0-471-49641-3.
- ^ Duport C, Spagnoli R, Degryse E, Pompon D (February 1998). «Self-sufficient biosynthesis of pregnenolone and progesterone in engineered yeast». Nature Biotechnology. 16 (2): 186–9. doi:10.1038/nbt0298-186. PMID 9487528. S2CID 852617.
- ^ Lemke TL, Williams DA (24 January 2012). Foye’s Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1397–. ISBN 978-1-60913-345-0.
- ^ Progesterone — Drugs.com, retrieved 2015-08-23
- ^ a b c Falcone T, Hurd WW (2007). Clinical Reproductive Medicine and Surgery. Elsevier Health Sciences. pp. 22–. ISBN 978-0-323-03309-1.
- ^ a b c d Cupps PT (20 February 1991). Reproduction in Domestic Animals. Elsevier. pp. 101–. ISBN 978-0-08-057109-6.
- ^ a b c d e f g h i Stanczyk FZ (November 2003). «All progestins are not created equal». Steroids. 68 (10–13): 879–90. doi:10.1016/j.steroids.2003.08.003. PMID 14667980. S2CID 44601264.
- ^ Dowd FJ, Johnson B, Mariotti A (3 September 2016). Pharmacology and Therapeutics for Dentistry. Elsevier Health Sciences. pp. 448–. ISBN 978-0-323-44595-5.
- ^ a b c d Kuhl H (August 2005). «Pharmacology of estrogens and progestogens: influence of different routes of administration». Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b Plant TM, Zeleznik AJ (15 November 2014). Knobil and Neill’s Physiology of Reproduction. Academic Press. pp. 304–. ISBN 978-0-12-397769-4.
- ^ a b Santoro NF, Neal-Perry G (11 September 2010). Amenorrhea: A Case-Based, Clinical Guide. Springer Science & Business Media. pp. 13–. ISBN 978-1-60327-864-5.
- ^ Reddy DS (2010). Neurosteroids: endogenous role in the human brain and therapeutic potentials. Progress in Brain Research. Vol. 186. pp. 113–37. doi:10.1016/B978-0-444-53630-3.00008-7. PMC 3139029. PMID 21094889.
- ^ a b Baulieu E, Kelly PA (30 November 1990). Hormones: From Molecules to Disease. Springer Science & Business Media. pp. 401–. ISBN 978-0-412-02791-8.
- ^ Beranič N, Gobec S, Rižner TL (2011). «Progestins as inhibitors of the human 20-ketosteroid reductases, AKR1C1 and AKR1C3». Chem. Biol. Interact. 191 (1–3): 227–33. doi:10.1016/j.cbi.2010.12.012. PMID 21182831.
- ^ Anderson GD, Odegard PS (October 2004). «Pharmacokinetics of estrogen and progesterone in chronic kidney disease». Adv Chronic Kidney Dis. 11 (4): 357–60. doi:10.1053/j.ackd.2004.07.001. PMID 15492972.
- ^ Greenblatt JM, Brogan K (27 April 2016). Integrative Therapies for Depression: Redefining Models for Assessment, Treatment and Prevention. CRC Press. pp. 201–. ISBN 978-1-4987-0230-0.
- ^ Graham C (2 December 2012). Reproductive Biology of the Great Apes: Comparative and Biomedical Perspectives. Elsevier. pp. 179–. ISBN 978-0-323-14971-6.
- ^ Strushkevich, N.; Gilep, A. A.; Shen, L.; Arrowsmith, C. H.; Edwards, A. M.; Usanov, S. A.; Park, H. W. (2013). «Structural Insights into Aldosterone Synthase Substrate Specificity and Targeted Inhibition». Molecular Endocrinology. 27 (2): 315–324. doi:10.1210/me.2012-1287. PMC 5417327. PMID 23322723.
- ^ van Rooyen D, Gent R, Barnard L, Swart AC (April 2018). «The in vitro metabolism of 11β-hydroxyprogesterone and 11-ketoprogesterone to 11-ketodihydrotestosterone in the backdoor pathway». The Journal of Steroid Biochemistry and Molecular Biology. 178: 203–212. doi:10.1016/j.jsbmb.2017.12.014. PMID 29277707. S2CID 3700135.
- ^ a b de Azevedo Piccinato C (2008). Regulation of Steroid Metabolism and the Hepatic Transcriptome by Estradiol and Progesterone. pp. 24–25. ISBN 978-1-109-04632-8.[permanent dead link]
- ^ Akalin S (January 1991). «Effects of ketoconazole in hirsute women». Acta Endocrinologica. 124 (1): 19–22. doi:10.1530/acta.0.1240019. PMID 1825737. S2CID 9831739.
- ^ Aufrère MB, Benson H (June 1976). «Progesterone: an overview and recent advances». Journal of Pharmaceutical Sciences. 65 (6): 783–800. doi:10.1002/jps.2600650602. PMID 945344.
- ^ Stricker R, Eberhart R, Chevailler MC, Quinn FA, Bischof P, Stricker R (2006). «Establishment of detailed reference values for luteinizing hormone, follicle stimulating hormone, estradiol, and progesterone during different phases of the menstrual cycle on the Abbott ARCHITECT analyzer». Clin. Chem. Lab. Med. 44 (7): 883–7. doi:10.1515/CCLM.2006.160. PMID 16776638. S2CID 524952.
- ^ Csapo AI, Pulkkinen MU, Wiest WG (1973). «Effects of lutectomy and progestreone replacement therapy in early pregnancy patients». Am J Obstet Gynecol. 115 (6): 759–65. doi:10.1016/0002-9378(73)90517-6. PMID 4688578.
- ^ NIH Clinical Center (2004-08-16). «Progesterone Historical Reference Ranges». United States National Institutes of Health. Archived from the original on 2009-01-09. Retrieved 2008-03-12.
- ^ a b c d e f g h i Progesterone Reference Ranges, Performed at the Clinical Center at the National Institutes of Health, Bethesda MD, 03Feb09
- ^ a b c d e f g h Converted from mass values using molar mass of 314.46 g/mol
- ^ Häggström, Mikael (2014). «Reference ranges for estradiol, progesterone, luteinizing hormone and follicle-stimulating hormone during the menstrual cycle». WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.001. ISSN 2002-4436.
- ^ Goodson III WH, Handagama P, Moore II DH, Dairkee S (2007-12-13). «Milk products are a source of dietary progesterone». 30th Annual San Antonio Breast Cancer Symposium. pp. abstract # 2028. Retrieved 2008-03-12.
- ^ Pauli GF, Friesen JB, Gödecke T, Farnsworth NR, Glodny B (March 2010). «Occurrence of progesterone and related animal steroids in two higher plants». Journal of Natural Products. 73 (3): 338–45. doi:10.1021/np9007415. PMID 20108949. S2CID 26467578.
- ^ Applezweig N (May 1969). «Steroids». Chemical Week. 104: 57–72. PMID 12255132.
- ^ Noguchi E, Fujiwara Y, Matsushita S, Ikeda T, Ono M, Nohara T (September 2006). «Metabolism of tomato steroidal glycosides in humans». Chemical & Pharmaceutical Bulletin. 54 (9): 1312–4. doi:10.1248/cpb.54.1312. PMID 16946542.
- ^ Yang DJ, Lu TJ, Hwang LS (October 2003). «Isolation and identification of steroidal saponins in Taiwanese yam cultivar (Dioscorea pseudojaponica Yamamoto)» (PDF). Journal of Agricultural and Food Chemistry. 51 (22): 6438–44. doi:10.1021/jf030390j. PMID 14558759.
- ^ «Final report of the amended safety assessment of Dioscorea Villosa (Wild Yam) root extract». International Journal of Toxicology. 23 Suppl 2 (2_suppl): 49–54. 2004. doi:10.1080/10915810490499055. PMID 15513824. S2CID 962216.
- ^ Niño J, Jiménez DA, Mosquera OM, Correa YM (2007). «Diosgenin quantification by HPLC in a Dioscorea polygonoides tuber collection from colombian flora». Journal of the Brazilian Chemical Society. 18 (5): 1073–1076. doi:10.1590/S0103-50532007000500030.
- ^ Myoda T, Nagai T, Nagashima T (2005). Properties of starches in yam (Dioscorea spp.) tuber. Current Topics in Food Science and Technology. pp. 105–114. ISBN 81-308-0003-9.
- ^ Wesp LM, Deutsch MB (2017). «Hormonal and Surgical Treatment Options for Transgender Women and Transfeminine Spectrum Persons». Psychiatr. Clin. North Am. 40 (1): 99–111. doi:10.1016/j.psc.2016.10.006. PMID 28159148.
- ^ Ruan X, Mueck AO (November 2014). «Systemic progesterone therapy—oral, vaginal, injections and even transdermal?». Maturitas. 79 (3): 248–55. doi:10.1016/j.maturitas.2014.07.009. PMID 25113944.
- ^ Filicori M (2015). «Clinical roles and applications of progesterone in reproductive medicine: an overview». Acta Obstet Gynecol Scand. 94 Suppl 161: 3–7. doi:10.1111/aogs.12791. PMID 26443945.
- ^ Ciampaglia W, Cognigni GE (2015). «Clinical use of progesterone in infertility and assisted reproduction». Acta Obstet Gynecol Scand. 94 Suppl 161: 17–27. doi:10.1111/aogs.12770. PMID 26345161. S2CID 40753277.
- ^ Choi SJ (2017). «Use of progesterone supplement therapy for prevention of preterm birth: review of literatures». Obstet Gynecol Sci. 60 (5): 405–420. doi:10.5468/ogs.2017.60.5.405. PMC 5621069. PMID 28989916.
- ^ Coomarasamy A, Harb HM, Devall AJ, Cheed V, Roberts TE, Goranitis I, et al. (June 2020). «Progesterone to prevent miscarriage in women with early pregnancy bleeding: the PRISM RCT». Health Technology Assessment. 24 (33): 1–70. doi:10.3310/hta24330. PMC 7355406. PMID 32609084.
- ^ a b Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 1024–. ISBN 978-1-4757-2085-3.
- ^ a b Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 880–. ISBN 978-3-88763-075-1.
- ^ Numazawa M, Nagaoka M, Kunitama Y (September 1986). «Regiospecific deoxygenation of the dihydroxyacetone moiety at C-17 of corticoid steroids with iodotrimethylsilane». Chemical & Pharmaceutical Bulletin. 34 (9): 3722–6. doi:10.1248/cpb.34.3722. PMID 3815593.
- ^ a b Marker RE, Krueger J (1940). «Sterols. CXII. Sapogenins. XLI. The Preparation of Trillin and its Conversion to Progesterone». J. Am. Chem. Soc. 62 (12): 3349–3350. doi:10.1021/ja01869a023.
- ^ Goswami, Amrit; Kotoky, Rumi; Rastogi, Romesh C.; Ghosh, Anil C. (1 May 2003). «A One-Pot Efficient Process for 16-Dehydropregnenolone Acetate». Organic Process Research & Development. 7 (3): 306–308. doi:10.1021/op0200625.
- ^ Heyl FW (1950). «Progesterone from 3-Acetoxybisnor-5-cholenaldehyde and 3-Ketobisnor-4-cholenaldehyde». Journal of the American Chemical Society. 72 (6): 2617–2619. doi:10.1021/ja01162a076.
- ^ Slomp G (1958). «Ozonolysis. II. 1 The Effect of Pyridine on the Ozonolysis of 4,22-Stigmastadien-3-one 2». Journal of the American Chemical Society. 80 (4): 915–921. doi:10.1021/ja01537a041.
- ^ Sundararaman P, Djerassi C (October 1977). «A convenient synthesis of progesterone from stigmasterol». The Journal of Organic Chemistry. 42 (22): 3633–4. doi:10.1021/jo00442a044. PMID 915584.
- ^ «Nova Transcripts: Forgotten Genius». PBS.org. February 6, 2007.
- ^ «Giants of the Past». lipidlibrary.aocs.org. Archived from the original on 2012-04-15.
- ^ a b c Johnson WS, Gravestock MB, McCarry BE (August 1971). «Acetylenic bond participation in biogenetic-like olefinic cyclizations. II. Synthesis of dl-progesterone». Journal of the American Chemical Society. 93 (17): 4332–4. doi:10.1021/ja00746a062. PMID 5131151.
- ^ Corner, George W.; Allen, Willard M. (1929-03-01). «Physiology of the corpus luteum». American Journal of Physiology. Legacy Content. 88 (2): 326–339. doi:10.1152/ajplegacy.1929.88.2.326. ISSN 0002-9513.
- ^ a b c Coutinho EM, Segal SJ (1999). Is Menstruation Obsolete?. Oxford University Press. pp. 31–. ISBN 978-0-19-513021-8.
- ^ Walker A (7 March 2008). The Menstrual Cycle. Routledge. pp. 49–. ISBN 978-1-134-71411-7.
- ^ Piosik R (2003). «Adolf Butenandt und sein Wirken an der Technischen Hochschule Danzig». Chemkon. 10 (3): 135–138. doi:10.1002/ckon.200390038.
- ^ Ginsburg B (6 December 2012). Premenstrual Syndrome: Ethical and Legal Implications in a Biomedical Perspective. Springer Science & Business Media. pp. 274–. ISBN 978-1-4684-5275-4.
- ^ Rolleston HD (1936). The Endocrine Organs in Health and Disease: With an Historical Review. Oxford University Press, H. Milford. p. 406.
- ^ Allen WM (October 1970). «Progesterone: how did the name originate?». Southern Medical Journal. 63 (10): 1151–5. doi:10.1097/00007611-197010000-00012. PMID 4922128. S2CID 35867375.
- ^ Refsal K (February 2009). «Interpretation of Serum Progesterone Results for Management of Breeding in Dogs» (PDF). Webcd.endo.ref.
External links[edit]
- Progesterone MS Spectrum
- Progesterone at the US National Library of Medicine Medical Subject Headings (MeSH)
- Kimball JW (2007-05-27). «Progesterone». Kimball’s Biology Pages. Archived from the original on 2008-06-18. Retrieved 2008-06-18.
This article is about progesterone as a hormone. For its use as a medication, see progesterone (medication).

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
(1S,3aS,3bS,9aR,9bS,11aS)-1-Acetyl-9a,11a-dimethyl-1,2,3,3a,3b,4,5,8,9,9a,9b,10,11,11a-tetradecahydro-7H-cyclopenta[a]phenanthren-7-one |
|
| Other names
P4;[1] Pregnenedione; Pregn-4-ene-3,20-dione[2][3] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.000.318 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C21H30O2 |
| Molar mass | 314.469 g/mol |
| Melting point | 126 |
| log P | 4.04[4] |
| Pharmacology | |
|
ATC code |
G03DA04 (WHO) |
|
Routes of |
By mouth, topical/transdermal, vaginal, intramuscular injection, subcutaneous injection, subcutaneous implant |
| Pharmacokinetics: | |
|
Bioavailability |
OMP: <10%[5][6] |
|
Protein binding |
• Albumin: 80% • CBG: 18% • SHBG: <1% • Free: 1–2%[7][8] |
|
Metabolism |
Hepatic (CYP2C19, CYP3A4, CYP2C9, 5α-reductase, 3α-HSD, 17α-hydroxylase, 21-hydroxylase, 20α-HSD)[9][10] |
|
Biological half-life |
OMP: 16–18 hours[5][6][11] IM: 22–26 hours[6][12] SC: 13–18 hours[12] |
|
Excretion |
Renal |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Progesterone (P4) is an endogenous steroid and progestogen sex hormone involved in the menstrual cycle, pregnancy, and embryogenesis of humans and other species.[1][13] It belongs to a group of steroid hormones called the progestogens[13] and is the major progestogen in the body. Progesterone has a variety of important functions in the body. It is also a crucial metabolic intermediate in the production of other endogenous steroids, including the sex hormones and the corticosteroids, and plays an important role in brain function as a neurosteroid.[14]
In addition to its role as a natural hormone, progesterone is also used as a medication, such as in combination with estrogen for contraception, to reduce the risk of uterine or cervical cancer, in hormone replacement therapy, and in feminizing hormone therapy.[15] It was first prescribed in 1934.[16]
Biological activity[edit]
Progesterone is the most important progestogen in the body. As a potent agonist of the nuclear progesterone receptor (nPR) (with an affinity of KD = 1 nM) the resulting effects on ribosomal transcription plays a major role in regulation of female reproduction.[13][17][18] In addition, progesterone is an agonist of the more recently discovered membrane progesterone receptors (mPRs),[19] of which the expression has regulation effects in reproduction function (oocyte maturation, labor, and sperm motility) and cancer although additional research is required to further define the roles.[20] It also functions as a ligand of the PGRMC1 (progesterone receptor membrane component 1) which impacts tumor progression, metabolic regulation, and viability control of nerve cells.[21][22][23] Moreover, progesterone is also known to be an antagonist of the sigma σ1 receptor,[24][25] a negative allosteric modulator of nicotinic acetylcholine receptors,[14] and a potent antagonist of the mineralocorticoid receptor (MR).[26] Progesterone prevents MR activation by binding to this receptor with an affinity exceeding even those of aldosterone and glucocorticoids such as cortisol and corticosterone,[26] and produces antimineralocorticoid effects, such as natriuresis, at physiological concentrations.[27] In addition, progesterone binds to and behaves as a partial agonist of the glucocorticoid receptor (GR), albeit with very low potency (EC50 >100-fold less relative to cortisol).[28][29]
Progesterone, through its neurosteroid active metabolites such as 5α-dihydroprogesterone and allopregnanolone, acts indirectly as a positive allosteric modulator of the GABAA receptor.[30]
Progesterone and some of its metabolites, such as 5β-dihydroprogesterone, are agonists of the pregnane X receptor (PXR),[31] albeit weakly so (EC50 >10 μM).[32] In accordance, progesterone induces several hepatic cytochrome P450 enzymes,[33] such as CYP3A4,[34][35] especially during pregnancy when concentrations are much higher than usual.[36] Perimenopausal women have been found to have greater CYP3A4 activity relative to men and postmenopausal women, and it has been inferred that this may be due to the higher progesterone levels present in perimenopausal women.[34]
Progesterone modulates the activity of CatSper (cation channels of sperm) voltage-gated Ca2+ channels. Since eggs release progesterone, sperm may use progesterone as a homing signal to swim toward eggs (chemotaxis). As a result, it has been suggested that substances that block the progesterone binding site on CatSper channels could potentially be used in male contraception.[37][38]
Biological function[edit]
During the menstrual cycle, levels of estradiol (an estrogen) vary by 200 percent. Levels of progesterone vary by over 1200 percent.[39]
Hormonal interactions[edit]
Progesterone has a number of physiological effects that are amplified in the presence of estrogens. Estrogens through estrogen receptors (ERs) induce or upregulate the expression of the PR.[40] One example of this is in breast tissue, where estrogens allow progesterone to mediate lobuloalveolar development.[41][42][43]
Elevated levels of progesterone potently reduce the sodium-retaining activity of aldosterone, resulting in natriuresis and a reduction in extracellular fluid volume. Progesterone withdrawal, on the other hand, is associated with a temporary increase in sodium retention (reduced natriuresis, with an increase in extracellular fluid volume) due to the compensatory increase in aldosterone production, which combats the blockade of the mineralocorticoid receptor by the previously elevated level of progesterone.[44]
Reproductive system[edit]
Progesterone has key effects via non-genomic signalling on human sperm as they migrate through the female tract before fertilization occurs, though the receptor(s) as yet remain unidentified.[45] Detailed characterisation of the events occurring in sperm in response to progesterone has elucidated certain events including intracellular calcium transients and maintained changes,[46] slow calcium oscillations,[47] now thought to possibly regulate motility.[48] It is produced by the ovaries.[49] Progesterone has also been shown to demonstrate effects on octopus spermatozoa.[50]
Progesterone is sometimes called the «hormone of pregnancy»,[51] and it has many roles relating to the development of the fetus:
- Progesterone converts the endometrium to its secretory stage to prepare the uterus for implantation. At the same time progesterone affects the vaginal epithelium and cervical mucus, making it thick and impenetrable to sperm. Progesterone is anti-mitogenic in endometrial epithelial cells, and as such, mitigates the tropic effects of estrogen.[52] If pregnancy does not occur, progesterone levels will decrease, leading to menstruation. Normal menstrual bleeding is progesterone-withdrawal bleeding. If ovulation does not occur and the corpus luteum does not develop, levels of progesterone may be low, leading to anovulatory dysfunctional uterine bleeding.
- During implantation and gestation, progesterone appears to decrease the maternal immune response to allow for the acceptance of the pregnancy.[53]
- Progesterone decreases contractility of the uterine smooth muscle.[51] This effect contributes to prevention of preterm labor.[53]
- A drop in progesterone levels is possibly one step that facilitates the onset of labor.
- In addition, progesterone inhibits lactation during pregnancy. The fall in progesterone levels following delivery is one of the triggers for milk production.
The fetus metabolizes placental progesterone in the production of adrenal steroids.
Breasts[edit]
Lobuloalveolar development[edit]
Progesterone plays an important role in breast development in women. In conjunction with prolactin, it mediates lobuloalveolar maturation of the mammary glands during pregnancy to allow for milk production and thus lactation and breastfeeding of offspring following parturition (childbirth).[54] Estrogen induces expression of the PR in breast tissue and hence progesterone is dependent on estrogen to mediate lobuloalveolar development.[41][42][43] It has been found that RANKL is a critical downstream mediator of progesterone-induced lobuloalveolar maturation.[55] RANKL knockout mice show an almost identical mammary phenotype to PR knockout mice, including normal mammary ductal development but complete failure of the development of lobuloalveolar structures.[55]
Ductal development[edit]
Though to a far lesser extent than estrogen, which is the major mediator of mammary ductal development (via the ERα),[56][57] progesterone may be involved in ductal development of the mammary glands to some extent as well.[58] PR knockout mice or mice treated with the PR antagonist mifepristone show delayed although otherwise normal mammary ductal development at puberty.[58] In addition, mice modified to have overexpression of PRA display ductal hyperplasia,[55] and progesterone induces ductal growth in the mouse mammary gland.[58] Progesterone mediates ductal development mainly via induction of the expression of amphiregulin, the same growth factor that estrogen primarily induces the expression of to mediate ductal development.[58] These animal findings suggest that, while not essential for full mammary ductal development, progesterone seems to play a potentiating or accelerating role in estrogen-mediated mammary ductal development.[58]
Breast cancer risk[edit]
Progesterone also appears to be involved in the pathophysiology of breast cancer, though its role, and whether it is a promoter or inhibitor of breast cancer risk, has not been fully elucidated.[59][60] Most progestins, or synthetic progestogens, like medroxyprogesterone acetate, have been found to increase the risk of breast cancer in postmenopausal women in combination with estrogen as a component of menopausal hormone therapy.[61][60] The combination of natural oral progesterone or the atypical progestin dydrogesterone with estrogen has been associated with less risk of breast cancer than progestins plus estrogen.[62][63][64] However, this may simply be an artifact of the low progesterone levels produced with oral progesterone.[59][65] More research is needed on the role of progesterone in breast cancer.[60]
Skin health[edit]
The estrogen receptor, as well as the progesterone receptor, have been detected in the skin, including in keratinocytes and fibroblasts.[66][67] At menopause and thereafter, decreased levels of female sex hormones result in atrophy, thinning, and increased wrinkling of the skin and a reduction in skin elasticity, firmness, and strength.[66][67] These skin changes constitute an acceleration in skin aging and are the result of decreased collagen content, irregularities in the morphology of epidermal skin cells, decreased ground substance between skin fibers, and reduced capillaries and blood flow.[66][67] The skin also becomes more dry during menopause, which is due to reduced skin hydration and surface lipids (sebum production).[66] Along with chronological aging and photoaging, estrogen deficiency in menopause is one of the three main factors that predominantly influences skin aging.[66]
Hormone replacement therapy, consisting of systemic treatment with estrogen alone or in combination with a progestogen, has well-documented and considerable beneficial effects on the skin of postmenopausal women.[66][67] These benefits include increased skin collagen content, skin thickness and elasticity, and skin hydration and surface lipids.[66][67] Topical estrogen has been found to have similar beneficial effects on the skin.[66] In addition, a study has found that topical 2% progesterone cream significantly increases skin elasticity and firmness and observably decreases wrinkles in peri- and postmenopausal women.[67] Skin hydration and surface lipids, on the other hand, did not significantly change with topical progesterone.[67] These findings suggest that progesterone, like estrogen, also has beneficial effects on the skin, and may be independently protective against skin aging.[67]
Sexuality[edit]
Libido[edit]
Progesterone and its neurosteroid active metabolite allopregnanolone appear to be importantly involved in libido in females.[68]
Homosexuality[edit]
Dr. Diana Fleischman, of the University of Portsmouth, and colleagues looked for a relationship between progesterone and sexual attitudes in 92 women. Their research, published in the Archives of Sexual Behavior found that women who had higher levels of progesterone scored higher on a questionnaire measuring homoerotic motivation. They also found that men who had high levels of progesterone were more likely to have higher homoerotic motivation scores after affiliative priming compared to men with low levels of progesterone.[69][70][71][72]
Nervous system[edit]
Progesterone, like pregnenolone and dehydroepiandrosterone (DHEA), belongs to an important group of endogenous steroids called neurosteroids. It can be metabolized within all parts of the central nervous system.[73]
Neurosteroids are neuromodulators, and are neuroprotective, neurogenic, and regulate neurotransmission and myelination.[74] The effects of progesterone as a neurosteroid are mediated predominantly through its interactions with non-nuclear PRs, namely the mPRs and PGRMC1, as well as certain other receptors, such as the σ1 and nACh receptors.[medical citation needed]
Brain damage[edit]
Previous studies have shown that progesterone supports the normal development of neurons in the brain, and that the hormone has a protective effect on damaged brain tissue. It has been observed in animal models that females have reduced susceptibility to traumatic brain injury and this protective effect has been hypothesized to be caused by increased circulating levels of estrogen and progesterone in females.[75]
Proposed mechanism[edit]
The mechanism of progesterone protective effects may be the reduction of inflammation that follows brain trauma and hemorrhage.[76][77]
Damage incurred by traumatic brain injury is believed to be caused in part by mass depolarization leading to excitotoxicity. One way in which progesterone helps to alleviate some of this excitotoxicity is by blocking the voltage-dependent calcium channels that trigger neurotransmitter release.[78] It does so by manipulating the signaling pathways of transcription factors involved in this release. Another method for reducing the excitotoxicity is by up-regulating the GABAA, a widespread inhibitory neurotransmitter receptor.[79]
Progesterone has also been shown to prevent apoptosis in neurons, a common consequence of brain injury.[80] It does so by inhibiting enzymes involved in the apoptosis pathway specifically concerning the mitochondria, such as activated caspase 3 and cytochrome c.
Not only does progesterone help prevent further damage, it has also been shown to aid in neuroregeneration.[81] One of the serious effects of traumatic brain injury includes edema. Animal studies show that progesterone treatment leads to a decrease in edema levels by increasing the concentration of macrophages and microglia sent to the injured tissue.[78][82] This was observed in the form of reduced leakage from the blood brain barrier in secondary recovery in progesterone treated rats. In addition, progesterone was observed to have antioxidant properties, reducing the concentration of oxygen free radicals faster than without.[79] There is also evidence that the addition of progesterone can also help remyelinate damaged axons due to trauma, restoring some lost neural signal conduction.[79] Another way progesterone aids in regeneration includes increasing the circulation of endothelial progenitor cells in the brain.[83] This helps new vasculature to grow around scar tissue which helps repair the area of insult.
Addiction[edit]
Progesterone enhances the function of serotonin receptors in the brain, so an excess or deficit of progesterone has the potential to result in significant neurochemical issues. This provides an explanation for why some people resort to substances that enhance serotonin activity such as nicotine, alcohol, and cannabis when their progesterone levels fall below optimal levels.[84]
- Sex differences in hormone levels may induce women to respond differently than men to nicotine. When women undergo cyclic changes or different hormonal transition phases (menopause, pregnancy, adolescence), there are changes in their progesterone levels.[85] Therefore, females have an increased biological vulnerability to nicotine’s reinforcing effects compared to males and progesterone may be used to counter this enhanced vulnerability. This information supports the idea that progesterone can affect behavior.[84]
- Similar to nicotine, cocaine also increases the release of dopamine in the brain. The neurotransmitter is involved in the reward center and is one of the main neurotransmitters involved with substance abuse and reliance. In a study of cocaine users, it was reported that progesterone reduced craving and the feeling of being stimulated by cocaine. Thus, progesterone was suggested as an agent that decreases cocaine craving by reducing the dopaminergic properties of the drug.[86]
Societal[edit]
In a 2012 University of Amsterdam study of 120 women, women’s luteal phase (higher levels of progesterone, and increasing levels of estrogen) was correlated with lower level of competitive behavior in gambling and math contest scenarios, while their premenstrual phase (sharply-decreasing levels of progesterone, and decreasing levels of estrogen) was correlated with a higher level of competitive behavior.[87]
Other effects[edit]
- Progesterone also has a role in skin elasticity and bone strength, in respiration, in nerve tissue and in female sexuality, and the presence of progesterone receptors in certain muscle and fat tissue may hint at a role in sexually dimorphic proportions of those.[88][infringing link?]
- During pregnancy, progesterone is said to decrease uterine irritability.[89]
- During pregnancy, progesterone helps to suppress immune responses of the mother to fetal antigens, which prevents rejection of the fetus.[89]
- Progesterone raises epidermal growth factor-1 (EGF-1) levels, a factor often used to induce proliferation, and used to sustain cultures, of stem cells.[90]
- Progesterone increases core temperature (thermogenic function) during ovulation.[91][92]
- Progesterone reduces spasm and relaxes smooth muscle. Bronchi are widened and mucus regulated. (PRs are widely present in submucosal tissue.)
- Progesterone acts as an antiinflammatory agent and regulates the immune response.
- Progesterone reduces gall-bladder activity.[93]
- Progesterone normalizes blood clotting and vascular tone, zinc and copper levels, cell oxygen levels, and use of fat stores for energy.
- Progesterone may affect gum health, increasing risk of gingivitis (gum inflammation).[94]
- Progesterone appears to prevent endometrial cancer (involving the uterine lining) by regulating the effects of estrogen.
- Progesterone plays an important role in the signaling of insulin release and pancreatic function, and may affect the susceptibility to diabetes or gestational diabetes.[95][96]
Biochemistry[edit]
Biosynthesis[edit]
In mammals, progesterone, like all other steroid hormones, is synthesized from pregnenolone, which itself is derived from cholesterol.
Cholesterol undergoes double oxidation to produce 22R-hydroxycholesterol and then 20α,22R-dihydroxycholesterol. This vicinal diol is then further oxidized with loss of the side chain starting at position C22 to produce pregnenolone. This reaction is catalyzed by cytochrome P450scc.
The conversion of pregnenolone to progesterone takes place in two steps. First, the 3β-hydroxyl group is oxidized to a keto group and second, the double bond is moved to C4, from C5 through a keto/enol tautomerization reaction.[98] This reaction is catalyzed by 3β-hydroxysteroid dehydrogenase/δ5-4-isomerase.
Progesterone in turn is the precursor of the mineralocorticoid aldosterone, and after conversion to 17α-hydroxyprogesterone, of cortisol and androstenedione. Androstenedione can be converted to testosterone, estrone, and estradiol, highlighting the critical role of progesterone in testosterone synthesis.
Pregnenolone and progesterone can also be synthesized by yeast.[99]
Approximately 25 mg of progesterone is secreted from the ovaries per day in women, while the adrenal glands produce about 2 mg of progesterone per day.[100]
| Sex | Sex hormone | Reproductive phase |
Blood production rate |
Gonadal secretion rate |
Metabolic clearance rate |
Reference range (serum levels) | |
|---|---|---|---|---|---|---|---|
| SI units | Non-SI units | ||||||
| Men | Androstenedione |
– |
2.8 mg/day | 1.6 mg/day | 2200 L/day | 2.8–7.3 nmol/L | 80–210 ng/dL |
| Testosterone |
– |
6.5 mg/day | 6.2 mg/day | 950 L/day | 6.9–34.7 nmol/L | 200–1000 ng/dL | |
| Estrone |
– |
150 μg/day | 110 μg/day | 2050 L/day | 37–250 pmol/L | 10–70 pg/mL | |
| Estradiol |
– |
60 μg/day | 50 μg/day | 1600 L/day | <37–210 pmol/L | 10–57 pg/mL | |
| Estrone sulfate |
– |
80 μg/day | Insignificant | 167 L/day | 600–2500 pmol/L | 200–900 pg/mL | |
| Women | Androstenedione |
– |
3.2 mg/day | 2.8 mg/day | 2000 L/day | 3.1–12.2 nmol/L | 89–350 ng/dL |
| Testosterone |
– |
190 μg/day | 60 μg/day | 500 L/day | 0.7–2.8 nmol/L | 20–81 ng/dL | |
| Estrone | Follicular phase | 110 μg/day | 80 μg/day | 2200 L/day | 110–400 pmol/L | 30–110 pg/mL | |
| Luteal phase | 260 μg/day | 150 μg/day | 2200 L/day | 310–660 pmol/L | 80–180 pg/mL | ||
| Postmenopause | 40 μg/day | Insignificant | 1610 L/day | 22–230 pmol/L | 6–60 pg/mL | ||
| Estradiol | Follicular phase | 90 μg/day | 80 μg/day | 1200 L/day | <37–360 pmol/L | 10–98 pg/mL | |
| Luteal phase | 250 μg/day | 240 μg/day | 1200 L/day | 699–1250 pmol/L | 190–341 pg/mL | ||
| Postmenopause | 6 μg/day | Insignificant | 910 L/day | <37–140 pmol/L | 10–38 pg/mL | ||
| Estrone sulfate | Follicular phase | 100 μg/day | Insignificant | 146 L/day | 700–3600 pmol/L | 250–1300 pg/mL | |
| Luteal phase | 180 μg/day | Insignificant | 146 L/day | 1100–7300 pmol/L | 400–2600 pg/mL | ||
| Progesterone | Follicular phase | 2 mg/day | 1.7 mg/day | 2100 L/day | 0.3–3 nmol/L | 0.1–0.9 ng/mL | |
| Luteal phase | 25 mg/day | 24 mg/day | 2100 L/day | 19–45 nmol/L | 6–14 ng/mL | ||
|
Notes and sources Notes: «The concentration of a steroid in the circulation is determined by the rate at which it is secreted from glands, the rate of metabolism of precursor or prehormones into the steroid, and the rate at which it is extracted by tissues and metabolized. The secretion rate of a steroid refers to the total secretion of the compound from a gland per unit time. Secretion rates have been assessed by sampling the venous effluent from a gland over time and subtracting out the arterial and peripheral venous hormone concentration. The metabolic clearance rate of a steroid is defined as the volume of blood that has been completely cleared of the hormone per unit time. The production rate of a steroid hormone refers to entry into the blood of the compound from all possible sources, including secretion from glands and conversion of prohormones into the steroid of interest. At steady state, the amount of hormone entering the blood from all sources will be equal to the rate at which it is being cleared (metabolic clearance rate) multiplied by blood concentration (production rate = metabolic clearance rate × concentration). If there is little contribution of prohormone metabolism to the circulating pool of steroid, then the production rate will approximate the secretion rate.» Sources: See template. |
Distribution[edit]
Progesterone binds extensively to plasma proteins, including albumin (50–54%) and transcortin (43–48%).[101] It has similar affinity for albumin relative to the PR.[17]
Metabolism[edit]
The metabolism of progesterone is rapid and extensive and occurs mainly in the liver,[102][103][104] though enzymes that metabolize progesterone are also expressed widely in the brain, skin, and various other extrahepatic tissues.[73][105] Progesterone has an elimination half-life of only approximately 5 minutes in circulation.[102] The metabolism of progesterone is complex, and it may form as many as 35 different unconjugated metabolites when it is ingested orally.[104][106] Progesterone is highly susceptible to enzymatic reduction via reductases and hydroxysteroid dehydrogenases due to its double bond (between the C4 and C5 positions) and its two ketones (at the C3 and C20 positions).[104]
The major metabolic pathway of progesterone is reduction by 5α-reductase[73] and 5β-reductase into the dihydrogenated 5α-dihydroprogesterone and 5β-dihydroprogesterone, respectively.[103][104][107][108] This is followed by the further reduction of these metabolites via 3α-hydroxysteroid dehydrogenase and 3β-hydroxysteroid dehydrogenase into the tetrahydrogenated allopregnanolone, pregnanolone, isopregnanolone, and epipregnanolone.[109][103][104][107] Subsequently, 20α-hydroxysteroid dehydrogenase and 20β-hydroxysteroid dehydrogenase reduce these metabolites to form the corresponding hexahydrogenated pregnanediols (eight different isomers in total),[103][108] which are then conjugated via glucuronidation and/or sulfation, released from the liver into circulation, and excreted by the kidneys into the urine.[102][104] The major metabolite of progesterone in the urine is the 3α,5β,20α isomer of pregnanediol glucuronide, which has been found to constitute 15 to 30% of an injection of progesterone.[17][110] Other metabolites of progesterone formed by the enzymes in this pathway include 3α-dihydroprogesterone, 3β-dihydroprogesterone, 20α-dihydroprogesterone, and 20β-dihydroprogesterone, as well as various combination products of the enzymes aside from those already mentioned.[17][104][110][111] Progesterone can also first be hydroxylated (see below) and then reduced.[104] Endogenous progesterone is metabolized approximately 50% into 5α-dihydroprogesterone in the corpus luteum, 35% into 3β-dihydroprogesterone in the liver, and 10% into 20α-dihydroprogesterone.[112]
Relatively small portions of progesterone are hydroxylated via 17α-hydroxylase (CYP17A1) and 21-hydroxylase (CYP21A2) into 17α-hydroxyprogesterone and 11-deoxycorticosterone (21-hydroxyprogesterone), respectively,[106] and pregnanetriols are formed secondarily to 17α-hydroxylation.[113][114] Even smaller amounts of progesterone may be also hydroxylated via 11β-hydroxylase (CYP11B1) and to a lesser extent via aldosterone synthase (CYP11B2) into 11β-hydroxyprogesterone.[115][116] In addition, progesterone can be hydroxylated in the liver by other cytochrome P450 enzymes which are not steroid-specific.[117] 6β-Hydroxylation, which is catalyzed mainly by CYP3A4, is the major transformation, and is responsible for approximately 70% of cytochrome P450-mediated progesterone metabolism.[117] Other routes include 6α-, 16α-, and 16β-hydroxylation.[104] However, treatment of women with ketoconazole, a strong CYP3A4 inhibitor, had minimal effects on progesterone levels, producing only a slight and non-significant increase, and this suggests that cytochrome P450 enzymes play only a small role in progesterone metabolism.[118]
Levels[edit]
Progesterone levels across the menstrual cycle in normally cycling and ovulatory women.[120] The horizontal lines are the mean integrated levels for each curve. The vertical line is mid-cycle.
In women, progesterone levels are relatively low during the preovulatory phase of the menstrual cycle, rise after ovulation, and are elevated during the luteal phase, as shown in the diagram above. Progesterone levels tend to be less than 2 ng/mL prior to ovulation and greater than 5 ng/mL after ovulation. If pregnancy occurs, human chorionic gonadotropin is released, maintaining the corpus luteum and allowing it to maintain levels of progesterone. Between 7 and 9 weeks, the placenta begins to produce progesterone in place of the corpus luteum in a process called the luteal-placental shift.[121]
After the luteal-placental shift, progesterone levels start to rise further and may reach 100 to 200 ng/mL at term. Whether a decrease in progesterone levels is critical for the initiation of labor has been argued and may be species-specific. After delivery of the placenta and during lactation, progesterone levels are very low.
Progesterone levels are low in children and postmenopausal women.[122] Adult males have levels similar to those in women during the follicular phase of the menstrual cycle.
| Group | P4 production | P4 levels |
|---|---|---|
| Prepubertal children | ND | 0.06–0.5 ng/mL |
| Pubertal girls Tanner stage I (childhood) Tanner stage II (ages 8–12) Tanner stage III (ages 10–13) Tanner stage IV (ages 11–14) Tanner stage V (ages 12–15) Follicular phase (days 1–14) Luteal phase (days 15–28) |
ND ND ND ND ND |
0.22 (<0.10–0.32) ng/mL 0.30 (0.10–0.51) ng/mL 0.36 (0.10–0.75) ng/mL 1.75 (<0.10–25.0) ng/mL 0.35 (0.13–0.75) ng/mL |
| Premenopausal women Follicular phase (days 1–14) Luteal phase (days 15–28) Oral contraceptive (anovulatory) |
0.75–5.4 mg/day 15–50 mg/day ND |
0.02–1.2 ng/mL 4–30 ng/mL 0.1–0.3 ng/mL |
| Postmenopausal women Oophorectomized women Oophorectomized and adrenalectomized women |
ND 1.2 mg/day <0.3 mg/day |
0.03–0.3 ng/mL 0.39 ng/mL ND |
| Pregnant women First trimester (weeks 1–12) Second trimester (weeks 13–26) Third trimester (weeks 27–40) Postpartum (at 24 hours) |
55 mg/day 92–100 mg/day 190–563 mg/day ND |
9–75 ng/mL 17–146 ng/mL 55–255 ng/mL 19 ng/mL |
| Men | 0.75–3 mg/day | 0.1–0.3 ng/mL |
| Notes: Mean levels are given as a single value and ranges are given after in parentheses. Sources: See template. |
Ranges[edit]
Blood test results should always be interpreted using the reference ranges provided by the laboratory that performed the results. Example reference ranges are listed below.
| Person type | Reference range for blood test | ||
|---|---|---|---|
| Lower limit | Upper limit | Unit | |
| Female — menstrual cycle | (see diagram below) | ||
| Female — postmenopausal | <0.2[123] | 1[123] | ng/mL |
| <0.6[124] | 3[124] | nmol/L | |
| Female on oral contraceptives | 0.34[123] | 0.92[123] | ng/mL |
| 1.1[124] | 2.9[124] | nmol/L | |
| Males ≥16 years | 0.27[123] | 0.9[123] | ng/mL |
| 0.86[124] | 2.9[124] | nmol/L | |
| Female or male 1–9 years | 0.1[123] | 4.1[123] or 4.5[123] | ng/mL |
| 0.3[124] | 13[124] | nmol/L |
Sources[edit]
Animal[edit]
Progesterone is produced in high amounts in the ovaries (by the corpus luteum) from the onset of puberty to menopause, and is also produced in smaller amounts by the adrenal glands after the onset of adrenarche in both males and females. To a lesser extent, progesterone is produced in nervous tissue, especially in the brain, and in adipose (fat) tissue, as well.
During human pregnancy, progesterone is produced in increasingly high amounts by the ovaries and placenta. At first, the source is the corpus luteum that has been «rescued» by the presence of human chorionic gonadotropin (hCG) from the conceptus. However, after the 8th week, production of progesterone shifts to the placenta. The placenta utilizes maternal cholesterol as the initial substrate, and most of the produced progesterone enters the maternal circulation, but some is picked up by the fetal circulation and used as substrate for fetal corticosteroids. At term the placenta produces about 250 mg progesterone per day.
An additional animal source of progesterone is milk products. After consumption of milk products the level of bioavailable progesterone goes up.[126]
Plants[edit]
In at least one plant, Juglans regia, progesterone has been detected.[127] In addition, progesterone-like steroids are found in Dioscorea mexicana. Dioscorea mexicana is a plant that is part of the yam family native to Mexico.[128] It contains a steroid called diosgenin that is taken from the plant and is converted into progesterone.[129] Diosgenin and progesterone are also found in other Dioscorea species, as well as in other plants that are not closely related, such as fenugreek.
Another plant that contains substances readily convertible to progesterone is Dioscorea pseudojaponica native to Taiwan. Research has shown that the Taiwanese yam contains saponins — steroids that can be converted to diosgenin and thence to progesterone.[130]
Many other Dioscorea species of the yam family contain steroidal substances from which progesterone can be produced. Among the more notable of these are Dioscorea villosa and Dioscorea polygonoides. One study showed that the Dioscorea villosa contains 3.5% diosgenin.[131] Dioscorea polygonoides has been found to contain 2.64% diosgenin as shown by gas chromatography-mass spectrometry.[132] Many of the Dioscorea species that originate from the yam family grow in countries that have tropical and subtropical climates.[133]
Medical use[edit]
Progesterone is used as a medication. It is used in combination with estrogens mainly in hormone therapy for menopausal symptoms and low sex hormone levels in women.[106][134] It is also used in women to support pregnancy and fertility and to treat gynecological disorders.[135][136][137][138] Progesterone has been shown to prevent miscarriage in women with 1) vaginal bleeding early in their current pregnancy and 2) a previous history of miscarriage.[139] Progesterone can be taken by mouth, through the vagina, and by injection into muscle or fat, among other routes.[106]
Chemistry[edit]
A sample of progesterone.
Progesterone is a naturally occurring pregnane steroid and is also known as pregn-4-ene-3,20-dione.[140][141] It has a double bond (4-ene) between the C4 and C5 positions and two ketone groups (3,20-dione), one at the C3 position and the other at the C20 position.[140][141]
Synthesis[edit]
Progesterone is commercially produced by semisynthesis. Two main routes are used: one from yam diosgenin first pioneered by Marker in 1940, and one based on soy phytosterols scaled up in the 1970s. Additional (not necessarily economical) semisyntheses of progesterone have also been reported starting from a variety of steroids. For the example, cortisone can be simultaneously deoxygenated at the C-17 and C-21 position by treatment with iodotrimethylsilane in chloroform to produce 11-keto-progesterone (ketogestin), which in turn can be reduced at position-11 to yield progesterone.[142]
Marker semisynthesis[edit]
An economical semisynthesis of progesterone from the plant steroid diosgenin isolated from yams was developed by Russell Marker in 1940 for the Parke-Davis pharmaceutical company.[143] This synthesis is known as the Marker degradation.
The 16-DPA intermediate is important to the synthesis of many other medically important steroids. A very similar approach can produce 16-DPA from solanine.[144]
Soy semisynthesis[edit]
Progesterone can also be made from the stigmasterol found in soybean oil also. c.f. Percy Julian.
Total synthesis[edit]
The Johnson total synthesis of progesterone.[150]
A total synthesis of progesterone was reported in 1971 by W.S. Johnson.[150] The synthesis begins with reacting the phosphonium salt 7 with phenyl lithium to produce the phosphonium ylide 8. The ylide 8 is reacted with an aldehyde to produce the alkene 9. The ketal protecting groups of 9 are hydrolyzed to produce the diketone 10, which in turn is cyclized to form the cyclopentenone 11. The ketone of 11 is reacted with methyl lithium to yield the tertiary alcohol 12, which in turn is treated with acid to produce the tertiary cation 13. The key step of the synthesis is the π-cation cyclization of 13 in which the B-, C-, and D-rings of the steroid are simultaneously formed to produce 14. This step resembles the cationic cyclization reaction used in the biosynthesis of steroids and hence is referred to as biomimetic. In the next step the enol orthoester is hydrolyzed to produce the ketone 15. The cyclopentene A-ring is then opened by oxidizing with ozone to produce 16. Finally, the diketone 17 undergoes an intramolecular aldol condensation by treating with aqueous potassium hydroxide to produce progesterone.[150]
History[edit]
George W. Corner and Willard M. Allen discovered the hormonal action of progesterone in 1929.[17][151][152][153] By 1931–1932, nearly pure crystalline material of high progestational activity had been isolated from the corpus luteum of animals, and by 1934, pure crystalline progesterone had been refined and obtained and the chemical structure of progesterone was determined.[17][152] This was achieved by Adolf Butenandt at the Chemisches Institut of Technical University in Danzig, who extracted this new compound from several thousand liters of urine.[154]
Chemical synthesis of progesterone from stigmasterol and pregnanediol was accomplished later that year.[152][155] Up to this point, progesterone, known generically as corpus luteum hormone, had been being referred to by several groups by different names, including corporin, lutein, luteosterone, and progestin.[17][156] In 1935, at the time of the Second International Conference on the Standardization of Sex Hormones in London, England, a compromise was made between the groups and the name progesterone (progestational steroidal ketone) was created.[17][157]
Veterinary use[edit]
The use of progesterone tests in dog breeding to pinpoint ovulation is becoming more widely used. There are several tests available but the most reliable test is a blood test with blood drawn by a veterinarian and sent to a lab for processing. Results can usually be obtained with 24 to 72 hours. The rationale for using progesterone tests is that increased numbers begin in close proximity to preovulatory surge in gonadotrophins and continue through ovulation and estrus. When progesterone levels reach certain levels they can signal the stage of estrus the female is. Prediction of birth date of the pending litter can be very accurate if ovulation date is known. Puppies deliver with a day or two of 9 weeks gestation in most cases. It is not possible to determine pregnancy using progesterone tests once a breeding has taken place, however. This is due to the fact that, in dogs, progesterone levels remain elevated throughout the estrus period.[158]
References[edit]
- ^ a b Jameson JL, De Groot LJ (25 February 2015). Endocrinology: Adult and Pediatric E-Book. Elsevier Health Sciences. p. 2179. ISBN 978-0-323-32195-2.
- ^ Adler N, Pfaff D, Goy RW (6 Dec 2012). Handbook of Behavioral Neurobiology Volume 7 Reproduction (1st ed.). New York: Plenum Press. p. 189. ISBN 978-1-4684-4834-4. Retrieved 4 July 2015.
- ^ «progesterone (CHEBI:17026)». ChEBI. European Molecular Biology Laboratory-EBI. Retrieved 4 July 2015.
- ^ «Progesterone_msds».
- ^ a b Stanczyk FZ (September 2002). «Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception». Reviews in Endocrine & Metabolic Disorders. 3 (3): 211–24. doi:10.1023/A:1020072325818. PMID 12215716. S2CID 27018468.
- ^ a b c Simon JA, Robinson DE, Andrews MC, Hildebrand JR, Rocci ML, Blake RE, Hodgen GD (July 1993). «The absorption of oral micronized progesterone: the effect of food, dose proportionality, and comparison with intramuscular progesterone». Fertility and Sterility. 60 (1): 26–33. doi:10.1016/S0015-0282(16)56031-2. PMID 8513955.
- ^ Fritz MA, Speroff L (28 March 2012). Clinical Gynecologic Endocrinology and Infertility. Lippincott Williams & Wilkins. pp. 44–. ISBN 978-1-4511-4847-3.
- ^ Marshall WJ, Bangert SK (2008). Clinical Chemistry. Elsevier Health Sciences. pp. 192–. ISBN 978-0-7234-3455-9.
- ^ Yamazaki H, Shimada T (October 1997). «Progesterone and testosterone hydroxylation by cytochromes P450 2C19, 2C9, and 3A4 in human liver microsomes». Archives of Biochemistry and Biophysics. 346 (1): 161–9. doi:10.1006/abbi.1997.0302. PMID 9328296.
- ^ McKay GA, Walters MR (6 February 2013). Lecture Notes: Clinical Pharmacology and Therapeutics. John Wiley & Sons. p. 33. ISBN 978-1-118-34489-7.
- ^ Zutshi (1 January 2005). Hormones in Obstetrics and Gynaecology. Jaypee Brothers Publishers. p. 74. ISBN 978-81-8061-427-9.[permanent dead link]
- ^ a b Cometti B (November 2015). «Pharmaceutical and clinical development of a novel progesterone formulation». Acta Obstetricia et Gynecologica Scandinavica. 94 (Suppl 161): 28–37. doi:10.1111/aogs.12765. PMID 26342177. S2CID 31974637.
- ^ a b c King TL, Brucker MC (25 October 2010). Pharmacology for Women’s Health. Jones & Bartlett Publishers. pp. 372–373. ISBN 978-1-4496-5800-7.
- ^ a b Baulieu E, Schumacher M (2000). «Progesterone as a neuroactive neurosteroid, with special reference to the effect of progesterone on myelination». Steroids. 65 (10–11): 605–12. doi:10.1016/s0039-128x(00)00173-2. PMID 11108866. S2CID 14952168.
- ^ Prior JC (2019). «Progesterone Is Important for Transgender Women’s Therapy — Applying Evidence for the Benefits of Progesterone in Ciswomen». The Journal of Clinical Endocrinology & Metabolism. 104 (4): 1181–1186. doi:10.1210/jc.2018-01777. PMID 30608551. S2CID 58620122.
Evidence has accrued that normal progesterone (and ovulation), as well as physiological estradiol levels, is necessary during ciswomen’s premenopausal menstrual cycles for current fertility and long-term health; transgender women may require progesterone therapy and similar potential physiological benefits
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 47X. ISBN 9783527607495.
- ^ a b c d e f g h Josimovich JB (11 November 2013). Gynecologic Endocrinology. Springer Science & Business Media. pp. 9, 25–29. ISBN 978-1-4613-2157-6.
- ^ Taraborrelli S (November 2015). «Physiology, production and action of progesterone». Acta Obstetricia et Gynecologica Scandinavica. 94 Suppl 161: 8–16. doi:10.1111/aogs.12771. PMID 26358238. S2CID 40213725.
- ^ Thomas P, Pang Y (2012). «Membrane progesterone receptors: evidence for neuroprotective, neurosteroid signaling and neuroendocrine functions in neuronal cells». Neuroendocrinology. 96 (2): 162–71. doi:10.1159/000339822. PMC 3489003. PMID 22687885.
- ^ Valadez-Cosmes P, Vázquez-Martínez ER, Cerbón M, Camacho-Arroyo I (October 2016). «Membrane progesterone receptors in reproduction and cancer». Molecular and Cellular Endocrinology. 434: 166–75. doi:10.1016/j.mce.2016.06.027. PMID 27368976. S2CID 3826650.
- ^ Meyer C, Schmid R, Schmieding K, Falkenstein E, Wehling M (February 1998). «Characterization of high affinity progesterone-binding membrane proteins by anti-peptide antiserum». Steroids. 63 (2): 111–6. doi:10.1016/s0039-128x(97)00143-8. PMID 9516722. S2CID 40096058.
- ^ Kabe Y, Handa H, Suematsu M (July 2018). «Function and structural regulation of the carbon monoxide (CO)-responsive membrane protein PGRMC1». Journal of Clinical Biochemistry and Nutrition. 63 (1): 12–17. doi:10.3164/jcbn.17-132. PMC 6064819. PMID 30087538.
- ^ Ryu CS, Klein K, Zanger UM (2017-03-27). «Membrane Associated Progesterone Receptors: Promiscuous Proteins with Pleiotropic Functions — Focus on Interactions with Cytochromes P450». Frontiers in Pharmacology. 8: 159. doi:10.3389/fphar.2017.00159. PMC 5366339. PMID 28396637.
- ^ Maurice T, Urani A, Phan VL, Romieu P (November 2001). «The interaction between neuroactive steroids and the sigma1 receptor function: behavioral consequences and therapeutic opportunities». Brain Research. Brain Research Reviews. 37 (1–3): 116–32. doi:10.1016/s0165-0173(01)00112-6. PMID 11744080. S2CID 44931783.
- ^ Johannessen M, Fontanilla D, Mavlyutov T, Ruoho AE, Jackson MB (February 2011). «Antagonist action of progesterone at σ-receptors in the modulation of voltage-gated sodium channels». American Journal of Physiology. Cell Physiology. 300 (2): C328-37. doi:10.1152/ajpcell.00383.2010. PMC 3043630. PMID 21084640.
- ^ a b Rupprecht R, Reul JM, van Steensel B, Spengler D, Söder M, Berning B, et al. (October 1993). «Pharmacological and functional characterization of human mineralocorticoid and glucocorticoid receptor ligands». European Journal of Pharmacology. 247 (2): 145–54. doi:10.1016/0922-4106(93)90072-H. PMID 8282004.
- ^ Elger W, Beier S, Pollow K, Garfield R, Shi SQ, Hillisch A (November 2003). «Conception and pharmacodynamic profile of drospirenone». Steroids. 68 (10–13): 891–905. doi:10.1016/j.steroids.2003.08.008. PMID 14667981. S2CID 41756726.
- ^ Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (December 2007). «Comparison of progesterone and glucocorticoid receptor binding and stimulation of gene expression by progesterone, 17-alpha hydroxyprogesterone caproate, and related progestins». American Journal of Obstetrics and Gynecology. 197 (6): 599.e1–7. doi:10.1016/j.ajog.2007.05.024. PMC 2278032. PMID 18060946.
- ^ Lei K, Chen L, Georgiou EX, Sooranna SR, Khanjani S, Brosens JJ, et al. (2012). «Progesterone acts via the nuclear glucocorticoid receptor to suppress IL-1β-induced COX-2 expression in human term myometrial cells». PLOS ONE. 7 (11): e50167. Bibcode:2012PLoSO…750167L. doi:10.1371/journal.pone.0050167. PMC 3509141. PMID 23209664.
- ^ Paul SM, Purdy RH (March 1992). «Neuroactive steroids». FASEB Journal. 6 (6): 2311–22. doi:10.1096/fasebj.6.6.1347506. PMID 1347506. S2CID 221753076.
- ^ Kliewer SA, Goodwin B, Willson TM (2002). «The nuclear pregnane X receptor: a key regulator of xenobiotic metabolism». Endocr. Rev. 23 (5): 687–702. doi:10.1210/er.2001-0038. PMID 12372848.
- ^ Lehmann JM, McKee DD, Watson MA, Willson TM, Moore JT, Kliewer SA (1998). «The human orphan nuclear receptor PXR is activated by compounds that regulate CYP3A4 gene expression and cause drug interactions». J. Clin. Invest. 102 (5): 1016–23. doi:10.1172/JCI3703. PMC 508967. PMID 9727070.
- ^ Meanwell NA (8 December 2014). Tactics in Contemporary Drug Design. Springer. pp. 161–. ISBN 978-3-642-55041-6.
- ^ a b Legato MJ, Bilezikian JP (2004). Principles of Gender-specific Medicine. Gulf Professional Publishing. pp. 146–. ISBN 978-0-12-440906-4.
- ^ Lemke TL, Williams DA (24 January 2012). Foye’s Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. p. 164. ISBN 978-1-60913-345-0.
- ^ Estrogens—Advances in Research and Application: 2013 Edition: ScholarlyBrief. ScholarlyEditions. 21 June 2013. pp. 4–. ISBN 978-1-4816-7550-5.
- ^ Strünker T, Goodwin N, Brenker C, Kashikar ND, Weyand I, Seifert R, Kaupp UB (March 2011). «The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm». Nature. 471 (7338): 382–6. Bibcode:2011Natur.471..382S. doi:10.1038/nature09769. PMID 21412338. S2CID 4431334.
- ^ Lishko PV, Botchkina IL, Kirichok Y (March 2011). «Progesterone activates the principal Ca2+ channel of human sperm». Nature. 471 (7338): 387–91. Bibcode:2011Natur.471..387L. doi:10.1038/nature09767. PMID 21412339. S2CID 4340309.
- ^ Prior JC (2020). «Women’s reproductive system as balanced estradiol and progesterone actions—A revolutionary, paradigm-shifting concept in women’s health». Drug Discovery Today: Disease Models. 32, Part B: 31–40. doi:10.1016/j.ddmod.2020.11.005.
- ^ Kastner P, Krust A, Turcotte B, Stropp U, Tora L, Gronemeyer H, Chambon P (May 1990). «Two distinct estrogen-regulated promoters generate transcripts encoding the two functionally different human progesterone receptor forms A and B». The EMBO Journal. 9 (5): 1603–14. doi:10.1002/j.1460-2075.1990.tb08280.x. PMC 551856. PMID 2328727.
- ^ a b Hallam SZ, Osuch JR (1 January 2006). Hormones and Breast Cancer in Post-Menopausal Women. IOS Press. p. 69. ISBN 978-1-58603-653-9.
- ^ a b Johnson LR (2003). Essential Medical Physiology. Academic Press. p. 770. ISBN 978-0-12-387584-6.
- ^ a b Coad J, Dunstall M (2011). Anatomy and Physiology for Midwives, with Pageburst online access,3: Anatomy and Physiology for Midwives. Elsevier Health Sciences. p. 413. ISBN 978-0-7020-3489-3.
- ^ Landau RL, Bergenstal DM, Lugibihl K, Kascht ME (October 1955). «The metabolic effects of progesterone in man». The Journal of Clinical Endocrinology and Metabolism. 15 (10): 1194–215. doi:10.1210/jcem-15-10-1194. PMID 13263410.
- ^ Correia JN, Conner SJ, Kirkman-Brown JC (May 2007). «Non-genomic steroid actions in human spermatozoa. «Persistent tickling from a laden environment»«. Seminars in Reproductive Medicine. 25 (3): 208–19. doi:10.1055/s-2007-973433. PMID 17447210.
- ^ Kirkman-Brown JC, Bray C, Stewart PM, Barratt CL, Publicover SJ (June 2000). «Biphasic elevation of [Ca(2+)](i) in individual human spermatozoa exposed to progesterone». Developmental Biology. 222 (2): 326–35. doi:10.1006/dbio.2000.9729. PMID 10837122.
- ^ Kirkman-Brown JC, Barratt CL, Publicover SJ (March 2004). «Slow calcium oscillations in human spermatozoa». The Biochemical Journal. 378 (Pt 3): 827–32. doi:10.1042/BJ20031368. PMC 1223996. PMID 14606954.
- ^ Harper CV, Barratt CL, Publicover SJ (October 2004). «Stimulation of human spermatozoa with progesterone gradients to simulate approach to the oocyte. Induction of [Ca(2+)](i) oscillations and cyclical transitions in flagellar beating». The Journal of Biological Chemistry. 279 (44): 46315–25. doi:10.1074/jbc.M401194200. PMID 15322137.
- ^ Marieb, Elaine (2013). Anatomy & physiology. Benjamin-Cummings. p. 903. ISBN 9780321887603.
- ^ Tosti E, Di Cosmo A, Cuomo A, Di Cristo C, Gragnaniello G (May 2001). «Progesterone induces activation in Octopus vulgaris spermatozoa». Molecular Reproduction and Development. 59 (1): 97–105. doi:10.1002/mrd.1011. PMID 11335951. S2CID 28390608.
- ^ a b Bowen R (2000-08-06). «Placental Hormones». Retrieved 2008-03-12.
- ^ Patel B, Elguero S, Thakore S, Dahoud W, Bedaiwy M, Mesiano S (2014). «Role of nuclear progesterone receptor isoforms in uterine pathophysiology». Human Reproduction Update. 21 (2): 155–73. doi:10.1093/humupd/dmu056. PMC 4366574. PMID 25406186.
- ^ a b Di Renzo GC, Giardina I, Clerici G, Brillo E, Gerli S (July 2016). «Progesterone in normal and pathological pregnancy». Hormone Molecular Biology and Clinical Investigation. 27 (1): 35–48. doi:10.1515/hmbci-2016-0038. PMID 27662646. S2CID 32239449.
- ^ Macias H, Hinck L (2012). «Mammary gland development». Wiley Interdisciplinary Reviews: Developmental Biology. 1 (4): 533–57. doi:10.1002/wdev.35. PMC 3404495. PMID 22844349.
- ^ a b c Hilton HN, Graham JD, Clarke CL (September 2015). «Minireview: Progesterone Regulation of Proliferation in the Normal Human Breast and in Breast Cancer: A Tale of Two Scenarios?». Molecular Endocrinology. 29 (9): 1230–42. doi:10.1210/me.2015-1152. PMC 5414684. PMID 26266959.
- ^ Strauss JF, Barbieri RL (13 September 2013). Yen and Jaffe’s Reproductive Endocrinology. Elsevier Health Sciences. pp. 236–. ISBN 978-1-4557-2758-2.
- ^ Scaling AL, Prossnitz ER, Hathaway HJ (June 2014). «GPER mediates estrogen-induced signaling and proliferation in human breast epithelial cells and normal and malignant breast». Hormones & Cancer. 5 (3): 146–160. doi:10.1007/s12672-014-0174-1. PMC 4091989. PMID 24718936.
- ^ a b c d e Aupperlee MD, Leipprandt JR, Bennett JM, Schwartz RC, Haslam SZ (May 2013). «Amphiregulin mediates progesterone-induced mammary ductal development during puberty». Breast Cancer Research. 15 (3): R44. doi:10.1186/bcr3431. PMC 3738150. PMID 23705924.
- ^ a b Kuhl H, Schneider HP (August 2013). «Progesterone—promoter or inhibitor of breast cancer». Climacteric. 16 Suppl 1: 54–68. doi:10.3109/13697137.2013.768806. PMID 23336704. S2CID 20808536.
- ^ a b c Trabert B, Sherman ME, Kannan N, Stanczyk FZ (April 2020). «Progesterone and Breast Cancer». Endocr Rev. 41 (2): 320–344. doi:10.1210/endrev/bnz001. PMC 7156851. PMID 31512725.
- ^ Collaborative Group on Hormonal Factors in Breast Cancer (September 2019). «Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence». Lancet. 394 (10204): 1159–1168. doi:10.1016/S0140-6736(19)31709-X. PMC 6891893. PMID 31474332.
- ^ Stute P, Wildt L, Neulen J (April 2018). «The impact of micronized progesterone on breast cancer risk: a systematic review». Climacteric. 21 (2): 111–122. doi:10.1080/13697137.2017.1421925. PMID 29384406. S2CID 3642971.
- ^ Asi N, Mohammed K, Haydour Q, Gionfriddo MR, Vargas OL, Prokop LJ, Faubion SS, Murad MH (July 2016). «Progesterone vs. synthetic progestins and the risk of breast cancer: a systematic review and meta-analysis». Syst Rev. 5 (1): 121. doi:10.1186/s13643-016-0294-5. PMC 4960754. PMID 27456847.
- ^ Gompel A, Plu-Bureau G (August 2018). «Progesterone, progestins and the breast in menopause treatment». Climacteric. 21 (4): 326–332. doi:10.1080/13697137.2018.1476483. PMID 29852797. S2CID 46922084.
- ^ Davey DA (October 2018). «Menopausal hormone therapy: a better and safer future». Climacteric. 21 (5): 454–461. doi:10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ a b c d e f g h Raine-Fenning NJ, Brincat MP, Muscat-Baron Y (2003). «Skin aging and menopause : implications for treatment». American Journal of Clinical Dermatology. 4 (6): 371–8. doi:10.2165/00128071-200304060-00001. PMID 12762829. S2CID 20392538.
- ^ a b c d e f g h Holzer G, Riegler E, Hönigsmann H, Farokhnia S, Schmidt JB, Schmidt B (September 2005). «Effects and side-effects of 2% progesterone cream on the skin of peri- and postmenopausal women: results from a double-blind, vehicle-controlled, randomized study». The British Journal of Dermatology. 153 (3): 626–34. doi:10.1111/j.1365-2133.2005.06685.x. PMID 16120154. S2CID 6077829.
- ^ King SR (9 November 2012). Neurosteroids and the Nervous System. Springer Science & Business Media. pp. 44–46. ISBN 978-1-4614-5559-2.
- ^ Fleischman DS, Fessler DM, Cholakians AE (July 2015). «Testing the Affiliation Hypothesis of Homoerotic Motivation in Humans: The Effects of Progesterone and Priming». Archives of Sexual Behavior. 44 (5): 1395–404. doi:10.1007/s10508-014-0436-6. PMID 25420899. S2CID 9864224.
- ^ «Homosexuality may help us bond | UoP News». Archived from the original on 2019-07-02. Retrieved 2019-07-02.
- ^ Having homosexual thoughts ‘is an essential part of human evolution’ study suggests The Telegraph
- ^ Homosexuality May Have Evolved In Humans Because It Helps Us Bond, Scientists Say Huff Post
- ^ a b c Hanukoglu I, Karavolas HJ, Goy RW (April 1977). «Progesterone metabolism in the pineal, brain stem, thalamus and corpus callosum of the female rat». Brain Research. 125 (2): 313–24. doi:10.1016/0006-8993(77)90624-2. PMID 558037. S2CID 35814845.
- ^ Schumacher M, Guennoun R, Robert F, Carelli C, Gago N, Ghoumari A, Gonzalez Deniselle MC, Gonzalez SL, Ibanez C, Labombarda F, Coirini H, Baulieu EE, De Nicola AF (June 2004). «Local synthesis and dual actions of progesterone in the nervous system: neuroprotection and myelination». Growth Hormone & IGF Research. 14 Suppl A: S18-33. doi:10.1016/j.ghir.2004.03.007. PMID 15135772.
- ^ Roof RL, Hall ED (May 2000). «Gender differences in acute CNS trauma and stroke: neuroprotective effects of estrogen and progesterone». Journal of Neurotrauma. 17 (5): 367–88. doi:10.1089/neu.2000.17.367. PMID 10833057.
- ^ Pan DS, Liu WG, Yang XF, Cao F (October 2007). «Inhibitory effect of progesterone on inflammatory factors after experimental traumatic brain injury». Biomedical and Environmental Sciences. 20 (5): 432–8. PMID 18188998.
- ^ Jiang C, Zuo F, Wang Y, Wan J, Yang Z, Lu H, Chen W, Zang W, Yang Q, Wang J (June 2016). «Progesterone exerts neuroprotective effects and improves long-term neurologic outcome after intracerebral hemorrhage in middle-aged mice». Neurobiology of Aging. 42: 13–24. doi:10.1016/j.neurobiolaging.2016.02.029. PMC 4857017. PMID 27143417.
- ^ a b Luoma JI, Stern CM, Mermelstein PG (August 2012). «Progesterone inhibition of neuronal calcium signaling underlies aspects of progesterone-mediated neuroprotection». The Journal of Steroid Biochemistry and Molecular Biology. 131 (1–2): 30–6. doi:10.1016/j.jsbmb.2011.11.002. PMC 3303940. PMID 22101209.
- ^ a b c Stein DG (March 2008). «Progesterone exerts neuroprotective effects after brain injury». Brain Research Reviews. 57 (2): 386–97. doi:10.1016/j.brainresrev.2007.06.012. PMC 2699575. PMID 17826842.
- ^ Espinoza TR, Wright DW (2011). «The role of progesterone in traumatic brain injury». The Journal of Head Trauma Rehabilitation. 26 (6): 497–9. doi:10.1097/HTR.0b013e31823088fa. PMC 6025750. PMID 22088981.
- ^ Jiang C, Zuo F, Wang Y, Lu H, Yang Q, Wang J (January 2017). «Progesterone Changes VEGF and BDNF Expression and Promotes Neurogenesis After Ischemic Stroke». Mol Neurobiol. 54 (1): 571–581. doi:10.1007/s12035-015-9651-y. PMC 4938789. PMID 26746666.
- ^ Herson PS, Koerner IP, Hurn PD (May 2009). «Sex, sex steroids, and brain injury». Seminars in Reproductive Medicine. 27 (3): 229–39. doi:10.1055/s-0029-1216276. PMC 2675922. PMID 19401954.
- ^ Li Z, Wang B, Kan Z, Zhang B, Yang Z, Chen J, Wang D, Wei H, Zhang JN, Jiang R (January 2012). «Progesterone increases circulating endothelial progenitor cells and induces neural regeneration after traumatic brain injury in aged rats». Journal of Neurotrauma. 29 (2): 343–53. doi:10.1089/neu.2011.1807. PMC 3261789. PMID 21534727.
- ^ a b Lynch WJ, Sofuoglu M (December 2010). «Role of progesterone in nicotine addiction: evidence from initiation to relapse». Experimental and Clinical Psychopharmacology. 18 (6): 451–61. doi:10.1037/a0021265. PMC 3638762. PMID 21186920.
- ^ Cosgrove KP, Esterlis I, McKee SA, Bois F, Seibyl JP, Mazure CM, Krishnan-Sarin S, Staley JK, Picciotto MR, O’Malley SS (April 2012). «Sex differences in availability of β2*-nicotinic acetylcholine receptors in recently abstinent tobacco smokers». Archives of General Psychiatry. 69 (4): 418–27. doi:10.1001/archgenpsychiatry.2011.1465. PMC 3508698. PMID 22474108.
- ^ Mello NK, Knudson IM, Kelly M, Fivel PA, Mendelson JH (October 2011). «Effects of progesterone and testosterone on cocaine self-administration and cocaine discrimination by female rhesus monkeys». Neuropsychopharmacology. 36 (11): 2187–99. doi:10.1038/npp.2011.130. PMC 3176575. PMID 21796112.
- ^ Buser, Thomas (2012-06-01). «The impact of the menstrual cycle and hormonal contraceptives on competitiveness». Journal of Economic Behavior & Organization. Gender Differences in Risk Aversion and Competition. 83 (1): 1–10. doi:10.1016/j.jebo.2011.06.006. ISSN 0167-2681.
- ^ Sriram, D (2007). Medicinal Chemistry. New Delhi: Dorling Kindersley India Pvt. Ltd. p. 432. ISBN 978-81-317-0031-0.
- ^ a b Blackburn S (14 April 2014). Maternal, Fetal, & Neonatal Physiology. Elsevier Health Sciences. pp. 92–. ISBN 978-0-323-29296-2.
- ^ Faivre EJ, Lange CA (January 2007). «Progesterone receptors upregulate Wnt-1 to induce epidermal growth factor receptor transactivation and c-Src-dependent sustained activation of Erk1/2 mitogen-activated protein kinase in breast cancer cells». Molecular and Cellular Biology. 27 (2): 466–80. doi:10.1128/MCB.01539-06. PMC 1800800. PMID 17074804.
- ^ Nosek, Thomas M. «Section 5/5ch9/s5ch9_13». Essentials of Human Physiology. Archived from the original on 2016-03-24.
- ^ Rothchild, Irving (1969), Salhanick, Hilton A.; Kipnis, David M.; Wiele, Raymond L. Vande (eds.), «The Physiologic Basis for the Temperature Raising Effect of Progesterone», Metabolic Effects of Gonadal Hormones and Contraceptive Steroids, Boston, MA: Springer US, pp. 668–675, doi:10.1007/978-1-4684-1782-1_49, ISBN 978-1-4684-1782-1, retrieved 2021-03-22
- ^ Hould FS, Fried GM, Fazekas AG, Tremblay S, Mersereau WA (December 1988). «Progesterone receptors regulate gallbladder motility». The Journal of Surgical Research. 45 (6): 505–12. doi:10.1016/0022-4804(88)90137-0. PMID 3184927.
- ^ «Hormones and Oral Health». WebMD.
- ^ Picard F, Wanatabe M, Schoonjans K, Lydon J, O’Malley BW, Auwerx J (November 2002). «Progesterone receptor knockout mice have an improved glucose homeostasis secondary to beta -cell proliferation». Proceedings of the National Academy of Sciences of the United States of America. 99 (24): 15644–8. doi:10.1073/pnas.202612199. PMC 137770. PMID 12438645.
- ^ Brănişteanu DD, Mathieu C (March 2003). «Progesterone in gestational diabetes mellitus: guilty or not guilty?». Trends in Endocrinology and Metabolism. 14 (2): 54–6. doi:10.1016/S1043-2760(03)00003-1. PMID 12591170. S2CID 38209977.
- ^ Häggström M, Richfield D (2014). «Diagram of the pathways of human steroidogenesis». WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436.
- ^ Bewick PM (2002). Medicinal natural products: a biosynthetic approach. New York: Wiley. p. 244. ISBN 0-471-49641-3.
- ^ Duport C, Spagnoli R, Degryse E, Pompon D (February 1998). «Self-sufficient biosynthesis of pregnenolone and progesterone in engineered yeast». Nature Biotechnology. 16 (2): 186–9. doi:10.1038/nbt0298-186. PMID 9487528. S2CID 852617.
- ^ Lemke TL, Williams DA (24 January 2012). Foye’s Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. pp. 1397–. ISBN 978-1-60913-345-0.
- ^ Progesterone — Drugs.com, retrieved 2015-08-23
- ^ a b c Falcone T, Hurd WW (2007). Clinical Reproductive Medicine and Surgery. Elsevier Health Sciences. pp. 22–. ISBN 978-0-323-03309-1.
- ^ a b c d Cupps PT (20 February 1991). Reproduction in Domestic Animals. Elsevier. pp. 101–. ISBN 978-0-08-057109-6.
- ^ a b c d e f g h i Stanczyk FZ (November 2003). «All progestins are not created equal». Steroids. 68 (10–13): 879–90. doi:10.1016/j.steroids.2003.08.003. PMID 14667980. S2CID 44601264.
- ^ Dowd FJ, Johnson B, Mariotti A (3 September 2016). Pharmacology and Therapeutics for Dentistry. Elsevier Health Sciences. pp. 448–. ISBN 978-0-323-44595-5.
- ^ a b c d Kuhl H (August 2005). «Pharmacology of estrogens and progestogens: influence of different routes of administration». Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ a b Plant TM, Zeleznik AJ (15 November 2014). Knobil and Neill’s Physiology of Reproduction. Academic Press. pp. 304–. ISBN 978-0-12-397769-4.
- ^ a b Santoro NF, Neal-Perry G (11 September 2010). Amenorrhea: A Case-Based, Clinical Guide. Springer Science & Business Media. pp. 13–. ISBN 978-1-60327-864-5.
- ^ Reddy DS (2010). Neurosteroids: endogenous role in the human brain and therapeutic potentials. Progress in Brain Research. Vol. 186. pp. 113–37. doi:10.1016/B978-0-444-53630-3.00008-7. PMC 3139029. PMID 21094889.
- ^ a b Baulieu E, Kelly PA (30 November 1990). Hormones: From Molecules to Disease. Springer Science & Business Media. pp. 401–. ISBN 978-0-412-02791-8.
- ^ Beranič N, Gobec S, Rižner TL (2011). «Progestins as inhibitors of the human 20-ketosteroid reductases, AKR1C1 and AKR1C3». Chem. Biol. Interact. 191 (1–3): 227–33. doi:10.1016/j.cbi.2010.12.012. PMID 21182831.
- ^ Anderson GD, Odegard PS (October 2004). «Pharmacokinetics of estrogen and progesterone in chronic kidney disease». Adv Chronic Kidney Dis. 11 (4): 357–60. doi:10.1053/j.ackd.2004.07.001. PMID 15492972.
- ^ Greenblatt JM, Brogan K (27 April 2016). Integrative Therapies for Depression: Redefining Models for Assessment, Treatment and Prevention. CRC Press. pp. 201–. ISBN 978-1-4987-0230-0.
- ^ Graham C (2 December 2012). Reproductive Biology of the Great Apes: Comparative and Biomedical Perspectives. Elsevier. pp. 179–. ISBN 978-0-323-14971-6.
- ^ Strushkevich, N.; Gilep, A. A.; Shen, L.; Arrowsmith, C. H.; Edwards, A. M.; Usanov, S. A.; Park, H. W. (2013). «Structural Insights into Aldosterone Synthase Substrate Specificity and Targeted Inhibition». Molecular Endocrinology. 27 (2): 315–324. doi:10.1210/me.2012-1287. PMC 5417327. PMID 23322723.
- ^ van Rooyen D, Gent R, Barnard L, Swart AC (April 2018). «The in vitro metabolism of 11β-hydroxyprogesterone and 11-ketoprogesterone to 11-ketodihydrotestosterone in the backdoor pathway». The Journal of Steroid Biochemistry and Molecular Biology. 178: 203–212. doi:10.1016/j.jsbmb.2017.12.014. PMID 29277707. S2CID 3700135.
- ^ a b de Azevedo Piccinato C (2008). Regulation of Steroid Metabolism and the Hepatic Transcriptome by Estradiol and Progesterone. pp. 24–25. ISBN 978-1-109-04632-8.[permanent dead link]
- ^ Akalin S (January 1991). «Effects of ketoconazole in hirsute women». Acta Endocrinologica. 124 (1): 19–22. doi:10.1530/acta.0.1240019. PMID 1825737. S2CID 9831739.
- ^ Aufrère MB, Benson H (June 1976). «Progesterone: an overview and recent advances». Journal of Pharmaceutical Sciences. 65 (6): 783–800. doi:10.1002/jps.2600650602. PMID 945344.
- ^ Stricker R, Eberhart R, Chevailler MC, Quinn FA, Bischof P, Stricker R (2006). «Establishment of detailed reference values for luteinizing hormone, follicle stimulating hormone, estradiol, and progesterone during different phases of the menstrual cycle on the Abbott ARCHITECT analyzer». Clin. Chem. Lab. Med. 44 (7): 883–7. doi:10.1515/CCLM.2006.160. PMID 16776638. S2CID 524952.
- ^ Csapo AI, Pulkkinen MU, Wiest WG (1973). «Effects of lutectomy and progestreone replacement therapy in early pregnancy patients». Am J Obstet Gynecol. 115 (6): 759–65. doi:10.1016/0002-9378(73)90517-6. PMID 4688578.
- ^ NIH Clinical Center (2004-08-16). «Progesterone Historical Reference Ranges». United States National Institutes of Health. Archived from the original on 2009-01-09. Retrieved 2008-03-12.
- ^ a b c d e f g h i Progesterone Reference Ranges, Performed at the Clinical Center at the National Institutes of Health, Bethesda MD, 03Feb09
- ^ a b c d e f g h Converted from mass values using molar mass of 314.46 g/mol
- ^ Häggström, Mikael (2014). «Reference ranges for estradiol, progesterone, luteinizing hormone and follicle-stimulating hormone during the menstrual cycle». WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.001. ISSN 2002-4436.
- ^ Goodson III WH, Handagama P, Moore II DH, Dairkee S (2007-12-13). «Milk products are a source of dietary progesterone». 30th Annual San Antonio Breast Cancer Symposium. pp. abstract # 2028. Retrieved 2008-03-12.
- ^ Pauli GF, Friesen JB, Gödecke T, Farnsworth NR, Glodny B (March 2010). «Occurrence of progesterone and related animal steroids in two higher plants». Journal of Natural Products. 73 (3): 338–45. doi:10.1021/np9007415. PMID 20108949. S2CID 26467578.
- ^ Applezweig N (May 1969). «Steroids». Chemical Week. 104: 57–72. PMID 12255132.
- ^ Noguchi E, Fujiwara Y, Matsushita S, Ikeda T, Ono M, Nohara T (September 2006). «Metabolism of tomato steroidal glycosides in humans». Chemical & Pharmaceutical Bulletin. 54 (9): 1312–4. doi:10.1248/cpb.54.1312. PMID 16946542.
- ^ Yang DJ, Lu TJ, Hwang LS (October 2003). «Isolation and identification of steroidal saponins in Taiwanese yam cultivar (Dioscorea pseudojaponica Yamamoto)» (PDF). Journal of Agricultural and Food Chemistry. 51 (22): 6438–44. doi:10.1021/jf030390j. PMID 14558759.
- ^ «Final report of the amended safety assessment of Dioscorea Villosa (Wild Yam) root extract». International Journal of Toxicology. 23 Suppl 2 (2_suppl): 49–54. 2004. doi:10.1080/10915810490499055. PMID 15513824. S2CID 962216.
- ^ Niño J, Jiménez DA, Mosquera OM, Correa YM (2007). «Diosgenin quantification by HPLC in a Dioscorea polygonoides tuber collection from colombian flora». Journal of the Brazilian Chemical Society. 18 (5): 1073–1076. doi:10.1590/S0103-50532007000500030.
- ^ Myoda T, Nagai T, Nagashima T (2005). Properties of starches in yam (Dioscorea spp.) tuber. Current Topics in Food Science and Technology. pp. 105–114. ISBN 81-308-0003-9.
- ^ Wesp LM, Deutsch MB (2017). «Hormonal and Surgical Treatment Options for Transgender Women and Transfeminine Spectrum Persons». Psychiatr. Clin. North Am. 40 (1): 99–111. doi:10.1016/j.psc.2016.10.006. PMID 28159148.
- ^ Ruan X, Mueck AO (November 2014). «Systemic progesterone therapy—oral, vaginal, injections and even transdermal?». Maturitas. 79 (3): 248–55. doi:10.1016/j.maturitas.2014.07.009. PMID 25113944.
- ^ Filicori M (2015). «Clinical roles and applications of progesterone in reproductive medicine: an overview». Acta Obstet Gynecol Scand. 94 Suppl 161: 3–7. doi:10.1111/aogs.12791. PMID 26443945.
- ^ Ciampaglia W, Cognigni GE (2015). «Clinical use of progesterone in infertility and assisted reproduction». Acta Obstet Gynecol Scand. 94 Suppl 161: 17–27. doi:10.1111/aogs.12770. PMID 26345161. S2CID 40753277.
- ^ Choi SJ (2017). «Use of progesterone supplement therapy for prevention of preterm birth: review of literatures». Obstet Gynecol Sci. 60 (5): 405–420. doi:10.5468/ogs.2017.60.5.405. PMC 5621069. PMID 28989916.
- ^ Coomarasamy A, Harb HM, Devall AJ, Cheed V, Roberts TE, Goranitis I, et al. (June 2020). «Progesterone to prevent miscarriage in women with early pregnancy bleeding: the PRISM RCT». Health Technology Assessment. 24 (33): 1–70. doi:10.3310/hta24330. PMC 7355406. PMID 32609084.
- ^ a b Elks J (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. pp. 1024–. ISBN 978-1-4757-2085-3.
- ^ a b Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. pp. 880–. ISBN 978-3-88763-075-1.
- ^ Numazawa M, Nagaoka M, Kunitama Y (September 1986). «Regiospecific deoxygenation of the dihydroxyacetone moiety at C-17 of corticoid steroids with iodotrimethylsilane». Chemical & Pharmaceutical Bulletin. 34 (9): 3722–6. doi:10.1248/cpb.34.3722. PMID 3815593.
- ^ a b Marker RE, Krueger J (1940). «Sterols. CXII. Sapogenins. XLI. The Preparation of Trillin and its Conversion to Progesterone». J. Am. Chem. Soc. 62 (12): 3349–3350. doi:10.1021/ja01869a023.
- ^ Goswami, Amrit; Kotoky, Rumi; Rastogi, Romesh C.; Ghosh, Anil C. (1 May 2003). «A One-Pot Efficient Process for 16-Dehydropregnenolone Acetate». Organic Process Research & Development. 7 (3): 306–308. doi:10.1021/op0200625.
- ^ Heyl FW (1950). «Progesterone from 3-Acetoxybisnor-5-cholenaldehyde and 3-Ketobisnor-4-cholenaldehyde». Journal of the American Chemical Society. 72 (6): 2617–2619. doi:10.1021/ja01162a076.
- ^ Slomp G (1958). «Ozonolysis. II. 1 The Effect of Pyridine on the Ozonolysis of 4,22-Stigmastadien-3-one 2». Journal of the American Chemical Society. 80 (4): 915–921. doi:10.1021/ja01537a041.
- ^ Sundararaman P, Djerassi C (October 1977). «A convenient synthesis of progesterone from stigmasterol». The Journal of Organic Chemistry. 42 (22): 3633–4. doi:10.1021/jo00442a044. PMID 915584.
- ^ «Nova Transcripts: Forgotten Genius». PBS.org. February 6, 2007.
- ^ «Giants of the Past». lipidlibrary.aocs.org. Archived from the original on 2012-04-15.
- ^ a b c Johnson WS, Gravestock MB, McCarry BE (August 1971). «Acetylenic bond participation in biogenetic-like olefinic cyclizations. II. Synthesis of dl-progesterone». Journal of the American Chemical Society. 93 (17): 4332–4. doi:10.1021/ja00746a062. PMID 5131151.
- ^ Corner, George W.; Allen, Willard M. (1929-03-01). «Physiology of the corpus luteum». American Journal of Physiology. Legacy Content. 88 (2): 326–339. doi:10.1152/ajplegacy.1929.88.2.326. ISSN 0002-9513.
- ^ a b c Coutinho EM, Segal SJ (1999). Is Menstruation Obsolete?. Oxford University Press. pp. 31–. ISBN 978-0-19-513021-8.
- ^ Walker A (7 March 2008). The Menstrual Cycle. Routledge. pp. 49–. ISBN 978-1-134-71411-7.
- ^ Piosik R (2003). «Adolf Butenandt und sein Wirken an der Technischen Hochschule Danzig». Chemkon. 10 (3): 135–138. doi:10.1002/ckon.200390038.
- ^ Ginsburg B (6 December 2012). Premenstrual Syndrome: Ethical and Legal Implications in a Biomedical Perspective. Springer Science & Business Media. pp. 274–. ISBN 978-1-4684-5275-4.
- ^ Rolleston HD (1936). The Endocrine Organs in Health and Disease: With an Historical Review. Oxford University Press, H. Milford. p. 406.
- ^ Allen WM (October 1970). «Progesterone: how did the name originate?». Southern Medical Journal. 63 (10): 1151–5. doi:10.1097/00007611-197010000-00012. PMID 4922128. S2CID 35867375.
- ^ Refsal K (February 2009). «Interpretation of Serum Progesterone Results for Management of Breeding in Dogs» (PDF). Webcd.endo.ref.
External links[edit]
- Progesterone MS Spectrum
- Progesterone at the US National Library of Medicine Medical Subject Headings (MeSH)
- Kimball JW (2007-05-27). «Progesterone». Kimball’s Biology Pages. Archived from the original on 2008-06-18. Retrieved 2008-06-18.
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Прогестерон
- Химическое название
- Брутто формула
- Фармакологическая группа вещества Прогестерон
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Прогестерон
- Противопоказания
- Ограничения к применению
- Побочные действия вещества Прогестерон
- Взаимодействие
- Способ применения и дозы
- Меры предосторожности
- Торговые названия с действующим веществом Прогестерон
Структурная формула
Русское название
Прогестерон
Английское название
Progesterone
Латинское название вещества Прогестерон
Progesteronum (род. Progesteroni)
Химическое название
Прегн-4-ен-3,20-дион
Фармакологическая группа вещества Прогестерон
Нозологическая классификация
Список кодов МКБ-10
- N91.5 Олигоменорея неуточненная
- E91* Диагностика заболеваний эндокринной системы
- N97 Женское бесплодие
- E28 Дисфункция яичников
- N64.4 Мастодиния
- N94.8 Другие уточненные состояния, связанные с женскими половыми органами и менструальным циклом
- N64.8 Другие уточненные болезни молочной железы
- O20.0 Угрожающий аборт
- N95.1 Менопаузное и климактерическое состояние у женщин
- N92.1 Обильные и частые менструации при нерегулярном цикле
- D25 Лейомиома матки
- N80 Эндометриоз
- N94.3 Синдром предменструального напряжения
- N96 Привычный выкидыш
- N95 Нарушения менопаузы и другие нарушения в околоменопаузном периоде
- Z31.1 Искусственное оплодотворение
- N60.1 Диффузная кистозная мастопатия
- N91.2 Аменорея неуточненная
- N94.6 Дисменорея неуточненная
Фармакологическое действие
—
прогестагенное.
Характеристика
Белый или почти белый кристаллический порошок, без запаха. Практически нерастворим в воде; растворим в спирте, ацетоне и диоксане; трудно растворим в растительных маслах и очень легко — в хлороформе. Стабилен на воздухе. Молекулярная масса 314,47.
Фармакология
Является гормоном желтого тела. Связываясь с рецепторами на поверхности клеток органов-мишеней, проникает в ядро, активирует ДНК и стимулирует синтез РНК.
Способствует переходу слизистой оболочки матки из пролиферативной в секреторную фазу, создает необходимые условия для имплантации оплодотворенной яйцеклетки, снижает чувствительность матки к окситоцину и расслабляет ее мускулатуру (токолитический эффект). Стимулирует липопротеиновые липазы, увеличивает запасы жира, повышает уровни базального и индуцированного инсулина, утилизацию глюкозы, накопление в печени гликогена, выработку альдостерона, вызывает гипоазотемию и гиперазотурию; подавляет продукцию гипоталамических факторов высвобождения ЛГ и ФСГ и, соответственно, биосинтез гонадотропных гормонов гипофиза.
В тканях молочной железы уменьшает проницаемость капилляров, снижает отек соединительнотканной стромы, зависимый от фазы менструального цикла, тормозит пролиферацию и митотическую активность эпителия протоков (при аппликации в виде геля).
При приеме внутрь, интравагинальном (капсулы), п/к и в/м введении быстро абсорбируется. Cmax при приеме внутрь достигается через 1–3 ч, при интравагинальной аппликации — через 2–6 ч. Связывание с белками — 96–99%, преимущественно с альбумином (50–54%) и транскортином (43–48%). В печени превращается главным образом в прегнандиол и прегнанолон, которые затем подвергаются конъюгации с образованием глюкуронидов и сульфатов. Выводится почками (50–60%) и с желчью (более 10%); метаболиты прогестерона, экскретирующиеся с желчью, выводятся с фекалиями и могут подвергаться энтерогепатической рециркуляции.
При аппликации на кожу в виде геля для наружного применения практически не всасывается и не попадает в системный кровоток.
Эффективность применения в виде вагинального геля показана при лечении вторичной аменореи, обусловленной недостатком прогестерона, а также в репродуктивных технологиях для восполнения недостатка прогестерона при донорстве яйцеклеток.
Применение вещества Прогестерон
Капсулы: для приема внутрь — предменструальный синдром, фиброзно-кистозная мастопатия; пременопауза, менопауза, в т.ч. преждевременная, постменопауза — в качестве гестагенного компонента заместительной гормональной терапии (ЗГТ) в сочетании с эстрогенами; интравагинально — ЗГТ при нефункционирующих яичниках в случае отсутствия прогестерона (донорство яйцеклеток), поддержка лютеиновой фазы во время подготовки к экстракорпоральному оплодотворению, поддержка лютеиновой фазы в спонтанном или индуцированном менструальном цикле, профилактика привычного и угрожающего выкидыша вследствие гестагенной недостаточности, эндокринное бесплодие, профилактика миомы матки, эндометриоз.
Раствор в масле: аменорея, олигоменорея, альгодисменорея (на почве гипогенитализма), ановуляторная метроррагия, эндокринное бесплодие (в т.ч. недостаточность желтого тела), угроза прерывания беременности, диагностика секреции эстрогенов.
Гель для наружного применения: мастодиния, мастопатия.
Противопоказания
Гиперчувствительность. Капсулы: выраженные нарушения функции печени, склонность к тромбозам, острые формы флебита или тромбоэмболических заболеваний, вагинальные кровотечения неустановленного генеза, неполный аборт, порфирия.
Раствор в масле: рак молочной железы и половых органов (для монотерапии), выраженные нарушения функции печени, беременность (II и III триместр), склонность к тромбозам, острые формы флебита или тромбоэмболических заболеваний, вагинальные кровотечения неустановленного генеза, несостоявшийся выкидыш, порфирия .
Ограничения к применению
Капсулы: заболевания сердечно-сосудистой системы, в т.ч. артериальная гипертензия, бронхиальная астма, выраженные нарушения функции почек; заболевания ЦНС, в т.ч. депрессия, эпилепсия, мигрень; сахарный диабет; беременность (II и III триместр), кормление грудью.
Раствор в масле: заболевания сердечно-сосудистой системы, в т.ч. артериальная гипертензия, бронхиальная астма, выраженные нарушения функции почек, заболевания ЦНС, в т.ч. депрессия, эпилепсия, мигрень; сахарный диабет, внематочная беременность, кормление грудью.
Побочные действия вещества Прогестерон
Аллергические реакции.
Капсулы: сонливость, преходящее головокружение (через 1–3 ч после приема), расстройства менструального цикла (сокращение, промежуточное кровотечение).
Раствор в масле: тромбоэмболия (в т.ч. легочной артерии и сосудов головного мозга), тромбофлебит, тромбоз вен сетчатки, повышение АД, отеки, калькулезный холецистит, холестатический гепатит, сонливость, головная боль, депрессия, апатия, дисфория, нарушение зрения, тошнота, рвота, снижение аппетита, галакторея, изменение массы тела, гирсутизм, алопеция; увеличение, боль и напряжение молочных желез; снижение либидо, расстройства менструального цикла (сокращение, промежуточное кровотечение); болезненность в месте введения.
Взаимодействие
Уменьшает эффективность действия ЛС, стимулирующих гладкие мышцы матки, анаболических стероидов. При одновременном применении с барбитуратами снижается действие прогестерона.
Способ применения и дозы
Внутрь, интравагинально, в/м, местно. Режим дозирования и выбор лекарственной формы зависят от показаний. Продолжительность лечения определяется характером и особенностями заболевания.
Меры предосторожности
Во время лечения ослабляется концентрация внимания (необходимо соблюдать осторожность при управлении автотранспортными средствами и занятиями другими потенциально опасными видами деятельности, требующими быстроты психомоторных реакций).
Торговые названия с действующим веществом Прогестерон
| Торговое название | Цена за упаковку, руб. |
|---|---|
| ДляЖенс® про |
от 349.00 до 349.00 |
| Ипрожин |
от 287.00 до 364.00 |
| Миражэль |
1746.00 |
| Праджисан® |
от 211.00 до 2775.00 |
| Прогестерон |
от 353.00 до 933.00 |
| Прожестожель |
от 1010.00 до 1206.00 |
| Утрожестан® |
от 353.00 до 509.00 |
CharChem
:
Система описания химических формул для WEB.
ПрогестеронПоиск химических веществ по названиям или формулам.
|
Прогестерон (Progesterone)
💊 Состав препарата Прогестерон
✅ Применение препарата Прогестерон
Описание активных компонентов препарата
Прогестерон
(Progesterone)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.06.24
Владелец регистрационного удостоверения:
Код ATX:
G03DA04
(Прогестерон)
Лекарственная форма
| Прогестерон |
Р-р д/в/м введения масляный 2.5% (25 мг/1 мл): амп. 10 шт. рег. №: Р N002804/01-2003 |
Форма выпуска, упаковка и состав
препарата Прогестерон
Раствор для в/м введения масляный 2.5%.
1 мл — ампулы (10) — коробки картонные.
1 мл — ампулы (5) — упаковки ячейковые контурные (2) — пачки картонные.
Клинико-фармакологическая группа:
Гестаген
Фармакологическое действие
Гормон, идентичный естественному гормону желтого тела яичника. Связываясь с рецепторами на поверхности клеток органов-мишеней, проникает в ядро, где активируя ДНК, стимулирует синтез РНК.
Способствует переходу слизистой оболочки матки из фазы пролиферации, вызываемой фолликулярным гормоном эстрадиолом, в секреторную фазу. После оплодотворения способствует переходу в состояние, необходимое для развития оплодотворенной яйцеклетки. Уменьшает возбудимость и сократимость мускулатуры матки и маточных труб. Способствует образованию нормального эндометрия. Стимулирует развитие концевых элементов молочной железы, индуцирует лактацию.
Стимулируя протеинлипазу, увеличивает запасы жира, повышает утилизацию глюкозы. Увеличивая концентрацию базального и стимулированного инсулина, способствует накоплению в печени гликогена, повышает выработку гонадотропных гормонов гипофиза; уменьшает азотемию, увеличивает выведение азота с мочой.
Фармакокинетика
После в/м введения всасывается быстро и практически полностью. После в/м введения 10 мг прогестерона Cmax в плазме достигается в течение приблизительно 8 ч и остается выше базального уровня в течение около 24 ч. Прогестерон активно связывается с белками плазмы крови, главным образом, с альбумином (50-54%) и кортикостероид-связывающим глобулином (43-48%). Метаболизируется в печени с образованием метаболитов — прегнандиола и прегнанолона, которые конъюгируют с глюкуроновой и серной кислотами. В метаболизме участвует изофермент CYP2C19. Метаболиты прогестерона выводятся почками — 50-60%, через кишечник — более 10%. Количество метаболитов, выводимых почками, колеблется в зависимости от фазы желтого тела. T1/2 — несколько минут.
Показания активных веществ препарата
Прогестерон
Бесплодие вследствие недостаточности желтого тела.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
В/м — 12.5 мг/сут в течение 2 недель с момента овуляции.
Побочное действие
Со стороны иммунной системы: кожный зуд, сыпь, крапивница, анафилактоидные реакции.
Со стороны эндокринной системы: гирсутизм.
Со стороны обмена веществ: отеки, увеличение или уменьшение массы тела, снижение аппетита, гипертермия.
Со стороны психики: апатия, дисфория, депрессия, лабильность настроения.
Со стороны нервной системы: головная боль, головокружение, сонливость, бессонница, астения, неврит зрительного нерва.
Со стороны органа зрения: нарушение зрения.
Со стороны сосудов: повышение АД, тромбоэмболия (в т.ч. легочной артерии), тромбоз сосудов головного мозга или вен сетчатки, тромбофлебит, геморрагическая сыпь.
Со стороны пищеварительной системы: тошнота, рвота, вздутие живота, запор, диарея, боль в животе.
Со стороны печени и желчевыводящих путей: холецистит, холестатическая желтуха, холестатический гепатит.
Со стороны половых органов и молочной железы: изменение либидо; «прорывное» кровотечение; «мажущие» кровянистые выделения; аменорея; укорочение менструального цикла; эрозия шейки матки; спазм мышц матки, выделения из влагалища, зуд и ощущение дискомфорта во влагалище, вульвовагинит, синдром гиперстимуляции яичников, «приливы», злокачественные заболевания молочной железы; изменение вязкости секрета шейки матки; предменструальный синдром; галакторея; увеличение, боль и напряжение молочных желез.
Со стороны костно-мышечной системы: боль в спине.
Со стороны кожи и подкожных тканей: акне, алопеция, многоформная эритема, узловатая эритема.
Со стороны мочевыделительной системы: цистит.
Общие реакции: общее недомогание, усталость
Местные реакции: гиперемия, раздражение и/или боль в месте введения, гематома, уплотнение, отек и зуд в месте инъекции.
Противопоказания к применению
Тромбоз глубоких вен, тромбофлебит; тромбоэмболические нарушения (тромбоэмболия легочной артерии, инфаркт миокарда, инсульт), внутричерепное кровоизлияние или наличие данных состояний/заболеваний в анамнезе; кровотечения из влагалища неясного генеза; неполный аборт; порфирия; установленные или подозреваемые злокачественные новообразования молочных желез и половых органов; тяжелые заболевания печени (в т.ч. холестатическая желтуха, гепатит, синдромы Дубина-Джонсона, Ротора, злокачественные опухоли печени) в настоящее время или в анамнезе; идиопатическая желтуха, зуд или герпес во время предыдущей беременности; беременность, период грудного вскармливания; возраст до 18 лет (эффективность и безопасность не установлены); повышенная чувствительность к прогестерону.
С осторожностью
Заболевания сердечно-сосудистой системы, артериальная гипертензия, хроническая почечная недостаточность, сахарный диабет, бронхиальная астма, эпилепсия, мигрень, депрессия, гиперлипопротеинемия, нарушения функции печени легкой и средней степени тяжести, фоточувствительность.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Противопоказано применение при тяжелых заболеваниях печени (в т.ч. холестатическая желтуха, гепатит, синдромы Дубина-Джонсона, Ротора, злокачественные опухоли печени) в настоящее время или в анамнезе.
С осторожностью применяют при нарушениях функции печени легкой и средней степени тяжести.
Применение при нарушениях функции почек
С осторожностью применяют при хронической почечной недостаточности.
Применение у детей
Противопоказано применение в возрасте до 18 лет (эффективность и безопасность не установлены).
Применение у пожилых пациентов
Эффективность и безопасность у пациенток пожилого возраста (старше 65 лет) не установлена. Показания к применению в пожилом возрасте отсутствуют.
Особые указания
Не применяется с целью контрацепции.
До начала применения прогестерона необходимо проведение медицинского обследования, включающего обследование молочных желез и органов малого таза и исследование мазка по Папаниколау.
Следует принимать с осторожностью у пациенток с заболеваниями и состояниями, которые могут усугубляться при задержке жидкости (артериальная гипертензия, сердечно-сосудистые заболевания, хроническая почечная недостаточность, эпилепсия, мигрень, бронхиальная астма); у пациенток с сахарным диабетом; нарушениями функции печени легкой и средней степени тяжести; фоточувствительностью.
Необходимо наблюдать за пациентками с депрессией в анамнезе, и в случае развития депрессии тяжелой степени, необходимо отменить прогестерон.
Пациентки с сопутствующими сердечно-сосудистыми заболеваниями или наличием их в анамнезе должны также периодически наблюдаться врачом.
При длительном лечении прогестероном необходимо регулярно проводить медицинские осмотры (включая исследование функции печени); лечение необходимо отменить в случае возникновения отклонений от нормальных показателей функциональных проб печени или холестатической желтухи.
При применении прогестерона возможно снижение толерантности к глюкозе и увеличение потребности в инсулине и других гипогликемических препаратах у пациенток с сахарным диабетом.
В случае появления аменореи в процессе лечения необходимо исключить беременность.
В случае ациклических кровотечений не следует применять прогестерон до выяснения их причины, включая проведение гистологического исследования эндометрия.
При наличии в анамнезе хлоазмы или склонности к ее развитию пациенткам рекомендуется избегать УФ-облучения.
Из-за риска развития тромбоэмболических осложнений следует прекратить применение прогестерона в случае возникновения: зрительных нарушений, таких как потеря зрения, экзофтальм, двоение в глазах, сосудистые поражения сетчатки; мигрени; венозной тромбоэмболии или тромботических осложнений, независимо от их локализации.
При наличии тромбофлебита в анамнезе, пациентка должна находиться под тщательным наблюдением.
Применение прогестерона может влиять на результаты некоторых лабораторных анализов, включая показатели функции печени, щитовидной железы; параметры коагуляции; концентрацию прегнандиола.
Влияние на способность к управлению транспортными средствами и механизмами
Во время лечения необходимо соблюдать осторожность при управлении транспортными средствами, механизмами или занятии деятельностью, требующей повышенной концентрации внимания и быстроты психомоторных реакций.
Лекарственное взаимодействие
Прогестерон усиливает действие диуретиков, гипотензивных лекарственных средств, иммунодепрессантов, антикоагулянтов.
Уменьшает лактогенный эффект окситоцина.
Одновременное применение с препаратами-индукторами микросомальных ферментов печени CYP3A4, такими как барбитураты, противоэпилептические препараты (фенитоин), рифампицин, фенилбутазон, спиронолактон, гризеофульвин, сопровождается ускорением метаболизма прогестерона в печени.
Одновременный прием прогестерона с некоторыми антибиотиками (пенициллины, тетрациклины) может привести к снижению его эффективности из-за нарушения кишечно-печеночной рециркуляции половых гормонов вследствие изменения кишечной микрофлоры.
Степень выраженности указанных взаимодействий может варьировать у разных пациенток, поэтому прогноз клинических эффектов перечисленных взаимодействий затруднен.
Кетоконазол может увеличить биодоступность прогестерона.
Прогестерон может повышать концентрацию кетоконазола и циклоспорина.
Прогестерон может снизить эффективность бромокриптина.
Прогестерон может вызвать снижение толерантности к глюкозе, вследствие чего — увеличить потребность в инсулине или других гипогликемических препаратах у пациенток с сахарным диабетом.
Биодоступность прогестерона может быть снижена у курящих пациенток и при чрезмерном употреблении алкоголя.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
 |
||
 |
||
| Клинические данные | ||
|---|---|---|
| Торговые наименования | Прометриум, Утрогестан, Эндометрин, Кринон и другие | |
| Другие названия | P4; Прегненедион; Берег-4-ен-3,20-дион | |
| AHFS / Drugs.com | Монография | |
| MedlinePlus | a604017 | |
| Беременность. категория |
|
|
| Пути введения. | • Внутрь (капсула ). • Сублингвально (таблетка ). • Местное (крем, гель ). • вагинальный (капсула, таблетка, гель, суппозиторий, кольцо ). • Ректальный (суппозиторий). • IMинъекция ( масляный раствор ). • SCинъекция (водный раствор ). • Внутриматочная (ВМС ) | |
| Класс препарата | Прогестаген ; Антиминералокортикоид ; Нейростероид | |
| Код УВД |
|
|
| Правовой статус | ||
| Правовой статус |
|
|
| Фармакокинетические данные | ||
| Биодоступность | Перорально: <2.4%. Вагинально: 4–8% | |
| Связывание с белками | 98–99%:. • Альбумин : 80%. • КБГ : 18%. • ГСПГ : <1%. • Свободно: 1-2% | |
| Метаболизм | В основном печень :. • 5α- и 5β-редуктаза. • 3α- и 3β-HSD. • 20α- и 20β-HSD. • Конъюгация. • 17α-гидроксилаза. • 21- гидроксилаза. • CYPs (например, CYP3A4 ) | |
| Метаболиты | • дигидропрогестероны. • прегнанолоны. • прегнандиолы. • 20α-гидроксипрогестерон. • 17α-гидроксипрогестерон. • прегнантриолы. • 11-дезоксикортикостерон. глюк (и | / сульфатные конъюгаты ) |
| Период полувыведения | • Перорально: 5 часов (с едой). * Сублингвально: 6–7 часов. • Вагинально: 14– 50 часов. • Актуально: 30–40 часов. • IM: 20–28 часов. • SC: 13–18 часов. • IV : 3–90 минут | |
| Выведение | Желчь и моча | |
| Идентификаторы | ||
Название ИЮПАК
|
||
| Номер CAS |
|
|
| PubChem CID |
|
|
| IUPHAR / BPS |
|
|
| DrugBank |
|
|
| ChemSpider |
|
|
| UNII |
|
|
| KEGG |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| Che физические и физические данные | ||
| Формула | C21H30O2 | |
| Молярная масса | 314,469 г · моль | |
| 3D-модель (JSmol ) |
|
|
| Удельное вращение | [α] D = от +172 до + 182 ° (2% в диоксане, β-форме) | |
| Температура плавления | 126 ° C (259 ° F) | |
SMILES
|
||
InChI
|
||
Прогестерон (P4) — это лекарство и природный стероидный гормон. Это гестаген, который используется в комбинации с эстрогенами в основном в гормональной терапии при менопаузе симптомах и низкий уровень половых гормонов у женщин. Он также используется женщинами для поддержки беременности и фертильности и для лечения гинекологических заболеваний. Прогестерон можно принимать внутрь, через влагалище и инъекцией в мышцу или жир, среди других маршрутов. вагинальное кольцо с прогестероном и прогестерон внутриматочная спираль, используемые для контроля над рождаемостью, также существуют в некоторых регионах мира.
Прогестерон хорошо переносится и часто вызывает мало или не вызывает побочных эффектов. Однако возможен ряд побочных эффектов, например изменение настроения. При приеме прогестерона внутрь или в высоких дозах также могут возникать определенные центральные побочные эффекты, включая седативный эффект, сонливость и когнитивные нарушения.. Лекарство является естественным прогестагеном и, следовательно, является агонистом рецептора прогестерона (PR), биологической мишенью таких прогестагенов, как эндогенный прогестерон. Он противодействует воздействию эстрогенов на различные части тела, такие как матка, а также блокирует действие гормона альдостерон. Кроме того, прогестерон оказывает нейростероидное действие на мозг..
Прогестерон был впервые выделен в чистом виде в 1934 году. Впервые он стал доступен в качестве лекарства позже в том же году. Пероральный микронизированный прогестерон (OMP), позволяющий принимать прогестерон внутрь, был введен в 1980 году. Большое количество синтетических прогестагенов или прогестинов имеют получены из прогестерона и также используются в качестве лекарств. Примеры включают ацетат медроксипрогестерона и норэтистерон. В 2017 году это было 195-е место среди наиболее часто назначаемых лекарств в США, было выписано более двух миллионов рецептов.
Содержание
- 1 Применение в медицине
- 1.1 Гормональная терапия
- 1.1.1 Менопауза
- 1.1.2 Трансгендерные женщины
- 1.2 Поддержка беременности
- 1.3 Поддержка фертильности
- 1.4 Контроль над рождаемостью
- 1.5 Гинекологические нарушения
- 1.6 Другое применение
- 1.6.1 Боль в груди
- 1.6.2 Предменструальный синдром
- 1.6.3 Катамениальная эпилепсия
- 1.7 Доступные формы
- 1.1 Гормональная терапия
- 2 Противопоказания
- 3 Побочные эффекты
- 3.1 Центральная депрессия
- 3.2 Рак груди
- 3.3 Сгустки крови
- 4 Передозировка
- 5 Взаимодействия
- 6 Фармакология
- 6.1 Фармакодинамика
- 6.2 Фармакокинетика
- 7 Химия
- 7.1 Производные
- 7.2 Синтез
- 8 История
- 8.1 Открытие и синтез
- 8.2 Инъекции и имплантаты
- 8.3 Оральный и сублингвальный
- 8.4 Влагалищный, ректальный и маточный
- 8.5 Трансдермальный и местный
- 9 Общество и культура
- 9.1 Общие названия
- 9.2 Торговые марки
- 9.3 Доступность
- 9.3.1 США
- 10 Исследования
- 11 См. Также
- 12 Ссылки
- 13 Дополнительная литература
Использование в медицине
Гормональная терапия
Менопауза
Прогестерон используется в сочетании с эстрогеном как компонент гормональной терапии менопаузы для лечения менопаузальных симптомов в пери- и постменопаузальные женщины. Он используется специально для обеспечения защиты эндометрия против вызываемой эстрогеном гиперплазии эндометрия и рака у женщин с интактной маткой. В систематическом обзоре 2016 года защиты эндометрия с помощью прогестерона рекомендовано 100 мг / день непрерывного перорального прогестерона, 200 мг / день циклический пероральный прогестерон, 45-100 мг / день циклический вагинальный прогестерон и 100 мг вагинального прогестерона через день. Также было рекомендовано вагинальное введение прогестерона в дозе 100 мг 2 раза в неделю, но необходимы дополнительные исследования этой дозы и может быть рекомендован мониторинг эндометрия. Трансдермальный прогестерон не рекомендовался для защиты эндометрия.
Исследование REPLENISH было первым адекватным исследованием, которое показало, что непрерывный пероральный прием прогестерона в дозе 100 мг / день с пищей обеспечивает адекватный результат. защита эндометрия. Циклический пероральный прогестерон в дозе 200 мг / день также оказался эффективным в профилактике гиперплазии эндометрия, например, в исследовании Постменопаузальные вмешательства эстрогена / прогестина (PEPI). Однако исследование PEPI не имело достаточной мощности для полной количественной оценки гиперплазии эндометрия или риска рака. Нет достаточно мощных исследований, оценивающих защиту эндометрия с вагинальным прогестероном. В любом случае, исследование раннего и позднего вмешательства с эстрадиолом (ELITE) показало, что циклический вагинальный прогестерон гель в дозе 45 мг / день не показал значительных отличий от плацебо в заболеваемость раком эндометрия. Из-за вагинального эффекта первого прохождения низкие дозы вагинального прогестерона могут обеспечить адекватную защиту эндометрия. Несмотря на недостаточную мощность, различные другие более мелкие исследования также обнаружили защиту эндометрия с помощью перорального или вагинального прогестерона. Недостаточно доказательств защиты эндометрия с помощью трансдермального прогестерона крема.
Было обнаружено, что пероральный прогестерон в дозе 300 мг / день значительно снижает приливы по сравнению с плацебо. Комбинация эстрогена и прогестерона орально также уменьшает приливы. Было обнаружено, что эстроген плюс пероральный прогестерон значительно улучшает качество жизни. Было обнаружено, что комбинация эстрогена и перорального приема прогестерона от 100 до 300 мг / день улучшает сон. Более того, сон улучшался в значительно большей степени, чем эстроген плюс медроксипрогестерона ацетат. Это может быть связано с седативным нейростероидным действием прогестерона. Уменьшение количества приливов также может помочь улучшить сон. На основании исследования на животных прогестерон может участвовать в сексуальной функции у женщин. Однако очень ограниченные клинические исследования показывают, что прогестерон не улучшает сексуальное желание или функцию у женщин.
Было обнаружено, что комбинация эстрогена и прогестерона для приема внутрь улучшает минеральную плотность костей (МПК) в той же степени, что и эстроген плюс медроксипрогестерона ацетат. Прогестагены, в том числе прогестерон, могут оказывать благотворное влияние на кости независимо от действия эстрогенов, хотя для подтверждения этого предположения требуются дополнительные исследования. Было обнаружено, что комбинация эстрогена и прогестерона орально или вагинально улучшает здоровье сердечно-сосудистой системы у женщин в ранней менопаузе, но не у женщин в поздней менопаузе. Терапия эстрогенами оказывает благоприятное влияние на кровь липидный профиль, что может привести к улучшению здоровья сердечно-сосудистой системы. Добавление прогестерона внутрь или вагинально оказывает нейтральное или положительное влияние на эти изменения. Это контрастирует с различными прогестинами, которые, как известно, противодействуют положительному влиянию эстрогенов на липиды крови. Было обнаружено, что прогестерон, как сам по себе, так и в сочетании с эстрогеном, оказывает благотворное влияние на кожу и замедляет скорость старения кожи у женщин в постменопаузе.
Во французском наблюдательном исследовании E3N-EPIC риск диабета был значительно ниже у женщин, получающих гормональную терапию в период менопаузы, в том числе при комбинации перорального или трансдермального эстрогена и перорального прогестерона или прогестина.
Трансгендерные женщины
Прогестерон используется в качестве компонента феминизирующей гормональной терапии для трансгендерных женщин в комбинации с эстрогенами и антиандрогенами. Однако добавление прогестагенов в HRT для транссексуалов женщин является спорным, и их роль не ясна. Некоторые пациенты и врачи неофициально полагают, что прогестерон может улучшить развитие груди, улучшить настроение и повысить половое влечение. Однако в настоящее время отсутствуют данные хорошо спланированных исследований, подтверждающие эти представления. Кроме того, прогестагены могут вызывать нежелательные побочные эффекты, хотя биоидентичный прогестерон может быть безопаснее и лучше переноситься, чем синтетические прогестагены, такие как медроксипрогестерона ацетат.
Поскольку некоторые считают, что прогестагены необходимы для полноценного развития груди, прогестерон иногда используется трансгендерными женщинами с целью улучшения развития груди. Тем не менее, в обзоре 2014 года был сделан следующий вывод по теме прогестерона для улучшения развития груди у трансгендерных женщин:
- «Наши знания о естественном происхождении и влиянии различных методов кросс-половой гормональной терапии на развитие груди у [трансгендерных] женщин чрезвычайно немногочисленны и основаны на низком качестве доказательств. Текущие данные не подтверждают, что прогестагены усиливают развитие груди у [трансгендерных] женщин. Они также не доказывают отсутствие такого эффекта. Это не позволяет нам сделать какой-либо твердый вывод в настоящий момент и демонстрирует необходимость дальнейших исследований для прояснения этих важных клинических вопросов ».
Данные о менструирующих женщинах показывают, что нет корреляции между задержкой воды и уровнями прогестерона или эстрогена. Несмотря на это, некоторые теории предполагают, что прогестерон может вызывать временное увеличение груди из-за локальной задержки жидкости и, таким образом, может создавать обманчивый вид роста груди. Помимо гипотетического участия в развитии груди, про гестагены не известны иным образом участвуют в физической феминизации.
Поддержка беременности
Вагинальный прием прогестерона исследуется как потенциально полезный для предотвращения преждевременных родов. у женщин с риском преждевременных родов. Первоначальное исследование Fonseca показало, что вагинальный прогестерон может предотвратить преждевременные роды у женщин с преждевременными родами в анамнезе. Согласно недавнему исследованию, у женщин с короткой шейкой матки, получавших гормональную терапию прогестероновым гелем, был снижен риск преждевременных родов. Гормональное лечение проводилось вагинально каждый день во второй половине беременности. Последующее и более крупное исследование показало, что вагинальный прогестерон не лучше плацебо в предотвращении повторных преждевременных родов у женщин с предыдущими преждевременными родами в анамнезе, но запланированный вторичный анализ данных в этом исследовании показал, что женщины с короткой шейкой матки на исходном уровне в испытании имел два преимущества: сокращение числа родов менее 32 недель и сокращение как частоты, так и времени, в течение которого их дети находились в отделении интенсивной терапии.
В другом испытании было показано, что вагинальный прогестерон был лучше, чем плацебо, в сокращении преждевременных родов до 34 недель у женщин с чрезвычайно короткой шейкой матки на исходном уровне. В редакционной статье Роберто Ромеро обсуждается роль сонографической длины шейки матки в выявлении пациентов, которым может помочь лечение прогестероном. Метаанализ, опубликованный в 2011 году, показал, что вагинальный прогестерон снижает риск преждевременных родов на 42 процента у женщин с короткой шейкой матки. Мета-анализ, объединивший опубликованные результаты пяти крупных клинических испытаний, также показал, что лечение уменьшило количество проблем с дыханием и уменьшило потребность в помещении ребенка на искусственную вентиляцию легких.
Поддержка фертильности
Прогестерон используется для поддержки лютеина в циклах вспомогательных репродуктивных технологий (ВРТ), таких как экстракорпоральное оплодотворение (ЭКО). Он также используется для коррекции недостаточности лютеиновой фазы для подготовки эндометрия к имплантации в терапии бесплодия и используется для поддержки ранней беременности.
Противозачаточные
A вагинальные кольца с прогестероном доступны для противозачаточных при грудном вскармливании в ряде регионов мира. внутриматочная спираль, содержащая прогестерон, также продавалась под торговой маркой Progestasert для контроля рождаемости, в том числе ранее в Соединенных Штатах.
Гинекологические заболевания
Прогестерон используется для контроля стойких ановуляторное кровотечение. Он используется у небеременных женщин с задержкой менструации на одну или несколько недель, чтобы дать возможность отшелушить утолщенную слизистую оболочку эндометрия. Этот процесс называется кровотечением отмены прогестерона. Прогестерон принимают перорально в течение короткого времени (обычно в течение одной недели), после чего его прекращают и должно возникнуть кровотечение.
Другое применение
Прогестерон имеет неясную пользу для отмены Мифепристон вызванный аборт. Доказательств недостаточно для поддержки использования при черепно-мозговой травме.
Прогестерон использовался в качестве местного лекарства, наносимого на кожу головы для лечения облысения по женскому и мужскому типу. Сообщалось о различной эффективности, но в целом его эффективность по этому показанию у обоих полов была низкой.
Боль в груди
Прогестерон одобрен под торговой маркой Progestogel как 1% местное средство гель для местного нанесения на грудь для лечения боли в груди в некоторых странах. Не одобрен для системной терапии. В клинических исследованиях было обнаружено, что он ингибирует индуцированную эстрогеном пролиферацию эпителиальных клеток груди и устраняет боль и болезненность груди у женщин с этим заболеванием. Однако в одном небольшом исследовании с участием женщин с циклической болью в груди это было неэффективно. вагинальный прогестерон также оказался эффективным при лечении боли и болезненности груди.
Предменструальный синдром
Исторически прогестерон широко использовался для лечения предменструального синдрома. В Кокрановском обзоре 2012 г. обнаружено недостаточно доказательств за или против эффективности прогестерона по этому показанию. Другой обзор 10 исследований показал, что прогестерон не эффективен при этом состоянии, хотя в нем говорится, что в настоящее время имеется недостаточно доказательств, чтобы сделать окончательное утверждение о прогестероне при предменструальном синдроме.
Катамениальная эпилепсия
Прогестерон может использоваться для лечения менструальной эпилепсии путем приема добавок в определенные периоды менструального цикла.
Доступные формы
Прогестерон доступен в различных формах, включая оральные капсулы ; сублингвальные таблетки ; вагинальные капсулы, таблетки, гели, суппозитории и кольца ; ректальные суппозитории; масляные растворы для внутримышечной инъекции ; и водные растворы для подкожной инъекции. Гель с прогестероном для местного применения одобрен для местного нанесения на грудь для лечения боли в груди, но не показан для системной терапии. Прогестерон ранее был доступен в виде внутриматочной спирали для использования в гормональной контрацепции, но этот препарат был прекращен. Прогестерон также ограниченно доступен в комбинации с эстрогенами, такими как эстрадиол и бензоат эстрадиола для внутримышечной инъекции.
В дополнение к одобренным фармацевтическим препаратам. продуктов прогестерон доступен в нерегулируемых индивидуальных составных и безрецептурных составах, таких как системные трансдермальные кремы и другие препараты. Системная эффективность трансдермального прогестерона является спорным и не была доказана.
| Маршрут | Форма | Доза | имя бренда | Доступность |
|---|---|---|---|---|
| Пероральный | Капсула | 100, 200, 300 мг | Прометриум | Широко распространенный |
| Таблетка (SR) | 200, 300, 400 мг | Dubagest SR | Индия | |
| Сублингвально | Таблетка | 10, 25, 50, 100 мг | Лютеина | Европа |
| Трансдермальный | гель | 1% (25 мг) | Прогестогель | Европа |
| вагинальный | капсула | 100, 200 мг | Утрожестан | Широко распространенный |
| Таблетка | 100 мг | Эндометрин | Широко распространенный | |
| Гель | 4,8% (45, 90 мг) | Кринон | Широко распространенный | |
| Суппозиторий | 200, 400 мг | Циклогест | Европа | |
| Кольцо | 10 мг / день | Фертиринг | Южная Америка | |
| Ректальный | Суппозиторий | 200, 400 мг | Циклогест | Eu веревка |
| матка | ВМС | 38 мг | Прогестасерт | Снято с производства |
| Внутримышечно. инъекция | Масляный раствор | 2, 5, 10, 20, 25,. 50, 100 мг / мл | пролутон | широко распространенный |
| водн. сусп. | 12,5, 30, 100 мг / мл | Аголютин | Европа | |
| Эмульсия | 5, 10, 25 мг / мл | Di-Pro-Emulsion | Снято с производства | |
| Microsph. | 20, 100 мг / мл | ProSphere | Мексика | |
| Подкожно | Aq. раствор (инъекция ) | 25 мг / флакон | Prolutex | Европа |
| Имплант | 50, 100 мг | Пролутон | Снято с производства | |
| Внутривенно | Водный раствор (инъекция ) | 20 мг / мл | Primolut | Снято с производства |
| Источники и сноски: |
Противопоказания
Противопоказания прогестерона включают гиперчувствительность к прогестерону или прогестагенам, профилактику сердечно-сосудистых заболеваний (предупреждение о черном ящике), тромбофлебит, тромбоэмболическое заболевание, кровоизлияние в мозг, нарушение функции печени или заболевание, рак груди, рак репродуктивных органов, недиагностированное вагинальное кровотечение, пропущенная менструация, выкидыш или наличие этих состояний в анамнезе. Прогестерон должен с осторожностью применять людям с состояниями, на которые может отрицательно повлиять задержка жидкости, такими как эпилепсия, мигрень головные боли, астма, сердечная дисфункция и почечная дисфункция. Его также следует использовать с осторожностью у пациентов с анемией, сахарным диабетом, депрессией в анамнезе, внематочной беременностью, <112 в анамнезе>венерическое заболевание и нерешенное отклонение от нормы мазок Папаниколау. Не рекомендуется использовать прогестерон во время беременности и грудного вскармливания. Тем не менее, Американская академия педиатрии считает, что препарат обычно безопасен при грудном вскармливании, но его не следует использовать в течение первых четырех месяцев беременности. Некоторые составы прогестерона содержат бензиловый спирт, и это может вызвать потенциально смертельный «синдром удушья», если давать недоношенным детям.
Побочные эффекты
Прогестерон хорошо переносится, и многие клинические исследования не сообщили о побочных эффектах. Побочные эффекты прогестерона могут включать спазмы в животе, боль в спине, болезненность груди, запор, тошноту, головокружение, отек, вагинальное кровотечение, гипотензия, утомляемость, дисфория, депрессия и раздражительность и др. Депрессия центральной нервной системы, например седативный эффект и нарушение когнитивных функций / памяти, также может возникать.
Прогестерон влагалища может быть связан с раздражением влагалища, зудом и выделениями, снижением либидо, болезненный половой акт, вагинальное кровотечение или кровянистые выделения в сочетании со спазмами и местным теплом или «чувством прохлады» без выделений. Внутримышечная инъекция может вызвать боль от легкой до умеренной в месте инъекции. Высокие внутримышечные дозы прогестерона были связаны с повышением температуры тела, которое можно уменьшить с помощью лечения парацетамолом.
Прогестерон не содержит нежелательных нецелевых гормональная активность, в отличие от различных прогестинов. В результате он не связан с андрогенным, антиандрогенным, эстрогенным или глюкокортикоидным эффектами. И наоборот, прогестерон может вызывать побочные эффекты, связанные с его антиминералокортикоидной и нейростероидной активностью. По сравнению с прогестином медроксипрогестерона ацетатом, меньше сообщений о болезненности груди при приеме прогестерона. Кроме того, сообщается, что величина и продолжительность вагинального кровотечения при приеме прогестерона ниже, чем при применении ацетата медроксипрогестерона.
Центральная депрессия
Прогестерон может вызывать депрессию центральной нервной системы, поскольку побочный эффект, особенно при пероральном введении или высоких дозах прогестерона. Эти побочные эффекты могут включать сонливость, седативный эффект, сонливость, утомляемость, вялость, снижение бодрости., головокружение, головокружение, спутанность сознания и когнитивный, память и / или двигательная недостаточность. Ограниченные доступные доказательства показали минимальное или нулевое отрицательное влияние на когнитивные функции при пероральном приеме прогестерона (100–600 мг), вагинального прогестерона (45 мг геля) или прогестерона внутримышечно (25–200 мг). Однако было обнаружено, что высокие дозы прогестерона перорально (300–1200 мг), вагинального прогестерона (100–200 мг) и внутримышечного прогестерона (100–200 мг) вызывают дозозависимую утомляемость, сонливость и снижение энергии. Более того, высокие разовые дозы прогестерона перорально (1200 мг) вызывали значительное ухудшение когнитивных функций и памяти. Внутривенное вливание высоких доз прогестерона (например, 500 мг) вызывает глубокий сон у людей. Некоторые люди более чувствительны и могут испытывать значительные седативные и снотворные эффекты при более низких дозах перорального прогестерона (например, 400 мг).
Седативный эффект, а также ухудшение когнитивных функций и памяти при приеме прогестерона объясняются его действием. ингибирующий нейростероид метаболиты. Эти метаболиты в большей степени возникают при пероральном приеме прогестерона, и их можно свести к минимуму, переключившись на парентеральный путь. Прогестерон также можно принимать перед сном, чтобы избежать этих побочных эффектов и улучшить сон. Нейростероидные эффекты прогестерона уникальны для прогестерона и не характерны для прогестинов.
Рак молочной железы
Было обнаружено, что пролиферация клеток молочной железы значительно увеличивается при комбинации перорального эстроген плюс циклический медроксипрогестерона ацетат у женщин в постменопаузе, но не комбинацией трансдермального эстрадиола и перорального прогестерона. Исследования местного применения эстрадиола и прогестерона, наносимого на грудь в течение 2 недель, показали высокие фармакологические локальные уровни эстрадиола и прогестерона. В этих исследованиях оценивались маркеры пролиферации груди и было обнаружено усиление пролиферации при использовании только эстрадиола, снижение пролиферации при использовании прогестерона и отсутствие изменений в пролиферации при сочетании эстрадиола и прогестерона. В исследовании Постменопаузальные вмешательства эстрогена / прогестина (PEPI) комбинация эстрогена и циклического перорального прогестерона привела к более высокой маммографической плотности груди, чем при использовании одного эстрогена (3,1 % против 0,9%), но плотность груди незначительно ниже, чем при комбинации эстрогена и циклического или непрерывного медроксипрогестерона ацетата (3,1% против 4,4–4,6%). Более высокая плотность груди является сильным известным фактором риска рака груди. Однако другие исследования дали неоднозначные результаты. В систематическом обзоре 2018 года сообщалось, что плотность груди при приеме эстрогена плюс пероральный прогестерон была значительно увеличена в трех исследованиях и не изменилась в двух исследованиях. Изменения плотности груди при приеме прогестерона, по-видимому, меньше, чем при использовании сравниваемых прогестинов.
В крупных краткосрочных наблюдательных исследованиях использование только эстрогена и комбинации эстрогена и перорального прогестерона обычно не проводилось. связано с повышенным риском рака груди. И наоборот, комбинация эстрогена и почти любого прогестина, такого как ацетат медроксипрогестерона или норэтистерона ацетат, была связана с повышенным риском рака груди. Единственным исключением среди прогестинов является дидрогестерон, который показал сходный риск с пероральным прогестероном. Риск рака груди при терапии эстрогенами и прогестинами зависит от продолжительности, при этом риск значительно выше при воздействии более 5 лет по сравнению с менее чем 5 годами. В отличие от краткосрочных исследований, более долгосрочные наблюдения (>5 лет) французского исследования E3N показали значительную связь как эстрогена плюс пероральный прогестерон, так и эстрогена плюс дидрогестерон с более высоким риском рака груди, как и эстроген плюс другие прогестагены. Пероральный прогестерон имеет очень низкую биодоступность и относительно слабые прогестагенные эффекты. Отсроченное начало риска рака груди при приеме эстрогена в сочетании с пероральным прогестероном потенциально согласуется со слабым пролиферативным эффектом перорального прогестерона на груди. Таким образом, для заметного увеличения риска рака груди может потребоваться более продолжительное воздействие. В любом случае риск остается ниже, чем у большинства прогестинов. Систематический обзор прогестерона и рака груди 2018 г. пришел к выводу, что краткосрочное употребление (<5 years) of an estrogen plus progesterone is not associated with a significant increase in risk of breast cancer but that long-term use (>5 лет) связано с повышенным риском. Выводы для прогестерона были такими же, как и в метаанализе всемирного эпидемиологического 2019 года, проведенном Совместной группой по гормональным факторам при раке молочной железы (CGHFBC).
Большинство данных об изменениях плотности груди и риске рака груди получены при пероральном приеме прогестерона. Данных о безопасности груди при вагинальном применении прогестерона немного. Сравнение раннего и позднего вмешательства с эстрадиолом (ELITE) было рандомизированным контролируемым исследованием с участием около 650 женщин в постменопаузе, которые принимали эстрадиол и циклический вагинальный прогестерон в дозе 45 мг / день. Сообщалось о возникновении рака груди как о побочном эффекте. Абсолютная частота составила 10 случаев в группе эстрадиола плюс вагинальный прогестерон и 8 случаев в контрольной группе . Однако это исследование не имело достаточной мощности для количественной оценки риска рака груди.
| Терапия | <5 years | 5–14 лет | 15+ лет | |||
|---|---|---|---|---|---|---|
| Случаи | RR (95% CI ) | Случаи | RR (95% CI ) | Случаи | RR (95% CI ) | |
| Только эстроген | 1259 | 1,18 (1,10–1,26) | 4869 | 1,33 (1,28–1,37) | 2183 | 1,58 (1,51–1,67) |
| По эстрогену | ||||||
| Конъюгированные эстрогены | 481 | 1,22 (1,09–1,35) | 1910 | 1,32 (1,25–1,39) | 1179 | 1,68 (1,57–1,80) |
| Эстрадиол | 346 | 1,20 (1,05–1,36) | 1580 | 1,38 (1,30–1,46) | 435 | 1,78 (1,58–1,99) |
| Эстропипат (сульфат эстрона) | 9 | 1,45 (0,67–3,15) | 50 | 1,09 (0,79–1,51) | 28 | 1,53 (1,01–2,33) |
| Эстриол | 15 | 1,21 (0,68–2,14) | 44 | 1,24 (0,89–1,73) | 9 | 1,41 (0,67–2,93) |
| Другие эстрогены | 15 | 0,98 (0,46–2,09) | 21 | 0,98 (0,58–1,66) | 5 | 0,77 (0,27–2,21) |
| Автор путь | ||||||
| перорально эстрогены | – | – | 3633 | 1,33 (1,27–1,38) | – | – |
| трансдермальные эстрогены | – | – | 919 | 1,35 (1,25–1,46) | – | – |
| вагинальные эстрогены | – | – | 437 | 1,09 (0,97–1,23) | – | – |
| эстроген и прогестагены | 2419 | 1,58 (1,51–1,67) | 8319 | 2,08 (2,02–2,15) | 1424 | 2,51 (2,34–2,68) |
| По прогестагену | ||||||
| (Лево) норгестрел | 343 | 1,70 (1,49–1,94) | 1735 | 2,12 (1,99–2,25) | 219 | 2,69 (2,27–3,18) |
| норэтистерона ацетат | 650 | 1,61 (1,46–1,77) | 2642 | 2,20 (2,09–2,32) | 420 | 2,97 (2,60–3,39) |
| Медроксипрогестерон ацетат | 714 | 1,64 (1,50–1,79) | 2012 | 2,07 (1,96–2,19) | 411 | 2,71 (2.39–3.07) |
| Дидрогестерон | 65 | 1,21 (0,90–1,61) | 162 | 1,41 (1,17–1,71) | 26 | 2,23 (1,32–3,76) |
| Прогестерон | 11 | 0,91 (0,47–1,78) | 38 | 2,05 (1,38– 3,06) | 1 | – |
| Промегестон | 12 | 1,68 (0,85–3,31) | 19 | 2,06 (1,19–3,56) | 0 | – |
| Номегестрола ацетат | 8 | 1,60 (0,70–3,64) | 14 | 1,38 (0,75–2,53) | 0 | – |
| Другие гестагены | 12 | 1,70 (0,86–3,38) | 19 | 1,79 (1,05–3,05) | 0 | – |
| По частоте прогестагена | ||||||
| Непрерывный | – | – | 3948 | 2,30 (2,21–2,40) | – | – |
| Прерывистый | – | – | 3467 | 1,93 (1,84–2,01) | – | – |
| Только прогестаген | 98 | 1,37 (1,08–1,74) | 107 | 1,39 (1,11–1,75) | 30 | 2,10 (1,35–3,27) |
| По прогестагену | ||||||
| Медроксипрогестерона ацетат | 28 | 1,68 (1,06–2,66) | 18 | 1,16 (0,68–1,98) | 7 | 3,42 (1,26 –9.30) |
| Норэтистерона ацетат | 13 | 1,58 (0,77–3,24) | 24 | 1,55 (0,88–2,74) | 6 | 3,33 (0,81– 13,8) |
| Дидрогестерон | 3 | 2,30 (0,49–10,9) | 11 | 3,31 (1,39–7,84) | 0 | – |
| Другое прогестагены | 8 | 2,83 (1,04–7,68) | 5 | 1,47 (0,47–4,56) | 1 | – |
| Разное | ||||||
| Тиболон | – | – | 680 | 1,57 (1,43–1,72) | – | – |
| Примечания: Мета-анализ всемирных эпидемиологических данных о менопаузальной гормональной терапии и риске рака груди, проведенный Совместной группой по гормональным факторам при раке молочной железы (CGHFBC). Полностью скорректированные относительные риски для текущих и никогда не применяющих гормональную терапию в период менопаузы. Источник : см. Шаблон. |
| Исследование | Терапия | Отношение рисков (95% CI ) |
|---|---|---|
| E3N-EPIC: Fournier и др. (2005) | Только эстроген | 1,1 (0,8–1,6) |
| Эстроген плюс прогестерон. Трансдермальный эстроген. Пероральный эстроген | 0,9 ( 0,7–1,2). 0,9 (0,7–1,2). Нет событий | |
| Эстроген плюс прогестин. Трансдермальный эстроген. Пероральный эстроген | 1,4 (1,2–1,7). 1,4 (1,2–1,7). 1,5 (1,1–1,9) | |
| E3N-EPIC: Fournier et al. (2008) | Только пероральный эстроген | 1,32 (0,76–2,29) |
| Пероральный эстроген плюс прогестоген. Прогестерон. Дидрогестерон. Медрогестон. Хлормадинона ацетат. Ципротерона ацетат. Промегестон. Номегестрола ацетат. Норэтистерона ацетат. Норэтистерона ацетат <10 | . Не проанализировано. 0,77 (0,36–1,62). 2,74 (1,42–5,29). 2,02 (1,00–4,06). 2,57 (1,81–3,65). 1,62 (0,94–2,82). 1,10 (0,55–2,21). 2,11 (1,56–2,86). 1,48 (1,02–2,16) | |
| Только трансдермальный эстроген | 1,28 (0,98–1,69) | |
| Трансдермальный эстроген плюс прогестаген. Прогестерон. Дидрогестерон. Медрогестон. Хлормадинона ацетат. Ципротерона ацетат. Промегестон. Номегестрола ацетат. Норэтистерона ацетат. Медроксипрогестерона ацетат | . 1,08 (0,89–1,31). 1,18 (0,95–1,48 (0,95–1,4)). 2,03 (1,39–2,97). 1,48 (1,05–2,09). Не анализировалось. 1,52 (1,19–1,96). 1,60 (1,28–2,01). Не анализировалось. Не проанализировано | |
| E3N-EPIC: Fournier et al. (2014) | Только эстроген | 1,17 (0,99–1,38) |
| Эстроген плюс прогестерон или дидрогестерон | 1,22 (1,11–1,35) | |
| Эстроген плюс прогестин | 1,87 (1,71–2,04) | |
| CECILE: Cordina-Duverger et al. (2013) | Только эстроген | 1,19 (0,69–2,04) |
| Эстроген плюс прогестаген. Прогестерон. Прогестины. Производные прогестерона. Производные тестостерона | 1,33 (0,92–1,92). 0,80 (0,44–1,43). 1,72 (1,11–2,65). 1,57 (0,99–2,49). 3,35 (1,07–10,4) | |
| Сноски: = Не проанализировано, менее 5 случаев. Источники : см. Шаблон. |
| Исследование | Терапия | Отношение рисков (95% CI ) |
|---|---|---|
| E3N-EPIC: Fournier et al. (2005) | Трансдермальный эстроген плюс прогестерон. <2 years. 2–4 года. ≥4 года | . 0,9 (0,6–1,4). 0,7 (0,4–1,2). 1,2 (0,7–2,0) |
| Трансдермальный эстроген плюс прогестин. <2 years. 2–4 года. ≥4 года | . 1,6 (1,3–2,0). 1,4 (1,0–1,8). 1,2 (0,8–1,7) | |
| пероральный эстроген плюс прогестин. <2 years. 2–4 года. ≥4 года | . 1,2 (0,9–1,8). 1,6 (1,1–2,3). 1,9 (1,2–3,2) | |
| E3N-EPIC: Fournier et al.. (2008) | Эстроген плюс прогестерон. <2 years. 2–4 года. 4–6 лет. ≥6 лет | . 0,71 (0,44–1,14). 0,95 (0,67–1,36). 1,26 (0,87–1,82). 1,22 (0,89–1,67) |
| Эстроген плюс дидрогестерон. <2 years. 2–4 года. 4–6 лет. ≥6 лет | . 0,84 (0,51–1,38). 1,16 (0,79–1,71). 1,28 (0,83–1,99). 1,32 (0,93–1,86) | |
| Эстроген плюс другие прогестагены. <2 years. 2–4 года. 4–6 лет. ≥6 лет | . 1,36 (1,07–1,72). 1,59 (1,30–1,94). 1,79 (1,44–2,23). 1,95 (1,62–2,35) | |
| E3N-EPIC: Fournier et al. (2014) | Эстрогены плюс прогестерон или дидрогестерон. <5 years. ≥5 лет | . 1,13 (0,99–1,29). 1,31 (1,15–1,48) |
| Эстроген плюс другие прогестагены. <5 years. ≥5 лет | . 1,70 (1,50–1,91). 2,02 (1,81–2,26) | |
| Сноски: = пероральный эстроген плюс прогестерон не анализировался, так как было небольшое количество женщин, которые использовал эту терапию. Источники : см. Шаблон. |
Сгустки крови
В то время как комбинация эстрогена и прогестина связана с повышенным риском венозной тромбоэмболии (ВТЭ) по сравнению с одним эстрогеном, нет никакой разницы в риске ВТЭ с комбинация эстрогена и перорального прогестерона по сравнению с одним эстрогеном. Следовательно, в отличие от прогестинов, пероральный прогестерон, добавленный к эстрогену, по-видимому, не увеличивает коагуляцию или риск ВТЭ. Причина различий между прогестероном и прогестинами с точки зрения риска ВТЭ неясна. Однако они могут быть связаны с очень низким уровнем прогестерона и относительно слабым прогестагенным действием, вызываемым пероральным прогестероном. В отличие от перорального прогестерона, прогестерон непероральный, который может достичь гораздо более высоких уровней прогестерона, не оценивался с точки зрения риска ВТЭ.
Передозировка
Прогестерон, вероятно, будет относительно безопасным при передозировка. Уровень прогестерона во время беременности до 100 раз выше, чем во время нормального менструального цикла, хотя уровень прогестерона постепенно увеличивается в течение беременности. Пероральные дозы прогестерона, достигающие 3600 мг / день, были оценены в ходе клинических испытаний, при этом основным побочным эффектом был седативный эффект. Имеется отчет о злоупотреблении прогестероном при пероральной дозировке 6400 мг в день. Введение 500 мг прогестерона путем внутривенной инфузии людям не сопровождалось токсичностью, но действительно вызывало глубокий сон, хотя люди все еще могли просыпаться при достаточной стимуляции.
Взаимодействия
Существует несколько примечательных лекарственных взаимодействий с прогестероном. Некоторые селективные ингибиторы обратного захвата серотонина (СИОЗС), такие как флуоксетин, пароксетин и сертралин, могут увеличивать ГАМК A рецепторные центральные депрессантные эффекты прогестерона за счет усиления его превращения в 5α-дигидропрогестерон и аллопрегнанолон посредством активации 3α-HSD. Прогестерон усиливает седативное действие бензодиазепинов и алкоголя. Примечательно, что имеется сообщение о случаях злоупотребления прогестероном одним только очень высокими дозами. Ингибиторы 5α-редуктазы, такие как финастерид и дутастерид подавляет превращение прогестерона в ингибирующий нейростероид аллопрегнанолон и по этой причине может иметь потенциал для уменьшения седативного и связанных эффектов прогестерона.
Прогестерон является слабым, но значимым агонистом рецептора прегнана X (PXR), и было обнаружено, что он индуцирует несколько ферментов цитохрома P450 в печени, таких как CYP3A4, особенно при высоких концентрациях, например, при уровне беременности. Таким образом, прогестерон может ускорять метаболизм различных лекарств.
Фармакология
Фармакодинамика
Прогестерон является прогестагеном или агонистом ядерных рецепторов прогестерона (PR), PR-A, PR-B и PR-C. Кроме того, прогестерон является агонистом мембранных рецепторов прогестерона (mPRs), включая mPRα, mPRβ, mPRγ, mPRδ и mPRϵ. Помимо PR и mPR, прогестерон является мощным антиминералокортикоидным или антагонистом минералокортикоидного рецептора, биологической мишенью минералокортикоид альдостерон. Прогестерон не только стероидный гормон, но и нейростероид. Среди других нейростероидных активностей, а также через свои активные метаболиты аллопрегнанолон и прегнанолон, прогестерон является мощным положительным аллостерическим модулятором ГАМК А рецептор, главный сигнальный рецептор ингибирующего нейромедиатора γ-аминомасляной кислоты (ГАМК).
PR широко выражены по всему телу, в том числе в матке, шейке матки, влагалище, фаллопиевых трубах, грудь, жир, кожа, гипофиз, гипоталамус и другие области мозга. Соответственно, прогестерон оказывает на организм множество эффектов. Среди других эффектов прогестерон вызывает изменения в женской репродуктивной системе, груди и мозге. Прогестерон обладает функциональным антиэстрогенным действием благодаря своей прогестагенной активности, в том числе в отношении матки, шейки матки и влагалища. Воздействие прогестерона может влиять на здоровье как положительно, так и отрицательно. В дополнение к вышеупомянутым эффектам, прогестерон обладает антигонадотропным действием из-за своей прогестагенной активности и может подавлять овуляцию и подавлять гонад половой гормон
Активность прогестерона, помимо активности, опосредованной PR и mPR, также имеет значение. Прогестерон снижает артериальное давление и снижает задержку воды и соли среди других эффектов за счет своей антиминералокортикоидной активности. Кроме того, прогестерон может вызывать седативное, снотворное, анксиолитическое, эйфорическое, когнитивное-, эффекты памяти — и двигательные, противосудорожные и даже анестезирующие за счет образования достаточно высоких концентраций его нейростероидных метаболитов и, как следствие, ГАМК A потенцирование рецептора в головном мозге.
Существуют различия между прогестероном и прогестинами, такими как медроксипрогестерона ацетат и норэтистерон, с последствиями для фармакодинамики и фармакокинетики, а также в отношении эффективности, переносимости и безопасности.
Фармакокинетика
Фармакокинетика прогестерона зависит от его пути введения. Лекарства одобрены в форме заполненных маслом капсул, содержащих микронизированный прогестерон для перорального введения, называемых пероральным микронизированным прогестероном или OMP. Он также доступен в форме вагинальных или ректальных суппозиториев или пессариев, кремов и гелей для местного применения, масляных растворов для внутримышечных инъекций, и водные растворы для подкожной инъекции.
Пути введения, в которых использовался прогестерон, включают пероральный, интраназальный, трансдермальный / местный, вагинальный, ректальный, внутримышечный, подкожный и внутривенный впрыск. Вагинальный прогестерон выпускается в форме капсул с прогестероном, таблеток или вкладышей, гелей, суппозиториев или пессариев и кольца.
Химия
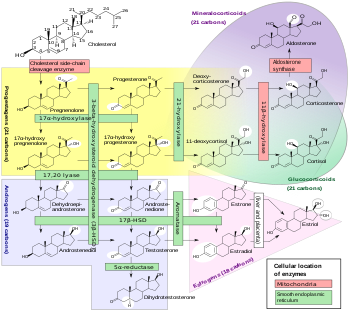
Прогестерон — это встречающийся в природе прегнан стероид, также известный как прегн-4 -ен-3,20-дион. Он имеет двойную связь (4- ен ) между положениями C4 и C5 и две кетонные группы (3,20- дион ), один в положении C3, а другой в положении C20. Прогестерон часто обозначают аббревиатурой P4 из-за его ядра прегнана и двойной связи C4 (5). Он контрастирует с прегненолоном, который имеет двойную связь C5 (6) и часто обозначается аббревиатурой P5.
Производные
Большое количество прогестинов или синтетических прогестагенов было получено из прогестерона. Их можно разделить на несколько структурных групп, включая производные ретропрогестерона, 17α-гидроксипрогестерона, 17α-метилпрогестерона и 19-норпрогестерона, с соответствующим примером из каждой группы, включая дидрогестерон, медроксипрогестерона ацетат, медрогестон и промегестон. простые эфиры прогестерона квингестрон (3-циклопентиленоловый эфир прогестерона) и 3-ацетиленоловый эфир прогестерона являются единственными примерами, которые не относятся ни к одному из этих группы. Другая основная группа прогестинов, производные 19-нортестостерона, примером которых являются норэтистерон (норэтиндрон) и левоноргестрел, являются производными не прогестерона, а скорее тестостерон.
Различные синтетические ингибирующие нейростероиды были получены из прогестерона и его метаболитов нейростероидов, аллопрегнанолона и прегнанолона. Примеры включают альфадолон, альфаксолон, ганаксолон, гидроксидион, минаксолон и ренанолон.. Кроме того, C3 и C20 конъюгаты прогестерона, такие как карбоксиметилоксим прогестерона (прогестерон-3- (O-карбоксиметил) оксим; P4-3-CMO), P1-185 (прогестерон 3-O- (L -валин) -E-оксим), EIDD-1723 (прогестерон 20E- [O — [(фосфоноокси) метил] оксим] натриевая соль), EIDD-036 (прогестерон 20-оксим; P4-20-O) и VOLT-02 (химическая структура без выделения), были разработаны как вода -растворимые пролекарства прогестерона и его нейростероидных метаболитов.
Синтез
Химический синтез прогестерона опубликован.
История
Открытие и синтез
Гормональное действие прогестерона было обнаружено в 1929 году. Чистый кристаллический прогестерон был выделен в 1934 году и была определена его химическая структура. Позже в том же году химический синтез прогестерона был завершен. Вскоре после своего химического синтеза прогестерон начал клинически испытываться на женщинах.
Инъекции и имплантаты
В 1933 или 1934 годах Шеринг ввел прогестерон в масляный раствор в качестве лекарства путем внутримышечной инъекции под торговой маркой Proluton. Это была первая фармацевтическая композиция прогестерона, поступившая на рынок для медицинского применения. Первоначально это был экстракт желтого тела, который только впоследствии стал чистым синтезированным прогестероном. Клиническое исследование состава было опубликовано в 1933 году. К 1936 году были доступны несколько составов прогестерона в масляном растворе для внутримышечной инъекции под торговыми марками Пролутон, Прогестин и Гестон. Парентеральный путь использовался, поскольку пероральный прогестерон имел очень низкую активность и считался неактивным. Прогестерон изначально был очень дорогим из-за требуемых больших доз. Однако с началом производства стероидов из диосгенина в 1940-х годах стоимость значительно снизилась.
Подкожные гранулированные имплантаты прогестерона впервые были изучены на женщинах в конце 1930-х годов. Это были первые препараты прогестагена длительного действия. Сообщалось, что гранулы вытесняются из кожи в течение нескольких недель с высокой скоростью, даже при имплантации под глубокой фасцией, а также вызывали частые воспалительные реакции в месте имплантации. Кроме того, они всасывались слишком медленно и достигли неудовлетворительно низкого уровня прогестерона. Следовательно, от них вскоре отказались в пользу других препаратов, таких как водные суспензии. Однако подкожные гранулированные имплантаты прогестерона позже изучались как форма контроля рождаемости у женщин в 1980-х и начале 1990-х годов, хотя в конечном итоге никаких препаратов на рынок не поступало.
Водные суспензии кристаллов прогестерона для внутримышечная инъекция была впервые описана в 1944 году. Эти препараты поступали на рынок в 1950-х годах под различными торговыми марками, включая флаволутан, лютеозан, лютоциклин М и лютрен, среди других. Водные суспензии стероидов были разработаны, потому что они показали гораздо более длительную продолжительность, чем внутримышечные инъекции стероидов в масляном растворе. Однако местные реакции в месте инъекции, которые не возникают с масляными растворами, ограничивают клиническое использование водных суспензий прогестерона и других стероидов. Сегодня препарат под торговой маркой Agolutin Depot остается на рынке Чехии и Словакии. Комбинированный препарат прогестерона, бензоата эстрадиола и лидокаина также остается доступным под торговой маркой Clinomin Forte в Парагвае. В дополнение к водным суспензиям, к 1949 г. были изучены эмульсии вода в масле стероидов, и были введены эмульсии прогестерона длительного действия для внутримышечных инъекций под торговыми марками Progestin. и ди-про-эмульсия (с бензоатом эстрадиола ) к 1950-м годам. Из-за отсутствия стандартизации размеров кристаллов кристаллические суспензии стероидов имели заметные различия в эффекте. Эмульсии были еще более ненадежными.
Макрокристаллические водные суспензии прогестерона, а также микросферы прогестерона были исследованы как потенциальные инъекционные контрацептивы, содержащие только прогестагены и комбинированные инъекционные контрацептивы (с эстрадиолом ) к концу 1980-х и началу 1990-х годов, но никогда не продавались.
Водные растворы нерастворимых в воде стероидов были первыми разработан путем ассоциации с коллоидом усилителями растворимости в 1940-х годах. Водный раствор прогестерона для внутривенной инъекции был продан Schering AG под торговой маркой Primolut Intravenous к 1962 году. Одним из его предполагаемых применений было лечение угрозы прерывания беременности., в котором желателен быстродействующий эффект. Водный раствор прогестерона в комплексе с циклодекстрином для увеличения его растворимости в воде был введен для использования с помощью подкожной инъекции один раз в день в Европе под торговой маркой Prolutex в середина 2010-х.
В 1950-е годы парентеральные прогестины длительного действия, такие как гидроксипрогестерона капроат, медроксипрогестерона ацетат и норэтистерон энантат были разработаны и внедрены для внутримышечной инъекции. У них не было необходимости в частых инъекциях и реакциях в месте инъекции, связанных с прогестероном при внутримышечной инъекции, и вскоре они вытеснили прогестерон для парентеральной терапии в большинстве случаев.
Пероральный и сублингвальный
Первое исследование перорального прогестерона у людей была опубликована в 1949 году. Было обнаружено, что пероральный прогестерон оказывает значительное прогестационное действие на эндометрий у женщин. До этого исследования исследования на животных показали, что пероральный прогестерон неактивен, и по этой причине пероральный прогестерон никогда не оценивался на людях. Множество других ранних исследований орального прогестерона у людей были также опубликованы в 1950-х и 1960-х годах. В этих исследованиях обычно сообщалось, что пероральный прогестерон очень слабо активен. Пероральный немикронизированный прогестерон был представлен в качестве фармацевтического препарата примерно в 1953 году, например, как циклогестерин (1 мг эстрогенных веществ и 30 мг прогестерона таблетки ) для нарушений менструального цикла автор Апджон, хотя он имел ограниченное применение. Другим препаратом, который содержал только прогестерон, был Синдерон (товарный знак, зарегистрированный Chemical Specialties в 1952 году).
Сублингвальный прогестерон у женщин был впервые изучен в 1944 году Робертом Гринблаттом. Буккальные таблетки прогестерона продавались компанией Schering под торговой маркой Proluton Buccal Tablets к 1949 году. Сублингвальные таблетки прогестерона продавались под торговыми марками Progesterone Lingusorbs и Progesterone Membrettes к 1951 году. Сублингвальная таблетка прогестерона была одобрена в торговая марка Luteina в Польше и Украине и остается на рынке сегодня.
Прогестерон был первым прогестагеном, который, как было обнаружено, подавлял овуляцию как у животных, так и у женщин. Впервые было показано, что инъекции прогестерона подавляют овуляцию у животных между 1937 и 1939 годами. Ингибирование оплодотворения введением прогестерона во время лютеиновой фазы также было продемонстрировано у животных в период между 1947 и 1949 годами. Овуляция ингибирование прогестероном у животных было впоследствии повторно подтверждено и расширено Грегори Пинкус и его коллегами в 1953 и 1954 годах. Результаты ингибирования овуляции прогестероном у женщин были впервые представлены на Пятой Международной конференции по проблемам Планируемое отцовство в Токио, Япония в октябре 1955 года. Три разные исследовательские группы представили свои выводы по этой теме на конференции. Среди них были Пинкус (вместе с Джоном Роком, который не присутствовал на конференции); группа из девяти человек японцев во главе с Масаоми Исикава; и команда из двух человек — Абрахама Стоуна и Герберта Куппермана. Конференция ознаменовала начало новой эры в истории контроля рождаемости. Результаты были впоследствии опубликованы в научных журналах в 1956 г. в случае Пинкуса и в 1957 г. в случае Исикавы и его коллег. Рок и Пинкус также впоследствии описали результаты 1952 года о том, что терапия «псевдобеременностью » комбинацией высоких доз диэтилстильбестрола и перорального прогестерона предотвращала овуляцию и беременность у женщин.
К сожалению, использование прогестерона внутрь в качестве гормонального контрацептива было сопряжено с проблемами. К ним относятся требуемые большие и, соответственно, дорогие дозы, неполное подавление овуляции даже при высоких дозах и частые случаи прорывных кровотечений. На конференции 1955 года в Токио Пинкус также представил первые результаты ингибирования овуляции у животных пероральными прогестинами, в частности производными 19-нортестостерона, такими как норетинодрел и норэтистерон. Эти прогестины были гораздо более сильнодействующими, чем прогестерон, поэтому для их приема внутрь требовались гораздо меньшие дозы. К декабрю 1955 г. у женщин было продемонстрировано подавление овуляции пероральным приемом норэтинодрела и норэтистерона. Эти данные, а также результаты на животных были опубликованы в 1956 году. Норетинодрел и норэтистерон не выявили проблем, связанных с пероральным приемом прогестерона — в исследованиях они полностью подавляли овуляцию и не вызывали побочных эффектов, связанных с менструацией. Следовательно, от перорального приема прогестерона в качестве гормонального контрацептива у женщин отказались. Первыми противозачаточными таблетками, которые были введены на рынок, были препарат, содержащий норэтинодрел, в 1957 году и препарат, содержащий норэтистерон, в 1963 году, за которыми последовало множество других, содержащих различные прогестины. Сам прогестерон никогда не использовался в противозачаточных таблетках.
Более современные клинические исследования орального прогестерона, демонстрирующие повышенный уровень прогестерона и реакции органов-мишеней у женщин, особенно гестагенные изменения эндометрия, были опубликованы между 1980 и 1983 годами. До этого момента многие клиницисты и исследователи, по-видимому, все еще считали, что пероральный прогестерон неактивен. Лишь спустя почти полвека после введения прогестерона в медицину на рынке появилась достаточно эффективная пероральная форма прогестерона. Микронизация прогестерона и суспензии в маслонаполненных капсулах, что позволило прогестерону всасываться в несколько раз. -разложить более эффективно при пероральном введении, впервые был изучен в конце 1970-х и описан в литературе в 1982 году. Этот препарат, известный как микронизированный прогестерон (ОМП) для приема внутрь, затем был представлен для медицинского применения под торговой маркой Utrogestan во Франции в 1982 году. Впоследствии микронизированный прогестерон для перорального приема был представлен под торговой маркой Prometrium в США в 1998 г. К 1999 г. микронизированный прогестерон для перорального приема был продан более чем в 35 странах. В 2019 году первая комбинация перорального эстрадиола и прогестерона была представлена в Соединенных Штатах под торговой маркой Bijuva.
A Препарат с замедленным высвобождением (SR) перорального микронизированного прогестерона, также известного как «пероральный микронизированный прогестерон естественного действия с устойчивым действием». релиз »или« устный NMP SR », продавался в Индии в 2012 году под торговой маркой Gestofit SR. Затем последовали многие другие торговые марки. Первоначально препарат был разработан в 1986 г. аптекой под названием Madison Pharmacy Associates в Мэдисоне, Висконсин в США.
Вагинальный, ректальный и маточные
Вагинальные суппозитории с прогестероном были впервые исследованы на женщинах Робертом Гринблаттом в 1954 году. Вскоре после этого в 1955 году для медицинского применения были введены вагинальные суппозитории с прогестероном под торговой маркой Colprosterone. Ректальные суппозитории с прогестероном были впервые изучены на мужчинах и женщин — Christian Hamburger в 1965 году. Вагинальные и ректальные суппозитории с прогестероном были введены для использования под торговой маркой Cyclogest к 1976 году. Вагинальные микронизированные гели и капсулы с прогестероном были представлены для медицинского применения под торговыми марками, такими как Utrogestan и Crinone, в начале 1990-х. Прогестерон был одобрен в США как вагинальный гель в 1997 году и как вагинальный вкладыш в 2007 году. Противозачаточное вагинальное кольцо прогестерона, известное как прогеринг, было впервые изучено на женщинах в 1985 году и продолжало исследоваться в течение 1990-х годов. Он был одобрен для использования в качестве противозачаточного средства у кормящих матерей в Латинской Америке к 2004 году. Второе вагинальное кольцо с прогестероном, известное как Fertiring, было разработано в качестве добавки с прогестероном для использования во время вспомогательной репродукции и было одобрено в Латинской Америке к 2007 году..
Разработка прогестерон-содержащей внутриматочной спирали (ВМС) для контрацепции началась в 1960-х годах. Первоначально изучали включение прогестерона в ВМС, чтобы помочь снизить риск изгнания ВМС. Однако, хотя добавление прогестерона к ВМС не показало положительного влияния на частоту изгнания, неожиданно было обнаружено, что он вызывает атрофию эндометрия. Это привело в 1976 году к разработке и внедрению Прогестасерта, продукта, содержащего прогестерон, и первой ВМС, содержащей прогестаген. К сожалению, у продукта были различные проблемы, которые ограничивали его использование. К ним относятся короткая продолжительность эффективности, составляющая всего один год, высокая стоимость, относительно высокая частота неудач в 2,9%, отсутствие защиты от внематочной беременности, а также сложные и иногда болезненные вставки, которые могут потребовать использования местный анестетик или анальгетик. В результате этих проблем Прогестасерт так и не получил широкого распространения и был прекращен в 2001 году. Пока он продавался, он использовался в основном в США и Франции.
Трансдермальный и местный
A Гелевый состав прогестерона для местного применения для непосредственного нанесения на грудь в качестве местной терапии заболеваний груди, таких как боль в груди, был представлен в Европе под торговой маркой Progestogel к 1972 году. Нет трансдермальных составов прогестерона для системного применения. успешно продаются, несмотря на усилия фармацевтических компаний в достижении этой цели. Низкая эффективность трансдермального прогестерона до сих пор исключала такую возможность. Хотя ни один из составов трансдермального прогестерона не одобрен для системного применения, трансдермальный прогестерон доступен в форме кремов и гелей в специализированных аптеках в некоторых странах, и также продается без рецепта без рецепта в США. Однако эти препараты не регулируются и не были должным образом охарактеризованы, с низкой и необоснованной эффективностью.
Общество и культура
Общие названия
Прогестерон — это генерическое название препарата на английском языке и его INN, США, USP, BAN, DCIT и JAN, в то время как прогестерон — это его название на французском и его DCF. Он также называется прогестероном на латинском, прогестерон на испанском и португальском и прогестерон на немецком.
Торговые марки
Прогестерон продается под большим количеством торговых марок во всем мире. Примеры основных торговых марок, под которыми продается прогестерон, включают Crinone, Crinone 8%, Cyclogest, Endogest, Endometrin, Estima, Geslutin, Gesterol, Gestone, Luteina, Luteinol, Lutigest, Lutinus, Microgest, Progeffik, Progelan, Progendo, Progering, Progest, Progestaject, Progestan, Progesterone, Progestin, Progestogel, Prolutex, Proluton, Prometrium, Prontogest, Strone, Susten, Utrogest и Utrogestan.
Доступность
Прогестерон широко доступен в странах по всей Европе. мир во множестве составов. Прогестерон в форме оральных капсул; вагинальные капсулы, таблетки / вкладыши и гели; и внутримышечное масло широко доступны. Следующие составы / способы введения прогестерона имеют избирательную или более ограниченную доступность:
- A таблетка микронизированного прогестерона, которая продается под торговой маркой Luteina, показана для сублингвального введения в дополнение к вагинальному введению и доступен в Польше и Украине.
- Прогестероновые суппозитории, которые продаются под торговой маркой Cyclogest, показаны для ректального введения в дополнение к вагинальному введению и доступен в Кипре, Гонконге, Индии, Малайзии, Мальте, Омане, Сингапур, Южная Африка, Таиланд, Тунис, Турция, Соединенное Королевство и Вьетнам.
- водный раствор прогестерона в комплексе с β-циклодекстрином для подкожной инъекции продается под торговой маркой Prolutex в Чехии. Республика, Венгрия, Италия, Польша, Португалия, Словакия, Испания и Швейцария.
- Несистемный местный гель состав прогестерона для местного нанесения на грудь для лечения боли в груди продается под торговой маркой Progestogel и доступен в Бельгии, Болгария, Колумбия, Эквадор, Франция, Грузия, Германия, Гонконг, Ливан, Перу, Румыния, Россия, Сербия, Швейцария, Тунис, Венесуэла и Вьетнам. Ранее он также был доступен в Италии, Португалии и Испании, но был прекращен в этих странах.
- Прогестерон внутриутробно устройство ранее продавалось под торговой маркой Progestasert и было доступно в Канаде, Франции, США и, возможно, в других странах, но было снято с производства.
- Прогестерон вагинальные кольца продаются под торговыми марками Fertiring и Progering и доступны в Чили, Эквадоре и Перу..
- A таблетированная форма с замедленным высвобождением перорального микронизированного прогестерона (также известного как «пероральный натуральный микронизированный прогестерон с замедленным высвобождением» или «пероральный NMP SR») продается в Индии под торговыми марками Dubagest SR., Gestofit SR и Susten SR, среди многих других.
В дополнение к составам с одним лекарственным средством, следующие комбинированные составы прогестерона продаются или продавались, хотя и с ограниченной доступностью:
- A Комбинированная упаковка капсул с прогестероном для перорального применения и геля эстрадиола для трансдермального применения продается под торговой маркой Estrogel Propak в Канаде.
- Продается комбинированная упаковка капсул с прогестероном и таблеток эстрадиола для перорального применения. под торговой маркой Duogestan в Бельгии.
- Прогестерон и эстрадиол в водной суспензии для внутримышечной инъекции продается под торговой маркой Cristerona FP в Аргентина.
- Прогестерон и эстрадиол в микросферах в масляном растворе для внутримышечной инъекции продается под торговой маркой Juvenum в Мексике.
- Прогестерон и бензоат эстрадиола в масляном растворе для внутримышечной инъекции продается под торговыми марками Duogynon, Duoton Fort TP, Emmenovis, Gestrygen, Lutofolone, Menovis, Mestrolar, Metrigen Fuerte, Nomestrol, Phenokinon-F, Prodiol, Pro- Эстрамон-С, Прогер F, Прогестедиол и Вермагест и есть в наличии. ble in Белиз, Египет, Сальвадор, Эфиопия, Гватемала, Гондурас, Италия, Ливан, Малайзия, Мексика, Никарагуа, Тайвань, Таиланд и Турция.
- Прогестерон и гемисукцинат эстрадиола в масляном растворе для внутримышечных инъекций продается под торговой маркой Hosterona в Аргентине.
- Прогестерон и эстрон для внутримышечной инъекции продается под торговой маркой Synergon в Монако.
США
По состоянию на ноябрь 2016 года прогестерон доступен в United States Состояния в следующих составах:
- Пероральный: Капсулы: Прометриум (100 мг, 200 мг, 300 мг)
- Вагинальный: Таблетки: Эндометрин (100 мг); Гели: Crinone (4%, 8%)
- Внутримышечная инъекция: Масло: Прогестерон (50 мг / мл)
Концентрация прогестеронового масла 25 мг / мл для внутримышечной инъекции и прогестерона 38 мг / устройство производство внутриматочной спирали (Прогестасерт) прекращено.
Пероральный комбинированный препарат микронизированного прогестерона и эстрадиола в маслонаполненных капсулах (торговая марка Bijuva) продается в Соединенных Штатах для лечения симптомов менопаузы и гиперплазии эндометрия.
Прогестерон также доступен в нерегулируемых индивидуальных препаратах в аптеках в Соединенных Штатах. Кроме того, трансдермальный прогестерон доступен без рецепта в Соединенных Штатах, хотя клиническая эффективность трансдермального прогестерона спорна.
Исследования
Прогестерон изучался как инъекционный контрацептив, содержащий только прогестагены,, но никогда не продавался. Комбинации эстрадиола и прогестерона в виде макрокристаллической водной суспензии и в виде водной суспензии микросфер изучались один раз в месяц. комбинированные инъекционные контрацептивы, но также никогда не поступали в продажу.
Прогестерон оценивался на предмет подавления полового влечения и сперматогенеза у мужчин. В одном исследовании 100 мг ректальных суппозиториев прогестерона, вводимых пять раз в день в течение 9 дней, приводили к уровню прогестерона от 5,5 до 29 нг / мл и подавляли циркулирующий тестостерон и гормона роста примерно на 50% у мужчин, но не повлияли на либидо или эректильную потенцию за этот короткий период лечения. В других исследованиях прогестерон в дозе 50 мг / день внутримышечной инъекцией в течение 10 недель у мужчин вызывал азооспермию, уменьшал размер яичек, заметно подавлял либидо и эректильную потенцию, а также приводило к минимальному объему семенной жидкости при эякуляции.
масло и вода наноэмульсия прогестерона (частицы <1 mm in diameter) using Технология мицеллярных наночастиц для трансдермального введения, известная как Progestsorb NE, разрабатывалась компанией Novavax для использования в менопаузальной гормональной терапии в 2000-х годах. производство прекращено в 2007 году, и препарат никогда не продавался.
См. также
- Эстрадиол / прогестерон
- Эстрадиолбензоат / прогестерон
- Эстрадиол гемисукцинат / прогестерон