| Multiple sclerosis | |
|---|---|
| Other names | Multiple cerebral sclerosis, multiple cerebro-spinal sclerosis, disseminated sclerosis, encephalomyelitis disseminata |
 |
|
| CD68-stained tissue shows several macrophages in the area of a demyelinated lesion caused by MS. | |
| Specialty | Neurology |
| Symptoms | Variable, including almost any neurological symptom or sign, with autonomic, visual, motor, and sensory problems being the most common.[1] |
| Usual onset | Age 20–50[2] |
| Duration | Long term[3] |
| Causes | Unknown[4] |
| Diagnostic method | Based on symptoms and medical tests[5] |
| Treatment | Disease-Modifying Therapies [6]
Physiotherapy [7] Occupational Therapy [7] |
| Frequency | 0.032% (world) |
Multiple sclerosis (MS) is the most common demyelinating disease,[8] in which the insulating covers of nerve cells in the brain and spinal cord are damaged.[3] This damage disrupts the ability of parts of the nervous system to transmit signals, resulting in a range of signs and symptoms, including physical, mental, and sometimes psychiatric problems.[1][9][10] Specific symptoms can include double vision, blindness in one eye, muscle weakness, and trouble with sensation or coordination.[3][11][12] MS takes several forms, with new symptoms either occurring in isolated attacks (relapsing forms) or building up over time (progressive forms).[13][14] In the relapsing forms of MS, between attacks, symptoms may disappear completely, although some permanent neurological problems often remain, especially as the disease advances.[14]
While the cause is unclear, the underlying mechanism is thought to be either destruction by the immune system or failure of the myelin-producing cells.[4] Proposed causes for this include genetics and environmental factors, such as viral infections.[15][9][16] MS is usually diagnosed based on the presenting signs and symptoms and the results of supporting medical tests.[5]
No cure for multiple sclerosis is known.[3] Treatments attempt to improve function after an attack and prevent new attacks.[9] Physical therapy[7] and occupational therapy[17] can help with people’s ability to function. Many people pursue alternative treatments, despite a lack of evidence of benefit.[18] The long-term outcome is difficult to predict; better outcomes are more often seen in women, those who develop the disease early in life, those with a relapsing course, and those who initially experienced few attacks.[19]
Multiple sclerosis is the most common immune-mediated disorder affecting the central nervous system.[20] Nearly one million people have MS in the United States in 2022,[21] and in 2020, about 2.8 million people were affected globally, with rates varying widely in different regions and among different populations.[22] The disease usually begins between the ages of 20 and 50 and is twice as common in women as in men.[2] MS was first described in 1868 by French neurologist Jean-Martin Charcot.[23] The name «multiple sclerosis» is short for multiple cerebro-spinal sclerosis, which refers to the numerous glial scars (or sclerae – essentially plaques or lesions) that develop on the white matter of the brain and spinal cord.[23]
Signs and symptoms[edit]
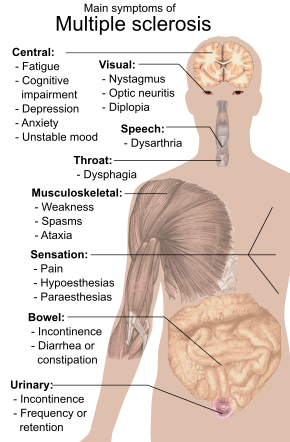
Main symptoms of multiple sclerosis
A person with MS can have almost any neurological symptom or sign, with autonomic, visual, motor, and sensory problems being the most common.[1] The specific symptoms are determined by the locations of the lesions within the nervous system, and may include loss of sensitivity or changes in sensation, such as tingling, pins and needles, or numbness; muscle weakness, blurred vision,[24] pronounced reflexes, muscle spasms, difficulty in moving, difficulties with coordination, and balance (ataxia); problems with speech or swallowing, visual problems (nystagmus, optic neuritis, or double vision), feeling tired, acute or chronic pain; and bladder and bowel difficulties (such as neurogenic bladder), among others.[1] When multiple sclerosis is more advanced, walking difficulties can occur and the risk of falling increases.[25]
Difficulties thinking and emotional problems such as depression or unstable mood are also common.[1] The primary deficit in cognitive function that people with MS experience is slowed information-processing speed, with memory also commonly affected, and executive function less commonly. Intelligence, language, and semantic memory are usually preserved, and the level of cognitive impairment varies significantly between people with MS.[26][27][28]
Uhthoff’s phenomenon, a worsening of symptoms due to exposure to higher-than-usual temperatures, and Lhermitte’s sign, an electrical sensation that runs down the back when bending the neck, are particularly characteristic of MS.[1] The main measure of disability and severity is the expanded disability status scale (EDSS), with other measures such as the multiple sclerosis functional composite being increasingly used in research.[29][30][31] EDSS is also correlated with falls in people with MS.[11] While it is a popular measure, EDSS has been criticized for some of its limitations, such as relying too much on walking.[32][11]
The condition begins in 85% of cases as a clinically isolated syndrome (CIS) over a number of days with 45% having motor or sensory problems, 20% having optic neuritis, and 10% having symptoms related to brainstem dysfunction, while the remaining 25% have more than one of the previous difficulties.[5] The course of symptoms occurs in two main patterns initially: either as episodes of sudden worsening that last a few days to months (called relapses, exacerbations, bouts, attacks, or flare-ups) followed by improvement (85% of cases) or as a gradual worsening over time without periods of recovery (10–15% of cases).[2] A combination of these two patterns may also occur[14] or people may start in a relapsing and remitting course that then becomes progressive later on.[2]
Relapses are usually not predictable, occurring without warning.[1] Exacerbations rarely occur more frequently than twice per year.[1] Some relapses, however, are preceded by common triggers and they occur more frequently during spring and summer.[33] Similarly, viral infections such as the common cold, influenza, or gastroenteritis increase their risk.[1] Stress may also trigger an attack.[34] Women with MS who become pregnant experience fewer relapses; however, during the first months after delivery the risk increases.[1] Overall, pregnancy does not seem to influence long-term disability.[1] Many events have been found not to affect relapse rates including vaccination[citation needed], breast feeding,[1] physical trauma,[35] and Uhthoff’s phenomenon.[33]
Prodromal phase[edit]
MS may have a prodromal phase in the years leading up to MS manifestation, characterized by psychiatric issues, cognitive impairment, and increased utilization of healthcare.[36][37]
Causes[edit]
The cause of MS is unknown, but it is believed to occur as a result of some combination of genetic and environmental factors, such as infectious agents.[1]
Infectious agents[edit]
Many microbes have been proposed as triggers of MS.[9] One hypothesis is that infection by a widespread microbe contributes to disease development, and the geographic distribution of this organism significantly influences the epidemiology of MS.[16] Two opposing versions of this hypothesis include the hygiene hypothesis and the prevalence hypothesis, the former being more favored.[16] The hygiene hypothesis proposes that exposure to certain infectious agents early in life is protective; the disease is a response to a late encounter with such agents.[1] The prevalence hypothesis proposes that an early, persistent, and silent infection increases risk of disease, thus the disease is more common where the infectious agent is more common. Only in a few cases and after many years does it cause demyelination.[16][38] Evidence for a virus as a cause include the presence of oligoclonal bands in the brain and cerebrospinal fluid of most people with MS, the association of several viruses with human demyelinating encephalomyelitis, and the occurrence of demyelination in animals caused by some viral infections.[39]
Epstein-Barr herpes virus (EBV) can cause infectious mononucleosis and infects about 95% of adults. In combination with other genetic and environmental factors, there is «compelling epidemiological and mechanistic evidence for a causal role of EBV in multiple sclerosis», though only a small proportion of those infected with EBV later develop MS.[40][15][41] A study of individuals in the United States military between 1993 and 2013 (total population greater than 10 million) compared 801 people who developed MS on or after military service to 1,566 matched controls who did not develop MS during this observation period. The study found a 32-fold increased risk of developing MS after infection with EBV. It did not find an increased risk after infection with other viruses, including the similarly transmitted cytomegalovirus. The finding strongly suggests that EBV plays a role in the onset of MS, although EBV alone may be insufficent to cause it.[15][41]
Genetics[edit]
HLA region of chromosome 6: Changes in this area increase the probability of getting MS.
MS is not considered a hereditary disease, but several genetic variations have been shown to increase the risk.[42] Some of these genes appear to have higher levels of expression in microglial cells than expected by chance.[43] The probability of developing the disease is higher in relatives of an affected person, with a greater risk among those more closely related.[9] An identical twin of an affected individual has a 30% chance of developing MS, 5% for a nonidentical twin, 2.5% for a sibling, and an even lower chance for a half sibling.[1][9][44] If both parents are affected, the risk in their children is 10 times that of the general population.[2] MS is also more common in some ethnic groups than others.[45]
Specific genes that have been linked with MS include differences in the human leukocyte antigen (HLA) system—a group of genes on chromosome 6 that serves as the major histocompatibility complex (MHC).[1] That differences in the HLA region are related to susceptibility has been known since the 1980s,[46] and this same region has also been implicated in the development of other autoimmune diseases, such as diabetes type I and systemic lupus erythematosus.[46] The most consistent finding is the association between multiple sclerosis and alleles of the MHC defined as DR15 and DQ6.[1] Other loci have shown a protective effect, such as HLA-C554 and HLA-DRB1*11.[1] HLA differences account for an estimated 20 to 60% of the genetic predisposition.[46] Modern genetic methods (genome-wide association studies) have revealed at least 200 variants outside the HLA locus that modestly increase the probability of MS.[47]
Geography[edit]
MS is more common in people who live farther from the equator, although exceptions exist.[1][48] These exceptions include ethnic groups that are at low risk and that live far from the equator such as the Sami, Amerindians, Canadian Hutterites, New Zealand Māori,[49] and Canada’s Inuit,[2] as well as groups that have a relatively high risk and that live closer to the equator such as Sardinians,[2] inland Sicilians,[50] Palestinians, and Parsi.[49] The cause of this geographical pattern is not clear.[2] While the north–south gradient of incidence is decreasing,[48] as of 2010 it is still present.[2]
MS is more common in regions with northern European populations,[1] so the geographic variation may simply reflect the global distribution of these high-risk populations.[2]
A relationship between season of birth and MS lends support to this idea, with fewer people born in the Northern Hemisphere in November compared to May being affected later in life.[51]
Environmental factors may play a role during childhood, with several studies finding that people who move to a different region of the world before the age of 15 acquire the new region’s risk of MS. If migration takes place after age 15, the persons retain the risk of their home country.[1][52] Some evidence indicates that the effect of moving may still apply to people older than 15.[1]
Other[edit]
Smoking may be an independent risk factor for MS.[53] Stress may be a risk factor, although the evidence to support this is weak.[52] Association with occupational exposures and toxins—mainly organic solvents[54]—has been evaluated, but no clear conclusions have been reached.[52] Vaccinations were studied as causal factors; most studies, though, show no association.[52][55] Several other possible risk factors, such as diet and hormone intake, have been evaluated, but evidence on their relation with the disease is «sparse and unpersuasive».[53] Gout occurs less than would be expected and lower levels of uric acid have been found in people with MS. This has led to the theory that uric acid is protective, although its exact importance remains unknown.[56] Obesity during adolescence and young adulthood is a risk factor for MS.[57]
Pathophysiology[edit]
The three main characteristics of MS are the formation of lesions in the central nervous system (also called plaques), inflammation, and the destruction of myelin sheaths of neurons. These features interact in a complex and not yet fully understood manner to produce the breakdown of nerve tissue, and in turn, the signs and symptoms of the disease.[1]
Cholesterol crystals are believed both to impair myelin repair and aggravate inflammation.[58][59] MS is believed to be an immune-mediated disorder that develops from an interaction of the individual’s genetics and as yet unidentified environmental causes.[9] Damage is believed to be caused, at least in part, by attack on the nervous system by a person’s own immune system.[1]
Lesions[edit]
Demyelination in MS: On Klüver-Barrera myelin staining, decoloration in the area of the lesion can be appreciated.
The name multiple sclerosis refers to the scars (sclerae – better known as plaques or lesions) that form in the nervous system. These lesions most commonly affect the white matter in the optic nerve, brain stem, basal ganglia, and spinal cord, or white matter tracts close to the lateral ventricles.[1] The function of white matter cells is to carry signals between grey matter areas, where the processing is done, and the rest of the body. The peripheral nervous system is rarely involved.[9]
To be specific, MS involves the loss of oligodendrocytes, the cells responsible for creating and maintaining a fatty layer—known as the myelin sheath—which helps the neurons carry electrical signals (action potentials).[1] This results in a thinning or complete loss of myelin, and as the disease advances, the breakdown of the axons of neurons. When the myelin is lost, a neuron can no longer effectively conduct electrical signals.[9] A repair process, called remyelination, takes place in early phases of the disease, but the oligodendrocytes are unable to completely rebuild the cell’s myelin sheath.[60] Repeated attacks lead to successively less effective remyelinations, until a scar-like plaque is built up around the damaged axons.[60] These scars are the origin of the symptoms and during an attack magnetic resonance imaging (MRI) often shows more than 10 new plaques.[1] This could indicate that some number of lesions exist, below which the brain is capable of repairing itself without producing noticeable consequences.[1] Another process involved in the creation of lesions is an abnormal increase in the number of astrocytes due to the destruction of nearby neurons.[1] A number of lesion patterns have been described.[61]
Inflammation[edit]
Apart from demyelination, the other sign of the disease is inflammation. Fitting with an immunological explanation, the inflammatory process is caused by T cells, a kind of lymphocytes that plays an important role in the body’s defenses.[9] T cells gain entry into the brain as a result of disruptions in the blood–brain barrier. The T cells recognize myelin as foreign and attack it, explaining why these cells are also called «autoreactive lymphocytes.»[1]
The attack on myelin starts inflammatory processes, which trigger other immune cells and the release of soluble factors like cytokines and antibodies. A further breakdown of the blood-brain barrier, in turn, causes a number of other damaging effects, such as swelling, activation of macrophages, and more activation of cytokines and other destructive proteins.[9] Inflammation can potentially reduce transmission of information between neurons in at least three ways.[1] The soluble factors released might stop neurotransmission by intact neurons. These factors could lead to or enhance the loss of myelin, or they may cause the axon to break down completely.[1]
Blood–brain barrier[edit]
The blood–brain barrier (BBB) is a part of the capillary system that prevents the entry of T cells into the central nervous system. It may become permeable to these types of cells secondary to an infection by a virus or bacteria. After it repairs itself, typically once the infection has cleared, T cells may remain trapped inside the brain.[9][62] Gadolinium cannot cross a normal BBB, so gadolinium-enhanced MRI is used to show BBB breakdowns.[63]
Diagnosis[edit]
Animation showing dissemination of brain lesions in time and space as demonstrated by monthly MRI studies along a year
Multiple sclerosis as seen on MRI
Multiple sclerosis is typically diagnosed based on the presenting signs and symptoms, in combination with supporting medical imaging and laboratory testing.[5] It can be difficult to confirm, especially early on, since the signs and symptoms may be similar to those of other medical problems.[1][64]
The McDonald criteria, which focus on clinical, laboratory, and radiologic evidence of lesions at different times and in different areas, is the most commonly used method of diagnosis[65] with the Schumacher and Poser criteria being of mostly historical significance.[66]
As of 2017, no single test (including biopsy) can provide a definitive diagnosis.[67]
Magnetic resonance imaging (MRI) of the brain and spine may show areas of demyelination (lesions or plaques). Gadolinium can be administered intravenously as a contrast agent to highlight active plaques, and by elimination, demonstrate the existence of historical lesions not associated with symptoms at the moment of the evaluation.[68][69]
Central vein signs (CVSs) have been proposed as a good indicator of MS in comparison with other conditions causing white lesions.[70][71][72][73] One small study found fewer CVSs in older and hypertensive people.[74] Further research on CVS as a biomarker for MS is ongoing.[75]
Brain atrophy is seen as an indicator of MS.[76][77]
Testing of cerebrospinal fluid obtained from a lumbar puncture can provide evidence of chronic inflammation in the central nervous system. The cerebrospinal fluid is tested for oligoclonal bands of IgG on electrophoresis, which are inflammation markers found in 75–85% of people with MS.[68][78]
Differential diagnosis[edit]
Several diseases present similarly to multiple sclerosis. Intractable vomiting, severe optic neuritis, or bilateral optic neuritis raises suspicion for neuromyelitis optica spectrum disorder (NMOSD).[79] Involvement of multiple cranial nerves raises suspicion for neurosarcoidosis.[79] Longitudinally extensive transverse myelitis (LETM), in which spinal cord damage spans three or more vertebral segments, raises suspicion for NMOSD, neurosarcoidosis, anti-MOG–associated myelitis, systemic rheumatologic disease, or a paraneoplastic disorder.[79]
Types and variants[edit]
Several phenotypes (commonly termed «types»), or patterns of progression, have been described. Phenotypes use the past course of the disease in an attempt to predict the future course. They are important not only for prognosis, but also for treatment decisions.
The International Advisory Committee on Clinical Trials of MS describes four types of MS (revised in 2013) in what is known as the Lublin classification:[80][81]
- Clinically isolated syndrome (CIS)
- Relapsing-remitting MS (RRMS)
- Primary progressive MS (PPMS)
- Secondary progressive MS (SPMS)
RRMS is characterized by unpredictable relapses followed by periods of months to years of relative quiet (remission) with no new signs of disease activity. Deficits that occur during attacks may either resolve or leave problems, the latter in about 40% of attacks and being more common the longer a person has had the disease.[1][5] This describes the initial course of 80% of individuals with MS.[1]
The relapsing-remitting subtype usually begins with a clinically isolated syndrome (CIS). In CIS, a person has an attack suggestive of demyelination, but does not fulfill the criteria for multiple sclerosis.[1][82] 30 to 70% of persons who experience CIS, later develop MS.[82]
PPMS occurs in roughly 10–20% of individuals with the disease, with no remission after the initial symptoms.[5][83] It is characterized by progression of disability from onset, with no, or only occasional and minor, remissions and improvements.[14] The usual age of onset for the primary progressive subtype is later than of the relapsing-remitting subtype. It is similar to the age that secondary progressive usually begins in RRMS, around 40 years of age.[1]
SPMS occurs in around 65% of those with initial RRMS, who eventually have progressive neurologic decline between acute attacks without any definite periods of remission.[1][14] Occasional relapses and minor remissions may appear.[14] The most common length of time between disease onset and conversion from RRMS to SPMS is 19 years.[84]
Special courses[edit]
Independently of the types published by the MS associations, regulatory agencies such as the FDA often consider special courses, trying to reflect some clinical trials results on their approval documents. Some examples could be «highly active MS» (HAMS),[85] «active secondary MS» (similar to the old progressive-relapsing)[86] and «rapidly progressing PPMS».[87]
Also, deficits always resolving between attacks is sometimes referred to as «benign» MS,[88] although people still build up some degree of disability in the long term.[1] On the other hand, the term malignant multiple sclerosis is used to describe people with MS having reached significant level of disability in a short period.[89]
An international panel has published a standardized definition for the course HAMS.[85]
Variants[edit]
Atypical variants of MS have been described; these include tumefactive multiple sclerosis, Balo concentric sclerosis, Schilder’s diffuse sclerosis, and Marburg multiple sclerosis. Debate remains on whether they are MS variants or different diseases.[90] Some diseases previously considered MS variants, such as Devic’s disease, are now considered outside the MS spectrum.[91]
Management[edit]
Although no cure for multiple sclerosis has been found, several therapies have proven helpful. Several effective treatments can significantly decrease the number of attacks and the rate of progression.[21] The primary aims of therapy are returning function after an attack, preventing new attacks, and preventing disability. Starting medications is generally recommended in people after the first attack when more than two lesions are seen on MRI.[92]
The first approved medications used to treat MS were modestly effective, though were poorly tolerated and had many adverse effects. [3] Several treatment options with better safety and tolerability profiles have been introduced,[21] improving the prognosis of MS.
As with any medical treatment, medications used in the management of MS have several adverse effects. Alternative treatments are pursued by some people, despite the shortage of supporting evidence of efficacy.
Initial management of acute flare[edit]
During symptomatic attacks, administration of high doses of intravenous corticosteroids, such as methylprednisolone, is the usual therapy,[1] with oral corticosteroids seeming to have a similar efficacy and safety profile.[93] Although effective in the short term for relieving symptoms, corticosteroid treatments do not appear to have a significant impact on long-term recovery.[94][95] The long-term benefit is unclear in optic neuritis as of 2020.[96] The consequences of severe attacks that do not respond to corticosteroids might be treatable by plasmapheresis.[1]
Chronic management[edit]
Relapsing remitting multiple sclerosis[edit]
Multiple disease-modifying medications were approved by regulatory agencies for RRMS; they are modestly effective at decreasing the number of attacks.[97] The interferons[98] and glatiramer acetate are first-line treatments[5] and are roughly equivalent, reducing relapses by approximately 30%.[99] Early-initiated long-term therapy is safe and improves outcomes.[100][101]
Treatment of CIS with interferons decreases the chance of progressing to clinical MS.[1][102][103] Efficacy of interferons and glatiramer acetate in children has been estimated to be roughly equivalent to that of adults.[104] The role of some newer agents such as fingolimod,[105] teriflunomide, and dimethyl fumarate,[106] is not yet entirely clear.[107] Making firm conclusions about the best treatment is difficult, especially regarding the long‐term benefit and safety of early treatment, given the lack of studies directly comparing disease-modifying therapies or long-term monitoring of patient outcomes.[108]
The relative effectiveness of different treatments is unclear, as most have only been compared to placebo or a small number of other therapies.[109] Direct comparisons of interferons and glatiramer acetate indicate similar effects or only small differences in effects on relapse rate, disease progression, and MRI measures.[110] Alemtuzumab, natalizumab, and fingolimod may be more effective than other drugs in reducing relapses over the short term in people with RRMS.[111] Natalizumab and interferon beta-1a (Rebif) may reduce relapses compared to both placebo and interferon beta-1a (Avonex) while Interferon beta-1b (Betaseron), glatiramer acetate, and mitoxantrone may also prevent relapses.[109] Evidence on relative effectiveness in reducing disability progression is unclear.[109][111] All medications are associated with adverse effects that may influence their risk to benefit profiles.[109][111]
Ublituximab was approved for medical use in the United States in December 2022.[112]
Progressive multiple sclerosis[edit]
In 2011, mitoxantrone was the first medication approved for secondary progressive MS.[113] In this population, tentative evidence supports mitoxantrone moderately slowing the progression of the disease and decreasing rates of relapses over two years.[114][115]
New approved medications continue to emerge in modern medicine. In March 2017, the FDA approved ocrelizumab as a treatment for primary progressive MS in adults, the first drug to gain that approval,[116][117][118] with requirements for several Phase IV clinical trials.[119] It is also used for the treatment of relapsing forms of multiple sclerosis, to include clinically isolated syndrome, relapsing-remitting disease, and active secondary progressive disease in adults.[118] According to a 2021 Cochrane review, ocrelizumab may reduce worsening of symptoms for primary progressive MS and probably increases unwanted effects but makes little or no difference to the number of serious unwanted effects.[120]
In 2019, siponimod and cladribine were approved in the United States for the treatment of secondary progressive multiple sclerosis (SPMS). [116] Subsequently, ozanimod was approved in 2020, and ponesimod was approved in 2021, which were both approved for management of CIS, relapsing MS, and SPMS in the U.S., and RRMS in Europe. [121]
Adverse effects[edit]
Irritation zone after injection of glatiramer acetate.
The disease-modifying treatments have several adverse effects. One of the most common is irritation at the injection site for glatiramer acetate and the interferons (up to 90% with subcutaneous injections and 33% with intramuscular injections).[98][122] Over time, a visible dent at the injection site, due to the local destruction of fat tissue, known as lipoatrophy, may develop.[122] Interferons may produce flu-like symptoms;[123] some people taking glatiramer experience a post-injection reaction with flushing, chest tightness, heart palpitations, and anxiety, which usually lasts less than thirty minutes.[124] More dangerous but much less common are liver damage from interferons,[125] systolic dysfunction (12%), infertility, and acute myeloid leukemia (0.8%) from mitoxantrone,[114][126] and progressive multifocal leukoencephalopathy occurring with natalizumab (occurring in 1 in 600 people treated).[5][127]
Fingolimod may give rise to hypertension and slowed heart rate, macular edema, elevated liver enzymes, or a reduction in lymphocyte levels.[105][107] Tentative evidence supports the short-term safety of teriflunomide, with common side effects including: headaches, fatigue, nausea, hair loss, and limb pain.[97] There have also been reports of liver failure and PML with its use and it is dangerous for fetal development.[107] Most common side effects of dimethyl fumarate are flushing and gastrointestinal problems.[106][128][107] While dimethyl fumarate may lead to a reduction in the white blood cell count there were no reported cases of opportunistic infections during trials.[129]
Associated symptoms[edit]
Both medications and neurorehabilitation have been shown to improve some symptoms, though neither changes the course of the disease.[130] Some symptoms have a good response to medication, such as bladder spasticity, while others are little changed.[1] Equipment such as catheters for neurogenic bladder or mobility aids can be helpful in improving functional status.
A multidisciplinary approach is important for improving quality of life; however, it is difficult to specify a ‘core team’ as many health services may be needed at different points in time.[1] Multidisciplinary rehabilitation programs increase activity and participation of people with MS but do not influence impairment level.[131] Studies investigating information provision in support of patient understanding and participation suggest that while interventions (written information, decision aids, coaching, educational programmes) may increase knowledge, the evidence of an effect on decision making and quality of life is mixed and low certainty.[132] There is limited evidence for the overall efficacy of individual therapeutic disciplines,[133][134] though there is good evidence that specific approaches, such as exercise,[135][136][137][138] and psychological therapies are effective.[139] Cognitive training, alone or combined with other neuropsychological interventions, may show positive effects for memory and attention though firm conclusions are not possible given small sample numbers, variable methodology, interventions and outcome measures.[140] The effectiveness of palliative approaches in addition to standard care is uncertain, due to lack of evidence.[141] The effectiveness of interventions, including exercise, specifically for the prevention of falls in people with MS is uncertain, while there is some evidence of an effect on balance function and mobility.[142] Cognitive behavioral therapy has shown to be moderately effective for reducing MS fatigue.[143] The evidence for the effectiveness of non-pharmacological interventions for chronic pain is insufficient to recommend such interventions alone, however their use in combination with medications may be reasonable.[144]
Non-pharmaceutical[edit]
There is some evidence that aquatic therapy is a beneficial intervention.[145]
The spasticity associated with MS can be difficult to manage because of the progressive and fluctuating course of the disease.[146] Although there is no firm conclusion on the efficacy in reducing spasticity, PT interventions can be a safe and beneficial option for patients with multiple sclerosis. Physical therapy including vibration interventions, electrical stimulation, exercise therapy, standing therapy, and radial shock wave therapy (RSWT), were beneficial for limiting spasticity, helping limit excitability, or increasing range of motion.[147]
Alternative treatments[edit]
Over 50% of people with MS may use complementary and alternative medicine, although percentages vary depending on how alternative medicine is defined.[18] Regarding the characteristics of users, they are more frequently women, have had MS for a longer time, tend to be more disabled and have lower levels of satisfaction with conventional healthcare.[18] The evidence for the effectiveness for such treatments in most cases is weak or absent.[18][148] Treatments of unproven benefit used by people with MS include dietary supplementation and regimens,[18][149][150] vitamin D,[151] relaxation techniques such as yoga,[18] herbal medicine (including medical cannabis),[18][152][153] hyperbaric oxygen therapy,[154] self-infection with hookworms, reflexology, acupuncture,[18][155] and mindfulness.[156] Evidence suggests vitamin D supplementation, irrespective of the form and dose, provides no benefit for people with MS; this includes for measures such as relapse recurrence, disability, and MRI lesions while effects on health‐related quality of life and fatigue are unclear.[157] There is insufficient evidence supporting high-dose biotin[158][159][160] and some evidence for increased disease activity and higher risk of relapse with its use.[161]
Prognosis[edit]
The availability of treatments that modify the course of multiple sclerosis beginning in the 1990s, known as disease-modifying therapies (DMTs), has improved prognosis. These treatments can reduce relapses and slow progression, but as of 2022 there is no cure.[21][162]
The prognosis of MS depends on the subtype of the disease, and there is also great individual variation in the progression of the disease.[163] In relapsing MS, which is the most common subtype, a 2016 cohort study found that after a median of 16.8 years from onset, one in ten of those with relapsing MS needed a walking aid, and almost two in ten transitioned to secondary progressive MS, a form characterized by more progressive decline.[21] With treatments available in the 2020s, relapses can be eliminated or substantially reduced. However, «silent progression» of the disease still occurs.[162][164]
In addition to secondary progressive MS (SPMS), a small proportion of people with MS (10-15%) experience progressive decline from the onset, known as primary progressive MS (PPMS). Most treatments have been approved for use in relapsing MS; there are limited effective treatments for progressive forms of MS, and treatments aren’t as effective.[165][162][21] The prognosis for progressive MS is worse, with faster accumulation of disability, though the rate of decline varies considerably between people.[165] In untreated PPMS, the median time from onset to requiring a walking aid is estimated as seven years.[21] In SPMS, a 2014 cohort study reported that people required a walking aid after an average of five years from onset of SPMS, and were chair or bed-bound after average fifteen years.[166]
After diagnosis of MS, characteristics that predict a worse course are male sex, older age, and greater disability at the time of diagnosis; female sex is associated with a higher relapse rate.[167] As of 2018, no biomarker can accurately predict disease progression in every patient.[163] Spinal cord lesions, abnormalities on MRI, and more brain atrophy are predictive of a worse course, though brain atrophy as a predictor of disease course is experimental and not used in clinical practice as of 2018.[167] Early treatment leads to a better prognosis, but a higher relapse frequency when treated with DMTs is associated with a poorer prognosis.[163][167] A 60-year longitudinal population study conducted in Norway found a 7-year shorter life expectancy in MS compared with the general population and a rise in survival in MS during the observation period. Median life expectancy for RRMS patients was 77.8 years and 71.4 years for PPMS compared to 81.8 years for the general population. Life expectancy for men was 5 years shorter than for women.[168]
Epidemiology[edit]
|
|
This article needs to be updated. Please help update this article to reflect recent events or newly available information. (July 2022) |
Deaths from multiple sclerosis per million persons in 2012
MS is the most common autoimmune disorder of the central nervous system.[20] The latest estimation of the total number of people with MS was 2.8 million globally, with a prevalence of 36 per 100,000 people. Moreover, prevalence varies widely in different regions around the world.[22] In Africa, there are 5 people per 100,000 diagnosed with MS, compared to South East Asia where the prevalence is 9 per 100,000, 112 per 100,000 in the Americas, and 133 per 100,000 in Europe. [169]
Increasing rates of MS may be explained simply by better diagnosis.[2] Studies on populational and geographical patterns have been common[38] and have led to a number of theories about the cause.[16][52][53]
MS usually appears in adults in their late twenties or early thirties but it can rarely start in childhood and after 50 years of age.[2][65] The primary progressive subtype is more common in people in their fifties.[83] Similarly to many autoimmune disorders, the disease is more common in women, and the trend may be increasing.[1][48] As of 2008, globally it is about two times more common in women than in men.[65] In children, it is even more common in females than males,[1] while in people over fifty, it affects males and females almost equally.[83]
History[edit]
Medical discovery[edit]
Robert Carswell (1793–1857), a British professor of pathology, and Jean Cruveilhier (1791–1873), a French professor of pathologic anatomy, described and illustrated many of the disease’s clinical details, but did not identify it as a separate disease.[170] Specifically, Carswell described the injuries he found as «a remarkable lesion of the spinal cord accompanied with atrophy».[1] Under the microscope, Swiss pathologist Georg Eduard Rindfleisch (1836–1908) noted in 1863 that the inflammation-associated lesions were distributed around blood vessels.[171][172]
The French neurologist Jean-Martin Charcot (1825–1893) was the first person to recognize multiple sclerosis as a distinct disease in 1868.[170] Summarizing previous reports and adding his own clinical and pathological observations, Charcot called the disease sclerose en plaques.
Diagnosis history[edit]
The first attempt to establish a set of diagnostic criteria was also due to Charcot in 1868. He published what now is known as the «Charcot Triad», consisting in nystagmus, intention tremor, and telegraphic speech (scanning speech).[173] Charcot also observed cognition changes, describing his patients as having a «marked enfeeblement of the memory» and «conceptions that formed slowly».[23]
Diagnosis was based on Charcot triad and clinical observation until Schumacher made the first attempt to standardize criteria in 1965 by introducing some fundamental requirements: Dissemination of the lesions in time (DIT) and space (DIS), and that «signs and symptoms cannot be explained better by another disease process».[173] The DIT and DIS requirement was later inherited by Poser criteria and McDonald criteria, whose 2017 revision is in use.[173][163]
During the 20th century, theories about the cause and pathogenesis were developed and effective treatments began to appear in the 1990s.[1] Since the beginning of the 21st century, refinements of the concepts have taken place. The 2010 revision of the McDonald criteria allowed for the diagnosis of MS with only one proved lesion (CIS).[174]
In 1996, the US National Multiple Sclerosis Society (NMSS) (Advisory Committee on Clinical Trials) defined the first version of the clinical phenotypes that is in use. In this first version they provided standardized definitions for four MS clinical courses: relapsing-remitting (RR), secondary progressive (SP), primary progressive (PP), and progressive relapsing (PR). In 2010, PR was dropped and CIS was incorporated.[174] Three years later, the 2013 revision of the «phenotypes for the disease course» were forced to consider CIS as one of the phenotypes of MS, making obsolete some expressions like «conversion from CIS to MS».[175] Other organizations have proposed later new clinical phenotypes, like HAMS (Highly Active MS).[176]
Historical cases[edit]
Photographic study of locomotion of a female with MS with walking difficulties created in 1887 by Muybridge
There are several historical accounts of people who probably had MS and lived before or shortly after the disease was described by Charcot.
A young woman called Halldora who lived in Iceland around 1200 suddenly lost her vision and mobility but recovered them seven days after. Saint Lidwina of Schiedam (1380–1433), a Dutch nun, may be one of the first clearly identifiable people with MS. From the age of 16 until her death at 53, she had intermittent pain, weakness of the legs and vision loss: symptoms typical of MS.[177] Both cases have led to the proposal of a «Viking gene» hypothesis for the dissemination of the disease.[178]
Augustus Frederick d’Este (1794–1848), son of Prince Augustus Frederick, Duke of Sussex and Lady Augusta Murray and a grandson of George III of the United Kingdom, almost certainly had MS. D’Este left a detailed diary describing his 22 years living with the disease. His diary began in 1822 and ended in 1846, although it remained unknown until 1948. His symptoms began at age 28 with a sudden transient visual loss (amaurosis fugax) after the funeral of a friend. During his disease, he developed weakness of the legs, clumsiness of the hands, numbness, dizziness, bladder disturbance and erectile dysfunction. In 1844, he began to use a wheelchair. Despite his illness, he kept an optimistic view of life.[179][180] Another early account of MS was kept by the British diarist W. N. P. Barbellion, pen name of Bruce Frederick Cummings (1889–1919), who maintained a detailed log of his diagnosis and struggle.[180] His diary was published in 1919 as The Journal of a Disappointed Man.[181]
Research[edit]
Epstein-Barr virus ongoing studies[edit]
As of 2022, the pathogenesis of MS as it relates to EBV is actively investigated, as are disease-modifying therapies; understanding of how risk factors combine with EBV to initiate MS is sought. Whether EBV is the only cause of MS might be better understood if an EBV vaccine is developed and shown to prevent MS as well.[15]
Even though a variety of studies showed the connection between an EBV infection and a later development of multiple sclerosis, the mechanisms behind this correlation are still not completely clear. Though there are some leading theories which are explaining the relationship between the two diseases closer. It is expected that the involvement of EBV-infected B-cells[182] and the involvement of anti-EBNA antibodies, which appear to be significantly higher in multiple sclerosis patients, play a crucial role in the development of the disease.[183] This is supported by the fact that with treatment against B-cells, e.g. through Ocrelizumab therapy, the course of multiple sclerosis symptoms will be improved. Annual relapses will appear in a minor rate and disability progression is slower.[184] A study led by a Stanford research unit which was published in 2022, has shown that during an EBV infection, molecular mimicry can occur, where the immune system will produce antibodies against the EBNA1 protein, which at the same time is able to bind to GlialCAM in the myelin. Additionally, they observed a phenomenon which is uncommon in healthy individuals but often detected in multiple sclerosis patients – B-cells are trafficking to the brain and spinal cord, where they are producing oligoclonal antibody bands. A majority of these oligoclonal bands do have an affinity to the viral protein EBNA1, which is cross-reactive to GlialCAM. These antibodies are abundant in approximately 20-25% of multiple sclerosis patients and worsen the autoimmune demyelination which leads consequently to an pathophysiologocal exacerbation of the disease. Furthermore, the intrathecal oligoclonal expansion with a constant somatic hypermutation is unique in multiple sclerosis when compared to other neuroinflammatory diseases. In the study there was also the abundance of antibodies with IGHV 3-7 genes measured, which appears to be connected to the disease progress. Antibodies which are IGHV3–7-based are binding with a high affinity to EBNA1 and GlialCAM. This process is actively thriving the demyelination. It is probable that B-cells, expressing IGHV 3-7 genes entered the CSF and underwent there affinity maturation after facing GlialCAM, which led consequently to the production of high affinity anti-GlialCAM antibodies. This was additionally shown in the EAE mouse model where immunization with EBNA1 lead to a strong B-cell response against GlialCAM, which worsened the EAE.[185]
Medications[edit]
Medications that influence voltage-gated sodium ion channels are under investigation as a potential neuroprotective strategy because of hypothesized role of sodium in the pathological process leading to axonal injury and accumulating disability. There is insufficient evidence of an effect of sodium channel blockers for people with MS.[186]
Pathogenesis[edit]
MS is a clinically defined entity with several atypical presentations. Some auto-antibodies have been found in atypical MS cases, giving birth to separate disease families and restricting the previously wider concept of MS.
Anti-AQP4 autoantibodies were found in neuromyelitis optica (NMO), which was previously considered a MS variant. A spectrum of diseases named NMOSD (NMO spectrum diseases) or anti-AQP4 diseases has been accepted.[187] Some cases of MS were presenting anti-MOG autoantibodies, mainly overlapping with the Marburg variant. Anti-MOG autoantibodies were found to be also present in ADEM, and a second spectrum of separated diseases is being considered. This spectrum is named inconsistently across different authors, but it is normally something similar to anti-MOG demyelinating diseases.[187]
A third kind of auto-antibodies is accepted. They are several anti-neurofascin auto-antibodies which damage the Ranvier nodes of the neurons. These antibodies are more related to the peripheral nervous demyelination, but they were also found in chronic progressive PPMS and combined central and peripheral demyelination (CCPD, which is considered another atypical MS presentation).[188]
In addition to the significance of auto-antibodies in MS, four different patterns of demyelination have been reported, opening the door to consider MS as a heterogeneous disease.[189]
Disease biomarkers[edit]
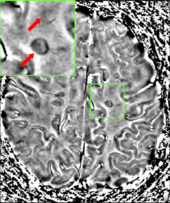
MRI brain scan produced using a Gradient-echo phase sequence showing an iron deposit in a white matter lesion (inside green box in the middle of the image; enhanced and marked by red arrow top-left corner)[190]
Since disease progression is the result of degeneration of neurons, the roles of proteins showing loss of nerve tissue such as neurofilaments, tau, and N-acetylaspartate are under investigation.[191][192]
Improvement in neuroimaging techniques such as positron emission tomography (PET) or magnetic resonance imaging (MRI) carry a promise for better diagnosis and prognosis predictions. Regarding MRI, there are several techniques that have already shown some usefulness in research settings and could be introduced into clinical practice, such as double-inversion recovery sequences, magnetization transfer, diffusion tensor, and functional magnetic resonance imaging.[193] These techniques are more specific for the disease than existing ones, but still lack some standardization of acquisition protocols and the creation of normative values.[193] This is particularly the case for proton magnetic resonance spectroscopy, for which a number of methodological variations observed in the literature may underlie continued inconsistencies in central nervous system metabolic abnormalities, particularly in N-acetyl aspartate, myoinositol, choline, glutamate, GABA, and GSH, observed for multiple sclerosis and its subtypes.[194] There are other techniques under development that include contrast agents capable of measuring levels of peripheral macrophages, inflammation, or neuronal dysfunction,[193] and techniques that measure iron deposition that could serve to determine the role of this feature in MS, or that of cerebral perfusion.[193]
COVID-19[edit]
The hospitalization rate was found to be higher among individuals with MS and COVID-19 infection, at 10%, while the pooled infection rate is estimated at 4%. The pooled prevalence of death in hospitalized individuals with MS is estimated as 4%.[195]
Other emerging theories[edit]
One emerging hypothesis, referred to as the hygiene hypothesis, suggests that early-life exposure to infectious agents helps to develop the immune system and reduces susceptibility to allergies and autoimmune disorders, including MS. Germ-free mice infected with transplanted fecal matter from MS patients exhibit an increased risk of developing EAE, an animal model of MS.[196][medical citation needed] It has also been proposed that certain bacteria found in the gut use molecular mimicry to infiltrate the brain via the gut-brain axis, initiating an inflammatory response and increasing blood-brain barrier permeability. Vitamin D levels have also been correlated with MS; lower levels of vitamin D correspond to an increased risk of MS, suggesting a reduced prevalence in the tropics — an area with more Vitamin D-rich sunlight — strengthening the impact of geographical location on MS development.[197] MS mechanisms begin when peripheral autoreactive effector CD4+ T cells get activated and move into the CNS. Antigen-presenting cells localize the reactivation of autoreactive effector CD4-T cells once they have entered the CNS, attracting more T cells and macrophages to form the inflammatory lesion.[198][medical citation needed] In MS patients, macrophages and microglia assemble at locations where demyelination and neurodegeneration are actively occurring, and microglial activation is more apparent in the normal-appearing white matter of MS patients.[199] Astrocytes generate neurotoxic chemicals like nitric oxide and TNFα, attract neurotoxic inflammatory monocytes to the CNS, and are responsible for astrogliosis, the scarring that prevents the spread of neuroinflammation and kills neurons inside the scarred area.[200][better source needed]
See also[edit]
- List of multiple sclerosis organizations
- List of people with multiple sclerosis
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av Compston A, Coles A (October 2008). «Multiple sclerosis». Lancet. 372 (9648): 1502–1517. doi:10.1016/S0140-6736(08)61620-7. PMID 18970977. S2CID 195686659.
- ^ a b c d e f g h i j k l Milo R, Kahana E (March 2010). «Multiple sclerosis: geoepidemiology, genetics and the environment». Autoimmunity Reviews. 9 (5): A387-94. doi:10.1016/j.autrev.2009.11.010. PMID 19932200.
- ^ a b c d e «NINDS Multiple Sclerosis Information Page». National Institute of Neurological Disorders and Stroke. 19 November 2015. Archived from the original on 13 February 2016. Retrieved 6 March 2016.
- ^ a b Nakahara J, Maeda M, Aiso S, Suzuki N (February 2012). «Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy». Clinical Reviews in Allergy & Immunology. 42 (1): 26–34. doi:10.1007/s12016-011-8287-6. PMID 22189514. S2CID 21058811.
- ^ a b c d e f g h Tsang BK, Macdonell R (December 2011). «Multiple sclerosis- diagnosis, management and prognosis». Australian Family Physician. 40 (12): 948–55. PMID 22146321. Archived from the original on 5 October 2021. Retrieved 5 October 2021.
- ^ Liu Z, Liao Q, Wen H, Zhang Y (June 2021). «Disease modifying therapies in relapsing-remitting multiple sclerosis: A systematic review and network meta-analysis». Autoimmunity Reviews. 20 (6): 102826. doi:10.1016/j.autrev.2021.102826. PMID 33878488. S2CID 233325057.
- ^ a b c Alphonsus KB, Su Y, D’Arcy C (April 2019). «The effect of exercise, yoga and physiotherapy on the quality of life of people with multiple sclerosis: Systematic review and meta-analysis». Complementary Therapies in Medicine. 43: 188–195. doi:10.1016/j.ctim.2019.02.010. PMID 30935529. S2CID 86669723.
- ^ Leray E, Moreau T, Fromont A, Edan G (January 2016). «Epidemiology of multiple sclerosis». Revue Neurologique. 172 (1): 3–13. doi:10.1016/j.neurol.2015.10.006. PMID 26718593.
- ^ a b c d e f g h i j k l Compston A, Coles A (April 2002). «Multiple sclerosis». Lancet. 359 (9313): 1221–1231. doi:10.1016/S0140-6736(02)08220-X. PMID 11955556. S2CID 14207583.
- ^ Murray ED, Buttner EA, Price BH (2012). «Depression and Psychosis in Neurological Practice». In Daroff R, Fenichel G, Jankovic J, Mazziotta J (eds.). Bradley’s neurology in clinical practice (6th ed.). Philadelphia, PA: Elsevier/Saunders. ISBN 978-1-4377-0434-1.
- ^ a b c Piryonesi SM, Rostampour S, Piryonesi SA (April 2021). «Predicting falls and injuries in people with multiple sclerosis using machine learning algorithms». Multiple Sclerosis and Related Disorders. 49: 102740. doi:10.1016/j.msard.2021.102740. PMID 33450500. S2CID 231624230.
- ^ Mazumder R, Murchison C, Bourdette D, Cameron M (25 September 2014). «Falls in people with multiple sclerosis compared with falls in healthy controls». PLOS ONE. 9 (9): e107620. Bibcode:2014PLoSO…9j7620M. doi:10.1371/journal.pone.0107620. PMC 4177842. PMID 25254633.
- ^ Baecher-Allan C, Kaskow BJ, Weiner HL (February 2018). «Multiple Sclerosis: Mechanisms and Immunotherapy». Neuron. 97 (4): 742–768. doi:10.1016/j.neuron.2018.01.021. PMID 29470968. S2CID 3499974.
- ^ a b c d e f [medical citation needed]Lublin FD, Reingold SC (April 1996). «Defining the clinical course of multiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis». Neurology. 46 (4): 907–911. doi:10.1212/WNL.46.4.907. PMID 8780061. S2CID 40213123.
- ^ a b c d Aloisi F, Cross AH (October 2022). «MINI-review of Epstein-Barr virus involvement in multiple sclerosis etiology and pathogenesis». Journal of Neuroimmunology. 371: 577935. doi:10.1016/j.jneuroim.2022.577935. PMID 35931008. S2CID 251152784.
- ^ a b c d e Ascherio A, Munger KL (April 2007). «Environmental risk factors for multiple sclerosis. Part I: the role of infection». Annals of Neurology. 61 (4): 288–99. doi:10.1002/ana.21117. PMID 17444504. S2CID 7682774.
- ^ Quinn É, Hynes SM (July 2021). «Occupational therapy interventions for multiple sclerosis: A scoping review». Scandinavian Journal of Occupational Therapy. 28 (5): 399–414. doi:10.1080/11038128.2020.1786160. hdl:10379/16066. PMID 32643486. S2CID 220436640.
- ^ a b c d e f g h Huntley A (January 2006). «A review of the evidence for efficacy of complementary and alternative medicines in MS». International MS Journal. 13 (1): 5–12, 4. PMID 16420779.
- ^ Weinshenker BG (1994). «Natural history of multiple sclerosis». Annals of Neurology. 36 Suppl (Suppl): S6-11. doi:10.1002/ana.410360704. PMID 8017890. S2CID 7140070.
- ^ a b Berer K, Krishnamoorthy G (November 2014). «Microbial view of central nervous system autoimmunity». FEBS Letters. 588 (22): 4207–13. doi:10.1016/j.febslet.2014.04.007. PMID 24746689. S2CID 2772656.
- ^ a b c d e f g McGinley MP, Goldschmidt CH, Rae-Grant AD (February 2021). «Diagnosis and Treatment of Multiple Sclerosis: A Review». JAMA. 325 (8): 765–779. doi:10.1001/jama.2020.26858. PMID 33620411. S2CID 232019589.
- ^ a b Lane J, Ng HS, Poyser C, Lucas RM, Tremlett H (July 2022). «Multiple sclerosis incidence: A systematic review of change over time by geographical region». Mult Scler Relat Disord. 63: 103932. doi:10.1016/j.msard.2022.103932. PMID 35667315. S2CID 249188137. Archived from the original on 10 February 2023. Retrieved 6 July 2022.
- ^ a b c Clanet M (June 2008). «Jean-Martin Charcot. 1825 to 1893». International MS Journal. 15 (2): 59–61. PMID 18782501. Archived from the original (PDF) on 30 March 2019. Retrieved 21 October 2010.
* Charcot J (1868). «Histologie de la sclerose en plaques». Gazette des Hopitaux, Paris. 41: 554–5. - ^ «MS Signs». Webmd. Archived from the original on 30 September 2016. Retrieved 7 October 2016.
- ^ Cameron MH, Nilsagard Y (2018). «Balance, gait, and falls in multiple sclerosis». Handbook of Clinical Neurology. 159: 237–250. doi:10.1016/b978-0-444-63916-5.00015-x. ISBN 978-0-444-63916-5. PMID 30482317.
- ^ Oreja-Guevara C, Ayuso Blanco T, Brieva Ruiz L, Hernández Pérez MÁ, Meca-Lallana V, Ramió-Torrentà L (2019). «Cognitive Dysfunctions and Assessments in Multiple Sclerosis». Frontiers in Neurology. 10: 581. doi:10.3389/fneur.2019.00581. PMC 6558141. PMID 31214113.
- ^ Kalb R, Beier M, Benedict RH, Charvet L, Costello K, Feinstein A, et al. (November 2018). «Recommendations for cognitive screening and management in multiple sclerosis care». Multiple Sclerosis. 24 (13): 1665–1680. doi:10.1177/1352458518803785. PMC 6238181. PMID 30303036.
- ^ Benedict RH, Amato MP, DeLuca J, Geurts JJ (October 2020). «Cognitive impairment in multiple sclerosis: clinical management, MRI, and therapeutic avenues». The Lancet. Neurology. 19 (10): 860–871. doi:10.1016/S1474-4422(20)30277-5. PMID 32949546. S2CID 221744328.
- ^ Kurtzke JF (November 1983). «Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS)». Neurology. 33 (11): 1444–52. doi:10.1212/WNL.33.11.1444. PMID 6685237.
- ^ Amato MP, Ponziani G (August 1999). «Quantification of impairment in MS: discussion of the scales in use». Multiple Sclerosis. 5 (4): 216–9. doi:10.1191/135245899678846113. PMID 10467378.
- ^ Rudick RA, Cutter G, Reingold S (October 2002). «The multiple sclerosis functional composite: a new clinical outcome measure for multiple sderosis trials». Multiple Sclerosis. 8 (5): 359–65. doi:10.1191/1352458502ms845oa. PMID 12356200. S2CID 31529508.
- ^ van Munster CE, Uitdehaag BM (March 2017). «Outcome Measures in Clinical Trials for Multiple Sclerosis». CNS Drugs. 31 (3): 217–236. doi:10.1007/s40263-017-0412-5. PMC 5336539. PMID 28185158.
- ^ a b Tataru N, Vidal C, Decavel P, Berger E, Rumbach L (2006). «Limited impact of the summer heat wave in France (2003) on hospital admissions and relapses for multiple sclerosis». Neuroepidemiology. 27 (1): 28–32. doi:10.1159/000094233. PMID 16804331. S2CID 20870484.
- ^ Heesen C, Mohr DC, Huitinga I, Bergh FT, Gaab J, Otte C, Gold SM (March 2007). «Stress regulation in multiple sclerosis: current issues and concepts». Multiple Sclerosis. 13 (2): 143–8. doi:10.1177/1352458506070772. PMID 17439878. S2CID 8262595.
- ^ Martinelli V (2000). «Trauma, stress and multiple sclerosis». Neurological Sciences. 21 (4 Suppl 2): S849-52. doi:10.1007/s100720070024. PMID 11205361. S2CID 2376078.
- ^ Makhani N, Tremlett H (August 2021). «The multiple sclerosis prodrome». Nature Reviews. Neurology. 17 (8): 515–521. doi:10.1038/s41582-021-00519-3. PMC 8324569. PMID 34155379.
- ^ Marrie RA (December 2019). «Mounting evidence for a multiple sclerosis prodrome». Nature Reviews. Neurology. 15 (12): 689–690. doi:10.1038/s41582-019-0283-0. PMID 31654040. S2CID 204887642.
- ^ a b Kurtzke JF (October 1993). «Epidemiologic evidence for multiple sclerosis as an infection». Clinical Microbiology Reviews. 6 (4): 382–427. doi:10.1128/CMR.6.4.382. PMC 358295. PMID 8269393.
- ^ Gilden DH (March 2005). «Infectious causes of multiple sclerosis». The Lancet. Neurology. 4 (3): 195–202. doi:10.1016/S1474-4422(05)01017-3. PMC 7129502. PMID 15721830.
- ^ Soldan SS, Lieberman PM (January 2023). «Epstein-Barr virus and multiple sclerosis». Nature Reviews. Microbiology. 21 (1): 51–64. doi:10.1038/s41579-022-00770-5. PMC 9362539. PMID 35931816.
- ^ a b Bjornevik K, Cortese M, Healy BC, Kuhle J, Mina MJ, Leng Y, et al. (January 2022). «Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis». Science. 375 (6578): 296–301. Bibcode:2022Sci…375..296B. doi:10.1126/science.abj8222. PMID 35025605. S2CID 245983763. See BBC lay summary Archived 25 April 2022 at the Wayback Machine of 13 April 2022.
- ^
- ^ Skene NG, Grant SG (2016). «Identification of Vulnerable Cell Types in Major Brain Disorders Using Single Cell Transcriptomes and Expression Weighted Cell Type Enrichment». Frontiers in Neuroscience. 10: 16. doi:10.3389/fnins.2016.00016. PMC 4730103. PMID 26858593.
- ^ Hassan-Smith G, Douglas MR (October 2011). «Epidemiology and diagnosis of multiple sclerosis». British Journal of Hospital Medicine. 72 (10): M146-51. doi:10.12968/hmed.2011.72.Sup10.M146. PMID 22041658.
- ^ Rosati G (April 2001). «The prevalence of multiple sclerosis in the world: an update». Neurological Sciences. 22 (2): 117–39. doi:10.1007/s100720170011. PMID 11603614. S2CID 207051545.
- ^ a b c Baranzini SE (June 2011). «Revealing the genetic basis of multiple sclerosis: are we there yet?». Current Opinion in Genetics & Development. 21 (3): 317–24. doi:10.1016/j.gde.2010.12.006. PMC 3105160. PMID 21247752.
- ^ International Multiple Sclerosis Genetics Consortium (2019). «Multiple sclerosis genomic map implicates peripheral immune cells and microglia in susceptibility». Science. 365 (6460). doi:10.1126/science.aav7188. PMC 7241648. PMID 31604244.
- ^ a b c Alonso A, Hernán MA (July 2008). «Temporal trends in the incidence of multiple sclerosis: a systematic review». Neurology. 71 (2): 129–35. doi:10.1212/01.wnl.0000316802.35974.34. PMC 4109189. PMID 18606967.
- ^ a b Pugliatti M, Sotgiu S, Rosati G (July 2002). «The worldwide prevalence of multiple sclerosis». Clinical Neurology and Neurosurgery. 104 (3): 182–91. doi:10.1016/S0303-8467(02)00036-7. PMID 12127652. S2CID 862001.
- ^ Grimaldi LM, Salemi G, Grimaldi G, Rizzo A, Marziolo R, Lo Presti C, Maimone D, Savettieri G (November 2001). «High incidence and increasing prevalence of MS in Enna (Sicily), southern Italy». Neurology. 57 (10): 1891–3. doi:10.1212/wnl.57.10.1891. PMID 11723283. S2CID 34895995.
- ^ Kulie T, Groff A, Redmer J, Hounshell J, Schrager S (2009). «Vitamin D: an evidence-based review». Journal of the American Board of Family Medicine. 22 (6): 698–706. doi:10.3122/jabfm.2009.06.090037. PMID 19897699.
- ^ a b c d e Marrie RA (December 2004). «Environmental risk factors in multiple sclerosis aetiology». The Lancet. Neurology. 3 (12): 709–18. doi:10.1016/S1474-4422(04)00933-0. PMID 15556803. S2CID 175786.
- ^ a b c Ascherio A, Munger KL (June 2007). «Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors». Annals of Neurology. 61 (6): 504–13. doi:10.1002/ana.21141. PMID 17492755. S2CID 36999504.
- ^ Hedström A, Hössjer O, Katsoulis M (September 2018). «Organic solvents and MS susceptibility: Interaction with MS risk HLA genes». Neurology. 91 (5): 455–462. doi:10.1212/WNL.0000000000005906. PMC 6093765. PMID 29970406.
- ^ Stowe J, Andrews N, Miller E (January 2020). «Do Vaccines Trigger Neurological Diseases? Epidemiological Evaluation of Vaccination and Neurological Diseases Using Examples of Multiple Sclerosis, Guillain-Barré Syndrome and Narcolepsy». CNS Drugs. 34 (1): 1–8. doi:10.1007/s40263-019-00670-y. PMC 7224038. PMID 31576507.
- ^ Spitsin S, Koprowski H (2008). «Role of uric acid in multiple sclerosis». Current Topics in Microbiology and Immunology. 318: 325–342. doi:10.1007/978-3-540-73677-6_13. ISBN 978-3-540-73676-9. PMID 18219824.
- ^ Nourbakhsh B, Mowry EM (June 2019). «Multiple Sclerosis Risk Factors and Pathogenesis». Continuum. 25 (3): 596–610. doi:10.1212/CON.0000000000000725. PMID 31162307. S2CID 174806511.
- ^ Chen Y, Popko B (2018). «Cholesterol crystals impede nerve repair». Science. 359 (6376): 635–636. Bibcode:2018Sci…359..635C. doi:10.1126/science.aar7369. PMID 29439228. S2CID 3257111.
- ^ Cantuti-Castelvetri L, Fitzner D, Bosch-Queralt M, Weil MT, Su M, Sen P, Ruhwedel T, Mitkovski M, Trendelenburg G, Lütjohann D, Möbius W, Simons M (2018). «Defective cholesterol clearance limits remyelination in the aged central nervous system». Science. 359 (6376): 684–688. Bibcode:2018Sci…359..684C. doi:10.1126/science.aan4183. PMID 29301957.
- ^ a b Chari DM (2007). «Remyelination in multiple sclerosis». International Review of Neurobiology. 79: 589–620. doi:10.1016/S0074-7742(07)79026-8. ISBN 978-0-12-373736-6. PMC 7112255. PMID 17531860.
- ^ Pittock SJ, Lucchinetti CF (March 2007). «The pathology of MS: new insights and potential clinical applications». The Neurologist. 13 (2): 45–56. doi:10.1097/01.nrl.0000253065.31662.37. PMID 17351524. S2CID 2993523.
- ^ Huang X, Hussain B, Chang J (January 2021). «Peripheral inflammation and blood-brain barrier disruption: effects and mechanisms». CNS Neuroscience & Therapeutics. 27 (1): 36–47. doi:10.1111/cns.13569. PMC 7804893. PMID 33381913.
- ^ Ferré JC, Shiroishi MS, Law M (November 2012). «Advanced techniques using contrast media in neuroimaging». Magnetic Resonance Imaging Clinics of North America. 20 (4): 699–713. doi:10.1016/j.mric.2012.07.007. PMC 3479680. PMID 23088946.
- ^ Trojano M, Paolicelli D (November 2001). «The differential diagnosis of multiple sclerosis: classification and clinical features of relapsing and progressive neurological syndromes». Neurological Sciences. 22 (Suppl 2): S98-102. doi:10.1007/s100720100044. PMID 11794488. S2CID 3057096.
- ^ a b c World Health Organization (2008). Atlas: Multiple Sclerosis Resources in the World 2008. Geneva: World Health Organization. pp. 15–16. hdl:10665/43968. ISBN 978-92-4-156375-8.
- ^ Poser CM, Brinar VV (June 2004). «Diagnostic criteria for multiple sclerosis: an historical review». Clinical Neurology and Neurosurgery. 106 (3): 147–58. doi:10.1016/j.clineuro.2004.02.004. PMID 15177763. S2CID 23452341.
- ^ Rovira À (November 2017). «Diagnosis of Multiple Sclerosis». Journal of the Belgian Society of Radiology. 101 (S1): 12. doi:10.5334/jbr-btr.1426.
- ^ a b McDonald WI, Compston A, Edan G, Goodkin D, Hartung HP, Lublin FD, McFarland HF, Paty DW, Polman CH, Reingold SC, Sandberg-Wollheim M, Sibley W, Thompson A, van den Noort S, Weinshenker BY, Wolinsky JS (July 2001). «Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis». Annals of Neurology. 50 (1): 121–7. doi:10.1002/ana.1032. PMID 11456302. S2CID 13870943.
- ^ Rashid W, Miller DH (February 2008). «Recent advances in neuroimaging of multiple sclerosis». Seminars in Neurology. 28 (1): 46–55. doi:10.1055/s-2007-1019127. PMID 18256986.
- ^ Sinnecker T, Clarke MA, Meier D, Enzinger C, Calabrese M, De Stefano N, et al. (MAGNIMS Study Group) (December 2019). «Evaluation of the Central Vein Sign as a Diagnostic Imaging Biomarker in Multiple Sclerosis». JAMA Neurology. 76 (12): 1446–1456. doi:10.1001/jamaneurol.2019.2478. PMC 6704746. PMID 31424490.
- ^ Bernitsas E (February 2020). «The Central Vein Sign». Practical Neurology. Archived from the original on 5 October 2021. Retrieved 5 October 2021.
- ^ Castellaro M, Tamanti A, Pisani AI, Pizzini FB, Crescenzo F, Calabrese M (November 2020). «The Use of the Central Vein Sign in the Diagnosis of Multiple Sclerosis: A Systematic Review and Meta-analysis». Diagnostics. 10 (12): 1025. doi:10.3390/diagnostics10121025. PMC 7760678. PMID 33260401.
- ^ Al-Zandi SH, Fayadh NA, Al-Waely NK (1 March 2018). «Central vein sign detected by SWI at 3 T MRI as a discriminator between multiple sclerosis and leukoaraiosis». The Egyptian Journal of Radiology and Nuclear Medicine. 49 (1): 158–164. doi:10.1016/j.ejrnm.2017.09.003.
- ^ Guisset F, Lolli V, Bugli C, Perrotta G, Absil J, Dachy B, et al. (June 2021). «The central vein sign in multiple sclerosis patients with vascular comorbidities» (PDF). Multiple Sclerosis. 27 (7): 1057–1065. doi:10.1177/1352458520943785. hdl:2078.1/239849. PMID 32749948. S2CID 220976821. Archived (PDF) from the original on 15 July 2021. Retrieved 5 October 2021.
- ^ Chapman M (16 June 2020). «$7.2M NIH Grant Supports Study of MS Diagnostic Biomarker». BioNews Services. Archived from the original on 5 October 2021. Retrieved 5 October 2021.
- ^ Andravizou A, Dardiotis E, Artemiadis A, Sokratous M, Siokas V, Tsouris Z, et al. (December 2019). «Brain atrophy in multiple sclerosis: mechanisms, clinical relevance and treatment options». Auto- Immunity Highlights. 10 (1): 7. doi:10.1186/s13317-019-0117-5. PMC 7065319. PMID 32257063.
- ^ Jacobsen C, Hagemeier J, Myhr KM, Nyland H, Lode K, Bergsland N, et al. (October 2014). «Brain atrophy and disability progression in multiple sclerosis patients: a 10-year follow-up study». Journal of Neurology, Neurosurgery, and Psychiatry. 85 (10): 1109–1115. doi:10.1136/jnnp-2013-306906. PMID 24554101. S2CID 6144791.
- ^ Link H, Huang YM (November 2006). «Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness». Journal of Neuroimmunology. 180 (1–2): 17–28. doi:10.1016/j.jneuroim.2006.07.006. PMID 16945427. S2CID 22724352.
- ^ a b c Solomon AJ (June 2019). «Diagnosis, Differential Diagnosis, and Misdiagnosis of Multiple Sclerosis». Continuum. 25 (3): 611–635. doi:10.1212/CON.0000000000000728. PMID 31162308. S2CID 173991777.
- ^ Lublin FD, et al. (15 July 2014). «Defining the clinical course of multiple sclerosis, The 2013 revisions». Neurology. 83 (3): 278–286. doi:10.1212/WNL.0000000000000560. PMC 4117366. PMID 24871874.
- ^ Lublin FD, Coetzee T, Cohen JA, Marrie RA, Thompson AJ (June 2020). «The 2013 clinical course descriptors for multiple sclerosis: A clarification». Neurology. 94 (24): 1088–1092. doi:10.1212/WNL.0000000000009636. PMC 7455332. PMID 32471886.
- ^ a b Miller D, Barkhof F, Montalban X, Thompson A, Filippi M (May 2005). «Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis». The Lancet. Neurology. 4 (5): 281–8. doi:10.1016/S1474-4422(05)70071-5. PMID 15847841. S2CID 36401666.
- ^ a b c Miller DH, Leary SM (October 2007). «Primary-progressive multiple sclerosis». The Lancet. Neurology. 6 (10): 903–12. doi:10.1016/S1474-4422(07)70243-0. hdl:1871/24666. PMID 17884680. S2CID 31389841.
- ^ Rovaris M, Confavreux C, Furlan R, Kappos L, Comi G, Filippi M (April 2006). «Secondary progressive multiple sclerosis: current knowledge and future challenges». The Lancet. Neurology. 5 (4): 343–54. doi:10.1016/S1474-4422(06)70410-0. PMID 16545751. S2CID 39503553.
- ^ a b Sørensen PS, Centonze D, Giovannoni G, et al. (2020). «Expert opinion on the use of cladribine tablets in clinical practice». Ther Adv Neurol Disord (Review). 13: 1756286420935019. doi:10.1177/1756286420935019. PMC 7318823. PMID 32636933.
- ^ «Novartis receives FDA approval for Mayzent® (siponimod), the first oral drug to treat secondary progressive MS with active disease». Novartis.com. Archived from the original on 20 November 2020. Retrieved 12 November 2021.
- ^ Saida T (November 2004). «[Multiple sclerosis: treatment and prevention of relapses and progression in multiple sclerosis]». Rinsho Shinkeigaku (Review) (in Japanese). 44 (11): 796–8. PMID 15651294.
- ^ Pittock SJ, Rodriguez M (2008). «Benign multiple sclerosis: a distinct clinical entity with therapeutic implications». Current Topics in Microbiology and Immunology. 318: 1–17. doi:10.1007/978-3-540-73677-6_1. ISBN 978-3-540-73676-9. PMID 18219812.
- ^ Feinstein A (May 2005). «The clinical neuropsychiatry of multiple sclerosis». CNS Spectrums. 10 (5): 362. doi:10.1017/s1092852900022720. PMID 15858453. S2CID 231890354.
- ^ Stadelmann C, Brück W (November 2004). «Lessons from the neuropathology of atypical forms of multiple sclerosis». Neurological Sciences. 25 (Suppl 4): S319–S322. doi:10.1007/s10072-004-0333-1. PMID 15727225. S2CID 21212935.
- ^ Fujihara K (June 2019). «Neuromyelitis optica spectrum disorders: still evolving and broadening». Current Opinion in Neurology (Review). 32 (3): 385–394. doi:10.1097/WCO.0000000000000694. PMC 6522202. PMID 30893099.
- ^ Rae-Grant A, Day GS, Marrie RA, Rabinstein A, Cree BA, Gronseth GS, et al. (April 2018). «Practice guideline recommendations summary: Disease-modifying therapies for adults with multiple sclerosis: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology». Neurology. 90 (17): 777–788. doi:10.1212/WNL.0000000000005347. PMID 29686116.
- ^ Burton JM, O’Connor PW, Hohol M, Beyene J (December 2012). «Oral versus intravenous steroids for treatment of relapses in multiple sclerosis». The Cochrane Database of Systematic Reviews. 12: CD006921. doi:10.1002/14651858.CD006921.pub3. PMID 23235634.
- ^ Filippini G, Brusaferri F, Sibley WA, et al. (2000). «Corticosteroids or ACTH for acute exacerbations in multiple sclerosis». Cochrane Database Syst Rev (4): CD001331. doi:10.1002/14651858.CD001331. PMID 11034713.
- ^ The National Collaborating Centre for Chronic Conditions (2004). «Treatment of acute episodes». Multiple sclerosis : national clinical guideline for diagnosis and management in primary and secondary care. London: Royal College of Physicians. pp. 54–58. ISBN 1-86016-182-0. PMID 21290636. Archived from the original on 10 February 2023. Retrieved 5 October 2021.
- ^ Petzold A, Braithwaite T, van Oosten BW (January 2020). «Case for a new corticosteroid treatment trial in optic neuritis: review of updated evidence». J. Neurol. Neurosurg. Psychiatry (Review). 91 (1): 9–14. doi:10.1136/jnnp-2019-321653. PMC 6952848. PMID 31740484.
- ^ a b He D, Zhang C, Zhao X, Zhang Y, Dai Q, Li Y, Chu L (March 2016). «Teriflunomide for multiple sclerosis». The Cochrane Database of Systematic Reviews. 3: CD009882. doi:10.1002/14651858.CD009882.pub3. PMID 27003123.
- ^ a b Rice GP, Incorvaia B, Munari L, et al. (2001). «Interferon in relapsing-remitting multiple sclerosis». Cochrane Database Syst Rev. 2001 (4): CD002002. doi:10.1002/14651858.CD002002. PMC 7017973. PMID 11687131.
- ^ Hassan-Smith G, Douglas MR (November 2011). «Management and prognosis of multiple sclerosis». British Journal of Hospital Medicine. 72 (11): M174-6. doi:10.12968/hmed.2011.72.Sup11.M174. PMID 22082979.
- ^ Freedman MS (January 2011). «Long-term follow-up of clinical trials of multiple sclerosis therapies». Neurology. 76 (1 Suppl 1): S26-34. doi:10.1212/WNL.0b013e318205051d. PMID 21205679. S2CID 16929304.
- ^ Qizilbash N, Mendez I, Sanchez-de la Rosa R (January 2012). «Benefit-risk analysis of glatiramer acetate for relapsing-remitting and clinically isolated syndrome multiple sclerosis». Clinical Therapeutics. 34 (1): 159–176.e5. doi:10.1016/j.clinthera.2011.12.006. PMID 22284996.
- ^ Bates D (January 2011). «Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials». Neurology. 76 (1 Suppl 1): S14-25. doi:10.1212/WNL.0b013e3182050388. PMID 21205678. S2CID 362182.
- ^ Clerico M, Faggiano F, Palace J, et al. (April 2008). «Recombinant interferon beta or glatiramer acetate for delaying conversion of the first demyelinating event to multiple sclerosis». Cochrane Database Syst Rev (2): CD005278. doi:10.1002/14651858.CD005278.pub3. PMID 18425915.
- ^ Johnston J, So TY (June 2012). «First-line disease-modifying therapies in paediatric multiple sclerosis: a comprehensive overview». Drugs. 72 (9): 1195–211. doi:10.2165/11634010-000000000-00000. PMID 22642799. S2CID 20323687.
- ^ a b La Mantia L, Tramacere I, Firwana B, et al. (April 2016). «Fingolimod for relapsing-remitting multiple sclerosis». Cochrane Database Syst Rev. 4: CD009371. doi:10.1002/14651858.CD009371.pub2. PMID 27091121.
- ^ a b Xu Z, Zhang F, Sun F, et al. (April 2015). «Dimethyl fumarate for multiple sclerosis». Cochrane Database Syst Rev (4): CD011076. doi:10.1002/14651858.CD011076.pub2. PMID 25900414.
- ^ a b c d Killestein J, Rudick RA, Polman CH (November 2011). «Oral treatment for multiple sclerosis». The Lancet. Neurology. 10 (11): 1026–34. doi:10.1016/S1474-4422(11)70228-9. PMID 22014437. S2CID 206160178.
- ^ Filippini G, Del Giovane C, Clerico M, et al. (April 2017). «Treatment with disease-modifying drugs for people with a first clinical attack suggestive of multiple sclerosis». Cochrane Database Syst Rev. 4 (4): CD012200. doi:10.1002/14651858.CD012200.pub2. PMC 6478290. PMID 28440858.
- ^ a b c d Filippini G, Del Giovane C, Vacchi L, et al. (June 2013). «Immunomodulators and immunosuppressants for multiple sclerosis: a network meta-analysis» (PDF). Cochrane Database Syst Rev (6): CD008933. doi:10.1002/14651858.CD008933.pub2. PMID 23744561. Archived (PDF) from the original on 5 October 2021. Retrieved 5 October 2021.
- ^ La Mantia L, Di Pietrantonj C, Rovaris M, et al. (November 2016). «Interferons-beta versus glatiramer acetate for relapsing-remitting multiple sclerosis». Cochrane Database Syst Rev. 2016 (11): CD009333. doi:10.1002/14651858.CD009333.pub3. PMC 6464642. PMID 27880972.
- ^ a b c Tramacere I, Del Giovane C, Salanti G, D’Amico R, Filippini G (September 2015). «Immunomodulators and immunosuppressants for relapsing-remitting multiple sclerosis: a network meta-analysis». Cochrane Database Syst Rev. 2015 (9): CD011381. doi:10.1002/14651858.CD011381.pub2. hdl:11380/1082490. PMC 9235409. PMID 26384035.
- ^ «TG Therapeutics Announces FDA Approval of Briumvi (ublituximab-xiiy)» (Press release). TG Therapeutics. 28 December 2022. Archived from the original on 28 December 2022. Retrieved 29 December 2022 – via GlobeNewswire.
- ^ Bope ET, Kellerman RD (22 December 2011). Conn’s Current Therapy 2012: Expert Consult – Online and Print. Elsevier Health Sciences. pp. 662–. ISBN 978-1-4557-0738-6.
- ^ a b Martinelli Boneschi F, Vacchi L, Rovaris M, Capra R, Comi G (May 2013). «Mitoxantrone for multiple sclerosis». The Cochrane Database of Systematic Reviews. 5 (5): CD002127. doi:10.1002/14651858.CD002127.pub3. hdl:2434/533488. PMID 23728638.
- ^ Marriott JJ, Miyasaki JM, Gronseth G, O’Connor PW (May 2010). «Evidence Report: The efficacy and safety of mitoxantrone (Novantrone) in the treatment of multiple sclerosis: Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology». Neurology. 74 (18): 1463–70. doi:10.1212/WNL.0b013e3181dc1ae0. PMC 2871006. PMID 20439849.
- ^ a b Faissner S, Gold R (2019). «Progressive multiple sclerosis: latest therapeutic developments and future directions». Ther Adv Neurol Disord. 12: 1756286419878323. doi:10.1177/1756286419878323. PMC 6764045. PMID 31598138.
- ^ Winslow R (28 March 2017). «After 40-year odyssey, first drug for aggressive MS wins FDA approval». STAT. Archived from the original on 1 April 2017.
- ^ a b «Ocrevus- ocrelizumab injection». DailyMed. 13 December 2019. Archived from the original on 27 June 2020. Retrieved 26 March 2020.
- ^ «BLA Approval Letter» (PDF). FDA. 28 March 2017. Archived (PDF) from the original on 2 April 2017.
- ^ Lin, Mengbing; Zhang, Jian; Zhang, Yueling; Luo, Jiefeng; Shi, Shengliang (18 May 2022). Cochrane Multiple Sclerosis and Rare Diseases of the CNS Group (ed.). «Ocrelizumab for multiple sclerosis». Cochrane Database of Systematic Reviews. 2022 (5): CD013247. doi:10.1002/14651858.CD013247.pub2. PMC 9115862. PMID 35583174.
- ^ Penner, IK; Schreiber, H (2023). Fatigue in Multiple Sclerosis. Springer, Cham. ISBN 978-3-031-13498-2.
- ^ a b Balak DM, Hengstman GJ, Çakmak A, Thio HB (December 2012). «Cutaneous adverse events associated with disease-modifying treatment in multiple sclerosis: a systematic review». Multiple Sclerosis. 18 (12): 1705–17. doi:10.1177/1352458512438239. hdl:1765/73097. PMID 22371220. S2CID 20343951. Archived from the original on 24 January 2021. Retrieved 5 September 2019.
- ^ Sládková T, Kostolanský F (2006). «The role of cytokines in the immune response to influenza A virus infection». Acta Virologica. 50 (3): 151–62. PMID 17131933.
- ^ La Mantia L, Munari LM, Lovati R (May 2010). «Glatiramer acetate for multiple sclerosis». The Cochrane Database of Systematic Reviews (5): CD004678. doi:10.1002/14651858.CD004678.pub2. PMID 20464733.
- ^ Tremlett H, Oger J (November 2004). «Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis». Journal of Neurology. 251 (11): 1297–303. doi:10.1007/s00415-004-0619-5. PMID 15592724. S2CID 12529733.
- ^ Comi G (October 2009). «Treatment of multiple sclerosis: role of natalizumab». Neurological Sciences. 30. 30 (S2): S155-8. doi:10.1007/s10072-009-0147-2. PMID 19882365. S2CID 25910077.
- ^ Hunt D, Giovannoni G (February 2012). «Natalizumab-associated progressive multifocal leucoencephalopathy: a practical approach to risk profiling and monitoring». Practical Neurology. 12 (1): 25–35. doi:10.1136/practneurol-2011-000092. PMID 22258169. S2CID 46326042.
- ^ «Biogen Idec’s TECFIDERA™ (Dimethyl Fumarate) Approved in US as a First-Line Oral Treatment for Multiple Sclerosis» (Press release). Biogen Idec. 27 March 2013. Archived from the original on 12 May 2013. Retrieved 4 June 2013.
- ^ «NDA 204063 – FDA Approved Labeling Text» (PDF). US Food and Drug Agency. 27 March 2013. Archived (PDF) from the original on 4 October 2013. Retrieved 5 April 2013.
«NDA Approval» (PDF). US Food and Drug Agency. 27 March 2013. Archived (PDF) from the original on 4 October 2013. Retrieved 5 April 2013. - ^ Kesselring J, Beer S (October 2005). «Symptomatic therapy and neurorehabilitation in multiple sclerosis». The Lancet. Neurology. 4 (10): 643–52. doi:10.1016/S1474-4422(05)70193-9. PMID 16168933. S2CID 28253186.
- ^ Khan F, Turner-Stokes L, Ng L, Kilpatrick T (April 2007). Khan F (ed.). «Multidisciplinary rehabilitation for adults with multiple sclerosis». The Cochrane Database of Systematic Reviews. 2011 (2): CD006036. doi:10.1002/14651858.CD006036.pub2. PMC 8992048. PMID 17443610.
- ^ Köpke S, Solari A, Rahn A, Khan F, Heesen C, Giordano A (October 2018). «Information provision for people with multiple sclerosis». The Cochrane Database of Systematic Reviews. 10 (10): CD008757. doi:10.1002/14651858.CD008757.pub3. PMC 6517040. PMID 30317542.
- ^ Steultjens EM, Dekker J, Bouter LM, Leemrijse CJ, van den Ende CH (May 2005). «Evidence of the efficacy of occupational therapy in different conditions: an overview of systematic reviews» (PDF). Clinical Rehabilitation. 19 (3): 247–54. doi:10.1191/0269215505cr870oa. hdl:1871/26505. PMID 15859525. S2CID 18785849. Archived (PDF) from the original on 4 August 2020. Retrieved 24 September 2019.
- ^ Steultjens EM, Dekker J, Bouter LM, Cardol M, Van de Nes JC, Van den Ende CH (2003). Steultjens EE (ed.). «Occupational therapy for multiple sclerosis» (PDF). The Cochrane Database of Systematic Reviews. 2010 (3): CD003608. doi:10.1002/14651858.CD003608. PMC 9022193. PMID 12917976. Archived (PDF) from the original on 28 April 2022. Retrieved 5 October 2021.
- ^ Amatya B, Khan F, Galea M (January 2019). «Rehabilitation for people with multiple sclerosis: an overview of Cochrane Reviews». The Cochrane Database of Systematic Reviews. 1 (1): CD012732. doi:10.1002/14651858.CD012732.pub2. PMC 6353175. PMID 30637728.
- ^ Heine M, van de Port I, Rietberg MB, van Wegen EE, Kwakkel G (September 2015). «Exercise therapy for fatigue in multiple sclerosis». The Cochrane Database of Systematic Reviews. 2015 (9): CD009956. doi:10.1002/14651858.CD009956.pub2. PMC 9554249. PMID 26358158.
- ^ Gallien P, Nicolas B, Robineau S, Pétrilli S, Houedakor J, Durufle A (July 2007). «Physical training and multiple sclerosis». Annales de Réadaptation et de Médecine Physique. 50 (6): 373–6, 369–72. doi:10.1016/j.annrmp.2007.04.004. PMID 17482708.
- ^ Rietberg MB, Brooks D, Uitdehaag BM, Kwakkel G (January 2005). Kwakkel G (ed.). «Exercise therapy for multiple sclerosis». The Cochrane Database of Systematic Reviews. 2005 (1): CD003980. doi:10.1002/14651858.CD003980.pub2. PMC 6485797. PMID 15674920.
- ^ Thomas PW, Thomas S, Hillier C, Galvin K, Baker R (January 2006). Thomas PW (ed.). «Psychological interventions for multiple sclerosis». The Cochrane Database of Systematic Reviews. 2010 (1): CD004431. doi:10.1002/14651858.CD004431.pub2. PMC 8406851. PMID 16437487.
- ^ Rosti-Otajärvi EM, Hämäläinen PI (February 2014). «Neuropsychological rehabilitation for multiple sclerosis». The Cochrane Database of Systematic Reviews (2): CD009131. doi:10.1002/14651858.CD009131.pub3. PMID 24515630.
- ^ Latorraca CO, Martimbianco AL, Pachito DV, Torloni MR, Pacheco RL, Pereira JG, Riera R (October 2019). «Palliative care interventions for people with multiple sclerosis». The Cochrane Database of Systematic Reviews. 2019 (10): CD012936. doi:10.1002/14651858.CD012936.pub2. PMC 6803560. PMID 31637711.
- ^ Hayes S, Galvin R, Kennedy C, Finlayson M, McGuigan C, Walsh CD, Coote S (November 2019). «Interventions for preventing falls in people with multiple sclerosis». The Cochrane Database of Systematic Reviews. 11 (11): CD012475. doi:10.1002/14651858.CD012475.pub2. PMC 6953359. PMID 31778221.
- ^ van den Akker LE, Beckerman H, Collette EH, Eijssen IC, Dekker J, de Groot V (November 2016). «Effectiveness of cognitive behavioral therapy for the treatment of fatigue in patients with multiple sclerosis: A systematic review and meta-analysis». Journal of Psychosomatic Research. 90: 33–42. doi:10.1016/j.jpsychores.2016.09.002. PMID 27772557.
- ^ Amatya B, Young J, Khan F (December 2018). «Non-pharmacological interventions for chronic pain in multiple sclerosis». The Cochrane Database of Systematic Reviews. 12 (12): CD012622. doi:10.1002/14651858.CD012622.pub2. PMC 6516893. PMID 30567012.
- ^ Corvillo I, Varela E, Armijo F, Alvarez-Badillo A, Armijo O, Maraver F (December 2017). «Efficacy of aquatic therapy for multiple sclerosis: a systematic review». Eur J Phys Rehabil Med (Review). 53 (6): 944–952. doi:10.23736/S1973-9087.17.04570-1. PMID 28215060.
- ^ Khan F, Amatya B, Bensmail D, Yelnik A (July 2019). «Non-pharmacological interventions for spasticity in adults: An overview of systematic reviews». Ann Phys Rehabil Med. 62 (4): 265–273. doi:10.1016/j.rehab.2017.10.001. PMID 29042299. S2CID 207497395.
- ^ Etoom M, Khraiwesh Y, Lena F, et al. (November 2018). «Effectiveness of Physiotherapy Interventions on Spasticity in People With Multiple Sclerosis: A Systematic Review and Meta-Analysis». Am J Phys Med Rehabil. 97 (11): 793–807. doi:10.1097/PHM.0000000000000970. PMID 29794531. S2CID 44156766.
- ^ Olsen SA (2009). «A review of complementary and alternative medicine (CAM) by people with multiple sclerosis». Occupational Therapy International. 16 (1): 57–70. doi:10.1002/oti.266. PMID 19222053.
- ^ Parks NE, Jackson-Tarlton CS, Vacchi L, Merdad R, Johnston BC (May 2020). «Dietary interventions for multiple sclerosis-related outcomes». The Cochrane Database of Systematic Reviews. 2020 (5): CD004192. doi:10.1002/14651858.CD004192.pub4. PMC 7388136. PMID 32428983.
- ^ Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M (November 2011). «N-acetylglucosamine inhibits T-helper 1 (Th1)/T-helper 17 (Th17) cell responses and treats experimental autoimmune encephalomyelitis». The Journal of Biological Chemistry. 286 (46): 40133–41. doi:10.1074/jbc.M111.277814. PMC 3220534. PMID 21965673.
- ^ Pozuelo-Moyano B, Benito-León J, Mitchell AJ, Hernández-Gallego J (2013). «A systematic review of randomized, double-blind, placebo-controlled trials examining the clinical efficacy of vitamin D in multiple sclerosis». Neuroepidemiology (Systematic review). 40 (3): 147–53. doi:10.1159/000345122. PMC 3649517. PMID 23257784.
the available evidence substantiates neither clinically significant benefit nor harm from vitamin D in the treatment of patients with MS
- ^ Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E (October 2006). «Cannabis use in patients with multiple sclerosis». Multiple Sclerosis. 12 (5): 646–51. doi:10.1177/1352458506070947. PMID 17086912. S2CID 34692470.
- ^ Torres-Moreno MC, Papaseit E, Torrens M, Farré M (October 2018). «Assessment of Efficacy and Tolerability of Medicinal Cannabinoids in Patients With Multiple Sclerosis: A Systematic Review and Meta-analysis». JAMA Network Open. 1 (6): e183485. doi:10.1001/jamanetworkopen.2018.3485. PMC 6324456. PMID 30646241.
- ^ Bennett M, Heard R (2004). Bennett MH (ed.). «Hyperbaric oxygen therapy for multiple sclerosis». The Cochrane Database of Systematic Reviews. 2011 (1): CD003057. doi:10.1002/14651858.CD003057.pub2. PMC 8407327. PMID 14974004.
- ^ Adams T (23 May 2010). «Gut instinct: the miracle of the parasitic hookworm». The Observer. Archived from the original on 24 October 2014.
- ^ Simpson R, Booth J, Lawrence M, Byrne S, Mair F, Mercer S (January 2014). «Mindfulness based interventions in multiple sclerosis—a systematic review». BMC Neurology. 14: 15. doi:10.1186/1471-2377-14-15. PMC 3900731. PMID 24438384.
- ^ Jagannath VA, Filippini G, Di Pietrantonj C, Asokan GV, Robak EW, Whamond L, Robinson SA (September 2018). «Vitamin D for the management of multiple sclerosis». The Cochrane Database of Systematic Reviews. 9 (9): CD008422. doi:10.1002/14651858.CD008422.pub3. PMC 6513642. PMID 30246874.
- ^ Motte J, Gold R (December 2020). «High-dose biotin in multiple sclerosis: the end of the road». Lancet Neurol. 19 (12): 965–966. doi:10.1016/S1474-4422(20)30353-7. PMID 33222766. S2CID 225049079.
- ^ Tryfonos C, Mantzorou M, Fotiou D, Vrizas M, Vadikolias K, Pavlidou E, Giaginis C (September 2019). «Dietary Supplements on Controlling Multiple Sclerosis Symptoms and Relapses: Current Clinical Evidence and Future Perspectives». Medicines. 6 (3): 95. doi:10.3390/medicines6030095. PMC 6789617. PMID 31547410.
- ^ Sedel F, Bernard D, Mock DM, Tourbah A (November 2016). «Targeting demyelination and virtual hypoxia with high-dose biotin as a treatment for progressive multiple sclerosis». Neuropharmacology. 110 (Pt B): 644–653. doi:10.1016/j.neuropharm.2015.08.028. PMID 26327679.
- ^ Goldschmidt CH, Cohen JA (July 2020). «The Rise and Fall of High-Dose Biotin to Treat Progressive Multiple Sclerosis». Neurotherapeutics. 17 (3): 968–970. doi:10.1007/s13311-020-00907-5. PMC 7609671. PMID 32761325.
- ^ a b c Cree BA, Hartung HP, Barnett M (June 2022). «New drugs for multiple sclerosis: new treatment algorithms». Curr Opin Neurol. 35 (3): 262–270. doi:10.1097/WCO.0000000000001063. PMID 35674067. S2CID 249438715.
- ^ a b c d Oh J, Vidal-Jordana A, Montalban X (December 2018). «Multiple sclerosis: clinical aspects». Curr Opin Neurol. 31 (6): 752–759. doi:10.1097/WCO.0000000000000622. PMID 30300239. S2CID 6103857.
- ^ Hauser SL, Cree BA (December 2020). «Treatment of Multiple Sclerosis: A Review». Am J Med. 133 (12): 1380–1390.e2. doi:10.1016/j.amjmed.2020.05.049. PMC 7704606. PMID 32682869.
- ^ a b Ontaneda D (June 2019). «Progressive Multiple Sclerosis». Continuum (Minneap Minn). 25 (3): 736–752. doi:10.1212/CON.0000000000000727. PMID 31162314. S2CID 174808956.
- ^ Inojosa H, Proschmann U, Akgün K, Ziemssen T (April 2021). «A focus on secondary progressive multiple sclerosis (SPMS): challenges in diagnosis and definition». J Neurol. 268 (4): 1210–1221. doi:10.1007/s00415-019-09489-5. PMID 31363847. S2CID 198999832. Expanded Disability Status Scale (EDSS) 6.0 is equivalent to requiring a walking aid, and EDSS 8.0 equivalent to chair or bedbound
- ^ a b c Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O (April 2018). «Multiple sclerosis». Lancet. 391 (10130): 1622–1636. doi:10.1016/S0140-6736(18)30481-1. PMID 29576504. S2CID 4313310.
- ^ Lunde, Hanne Marie Bøe; Assmus, Jörg; Myhr, Kjell-Morten; Bø, Lars; Grytten, Nina (2017). «Survival and cause of death in multiple sclerosis: a 60-year longitudinal population study». Journal of Neurology, Neurosurgery & Psychiatry. 88 (8): 621–625. doi:10.1136/jnnp-2016-315238. ISSN 0022-3050. PMC 5537547. PMID 28365589.
- ^ Multiple Sclerosis International Federation (September 2020). «Atlas of MS» (PDF).
- ^ a b Compston A (October 1988). «The 150th anniversary of the first depiction of the lesions of multiple sclerosis». Journal of Neurology, Neurosurgery, and Psychiatry. 51 (10): 1249–52. doi:10.1136/jnnp.51.10.1249. PMC 1032909. PMID 3066846.
- ^ Lassmann H (October 1999). «The pathology of multiple sclerosis and its evolution». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 354 (1390): 1635–40. doi:10.1098/rstb.1999.0508. PMC 1692680. PMID 10603616.
- ^ Lassmann H (July 2005). «Multiple sclerosis pathology: evolution of pathogenetic concepts». Brain Pathology. 15 (3): 217–22. doi:10.1111/j.1750-3639.2005.tb00523.x. PMC 8095927. PMID 16196388. S2CID 8342303.
- ^ a b c Milo R, Miller A (April 2014). «Revised diagnostic criteria of multiple sclerosis». Autoimmunity Reviews. 13 (4–5): 518–524. doi:10.1016/j.autrev.2014.01.012. PMID 24424194.
- ^ a b Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M, Fujihara K, Havrdova E, Hutchinson M, Kappos L, Lublin FD, Montalban X, O’Connor P, Sandberg-Wollheim M, Thompson AJ, Waubant E, Weinshenker B, Wolinsky JS (February 2011). «Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria». Annals of Neurology. 69 (2): 292–302. doi:10.1002/ana.22366. PMC 3084507. PMID 21387374.
- ^ Lublin FD, Reingold SC, Cohen JA, Cutter GR, Sørensen PS, Thompson AJ, Wolinsky JS, Balcer LJ, Banwell B, Barkhof F, Bebo B, Calabresi PA, Clanet M, Comi G, Fox RJ, Freedman MS, Goodman AD, Inglese M, Kappos L, Kieseier BC, Lincoln JA, Lubetzki C, Miller AE, Montalban X, O’Connor PW, Petkau J, Pozzilli C, Rudick RA, Sormani MP, Stüve O, Waubant E, Polman CH (July 2014). «Defining the clinical course of multiple sclerosis: the 2013 revisions». Neurology. 83 (3): 278–86. doi:10.1212/WNL.0000000000000560. PMC 4117366. PMID 24871874.
- ^ Sørensen PS, Centonze D, Giovannoni G, Montalban X, Selchen D, Vermersch P, et al. (24 June 2020). «Expert opinion on the use of cladribine tablets in clinical practice». Therapeutic Advances in Neurological Disorders. 13: 1756286420935019. doi:10.1177/1756286420935019. PMC 7318823. PMID 32636933.
- ^ Medaer R (September 1979). «Does the history of multiple sclerosis go back as far as the 14th century?». Acta Neurologica Scandinavica. 60 (3): 189–92. doi:10.1111/j.1600-0447.1979.tb08970.x. PMID 390966. S2CID 221422840.
- ^ Holmøy T (2006). «A Norse contribution to the history of neurological diseases». European Neurology. 55 (1): 57–8. doi:10.1159/000091431. PMID 16479124.
- ^ Firth D (1948). The Case of August D’Esté. Cambridge: Cambridge University Press.
- ^ a b Pearce JM (2005). «Historical descriptions of multiple sclerosis». European Neurology. 54 (1): 49–53. doi:10.1159/000087387. PMID 16103678.
- ^ Barbellion WN (1919). The Journal of a Disappointed Man. New York: George H. Doran. ISBN 0-7012-1906-8.
- ^ Bar-Or A, Pender MP, Khanna R, Steinman L, Hartung HP, Maniar T, et al. (March 2020). «Epstein-Barr Virus in Multiple Sclerosis: Theory and Emerging Immunotherapies». Trends in Molecular Medicine. 26 (3): 296–310. doi:10.1016/j.molmed.2019.11.003. PMC 7106557. PMID 31862243.
- ^ DeLorenze GN, Munger KL, Lennette ET, Orentreich N, Vogelman JH, Ascherio A (June 2006). «Epstein-Barr virus and multiple sclerosis: evidence of association from a prospective study with long-term follow-up». Archives of Neurology. 63 (6): 839–844. doi:10.1001/archneur.63.6.noc50328. PMID 16606758.
- ^ Hauser SL, Bar-Or A, Comi G, Giovannoni G, Hartung HP, Hemmer B, et al. (January 2017). «Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis». The New England Journal of Medicine. 376 (3): 221–234. doi:10.1056/NEJMoa1601277. PMID 28002679. S2CID 205099904.
- ^ Lanz TV, Brewer RC, Ho PP, Moon JS, Jude KM, Fernandez D, et al. (March 2022). «Clonally expanded B cells in multiple sclerosis bind EBV EBNA1 and GlialCAM». Nature. 603 (7900): 321–327. doi:10.1038/s41586-022-04432-7. PMC 9382663. PMID 35073561.
- ^ Yang C, Hao Z, Zhang L, Zeng L, Wen J (October 2015). «Sodium channel blockers for neuroprotection in multiple sclerosis». The Cochrane Database of Systematic Reviews. 2015 (10): CD010422. doi:10.1002/14651858.CD010422.pub2. PMC 9242538. PMID 26486929.
- ^ a b Misu T, Fujihara K (February 2019). «Neuromyelitis optica spectrum and myelin oligodendrocyte glycoprotein antibody‐related disseminated encephalomyelitis». Clinical and Experimental Neuroimmunology. 10 (1): 9–17. doi:10.1111/cen3.12491.
- ^ Kira JI, Yamasaki R, Ogata H (2019). «Anti-neurofascin autoantibody and demyelination». Neurochemistry International. 130: 104360. doi:10.1016/j.neuint.2018.12.011. PMID 30582947.
- ^ Popescu BF, Pirko I, Lucchinetti CF (August 2013). «Pathology of multiple sclerosis: where do we stand?». Continuum (Minneapolis, Minn.). 19 (4 Multiple Sclerosis): 901–21. doi:10.1212/01.CON.0000433291.23091.65. PMC 3915566. PMID 23917093.
- ^ Mehta V, Pei W, Yang G, Li S, Swamy E, Boster A, Schmalbrock P, Pitt D (2013). «Iron is a sensitive biomarker for inflammation in multiple sclerosis lesions». PLOS ONE. 8 (3): e57573. Bibcode:2013PLoSO…857573M. doi:10.1371/journal.pone.0057573. PMC 3597727. PMID 23516409.
- ^ Khalil M, Teunissen CE, Otto M, Piehl F, Sormani MP, Gattringer T, et al. (October 2018). «Neurofilaments as biomarkers in neurological disorders» (PDF). Nature Reviews. Neurology. 14 (10): 577–589. doi:10.1038/s41582-018-0058-z. PMID 30171200. S2CID 52140127. Archived (PDF) from the original on 24 January 2021. Retrieved 19 September 2020.
- ^ Petzold A (June 2005). «Neurofilament phosphoforms: surrogate markers for axonal injury, degeneration and loss» (PDF). Journal of the Neurological Sciences. 233 (1–2): 183–98. doi:10.1016/j.jns.2005.03.015. PMID 15896809. S2CID 18311152. Archived (PDF) from the original on 22 September 2017. Retrieved 19 September 2020.
- ^ a b c d Filippi M, Rocca MA, De Stefano N, Enzinger C, Fisher E, Horsfield MA, Inglese M, Pelletier D, Comi G (December 2011). «Magnetic resonance techniques in multiple sclerosis: the present and the future». Archives of Neurology. 68 (12): 1514–20. doi:10.1001/archneurol.2011.914. PMID 22159052.
- ^ Swanberg KM, Landheer K, Pitt D, Juchem C (2019). «Quantifying the Metabolic Signature of Multiple Sclerosis by in vivo Proton Magnetic Resonance Spectroscopy: Current Challenges and Future Outlook in the Translation From Proton Signal to Diagnostic Biomarker». Frontiers in Neurology. 10: 1173. doi:10.3389/fneur.2019.01173. PMC 6876616. PMID 31803127.
- ^ Moghadasi AN, Mirmosayyeb O, Barzegar M, Sahraian MA, Ghajarzadeh M (August 2021). «The prevalence of COVID-19 infection in patients with multiple sclerosis (MS): a systematic review and meta-analysis». Neurol Sci. 42 (8): 3093–3099. doi:10.1007/s10072-021-05373-1. PMC 8184129. PMID 34100130.
- ^ Prinz M (3 November 2017). «Faculty Opinions recommendation of Gut microbiota from multiple sclerosis patients enables spontaneous autoimmune encephalomyelitis in mice». Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature. doi:10.3410/f.731077576.793538553.
- ^ Aranow C (August 2011). «Vitamin D and the immune system». Journal of Investigative Medicine. 59 (6): 881–886. doi:10.2310/jim.0b013e31821b8755. PMC 3166406. PMID 21527855.
- ^ Tada T, Takemori T, Okumura K, Nonaka M, Tokuhisa T (February 1978). «Two distinct types of helper T cells involved in the secondary antibody response: independent and synergistic effects of Ia- and Ia+ helper T cells». The Journal of Experimental Medicine. 147 (2): 446–458. doi:10.1084/jem.147.2.446. PMC 2184496. PMID 415110.
- ^ Lassmann H (March 2018). «Multiple Sclerosis Pathology». Cold Spring Harbor Perspectives in Medicine. 8 (3): a028936. doi:10.1101/cshperspect.a028936. PMC 5830904. PMID 29358320.
- ^ «Pathogenesis of HIV-Associated Dementia and Multiple Sclerosis: Role of Microglia and Astrocytes», The Role of Glia in Neurotoxicity, CRC Press, pp. 283–298, 28 December 2004, doi:10.1201/9781420039740-21, ISBN 9780429128608
External links[edit]
- Multiple sclerosis at Curlie
- Database for analysis and comparison of global data on the epidemiology of MS
| Multiple sclerosis | |
|---|---|
| Other names | Multiple cerebral sclerosis, multiple cerebro-spinal sclerosis, disseminated sclerosis, encephalomyelitis disseminata |
 |
|
| CD68-stained tissue shows several macrophages in the area of a demyelinated lesion caused by MS. | |
| Specialty | Neurology |
| Symptoms | Variable, including almost any neurological symptom or sign, with autonomic, visual, motor, and sensory problems being the most common.[1] |
| Usual onset | Age 20–50[2] |
| Duration | Long term[3] |
| Causes | Unknown[4] |
| Diagnostic method | Based on symptoms and medical tests[5] |
| Treatment | Disease-Modifying Therapies [6]
Physiotherapy [7] Occupational Therapy [7] |
| Frequency | 0.032% (world) |
Multiple sclerosis (MS) is the most common demyelinating disease,[8] in which the insulating covers of nerve cells in the brain and spinal cord are damaged.[3] This damage disrupts the ability of parts of the nervous system to transmit signals, resulting in a range of signs and symptoms, including physical, mental, and sometimes psychiatric problems.[1][9][10] Specific symptoms can include double vision, blindness in one eye, muscle weakness, and trouble with sensation or coordination.[3][11][12] MS takes several forms, with new symptoms either occurring in isolated attacks (relapsing forms) or building up over time (progressive forms).[13][14] In the relapsing forms of MS, between attacks, symptoms may disappear completely, although some permanent neurological problems often remain, especially as the disease advances.[14]
While the cause is unclear, the underlying mechanism is thought to be either destruction by the immune system or failure of the myelin-producing cells.[4] Proposed causes for this include genetics and environmental factors, such as viral infections.[15][9][16] MS is usually diagnosed based on the presenting signs and symptoms and the results of supporting medical tests.[5]
No cure for multiple sclerosis is known.[3] Treatments attempt to improve function after an attack and prevent new attacks.[9] Physical therapy[7] and occupational therapy[17] can help with people’s ability to function. Many people pursue alternative treatments, despite a lack of evidence of benefit.[18] The long-term outcome is difficult to predict; better outcomes are more often seen in women, those who develop the disease early in life, those with a relapsing course, and those who initially experienced few attacks.[19]
Multiple sclerosis is the most common immune-mediated disorder affecting the central nervous system.[20] Nearly one million people have MS in the United States in 2022,[21] and in 2020, about 2.8 million people were affected globally, with rates varying widely in different regions and among different populations.[22] The disease usually begins between the ages of 20 and 50 and is twice as common in women as in men.[2] MS was first described in 1868 by French neurologist Jean-Martin Charcot.[23] The name «multiple sclerosis» is short for multiple cerebro-spinal sclerosis, which refers to the numerous glial scars (or sclerae – essentially plaques or lesions) that develop on the white matter of the brain and spinal cord.[23]
Signs and symptoms[edit]
Main symptoms of multiple sclerosis
A person with MS can have almost any neurological symptom or sign, with autonomic, visual, motor, and sensory problems being the most common.[1] The specific symptoms are determined by the locations of the lesions within the nervous system, and may include loss of sensitivity or changes in sensation, such as tingling, pins and needles, or numbness; muscle weakness, blurred vision,[24] pronounced reflexes, muscle spasms, difficulty in moving, difficulties with coordination, and balance (ataxia); problems with speech or swallowing, visual problems (nystagmus, optic neuritis, or double vision), feeling tired, acute or chronic pain; and bladder and bowel difficulties (such as neurogenic bladder), among others.[1] When multiple sclerosis is more advanced, walking difficulties can occur and the risk of falling increases.[25]
Difficulties thinking and emotional problems such as depression or unstable mood are also common.[1] The primary deficit in cognitive function that people with MS experience is slowed information-processing speed, with memory also commonly affected, and executive function less commonly. Intelligence, language, and semantic memory are usually preserved, and the level of cognitive impairment varies significantly between people with MS.[26][27][28]
Uhthoff’s phenomenon, a worsening of symptoms due to exposure to higher-than-usual temperatures, and Lhermitte’s sign, an electrical sensation that runs down the back when bending the neck, are particularly characteristic of MS.[1] The main measure of disability and severity is the expanded disability status scale (EDSS), with other measures such as the multiple sclerosis functional composite being increasingly used in research.[29][30][31] EDSS is also correlated with falls in people with MS.[11] While it is a popular measure, EDSS has been criticized for some of its limitations, such as relying too much on walking.[32][11]
The condition begins in 85% of cases as a clinically isolated syndrome (CIS) over a number of days with 45% having motor or sensory problems, 20% having optic neuritis, and 10% having symptoms related to brainstem dysfunction, while the remaining 25% have more than one of the previous difficulties.[5] The course of symptoms occurs in two main patterns initially: either as episodes of sudden worsening that last a few days to months (called relapses, exacerbations, bouts, attacks, or flare-ups) followed by improvement (85% of cases) or as a gradual worsening over time without periods of recovery (10–15% of cases).[2] A combination of these two patterns may also occur[14] or people may start in a relapsing and remitting course that then becomes progressive later on.[2]
Relapses are usually not predictable, occurring without warning.[1] Exacerbations rarely occur more frequently than twice per year.[1] Some relapses, however, are preceded by common triggers and they occur more frequently during spring and summer.[33] Similarly, viral infections such as the common cold, influenza, or gastroenteritis increase their risk.[1] Stress may also trigger an attack.[34] Women with MS who become pregnant experience fewer relapses; however, during the first months after delivery the risk increases.[1] Overall, pregnancy does not seem to influence long-term disability.[1] Many events have been found not to affect relapse rates including vaccination[citation needed], breast feeding,[1] physical trauma,[35] and Uhthoff’s phenomenon.[33]
Prodromal phase[edit]
MS may have a prodromal phase in the years leading up to MS manifestation, characterized by psychiatric issues, cognitive impairment, and increased utilization of healthcare.[36][37]
Causes[edit]
The cause of MS is unknown, but it is believed to occur as a result of some combination of genetic and environmental factors, such as infectious agents.[1]
Infectious agents[edit]
Many microbes have been proposed as triggers of MS.[9] One hypothesis is that infection by a widespread microbe contributes to disease development, and the geographic distribution of this organism significantly influences the epidemiology of MS.[16] Two opposing versions of this hypothesis include the hygiene hypothesis and the prevalence hypothesis, the former being more favored.[16] The hygiene hypothesis proposes that exposure to certain infectious agents early in life is protective; the disease is a response to a late encounter with such agents.[1] The prevalence hypothesis proposes that an early, persistent, and silent infection increases risk of disease, thus the disease is more common where the infectious agent is more common. Only in a few cases and after many years does it cause demyelination.[16][38] Evidence for a virus as a cause include the presence of oligoclonal bands in the brain and cerebrospinal fluid of most people with MS, the association of several viruses with human demyelinating encephalomyelitis, and the occurrence of demyelination in animals caused by some viral infections.[39]
Epstein-Barr herpes virus (EBV) can cause infectious mononucleosis and infects about 95% of adults. In combination with other genetic and environmental factors, there is «compelling epidemiological and mechanistic evidence for a causal role of EBV in multiple sclerosis», though only a small proportion of those infected with EBV later develop MS.[40][15][41] A study of individuals in the United States military between 1993 and 2013 (total population greater than 10 million) compared 801 people who developed MS on or after military service to 1,566 matched controls who did not develop MS during this observation period. The study found a 32-fold increased risk of developing MS after infection with EBV. It did not find an increased risk after infection with other viruses, including the similarly transmitted cytomegalovirus. The finding strongly suggests that EBV plays a role in the onset of MS, although EBV alone may be insufficent to cause it.[15][41]
Genetics[edit]
HLA region of chromosome 6: Changes in this area increase the probability of getting MS.
MS is not considered a hereditary disease, but several genetic variations have been shown to increase the risk.[42] Some of these genes appear to have higher levels of expression in microglial cells than expected by chance.[43] The probability of developing the disease is higher in relatives of an affected person, with a greater risk among those more closely related.[9] An identical twin of an affected individual has a 30% chance of developing MS, 5% for a nonidentical twin, 2.5% for a sibling, and an even lower chance for a half sibling.[1][9][44] If both parents are affected, the risk in their children is 10 times that of the general population.[2] MS is also more common in some ethnic groups than others.[45]
Specific genes that have been linked with MS include differences in the human leukocyte antigen (HLA) system—a group of genes on chromosome 6 that serves as the major histocompatibility complex (MHC).[1] That differences in the HLA region are related to susceptibility has been known since the 1980s,[46] and this same region has also been implicated in the development of other autoimmune diseases, such as diabetes type I and systemic lupus erythematosus.[46] The most consistent finding is the association between multiple sclerosis and alleles of the MHC defined as DR15 and DQ6.[1] Other loci have shown a protective effect, such as HLA-C554 and HLA-DRB1*11.[1] HLA differences account for an estimated 20 to 60% of the genetic predisposition.[46] Modern genetic methods (genome-wide association studies) have revealed at least 200 variants outside the HLA locus that modestly increase the probability of MS.[47]
Geography[edit]
MS is more common in people who live farther from the equator, although exceptions exist.[1][48] These exceptions include ethnic groups that are at low risk and that live far from the equator such as the Sami, Amerindians, Canadian Hutterites, New Zealand Māori,[49] and Canada’s Inuit,[2] as well as groups that have a relatively high risk and that live closer to the equator such as Sardinians,[2] inland Sicilians,[50] Palestinians, and Parsi.[49] The cause of this geographical pattern is not clear.[2] While the north–south gradient of incidence is decreasing,[48] as of 2010 it is still present.[2]
MS is more common in regions with northern European populations,[1] so the geographic variation may simply reflect the global distribution of these high-risk populations.[2]
A relationship between season of birth and MS lends support to this idea, with fewer people born in the Northern Hemisphere in November compared to May being affected later in life.[51]
Environmental factors may play a role during childhood, with several studies finding that people who move to a different region of the world before the age of 15 acquire the new region’s risk of MS. If migration takes place after age 15, the persons retain the risk of their home country.[1][52] Some evidence indicates that the effect of moving may still apply to people older than 15.[1]
Other[edit]
Smoking may be an independent risk factor for MS.[53] Stress may be a risk factor, although the evidence to support this is weak.[52] Association with occupational exposures and toxins—mainly organic solvents[54]—has been evaluated, but no clear conclusions have been reached.[52] Vaccinations were studied as causal factors; most studies, though, show no association.[52][55] Several other possible risk factors, such as diet and hormone intake, have been evaluated, but evidence on their relation with the disease is «sparse and unpersuasive».[53] Gout occurs less than would be expected and lower levels of uric acid have been found in people with MS. This has led to the theory that uric acid is protective, although its exact importance remains unknown.[56] Obesity during adolescence and young adulthood is a risk factor for MS.[57]
Pathophysiology[edit]
The three main characteristics of MS are the formation of lesions in the central nervous system (also called plaques), inflammation, and the destruction of myelin sheaths of neurons. These features interact in a complex and not yet fully understood manner to produce the breakdown of nerve tissue, and in turn, the signs and symptoms of the disease.[1]
Cholesterol crystals are believed both to impair myelin repair and aggravate inflammation.[58][59] MS is believed to be an immune-mediated disorder that develops from an interaction of the individual’s genetics and as yet unidentified environmental causes.[9] Damage is believed to be caused, at least in part, by attack on the nervous system by a person’s own immune system.[1]
Lesions[edit]
Demyelination in MS: On Klüver-Barrera myelin staining, decoloration in the area of the lesion can be appreciated.
The name multiple sclerosis refers to the scars (sclerae – better known as plaques or lesions) that form in the nervous system. These lesions most commonly affect the white matter in the optic nerve, brain stem, basal ganglia, and spinal cord, or white matter tracts close to the lateral ventricles.[1] The function of white matter cells is to carry signals between grey matter areas, where the processing is done, and the rest of the body. The peripheral nervous system is rarely involved.[9]
To be specific, MS involves the loss of oligodendrocytes, the cells responsible for creating and maintaining a fatty layer—known as the myelin sheath—which helps the neurons carry electrical signals (action potentials).[1] This results in a thinning or complete loss of myelin, and as the disease advances, the breakdown of the axons of neurons. When the myelin is lost, a neuron can no longer effectively conduct electrical signals.[9] A repair process, called remyelination, takes place in early phases of the disease, but the oligodendrocytes are unable to completely rebuild the cell’s myelin sheath.[60] Repeated attacks lead to successively less effective remyelinations, until a scar-like plaque is built up around the damaged axons.[60] These scars are the origin of the symptoms and during an attack magnetic resonance imaging (MRI) often shows more than 10 new plaques.[1] This could indicate that some number of lesions exist, below which the brain is capable of repairing itself without producing noticeable consequences.[1] Another process involved in the creation of lesions is an abnormal increase in the number of astrocytes due to the destruction of nearby neurons.[1] A number of lesion patterns have been described.[61]
Inflammation[edit]
Apart from demyelination, the other sign of the disease is inflammation. Fitting with an immunological explanation, the inflammatory process is caused by T cells, a kind of lymphocytes that plays an important role in the body’s defenses.[9] T cells gain entry into the brain as a result of disruptions in the blood–brain barrier. The T cells recognize myelin as foreign and attack it, explaining why these cells are also called «autoreactive lymphocytes.»[1]
The attack on myelin starts inflammatory processes, which trigger other immune cells and the release of soluble factors like cytokines and antibodies. A further breakdown of the blood-brain barrier, in turn, causes a number of other damaging effects, such as swelling, activation of macrophages, and more activation of cytokines and other destructive proteins.[9] Inflammation can potentially reduce transmission of information between neurons in at least three ways.[1] The soluble factors released might stop neurotransmission by intact neurons. These factors could lead to or enhance the loss of myelin, or they may cause the axon to break down completely.[1]
Blood–brain barrier[edit]
The blood–brain barrier (BBB) is a part of the capillary system that prevents the entry of T cells into the central nervous system. It may become permeable to these types of cells secondary to an infection by a virus or bacteria. After it repairs itself, typically once the infection has cleared, T cells may remain trapped inside the brain.[9][62] Gadolinium cannot cross a normal BBB, so gadolinium-enhanced MRI is used to show BBB breakdowns.[63]
Diagnosis[edit]
Animation showing dissemination of brain lesions in time and space as demonstrated by monthly MRI studies along a year
Multiple sclerosis as seen on MRI
Multiple sclerosis is typically diagnosed based on the presenting signs and symptoms, in combination with supporting medical imaging and laboratory testing.[5] It can be difficult to confirm, especially early on, since the signs and symptoms may be similar to those of other medical problems.[1][64]
The McDonald criteria, which focus on clinical, laboratory, and radiologic evidence of lesions at different times and in different areas, is the most commonly used method of diagnosis[65] with the Schumacher and Poser criteria being of mostly historical significance.[66]
As of 2017, no single test (including biopsy) can provide a definitive diagnosis.[67]
Magnetic resonance imaging (MRI) of the brain and spine may show areas of demyelination (lesions or plaques). Gadolinium can be administered intravenously as a contrast agent to highlight active plaques, and by elimination, demonstrate the existence of historical lesions not associated with symptoms at the moment of the evaluation.[68][69]
Central vein signs (CVSs) have been proposed as a good indicator of MS in comparison with other conditions causing white lesions.[70][71][72][73] One small study found fewer CVSs in older and hypertensive people.[74] Further research on CVS as a biomarker for MS is ongoing.[75]
Brain atrophy is seen as an indicator of MS.[76][77]
Testing of cerebrospinal fluid obtained from a lumbar puncture can provide evidence of chronic inflammation in the central nervous system. The cerebrospinal fluid is tested for oligoclonal bands of IgG on electrophoresis, which are inflammation markers found in 75–85% of people with MS.[68][78]
Differential diagnosis[edit]
Several diseases present similarly to multiple sclerosis. Intractable vomiting, severe optic neuritis, or bilateral optic neuritis raises suspicion for neuromyelitis optica spectrum disorder (NMOSD).[79] Involvement of multiple cranial nerves raises suspicion for neurosarcoidosis.[79] Longitudinally extensive transverse myelitis (LETM), in which spinal cord damage spans three or more vertebral segments, raises suspicion for NMOSD, neurosarcoidosis, anti-MOG–associated myelitis, systemic rheumatologic disease, or a paraneoplastic disorder.[79]
Types and variants[edit]
Several phenotypes (commonly termed «types»), or patterns of progression, have been described. Phenotypes use the past course of the disease in an attempt to predict the future course. They are important not only for prognosis, but also for treatment decisions.
The International Advisory Committee on Clinical Trials of MS describes four types of MS (revised in 2013) in what is known as the Lublin classification:[80][81]
- Clinically isolated syndrome (CIS)
- Relapsing-remitting MS (RRMS)
- Primary progressive MS (PPMS)
- Secondary progressive MS (SPMS)
RRMS is characterized by unpredictable relapses followed by periods of months to years of relative quiet (remission) with no new signs of disease activity. Deficits that occur during attacks may either resolve or leave problems, the latter in about 40% of attacks and being more common the longer a person has had the disease.[1][5] This describes the initial course of 80% of individuals with MS.[1]
The relapsing-remitting subtype usually begins with a clinically isolated syndrome (CIS). In CIS, a person has an attack suggestive of demyelination, but does not fulfill the criteria for multiple sclerosis.[1][82] 30 to 70% of persons who experience CIS, later develop MS.[82]
PPMS occurs in roughly 10–20% of individuals with the disease, with no remission after the initial symptoms.[5][83] It is characterized by progression of disability from onset, with no, or only occasional and minor, remissions and improvements.[14] The usual age of onset for the primary progressive subtype is later than of the relapsing-remitting subtype. It is similar to the age that secondary progressive usually begins in RRMS, around 40 years of age.[1]
SPMS occurs in around 65% of those with initial RRMS, who eventually have progressive neurologic decline between acute attacks without any definite periods of remission.[1][14] Occasional relapses and minor remissions may appear.[14] The most common length of time between disease onset and conversion from RRMS to SPMS is 19 years.[84]
Special courses[edit]
Independently of the types published by the MS associations, regulatory agencies such as the FDA often consider special courses, trying to reflect some clinical trials results on their approval documents. Some examples could be «highly active MS» (HAMS),[85] «active secondary MS» (similar to the old progressive-relapsing)[86] and «rapidly progressing PPMS».[87]
Also, deficits always resolving between attacks is sometimes referred to as «benign» MS,[88] although people still build up some degree of disability in the long term.[1] On the other hand, the term malignant multiple sclerosis is used to describe people with MS having reached significant level of disability in a short period.[89]
An international panel has published a standardized definition for the course HAMS.[85]
Variants[edit]
Atypical variants of MS have been described; these include tumefactive multiple sclerosis, Balo concentric sclerosis, Schilder’s diffuse sclerosis, and Marburg multiple sclerosis. Debate remains on whether they are MS variants or different diseases.[90] Some diseases previously considered MS variants, such as Devic’s disease, are now considered outside the MS spectrum.[91]
Management[edit]
Although no cure for multiple sclerosis has been found, several therapies have proven helpful. Several effective treatments can significantly decrease the number of attacks and the rate of progression.[21] The primary aims of therapy are returning function after an attack, preventing new attacks, and preventing disability. Starting medications is generally recommended in people after the first attack when more than two lesions are seen on MRI.[92]
The first approved medications used to treat MS were modestly effective, though were poorly tolerated and had many adverse effects. [3] Several treatment options with better safety and tolerability profiles have been introduced,[21] improving the prognosis of MS.
As with any medical treatment, medications used in the management of MS have several adverse effects. Alternative treatments are pursued by some people, despite the shortage of supporting evidence of efficacy.
Initial management of acute flare[edit]
During symptomatic attacks, administration of high doses of intravenous corticosteroids, such as methylprednisolone, is the usual therapy,[1] with oral corticosteroids seeming to have a similar efficacy and safety profile.[93] Although effective in the short term for relieving symptoms, corticosteroid treatments do not appear to have a significant impact on long-term recovery.[94][95] The long-term benefit is unclear in optic neuritis as of 2020.[96] The consequences of severe attacks that do not respond to corticosteroids might be treatable by plasmapheresis.[1]
Chronic management[edit]
Relapsing remitting multiple sclerosis[edit]
Multiple disease-modifying medications were approved by regulatory agencies for RRMS; they are modestly effective at decreasing the number of attacks.[97] The interferons[98] and glatiramer acetate are first-line treatments[5] and are roughly equivalent, reducing relapses by approximately 30%.[99] Early-initiated long-term therapy is safe and improves outcomes.[100][101]
Treatment of CIS with interferons decreases the chance of progressing to clinical MS.[1][102][103] Efficacy of interferons and glatiramer acetate in children has been estimated to be roughly equivalent to that of adults.[104] The role of some newer agents such as fingolimod,[105] teriflunomide, and dimethyl fumarate,[106] is not yet entirely clear.[107] Making firm conclusions about the best treatment is difficult, especially regarding the long‐term benefit and safety of early treatment, given the lack of studies directly comparing disease-modifying therapies or long-term monitoring of patient outcomes.[108]
The relative effectiveness of different treatments is unclear, as most have only been compared to placebo or a small number of other therapies.[109] Direct comparisons of interferons and glatiramer acetate indicate similar effects or only small differences in effects on relapse rate, disease progression, and MRI measures.[110] Alemtuzumab, natalizumab, and fingolimod may be more effective than other drugs in reducing relapses over the short term in people with RRMS.[111] Natalizumab and interferon beta-1a (Rebif) may reduce relapses compared to both placebo and interferon beta-1a (Avonex) while Interferon beta-1b (Betaseron), glatiramer acetate, and mitoxantrone may also prevent relapses.[109] Evidence on relative effectiveness in reducing disability progression is unclear.[109][111] All medications are associated with adverse effects that may influence their risk to benefit profiles.[109][111]
Ublituximab was approved for medical use in the United States in December 2022.[112]
Progressive multiple sclerosis[edit]
In 2011, mitoxantrone was the first medication approved for secondary progressive MS.[113] In this population, tentative evidence supports mitoxantrone moderately slowing the progression of the disease and decreasing rates of relapses over two years.[114][115]
New approved medications continue to emerge in modern medicine. In March 2017, the FDA approved ocrelizumab as a treatment for primary progressive MS in adults, the first drug to gain that approval,[116][117][118] with requirements for several Phase IV clinical trials.[119] It is also used for the treatment of relapsing forms of multiple sclerosis, to include clinically isolated syndrome, relapsing-remitting disease, and active secondary progressive disease in adults.[118] According to a 2021 Cochrane review, ocrelizumab may reduce worsening of symptoms for primary progressive MS and probably increases unwanted effects but makes little or no difference to the number of serious unwanted effects.[120]
In 2019, siponimod and cladribine were approved in the United States for the treatment of secondary progressive multiple sclerosis (SPMS). [116] Subsequently, ozanimod was approved in 2020, and ponesimod was approved in 2021, which were both approved for management of CIS, relapsing MS, and SPMS in the U.S., and RRMS in Europe. [121]
Adverse effects[edit]
Irritation zone after injection of glatiramer acetate.
The disease-modifying treatments have several adverse effects. One of the most common is irritation at the injection site for glatiramer acetate and the interferons (up to 90% with subcutaneous injections and 33% with intramuscular injections).[98][122] Over time, a visible dent at the injection site, due to the local destruction of fat tissue, known as lipoatrophy, may develop.[122] Interferons may produce flu-like symptoms;[123] some people taking glatiramer experience a post-injection reaction with flushing, chest tightness, heart palpitations, and anxiety, which usually lasts less than thirty minutes.[124] More dangerous but much less common are liver damage from interferons,[125] systolic dysfunction (12%), infertility, and acute myeloid leukemia (0.8%) from mitoxantrone,[114][126] and progressive multifocal leukoencephalopathy occurring with natalizumab (occurring in 1 in 600 people treated).[5][127]
Fingolimod may give rise to hypertension and slowed heart rate, macular edema, elevated liver enzymes, or a reduction in lymphocyte levels.[105][107] Tentative evidence supports the short-term safety of teriflunomide, with common side effects including: headaches, fatigue, nausea, hair loss, and limb pain.[97] There have also been reports of liver failure and PML with its use and it is dangerous for fetal development.[107] Most common side effects of dimethyl fumarate are flushing and gastrointestinal problems.[106][128][107] While dimethyl fumarate may lead to a reduction in the white blood cell count there were no reported cases of opportunistic infections during trials.[129]
Associated symptoms[edit]
Both medications and neurorehabilitation have been shown to improve some symptoms, though neither changes the course of the disease.[130] Some symptoms have a good response to medication, such as bladder spasticity, while others are little changed.[1] Equipment such as catheters for neurogenic bladder or mobility aids can be helpful in improving functional status.
A multidisciplinary approach is important for improving quality of life; however, it is difficult to specify a ‘core team’ as many health services may be needed at different points in time.[1] Multidisciplinary rehabilitation programs increase activity and participation of people with MS but do not influence impairment level.[131] Studies investigating information provision in support of patient understanding and participation suggest that while interventions (written information, decision aids, coaching, educational programmes) may increase knowledge, the evidence of an effect on decision making and quality of life is mixed and low certainty.[132] There is limited evidence for the overall efficacy of individual therapeutic disciplines,[133][134] though there is good evidence that specific approaches, such as exercise,[135][136][137][138] and psychological therapies are effective.[139] Cognitive training, alone or combined with other neuropsychological interventions, may show positive effects for memory and attention though firm conclusions are not possible given small sample numbers, variable methodology, interventions and outcome measures.[140] The effectiveness of palliative approaches in addition to standard care is uncertain, due to lack of evidence.[141] The effectiveness of interventions, including exercise, specifically for the prevention of falls in people with MS is uncertain, while there is some evidence of an effect on balance function and mobility.[142] Cognitive behavioral therapy has shown to be moderately effective for reducing MS fatigue.[143] The evidence for the effectiveness of non-pharmacological interventions for chronic pain is insufficient to recommend such interventions alone, however their use in combination with medications may be reasonable.[144]
Non-pharmaceutical[edit]
There is some evidence that aquatic therapy is a beneficial intervention.[145]
The spasticity associated with MS can be difficult to manage because of the progressive and fluctuating course of the disease.[146] Although there is no firm conclusion on the efficacy in reducing spasticity, PT interventions can be a safe and beneficial option for patients with multiple sclerosis. Physical therapy including vibration interventions, electrical stimulation, exercise therapy, standing therapy, and radial shock wave therapy (RSWT), were beneficial for limiting spasticity, helping limit excitability, or increasing range of motion.[147]
Alternative treatments[edit]
Over 50% of people with MS may use complementary and alternative medicine, although percentages vary depending on how alternative medicine is defined.[18] Regarding the characteristics of users, they are more frequently women, have had MS for a longer time, tend to be more disabled and have lower levels of satisfaction with conventional healthcare.[18] The evidence for the effectiveness for such treatments in most cases is weak or absent.[18][148] Treatments of unproven benefit used by people with MS include dietary supplementation and regimens,[18][149][150] vitamin D,[151] relaxation techniques such as yoga,[18] herbal medicine (including medical cannabis),[18][152][153] hyperbaric oxygen therapy,[154] self-infection with hookworms, reflexology, acupuncture,[18][155] and mindfulness.[156] Evidence suggests vitamin D supplementation, irrespective of the form and dose, provides no benefit for people with MS; this includes for measures such as relapse recurrence, disability, and MRI lesions while effects on health‐related quality of life and fatigue are unclear.[157] There is insufficient evidence supporting high-dose biotin[158][159][160] and some evidence for increased disease activity and higher risk of relapse with its use.[161]
Prognosis[edit]
The availability of treatments that modify the course of multiple sclerosis beginning in the 1990s, known as disease-modifying therapies (DMTs), has improved prognosis. These treatments can reduce relapses and slow progression, but as of 2022 there is no cure.[21][162]
The prognosis of MS depends on the subtype of the disease, and there is also great individual variation in the progression of the disease.[163] In relapsing MS, which is the most common subtype, a 2016 cohort study found that after a median of 16.8 years from onset, one in ten of those with relapsing MS needed a walking aid, and almost two in ten transitioned to secondary progressive MS, a form characterized by more progressive decline.[21] With treatments available in the 2020s, relapses can be eliminated or substantially reduced. However, «silent progression» of the disease still occurs.[162][164]
In addition to secondary progressive MS (SPMS), a small proportion of people with MS (10-15%) experience progressive decline from the onset, known as primary progressive MS (PPMS). Most treatments have been approved for use in relapsing MS; there are limited effective treatments for progressive forms of MS, and treatments aren’t as effective.[165][162][21] The prognosis for progressive MS is worse, with faster accumulation of disability, though the rate of decline varies considerably between people.[165] In untreated PPMS, the median time from onset to requiring a walking aid is estimated as seven years.[21] In SPMS, a 2014 cohort study reported that people required a walking aid after an average of five years from onset of SPMS, and were chair or bed-bound after average fifteen years.[166]
After diagnosis of MS, characteristics that predict a worse course are male sex, older age, and greater disability at the time of diagnosis; female sex is associated with a higher relapse rate.[167] As of 2018, no biomarker can accurately predict disease progression in every patient.[163] Spinal cord lesions, abnormalities on MRI, and more brain atrophy are predictive of a worse course, though brain atrophy as a predictor of disease course is experimental and not used in clinical practice as of 2018.[167] Early treatment leads to a better prognosis, but a higher relapse frequency when treated with DMTs is associated with a poorer prognosis.[163][167] A 60-year longitudinal population study conducted in Norway found a 7-year shorter life expectancy in MS compared with the general population and a rise in survival in MS during the observation period. Median life expectancy for RRMS patients was 77.8 years and 71.4 years for PPMS compared to 81.8 years for the general population. Life expectancy for men was 5 years shorter than for women.[168]
Epidemiology[edit]
|
|
This article needs to be updated. Please help update this article to reflect recent events or newly available information. (July 2022) |
Deaths from multiple sclerosis per million persons in 2012
MS is the most common autoimmune disorder of the central nervous system.[20] The latest estimation of the total number of people with MS was 2.8 million globally, with a prevalence of 36 per 100,000 people. Moreover, prevalence varies widely in different regions around the world.[22] In Africa, there are 5 people per 100,000 diagnosed with MS, compared to South East Asia where the prevalence is 9 per 100,000, 112 per 100,000 in the Americas, and 133 per 100,000 in Europe. [169]
Increasing rates of MS may be explained simply by better diagnosis.[2] Studies on populational and geographical patterns have been common[38] and have led to a number of theories about the cause.[16][52][53]
MS usually appears in adults in their late twenties or early thirties but it can rarely start in childhood and after 50 years of age.[2][65] The primary progressive subtype is more common in people in their fifties.[83] Similarly to many autoimmune disorders, the disease is more common in women, and the trend may be increasing.[1][48] As of 2008, globally it is about two times more common in women than in men.[65] In children, it is even more common in females than males,[1] while in people over fifty, it affects males and females almost equally.[83]
History[edit]
Medical discovery[edit]
Robert Carswell (1793–1857), a British professor of pathology, and Jean Cruveilhier (1791–1873), a French professor of pathologic anatomy, described and illustrated many of the disease’s clinical details, but did not identify it as a separate disease.[170] Specifically, Carswell described the injuries he found as «a remarkable lesion of the spinal cord accompanied with atrophy».[1] Under the microscope, Swiss pathologist Georg Eduard Rindfleisch (1836–1908) noted in 1863 that the inflammation-associated lesions were distributed around blood vessels.[171][172]
The French neurologist Jean-Martin Charcot (1825–1893) was the first person to recognize multiple sclerosis as a distinct disease in 1868.[170] Summarizing previous reports and adding his own clinical and pathological observations, Charcot called the disease sclerose en plaques.
Diagnosis history[edit]
The first attempt to establish a set of diagnostic criteria was also due to Charcot in 1868. He published what now is known as the «Charcot Triad», consisting in nystagmus, intention tremor, and telegraphic speech (scanning speech).[173] Charcot also observed cognition changes, describing his patients as having a «marked enfeeblement of the memory» and «conceptions that formed slowly».[23]
Diagnosis was based on Charcot triad and clinical observation until Schumacher made the first attempt to standardize criteria in 1965 by introducing some fundamental requirements: Dissemination of the lesions in time (DIT) and space (DIS), and that «signs and symptoms cannot be explained better by another disease process».[173] The DIT and DIS requirement was later inherited by Poser criteria and McDonald criteria, whose 2017 revision is in use.[173][163]
During the 20th century, theories about the cause and pathogenesis were developed and effective treatments began to appear in the 1990s.[1] Since the beginning of the 21st century, refinements of the concepts have taken place. The 2010 revision of the McDonald criteria allowed for the diagnosis of MS with only one proved lesion (CIS).[174]
In 1996, the US National Multiple Sclerosis Society (NMSS) (Advisory Committee on Clinical Trials) defined the first version of the clinical phenotypes that is in use. In this first version they provided standardized definitions for four MS clinical courses: relapsing-remitting (RR), secondary progressive (SP), primary progressive (PP), and progressive relapsing (PR). In 2010, PR was dropped and CIS was incorporated.[174] Three years later, the 2013 revision of the «phenotypes for the disease course» were forced to consider CIS as one of the phenotypes of MS, making obsolete some expressions like «conversion from CIS to MS».[175] Other organizations have proposed later new clinical phenotypes, like HAMS (Highly Active MS).[176]
Historical cases[edit]
Photographic study of locomotion of a female with MS with walking difficulties created in 1887 by Muybridge
There are several historical accounts of people who probably had MS and lived before or shortly after the disease was described by Charcot.
A young woman called Halldora who lived in Iceland around 1200 suddenly lost her vision and mobility but recovered them seven days after. Saint Lidwina of Schiedam (1380–1433), a Dutch nun, may be one of the first clearly identifiable people with MS. From the age of 16 until her death at 53, she had intermittent pain, weakness of the legs and vision loss: symptoms typical of MS.[177] Both cases have led to the proposal of a «Viking gene» hypothesis for the dissemination of the disease.[178]
Augustus Frederick d’Este (1794–1848), son of Prince Augustus Frederick, Duke of Sussex and Lady Augusta Murray and a grandson of George III of the United Kingdom, almost certainly had MS. D’Este left a detailed diary describing his 22 years living with the disease. His diary began in 1822 and ended in 1846, although it remained unknown until 1948. His symptoms began at age 28 with a sudden transient visual loss (amaurosis fugax) after the funeral of a friend. During his disease, he developed weakness of the legs, clumsiness of the hands, numbness, dizziness, bladder disturbance and erectile dysfunction. In 1844, he began to use a wheelchair. Despite his illness, he kept an optimistic view of life.[179][180] Another early account of MS was kept by the British diarist W. N. P. Barbellion, pen name of Bruce Frederick Cummings (1889–1919), who maintained a detailed log of his diagnosis and struggle.[180] His diary was published in 1919 as The Journal of a Disappointed Man.[181]
Research[edit]
Epstein-Barr virus ongoing studies[edit]
As of 2022, the pathogenesis of MS as it relates to EBV is actively investigated, as are disease-modifying therapies; understanding of how risk factors combine with EBV to initiate MS is sought. Whether EBV is the only cause of MS might be better understood if an EBV vaccine is developed and shown to prevent MS as well.[15]
Even though a variety of studies showed the connection between an EBV infection and a later development of multiple sclerosis, the mechanisms behind this correlation are still not completely clear. Though there are some leading theories which are explaining the relationship between the two diseases closer. It is expected that the involvement of EBV-infected B-cells[182] and the involvement of anti-EBNA antibodies, which appear to be significantly higher in multiple sclerosis patients, play a crucial role in the development of the disease.[183] This is supported by the fact that with treatment against B-cells, e.g. through Ocrelizumab therapy, the course of multiple sclerosis symptoms will be improved. Annual relapses will appear in a minor rate and disability progression is slower.[184] A study led by a Stanford research unit which was published in 2022, has shown that during an EBV infection, molecular mimicry can occur, where the immune system will produce antibodies against the EBNA1 protein, which at the same time is able to bind to GlialCAM in the myelin. Additionally, they observed a phenomenon which is uncommon in healthy individuals but often detected in multiple sclerosis patients – B-cells are trafficking to the brain and spinal cord, where they are producing oligoclonal antibody bands. A majority of these oligoclonal bands do have an affinity to the viral protein EBNA1, which is cross-reactive to GlialCAM. These antibodies are abundant in approximately 20-25% of multiple sclerosis patients and worsen the autoimmune demyelination which leads consequently to an pathophysiologocal exacerbation of the disease. Furthermore, the intrathecal oligoclonal expansion with a constant somatic hypermutation is unique in multiple sclerosis when compared to other neuroinflammatory diseases. In the study there was also the abundance of antibodies with IGHV 3-7 genes measured, which appears to be connected to the disease progress. Antibodies which are IGHV3–7-based are binding with a high affinity to EBNA1 and GlialCAM. This process is actively thriving the demyelination. It is probable that B-cells, expressing IGHV 3-7 genes entered the CSF and underwent there affinity maturation after facing GlialCAM, which led consequently to the production of high affinity anti-GlialCAM antibodies. This was additionally shown in the EAE mouse model where immunization with EBNA1 lead to a strong B-cell response against GlialCAM, which worsened the EAE.[185]
Medications[edit]
Medications that influence voltage-gated sodium ion channels are under investigation as a potential neuroprotective strategy because of hypothesized role of sodium in the pathological process leading to axonal injury and accumulating disability. There is insufficient evidence of an effect of sodium channel blockers for people with MS.[186]
Pathogenesis[edit]
MS is a clinically defined entity with several atypical presentations. Some auto-antibodies have been found in atypical MS cases, giving birth to separate disease families and restricting the previously wider concept of MS.
Anti-AQP4 autoantibodies were found in neuromyelitis optica (NMO), which was previously considered a MS variant. A spectrum of diseases named NMOSD (NMO spectrum diseases) or anti-AQP4 diseases has been accepted.[187] Some cases of MS were presenting anti-MOG autoantibodies, mainly overlapping with the Marburg variant. Anti-MOG autoantibodies were found to be also present in ADEM, and a second spectrum of separated diseases is being considered. This spectrum is named inconsistently across different authors, but it is normally something similar to anti-MOG demyelinating diseases.[187]
A third kind of auto-antibodies is accepted. They are several anti-neurofascin auto-antibodies which damage the Ranvier nodes of the neurons. These antibodies are more related to the peripheral nervous demyelination, but they were also found in chronic progressive PPMS and combined central and peripheral demyelination (CCPD, which is considered another atypical MS presentation).[188]
In addition to the significance of auto-antibodies in MS, four different patterns of demyelination have been reported, opening the door to consider MS as a heterogeneous disease.[189]
Disease biomarkers[edit]
MRI brain scan produced using a Gradient-echo phase sequence showing an iron deposit in a white matter lesion (inside green box in the middle of the image; enhanced and marked by red arrow top-left corner)[190]
Since disease progression is the result of degeneration of neurons, the roles of proteins showing loss of nerve tissue such as neurofilaments, tau, and N-acetylaspartate are under investigation.[191][192]
Improvement in neuroimaging techniques such as positron emission tomography (PET) or magnetic resonance imaging (MRI) carry a promise for better diagnosis and prognosis predictions. Regarding MRI, there are several techniques that have already shown some usefulness in research settings and could be introduced into clinical practice, such as double-inversion recovery sequences, magnetization transfer, diffusion tensor, and functional magnetic resonance imaging.[193] These techniques are more specific for the disease than existing ones, but still lack some standardization of acquisition protocols and the creation of normative values.[193] This is particularly the case for proton magnetic resonance spectroscopy, for which a number of methodological variations observed in the literature may underlie continued inconsistencies in central nervous system metabolic abnormalities, particularly in N-acetyl aspartate, myoinositol, choline, glutamate, GABA, and GSH, observed for multiple sclerosis and its subtypes.[194] There are other techniques under development that include contrast agents capable of measuring levels of peripheral macrophages, inflammation, or neuronal dysfunction,[193] and techniques that measure iron deposition that could serve to determine the role of this feature in MS, or that of cerebral perfusion.[193]
COVID-19[edit]
The hospitalization rate was found to be higher among individuals with MS and COVID-19 infection, at 10%, while the pooled infection rate is estimated at 4%. The pooled prevalence of death in hospitalized individuals with MS is estimated as 4%.[195]
Other emerging theories[edit]
One emerging hypothesis, referred to as the hygiene hypothesis, suggests that early-life exposure to infectious agents helps to develop the immune system and reduces susceptibility to allergies and autoimmune disorders, including MS. Germ-free mice infected with transplanted fecal matter from MS patients exhibit an increased risk of developing EAE, an animal model of MS.[196][medical citation needed] It has also been proposed that certain bacteria found in the gut use molecular mimicry to infiltrate the brain via the gut-brain axis, initiating an inflammatory response and increasing blood-brain barrier permeability. Vitamin D levels have also been correlated with MS; lower levels of vitamin D correspond to an increased risk of MS, suggesting a reduced prevalence in the tropics — an area with more Vitamin D-rich sunlight — strengthening the impact of geographical location on MS development.[197] MS mechanisms begin when peripheral autoreactive effector CD4+ T cells get activated and move into the CNS. Antigen-presenting cells localize the reactivation of autoreactive effector CD4-T cells once they have entered the CNS, attracting more T cells and macrophages to form the inflammatory lesion.[198][medical citation needed] In MS patients, macrophages and microglia assemble at locations where demyelination and neurodegeneration are actively occurring, and microglial activation is more apparent in the normal-appearing white matter of MS patients.[199] Astrocytes generate neurotoxic chemicals like nitric oxide and TNFα, attract neurotoxic inflammatory monocytes to the CNS, and are responsible for astrogliosis, the scarring that prevents the spread of neuroinflammation and kills neurons inside the scarred area.[200][better source needed]
See also[edit]
- List of multiple sclerosis organizations
- List of people with multiple sclerosis
References[edit]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av Compston A, Coles A (October 2008). «Multiple sclerosis». Lancet. 372 (9648): 1502–1517. doi:10.1016/S0140-6736(08)61620-7. PMID 18970977. S2CID 195686659.
- ^ a b c d e f g h i j k l Milo R, Kahana E (March 2010). «Multiple sclerosis: geoepidemiology, genetics and the environment». Autoimmunity Reviews. 9 (5): A387-94. doi:10.1016/j.autrev.2009.11.010. PMID 19932200.
- ^ a b c d e «NINDS Multiple Sclerosis Information Page». National Institute of Neurological Disorders and Stroke. 19 November 2015. Archived from the original on 13 February 2016. Retrieved 6 March 2016.
- ^ a b Nakahara J, Maeda M, Aiso S, Suzuki N (February 2012). «Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy». Clinical Reviews in Allergy & Immunology. 42 (1): 26–34. doi:10.1007/s12016-011-8287-6. PMID 22189514. S2CID 21058811.
- ^ a b c d e f g h Tsang BK, Macdonell R (December 2011). «Multiple sclerosis- diagnosis, management and prognosis». Australian Family Physician. 40 (12): 948–55. PMID 22146321. Archived from the original on 5 October 2021. Retrieved 5 October 2021.
- ^ Liu Z, Liao Q, Wen H, Zhang Y (June 2021). «Disease modifying therapies in relapsing-remitting multiple sclerosis: A systematic review and network meta-analysis». Autoimmunity Reviews. 20 (6): 102826. doi:10.1016/j.autrev.2021.102826. PMID 33878488. S2CID 233325057.
- ^ a b c Alphonsus KB, Su Y, D’Arcy C (April 2019). «The effect of exercise, yoga and physiotherapy on the quality of life of people with multiple sclerosis: Systematic review and meta-analysis». Complementary Therapies in Medicine. 43: 188–195. doi:10.1016/j.ctim.2019.02.010. PMID 30935529. S2CID 86669723.
- ^ Leray E, Moreau T, Fromont A, Edan G (January 2016). «Epidemiology of multiple sclerosis». Revue Neurologique. 172 (1): 3–13. doi:10.1016/j.neurol.2015.10.006. PMID 26718593.
- ^ a b c d e f g h i j k l Compston A, Coles A (April 2002). «Multiple sclerosis». Lancet. 359 (9313): 1221–1231. doi:10.1016/S0140-6736(02)08220-X. PMID 11955556. S2CID 14207583.
- ^ Murray ED, Buttner EA, Price BH (2012). «Depression and Psychosis in Neurological Practice». In Daroff R, Fenichel G, Jankovic J, Mazziotta J (eds.). Bradley’s neurology in clinical practice (6th ed.). Philadelphia, PA: Elsevier/Saunders. ISBN 978-1-4377-0434-1.
- ^ a b c Piryonesi SM, Rostampour S, Piryonesi SA (April 2021). «Predicting falls and injuries in people with multiple sclerosis using machine learning algorithms». Multiple Sclerosis and Related Disorders. 49: 102740. doi:10.1016/j.msard.2021.102740. PMID 33450500. S2CID 231624230.
- ^ Mazumder R, Murchison C, Bourdette D, Cameron M (25 September 2014). «Falls in people with multiple sclerosis compared with falls in healthy controls». PLOS ONE. 9 (9): e107620. Bibcode:2014PLoSO…9j7620M. doi:10.1371/journal.pone.0107620. PMC 4177842. PMID 25254633.
- ^ Baecher-Allan C, Kaskow BJ, Weiner HL (February 2018). «Multiple Sclerosis: Mechanisms and Immunotherapy». Neuron. 97 (4): 742–768. doi:10.1016/j.neuron.2018.01.021. PMID 29470968. S2CID 3499974.
- ^ a b c d e f [medical citation needed]Lublin FD, Reingold SC (April 1996). «Defining the clinical course of multiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis». Neurology. 46 (4): 907–911. doi:10.1212/WNL.46.4.907. PMID 8780061. S2CID 40213123.
- ^ a b c d Aloisi F, Cross AH (October 2022). «MINI-review of Epstein-Barr virus involvement in multiple sclerosis etiology and pathogenesis». Journal of Neuroimmunology. 371: 577935. doi:10.1016/j.jneuroim.2022.577935. PMID 35931008. S2CID 251152784.
- ^ a b c d e Ascherio A, Munger KL (April 2007). «Environmental risk factors for multiple sclerosis. Part I: the role of infection». Annals of Neurology. 61 (4): 288–99. doi:10.1002/ana.21117. PMID 17444504. S2CID 7682774.
- ^ Quinn É, Hynes SM (July 2021). «Occupational therapy interventions for multiple sclerosis: A scoping review». Scandinavian Journal of Occupational Therapy. 28 (5): 399–414. doi:10.1080/11038128.2020.1786160. hdl:10379/16066. PMID 32643486. S2CID 220436640.
- ^ a b c d e f g h Huntley A (January 2006). «A review of the evidence for efficacy of complementary and alternative medicines in MS». International MS Journal. 13 (1): 5–12, 4. PMID 16420779.
- ^ Weinshenker BG (1994). «Natural history of multiple sclerosis». Annals of Neurology. 36 Suppl (Suppl): S6-11. doi:10.1002/ana.410360704. PMID 8017890. S2CID 7140070.
- ^ a b Berer K, Krishnamoorthy G (November 2014). «Microbial view of central nervous system autoimmunity». FEBS Letters. 588 (22): 4207–13. doi:10.1016/j.febslet.2014.04.007. PMID 24746689. S2CID 2772656.
- ^ a b c d e f g McGinley MP, Goldschmidt CH, Rae-Grant AD (February 2021). «Diagnosis and Treatment of Multiple Sclerosis: A Review». JAMA. 325 (8): 765–779. doi:10.1001/jama.2020.26858. PMID 33620411. S2CID 232019589.
- ^ a b Lane J, Ng HS, Poyser C, Lucas RM, Tremlett H (July 2022). «Multiple sclerosis incidence: A systematic review of change over time by geographical region». Mult Scler Relat Disord. 63: 103932. doi:10.1016/j.msard.2022.103932. PMID 35667315. S2CID 249188137. Archived from the original on 10 February 2023. Retrieved 6 July 2022.
- ^ a b c Clanet M (June 2008). «Jean-Martin Charcot. 1825 to 1893». International MS Journal. 15 (2): 59–61. PMID 18782501. Archived from the original (PDF) on 30 March 2019. Retrieved 21 October 2010.
* Charcot J (1868). «Histologie de la sclerose en plaques». Gazette des Hopitaux, Paris. 41: 554–5. - ^ «MS Signs». Webmd. Archived from the original on 30 September 2016. Retrieved 7 October 2016.
- ^ Cameron MH, Nilsagard Y (2018). «Balance, gait, and falls in multiple sclerosis». Handbook of Clinical Neurology. 159: 237–250. doi:10.1016/b978-0-444-63916-5.00015-x. ISBN 978-0-444-63916-5. PMID 30482317.
- ^ Oreja-Guevara C, Ayuso Blanco T, Brieva Ruiz L, Hernández Pérez MÁ, Meca-Lallana V, Ramió-Torrentà L (2019). «Cognitive Dysfunctions and Assessments in Multiple Sclerosis». Frontiers in Neurology. 10: 581. doi:10.3389/fneur.2019.00581. PMC 6558141. PMID 31214113.
- ^ Kalb R, Beier M, Benedict RH, Charvet L, Costello K, Feinstein A, et al. (November 2018). «Recommendations for cognitive screening and management in multiple sclerosis care». Multiple Sclerosis. 24 (13): 1665–1680. doi:10.1177/1352458518803785. PMC 6238181. PMID 30303036.
- ^ Benedict RH, Amato MP, DeLuca J, Geurts JJ (October 2020). «Cognitive impairment in multiple sclerosis: clinical management, MRI, and therapeutic avenues». The Lancet. Neurology. 19 (10): 860–871. doi:10.1016/S1474-4422(20)30277-5. PMID 32949546. S2CID 221744328.
- ^ Kurtzke JF (November 1983). «Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS)». Neurology. 33 (11): 1444–52. doi:10.1212/WNL.33.11.1444. PMID 6685237.
- ^ Amato MP, Ponziani G (August 1999). «Quantification of impairment in MS: discussion of the scales in use». Multiple Sclerosis. 5 (4): 216–9. doi:10.1191/135245899678846113. PMID 10467378.
- ^ Rudick RA, Cutter G, Reingold S (October 2002). «The multiple sclerosis functional composite: a new clinical outcome measure for multiple sderosis trials». Multiple Sclerosis. 8 (5): 359–65. doi:10.1191/1352458502ms845oa. PMID 12356200. S2CID 31529508.
- ^ van Munster CE, Uitdehaag BM (March 2017). «Outcome Measures in Clinical Trials for Multiple Sclerosis». CNS Drugs. 31 (3): 217–236. doi:10.1007/s40263-017-0412-5. PMC 5336539. PMID 28185158.
- ^ a b Tataru N, Vidal C, Decavel P, Berger E, Rumbach L (2006). «Limited impact of the summer heat wave in France (2003) on hospital admissions and relapses for multiple sclerosis». Neuroepidemiology. 27 (1): 28–32. doi:10.1159/000094233. PMID 16804331. S2CID 20870484.
- ^ Heesen C, Mohr DC, Huitinga I, Bergh FT, Gaab J, Otte C, Gold SM (March 2007). «Stress regulation in multiple sclerosis: current issues and concepts». Multiple Sclerosis. 13 (2): 143–8. doi:10.1177/1352458506070772. PMID 17439878. S2CID 8262595.
- ^ Martinelli V (2000). «Trauma, stress and multiple sclerosis». Neurological Sciences. 21 (4 Suppl 2): S849-52. doi:10.1007/s100720070024. PMID 11205361. S2CID 2376078.
- ^ Makhani N, Tremlett H (August 2021). «The multiple sclerosis prodrome». Nature Reviews. Neurology. 17 (8): 515–521. doi:10.1038/s41582-021-00519-3. PMC 8324569. PMID 34155379.
- ^ Marrie RA (December 2019). «Mounting evidence for a multiple sclerosis prodrome». Nature Reviews. Neurology. 15 (12): 689–690. doi:10.1038/s41582-019-0283-0. PMID 31654040. S2CID 204887642.
- ^ a b Kurtzke JF (October 1993). «Epidemiologic evidence for multiple sclerosis as an infection». Clinical Microbiology Reviews. 6 (4): 382–427. doi:10.1128/CMR.6.4.382. PMC 358295. PMID 8269393.
- ^ Gilden DH (March 2005). «Infectious causes of multiple sclerosis». The Lancet. Neurology. 4 (3): 195–202. doi:10.1016/S1474-4422(05)01017-3. PMC 7129502. PMID 15721830.
- ^ Soldan SS, Lieberman PM (January 2023). «Epstein-Barr virus and multiple sclerosis». Nature Reviews. Microbiology. 21 (1): 51–64. doi:10.1038/s41579-022-00770-5. PMC 9362539. PMID 35931816.
- ^ a b Bjornevik K, Cortese M, Healy BC, Kuhle J, Mina MJ, Leng Y, et al. (January 2022). «Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis». Science. 375 (6578): 296–301. Bibcode:2022Sci…375..296B. doi:10.1126/science.abj8222. PMID 35025605. S2CID 245983763. See BBC lay summary Archived 25 April 2022 at the Wayback Machine of 13 April 2022.
- ^
- ^ Skene NG, Grant SG (2016). «Identification of Vulnerable Cell Types in Major Brain Disorders Using Single Cell Transcriptomes and Expression Weighted Cell Type Enrichment». Frontiers in Neuroscience. 10: 16. doi:10.3389/fnins.2016.00016. PMC 4730103. PMID 26858593.
- ^ Hassan-Smith G, Douglas MR (October 2011). «Epidemiology and diagnosis of multiple sclerosis». British Journal of Hospital Medicine. 72 (10): M146-51. doi:10.12968/hmed.2011.72.Sup10.M146. PMID 22041658.
- ^ Rosati G (April 2001). «The prevalence of multiple sclerosis in the world: an update». Neurological Sciences. 22 (2): 117–39. doi:10.1007/s100720170011. PMID 11603614. S2CID 207051545.
- ^ a b c Baranzini SE (June 2011). «Revealing the genetic basis of multiple sclerosis: are we there yet?». Current Opinion in Genetics & Development. 21 (3): 317–24. doi:10.1016/j.gde.2010.12.006. PMC 3105160. PMID 21247752.
- ^ International Multiple Sclerosis Genetics Consortium (2019). «Multiple sclerosis genomic map implicates peripheral immune cells and microglia in susceptibility». Science. 365 (6460). doi:10.1126/science.aav7188. PMC 7241648. PMID 31604244.
- ^ a b c Alonso A, Hernán MA (July 2008). «Temporal trends in the incidence of multiple sclerosis: a systematic review». Neurology. 71 (2): 129–35. doi:10.1212/01.wnl.0000316802.35974.34. PMC 4109189. PMID 18606967.
- ^ a b Pugliatti M, Sotgiu S, Rosati G (July 2002). «The worldwide prevalence of multiple sclerosis». Clinical Neurology and Neurosurgery. 104 (3): 182–91. doi:10.1016/S0303-8467(02)00036-7. PMID 12127652. S2CID 862001.
- ^ Grimaldi LM, Salemi G, Grimaldi G, Rizzo A, Marziolo R, Lo Presti C, Maimone D, Savettieri G (November 2001). «High incidence and increasing prevalence of MS in Enna (Sicily), southern Italy». Neurology. 57 (10): 1891–3. doi:10.1212/wnl.57.10.1891. PMID 11723283. S2CID 34895995.
- ^ Kulie T, Groff A, Redmer J, Hounshell J, Schrager S (2009). «Vitamin D: an evidence-based review». Journal of the American Board of Family Medicine. 22 (6): 698–706. doi:10.3122/jabfm.2009.06.090037. PMID 19897699.
- ^ a b c d e Marrie RA (December 2004). «Environmental risk factors in multiple sclerosis aetiology». The Lancet. Neurology. 3 (12): 709–18. doi:10.1016/S1474-4422(04)00933-0. PMID 15556803. S2CID 175786.
- ^ a b c Ascherio A, Munger KL (June 2007). «Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors». Annals of Neurology. 61 (6): 504–13. doi:10.1002/ana.21141. PMID 17492755. S2CID 36999504.
- ^ Hedström A, Hössjer O, Katsoulis M (September 2018). «Organic solvents and MS susceptibility: Interaction with MS risk HLA genes». Neurology. 91 (5): 455–462. doi:10.1212/WNL.0000000000005906. PMC 6093765. PMID 29970406.
- ^ Stowe J, Andrews N, Miller E (January 2020). «Do Vaccines Trigger Neurological Diseases? Epidemiological Evaluation of Vaccination and Neurological Diseases Using Examples of Multiple Sclerosis, Guillain-Barré Syndrome and Narcolepsy». CNS Drugs. 34 (1): 1–8. doi:10.1007/s40263-019-00670-y. PMC 7224038. PMID 31576507.
- ^ Spitsin S, Koprowski H (2008). «Role of uric acid in multiple sclerosis». Current Topics in Microbiology and Immunology. 318: 325–342. doi:10.1007/978-3-540-73677-6_13. ISBN 978-3-540-73676-9. PMID 18219824.
- ^ Nourbakhsh B, Mowry EM (June 2019). «Multiple Sclerosis Risk Factors and Pathogenesis». Continuum. 25 (3): 596–610. doi:10.1212/CON.0000000000000725. PMID 31162307. S2CID 174806511.
- ^ Chen Y, Popko B (2018). «Cholesterol crystals impede nerve repair». Science. 359 (6376): 635–636. Bibcode:2018Sci…359..635C. doi:10.1126/science.aar7369. PMID 29439228. S2CID 3257111.
- ^ Cantuti-Castelvetri L, Fitzner D, Bosch-Queralt M, Weil MT, Su M, Sen P, Ruhwedel T, Mitkovski M, Trendelenburg G, Lütjohann D, Möbius W, Simons M (2018). «Defective cholesterol clearance limits remyelination in the aged central nervous system». Science. 359 (6376): 684–688. Bibcode:2018Sci…359..684C. doi:10.1126/science.aan4183. PMID 29301957.
- ^ a b Chari DM (2007). «Remyelination in multiple sclerosis». International Review of Neurobiology. 79: 589–620. doi:10.1016/S0074-7742(07)79026-8. ISBN 978-0-12-373736-6. PMC 7112255. PMID 17531860.
- ^ Pittock SJ, Lucchinetti CF (March 2007). «The pathology of MS: new insights and potential clinical applications». The Neurologist. 13 (2): 45–56. doi:10.1097/01.nrl.0000253065.31662.37. PMID 17351524. S2CID 2993523.
- ^ Huang X, Hussain B, Chang J (January 2021). «Peripheral inflammation and blood-brain barrier disruption: effects and mechanisms». CNS Neuroscience & Therapeutics. 27 (1): 36–47. doi:10.1111/cns.13569. PMC 7804893. PMID 33381913.
- ^ Ferré JC, Shiroishi MS, Law M (November 2012). «Advanced techniques using contrast media in neuroimaging». Magnetic Resonance Imaging Clinics of North America. 20 (4): 699–713. doi:10.1016/j.mric.2012.07.007. PMC 3479680. PMID 23088946.
- ^ Trojano M, Paolicelli D (November 2001). «The differential diagnosis of multiple sclerosis: classification and clinical features of relapsing and progressive neurological syndromes». Neurological Sciences. 22 (Suppl 2): S98-102. doi:10.1007/s100720100044. PMID 11794488. S2CID 3057096.
- ^ a b c World Health Organization (2008). Atlas: Multiple Sclerosis Resources in the World 2008. Geneva: World Health Organization. pp. 15–16. hdl:10665/43968. ISBN 978-92-4-156375-8.
- ^ Poser CM, Brinar VV (June 2004). «Diagnostic criteria for multiple sclerosis: an historical review». Clinical Neurology and Neurosurgery. 106 (3): 147–58. doi:10.1016/j.clineuro.2004.02.004. PMID 15177763. S2CID 23452341.
- ^ Rovira À (November 2017). «Diagnosis of Multiple Sclerosis». Journal of the Belgian Society of Radiology. 101 (S1): 12. doi:10.5334/jbr-btr.1426.
- ^ a b McDonald WI, Compston A, Edan G, Goodkin D, Hartung HP, Lublin FD, McFarland HF, Paty DW, Polman CH, Reingold SC, Sandberg-Wollheim M, Sibley W, Thompson A, van den Noort S, Weinshenker BY, Wolinsky JS (July 2001). «Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis». Annals of Neurology. 50 (1): 121–7. doi:10.1002/ana.1032. PMID 11456302. S2CID 13870943.
- ^ Rashid W, Miller DH (February 2008). «Recent advances in neuroimaging of multiple sclerosis». Seminars in Neurology. 28 (1): 46–55. doi:10.1055/s-2007-1019127. PMID 18256986.
- ^ Sinnecker T, Clarke MA, Meier D, Enzinger C, Calabrese M, De Stefano N, et al. (MAGNIMS Study Group) (December 2019). «Evaluation of the Central Vein Sign as a Diagnostic Imaging Biomarker in Multiple Sclerosis». JAMA Neurology. 76 (12): 1446–1456. doi:10.1001/jamaneurol.2019.2478. PMC 6704746. PMID 31424490.
- ^ Bernitsas E (February 2020). «The Central Vein Sign». Practical Neurology. Archived from the original on 5 October 2021. Retrieved 5 October 2021.
- ^ Castellaro M, Tamanti A, Pisani AI, Pizzini FB, Crescenzo F, Calabrese M (November 2020). «The Use of the Central Vein Sign in the Diagnosis of Multiple Sclerosis: A Systematic Review and Meta-analysis». Diagnostics. 10 (12): 1025. doi:10.3390/diagnostics10121025. PMC 7760678. PMID 33260401.
- ^ Al-Zandi SH, Fayadh NA, Al-Waely NK (1 March 2018). «Central vein sign detected by SWI at 3 T MRI as a discriminator between multiple sclerosis and leukoaraiosis». The Egyptian Journal of Radiology and Nuclear Medicine. 49 (1): 158–164. doi:10.1016/j.ejrnm.2017.09.003.
- ^ Guisset F, Lolli V, Bugli C, Perrotta G, Absil J, Dachy B, et al. (June 2021). «The central vein sign in multiple sclerosis patients with vascular comorbidities» (PDF). Multiple Sclerosis. 27 (7): 1057–1065. doi:10.1177/1352458520943785. hdl:2078.1/239849. PMID 32749948. S2CID 220976821. Archived (PDF) from the original on 15 July 2021. Retrieved 5 October 2021.
- ^ Chapman M (16 June 2020). «$7.2M NIH Grant Supports Study of MS Diagnostic Biomarker». BioNews Services. Archived from the original on 5 October 2021. Retrieved 5 October 2021.
- ^ Andravizou A, Dardiotis E, Artemiadis A, Sokratous M, Siokas V, Tsouris Z, et al. (December 2019). «Brain atrophy in multiple sclerosis: mechanisms, clinical relevance and treatment options». Auto- Immunity Highlights. 10 (1): 7. doi:10.1186/s13317-019-0117-5. PMC 7065319. PMID 32257063.
- ^ Jacobsen C, Hagemeier J, Myhr KM, Nyland H, Lode K, Bergsland N, et al. (October 2014). «Brain atrophy and disability progression in multiple sclerosis patients: a 10-year follow-up study». Journal of Neurology, Neurosurgery, and Psychiatry. 85 (10): 1109–1115. doi:10.1136/jnnp-2013-306906. PMID 24554101. S2CID 6144791.
- ^ Link H, Huang YM (November 2006). «Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness». Journal of Neuroimmunology. 180 (1–2): 17–28. doi:10.1016/j.jneuroim.2006.07.006. PMID 16945427. S2CID 22724352.
- ^ a b c Solomon AJ (June 2019). «Diagnosis, Differential Diagnosis, and Misdiagnosis of Multiple Sclerosis». Continuum. 25 (3): 611–635. doi:10.1212/CON.0000000000000728. PMID 31162308. S2CID 173991777.
- ^ Lublin FD, et al. (15 July 2014). «Defining the clinical course of multiple sclerosis, The 2013 revisions». Neurology. 83 (3): 278–286. doi:10.1212/WNL.0000000000000560. PMC 4117366. PMID 24871874.
- ^ Lublin FD, Coetzee T, Cohen JA, Marrie RA, Thompson AJ (June 2020). «The 2013 clinical course descriptors for multiple sclerosis: A clarification». Neurology. 94 (24): 1088–1092. doi:10.1212/WNL.0000000000009636. PMC 7455332. PMID 32471886.
- ^ a b Miller D, Barkhof F, Montalban X, Thompson A, Filippi M (May 2005). «Clinically isolated syndromes suggestive of multiple sclerosis, part I: natural history, pathogenesis, diagnosis, and prognosis». The Lancet. Neurology. 4 (5): 281–8. doi:10.1016/S1474-4422(05)70071-5. PMID 15847841. S2CID 36401666.
- ^ a b c Miller DH, Leary SM (October 2007). «Primary-progressive multiple sclerosis». The Lancet. Neurology. 6 (10): 903–12. doi:10.1016/S1474-4422(07)70243-0. hdl:1871/24666. PMID 17884680. S2CID 31389841.
- ^ Rovaris M, Confavreux C, Furlan R, Kappos L, Comi G, Filippi M (April 2006). «Secondary progressive multiple sclerosis: current knowledge and future challenges». The Lancet. Neurology. 5 (4): 343–54. doi:10.1016/S1474-4422(06)70410-0. PMID 16545751. S2CID 39503553.
- ^ a b Sørensen PS, Centonze D, Giovannoni G, et al. (2020). «Expert opinion on the use of cladribine tablets in clinical practice». Ther Adv Neurol Disord (Review). 13: 1756286420935019. doi:10.1177/1756286420935019. PMC 7318823. PMID 32636933.
- ^ «Novartis receives FDA approval for Mayzent® (siponimod), the first oral drug to treat secondary progressive MS with active disease». Novartis.com. Archived from the original on 20 November 2020. Retrieved 12 November 2021.
- ^ Saida T (November 2004). «[Multiple sclerosis: treatment and prevention of relapses and progression in multiple sclerosis]». Rinsho Shinkeigaku (Review) (in Japanese). 44 (11): 796–8. PMID 15651294.
- ^ Pittock SJ, Rodriguez M (2008). «Benign multiple sclerosis: a distinct clinical entity with therapeutic implications». Current Topics in Microbiology and Immunology. 318: 1–17. doi:10.1007/978-3-540-73677-6_1. ISBN 978-3-540-73676-9. PMID 18219812.
- ^ Feinstein A (May 2005). «The clinical neuropsychiatry of multiple sclerosis». CNS Spectrums. 10 (5): 362. doi:10.1017/s1092852900022720. PMID 15858453. S2CID 231890354.
- ^ Stadelmann C, Brück W (November 2004). «Lessons from the neuropathology of atypical forms of multiple sclerosis». Neurological Sciences. 25 (Suppl 4): S319–S322. doi:10.1007/s10072-004-0333-1. PMID 15727225. S2CID 21212935.
- ^ Fujihara K (June 2019). «Neuromyelitis optica spectrum disorders: still evolving and broadening». Current Opinion in Neurology (Review). 32 (3): 385–394. doi:10.1097/WCO.0000000000000694. PMC 6522202. PMID 30893099.
- ^ Rae-Grant A, Day GS, Marrie RA, Rabinstein A, Cree BA, Gronseth GS, et al. (April 2018). «Practice guideline recommendations summary: Disease-modifying therapies for adults with multiple sclerosis: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology». Neurology. 90 (17): 777–788. doi:10.1212/WNL.0000000000005347. PMID 29686116.
- ^ Burton JM, O’Connor PW, Hohol M, Beyene J (December 2012). «Oral versus intravenous steroids for treatment of relapses in multiple sclerosis». The Cochrane Database of Systematic Reviews. 12: CD006921. doi:10.1002/14651858.CD006921.pub3. PMID 23235634.
- ^ Filippini G, Brusaferri F, Sibley WA, et al. (2000). «Corticosteroids or ACTH for acute exacerbations in multiple sclerosis». Cochrane Database Syst Rev (4): CD001331. doi:10.1002/14651858.CD001331. PMID 11034713.
- ^ The National Collaborating Centre for Chronic Conditions (2004). «Treatment of acute episodes». Multiple sclerosis : national clinical guideline for diagnosis and management in primary and secondary care. London: Royal College of Physicians. pp. 54–58. ISBN 1-86016-182-0. PMID 21290636. Archived from the original on 10 February 2023. Retrieved 5 October 2021.
- ^ Petzold A, Braithwaite T, van Oosten BW (January 2020). «Case for a new corticosteroid treatment trial in optic neuritis: review of updated evidence». J. Neurol. Neurosurg. Psychiatry (Review). 91 (1): 9–14. doi:10.1136/jnnp-2019-321653. PMC 6952848. PMID 31740484.
- ^ a b He D, Zhang C, Zhao X, Zhang Y, Dai Q, Li Y, Chu L (March 2016). «Teriflunomide for multiple sclerosis». The Cochrane Database of Systematic Reviews. 3: CD009882. doi:10.1002/14651858.CD009882.pub3. PMID 27003123.
- ^ a b Rice GP, Incorvaia B, Munari L, et al. (2001). «Interferon in relapsing-remitting multiple sclerosis». Cochrane Database Syst Rev. 2001 (4): CD002002. doi:10.1002/14651858.CD002002. PMC 7017973. PMID 11687131.
- ^ Hassan-Smith G, Douglas MR (November 2011). «Management and prognosis of multiple sclerosis». British Journal of Hospital Medicine. 72 (11): M174-6. doi:10.12968/hmed.2011.72.Sup11.M174. PMID 22082979.
- ^ Freedman MS (January 2011). «Long-term follow-up of clinical trials of multiple sclerosis therapies». Neurology. 76 (1 Suppl 1): S26-34. doi:10.1212/WNL.0b013e318205051d. PMID 21205679. S2CID 16929304.
- ^ Qizilbash N, Mendez I, Sanchez-de la Rosa R (January 2012). «Benefit-risk analysis of glatiramer acetate for relapsing-remitting and clinically isolated syndrome multiple sclerosis». Clinical Therapeutics. 34 (1): 159–176.e5. doi:10.1016/j.clinthera.2011.12.006. PMID 22284996.
- ^ Bates D (January 2011). «Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials». Neurology. 76 (1 Suppl 1): S14-25. doi:10.1212/WNL.0b013e3182050388. PMID 21205678. S2CID 362182.
- ^ Clerico M, Faggiano F, Palace J, et al. (April 2008). «Recombinant interferon beta or glatiramer acetate for delaying conversion of the first demyelinating event to multiple sclerosis». Cochrane Database Syst Rev (2): CD005278. doi:10.1002/14651858.CD005278.pub3. PMID 18425915.
- ^ Johnston J, So TY (June 2012). «First-line disease-modifying therapies in paediatric multiple sclerosis: a comprehensive overview». Drugs. 72 (9): 1195–211. doi:10.2165/11634010-000000000-00000. PMID 22642799. S2CID 20323687.
- ^ a b La Mantia L, Tramacere I, Firwana B, et al. (April 2016). «Fingolimod for relapsing-remitting multiple sclerosis». Cochrane Database Syst Rev. 4: CD009371. doi:10.1002/14651858.CD009371.pub2. PMID 27091121.
- ^ a b Xu Z, Zhang F, Sun F, et al. (April 2015). «Dimethyl fumarate for multiple sclerosis». Cochrane Database Syst Rev (4): CD011076. doi:10.1002/14651858.CD011076.pub2. PMID 25900414.
- ^ a b c d Killestein J, Rudick RA, Polman CH (November 2011). «Oral treatment for multiple sclerosis». The Lancet. Neurology. 10 (11): 1026–34. doi:10.1016/S1474-4422(11)70228-9. PMID 22014437. S2CID 206160178.
- ^ Filippini G, Del Giovane C, Clerico M, et al. (April 2017). «Treatment with disease-modifying drugs for people with a first clinical attack suggestive of multiple sclerosis». Cochrane Database Syst Rev. 4 (4): CD012200. doi:10.1002/14651858.CD012200.pub2. PMC 6478290. PMID 28440858.
- ^ a b c d Filippini G, Del Giovane C, Vacchi L, et al. (June 2013). «Immunomodulators and immunosuppressants for multiple sclerosis: a network meta-analysis» (PDF). Cochrane Database Syst Rev (6): CD008933. doi:10.1002/14651858.CD008933.pub2. PMID 23744561. Archived (PDF) from the original on 5 October 2021. Retrieved 5 October 2021.
- ^ La Mantia L, Di Pietrantonj C, Rovaris M, et al. (November 2016). «Interferons-beta versus glatiramer acetate for relapsing-remitting multiple sclerosis». Cochrane Database Syst Rev. 2016 (11): CD009333. doi:10.1002/14651858.CD009333.pub3. PMC 6464642. PMID 27880972.
- ^ a b c Tramacere I, Del Giovane C, Salanti G, D’Amico R, Filippini G (September 2015). «Immunomodulators and immunosuppressants for relapsing-remitting multiple sclerosis: a network meta-analysis». Cochrane Database Syst Rev. 2015 (9): CD011381. doi:10.1002/14651858.CD011381.pub2. hdl:11380/1082490. PMC 9235409. PMID 26384035.
- ^ «TG Therapeutics Announces FDA Approval of Briumvi (ublituximab-xiiy)» (Press release). TG Therapeutics. 28 December 2022. Archived from the original on 28 December 2022. Retrieved 29 December 2022 – via GlobeNewswire.
- ^ Bope ET, Kellerman RD (22 December 2011). Conn’s Current Therapy 2012: Expert Consult – Online and Print. Elsevier Health Sciences. pp. 662–. ISBN 978-1-4557-0738-6.
- ^ a b Martinelli Boneschi F, Vacchi L, Rovaris M, Capra R, Comi G (May 2013). «Mitoxantrone for multiple sclerosis». The Cochrane Database of Systematic Reviews. 5 (5): CD002127. doi:10.1002/14651858.CD002127.pub3. hdl:2434/533488. PMID 23728638.
- ^ Marriott JJ, Miyasaki JM, Gronseth G, O’Connor PW (May 2010). «Evidence Report: The efficacy and safety of mitoxantrone (Novantrone) in the treatment of multiple sclerosis: Report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology». Neurology. 74 (18): 1463–70. doi:10.1212/WNL.0b013e3181dc1ae0. PMC 2871006. PMID 20439849.
- ^ a b Faissner S, Gold R (2019). «Progressive multiple sclerosis: latest therapeutic developments and future directions». Ther Adv Neurol Disord. 12: 1756286419878323. doi:10.1177/1756286419878323. PMC 6764045. PMID 31598138.
- ^ Winslow R (28 March 2017). «After 40-year odyssey, first drug for aggressive MS wins FDA approval». STAT. Archived from the original on 1 April 2017.
- ^ a b «Ocrevus- ocrelizumab injection». DailyMed. 13 December 2019. Archived from the original on 27 June 2020. Retrieved 26 March 2020.
- ^ «BLA Approval Letter» (PDF). FDA. 28 March 2017. Archived (PDF) from the original on 2 April 2017.
- ^ Lin, Mengbing; Zhang, Jian; Zhang, Yueling; Luo, Jiefeng; Shi, Shengliang (18 May 2022). Cochrane Multiple Sclerosis and Rare Diseases of the CNS Group (ed.). «Ocrelizumab for multiple sclerosis». Cochrane Database of Systematic Reviews. 2022 (5): CD013247. doi:10.1002/14651858.CD013247.pub2. PMC 9115862. PMID 35583174.
- ^ Penner, IK; Schreiber, H (2023). Fatigue in Multiple Sclerosis. Springer, Cham. ISBN 978-3-031-13498-2.
- ^ a b Balak DM, Hengstman GJ, Çakmak A, Thio HB (December 2012). «Cutaneous adverse events associated with disease-modifying treatment in multiple sclerosis: a systematic review». Multiple Sclerosis. 18 (12): 1705–17. doi:10.1177/1352458512438239. hdl:1765/73097. PMID 22371220. S2CID 20343951. Archived from the original on 24 January 2021. Retrieved 5 September 2019.
- ^ Sládková T, Kostolanský F (2006). «The role of cytokines in the immune response to influenza A virus infection». Acta Virologica. 50 (3): 151–62. PMID 17131933.
- ^ La Mantia L, Munari LM, Lovati R (May 2010). «Glatiramer acetate for multiple sclerosis». The Cochrane Database of Systematic Reviews (5): CD004678. doi:10.1002/14651858.CD004678.pub2. PMID 20464733.
- ^ Tremlett H, Oger J (November 2004). «Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis». Journal of Neurology. 251 (11): 1297–303. doi:10.1007/s00415-004-0619-5. PMID 15592724. S2CID 12529733.
- ^ Comi G (October 2009). «Treatment of multiple sclerosis: role of natalizumab». Neurological Sciences. 30. 30 (S2): S155-8. doi:10.1007/s10072-009-0147-2. PMID 19882365. S2CID 25910077.
- ^ Hunt D, Giovannoni G (February 2012). «Natalizumab-associated progressive multifocal leucoencephalopathy: a practical approach to risk profiling and monitoring». Practical Neurology. 12 (1): 25–35. doi:10.1136/practneurol-2011-000092. PMID 22258169. S2CID 46326042.
- ^ «Biogen Idec’s TECFIDERA™ (Dimethyl Fumarate) Approved in US as a First-Line Oral Treatment for Multiple Sclerosis» (Press release). Biogen Idec. 27 March 2013. Archived from the original on 12 May 2013. Retrieved 4 June 2013.
- ^ «NDA 204063 – FDA Approved Labeling Text» (PDF). US Food and Drug Agency. 27 March 2013. Archived (PDF) from the original on 4 October 2013. Retrieved 5 April 2013.
«NDA Approval» (PDF). US Food and Drug Agency. 27 March 2013. Archived (PDF) from the original on 4 October 2013. Retrieved 5 April 2013. - ^ Kesselring J, Beer S (October 2005). «Symptomatic therapy and neurorehabilitation in multiple sclerosis». The Lancet. Neurology. 4 (10): 643–52. doi:10.1016/S1474-4422(05)70193-9. PMID 16168933. S2CID 28253186.
- ^ Khan F, Turner-Stokes L, Ng L, Kilpatrick T (April 2007). Khan F (ed.). «Multidisciplinary rehabilitation for adults with multiple sclerosis». The Cochrane Database of Systematic Reviews. 2011 (2): CD006036. doi:10.1002/14651858.CD006036.pub2. PMC 8992048. PMID 17443610.
- ^ Köpke S, Solari A, Rahn A, Khan F, Heesen C, Giordano A (October 2018). «Information provision for people with multiple sclerosis». The Cochrane Database of Systematic Reviews. 10 (10): CD008757. doi:10.1002/14651858.CD008757.pub3. PMC 6517040. PMID 30317542.
- ^ Steultjens EM, Dekker J, Bouter LM, Leemrijse CJ, van den Ende CH (May 2005). «Evidence of the efficacy of occupational therapy in different conditions: an overview of systematic reviews» (PDF). Clinical Rehabilitation. 19 (3): 247–54. doi:10.1191/0269215505cr870oa. hdl:1871/26505. PMID 15859525. S2CID 18785849. Archived (PDF) from the original on 4 August 2020. Retrieved 24 September 2019.
- ^ Steultjens EM, Dekker J, Bouter LM, Cardol M, Van de Nes JC, Van den Ende CH (2003). Steultjens EE (ed.). «Occupational therapy for multiple sclerosis» (PDF). The Cochrane Database of Systematic Reviews. 2010 (3): CD003608. doi:10.1002/14651858.CD003608. PMC 9022193. PMID 12917976. Archived (PDF) from the original on 28 April 2022. Retrieved 5 October 2021.
- ^ Amatya B, Khan F, Galea M (January 2019). «Rehabilitation for people with multiple sclerosis: an overview of Cochrane Reviews». The Cochrane Database of Systematic Reviews. 1 (1): CD012732. doi:10.1002/14651858.CD012732.pub2. PMC 6353175. PMID 30637728.
- ^ Heine M, van de Port I, Rietberg MB, van Wegen EE, Kwakkel G (September 2015). «Exercise therapy for fatigue in multiple sclerosis». The Cochrane Database of Systematic Reviews. 2015 (9): CD009956. doi:10.1002/14651858.CD009956.pub2. PMC 9554249. PMID 26358158.
- ^ Gallien P, Nicolas B, Robineau S, Pétrilli S, Houedakor J, Durufle A (July 2007). «Physical training and multiple sclerosis». Annales de Réadaptation et de Médecine Physique. 50 (6): 373–6, 369–72. doi:10.1016/j.annrmp.2007.04.004. PMID 17482708.
- ^ Rietberg MB, Brooks D, Uitdehaag BM, Kwakkel G (January 2005). Kwakkel G (ed.). «Exercise therapy for multiple sclerosis». The Cochrane Database of Systematic Reviews. 2005 (1): CD003980. doi:10.1002/14651858.CD003980.pub2. PMC 6485797. PMID 15674920.
- ^ Thomas PW, Thomas S, Hillier C, Galvin K, Baker R (January 2006). Thomas PW (ed.). «Psychological interventions for multiple sclerosis». The Cochrane Database of Systematic Reviews. 2010 (1): CD004431. doi:10.1002/14651858.CD004431.pub2. PMC 8406851. PMID 16437487.
- ^ Rosti-Otajärvi EM, Hämäläinen PI (February 2014). «Neuropsychological rehabilitation for multiple sclerosis». The Cochrane Database of Systematic Reviews (2): CD009131. doi:10.1002/14651858.CD009131.pub3. PMID 24515630.
- ^ Latorraca CO, Martimbianco AL, Pachito DV, Torloni MR, Pacheco RL, Pereira JG, Riera R (October 2019). «Palliative care interventions for people with multiple sclerosis». The Cochrane Database of Systematic Reviews. 2019 (10): CD012936. doi:10.1002/14651858.CD012936.pub2. PMC 6803560. PMID 31637711.
- ^ Hayes S, Galvin R, Kennedy C, Finlayson M, McGuigan C, Walsh CD, Coote S (November 2019). «Interventions for preventing falls in people with multiple sclerosis». The Cochrane Database of Systematic Reviews. 11 (11): CD012475. doi:10.1002/14651858.CD012475.pub2. PMC 6953359. PMID 31778221.
- ^ van den Akker LE, Beckerman H, Collette EH, Eijssen IC, Dekker J, de Groot V (November 2016). «Effectiveness of cognitive behavioral therapy for the treatment of fatigue in patients with multiple sclerosis: A systematic review and meta-analysis». Journal of Psychosomatic Research. 90: 33–42. doi:10.1016/j.jpsychores.2016.09.002. PMID 27772557.
- ^ Amatya B, Young J, Khan F (December 2018). «Non-pharmacological interventions for chronic pain in multiple sclerosis». The Cochrane Database of Systematic Reviews. 12 (12): CD012622. doi:10.1002/14651858.CD012622.pub2. PMC 6516893. PMID 30567012.
- ^ Corvillo I, Varela E, Armijo F, Alvarez-Badillo A, Armijo O, Maraver F (December 2017). «Efficacy of aquatic therapy for multiple sclerosis: a systematic review». Eur J Phys Rehabil Med (Review). 53 (6): 944–952. doi:10.23736/S1973-9087.17.04570-1. PMID 28215060.
- ^ Khan F, Amatya B, Bensmail D, Yelnik A (July 2019). «Non-pharmacological interventions for spasticity in adults: An overview of systematic reviews». Ann Phys Rehabil Med. 62 (4): 265–273. doi:10.1016/j.rehab.2017.10.001. PMID 29042299. S2CID 207497395.
- ^ Etoom M, Khraiwesh Y, Lena F, et al. (November 2018). «Effectiveness of Physiotherapy Interventions on Spasticity in People With Multiple Sclerosis: A Systematic Review and Meta-Analysis». Am J Phys Med Rehabil. 97 (11): 793–807. doi:10.1097/PHM.0000000000000970. PMID 29794531. S2CID 44156766.
- ^ Olsen SA (2009). «A review of complementary and alternative medicine (CAM) by people with multiple sclerosis». Occupational Therapy International. 16 (1): 57–70. doi:10.1002/oti.266. PMID 19222053.
- ^ Parks NE, Jackson-Tarlton CS, Vacchi L, Merdad R, Johnston BC (May 2020). «Dietary interventions for multiple sclerosis-related outcomes». The Cochrane Database of Systematic Reviews. 2020 (5): CD004192. doi:10.1002/14651858.CD004192.pub4. PMC 7388136. PMID 32428983.
- ^ Grigorian A, Araujo L, Naidu NN, Place DJ, Choudhury B, Demetriou M (November 2011). «N-acetylglucosamine inhibits T-helper 1 (Th1)/T-helper 17 (Th17) cell responses and treats experimental autoimmune encephalomyelitis». The Journal of Biological Chemistry. 286 (46): 40133–41. doi:10.1074/jbc.M111.277814. PMC 3220534. PMID 21965673.
- ^ Pozuelo-Moyano B, Benito-León J, Mitchell AJ, Hernández-Gallego J (2013). «A systematic review of randomized, double-blind, placebo-controlled trials examining the clinical efficacy of vitamin D in multiple sclerosis». Neuroepidemiology (Systematic review). 40 (3): 147–53. doi:10.1159/000345122. PMC 3649517. PMID 23257784.
the available evidence substantiates neither clinically significant benefit nor harm from vitamin D in the treatment of patients with MS
- ^ Chong MS, Wolff K, Wise K, Tanton C, Winstock A, Silber E (October 2006). «Cannabis use in patients with multiple sclerosis». Multiple Sclerosis. 12 (5): 646–51. doi:10.1177/1352458506070947. PMID 17086912. S2CID 34692470.
- ^ Torres-Moreno MC, Papaseit E, Torrens M, Farré M (October 2018). «Assessment of Efficacy and Tolerability of Medicinal Cannabinoids in Patients With Multiple Sclerosis: A Systematic Review and Meta-analysis». JAMA Network Open. 1 (6): e183485. doi:10.1001/jamanetworkopen.2018.3485. PMC 6324456. PMID 30646241.
- ^ Bennett M, Heard R (2004). Bennett MH (ed.). «Hyperbaric oxygen therapy for multiple sclerosis». The Cochrane Database of Systematic Reviews. 2011 (1): CD003057. doi:10.1002/14651858.CD003057.pub2. PMC 8407327. PMID 14974004.
- ^ Adams T (23 May 2010). «Gut instinct: the miracle of the parasitic hookworm». The Observer. Archived from the original on 24 October 2014.
- ^ Simpson R, Booth J, Lawrence M, Byrne S, Mair F, Mercer S (January 2014). «Mindfulness based interventions in multiple sclerosis—a systematic review». BMC Neurology. 14: 15. doi:10.1186/1471-2377-14-15. PMC 3900731. PMID 24438384.
- ^ Jagannath VA, Filippini G, Di Pietrantonj C, Asokan GV, Robak EW, Whamond L, Robinson SA (September 2018). «Vitamin D for the management of multiple sclerosis». The Cochrane Database of Systematic Reviews. 9 (9): CD008422. doi:10.1002/14651858.CD008422.pub3. PMC 6513642. PMID 30246874.
- ^ Motte J, Gold R (December 2020). «High-dose biotin in multiple sclerosis: the end of the road». Lancet Neurol. 19 (12): 965–966. doi:10.1016/S1474-4422(20)30353-7. PMID 33222766. S2CID 225049079.
- ^ Tryfonos C, Mantzorou M, Fotiou D, Vrizas M, Vadikolias K, Pavlidou E, Giaginis C (September 2019). «Dietary Supplements on Controlling Multiple Sclerosis Symptoms and Relapses: Current Clinical Evidence and Future Perspectives». Medicines. 6 (3): 95. doi:10.3390/medicines6030095. PMC 6789617. PMID 31547410.
- ^ Sedel F, Bernard D, Mock DM, Tourbah A (November 2016). «Targeting demyelination and virtual hypoxia with high-dose biotin as a treatment for progressive multiple sclerosis». Neuropharmacology. 110 (Pt B): 644–653. doi:10.1016/j.neuropharm.2015.08.028. PMID 26327679.
- ^ Goldschmidt CH, Cohen JA (July 2020). «The Rise and Fall of High-Dose Biotin to Treat Progressive Multiple Sclerosis». Neurotherapeutics. 17 (3): 968–970. doi:10.1007/s13311-020-00907-5. PMC 7609671. PMID 32761325.
- ^ a b c Cree BA, Hartung HP, Barnett M (June 2022). «New drugs for multiple sclerosis: new treatment algorithms». Curr Opin Neurol. 35 (3): 262–270. doi:10.1097/WCO.0000000000001063. PMID 35674067. S2CID 249438715.
- ^ a b c d Oh J, Vidal-Jordana A, Montalban X (December 2018). «Multiple sclerosis: clinical aspects». Curr Opin Neurol. 31 (6): 752–759. doi:10.1097/WCO.0000000000000622. PMID 30300239. S2CID 6103857.
- ^ Hauser SL, Cree BA (December 2020). «Treatment of Multiple Sclerosis: A Review». Am J Med. 133 (12): 1380–1390.e2. doi:10.1016/j.amjmed.2020.05.049. PMC 7704606. PMID 32682869.
- ^ a b Ontaneda D (June 2019). «Progressive Multiple Sclerosis». Continuum (Minneap Minn). 25 (3): 736–752. doi:10.1212/CON.0000000000000727. PMID 31162314. S2CID 174808956.
- ^ Inojosa H, Proschmann U, Akgün K, Ziemssen T (April 2021). «A focus on secondary progressive multiple sclerosis (SPMS): challenges in diagnosis and definition». J Neurol. 268 (4): 1210–1221. doi:10.1007/s00415-019-09489-5. PMID 31363847. S2CID 198999832. Expanded Disability Status Scale (EDSS) 6.0 is equivalent to requiring a walking aid, and EDSS 8.0 equivalent to chair or bedbound
- ^ a b c Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O (April 2018). «Multiple sclerosis». Lancet. 391 (10130): 1622–1636. doi:10.1016/S0140-6736(18)30481-1. PMID 29576504. S2CID 4313310.
- ^ Lunde, Hanne Marie Bøe; Assmus, Jörg; Myhr, Kjell-Morten; Bø, Lars; Grytten, Nina (2017). «Survival and cause of death in multiple sclerosis: a 60-year longitudinal population study». Journal of Neurology, Neurosurgery & Psychiatry. 88 (8): 621–625. doi:10.1136/jnnp-2016-315238. ISSN 0022-3050. PMC 5537547. PMID 28365589.
- ^ Multiple Sclerosis International Federation (September 2020). «Atlas of MS» (PDF).
- ^ a b Compston A (October 1988). «The 150th anniversary of the first depiction of the lesions of multiple sclerosis». Journal of Neurology, Neurosurgery, and Psychiatry. 51 (10): 1249–52. doi:10.1136/jnnp.51.10.1249. PMC 1032909. PMID 3066846.
- ^ Lassmann H (October 1999). «The pathology of multiple sclerosis and its evolution». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 354 (1390): 1635–40. doi:10.1098/rstb.1999.0508. PMC 1692680. PMID 10603616.
- ^ Lassmann H (July 2005). «Multiple sclerosis pathology: evolution of pathogenetic concepts». Brain Pathology. 15 (3): 217–22. doi:10.1111/j.1750-3639.2005.tb00523.x. PMC 8095927. PMID 16196388. S2CID 8342303.
- ^ a b c Milo R, Miller A (April 2014). «Revised diagnostic criteria of multiple sclerosis». Autoimmunity Reviews. 13 (4–5): 518–524. doi:10.1016/j.autrev.2014.01.012. PMID 24424194.
- ^ a b Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M, Fujihara K, Havrdova E, Hutchinson M, Kappos L, Lublin FD, Montalban X, O’Connor P, Sandberg-Wollheim M, Thompson AJ, Waubant E, Weinshenker B, Wolinsky JS (February 2011). «Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria». Annals of Neurology. 69 (2): 292–302. doi:10.1002/ana.22366. PMC 3084507. PMID 21387374.
- ^ Lublin FD, Reingold SC, Cohen JA, Cutter GR, Sørensen PS, Thompson AJ, Wolinsky JS, Balcer LJ, Banwell B, Barkhof F, Bebo B, Calabresi PA, Clanet M, Comi G, Fox RJ, Freedman MS, Goodman AD, Inglese M, Kappos L, Kieseier BC, Lincoln JA, Lubetzki C, Miller AE, Montalban X, O’Connor PW, Petkau J, Pozzilli C, Rudick RA, Sormani MP, Stüve O, Waubant E, Polman CH (July 2014). «Defining the clinical course of multiple sclerosis: the 2013 revisions». Neurology. 83 (3): 278–86. doi:10.1212/WNL.0000000000000560. PMC 4117366. PMID 24871874.
- ^ Sørensen PS, Centonze D, Giovannoni G, Montalban X, Selchen D, Vermersch P, et al. (24 June 2020). «Expert opinion on the use of cladribine tablets in clinical practice». Therapeutic Advances in Neurological Disorders. 13: 1756286420935019. doi:10.1177/1756286420935019. PMC 7318823. PMID 32636933.
- ^ Medaer R (September 1979). «Does the history of multiple sclerosis go back as far as the 14th century?». Acta Neurologica Scandinavica. 60 (3): 189–92. doi:10.1111/j.1600-0447.1979.tb08970.x. PMID 390966. S2CID 221422840.
- ^ Holmøy T (2006). «A Norse contribution to the history of neurological diseases». European Neurology. 55 (1): 57–8. doi:10.1159/000091431. PMID 16479124.
- ^ Firth D (1948). The Case of August D’Esté. Cambridge: Cambridge University Press.
- ^ a b Pearce JM (2005). «Historical descriptions of multiple sclerosis». European Neurology. 54 (1): 49–53. doi:10.1159/000087387. PMID 16103678.
- ^ Barbellion WN (1919). The Journal of a Disappointed Man. New York: George H. Doran. ISBN 0-7012-1906-8.
- ^ Bar-Or A, Pender MP, Khanna R, Steinman L, Hartung HP, Maniar T, et al. (March 2020). «Epstein-Barr Virus in Multiple Sclerosis: Theory and Emerging Immunotherapies». Trends in Molecular Medicine. 26 (3): 296–310. doi:10.1016/j.molmed.2019.11.003. PMC 7106557. PMID 31862243.
- ^ DeLorenze GN, Munger KL, Lennette ET, Orentreich N, Vogelman JH, Ascherio A (June 2006). «Epstein-Barr virus and multiple sclerosis: evidence of association from a prospective study with long-term follow-up». Archives of Neurology. 63 (6): 839–844. doi:10.1001/archneur.63.6.noc50328. PMID 16606758.
- ^ Hauser SL, Bar-Or A, Comi G, Giovannoni G, Hartung HP, Hemmer B, et al. (January 2017). «Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis». The New England Journal of Medicine. 376 (3): 221–234. doi:10.1056/NEJMoa1601277. PMID 28002679. S2CID 205099904.
- ^ Lanz TV, Brewer RC, Ho PP, Moon JS, Jude KM, Fernandez D, et al. (March 2022). «Clonally expanded B cells in multiple sclerosis bind EBV EBNA1 and GlialCAM». Nature. 603 (7900): 321–327. doi:10.1038/s41586-022-04432-7. PMC 9382663. PMID 35073561.
- ^ Yang C, Hao Z, Zhang L, Zeng L, Wen J (October 2015). «Sodium channel blockers for neuroprotection in multiple sclerosis». The Cochrane Database of Systematic Reviews. 2015 (10): CD010422. doi:10.1002/14651858.CD010422.pub2. PMC 9242538. PMID 26486929.
- ^ a b Misu T, Fujihara K (February 2019). «Neuromyelitis optica spectrum and myelin oligodendrocyte glycoprotein antibody‐related disseminated encephalomyelitis». Clinical and Experimental Neuroimmunology. 10 (1): 9–17. doi:10.1111/cen3.12491.
- ^ Kira JI, Yamasaki R, Ogata H (2019). «Anti-neurofascin autoantibody and demyelination». Neurochemistry International. 130: 104360. doi:10.1016/j.neuint.2018.12.011. PMID 30582947.
- ^ Popescu BF, Pirko I, Lucchinetti CF (August 2013). «Pathology of multiple sclerosis: where do we stand?». Continuum (Minneapolis, Minn.). 19 (4 Multiple Sclerosis): 901–21. doi:10.1212/01.CON.0000433291.23091.65. PMC 3915566. PMID 23917093.
- ^ Mehta V, Pei W, Yang G, Li S, Swamy E, Boster A, Schmalbrock P, Pitt D (2013). «Iron is a sensitive biomarker for inflammation in multiple sclerosis lesions». PLOS ONE. 8 (3): e57573. Bibcode:2013PLoSO…857573M. doi:10.1371/journal.pone.0057573. PMC 3597727. PMID 23516409.
- ^ Khalil M, Teunissen CE, Otto M, Piehl F, Sormani MP, Gattringer T, et al. (October 2018). «Neurofilaments as biomarkers in neurological disorders» (PDF). Nature Reviews. Neurology. 14 (10): 577–589. doi:10.1038/s41582-018-0058-z. PMID 30171200. S2CID 52140127. Archived (PDF) from the original on 24 January 2021. Retrieved 19 September 2020.
- ^ Petzold A (June 2005). «Neurofilament phosphoforms: surrogate markers for axonal injury, degeneration and loss» (PDF). Journal of the Neurological Sciences. 233 (1–2): 183–98. doi:10.1016/j.jns.2005.03.015. PMID 15896809. S2CID 18311152. Archived (PDF) from the original on 22 September 2017. Retrieved 19 September 2020.
- ^ a b c d Filippi M, Rocca MA, De Stefano N, Enzinger C, Fisher E, Horsfield MA, Inglese M, Pelletier D, Comi G (December 2011). «Magnetic resonance techniques in multiple sclerosis: the present and the future». Archives of Neurology. 68 (12): 1514–20. doi:10.1001/archneurol.2011.914. PMID 22159052.
- ^ Swanberg KM, Landheer K, Pitt D, Juchem C (2019). «Quantifying the Metabolic Signature of Multiple Sclerosis by in vivo Proton Magnetic Resonance Spectroscopy: Current Challenges and Future Outlook in the Translation From Proton Signal to Diagnostic Biomarker». Frontiers in Neurology. 10: 1173. doi:10.3389/fneur.2019.01173. PMC 6876616. PMID 31803127.
- ^ Moghadasi AN, Mirmosayyeb O, Barzegar M, Sahraian MA, Ghajarzadeh M (August 2021). «The prevalence of COVID-19 infection in patients with multiple sclerosis (MS): a systematic review and meta-analysis». Neurol Sci. 42 (8): 3093–3099. doi:10.1007/s10072-021-05373-1. PMC 8184129. PMID 34100130.
- ^ Prinz M (3 November 2017). «Faculty Opinions recommendation of Gut microbiota from multiple sclerosis patients enables spontaneous autoimmune encephalomyelitis in mice». Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature. doi:10.3410/f.731077576.793538553.
- ^ Aranow C (August 2011). «Vitamin D and the immune system». Journal of Investigative Medicine. 59 (6): 881–886. doi:10.2310/jim.0b013e31821b8755. PMC 3166406. PMID 21527855.
- ^ Tada T, Takemori T, Okumura K, Nonaka M, Tokuhisa T (February 1978). «Two distinct types of helper T cells involved in the secondary antibody response: independent and synergistic effects of Ia- and Ia+ helper T cells». The Journal of Experimental Medicine. 147 (2): 446–458. doi:10.1084/jem.147.2.446. PMC 2184496. PMID 415110.
- ^ Lassmann H (March 2018). «Multiple Sclerosis Pathology». Cold Spring Harbor Perspectives in Medicine. 8 (3): a028936. doi:10.1101/cshperspect.a028936. PMC 5830904. PMID 29358320.
- ^ «Pathogenesis of HIV-Associated Dementia and Multiple Sclerosis: Role of Microglia and Astrocytes», The Role of Glia in Neurotoxicity, CRC Press, pp. 283–298, 28 December 2004, doi:10.1201/9781420039740-21, ISBN 9780429128608
External links[edit]
- Multiple sclerosis at Curlie
- Database for analysis and comparison of global data on the epidemiology of MS
Рассеянный склероз (РС) – это аутоиммунное заболевание, при котором возникает поражение головного и спинного мозга. В первую очередь повреждаются оболочки нервных волокон, содержащие миелин. Повреждение неравномерно распределяется в нервной системе – формируются рассеянные очаги демиелинизации. Структурно очаги напоминают рубец.
Рассеянный склероз характеризуется волнообразным течением с периодами обострения и полной или частичной ремиссии. Рассеянный склероз поражает в основном молодых людей в возрасте от 20 до 40 лет. Заболевание редко дебютирует в детском возрасте и по достижению пятидесяти лет. В настоящее время в мире насчитывается около 3 млн. больных РС. Женщины болеют в 1,5-2 раза чаще мужчин.
Лечение РС в Юсуповской больнице
Неврологи Юсуповской больницы применяют инновационные методики, имеют большой опыт в лечении пациентов с рассеянным склерозом. После проведенного комплексного лечения пациенты проходят программы реабилитации, медико-социальной адаптации, улучшается качество и продолжительность их жизни.
В клинике неврологии созданы все условия для лечения пациентов:
- Комфортные палаты;
- Диетическое питание;
- Профессиональное выполнение всех манипуляций;
- Внимательное отношение медицинского персонала к пожеланиям пациентов и их родственников.
Заболевание поражает преимущественно пациентов от 15 до 45 лет. Известны случаи, когда болезнь диагностировали у детей 2-х лет. В возрасте после 50 лет риск заболевания становится значительно меньше.
Рассеянный склероз развивается постепенно, а его проявления становятся визуально заметны только в тот момент, когда пострадала уже половина нервов. На этой стадии отмечается следующая симптоматика:
- ухудшение зрения;
- болевой синдром и раздвоение в глазах;
- ощущения покалывания в пальцах;
- онемение пальцев;
- уменьшение чувствительности кожных покровов;
- слабость в мышцах;
- ухудшение координации.
Врачи Юсуповской больницы проводят полное обследование пациента и назначают комплексное лечение под наблюдением.
Причины и механизмы развития заболевания
Ученые пока не определили точной причины РС. Известны следующие факторы, провоцирующие дебют заболевания:
- Возраст – заболевание может поражать людей любого возраста, однако чаще диагностируется от 16 до 55 лет;
- Пол – рецидивирующе-ремиттирующий склероз поражает женщин почти в три раза чаще, чем мужчин;
- Отягощённая наследственность – если у кого-то из кровных родственников был рассеянный склероз, риск его возникновения значительно возрастает;
- Возбудители инфекций – заболевание может быть связано с инфицированием вирусами, в том числе Эпштейн-Барра, вызывающего развитие инфекционного мононуклеоза;
- Расовая принадлежность – риск развития рассеянного склероза выше у белых людей, особенно родом из Северной Европы, чем, например, у жителей Азии, Африки и Индии;
- Климат – болезнь чаще поражает людей из стран с умеренным климатом: Канады, северной части США, Новой Зеландии, северной Европы и юго-восточной Австралии;
- Уровень витамина D – при недостатке солнечного света и связанным с этим дефицитом витамина D риск развития рассеянного склероза возрастает;
- Некоторые аутоиммунные заболевания – рассеянный склероз возникает чаще у пациентов, страдающих патологией щитовидной железы, сахарным диабетом первого типа, воспалительными процессами кишечника.
Основной причиной развития заболевания является дисфункция иммунной системы. Кроме того, возникновение рассеянного склероза может быть спровоцировано следующими предрасполагающими факторами:
- вирусными и бактериальными заболеваниями;
- сильными стрессами;
- дефицитом витамина D в организме;
- генетической предрасположенностью.
По мере развития поражений нервные волокна могут разрушаться или повреждаться. В результате электрические импульсы мозга не проходят надлежащим образом к целевому нерву. Это означает, что организм не может выполнять определенные функции.
Когда миелиновая оболочка исчезает или получает повреждения, во многих областях центральной нервной системы образуются рубцы. Они влияют на следующие участки ЦНС:
- Мозжечок, который координирует движения и контролирует равновесие;
- Спинной мозг;
- Зрительные нервы;
- Белое вещество в некоторых областях мозга.
Наследственная природа
Рассеянный склероз – мультифакторное наследственно детерминированное аутоиммунное заболевание. Оно развивается под воздействием внешних и внутренних факторов. Риск развития заболевания у ребёнка, один из родителей которого страдает рассеянным склерозом, не превышает 3%. Это достаточно низкий показатель.
Сегодня известны следующие причины рассеянного склероза:
- заболевание чаще встречается у лиц, проживающих на всех континентах северней 30 параллели;
- огромную роль в возникновении рассеянного склероза играют аутоиммунные механизмы, которые активизируются под воздействием Т-лимфоцитов, вследствие чего повреждаются липиды и белки миелиновой оболочки;
- предполагается, что заболевание может развиться при нехватке в организме витамина Д и под воздействием вирусов.
Рассеянный склероз передаётся по наследству. Вероятность заболеть у детей больного рассеянным склерозом ниже, чем у его братьев и сестёр. Наследственная предрасположенность зависит от многих независимых генов. В развитии рассеянного склероза принимают участие гены, расположенные на седьмой хромосоме, а также гены тяжелых цепей иммуноглобулинов. У больных рассеянным склерозом отсутствуют протективные локусы, выявляемые у здоровых людей.
Причины РС у молодых людей
Результаты последних исследований позволяют предположить, что рассеянный склероз у молодых людей возникает в силу тех же причин, что и у людей старшего возраста. Независимо от возраста у человека может быть генетическая предрасположенность к заболеванию. Негативные факторы окружающей среды воздействуют на людей разного возраста тоже одинаково.
До наступления полового созревания подобное заболевание диагностируется у равного количества девочек и мальчиков, после наступления половой зрелости – чаще у девочек. Этот факт свидетельствует о влиянии гормональных изменений, происходящих в этот период.
Российская статистика свидетельствует, что в нашей стране больных РС около 90 тысяч человек, но некоторые ученые считают, что около 150 тысяч. Такой разброс может быть связан с тем, что люди не всегда обращаются к специалистам при проявлении симптомов.
Рассеянный склероз: ремиттирующее течение заболевания
Проявления рассеянного склероза различны и носят индивидуальный характер, поэтому диагноз «рассеянный склероз» озвучивается сначала только предположительно. Учитывается набор симптомов, характер их рецидивирования, локализация нарушений в организме, а также результаты лабораторных и инструментальных исследований (в частности, МРТ). Последующее развитие рассеянного склероза предсказать достаточно сложно. Зачастую лишь через несколько лет после появления первых симптомов врачу удается с точностью установить диагноз «рассеянный склероз» и предположить, как именно будет протекать заболевание в дальнейшем.
В зависимости от течения рассеянный склероз может быть:
- ремиттирующим;
- первично-прогрессирующим;
- вторично-прогрессирующим;
- прогрессирующе-ремиттирующим.
При ремиттирующем рассеянном склерозе отмечаются непредсказуемые заранее острые приступы (рецидивы), на фоне которых ухудшаются симптомы заболевания. После этого может произойти полное либо частичное восстановление функций пораженных органов, в некоторых случаях функции не восстанавливаются. Очередной рецидив может развиваться через несколько дней либо недель. Иногда для восстановления после приступа может потребоваться более длительное время – до нескольких месяцев. В промежутках между приступами ухудшение состояния больного не происходит. Такая схема заболевания характерна для большинства пациентов на начальных стадиях рассеянного склероза.
Психосоматика
В развитии рассеянного склероза большое значение уделяется психосоматике. Многие исследователи связывают дебют заболевания с травмами (в том числе и в детском возрасте). В этот момент человек ощущал свою острую беспомощность и незащищенность. Компенсируя свои эмоции, он чувствовал гнев. Некоторые люди, ощущая беспомощность, настолько поглощались этим чувством, что блокировали свой гнев, оставаясь целиком подавленными.
Больной рассеянным склерозом нередко ощущает негодование, враждебность, направленную на события и людей из прошлого. Боясь повторения своих ошибок, повторного попадания в аналогичную ситуацию, он блокирует собственное развитие, боится перемен в жизни. Пережитая травма привела к ослаблению всех энергетических ресурсов человека. Поэтому все его усилия сейчас направлены на экономию того оставшегося малого ресурса. При этом он осознанно ограничивает себя от попыток изменить свою жизнь.
Луиза Хей и другие авторы о психосоматике РС
Целительница Инна Сигал определила психосоматические причины развития рассеянного склероза:
- Человек чрезмерно давил на себя;
- Ощущал собственную неполноценность;
- Создавал помехи самому себе;
- В пользу интересов других пренебрегал собственными потребностями;
- Чувствовал потерю связи с самим собой и окружающими;
- Страдал истощением, беспокойством, чувством ложного стыда и вины.
По мнению известного психолога Лиз Бурбо, развитие рассеянного склероза обусловлено следующими факторами:
- Подавлением собственного гнева;
- Слишком строгими требованиями к своей личности, черствостью по отношению к себе и окружающим;
- Неуверенностью в себе, отказом жить в свое удовольствие.
Как утверждает еще один знаменитый психолог Луиза Хей, рассеянный склероз –следствие жесткости мышления, жестокосердия, железной воли, отсутствия страха и гибкости.
Симптомы рассеянного склероза
У больных рассеянным склерозом наблюдается различная симптоматика. Заболевание может протекать в лёгкой форме или проявляться тяжёлыми нарушениями нервных функций.
Рассеянный склероз характеризуется следующими общими симптомами:
- Сложностью с ходьбой;
- Усталостью;
- Нарушением зрения;
- Онемением конечностей;
- Покалыванием под кожей;
- Эректильной дисфункцией;
- Расстройством процесса мочеиспускания и опорожнения кишечника;
- Болевыми ощущениями;
- Депрессией;
- Проблемами с запоминанием и фокусированием мысли.
Болезнь часто проявляется в 20-40 лет. Большинство больных рассеянным склерозом страдают от приступов и рецидивов, в результате которых наступает заметное ухудшение состояния. После приступов организм восстанавливается, но со временем проявления болезни усугубляются.
На этом этапе болезнь проявляется следующими нарушениями:
- нарушением зрения в одном или обоих глазах;
- болью и двоением в глазах;
- ощущением онемения и покалывания в пальцах;
- снижением чувствительности кожных покровов;
- мышечной слабостью;
- нарушением координации движений.
По мере роста и увеличения количества склеротических бляшек появляются и другие симптомы рассеянного склероза:
- возникают спазмы и болевые ощущения в мышцах;
- нарушается процесс мочеиспускания и дефекации;
- развивается эректильная дисфункция у мужчин;
- появляются патологические пирамидные рефлексы, выявляемые неврологом;
- повышается утомляемость при выполнении физических действий;
- возникает паралич тройничного, глазодвигательного, подъязычного и лицевого нервов;
- развивается паралич верхних или нижних конечностей, затрудняются произвольные движения;
- нарушается поведение больного, снижается его интеллект;
- эмоциональное состояние становится неустойчивым, депрессии сменяются эйфориями.
Прием горячей ванны, жара в помещении могут временно ухудшить состояние больного, поэтому перегрева следует избегать.
Для РС также характерно поражение зрительного нерва. Оптический неврит – типичное проявление поражения зрительных путей при рассеянном склерозе. Проявляется болью в одном глазу, усиливающейся при движениях глазного яблока, с последующим снижением зрения различной степени выраженности.
Расстройства функции тазовых органов – частое проявление рассеянного склероза. Проявляется императивными позывами или задержками на мочеиспускания, запором. По мере прогрессирования заболевания возможно развитие недержания мочи и кала. У мужчин с РС может развиться эректильная дисфункция, которая, помимо поражения спинного мозга, может быть также обусловлена психосоциальными факторами.
Типичнейший, почти патогномоничный признак рассеянного склероза – появление или ухудшение симптоматики при повышении температуры тела (например, после приёма горячей ванны или после того, как человек выпил горячий чай). Редкие клинические проявления рассеянного склероза – эпилептиформные припадки (наблюдают у 2–3% пациентов) и пароксизмальные симптомы (кратковременные стереотипные эпизоды диплопии, лицевых парестезий, тригеминальной невралгии, атаксии, дизартрии либо двигательных нарушений – болезненных тонических спазмов мышц одной или двух конечностей, туловища, иногда лица). Редко развиваются нарушения высших мозговых функций (афазия, агнозия, апраксия), экстрапирамидные нарушения (ригидность, хорея, атетоз).
Типы течения заболевания рассеянного склероза
На основе типа течения заболевания выделяют клинические формы рассеянного склероза:
- Ремитирующий;
- Вторично-прогрессирующий;
- Первично-прогрессирующий;
- Первично-прогрессирующий РС с обострениями.
Рассеянный склероз развивается волнообразно с периодами ухудшения и улучшения. Со временем реммитирующий рассеянный склероз может перейти во вторичное прогрессирование.
Первично-прогрессирующий склероз развивается преимущественно у мужчин. При первично-прогрессирующем заболевании симптоматика нарастает постоянно, постепенно приводя к тяжёлой инвалидности. Отмечаются следующие симптомы:
- Затруднения при ходьбе;
- Слабость в ногах или тугоподвижность;
- Нарушение равновесия.
Также у пациентов отмечаются проблемы с речью и зрением, затруднения при глотании, быстрое наступление чувства усталости. У них нарушается функция кишечника и мочевого пузыря.
Проблема первично-прогрессирующего рассеянного склероза во многом состоит в том, что диагноз таким пациентам ставится довольно поздно. Требуется время для наблюдения пациента и проведения широкого спектра дополнительных обследований для исключения других возможных причин неврологической симптоматики. Правильный диагноз ППРС требует от врача-невролога высокого профессионализма, глубокого знания диагностических методов и «готовности» распознать и правильно интерпретировать симптомы. Этими качествами обладают профессора и врачи высшей категории центра лечения рассеянного склероза Юсуповской больницы.
Лечение вторично-прогрессирующего рассеянного склероза остаётся одной из наиболее сложных проблем, так как на этом этапе развития болезни наиболее выражены необратимые нейродегенеративные изменения. В лечении вторично-прогрессирующего рассеянного склероза в настоящее время выделяют основные тенденции: пациентам с сохранением обострений можно рассмотреть назначение бетаферона или митоксантроната. Единственный препарат, направленный на лечение прогрессирующего рассеянного склероза, – окревус. Он зарегистрирован в США в 2017 году. В Юсуповской больнице имеется хороший положительный опыт применения окревуса для лечения пациентов со вторично-прогрессирующим рассеянным склерозом.
Исследования учёных
Учёные постоянно проводят научные исследования для того, чтобы выяснить точные механизмы развития РС и разрабатывают эффективные методики лечения заболевания. Врачи клиники неврологии Юсуповской больницы тесно сотрудничают с ведущими НИИ, занимающимися подобной проблемой. Они на практике используют результаты новейших научных исследований.
Диагностика заболевания выполняется с применением современных методик: нейровизуализационных методов, электроэнцефалографии, точных иммунологических тестов. Благодаря внедрению в практику инновационных диагностических методик рассеянный склероз выявляется своевременно. Это позволяет рано начать эффективную терапию, которая сохраняет пациенту высокое качество жизни.
Последние исследования, проведенные в 2019 году, позволяют сделать следующие заключения:
- Группа американских ученых занималась исследованием, результаты которого доказали, что симптомы рассеянного склероза появляются уже на начальной стадии развития заболевания. Явные признаки склероза могут дополняться когнитивными расстройствами (снижением памяти, падением качества умственных способностей), нарушениями тактильной функции, координации, постоянной выраженной усталостью и депрессивными состояниями;
- Исследователям удалось выяснить, что развитие рассеянного склероза тесно связано с концентрацией витамина D в организме. Иммунная система больного постепенно утрачивает возможность отличать пораженные клетки от неизмененных. Усугубление данной ситуации происходит при дефиците витамина D, который представляет собой защитный фактор для нервных волокон;
- Недавно была выявлена связь между рассеянным склерозом и курением. Выяснилось, что даже здоровые клетки иммунной системы у больных не способны в полной мере защититься от чужеродных тел, что еще в большей степени повышает риск развития рассеянного склероза;
- Приостановить процесс демиелинизации и улучшить передачу импульсов по зрительному нерву от сетчатки к головному мозгу у больных, страдающих рассеянным склерозом, помогает недавно разработанный метод иммунотерапии, в ходе которого вводятся моноклональные антитела;
- Приостановить прогрессирование заболевания можно путем пересадки стволовых клеток. У пациента изымают собственные клетки гемопоэза, обрабатывают их посредством химиотерапии (для уничтожения пораженных клеток) и возвращают обратно в кровь больного. В результате происходит «перезапуск» иммунной системы. Этот способ лечения находится в стадии изучения, исследования в данном направлении еще продолжаются.
Ранняя диагностика
На сегодняшний день специальный тест, подтверждающий диагноз, не разработан. В основе диагностики рассеянного склероза лежат основные принципы: жалобы пациента, данные анамнеза болезни и жизни, клинические проявления, которые затрагивают разные области ЦНС и появляются в разное время. После получения результатов исследований неврологи проводят дифференциальную диагностику РС с другими заболеваниями, которые проявляются похожими симптомами.
В 2010 году критерии диагностики были уточнены, и теперь заболевание можно выявить более, чем у 80% больных в течение одного года после возникновения первых признаков, в отличие от предыдущих лет, когда диагноз устанавливался максимум в 40% случаев в соответствии с симптоматикой.
Диагностика РС в Юсуповской больнице
Врачи клиники неврологии устанавливают диагноз «рассеянный склероз» на основании следующих критериев:
- Начало заболевания в возрасте 20-50 лет;
- Наличие симптомов, свидетельствующих о заболевании спинного или головного мозга;
- МРТ-признаки двух или более очагов демиелинизации;
- Два и больше эпизодов обострений длительностью не менее 24 часов с интервалом в один месяц;
- Отсутствие альтернативного объяснения имеющихся симптомов.
Неврологи Юсуповской больницы используют следующие методы диагностики рассеянного склероза:
- Вызванные потенциалы (ЭМГ ВП). Этот метод основан на том, что при рассеянном склерозе вследствие разрушения миелина (изолятора нервных проводников) замедляется проведение нервных импульсов. Скорость их проведения регистрируется специальной аппаратурой и подвергается компьютерной обработке. На основании полученных данных врачи устанавливают процент снижения скорости проведения нервных импульсов, что является косвенным свидетельством наличия демиелинизирующей патологии;
- Магниторезонансную томографию, которая позволяет чётко визуализировать участки демиелинизации;
- Исследование цереброспинальной жидкости, полученной посредством люмбальной пункции. Положительные результаты тестов обнаруживаются у 90 % пациентов с рассеянным склерозом;
- Биохимическое исследование крови – позволяет с помощью специальных реактивов определить наличие в крови определённых веществ, которые содержатся у больных рассеянным склерозом;
- Офтальмологическое обследование позволяет врачу-окулисту обнаружить на глазном дне характерные изменения и обнаружить феномен выпадения полей зрения.
Комплексное использование врачами Юсуповской больницы клинических, рентгенологических, лабораторных и электрофизиологических признаков позволяет поставить диагноз на ранней стадии заболевания, оценить характер течения, стадию и остроту процесса. Ранняя диагностика рассеянного склероза имеет огромное значение, поскольку своевременно назначенное лечение может замедлить прогрессирование заболевания.
МРТ при рассеянном склерозе
Для того чтобы установить диагноз рассеянный склероз, в Юсуповской больнице проводят магнитно-резонансную томографию (МРТ) головного мозга. В ходе проведения МРТ головы визуализируются очаги рассеянного склероза (бляшки), имеющие свои особенности, по которым данное заболевание дифференцируется с очаговым поражением головного мозга и другими патологиями, в т. ч. дисциркуляторной энцефалопатией. На основе диагностических критериев можно определить заболевание, выявить его обострение либо ремиссию, а также подобрать адекватное лечение.
Грамотная диагностика рассеянного склероза возможна при высоком уровне специализации МРТ-диагноста, владеющего знанием основных признаков данного заболевания. Поэтому для проведения подобного исследования необходимо выбрать клинику, обладающую современной аппаратурой и штатом высококлассных специалистов. В Москве такой клиникой является Юсуповская больница с собственным научно-практическим центром, где помогут не только диагностировать рассеянный склероз, но и подобрать эффективную терапию для улучшения качества жизни больного.
Анализ МРТ при РС может подтвердить наличие заболевания по следующим признакам:
- Диссеминация во времени (очаги увеличиваются на серии исследований);
- Критерий диссеминации в пространстве (новые очаги появляются в областях головного мозга, не тронутых ранее);
- Скопление контрастного препарата (по краю очага рассеянного склероза появляется кольцевидный участок повышения мр-сигнала, который отражает активную фазу воспалительно-демиелинизирующего процесса);
- Наличие перифокального отека вокруг очага рассеянного склероза, специфичного для данного заболевания либо, в некоторых случаях, симулирующего картину образования;
- Поражение инфратенториальных отделов головного мозга (ствола мозга, мозжечка, спинного мозга) и супратенториальных отделов мозга (больших полушарий, зрительного нерва);
- Поражение мозолистого тела: структуры, связывающей левое и правое полушария головного мозга;
- Локализация очагов вытянутой формы вдоль волокон лучистого венца.
В случае если диагноз «рассеянный склероз» на МРТ головного мозга был подтвержден, не стоит паниковать. Неврологи Юсуповской больницы благодаря применению самых современных препаратов добиваются прекрасных результатов лечения РС. У пациентов сохраняется высокое качество жизни, предотвращается быстрое прогрессирование поражения нервной системы.
Современные взгляды на лечение РС
Врачи Юсуповской больницы индивидуально подходят к лечению каждого пациента. Проводится купирование обострений, предотвращение появления новых симптомов и нарастания неврологического дефицита, подбор симптоматических препаратов. Неврологические нарушения восстанавливают при помощи пульс-терапии метилпреднизолоном, который вводят внутривенно капельно.
Неврологи Юсуповской больницы как можно раньше назначают терапию, модулирующую течение рассеянного склероза. Она позволяет стабилизировать состояние пациента. При ремитирующем рассеянном склерозе предупреждает трансформацию в прогрессирующее течение, а также снижает частоту обострений и замедляет нарастание инвалидизации.
Диета Эмбри при рассеянном склерозе. Рецепты
Диета Эмбри предполагает исключить или ограничить потребление вредных продуктов, заменив их теми, которые не могут усугубить течение заболевания. Рекомендуется обогатить организм витаминами и минералами (кальцием, суточная доза которого должна составлять 1100 мг, магнием –500 мг, 3-омега-ненасыщенными жирными кислотами 3 г и витамином D 3 – 4000 I).
Пациентам, которые используют диету Эмбри при рассеянном склерозе, следует убрать из рациона продукты, которые содержат большое количество белка:
- молочные продукты (молоко и молочнокислые продукты, различные сыры, соусы на сметанной основе, заливки и йогурты);
- бобовые (арахис, бобы и горох, фасоль, арахисовое масло);
- продукты из зерна пшеницы, ржи, ячменя.
Ознакомимся с рецептами диеты Эмбри, которые помогут правильно приготовить вкусные диетические блюда в домашних условиях. Для морковного супа понадобятся следующие продукты:
- 1 столовая ложка оливкового масла;
- 450 грамм нарезанной мелкими кубиками моркови;
- 1очищенная и нарезанная кубиками картофелина;
- Нарезанная кубиками луковица;
- 1 чайная ложка приправы тархун;
- 800мл овощного бульона;
- Соль и зелень.
Необходимо взять большую кастрюлю и подогреть в ней масло, положить порезанные овощи и добавить ложку тархуна. Их следует тушить на медленном огне несколько минут, не пережаривая. Добавляют в кастрюлю овощной минут и варят в течение 30 минут. Когда овощи станут мягкими. Суп готов.
Ремитирующий РС: варианты лечения
Ввиду того, что методы, позволяющие навсегда избавиться от данного недуга, находятся только в разработке, лечение рассеянного склероза на сегодняшний день предполагает прием препаратов для снятия симптоматики и облегчения проявлений заболевания, а также продления периодов ремиссии и предотвращения развития осложнений. В современной неврологии используются лекарственные средства, применяемые в периоды обострений и ухудшения состояния. Кроме того, в периоды ремиссии проводится интервальная терапия.
Врачи клиники неврологии Юсуповской больницы имеют огромный опыт в диагностике и лечении рассеянного склероза, в том числе ремиттирующей формы заболевания. При лечении рассеянного склероза применяются два основных направления, суть которых заключается в остановке обострения и предупреждении его развития. При выборе терапевтического метода учитываются индивидуальные особенности организма больного, тип течения заболевания и степень его тяжести.
При необходимости пациентов госпитализируют, наблюдают и проводят лечебные процедуры, повышающие эффективность реабилитации. Для создания максимального комфорта пациентам Юсуповской больницы предоставляются уютные палаты. Организовано полноценное сбалансированное питание, подобранное диетологом. Клиника оснащена современным МРТ-томографом и другим оборудованием, необходимым для диагностики и лечения неврологических патологий.
Лечение рассеянного склероза стволовыми клетками в Москве
Около двадцати лет назад определенную надежду возлагали на тогда считавшийся очень перспективным метод трансплантации стволовых клеток при рассеянном склерозе. Сейчас он относится лишь к четвертой линии лечения. Первую линию лечения составляют иммуномодуляторы (ребиф, бетаферон, копаксон), текфидера и абаджио, вторую – гиления, тизабри, лемтрада и окревус. К третьей линии относят человеческий иммуноглобулин, митоксантрон, азатиоприн. И в случае отсутствия эффекта от первых трёх линий лечения, при злокачественном течении рассеянного склероза рассматривают проведение трансплантации стволовых клеток.
Несмотря на большие ожидания, данный метод активно не используется. Во-первых, раньше или позже новые иммунные клетки снова обучаются действовать против собственного миелина, так как несмотря на химиотерапию сохраняются иммунные клетки в лимфоузлах, дендритные клетки и т.д. Заболевание снова активизируется. Во-вторых, такая массивная химиотерапия имеет различные отдаленные последствия в виде повышения риска развития онкологических заболеваний. В-третьих, за последние годы выпущены новые высокоэффективные препараты- моноклональные антитела (такие как, лемтрада, окревус и др.), которые как иммунологический нож удаляют только «плохие» иммунные клетки, сохраняя иммунитет в целом сохранным.
Более подробную информацию вы можете получить на консультации, записавшись по телефону на прием к врачу-специалисту по рассеянному склерозу Юсуповской больницы.
Первично прогрессирующий рассеянный склероз
Рассеянный склероз имеет несколько типов течения заболевания, каждый из которых имеет свои особенности:
- Наиболее часто встречается ремиттирующая-рецидивирующая форма рассеянного склероза. Такое течение заболевания состоит из периодов восстановления и периодов обострения, между обострениями не происходит нарастания симптомов.
- Вторично-прогрессирующее течение сопровождается сменой течения болезни с ремиттирующего-рецидивирующего на вторично-прогрессирующее течение. Независимо от наступления обострения болезнь прогрессирует.
- Первично-прогрессирующее течение заболевания характеризуется быстрым развитием с самого начала, с небольшими паузами улучшения состояния.
- Прогрессирующее течение болезни с обострениями встречается крайне редко, характеризуется быстрым развитием с самого начала заболевания, при замедлении процессов прогрессирования развиваются обострения.
Первично прогрессирующий рассеянный склероз тяжело поддается лечению, заканчивается, как правило, быстрым наступлением инвалидности больного. Первично-прогрессирующая форма заболевания характеризуется быстрым течением, нарастанием симптоматики, потерей неврологической функции. Негативными факторами при первично-прогрессивной форме заболевания являются:
- Вовлечение трех и более функциональных систем организма на начальном этапе заболевания;
- Скорость достижения баллов по расширенной шкале оценки степени инвалидизации от начала болезни.
Лечение первично прогрессирующего рассеянного склероза
Лечение заболевания начинают после определения типа течения заболевания – это позволяет поставить диагноз, определить прогноз течения заболевания, выбрать соответствующую тактику и наиболее эффективные для данного типа течения болезни препараты. В качестве эффективной терапии первично-прогрессирующей формы рассеянного склероза (ППРС) применяют препараты моноклональных антител.
Эффективность препаратов данной группы отмечена у молодых людей, которые болеют рассеянным склерозом непродолжительное время. Препараты показали хорошую переносимость больными, исследователи отметили уменьшение выраженности воспалительных реакций в ранее активных очагах. Также препараты этой группы показали эффективность в снижении риска прогрессирования инвалидности у больных.
Вторично прогрессирующий рассеянный склероз
Вторично-прогрессирующий рассеянный склероз (ВПРС) проявляется атрофией нервных тканей, дегенерацией белого и серого вещества, и меньшим количеством воспалительных реакций в отличие от ППРС. Поражение нервных тканей спинного мозга проявляется нарушением двигательной функции и работы внутренних органов. В большинстве случаев ВПРС предшествует ремиттирующая-рецидивирующая форма течения заболевания. ВПРС может проявляться с приступами или протекать без них, иметь злокачественное течение заболевания.
Для лечения рассеянного склероза назначают иммуносупрессивные и иммуномодулирующие препараты. Многочисленными исследованиями доказана эффективность этих препаратов в лечении рассеянного склероза. К ним относятся натализумаб, бета-интерферон, диметилфумарат, митоксантрон, глатирамер и другие препараты. Препараты, созданные в последнее время, позволяют контролировать и существенно снижать скорость развития заболевания. Исследованиями доказано, что раннее начало лечения РС наиболее эффективное, индивидуальный подбор терапии, контроль течения заболевания помогают отсрочить наступление инвалидности.
Рассеянный склероз у детей
У детей выделяют следующие формы рассеянного склероза, которые имеют значение в дебюте заболевания:
- Церебральную;
- Цереброспинальную;
- Глазную;
- Мозжечковую;
- Спинномозговую;
- Смешанную.
По характеру манифестации различают несколько вариантов течения рассеянного склероза у детей:
- Транзиторный монофокальный;
- Транзиторный полифокальный;
- Прогредиентный, или полифокальный стабильный.
Прогрессирование детского рассеянного склероза бывает первичным, вторичным и ремиттирующим.
Диагностика рассеянного склероза у детей представляет определённые трудности. Это связано с низкой частотой заболевания и вариабельностью симптомов. У детей заболевание может начинаться с одного признака или иметь полисимптомную клиническую картину. Анализ наблюдений врачей позволяет выделить следующие симптомы рассеянного склероза у детей:
- Одностороннее поражение зрительного нерва или сетчатки – приводит к частичной или полной слепоте и не сопровождается видимыми повреждениями или дефектами глазного яблока. Возможно появление «пелены», тумана перед глазами, цветного круга или чёрной точки. Пациенты ощущают боль в области лба, глубине орбиты и при движениях глазного яблока;
- Поражение пирамидного пути – проявляется снижением или исчезновением поверхностных брюшных рефлексов, повышением глубоких рефлексов на нижних конечностях, повышенной утомляемостью и мышечной слабостью;
- Нарушение чувствительности – пациенты жалуются на чувство «онемения» определённых участков тела. Субъективные чувствительные нарушения мигрируют в течение небольшого промежутка времени. Они не находят подтверждения во время клинического обследования;
- Нарушение функции черепных нервов;
- Симптомы поражения спинного мозга с локализацией патологического очага в верхне-шейном отделе – асимметрическое повышение глубоких рефлексов без чувствительных расстройств и нарушений функции тазовых органов.
Рассеянный склероз у подростков проявляется разными клиническими диссоциациями:
- Высокими с клонусами рефлексами при лёгком или умеренном нарушении объема движении;
- Патологическими рефлексами при сниженных коленных и карпорадиальных рефлексах;
- Диссоциациями между поверхностными и глубокими брюшными рефлексами.
Врачи центра рассеянного склероза Юсуповской больницы для постановки первичного диагноза используют 3 группы диагностических критериев:
- Иммунологическое исследование спинномозговой жидкости;
- Нейровизуализацию с использованием магниторезонансной и компьютерной томографии;
- Регистрацию вызванных потенциалов мозга.
Затем неврологи проводят дифференциальную диагностику рассеянного склероза с другими демиелинизирующими заболеваниями, имеющими похожую симптоматику.
Врачи проводят у детей, страдающих РС, две группы лечебных мероприятий:
- Патогенетические (направленные на предупреждение деструкции мозговой ткани токсическими веществами и активированными иммунными клетками);
- Симптоматические (компенсирующие имеющиеся нарушения, а также поддерживающие и корригирующие повреждённые функции нервной системы).
Патогенетическая терапия обострения рассеянного склероза включает иммуносупрессивные, иммуномодулирующие и противовоспалительные препараты. Препаратами выбора являются кортикостероиды (метилпреднизолон, дексаметазон и преднизолон). Они способствуют ограничению воспалительного процесса и деструкции миелина. В менее тяжёлых случаях применяем препараты адренокортикотропного гормона АКТГ.
Симптоматическая терапия зависит от симптомов заболевания. При выраженном гипертонусе врачи назначают детям миорелаксанты. Если имеет место дисфункция тазовых органов, проводят магнитостимуляцию, а при гиперефлексии детрузора применяют антихолинергические препараты. При интенционном треморе и нарушении координации вводят витамин В6, бета-адреноблокаторы в сочетании с трициклическими антидепрессантами и антагонисты серотонина. В случае атаксии назначают аминокислоты (глицин) и пропранолол в сочетании с трициклическими антидепрессантами.
Детям с рассеянным склерозом врачи рекомендуют вести максимально активный образ жизни, соответствующий возрасту, активно участвовать в домашних и общественных делах. Рано начатая медико-социальная реабилитация позволяет существенно улучшить течение заболевания, отдалённый прогноз, обогащает социальную жизнь маленьких пациентов.
РС у мужчин
Рассеянный склероз у мужчин проявляется следующими симптомами:
- Парезами, параличами. Паралич – неспособность совершать произвольные движения. При парезе частично сохраняется способность произвольных движений;
- Глазными расстройствами – у пациента изменяется восприятие цвета, выпадают поля зрения, снижается острота зрения. У некоторых больных бывает вертикальный нистагм – дрожание глазных яблок;
- Нарушениями чувствительности – мужчина чувствует покалывания, онемения в различных частях тела. Снижаются вибрационная и суставно-мышечная чувствительность. Реже происходят изменения температурной и поверхностной чувствительности;
- Интенционным тремором – дрожанием кончиков пальцев при произвольных движениях, которое начинается при завершении движения. Это характерный признак поражения мозжечка;
- Болью – может быть острой и хронической. Возникает боль по ходу тройничного нерва, цервикалгия, суставные и мышечные боли;
- Синдромом хронической усталости – пациенты быстро устают, им не помогает продолжительный отдых;
- Эмоциональной нестабильностью – настроение меняется от эйфории до депрессивного состояния. Больной то раздражается на любую мелочь, то наоборот, ни на что не реагирует;
- Расстройством речи. Характерная черта РС – скандированная речь. Больной говорит медленно, прерывисто, причем делает паузы не только после слов, но и после отдельных слогов;
- Спастичностью – повышается мышечный тонус. Пациент чувствует скованность в теле. Появляется судорожное дрожание;
- Эпилептическими припадкам – встречаются лишь у 5% мужчин с РС.
Статистика показывает, что течение данного заболевания будет благоприятным, если первые проявления начались с глазных расстройств. Если же дебютом были парезы, параличи и нарушения походки, то прогноз неблагоприятен.
Формы РС у мужчин
В зависимости от пораженного отдела мозга неврологи выделяют различные формы РС у мужчин. При церебральной форме патологический процесс затрагивает головной мозг. К церебральной форме относятся стволовая, оптическая и мозжечковые формы РС. Стволовая форма может быть представлена вариантом Марбурга. Он известен как злокачественная форма рассеянного склероза. Наблюдается у молодых мужчин. Характерно острое начало, стремительная прогрессия симптомов и отсутствие ремиссий.
При этом варианте РС первыми появляются не признаки поражения ЦНС, а стволовые симптомы:
- Тетраплегия и гемиплегия – паралич всех конечностей или руки и ноги с одной стороны;
- Дисфония, дисфагия, дизартрия – типичная триада, характерная для псевдобульбарного синдрома;
- Эпилептические припадки;
- Снижение интеллектуальных способностей.
Оптическая форма РС представлена невритами зрительного нерва. При этом снижается острота зрения, развиваются скотомы – слепые участки поля зрения. Выявляются изменения в диске зрительного нерва.
Мозжечковая форма проявляется ведущим симптомом – мозжечковой атаксией. Существуют два варианта:
- Статическая атаксия. Поражается червь мозжечка. У больного шаткая, неуверенная походка с широко расставленными ногами. Она очень напоминает походку пьяного человека. Если попросить пациента стоять прямо, то он широко расставит ноги, чтобы не потерять равновесие. Хорошо удается распознать нарушения координации в позе Ромберга. Человек становится прямо, сводит вместе стопы, руки вытягивает вперед и закрывает глаза. При наличии патологических изменений в черве мозжечка больной не сможет удерживать позу или даже упадет;
- Динамическая атаксия. Процесс рассеянного склероза переходит на полушария. Теряются навыки координированных движений. Для точного выявления необходимо провести координационные пробы.
При спинальной форме РС патологический процесс затрагивает аксоны нейронов спинного мозга. У пациентов развиваются нижний спастический парапарез, тазовые нарушения, нарушения чувствительности. Цереброспинальная форма проявляется симптомами и церебральной, и спинальной формы.
Лечение рассеянного склероза у мужчин решает следующие задачи:
- Не дать заболеванию прогрессировать, ухудшая качество жизни;
- Изменить течение заболевания;
- Купировать обострения.
ПИТРС – препараты, изменяющие течение рассеянного склероза. Лекарственные средства этой группы оказывают следующее действие:
- Уменьшают частоту обострений;
- Отдаляют момент перехода ремиттирующего течения во вторично-прогрессирующее состояние;
- Снижают тяжесть обострений.
Существует две линии ПИТРС лечения при рассеянном склерозе:
- Первая линия – препараты β-интерферона
- Вторая линия – иммуноглобулины, сильные иммуносупрессоры, аутологичная пересадка клеток костного мозга.
Для снятия спастичности назначают миорелаксанты различных групп, М-холиноблокаторы, проводят ботулинотерапию. Для нормализации работы мочевого пузыря применяют антихолинэстеразные препараты. Эпилептические припадки купируют противосудорожными средствами. При нарушении сна показаны анксиолитики. В случае развития депрессивного состояние назначают антидепрессанты.
Используется для:
- Купирования спастичности;
- Определения возбудимости коры головного мозга;
- Точечного воздействия на отдельные участки коры.
Это безболезненная и неинвазивная процедура.
Молодым мужчинам особенно тяжело переживать утрату прежних функций и симптомы болезни. Главное – поддержка родственников и близких друзей. Родственники должны понимать, что родной мужчина не выздоровеет, но без лечения ему станет хуже намного быстрее.
Советы по поддержке больного РС
Психологи разработали рекомендации, как общаться с мужчиной, больным РС:
- Не давайте ложных обещаний о выздоровлении. Лучше, если больной сможет поговорить с психологом о своих переживаниях;
- Сдержитесь от раздражительности на неуклюжесть и медлительность. Это расстраивает больных;
- Способствуйте реабилитации. В Юсуповской больнице функционирует центр реабилитации больных рассеянным склерозом. Для каждого пациента в зависимости от стадии подбирают индивидуальную программу по восстановлению функций. Так больной будет чувствовать себя увереннее и сможет дольше оставаться самостоятельным;
- Предлагайте выполнение посильных заданий. Чувствовать себя нужным — важная потребность любого человека;
- Стимулируйте больного на контакты с другими людьми. Хорошо начать общение с другими больными через группы в социальных сетях. Так человек будет знать, что он не одинок в своей болезни;
- Напоминайте о необходимости посильной физической активности. Следите, чтобы больной не перенапрягался при выполнении упражнений;
- Не надо акцентировать внимание на том, чего пациент не может. Подчеркивайте то, с чем он справляется. Не давайте человеку чувствовать себя обузой.
- Следите за диетой. Включайте в рацион больного продукты с клетчаткой, чтобы не было проблем со стулом;
- Поощряйте отказ от курения и алкоголя. Вредные привычки усугубляют течение и могут дать начало обострению.
Прогноз
Однозначно предсказать продолжительность жизни пациента, страдающего рассеянным склерозом, невозможно, так как заболевание влияет на людей по-разному.
Продолжительность жизни больных рассеянным склерозом могут сократить психические расстройства, пролежни и язвы на верхних или нижних конечностях, вследствие развития которых возникает инфицирование других органов. Существует также ряд причин, которые могут привести к моментальной смерти больного РС:
- Инфаркт миокарда;
- Поражение дыхательного центра;
- Почечная недостаточность;
- Инфекции органов мочевыделительной системы.
Продолжительность жизни зависит также от стадии патологических процессов, на которой была выявлена болезнь. Своевременная диагностика и правильное лечение рассеянного склероза позволяют предупредить или отсрочить наступление инвалидности.
Разная продолжительность жизни зафиксирована у людей, относящихся к следующим группам:
- Первая группа – больные, заболевание которых было выявлено на ранних стадиях. При условии приема лекарственных препаратов средняя продолжительность их жизни примерно аналогична сроку жизни здоровых людей (на семь лет короче);
- Вторая группа – данная категория включает в себя пожилых людей, диагноз которых был впервые установлен в 50 лет. Проведение правильного лечения дает им возможность прожить до 70 лет;
- Третья группа – пациенты, которым в 50 лет был установлен диагноз осложненный рассеянный склероз. Срок жизни данных больных составляет десять лет после выявления болезни;
- Четвертая группа – больные с молниеносным течением болезни. Продолжительность их жизни составляет, как правило, менее десяти лет после установления диагноза.
Продолжительность жизни сокращается при развитии осложнений РС:
- Утраты чувствительности конечностей;
- Поражения головного мозга;
- Отсутствия контроля над процессом мочеиспускания, дефекации;
- Слабости в нижних конечностях;
- Парезов и параличей;
- Судорог;
- Депрессивных состояний.
Раньше считалось, что рассеянный склероз неизлечим. Но в последние годы благодаря новым методам терапии врачи добиваются замедления развития болезни и эффективного управления симптоматики у некоторых больных. Новые «модифицирующие заболевание» лекарства и методики реабилитации позволяют сохранить больным более высокое качество жизни, чем было ранее.
По мнению современных исследователей, жизнь больного, страдающего рассеянный склерозом, укорачивается в связи с непрямым воздействием заболевания, которое может проявляться тяжелыми осложнениями или другими состояниями, не относящимися к болезни.
Инвалидность
Степень инвалидности больных рассеянным склерозом определяют врачебно-экспертные комиссии. Специалистами учитывается характер течения приступов и сопутствующие нарушения. Больным РС определяют следующие группы инвалидности:
- Первую – определяют пациентам с выраженными расстройствами опорно-двигательной системы;
- Вторую – определяют больным с серьезными расстройствами двигательной функции;
- Третью – назначают при незначительных или умеренных расстройствах движений и возможности больного работать
Профилактика
Никакие профилактические мероприятия не способны предупредить развитие рассеянного склероза.
Ряд простых рекомендаций помогут предотвратить развитие этого тяжелого недуга, а также будут способствовать уменьшению проявлений заболевания:
- проведение регулярных (но не изнуряющих) физических упражнений;
- отказ от употребления алкогольных напитков и табакокурения;
- правильный рацион питания – с минимумом жирных продуктов;
- стабилизация эмоционального состояния;
- нормализация собственного веса;
- контроль температурного режима в помещении (во избежание перегрева);
- отказ от использования гормональных контрацептивов;
- регулярный прием назначенных лекарственных препаратов (включая периоды ремиссии, для ослабления симптоматики).
У каждого больного рассеянный склероз протекает по-разному. Правильное лечение дает пациентам надежду сохранить физическое и умственное здоровье на долгие годы.
Если уже поставлен диагноз, профилактика поможет контролировать обострения и тяжесть заболевания. Неврологи рекомендуют больным РС:
- Избегать инфекций, поскольку одна из причин развития рассеянного склероза – вирусные и бактериальные заболевания;
- Отказаться от тепловых процедур: горячих ванн, бань, саун и других. Повышение температуры вызывает ухудшение симптоматики;
- Не допускать переутомления;
- Придерживаться диеты. При рассеянном склерозе рекомендовано обогатить пищу витамином D, перейти с животного на растительный белок, обеспечить адекватное потребление жирных кислот;
- Воздержаться от приема алкоголя, отказаться от курения;
- Вести активный образ жизни: настолько, насколько это возможно без перенапряжения организма.
Выполнение рекомендаций врача позволяет предотвратить очередное обострение РС. Чтобы получить консультацию невролога Юсуповской больницы, звоните по номеру телефона контакт-центра. Вас запишут на приём к ведущему специалисту в области лечения демиелинизирующих заболеваний центральной нервной системы.
Рассеянный склероз
Версия: Клинические рекомендации РФ 2022 (Россия)
Категории МКБ:
Рассеянный склероз (G35)
Разделы медицины:
Неврология
Общая информация
Краткое описание
Разработчик клинической рекомендации:
- Всероссийское общество неврологов
- Национальное общество нейрорадиологов
- Медицинская ассоциация врачей и центров рассеянного склероза и других нейроиммунологических заболеваний
- Российский комитет исследователей рассеянного склероза
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2024
Дата размещения:13.07.2022
ID:739
Определение заболевания или состояния (группы заболеваний или состояний)
Рассеянный склероз (РС) – это хроническое демиелинизирующее заболевание, в основе которого лежит комплекс аутоиммунновоспалительных и нейродегенеративных процессов, приводящих к множественному очаговому и диффузному поражению центральной нервной системы, следствием которого является инвалидизация пациентов и значительное снижение качества жизни [1].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
G35.0 – Рассеянный склероз
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Типы течения рассеянного склероза [1]:
Ремиттирующий рассеянный склероз (РРС) – тип течения РС, характеризующийся наличием обострений, между которыми не отмечается прогрессирование инвалидизации. В период ремиссии могут иметься признаки стойкого неврологического дефицита [5].
Вторично-прогрессирующий рассеянный склероз (ВПРС) – тип течения РС, возникающий после периода ремиттирующего РС и характеризующийся наличием подтвержденного прогрессирования инвалидизации, независимого от обострений [5].При данной форме РС могут сохраняться типичные обострения заболевания, между которыми наблюдается подтвержденное прогрессирование РС.
Первично-прогрессирующий РС (ППРС) – тип течения РС, характеризующийся подтвержденным прогрессированием инвалидизации с момента появления первых симптомов заболевания, с возможными периодами стабилизации состояния, во время которых не происходит нарастания неврологического дефицита. Достаточным считается непрерывное нарастание симптомов в течение 1 года, для диагностики используется специальный раздел критериев МакДональда 2017 года [5].При данной форме могут наблюдаться типичные обострения заболевания, между которыми имеется подтвержденное прогрессирование инвалидизации, однако заболевание дебютирует не с обострений, а с прогрессирования [5].У детей и подростков с РС практически всегда наблюдается РРС, иногда с активным началом по типу острого рассеянного энцефаломиелита (ОРЭМ), с переходом в ВПРС. ППРС при начале РС в возрасте до 16 лет встречается крайне редко, такие случаи всегда нуждаются в тщательном уточнении диагноза [6–8].
С 2013 года внедряется новая классификация типов течения заболевания, в рамках которой выделяют неактивный РС (без обострений и без признаков активности РС по данным МРТ), активный РС (наличие обострений или признаков активности РС по данным МРТ), РС с прогрессированием и РС без прогрессирования [9]. Постепенный переход на данную классификацию представляется целесообразным, однако, существенно затрудняет использование ПИТРС, содержащих в инструкциях по применению в разделе «показания» ремиттирующий, вторично-прогрессирующий и первично-прогрессирующий РС [9].
С учётом особенностей течения выделяют особые формы РС:
— Злокачественный РС (болезнь Марбурга) – острая форма тяжёлого течения РС, характеризующаяся быстрым усилением инвалидизации без ремиссий и в самых тяжёлых случаях – развитием летального исхода в течение нескольких месяцев от момента начала заболевания. Характерно развитие массивных очагов в стволе мозга, на МРТ эти очаги, как правило, активно накапливают парамагнитный контраст. Вариант по типу болезни Марбурга может начинаться как сразу после дебюта РС, так и сменять на определенном этапе типичное течение РС. Частота развития такого варианта РС не превышает 5%.
— Быстропрогрессирующий рассеянный склероз – тип течения РРС на фоне отсутствия терапии ПИТРС (наивные пациенты). При данном типе в течение одного года наблюдения имеют место два или более обострения с подтвержденным усилением инвалидизации и выявлением 1 или более контрастируемого очага на Т1-ВИ или увеличением количества очагов на Т2-ВИ по данным МРТ головного и/или спинного мозга в сравнении с предшествующим исследованием. Общепризнанная дефиниция данного типа течения РС была приведена в отчете РКИ финголимода** при подгрупповом анализе эффективности [10]. Ключевым моментом данного определения является инвалидизирующий характер обострений. Недостаточный объем данных из РКИ в настоящий момент не позволяет с высокой долей достоверности сравнивать эффективность терапии при данной форме РС [11]. Данные будущих исследований, возможно, смогут уточнить и расширить формулировку и предоставить больше доказательств ее целесообразности.
— Высокоактивный рассеянный склероз (ВАРС) – это клинико-радиологические характеристики течения РС, возникающие на фоне проводимой терапии ПИТРС, на основании которых необходимо принятие решения об эскалации терапии (Приложение А3.7).
Стадии заболевания:
Обострение рассеянного склероза – субъективные (сообщаемые пациентом) и/или объективные (выявляемые при неврологическом осмотре) симптомы, характерные для острого воспалительного демиелинизирующего процесса в ЦНС (фокального или мультифокального), либо в виде усугубления уже имеющихся неврологических симптомов, либо в виде появления новых неврологических симптомов, не наблюдаемых ранее, с острым или чаще подострым началом, длительностью свыше 24 часов, с полным или неполным регрессом симптомов, при условии отсутствия лихорадки, других признаков инфекционного заболевания, предшествующих метаболических нарушений, явлений стресса [5].
В случае последовательного появления симптомов они считаются одним обострением, если новый симптом или группа симптомов, или отчетливое ухудшение уже имевшихся симптомов появляется в период от 24 часов до 30 дней с момента появления первого; и считаются двумя разными обострениями, если от начала первого до начала второго имеется период стабильного или улучшающегося состояния длительностью не менее 30 дней [5]. В соответствии с критериями МакДональда в редакции 2017 года понятия «обострение», «атака», «экзацербация» являются синонимами [5].
Ремиссия рассеянного склероза – период отсутствия обострений, прогрессирования и ухудшения симптомов в течение, как минимум, 30 дней; в случае появления нового симптома или группы симптомов, или отчетливого ухудшения уже имевшихся симптомов в срок до 30 дней включительно ремиссия не фиксируется, состояние расценивается как продолжающееся обострение.
Подтверждённое прогрессирование инвалидизации – стойкое нарастание неврологических нарушений (по Расширенной шкале статуса инвалидизации пациента (EDSS), Приложения Г1 и Г2) по сравнению с исходным уровнем, вне периода обострений и не связанное с перенесённым ранее обострением. Подтвержденное прогрессирование выставляется тогда, когда у пациента сохраняется или увеличивается балл EDSS по сравнению с датой первого зафиксированного нарастания неврологических нарушений минимум через 6 месяцев, при условии отсутствия обострений в период измерения. Значимым нарастанием неврологических нарушений является увеличение EDSS на ≥ 1,5 балла при исходном балле EDSS = 0, на ≥ 1,0 балл для пациентов с исходным EDSS = 1,0 – 5,5 баллов, или ≥ 0,5 балла – для пациентов с исходным уровнем EDSS ≥ 6,0 [9]. Самый ранний период, когда подтвержденное прогрессирование может быть зафиксировано, составляет 3 месяца. Более достоверным и важным для рутинной практики можно считать подтвержденное прогрессирование инвалидизации через 6 месяцев.
Подтверждённое усиление инвалидизации – стойкое ухудшение неврологических нарушений (по шкале EDSS (Приложения Г1 и Г2) после окончания обострения, которое было подтверждено как минимум двумя измерениями EDSS, одно из которых было выполнено не ранее 30 дней с момента начала обострения, а второе – не менее чем через 3 месяца после этого [10]. Усиление инвалидизации можно рассматривать как вклад обострения в накопление инвалидизации пациента. При этом необходимо учитывать, что после тяжелых обострений пациент может иметь увеличение балла по шкале EDSS на самых ранних этапах, но это не является прогрессированием.
Подтверждённое уменьшение инвалидизации – стойкое уменьшение неврологических нарушений по шкале EDSS (Приложения Г1 и Г2) по сравнению с исходным баллом EDSS. Подтвержденное уменьшение выставляется, когда у пациента уменьшение балла EDSS по сравнению с первым зафиксированным уменьшением неврологических нарушений сохраняется в течение 6 месяцев. Уменьшением неврологических нарушений является снижение EDSS на 1,0 балл по сравнению с исходным баллом [11]. У пациентов, которые имеют длительность обострения более 30 дней с постепенным снижением балла EDSS, данное снижение не может быть рассмотрено как уменьшение. Базовой точкой расчета для измерения улучшения является точка измерения EDSS после завершения обострения. Уменьшение инвалидизации необходимо рассматривать как наилучший результат снижения воспалительной активности и реабилитационной помощи пациентам с РС.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Имеется полигенная наследственная предрасположенность к РС. В настоящее время выделено более 200 генетических факторов, формирующих эту предрасположенность. Реализация предрасположенности происходит при участии внешних факторов, среди которых на первом месте рассматриваются вирусные инфекции (особенно ретровирусы и вирус Эпштейн — Барр), недостаток витамина Д, раннее начало курения, изменения микробиома кишечника и другие факторы [2].
Продуцируемые Т- и В-клетками системно и локально в ткани провоспалительные цитокины вызывают активацию аутореактивных Т-лимфоцитов, приводят к аутоиммунному воспалительному поражению ткани ЦНС. Уже на ранних стадиях заболевания отмечаются нейродегенеративные изменения. Активация клонов сенсибилизированных клеток наряду с недостатком противовоспалительной, регуляторной систем, способствует хронизации процесса. Вторично активированные макрофаги и микроглия также секретируют провоспалительные цитокины [3].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Во всем мире имеется нарастание числа случаев РС, что связано как с улучшением диагностики и повышением возможностей патогенетической и симптоматической терапии, так и с истинным увеличением заболеваемости по неясным пока причинам. По данным публикации «Атлас РС Международной Федерации пациентов рассеянным склероз» (MSIF) с 2008 по 2013 годы распространенность РС возросла на 10% за 5 лет с 30 до 33 случаев на 100000 населения. При отсутствии адекватного современного лечения в среднем через 10 лет до 50% пациентов имеют трудности в выполнении профессиональных обязанностей, через 15 лет более 50% имеют трудности в самостоятельном передвижении, а при длительности РС более 20 лет – проблемы в самообслуживании [4].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Поражение зрительного нерва: односторонний оптический неврит (часто при ретробульбарной локализации очага – ретробульбарный неврит), часто в сочетании с болью при движении глазного яблока и снижением остроты зрения или появление скотом, длящимся от 2 до 4 недель; менее характерным является двусторонний оптический неврит без боли или с постоянной болью, полная и стойкая утрата зрения, отёк диска зрительного нерва и другие изменения на глазном дне.
Поражение мозжечка и его путей: статическая и динамическая мозжечковая атаксия – неустойчивость при ходьбе, дисметрия и мимопопадание в координаторных пробах, мегалография, асинергии, интенционное дрожание, мозжечковая дизартрия (скандированная речь).
Поражение ствола головного мозга: межъядерная офтальмоплегия, нистагм (центральный), парез отводящего нерва, гипестезия половины лица; менее характерны: снижение слуха, невралгия тройничного нерва, центральный или периферический парез лицевого нерва.
Поражение спинного мозга: моно- и гемипарезы, нижний парапарез, утрата чувствительности по проводниковому типу, симптом Лермитта, императивные позывы на мочеиспускание, неудержание мочи, задержки мочеиспускания; менее характерны: полный поперечный миелит, сегментарные нарушения чувствительности, радикулопатии, выпадение вибрационной чувствительности, сенситивная атаксия, недержание кала.
Поражение больших полушарий головного мозга: субкортикальный когнитивный дефицит (снижение памяти и внимания, скорости выполнения нейропсихологических тестов), хроническая усталость или утомляемость, центральный гемипарез, депрессия, реже тревожность, эйфоричность, менее характерными являются гемианопсии, острые нарушения поведения и эпилептические приступы.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
- Рекомендуется всем пациентам с 18 лет с подозрением на РС для раннего подтверждения диагноза использование критериев МакДональда (редакция 2017 года) (Приложение А3.1) [12].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Использование критериев МакДональда в редакции 2017 года обладает более высокой чувствительностью у пациентов на ранних стадиях заболевания, чем редакция критериев 2010 года (Приложение А3.7) или применением МРТ-критериев MAGNIMS 2016 (Приложение А3.4), что позволяет раньше установить диагноз РС. Следует, однако, учитывать, что специфичность критериев в редакции 2017 года ниже, чем в редакции 2010 года[12]. Для подтверждения диагноза рекомендуется использование алгоритма, разработанного на основе критериев МакДональда (редакция 2017 года) с целью наиболее ранней постановки диагноза (Приложение Б – 1,1 и 1,2 [5]. У пациентов с атипичным дебютом рекомендовано использовать критерии МакДональда в редакции 2010 года (Приложение А3.2) [12]. Тщательное проведение дифференциальной диагностики снизит риск ошибочной постановки диагноза РС [12–14].
- Рекомендуется у всех пациентов младше 18 лет с подозрением на РС при отсутствии энцефалопатии/общемозговой симптоматики в дебюте для подтверждения диагноза использование критериев МакДональда (редакция 2017 г., Приложение А3.1) [5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Международное исследование по валидации критериев МакДональда в редакции 2017 года для популяции пациентов младше 18 лет продемонстрировало результаты, позволяющие использовать их в диагностике РС у детей [15]. Проспективное когортное исследование с участием пациентов младше 18 лет также продемонстрировало результаты, позволяющие использовать критерии МакДональда в редакции 2017 года для данной популяции [16].
- Рекомендуется у всех пациентов младше 18 лет с подозрением на РС при наличии энцефалопатии/общемозговой симптоматики в дебюте для подтверждения диагноза РС использование критериев Международной группы по изучению детского рассеянного склероза (редакция 2013 г., Приложение А3.11) [17].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Исследований, оценивающих характеристики критериев Международной группы по изучению детского рассеянного склероза для пациентов с указанной симптоматикой, не проводилось.
2.1 Жалобы и анамнез
- У всех пациентов с подозрением на РС рекомендуется подробный сбор анамнеза на предмет наличия признаков острых демиелинизирующих эпизодов в прошлом для определения возможности соответствия критериям диссеминации в пространстве и времени (Приложение А3.1) [5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Оценка данных анамнеза должна проводиться врачом-неврологом для определения соответствия жалоб характерным клиническим проявления обострения РС и соответствия критериям диссеминации в пространстве и времени (Приложение А3.1).
- Всем пациентам с подозрением на РС рекомендуется проводить полную дифференциальную диагностику с другими неврологическими и не неврологическими заболеваниями с целью уменьшения риска диагностической ошибки и нанесения вреда пациенту по причине отложенного или неправильного лечения (План дифференциальной диагностики изложен в Приложении А3.3) [18–20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: Исследование Yamout и соавт. продемонстрировало, что только 70% пациентов, направленных к специалисту по РС, поставили диагноз РС [19]. Из пациентов с другими диагнозами 3,5% полностью соответствовали критериям РИС. Наиболее распространенными альтернативными диагнозами были психические расстройства (16,3%), неспецифические МРТ-поражения белого вещества (14,7%), заболевания спектра оптиконейромиелита (9,5%), мигрень (8,6%) и системные аутоиммунные заболевания (8,6%) [19]. Исследование Solomon с соавт. продемонстрировало, что 33% пациентов наблюдались с неправильным диагнозом в течение более 10 лет. 70% из них получали терапию ПИТРС и 31% имели нежелательные явления, связанные с терапией ПИТРС [20].
- Всем пациентам с наличием оптического неврита на момент осмотра или в анамнезе рекомендуется консультация врача-невролога с целью исключения РС [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
2.2 Физикальное обследование
- При проведении неврологического осмотра пациентов с подозрением на РС рекомендуется использовать Шкалу функциональных систем по Куртцке (ФС (Приложение Г1) и Расширенную шкалу инвалидизации (EDSS; Приложение Г2) [5,22,23].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
2.3 Лабораторные диагностические исследования
- Всем пациентам с подозрением на РС рекомендуется назначать следующие лабораторные анализы для исключения сопутствующих заболеваний и определения возможности назначения последующей терапии ПИТРС [24,25]:
— Общий (клинический) анализ крови развернутый;
— Анализ крови биохимический общетерапевтический, исследование уровня С-реактивного белка в сыворотке крови, исследование уровня фибриногена в крови, исследование уровня общего кальция в крови;
— Исследование уровня тиреотропного гормона (ТТГ) в крови, исследование уровня свободного тироксина (СТ4) сыворотки крови, определение содержания антител к тиреопероксидазе в крови, исследование уровня тиреоглобулина в крови.
— Общий (клинический) анализ мочи и микроскопическое исследование осадка мочи;
— Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови, определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител классов к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к бледной трепонеме (Treponema pallidum) в нетрепонемных тестах (RPR, РМП) (качественное и полуколичественное исследование) в сыворотке крови;
— Определение содержания антител к антигенам ядра клетки и ДНК [283].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Данный перечень исследований рассматривается экспертами-членами рабочей группы как достаточный, но не исчерпывающий. План обследования должен исходить из клинической картины заболевания и других данных, полученных при объективных, лабораторных и инструментальных методах обследования.
- Пациентам с подозрением на РС, при наличии признаков, заставляющих включить в дифференциальный диагноз церебральную аутосомно-доминантную артериопатию с субкортикальными инфарктами и лейкоэнцефалопатией (CADASIL), с целью проведения дифференциального диагноза рекомендуется назначать молекулярно-генетическое исследование мутации гена NOTCH3 [26].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
- Пациентам с подозрением на РС, при наличии признаков, заставляющих включить в дифференциальный диагноз дефицит витамина В12, с целью проведения дифференциального диагноза рекомендуется назначать определение уровня витамина B12 (цианокобаламин) в крови [27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Пациентам с подозрением на РС, при наличии признаков, заставляющих включить в дифференциальный диагноз прогрессирующую мультифокальную лейкоэнцефалопатию (ПМЛ), с целью проведения дифференциального диагноза рекомендуется назначать анализ спинномозговой жидкости методом полимеразноцепной реакции (ПЦР) на наличие JC-вируса [28].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: ПМЛ развивается в результате реактивации полиомавируса JC у JCV-серопозитивных пациентов. После того, как вирус приобретает нейротропность, он инфицирует клетки олигодендроглии и вызывает литическую инфекцию ЦНС [29]. Определение ДНК вируса в спинномозговой жидкости при наличии соответствующей клинической картины позволяет поставить диагноз ПМЛ [28].
- Пациентам с подозрением на РС, при наличии признаков, заставляющих включить в дифференциальный диагноз заболевания спектра оптиконейромиелита (ЗСОНМ), с целью проведения дифференциального диагноза рекомендуется назначать анализ на антитела к аквапорину-4 в крови [30].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: Антитела к аквапорину-4 являются высокоспецифичным маркером оптиконейромиелита, клиническая специфичность составляет 97 — 98%. Наибольшей чувствительностью и специфичностью обладает методика определения антител к аквапорину-4 в культуре трансфицированных клеток, экспрессирующих аквапорин-4 [30].
- Пациентам с подозрением на РС, при наличии признаков, заставляющих включить в дифференциальный диагноз системные заболевания соединительной ткани, с целью проведения дифференциального диагноза рекомендуется назначать определение содержания антител к антигенам ядра клетки и ДНК и определение содержания антител к экстрагируемым ядерным антигенам в крови [31–33].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Системные заболевания соединительной ткани имеют разнообразные проявления, в том числе, вовлекающие ЦНС. Исследования Leuchten с соавт. и Haga с соавт. показывают, что скрининговое тестирование на антинуклеарный фактор и определение антител к экстрагируемому ядерному антигену IgG имеют высокую чувствительность и специфичность при выявлении таких заболеваний как системная красная волчанка, синдром Шегрена [32,33]. Важной особенностью является высокая отрицательная прогностическая значимость и низкая позитивная прогностическая значимость [31]. Выявление указанных антител не является признаком системного заболевания само по себе, однако в таком случае требуется консультация ревматолога.
- Пациентам с подозрением на РС в качестве дополнительного метода подтверждения диагноза РС рекомендуется назначать парное исследование олигоклональных иммуноглобулинов класса IgG с установлением типа синтеза в сыворотке крови и спинномозговой жидкости [5,34–39].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Чувствительность и специфичность определения олигоклональных иммуноглобулинов класса IgG по данным разных авторов составляет около 90% и 60%, соответственно [34,36,37]. 2-й и 3-й типы синтеза олигоклональных IgG являются наиболее характерными для РС [35]. Исследование может использоваться в качестве дополнительного метода, подтверждающего диссеминацию во времени в соответствии с критериями МакДональда в редакции 2017 года [5,38]. Отсутствие олигоклональных иммуноглобулинов не является подтверждением отсутствия у пациента РС, что встречается с частотой до 13% случаев при РС и до 33% при КИС [34]. Наличие олигоклональных IgG в СМЖ является независимым фактором, повышающим риск конверсии КИС в достоверный РС [39].
- Пациентам с подозрением на РС в качестве дополнительного лабораторного метода подтверждения диагноза РС рекомендуется провести парное исследование концентрации свободных легких цепей иммуноглобулинов каппа (ƙ-СЛЦ) и индекса свободных легких цепей иммуноглобулинов каппа в сыворотке крови и спинномозговой жидкости [40].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: анализ СМЖ и сыворотки крови на концентрацию и индекс ƙ-СЛЦ является количественным биомаркером, отражающим уровень интратекальной продукции иммуноглобулинов [41]. Исследования, посвященные диагностической ценности данного биомаркера, демонстрируют чувствительность и специфичность, сопоставимую с определением олигоклональных иммуноглобулинов [42–44]. В дополнение к исследованию на олигоклональные иммуноглобулины, определение данного биомаркера повышает информативность диагностики и позволяет выявлять воспалительный процесс у пациентов с отрицательным анализом на олигоклональные антитела [41,44]. Исследования разных авторов указывают на прогностическую значимость ƙ-СЛЦ для определения риска прогрессирования РС [45,46].
2.4 Инструментальные диагностические исследования
- Всем пациентам с подозрением на РС не рекомендуется постановка диагноза РС только на основании данных МРТ, с целью снижения риска ошибочного диагноза [47].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: РС устанавливается, прежде всего, на основании характерной клинической картины [5]. МРТ является дополнительным методом исследования, повышающим точность и скорость диагностики.
- Всем пациентам с подозрением на РС рекомендуется проведение МРТ головного мозга с контрастированием для исключения иной природы неврологического заболевания, а также для установления соответствия процесса критериям диссеминации в пространстве и времени [48].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: Протокол первичной магнитно-резонансной томографии головного мозга должен включать в себя следующие обязательные последовательности: 1) Т2-FLAIR и Т2-ВИ/PD в аксиальной плоскости, 2) 2D или 3D Т2-FLAIR в сагиттальной плоскости, 3) 2D или 3D Т1-ВИ с введением КВ. Для получения снимков с контрастным усилением рекомендуется использовать стандартную дозировку КВ (0,1 — 0,2 ммоль/кг в зависимости от концентрации КВ), вводимую на протяжении 30 секунд, минимум за 10 минут до получения постконтрастного Т1-ВИ. При необходимости дополнительно проводятся: 1) 2D или 3D Т1-ВИ без КВ, 2) 2D и/или 3D DIR, 3) ДВИ в аксиальной плоскости. Исследуется весь объём головного мозга, толщина срезов ≤ 5 мм в зависимости от программы [49].
- Пациентам с подозрением на РС и наличием клинических симптомов поражения спинного мозга или радиологических признаков поражения головного мозга, не удовлетворяющих критериям диссеминации в пространстве, рекомендуется дополнительное проведение магнитно-резонансной томографии спинного мозга с внутривенным контрастированием (шейный отдел) с целью снижения риска ошибочного диагноза и критериального подтверждения возможного диагноза РС [50]. Выполнение магнитно-резонансной томографии спинного мозга (грудной и поясничный отделы) рекомендуется при подозрении на локализацию очага в этих областях.
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарий: Выполнение МРТ спинного мозга (шейный отдел) одновременно с МРТ головного мозга позволяет сократить частоту повторного направления на МРТ и избежать повторного введения контраста. В случае наличия возможности необходимо сразу выполнять оба исследования. Обязательными для включения в протокол МРТ последовательностями являются: 1) Т2-ВИ в импульсной последовательности быстрое «спиновое эхо» и Т2-STIR в сагиттальной плоскости, 2) 2D и/или 3D Т2-ВИ в импульсной последовательности быстрое «спиновое эхо» в аксиальной плоскости. При выявлении очагов на Т2-ВИ обязательно выполняется Т1-ВИ в импульсной последовательности «спиновое эхо» с введением КВ в сагиттальной и аксиальной плоскостях. В качестве альтернативы Т2-STIR могут быть использованы последовательности PSIR или режим протонной плотности (PD) в сагиттальной плоскости. Срезы должны выполняться без промежутков между срезами, толщиной не более 3 мм в сагиттальной плоскости и не более 5 мм в аксиальной плоскости [51] .
- Пациентам с подозрением на РС старше 40 лет с неспецифическими находками на МРТ головного мозга рекомендуется дополнительное проведение магнитно-резонансной томографии спинного мозга с внутривенным контрастированием (шейный отдел) с целью снижения риска ошибочного диагноза и критериального подтверждения возможного диагноза РС [50].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарий: Выполнение МРТ спинного мозга (шейный отдел) одновременно с МРТ головного мозга позволяет сократить частоту повторного направления на МРТ и избежать повторного введения контрастного препарата. В случае наличия возможности необходимо сразу выполнять оба исследования. Обязательными для включения в протокол МРТ последовательностями являются: 1) Т2-ВИ в импульсной последовательности быстрое «спиновое эхо» и Т2-STIR в сагиттальной плоскости, 2) 2D и/или 3D Т2-ВИ в импульсной последовательности быстрое «спиновое эхо» в аксиальной плоскости. При выявлении очагов на Т2-ВИ обязательно выполняется Т1-ВИ в импульсной последовательности «спиновое эхо» с введением КВ в сагиттальной и аксиальной плоскостях. В качестве альтернативы Т2-STIR могут быть использованы последовательности PSIR или режим протонной плотности (PD) в сагиттальной плоскости. Срезы должны выполняться без промежутков между срезами, толщиной не более 3 мм в сагиттальной плоскости и не более 5 мм в аксиальной плоскости [51].
- Пациентам с подозрением на РС, у которых при однократной магнитно-резонансной томографии головного мозга не удалось установить соответствие критериям диссеминации в пространстве и времени, рекомендуется назначение повторной МРТ головного мозга для оценки динамики и соответствия критериям диагностики РС [51–53].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: В 2016 году группой MAGNIMS предложены дополнения по применению МРТ при установлении диагноза РС по критериям МакДональда 2010 года (Приложение А3.4), однако эти дополнения не полностью соответствуют новым критериям МакДональда 2017 года, поэтому приводятся в качестве справочной информации [54]. В случае обнаружения у пациента с клинической картиной острого демиелинизирующего эпизода на первичной МРТ двух и более очагов, характеристики которых указывают на демиелинизирующий характер поражения при отсутствии признаков контрастного усиления, повторная МРТ головного мозга должна быть выполнена через 3 — 6 месяцев от первичной [52,53]. В случае выявления на МРТ двух и более очагов, характеристики которых указывают на демиелинизирующий характер поражения, у пациента без клиники острого демиелинизирующего эпизода или при неспецифической клинической картине (радиологически изолированный синдром – РИС) повторную МРТ рекомендуется проводить через 12 — 24 месяца [55]. При этом обязательными для включения в протокол повторной МРТ головного мозга последовательностями являются: 3D Т1-ВИ без контрастного усиления, 2D или 3D Т2-FLAIR в сагиттальной и аксиальной плоскости, 2D или 3D Т2-ВИ в аксиальной плоскости, 2D или 3D Т1-ВИ в аксиальной плоскости с введением КВ с толщиной срезов не более 3 мм без промежутков между срезами, а также 2D ДВИ в аксиальной плоскости с толщиной срезов не более 5 мм. При необходимости возможно выполнение последовательностей 2D и/или 3D DIR, SWI (SWAN), T1-ВИ и PD. Покрытие МРТ должно охватывать весь объём головного мозга, разрешение пикселя не должно превышать 1×1 мм на срез [51].
- Пациентам с подозрением на РС при выполнении МРТ исследований рекомендуется оформление структурированного протокола МРТ заключения, в том числе с целью оценки динамики очагов, сопоставления критериям диссеминации в месте и/или во времени (Приложение А3.5) [56,57].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: Экспертами — членами рабочей группы, однозначно рекомендуется оформление структурированного протокола МРТ заключения, включающего описательную часть (локализация, характеристики очагов, отсутствие или наличие патологического накопления КВ очагами), оценку динамики патологического процесса (появление, локализация и количество новых и/или увеличенных старых очагов в режимах Т2-ВИ и Т2FLAIR, накапливающих или не накапливающих КВ) и интерпретацию патологического процесса (типичная, атипичная или нетипичная для РС МРТ картина), на основе которого лечащий врач может принимать решения о дальнейшей тактике ведения пациента. Без оформления структурированного протокола МРТ заключения услуга проведения МРТ исследования считается выполненной некачественно.
2.5 Иные диагностические исследования
- У пациентов с подозрением на РС при наличии симптомов неврита зрительного нерва в настоящий момент или в анамнезе в качестве дополнительного метода исследования рекомендуется использовать дополнительные инструментальные методы диагностики: регистрация вызванных потенциалов коры головного мозга одной модальности (зрительные), магнитно-резонансная томография глазницы для объективизации эпизода зрительных нарушений [58,59].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарий: Чувствительность определения очаговых изменений зрительного нерва на МРТ составляет до 93%[58]. Наличие контрастируемого очага демиелинизации в зрительном нерве связано с более тяжелым течением неврита зрительного нерва и менее благоприятным прогнозом восстановления зрения [58]. В исследовании Frederiksen и соавт. чувствительность диагностики замедления проведения вызванных потенциалов при неврите зрительного нерва составила 77%, амплитуда зрительных вызванных потенциалов коррелировали с остротой зрения [59]. Увеличение латентности было связано с наличием подтвержденного диагноза РС [59].
- Пациентам с подозрением на РС, при наличии симптомов неврита зрительного нерва в настоящий момент или в анамнезе, в качестве дополнительного метода исследования рекомендуется назначение оптической когерентной томографии глаза для определения истончения слоя нервных волокон и слоя ганглионарных клеток сетчатки [60].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Наилучшая чувствительность метода достигается приблизительно через 3 месяца после перенесённого неврита зрительного нерва [49]. Атрофия слоя зрительных волокон сетчатки является неблагоприятным прогностическим фактором в отношении прогрессирования инвалидизации [61]. В систематическом обзоре Britze и соавт. показано, что атрофия слоя ганглионарных клеток проявляется раньше, чем атрофия слоя зрительных волокон сетчатки и лучше предсказывает восстановление функции зрения [62].
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Терапия РС состоит из трех составляющих компонентов: 1) терапия обострений РС, 2) препараты, изменяющие течение РС (ПИТРС) и 3) симптоматическая терапия (коррекция отдельных симптомов заболевания). В настоящее время препаратов, с доказанным нейропротективным и нейрорепаративным эффектом при РС не зарегистрировано.
3.1 Терапия обострений РС
- При наличии у пациента с РС клинических признаков обострения РС, подтвержденных объективно врачом-неврологом (вне зависимости от факта выполнения МРТ центральной нервной системы и/или при наличии активности по данным МРТ) рекомендуется терапия обострения РС c целью уменьшения выраженности и продолжительности симптомов обострения РС и уменьшения их продолжительности [63,64] (Приложение Б. Алгоритм 2).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- В качестве терапии обострения РС у пациентов с РС рекомендуется использование глюкокортикоидов (ГК) в высоких дозах с целью уменьшения выраженности и продолжительности симптомов обострения РС [63–65].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: До начала терапии глюкокортикоидами (ГК) следует учитывать возможные побочные эффекты использования ГК.
- При наличии у пациентов с РС обострения РС в ситуации, когда риски терапии обострения РС превышают возможную пользу терапии, рекомендуется воздержаться от терапии обострения РС по совместному решению врача-невролога и пациента с РС с целью предотвращения побочных эффектов терапии обострения РС (критерии оценки тяжести обострения представлены в Приложении А3.12) [63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Лечащий врач может обсуждать с пациентом возможность не применять глюкокортикоиды для лечения неинвалидизирующих обострений или обострений, с момента начала которых прошел продолжительный период времени (например, больше 3 месяцев). По данным исследования Национального института здравоохранения Великобритании, исследования эффективности глюкокортикоидов по сравнению с плацебо, как правило, имели низкое качество [63]. По данным метаанализа Miller c соавт., разница клинического эффекта глюкокортикоидов составила лишь 0,76 балла EDSS по сравнению с группой плацебо в конце лечения по сравнению с исходным уровнем [64]. Решение о воздержании от терапии обострения должно приниматься только совместно с пациентом. Freedman и соавт. предложена классификация, позволяющая определить степень тяжести обострения с целью дальнейшей маршрутизации помощи пациенту (Приложение А3.12) [66].
- С целью уменьшения выраженности и продолжительности симптомов обострения РС у пациентов с РС с 18 лет включительно в качестве лекарственного препарата первого выбора рекомендуется использовать метилпреднизолон**для внутривенного применения в режиме пульс-терапии в дозе 1000 мг в течение 3 — 5 дней (максимально – 7) [65,67–69].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- Для пациентов с РС младше 18 лет доза метилпреднизолона**для внутривенного применения в режиме пульс-терапии рассчитывается исходя из веса ребенка: 500 мг при весе 25 — 40 кг, 750 мг при весе 40 — 55 кг, 1000 мг при весе свыше 55 кг [70–72].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Рандомизированное исследование LaMantia и соавт. и систематический обзор с применением метаанализа Citterio с соавт. демонстрируют, что внутривенное введение метилпреднизолона** при обострении РС в режиме пульс-терапии способствовало значимому снижению показателя EDSS через 4 — 5 недель [65,69].
- В случае невозможности использования метилпреднизолона** с целью уменьшения выраженности и продолжительности симптомов обострения РС у пациентов с РС (с 18 лет) рекомендуется использование #дексаметазона** для внутривенного капельного применения по схеме: 8 мг в сутки в течение 7 дней, затем 4 мг в сутки в течение 4 дней, затем 2 мг в сутки в течение 3 дней [69].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Приведенное РКИ имело малый размер выборки и не продемонстрировало статистически значимых преимуществ терапии #дексаметазоном** перед терапией метилпреднизолоном** при оценке показателя EDSS через 7 и 15 дней после терапии [69]. Количество пациентов без обострений РС через 1 год после терапии обострения РС в группе высокодозного метилпреднизолона** было статистически значимо выше, чем в группе #дексаметазона**.
- В случаях, затрудняющих проведение терапии обострений РС парентеральными глюкокортикоидами, для пациентов с РС (с 18 лет) с обострением РС рекомендуется использование пероральных (таблетированных) глюкокортикоидов в эквивалентных суточных дозах (эквивалентных 1000 мг метилпреднизолона**) в течение 3 — 5 дней с целью уменьшения продолжительности и выраженности симптомов обострения РС [65,68,73–77].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Нет достоверных данных о статистически значимых различиях в эффективности и безопасности парентеральных и пероральных глюкокортикоидов в эквивалентных дозах в качестве терапии обострения РС в течение 5 дней. Однако, мощность исследований, включённых в мета-анализ, была ограниченной, а результаты не везде были согласованными, что не позволяет сделать окончательный вывод об однозначной эквивалентности данных типов терапии [65,68,73–77].
- У пациентов с РС (с 18 лет) при терапии обострений РС с использованием пероральных (таблетированных) глюкокортикоидов альтернативно внутривенному введению метилпреднизолона** не рекомендуется применение длительных курсов пероральных глюкокортикоидов (более 5 дней), в том числе с постепенным снижением дозы, с целью предотвращения развития побочных эффектов длительной терапии пероральными глюкокортикоидами [69,73,74].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: Более длительные курсы терапии глюкокортикоидами не являются более эффективными по сравнению с курсом продолжительностью до 5 дней [69,73,74].
- Пациентам с РС с 18 лет в случае неэффективности курса терапии глюкокортикоидами рекомендуется применение высокообъемного плазмафереза в количестве до 7 сеансов для терапии обострения РС [79, 80].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: Эффективность плазмафереза в качестве дополнительной терапии для пациентов, у которых терапия глюкокортикоидами при обострении РС оказалась неэффективной, продемонстрирована в некоторых рандомизированных клинических исследованиях [79,80].
- Пациентам с РС младше 18 лет в случае неэффективности курса терапии глюкокортикоидами рекомендуется применение высокообъемного плазмафереза в количестве до 7 сеансов для терапии обострения РС [78–80].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Пациентам с РС младше 18 лет при обострении РС рекомендуется применение #иммуноглобулина человека нормального** для внутривенного приема в курсовой дозе 2 г/кг веса в течение 5 дней с целью уменьшения продолжительности и выраженности симптомов обострения РС при наличии противопоказаний к приему глюкокортикоидов [70,81,82].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: #Иммуноглобулин человека нормальный** для внутривенного введения может рассматриваться как альтернативный метод лечения обострений РС у пациентов младше 18 лет, когда прием глюкокортикоидов противопоказан. Введение иммуноглобулинов может уменьшать выраженность воспаления путем снижения уровня цитокинов и связывания антител против миелина путем блокирования Fc рецепторов, а также стимулировать ремиелинизацию [83,84]. Ряд репортированных случаев лечения детей с демиелинизирующими заболеваниями (РС, ОРЭМ) сообщают о возможной эффективности применения иммуноглобулинов для внутривенного введения, однако контролируемых исследований надлежащего качества не опубликовано [81,82].
3.2 Терапия, изменяющая течение РС
- Всем пациентам с РС перед назначением терапии, изменяющей течение РС, рекомендуется установить тип течения и уровень инвалидизации по шкале EDSS (Приложение Г2) [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Всем пациентам с 18 лет с ремиттирующим РС с уровнем EDSS ≤ 6,5 баллов, не соответствующих критериям быстропрогрессирующего рассеянного склероза, с целью снижения риска подтвержденного прогрессирования инвалидизации и развития ВПРС (Приложение А3.7, Приложение Б. 4.1, 4.2, 4.3, 4.4) при первом назначении терапии ПИТРС рекомендуется максимально раннее назначение ПИТРС первой линии: интерферон бета-1а** (для п/к введения), интерферон бета-1b**, глатирамера ацетат**, диметилфумарат**, терифлуномид**[85–92].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
или
интерферон бета-1а** (для в/м введения) [94]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
или
пэгинтерферон бета-1a** [93,96].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Раннее назначение терапии ПИТРС способствует снижению риска прогрессирования инвалидизации и развития ВПРС [92].
- Интерферон бета-1а** 30 мкг для внутримышечного введения 1 раз в неделю рекомендуется пациентам с РРС (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [94].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
- Интерферон бета-1а** 44 мкг подкожно 3 раза в неделю рекомендуется пациентам с РРС (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [88].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
- Интерферон бета-1b** 250 мкг подкожно через день рекомендуются пациентам с РРС (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [86].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- Пэгинтерферон бета-1а** (пегилированный интерферон) 125 мкг подкожно 1 раз в 14 дней рекомендуется пациентам с РРС (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [93,96].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
- Глатирамера ацетат** 20 мг подкожно ежедневно или глатирамера ацетат** 40 мг подкожно 3 раза в неделю рекомендуется пациентам с РРС (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [86,87,97].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- Терифлуномид** 14 мг перорально 1 раз в сутки рекомендуется пациентам с РРС (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [89].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- Диметилфумарат** 240 мг перорально 2 раза в день рекомендуется пациентам с РРС (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [90,91].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- Всем пациентам с 12 лет с ремитирующим РС с уровнем EDSS ≤ 6,5 баллов, не соответствующих критериям быстропрогрессирующего рассеянного склероза, с целью снижения риска подтвержденного прогрессирования инвалидизации и развития ВПРС (Приложение А3.7, Приложение Б. 4.1, 4.2, 4.3, 4.4) при первом назначении терапии ПИТРС рекомендуется максимально раннее назначение ПИТРС первой линии интерферон бета-1а** 30 мкг для внутримышечного введения 1 раз в неделю [282].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
или
интерферон бета-1а** 44 мкг подкожно 3 раза в неделю [95].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Детям с 12 лет рекомендуется интерферон бета-1а** 30 мкг для внутримышечного введения 1 раз в неделю с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [282].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- Детям с 12 лет рекомендуется Интерферон бета-1а** 44 мкг подкожно 3 раза в неделю с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [95].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –4).
- Рекомендуется регулярно (не реже 1 раза в 6 месяцев) проводить оценку эффективности проводимой терапии ПИТРС. Терапию ПИТРС следует считать эффективной в случае наличия оптимального ответа на терапию (НДАЗ, «нет данных за активность заболевания»). При этом срок наблюдения и оценки эффективности должен соответствовать среднему сроку наступления эффекта для данного лекарственного препарата [98].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Критерий НДАЗ признается большинством экспертов как достоверный маркер ответа на терапию ПИТРС. В исследовании Rotstein и соавт. выполнение критерия НДАЗ через 2 года терапии обладало положительным прогностическим значением в 78,3% в отношении отсутствия прогрессирования инвалидизации через 7 лет [99].
- Для оценки эффективности терапии ПИТРС у пациентов с РС с целью предотвращения отмены терапии ПИТРС до начала развития эффекта терапии ПИТРС рекомендуется использовать следующие сроки начала ожидаемого эффекта от терапии [86,100–102]:
— глатирамера ацетатом** – 9 — 12 месяцев;
— интерферонами бета-1a** и интерфероном бета-1b** – 3 — 6 месяцев;
— терифлуномидом**– 3 — 6 месяцев;
— диметилфумаратом** – 3 — 6 месяцев;
— натализумабом** — 3 — 6 месяцев;
— финголимодом** – 3 — 6 месяцев;
— алемтузумабом** – 24 месяца;
— окрелизумабом** – 12 месяцев;
— кладрибином** – 24 месяцев;
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Исследования, направленные на определение сроков достижения эффективности ПИТРС, за исключением глатирамера ацетата**, не проводились. Для всех ПИТРС, за исключением глатирамера ацетата**, приведено мнение экспертов – членов рабочей группы. Рекомендация основана на данных отдельных РКИ, при этом сроки ожидаемого развития эффекта соответствуют срокам, в которые проводилась оценка эффективности терапии в представленных исследованиях. Исследования высокого методологического качества, в которых бы изучалось именно время наступления оптимального ответа на терапию, не проводились [87,100–102].
- Пациентам с РС, достигшим уровня EDSS ≥ 7,0 баллов, при отсутствии обострений и радиологической активности заболевания по данным МРТ в течение периода не менее 2 лет не рекомендуется продолжать терапию ПИТРС в связи с недоказанностью эффективности терапии в данной когорте пациентов и существенным повышением рисков побочных эффектов с целью предотвращения возможных побочных эффектов, связанных с терапией ПИТРС [25]. Решение о прекращении терапии ПИТРС должно приниматься только совместно с пациентом.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Исследований клинической эффективности ПИТРС в указанной когорте пациентов не проводилось, однако некоторые выводы можно сделать из анализа естественного течения заболевания. В исследовании Ahrweiller и соавт. показано, что частота обострений снижается на 46% каждые 5 лет после конверсии в ВПРС [103]. Похожие данные получены в исследовании Mateo Paz Soldan и соавт., которые показали, что в отобранной ими группе пациентов 91,6% обострений происходило в течение первых 5 лет после конверсии в ВПРС и 95,2% обострений развивалось до достижения возраста 55 лет [104]. При балле EDSS 6,0 и выше риск обострений и/или активности на МРТ ниже на 50%, поэтому отмена ПИТРС может не сопровождаться существенным риском возобновления клинической и радиологической активности РС [25].
- При развитии субоптимального ответа на терапию ПИТРС первой линии у пациента с РРС с уровнем EDSS ≤ 6,5 баллов, при условии высокой комплаентности пациента и достаточного времени для развития эффекта терапии ПИТРС рекомендуется смена терапии ПИТРС в рамках первой линии ПИТРС (Приложение Б, Алгоритм 3, Приложение А3.7) [105–110].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- При развитии резистентности на терапию ПИТРС первой линии у пациентов с РРС (ВАРС, «высокоактивный РС») с уровнем EDSS ≤ 6,5 баллов, при условии высокой комплаентности пациента, достаточного времени для развития эффекта терапии ПИТРС рекомендуется эскалация терапии на ПИТРС второй линии (Приложение Б, Алгоритм 3, Приложение А3.7) [105–110].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- При стойком субоптимальном ответе на терапию ПИТРС первой линии у пациентов с РРС (терапия проводилась двумя и более ПИТРС первой линии) рекомендуется эскалация терапии на ПИТРС второй линии (Приложение Б, Алгоритм 3, Приложение А3.7) [105–108].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- Пациентам с 18 лет с быстропрогрессирующим РРС с уровнем EDSS≤ 6,5 баллов рекомендуются ПИТРС второй линии (Приложение Б, Алгоритм 3, Приложение А3.7):
натализумаб** [117–121]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
или
финголимод** [122,123]
Уровень убедительности рекомендаций A (уровень достоверности доказательств –1).
или
алемтузумаб** [110,125,126]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
или
окрелизумаб** [127,128]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
или
кладрибин** [102,129]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
или
#митоксантрон** [130].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Пациентам с 10 лет с быстропрогрессирующим РРС с уровнем EDSS ≤ 6,5 баллов рекомендуется назначение финголимода** 0,5 мг перорально один раз в день [122,124]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
- Натализумаб** 300 мг внутривенно 1 раз в 28 дней рекомендуется пациентам (с 18 лет) с быстропрогрессирующим РРС или с высокоактивным РРС с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [117–121]. При применении натализумаба** у пациентов с РС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.6).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- Финголимод** 0,5 мг перорально один раз в день рекомендуется (с 10 лет) пациентам с быстропрогрессирующим РРС или с высокоактивным РС с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [122–124]. При применении финголимода** у пациентов с РС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.7).
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Алемтузумаб** 12 мг внутривенно 2 курса терапии (5 инфузий в 1-й год и 3 инфузии во 2-й год) рекомендуется пациентам (с 18 лет) с быстропрогрессирующим РРС или с высокоактивным РРС с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [110,125,126]. При применении алемтузумаба** у пациентов с РС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.8).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
- Окрелизумаб** 600 мг внутривенно 1 раз в 6 месяцев рекомендуется пациентам (с 18 лет) с быстропрогрессирующим РРС или с высокоактивным РРС с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [127,128]. При применении окрелизумаба** у пациентов с РС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.9).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
- Кладрибин** в таблетках 10 мг (3,5 мг/кг массы тела пациента в течение 2 лет: 1,75 мг/кг на 1 курс лечения в год общей продолжительностью не более 10 дней каждый курс без приёма препарата в последующие 2 года) рекомендуется пациентам (с 18 лет) с быстропрогрессирующим РРС или с высокоактивным РРС с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [102,129]. При применении кладрибина** у пациентов с РС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.10).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
- #Митоксантрон** рекомендуется при высокоактивном РРС (с 18 лет) при отсутствии альтернативы в качестве препарата резервной терапии в связи с негативным профилем безопасности (предельная относительно безопасная кумулятивная доза – 80 мг/м2) в дозировке 12 мг/м2 в/в на 200 мл изотонического раствора натрия хлорида** каждые 3 месяца с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [130]. При применении #митоксантрона** у пациентов с РС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.5).
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Пациентам с РС с 18 лет с уровнем EDSS ≤ 6,5 баллов при использовании терапии ПИТРС второй линии (натализумаб**, финголимод**, окрелизумаб**, алемтузумаб**, кладрибин**, #митоксантрон**) и оптимальном ответе на терапию, в случае наличия высоких рисков нежелательных побочных реакций (НПР), угрожающих жизни пациента, или при наличии риска развития тяжелой инвалидизации в условиях продолжения данной терапии ПИТРС рекомендуется смена терапии на другой ПИТРС второй линии с соблюдением рекомендованных периодов переходов и планов управления рисками при смене [98].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Рандомизированных клинических исследований, сравнивающих эффективность смены терапии в рамках ПИТРС второй линии, не проводилось. Существует некоторый положительный опыт смены натализумаба**(в основном, из-за рисков ПМЛ) на окрелизумаб**, алемтузумаб**, финголимод** и кладрибин** при соблюдении сроков перевода [131–136].Однако исследование Vollmer и соавт. демонстрирует, что частота обострений может возрастать после смены натализумаба** на финголимод** при более продолжительном интервале переключения [137]. В исследовании Alping и соавт. смена натализумаба** на #ритуксимаб** была более эффективной, чем на финголимод** [138].
- У пациентов с РС с 18 лет с уровнем EDSS ≤ 6,5 баллов при использовании терапии ПИТРС второй линии (натализумаб**, финголимод**, окрелизумаб**, алемтузумаб**, кладрибин**, #митоксантрон**), при условии высокой комплаентности пациента, достаточного времени для развития эффекта терапии ПИТРС, при отсутствии оптимального ответа на терапию ПИТРС рекомендуется смена терапии на другой ПИТРС второй линии с соблюдением рекомендованных периодов переходов и планов управления рисками при смене [98].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Рандомизированных клинических исследований, сравнивающих эффективность смены терапии в рамках ПИТРС второй линии, не проводилось. Эксперты-члены рабочей группы рассматривают смену терапии в рамках ПИТРС второй линии как способ добиться выполнения критерия оптимального ответа на терапию (НДАЗ) у пациентов с резистентностью к одному из ПИТРС второй линии. Выбор другого ПИТРС должен производиться с учетом спектра нежелательных явлений, предыдущего опыта пациента на терапии ПИТРС, сопутствующих заболеваний и текущей активности заболевания.
- Пациентам с 18 лет с ВПРС с обострениями с уровнем EDSS ≤ 6,5 баллов с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями, но не с целью предотвращения прогрессирования РС рекомендуется назначение ПИТРС:
интерферон бета-1а** (для п/к введения) [139],
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
или
интерферон бета-1b** [139],
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
или
окрелизумаб** [127,128],
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
или
#митоксантрон** [130].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: LaMantina и соавт. проанализировали 5 РКИ, в которых 3122 (1829 ИФН и 1293 плацебо) пациента, получавших лечение интерфероном бета-1а** или интерфероном бета-1b**, соответствовали критериям ВПРС. Включенная популяция была гетерогенной с точки зрения исходных клинических характеристик заболевания, в частности доля пациентов с ВПРС с обострениями колебалась от 72% до 44% [139]. Интерфероном бета-1а** или интерфероном бета-1b** не снижали риск прогрессирования, сохранявшегося в течение 6 месяцев после трех лет лечения. Анализ установил достоверное снижение риска прогрессирования заболевания через 3 месяца и риска развития новых обострений через три года. Риск развития новых активных очагов в головном мозге со временем снижался, но эти данные были получены в результате единичных исследований МРТ, выполненных в подгруппах пациентов; несмотря на отсутствие влияния на прогрессирование, рентгенологические данные подтверждали влияние на параметры МРТ [139].
- Интерферон бета-1b** 250 мкг подкожно через день рекомендуется пациентам с ВПРС с обострениями с уровнем EDSS ≤ 6,5 баллов (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями, но не с целью предотвращения прогрессирования РС [139].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарий: Несмотря на снижение частоты обострений у пациентов с ВПРС с активностью, терапия интерфероном бета-1b** не замедляла прогрессирование инвалидизации в течение нескольких лет по сравнению с плацебо, что подтверждено данными крупного метаанализа [139].
- Интерферон бета-1а** 44 мкг подкожно 3 раза в неделю рекомендуется пациентам с ВПРС с обострениями с уровнем EDSS ≤ 6,5 баллов (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями, но не с целью предотвращения прогрессирования РС [139].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарий: Несмотря на снижение частоты обострений у пациентов с ВПРС с активностью, терапия интерфероном бета-1а** не замедляла прогрессирование инвалидизации в течение нескольких лет по сравнению с плацебо, что подтверждено данными крупного мета-анализа [139].
- Окрелизумаб** 600 мг внутривенно 1 раз в 6 месяцев рекомендуется пациентам с ВПРС с обострениями и уровнем EDSS ≤ 6,5 баллов (с 18 лет) с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [127,128]. При применении окрелизумаба** у пациентов с ВПРС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.9).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Безопасность и эффективность окрелизумаба** не исследовалась у пациентов старше 55 лет. У таких пациентов окрелизумаб** следует использовать с осторожностью.
- #Митоксантрон** рекомендуется пациентам с ВПРС c обострениями с уровнем EDSS ≤ 6,5 баллов (с 18 лет) в качестве препарата резервной терапии при отсутствии альтернативы в связи с негативным профилем безопасности (предельная относительно безопасная кумулятивная доза – 80 мг/м2) в дозировке 12 мг/м2 в/в на 200 мл изотонического раствора натрия хлорида** каждые 3 месяца с целью предотвращения обострений и радиологической активности заболевания по данным МРТ головного/спинного мозга и инвалидизации, вызванной данными событиями [130]. При применении #митоксантрона** у пациентов с РС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.5).
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
- Пациентам с ППРС с 18 лет с уровнем EDSS ≤ 6,5 баллов рекомендуется назначение окрелизумаба**с целью предотвращения прогрессирования РС [140].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Безопасность и эффективность окрелизумаба** не исследовалась у пациентов младше 18 лет и старше 55 лет. У таких пациентов окрелизумаб** следует использовать с осторожностью. У пациентов с уровнем EDSS ≥ 7,0 баллов эффективность и безопасность окрелизумаба** не исследовалась.
- Окрелизумаб** 600 мг внутривенно 1 раз в 6 месяцев рекомендуется пациентам с ППРС и уровнем EDSS ≤ 6,5 баллов (с 18 лет) с целью предотвращения прогрессирования РС [140]. При применении окрелизумаба** у пациентов с ППРС с целью обеспечения безопасности пациента рекомендуется соблюдение плана управления рисками (Приложение Б. 4.9).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
3.2. Хирургическое лечение
Не предусмотрено
3.3. Иное лечение
Симптоматическая терапия является одной из важнейших составляющих лечения РС, рациональное использование препаратов позволяет существенно улучшить качество жизни пациентов. Симптоматическая терапия назначается любым медицинским специалистом по профилю своей деятельности. Назначение симптоматической терапии не зависит от получения или не получения пациентом ПИТРС, и индивидуально назначается в зависимости от стадии и типа течения заболевания.
Коррекция синдрома хронической усталости
- Пациентам с РС (с 18 лет) для лечения синдрома хронической усталости рекомендуется использование #амантадина** в дозе 200 мг в сутки [141].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: метаанализ Yang и соавт. показал, что амантадин** был наиболее эффективным средством для лечения синдрома хронической усталости, однако исследования высокого качества, подтверждающие это, отсутствуют [136].
- Пациентам с РС (с 18 лет) для лечения синдрома хронической усталости рекомендуется #левокарнитин в дозе 1 г 2 раза в сутки [141].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: метаанализ Yang и соавт. показал, что #левокарнитин был эффективен у некоторых пациентов с синдромом хронической усталости, однако все исследования были низкого качества [136].
Коррекция нарушений мочеиспускания у пациентов с рассеянным склерозом
- У пациента с РС (с 18 лет) с синдромом гиперактивности мочевого пузыря, проявляющегося частыми императивными позывами к мочеиспусканию или недержанием мочи, с целью коррекции расстройств мочеиспускания, рекомендуется использование оксибутинина 5 мг 2 — 3 раза в сутки, или #толтеродина 2 — 4 мг 1 раз в сутки [142, 285].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: М-холиноблокаторы (G04BD средства для лечения учащенного мочеиспускания и недержания мочи) являются наиболее распространенным средством для лечения синдрома гиперактивности мочевого пузыря при РС [142]. Однако, данных по их эффективности при РС пока недостаточно, а Кокрановский обзор с применением мета-анализа демонстрирует отсутствие статистически значимого эффекта в улучшении симптомов гиперактивности мочевого пузыря [143]. Тем не менее, данные отдельных клинических исследований демонстрируют эффективность М-холиноблокаторов в лечении синдрома гиперактивности мочевого пузыря [144–146].
- У пациента с РС (с 18 лет) с синдромом гиперактивности мочевого пузыря, проявляющегося частыми императивными позывами к мочеиспусканию или недержанием мочи, с целью коррекции расстройств мочеиспускания, рекомендуется использование #десмопрессина** 10 — 100 мкг 1 р/сутки [147,148, 285].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарий: #Десмопрессин** показал эффективность в исследовании Valiquette и соавт., уменьшив процент ночей с никтурией с 97% до 66%, а также в исследовании Hilton и соавт., снизив частоту позывов к мочеиспусканию [147,148]. Все исследования были низкого качества.
- У пациента с РС (с 18 лет) с затруднением опорожнения мочевого пузыря вследствие синдрома сфинктерно-детрузорной диссинергии рекомендуется использование альфа-адреноблокаторов (тамсулозин** 0,4 г 1 раз в сутки, доксазозин** 2 — 8 мг в сутки) с целью коррекции расстройств мочеиспускания [149,150].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарий: Положительный эффект при задержке мочеиспускания был показан в ряде исследований при рассеянном склерозе и других неврологических заболеваниях [149,150].
- У пациента с РС (с 18 лет) с синдромом гиперактивности мочевого пузыря, проявляющегося частыми императивными позывами к мочеиспусканию или недержанием мочи, и резистентности к пероральным и интраназальным лекарственным препаратам рекомендуется использование препаратов ботулинического токсина типа А** в виде интравезикальных инъекций по назначению врача-уролога с целью коррекции расстройств мочеиспускания [149–153].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Интравезикальное введение ботулинического токсина типа A** приводило к увеличению максимального объема мочевого пузыря, уменьшению частоты позывов в течения дня и ночи, уменьшению количества эпизодов недержания мочи, а также частоты использования впитывающего белья [152–156]. Большинство исследований были проведены в смешанных группах, включая пациентов с различными причинами нейрогенной дисфункции мочевого пузыря, что осложняет заключение вывода об эффективности метода лечения при рассеянном склерозе.
Коррекция нарушений мышечного тонуса
- У пациента с РС (с 18 лет) с синдромом спастичности с целью снижения мышечного тонуса рекомендуется использование:
баклофена** [159 — 164]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
или
тизанидина** [158]
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
или
толперизона (доза подбирается индивидуально с учетом переносимости и
эффективности) [157].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Систематический обзор клинических исследований сообщает об эффективности использования данных препаратов для коррекции спастического гипертонуса [158].
- В случае непереносимости либо неэффективности терапии баклофеном**, тизанидином** или толперизоном у пациентов с РС (с 18 лет) с синдромом спастичности рекомендуется использование #габапентина (доза подбирается индивидуально с учетом переносимости и эффективности) с целью снижения мышечного тонуса [158,165,166].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
- У пациента с РС (с 18 лет) с локальным спастическим гипертонусом мышц и неэффективности пероральной терапии спастичности рекомендуется применение препаратов ботулинического токсина типа A** внутримышечно обученным специалистом для облегчения передвижения пациента, манипуляций рукой или улучшения возможности обслуживания / самообслуживания [158,167–174].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Клинические исследования Hyman и соавт. и Gusev и соавт. продемонстрировали уменьшение выраженности нижнего спастического парапареза у пациентов с EDSS ≥ 7,0 баллов [168,169]. Введение ботулинического токсина типа A** в приводящие мышцы бедра увеличило объем движений в тазобедренном суставе, уменьшило выраженность спастического гипертонуса, боль в мышцах ног и облегчило проведение гигиенических мероприятий. Исследование Gracies и соавт. на менее инвалидизированной смешанной популяции пациентов (включая РС) с нижним спастическим парапарезом показало, что введение ботулинического токсина типа A** увеличило скорость ходьбы [170]. Ограниченные данные в смешанных популяциях существуют в отношении влияния ботулинического токсина типа A** на гипертонус мышц рук при РС [171–173]. На сегодняшний день не получено данных, что действие и спектр НПР ботулинического токсинатипа А** отличается при лечении спастичности при РС по сравнению с другими нозологиями.
- У пациентов с РС (с 18 лет) с такими симптомами и/или синдромами, как боль, синдром беспокойных ног, бессонница лечение рекомендуется осуществлять в соответствии с общими рекомендациями для таких синдромов и симптомов с целью их коррекции [175–177].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Специальных исследований при РС по данному вопросу не проводилось. В настоящий момент, лечение указанных синдромом подразумевает использование общих рекомендаций, не специализированных для лечения РС.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Пациентам с РС рекомендуется проводить медицинскую реабилитацию усилиями мультидисциплинарной бригады специалистов с целью снижения уровня инвалидизации, улучшения показателей активности и участия и улучшения качества жизни [178,179].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарий: Клинические исследования с умеренной доказательностью демонстрируют положительный эффект от мультидисциплинарной реабилитации.
- Пациентам с РС с 18 лет рекомендуется проводить медицинскую реабилитацию в рамках специализированного отделения нейрореабилитации в течение 3 — 5 недель с целью снижения уровня инвалидизации, улучшения показателей активности и участия и улучшения качества жизни [179–182].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: Клинические исследования применения мультидисциплинарного подхода к реабилитации демонстрируют краткосрочную эффективность (до 12 недель) в рамках стационарного пребывания в течение 3 — 5 недель для показателей активности и участия и уменьшения имеющегося неврологического дефицита [179–181]. Данные исследований подтверждают со слабой силой доказательности, что интенсивная стационарная реабилитация превосходит по эффективности амбулаторную реабилитацию в краткосрочной перспективе (через 3 месяца) [182].
- Пациентам с РС, недавно перенесшим обострение c неполным регрессом симптомов, рекомендуется проведение мультидисциплинарной реабилитации с целью уменьшения неврологического дефицита, ограничений активности и участия [181,183,184].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарий: В систематическом обзоре 3 исследований (включая 1 рандомизированное плацебоконтролируемое исследование) показана эффективность мультидисциплинарной реабилитации в условиях круглосуточного стационара или дневного стационара при давности возникновения симптомов не более 5 месяцев [181,183,184].
- Всем пациентам с РС рекомендуется проводить оценку эффективности реабилитации валидированными объективными методами с использованием тестов, шкал и опросников для оценки ходьбы, баланса, функции рук, повседневной жизнедеятельности и качества жизни. Оценка должна проводиться до начала и после завершения реабилитации [185–187].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4 (сложившаяся клиническая практика)).
Комментарий: Объективные методики оценки могут включать тесты оценки ходьбы (тест 6-минутной или 2-минутной ходьбы, тест 25 шагов, индекс мобильности Ривермид и др.), тесты оценки баланса (шкала баланса Берг, тест «Встань и иди» и др.) [185,186], тест функциональной независимости (FIM), тест 9 колышков и отверстий, тест руки Френчай, опросник оценки качества жизни (SF-36) (Приложения Г3 — Г8). Методы оценки должны применяться в зависимости от клинической ситуации, но целесообразно использование набора тестов для оценки всего спектра нарушений. Исследования по эффективности реабилитации рассеянного склероза с применением оценки до вмешательства и после по сравнению с отсутствием оценок не проводились. Однако, сложившаяся клиническая практика подтверждает важность регулярного тестирования и оценки эффективности реабилитации для врачей, пациентов, страховых компаний и государства [187]. Многим методикам требуется адаптация и валидация в условиях российской клинической практики.
- После курса реабилитации в рамках круглосуточного стационара, пациентам с РС с любым типом течения рекомендуется долгосрочная (до 6 недель) реабилитация в условиях реабилитационного дневного стационара или на дому (до 12 недель) для уменьшения инвалидизации, улучшения показателей активности и участия, а также качества жизни [179,188–190].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Существуют ограниченные доказательства эффективности высокоинтенсивного реабилитационного вмешательства в течение 6 недель в амбулаторных условиях для улучшения показателей участия и качества жизни через 12 месяцев [179]. Для долгосрочных вмешательств амбулаторно или на дому существуют убедительные доказательства улучшения качества жизни пациентов [188–190].
- Рекомендуется при кодировании реабилитационного диагноза пациентов с РС специалистам по медицинской реабилитации выставлять диагноз в категориях Международной классификации функционирования (МКФ) c целью унифицированного обозначения всех имеющихся нарушений пациента, а также для улучшения междисциплинарного взаимодействия [191–194].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: Постановка реабилитационного диагноза с помощью МКФ занимает центральное место при планировании реабилитации. Опираясь на рекомендации Всемирной Организации Здравоохранения (ВОЗ), специально для РС были разработаны и валидированы ключевые разделы МКФ для РС (ICF Core Set) [191–194]. Их использование помогает объективизировать состояние пациента и сформировать план реабилитации [191].
- Пациентам с РС рекомендуется физическая реабилитация в качестве обязательного компонента реабилитационных программ для снижения инвалидизации, улучшения показателей активности и участия и качества жизни [178,190].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Существующие данные с высокой степенью доказательности подтверждают эффективность физических методов реабилитации (например, лечебной физкультуры, кинезотерапии, роботизированной механотерапии, гидрокинезотерапии) для улучшения показателей активности и участия, повышения мышечной силы, способность пациента к передвижению, независимости, аэробной выносливости, снижает утомляемость и улучшает показатели качества жизни [178,190]. Никакой из методов не обладает существенным преимуществом перед остальными.
- Пациентам с РС для уменьшения мышечной слабости и утомляемости рекомендуется физическая реабилитация, в особенности, с использованием тренировок на выносливость, силовых тренировок, роботизированной механотерапии, йоги, лечебной физкультуры в бассейне, спортивного скалолазания [178,195–200].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Полученные данные клинических исследований и их мета-анализа указывают на эффект физической реабилитации для уменьшения утомляемости. Наибольшую эффективность продемонстрировали тренировки на выносливость, силовые тренировки, роботизированная механотерапия, йога, тренировки баланса и смешанные методики [178,195]. Механизмом, определяющим эффективность физической реабилитации при утомляемости, является улучшение состояния сердечно-сосудистой и дыхательной систем, прямой нейропротективный эффект реабилитации и нормализация работы гипоталамо-гипофизарной оси, которая, как считается, вовлечена в патогенез утомляемости при РС [195–198]. Исследования по оценке эффекта на утомляемость проводились в основном у пациентов с уровнем EDSS < 6,0 баллов. Эффективность подобных методик у более инвалидизированных пациентов не изучалась, однако, при наличии возможности, физическая реабилитация должна проводиться пациентам с любым уровнем EDSS [178]. Лечебная физкультура в бассейне и гидрокинезотерапия показали эффективность в уменьшении утомляемости, мышечной силы, депрессии и качества жизни [201,202]. Небольшие рандомизированные клинические исследования по спортивному скалолазанию демонстрируют снижение утомляемости и увеличение мышечной силы [203]. Интенсивность и продолжительность вмешательства следует выбирать индивидуально для каждого пациента. Никакой из методов не обладает существенным преимуществом перед остальными.
- Пациентам с РС для уменьшения общей (не мышечной) утомляемости рекомендуется назначение специализированной индивидуальной программы реабилитации с использованием когнитивной поведенческой терапии, обучения принципам сохранения энергии, а также проведение тренингов по формированию режима дня [178,200,204].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарий: Данные исследований с применением метаанализа с высокой достоверностью отмечают эффективность специализированных программ, направленных на борьбу с утомляемостью, включающих когнитивную поведенческую терапию и обучение принципам сохранения энергии [178,200]. Неоднозначные данные существуют в отношении использования охлаждающих жилетов [204].
- Пациентам с РС рекомендуется включение эрготерапии в программы реабилитации с целью уменьшения ограничений активности и участия, улучшения качества жизни [205].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарий: Ряд РКИ низкого качества демонстрирует эффективность некоторых подходов в эрготерапии для улучшения показателей активности и участия, утомляемости и качества жизни. При включении эрготерапии в программы реабилитации следует прежде всего рассматривать такие методы как обучение и консультирование пациентов и программы сохранения энергии, имеющие доказательную базу при РС [205].
- Пациентам с РС рекомендуется мультидисциплинарная холистическая реабилитация верхних конечностей для уменьшения степени нарушений их функций, ограничения активности и участия. Наиболее эффективными вмешательствами могут считаться роботассистированная реабилитация, лечебной физкультуры и эрготерапия [206].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарий: Исследования демонстрируют улучшение показателей реализации и капаситета (в структуре МКФ) верхних конечностей после проведения комплексной мультидисциплинарной и роботассистированной реабилитации [206]. Лечебная физкультура и тренировки на выносливость показали улучшение показателей функций верхних конечностей, но не активности и участия [206].
- Пациентам с РС с 18 лет рекомендуется обучение навыкам самообслуживания, консультирование по адаптации среды, по вопросам трудоустройства с учетом имеющихся ограничений, а также подбор необходимых технических средств реабилитации для уменьшения степени выраженности ограничений, социальной дезадаптации и снижения качества жизни [207]. Консультации рекомендуется проводить эрготерапевтам, врачам по физической и реабилитационной медицине и социальным работникам.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- В процессе реабилитации рекомендуется проводить консультации и обучение с родственниками пациентов с РС для уменьшения ограничений активности и участия пациента, обучения родственников уходу за инвалидизированным пациентом и профилактики психологического выгорания родственников инвалидизированных пациентов [208].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Пациентам с РС с 18 лет для коррекции нарушений баланса и ходьбы, а также профилактики падений рекомендуются баланстерапия, роботизированная механотерапия при заболеваниях центральной нервной системы и головного мозга, тренировка с биологической обратной связью по опорной реакции при заболеваниях центральной нервной системы и головного мозга [202,209–217].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: Клинические исследования и данные систематических обзоров выявили слабый или умеренный положительный эффект на показатели баланса при использовании индивидуальных и групповых упражнений для тренировки баланса [209], совмещенных с йогой [210], ЛФК в бассейне [202], упражнениями для зрения [211], сенсорной интеграцией [212], а также при использовании стабилометрических платформ с обратной связью для тренировки баланса [213]. В метаанализе использование виртуальной реальности продемонстрировало эффективность, сопоставимую с традиционными методиками [214]. Клинические исследования с использованием роботассистированной тренировки ходьбы продемонстрировали значимое улучшение некоторых показателей баланса [215]. Клинические исследования умеренного и слабого методологического качества демонстрируют улучшения баланса и ходьбы после применения экзоскелетассистированной реабилитации [216,217]. Ни один из методов не имеет научно-обоснованного предпочтения перед остальными.
- Пациентам с РС с 18 лет с синдромом свисающей стопы рекомендуется применение функциональной электростимуляции для увеличения скорости ходьбы [218].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Систематический обзор с применением мета-анализа продемонстрировал значимое увеличение скорости ходьбы при применении функциональной электростимуляции мышц передней поверхности голени при синдроме свисающей стопы [218].
- Пациентам с РС с 18 лет с синдромом спастического гипертонуса рекомендуются следующие немедикаментозные методы с целью коррекции спастического гипертонуса, болевого синдрома, профилактики и лечения суставных контрактур: физические упражнения на растяжение и сокращение мышц-агонистов и антагонистов (отдельно или в сочетании с инъекциями ботулинического токсина типа А**), транскраниальная магнитная стимуляция, ношение индивидуальных ортезов покоя, гипсование и обучение стратегиям поведения в повседневной жизни с целью уменьшения спастического гипертонуса мышц, увеличения объема активных и пассивных движений, уменьшения болевого синдрома [219].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Систематический анализ данных рандомизированных клинических исследований выявил низкое качество проведенных исследований [219]. Тем не менее, ряд исследований демонстрируют краткосрочную (до 1 недели) или среднесрочную (до 6 месяцев) эффективность от проведения лечебной физкультуры (отдельно или в сочетании с инъекциями ботулинического токсина типа А**), транскраниальной магнитной стимуляции[219]. Не показали эффективности методы чрескожной электрической стимуляции нервов, вибрация всего тела, спортивное скалолазание и йога [219]. Исследования демонстрируют недостаточно согласованные данные по эффективности использования индивидуальных ортезов покоя и гипсования при инсульте или при других приобретенных повреждениях головного мозга, однако в большинстве публикаций отмечен значимый положительный эффект от вмешательства в отношении объема активных и пассивных движений, уменьшения болевого синдрома [220–222].
- Пациентам с РС, получающим терапию ботулиническим токсином типа А** для уменьшения спастического гипертонуса мышц верхних и нижних конечностей, рекомендуется дополнительное применение физических методов реабилитации для уменьшения гипертонуса и увеличения объема пассивных и активных движений пораженных конечностей [223].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: Систематический обзор с применением метаанализа демонстрирует с умеренной степенью доказательности эффективность сочетания упражнений на растяжение и терапии, вызванная ограничением движения, с инъекциями ботулинического токсина типа А** [223]. Стоит отметить, что выраженность эффекта от данных мероприятий не высока, но превышает эффект от применения только инъекций ботулинического токсина типа А**.
- Пациентам с РС с 18 лет с нарушениями речи и глотания рекомендуется ранняя комплексная медико-логопедическая процедура при дисфагии, медико-логопедическая процедура при дизартрии, разработка индивидуальной программы логопедической реабилитации, обучение компенсаторным стратегиям и альтернативным способам коммуникации с целью уменьшения выраженности нарушений речи и глотания, улучшения дыхания, профилактики аспирации и снижения ограничений активности и участия [207].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Всем пациентам с РС, проходящим реабилитацию на амбулаторном или стационарном этапе, рекомендуется комплексное клинико-психологическое нейропсихологическое обследование с целью выявления нарушений памяти, внимания или других когнитивных функций. В ряде случае может быть рекомендован совместный осмотр эрготерапевта и медицинского психолога (нейропсихолога) [224].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: Большая часть пациентов с РС имеют нарушения когнитивных функций, что снижает качество жизни и влияет на инвалидизацию при РС [224]. Для коррекции нарушений требуется предварительная оценка выраженности нарушений.
- Пациентам с РС при выявлении объективного снижения показателей когнитивных функций по данным стандартизированных тестов рекомендуется нейропсихологическая реабилитация когнитивных функций с использованием холлистического подхода и/или специализированных когнитивных тренингов (в том числе в электронной форме) [224–226].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: Систематический обзор данных исследований с применением метаанализа выявил слабый положительный эффект от проведения нейропсихологической реабилитации, при этом часть исследований имели низкое качество. Результаты некоторых метаанализов конфликтуют с результатами других [224–226]. Исследования демонстрируют значимое улучшение показателей кратковременной и долговременной памяти, внимания, объема памяти и уменьшение депрессии после реабилитации [224,225]. Учитывая отсутствие доказанного эффекта на когнитивные функции от медикаментозной терапии, нейропсихологическую реабилитацию следует рассматривать как единственный доказанный метод улучшения когнитивных функций в настоящий момент. Продолжительность и виды вмешательства могут отличаться. В настоящий момент недостаточно данных, что определить преимущественную эффективность одного метода над другим [226].
- Пациентам с РС с 18 лет, проходящим реабилитацию на амбулаторном или стационарном этапе, рекомендуется консультация медицинского психолога и клинико-психологическое психодиагностическое обследование с целью выявления депрессии, тревожного синдрома, суицидальных наклонностей, нарушений мотивации и других эмоционально-волевых нарушений, а также для принятия решения о необходимости консультации врача-психиатра [227–229].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Депрессия и тревога являются частыми психологическими нарушениями при РС, приводя к снижению качества жизни, риску суицида и снижению комплаентности [227–229].
- Пациентам с РС при выявлении депрессивного синдрома по данным обследования медицинского психолога, рекомендуется индивидуальное клинико-психологическое консультирование, индивидуальная психотерапия и групповая психотерапия с целью снижения выраженности депрессии и улучшения качества жизни [230–232].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарий: Систематический обзор данных клинических исследований среднего качества (не все первичные конечные точки и выводы согласованы) с применением метаанализа демонстрирует снижение уровня депрессии от применения психологического консультирования и когнитивной поведенческой терапии индивидуально и в группе [232]. Недостаточно данных представлено по эффективности психологического вмешательства для уменьшения тревожного синдрома.
- Пациентам c РС с 18 лет рекомендуется проведение телемедицинской реабилитации для коррекции нарушений функций, улучшения показателей активности и участия (в структуре МКФ), уменьшения выраженности инвалидизации, уменьшения утомляемости и улучшения качества жизни [233].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Телемедицинская реабилитация может применяться в комплексном оказании помощи пациентам с РС. Очевидным преимуществом телереабилитации является возможность использования этого метода для наблюдения и контроля эффективности реабилитации у пациентов, проживающих удаленно. Исследования демонстрируют низкий уровень доказательности для проведенных вмешательств: в 9 РКИ, включенных в метаанализ, использовали различные виды и продолжительность вмешательств. Реабилитационные телемедицинские мероприятия включали физические упражнения, образование пациентов, поведенческую терапию и программы, направленные на снижение симптомов [233].
- Пациентам с РС при недержании мочи рекомендуются физические методы реабилитации с целью уменьшения выраженности дисфункции мочевого пузыря и улучшения качества жизни [234].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Рандомизированные клинические исследования выявили положительный эффект на показатели непроизвольного мочеиспускания и качества жизни при использовании физических упражнений для тренировки мышц малого таза, упражнений с применением биологической обратной связи c помощью электронейромиографии, стимуляции большеберцового нерва, стимуляции мышц тазового дна [234], совмещенных с ЛФК.
Прогноз
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
При постановке диагноза рассеянного склероза должны быть исключены все другие заболевания нервной системы, в том числе поражения при инфекционных, токсических, сосудистых и неопластических заболеваниях, а также системные аутоиммунные заболевания с васкулитами и наследственно-дегенеративные заболевания.
При начале и проведении ПИТРС необходимо учитывать соматическое состояние пациента и возможные побочные реакции. Особое внимание нужно уделить следующим состояниям на фоне терапии ПИТРС:
— Интерферонами бета-1a** и интерфероном бета-1b** – возможно усиление депрессии, усиление спастического повышения тонуса, повышение риска припадков при наличии эпилепсии в анамнезе;
— Терифлуномид** – у женщин детородного возраста — тщательная контрацепция, патология поджелудочной железы;
— Диметилфумарат** – гастроинтестинальные проблемы, симпатические реакции («жжение и горение» и др.), лимфопения и риск ПМЛ;
— #Митоксантрон**– существенное повышение риска развития лейкозов, повышение риска развития патологии сердца;
— Натализумаб** – острые инфузионные аллергические реакции на введение, риск ПМЛ в зависимости от наличия JC-инфекции и титра антител к этому вирусу, а также от предшествующей иммуносупрессии и длительности курса терапии препаратом, при отмене препарата – обострения РС, нельзя сочетать с другими ПИТРС;
— Финголимод** – брадикардия и нарушения ритма сердца, нельзя назначать при наличии сердечно-сосудистых заболеваний, особенно с брадикардией, при применении препаратов, замедляющих сердечный ритм, отек макулы (в малой степени), лимфопения и риск ПМЛ и других инфекций, высокий риск развития обострения при отмене препарата;
— Алемтузумаб** – острые инфузионные аллергические реакции на введение, риск оппортунистических инфекций (в том числе листериоза), патология щитовидной железы, иммунная тромбоцитопения (ИТП) и другие вторичные аутоиммунные реакции;
— Окрелизумаб** – острые инфузионные аллергические реакции на введение, риск оппортунистических инфекций;
— Кладрибин** — лимфопения и риск инфекций.
Госпитализация
Организация оказания медицинской помощи
- Для оказания помощи пациентам с РС рекомендуется организовывать отдельные структуры (кабинеты, клинико-диагностические кабинеты, отделения, специализированные неврологические центры по рассеянному склерозу) с целью диагностики, диспансерного наблюдения за данной категорией пациентов [237].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Организация специализированного центра/отделения/кабинета рассматривается экспертами — членами рабочей группы как единственно эффективная мера организации квалифицированной помощи пациентам с РС, а также способ сбора актуальной информации о распространённости заболевания и потребности в терапии ПИТРС, реабилитации и других мероприятиях.
- Диспансерное наблюдение пациентов с РС рекомендуется осуществлять в специализированном клинико-диагностическом кабинете/отделении или специализированном неврологическом центре рассеянного склероза [237].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Организация специализированного центра/отделения/кабинета рассматривается экспертами — членами рабочей группы как единственно эффективная мера организации квалифицированной помощи пациентам с РС, а также способ сбора актуальной информации о распространённости заболевания и потребности в терапии ПИТРС, реабилитации и других мероприятиях.
- Терапию обострений РС легкой степени тяжести рекомендуется проводить в дневном стационаре (Приложение Г14) [272].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Не все пациенты нуждаются в госпитализации в круглосуточный стационар для проведения терапии обострения РС. Нет достаточных данных для достоверной оценки преимуществ терапии обострения РС в условиях круглосуточного стационара, дневного стационара, домашних условиях. РКИ, проведенное Chataway и соавт., со средним качеством доказательств, включающее 124 пациента, не продемонстрировало различий в клинической эффективности между терапией обострения (внутривенными глюкокортикоидами), проводимой в дневном стационаре и на дому.
- Терапию обострений РС средней и тяжелой степеней тяжести рекомендуется проводить в круглосуточном стационаре (Приложение А3.12) [272].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарий: Не все пациенты нуждаются в госпитализации в круглосуточный стационар для проведения терапии обострения РС. Нет достаточных данных для достоверной оценки преимуществ терапии обострения РС в условиях круглосуточного стационара, дневного стационара, домашних условиях. РКИ, проведенное Chataway и соавт., со средним качеством доказательств, включающее 124 пациента, не продемонстрировало различий в клинической эффективности между терапией обострения (внутривенными глюкокортикоидами), проводимой в дневном стационаре и на дому.
- В случаях, затрудняющих проведение терапии обострений РС средней степени тяжести в круглосуточном стационаре, рекомендуется проводить лечение в дневном стационаре после обсуждения с пациентом [272].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: Не все пациенты нуждаются в госпитализации в круглосуточный стационар для проведения терапии обострения РС. Нет достаточных данных для достоверной оценки преимуществ терапии обострения РС в условиях круглосуточного стационара, дневного стационара, домашних условиях. РКИ, проведенное Chataway и соавт., со средним качеством доказательств, включающее 124 пациента, не продемонстрировало различий в клинической эффективности между терапией обострения (внутривенными глюкокортикоидами), проводимой в дневном стационаре и на дому.
- Пациентам, получающим инфузионные ПИТРС, для проведения внутривенных инфузий рекомендуется организовывать специализированные дневные стационары в структуре неврологических центров РС, клинико-диагностических кабинетов [237,273].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Проведение инфузии ПИТРС в рамках дневного стационара позволит снизить нагрузку на стационарное звено здравоохранения, обеспечив при этом оптимальный контроль за переносимостью и эффективностью терапии.
- В случае отсутствия показаний к назначению ПИТРС или письменного отказа пациента от терапии ПИТРС рекомендуется организация медицинской помощи по принципу доступности и качества (Приложение А3.9) [237].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: В первичную медицинскую документацию помещается документ, обосновывающий неполучение пациентом ПИТРС (решение специализированного центра; отказ пациента от получения ПИТРС). Пациентам, которые могут посещать первичное специализированное ЛПУ, проводится: осмотр лечащего врача-невролога (не реже 1 раза в 6 месяцев); назначение симптоматической терапии. Для пациентов, которые не могут посещать первичное специализированное ЛПУ, должна быть организованна патронажная служба по месту первичного ЛПУ.
- В случае принятия решения пациенткой с РС о планировании беременности рекомендуется направить пациентку в специализированный Центр (отделение, кабинет, клинико-диагностический кабинет) РС для проведения беседы об особенностях течения беременности и послеродового периода при РС. РС не является показанием для прерывания беременности [241–243].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Решение вопроса об оказании экстренной и плановой хирургической помощи, в том числе стоматологической, пациенту с РС рекомендуется принимать на основании объемов оперативного вмешательства и состояния пациента [274,275].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарий: РС не является противопоказанием для проведения медицинского вмешательства, необходимого пациенту в связи с возникшим сопутствующим заболеванием. Нет данных о наличии существенных противопоказаний к определенным видам медицинских вмешательств. Систематический обзор данных исследований с применением метаанализа выявил слабое повышение риска развития РС у пациентов, которым проводилась тонзилэктомия или аппендэктомия в возрасте до 20 лет, при этом часть исследований имели низкое качество.
- Решение вопроса об анестезиологическом пособии пациенту с РС в случае оказания хирургической помощи, в том числе стоматологической, рекомендуется принимать на основании объемов оперативного вмешательства и состояния пациента [276].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: РС не является противопоказанием для проведения медицинского вмешательства, необходимого пациенту в связи с возникшим сопутствующим заболеванием. Нет данных о наличии существенных противопоказаний к определенным видам медицинских вмешательств.
- Пациентам с РС рекомендуется телемедицинская консультация с целью обучения пациента использованию ПИТРС, плановой оценки состояния в динамике, выписки рецепта, а также с целью обсуждения вопросов, не требующих присутствия пациента (например, обсуждение диеты, режима дня или рисков передачи РС по наследству) [277,278].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарий: Телемедицинская консультация является вариантом эффективного расходования сил и средств системы здравоохранения и пациента в условиях дефицита времени и ограничений мобильности инвалидизированных пациентов. Широкое введение телемедицинских консультаций позволит пациентам получить от врача информацию, которую, за неимением времени на очном приеме, они задать не смогут.
- Пациентам с РС рекомендуется дистанционное наблюдение с целью оценки динамики лабораторных и инструментальных показателей при выполнении плана управления рисками, оценки рекомендованных и выполненных показателей обследований, оценки качества жизни пациентов [277,278].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарий: Дистанционное наблюдение возможно с применением информационных технологий и систем поддержки принятия решений, которые могут собирать, обрабатывать и фиксировать данные, полученные от пациента и передавать их лечащему врачу в соответствии с действующим законодательством.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Доказательных исследований по методам профилактики рассеянного склероза не проводилось. Вопросы первичной профилактики являются наиболее значимыми для людей, имеющих высокий риск развития РС, а именно – для родственников пациентов РС первой степени родства, пациентов с клинически изолированным синдромом, радиологически изолированным синдромом, носителями генетических маркеров РС (HLA-DR-1.15). Несмотря на отсутствие обширных исследований, отдельные эпидемиологические работы по методу случай-контроль показывают ассоциацию некоторых факторов риска с высокой частотой развития РС. К таким факторам относятся, курение, недостаток витамина Д, вирусные инфекции, хронический психоэмоциональный стресс.
Вторичная профилактика включает в себя профилактику активности РС (клиническую, радиологическую) и прогрессирования, а также управление рисками на ПИТРС, согласно утвержденному плану. Значимым считается правильное ведение беременности и родов, ограничение вакцинирования и инсоляции, диетические рекомендации, своевременная коррекция психоэмоциональных нарушений (особенно депрессии и тревоги) [235,236].
- Пациента с РС рекомендуется взять на диспансерное наблюдение в рамках специализированной амбулаторной неврологической службы, организованной либо в виде специализированного клинико-диагностического кабинета/отделения или специализированного неврологического центра по оказанию помощи пациентам с демиелинизирующими заболеваниями, с целью эффективного наблюдения и сопровождения [237].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Организация специализированного центра/отделения/кабинета рассматривается экспертами — членами рабочей группы как единственно эффективная мера организации квалифицированной помощи пациентам с РС, а также способ сбора актуальной информации о распространённости заболевания и потребности в терапии ПИТРС, реабилитации и других мероприятиях.
- Пациентам с РС рекомендуется плановый диспансерный осмотр проводить не реже чем 1 раз в 6 месяцев, с целью актуализации типа течения и стадии болезни, оценки прогрессирования, оценки эффективности ПИТРС, оценки безопасности терапии ПИТРС, соблюдения плана управления рисками, корректировки тактики ведения [238,239].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: Осмотр у специалиста по РС не реже 1 раза в 6 месяцев рассматривается экспертами-членами рабочей группы как достаточно эффективная мера для контроля эффективности и переносимости терапии, контроля над течением заболевания.
- Пациентам с РС при появлении новой неврологической симптоматики или значимого ухудшения имеющейся симптоматики длительностью свыше 24 часов рекомендуется проведение неврологического осмотра на предмет наличия обострения. При осмотре проводится объективизация имеющихся жалоб, исключение наличия инфекционного заболевания либо иной причины неврологических нарушений [24,240].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Ухудшение симптомов РС может возникать по многим причинам, в том числе, в результате инфекционного заболевания. Только осмотр квалифицированного врача-невролога — специалиста по РС — сможет определить причину появления жалоб, зафиксировать обострение или прогрессирование заболевания, а также сделать выводы об эффективности принимаемой терапии ПИТРС.
- Пациентам с РС при первоначальном назначении ПИТРС, а также при любой смене терапии рекомендуется повторный прием врача-невролога с целью разъяснительной беседы лечащим врачом об ожидаемых результатах терапии, режиме терапии. Пациенту должна быть предоставлена информация о рисках и побочных эффектах терапии [24].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Информированность пациента важна для повышения комплаенса. Совместное принятие решения о назначении или смене терапии ПИТРС, информирование пациента о рисках и правилах приема ПИТРС, а также о плане управления рисками является необходимым этапом при начале любой терапии ПИТРС, что требует дополнительного времени и повторного визита именно с целью обсуждения и принятия решения.
- При назначении ПИТРС пациенткам с РС рекомендуется проводить беседу о необходимости применения надежных методов контрацепции в течение всего периода терапии ПИТРС и определенное время после окончания терапии (в случае лечения натализумабом**, алемтузумабом**, окрелизумабом**, терифлуномидом**, #митоксантроном**, финголимодом**, кладрибином**) [241–244].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- Пациентам с РС рекомендуется проведение МРТ головного мозга с контрастированием по следующим показаниям [51,54]:
— при наличии клинических признаков обострения РС;
— перед началом терапии ПИТРС или при замене ПИТРС;
— после родов;
— при отсутствии корректных данных предыдущего исследования (например, пациент начинает наблюдаться в другой клинике, данные МРТ из предыдущей клиники отсутствуют);
— при сомнении и предполагаемом пересмотре диагноза;
— на фоне терапии ПИТРС (через 6 месяцев после начала терапии, через 12 месяцев после начала терапии, далее каждые 12 месяцев);
— на фоне терапии натализумабом** более 2 лет при наличии высокого риска развития ПМЛ (пациенты с высоким индексом антител к JC-вирусу ≥ 1,5 или предшествующей терапией иммунодепрессантами в анамнезе) каждые 3 — 6 месяцев по сокращенному протоколу [51].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Динамическое наблюдение пациента с использованием методики МРТ на фоне терапии ПИТРС для определения эффективности получаемой терапии. При анализе данных наблюдения следует учитывать, что начало клинического эффекта препарата обычно отсрочено и наступает (в зависимости от препарата) через 3 — 6 месяцев после начала его использования. Поэтому проведение контрольной МРТ при назначении или замене ПИТРС до срока 6 месяцев нецелесообразно. Проведение МРТ головного мозга в случае замены ПИТРС необходимо для обеспечения безопасности новой
терапии и стартовой оценки активности РС.
- Пациентам с РС при выполнении МРТ исследовании рекомендуется оформление структурированного протокола заключения, с целью анализа динамики очагов, оценки эффективности проводимой терапии (Приложение А3.5) [56,245].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарий: Экспертами — членами рабочей группы однозначно рекомендуется заполнение структурированного протокола заключения, на основе которого лечащий врач может принимать решения о дальнейшей тактике ведения пациента. Без заполнения структурированного протокола заключения услуга проведения МРТ исследования считается не выполненной или выполненной не качественно.
- Выбор тактики ведения беременности и метода родоразрешения у пациенток с РС рекомендуется осуществлять в соответствии с общими рекомендациями ведения беременности и родов по усмотрению лечащего врача-акушера-гинеколога [241,242].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарий: при наличии у пациентки с РС нижнего парапареза с выраженной спастичностью целесообразно использовать метод кесарева сечения для предупреждения развития вторичной слабости родовой деятельности [242].
- Пациенткам с РС после родов рекомендуется особое внимание уделять профилактике инфекций и адекватной психокоррекции, наиболее оптимальным сроком возобновления приема ПИТРС является третий месяц послеродового периода при условии полного прекращения грудного вскармливания ребенка (с целью минимизации возможных рисков обострений через 3 месяца после родов) [241,243].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- Пациентам с РС рекомендуется отказаться от курения, с целью предотвращения ухудшения прогноза течения заболевания [246,247].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Курение связано с большим риском обострений и прогрессирования РС [246,247]. С целью снижения риска прогрессирования инвалидизации рекомендуется информировать пациентов о пользе и способах отказа от курения.
- Пациентам с РС рекомендуется исследование уровня 25-OH витамина Д в крови в сыворотке крови с последующей коррекцией его уровня до нормальных значений с целью снижения риска ухудшения течения заболевания; в случае невозможности контроля уровня витамина Д необходимо рекомендовать безопасную дозу колекальциферола** до 4000 МЕ на постоянный прием; необходимо избегать бесконтрольного приема доз, превышающих 10000 МЕ[248].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Низкий уровень витамина Д связан с повышением риска развития РС [248]. Основным ограничением, препятствующим использованию витамина Д в качестве модифицирующей течение РС добавки, является отсутствие контролируемых рандомизированных исследований [248]. Существуют косвенные данные, указывающие на то, что прием витамина Д может снизить частоту обострений, однако эти данные нуждаются в подтверждении [249,250]. Не известно также влияние приема витамина Д на нейродегенеративный компонент РС и клиническое прогрессирование симптомов.
- При наличии у пациента с РС расстройств мочеиспускания рекомендуется направить пациента к профильному специалисту (врач-уролог, врач-акушер-гинеколог) для исключения сопутствующих заболеваний, приводящий к нарушению тазовых функций и выполнения УЗИ мочевого пузыря с определением объема остаточной мочи, при необходимости проведения уродинамических исследований для обеспечения безопасности терапии расстройств мочеиспускания [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Квалифицированное обследование у профильного специалиста позволит провести дифференциальную диагностику состояния, исключить причины, не связанные с поражением ЦНС и назначить адекватную терапию. Предпочтительнее направлять к специалистам, имеющим опыт в работе с пациентами неврологического профиля – врачам-урологам (нейроурологам).
- При остаточном объеме мочи более 100 мл у пациентов с РС с расстройствами мочеиспускания рекомендуется проведение периодической самокатетеризации (после обучения специалистом) с целью коррекции расстройств мочеиспускания [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Объем остаточной мочи, требующий периодической самокатетеризации, достоверно не определен. Необходимо учитывать индивидуальные особенности пациентов.
- У пациентов с РС, получающих инъекционную терапию ПИТРС первой линии с целью профилактики появления и контроля местных НПР терапии (покраснение и отек, зуд, уплотнение, дискомфорт, кровоизлияние, липоатрофия, некроз) рекомендуется [251,252]:
— при начале терапии интерферонами бета-1a** и интерфероном бета-1b**–титровать дозу препарата согласно инструкции по медицинскому применению лекарственного препарата;
— при наличии технической возможности использовать автоинжектор;
— проконтролировать асептику и антисептику, технику выполнения инъекций пациентом;
— перед инъекцией выдержать препарат при комнатной температуре в течение 20-30 минут;
— после инъекции приложить пакет охлаждающий к месту инъекции на 2 — 3 минуты;
— не вводить препарат в имеющиеся уплотнения после предыдущих инъекций;
— в случае подозрения на воспалительные изменения в местах инъекций или некроз – срочно проконсультировать у врача-хирурга.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Данные рекомендации по мнению экспертов-членов рабочей группы позволят снизить риск развития НПР. Дополнительное предоставление наглядной информации в виде раздаточных материалов, буклетов или материалов в сети Интернет поможет повысить информированность пациентов, особенно при нарушениях памяти.
- Пациентам с РС (с 18 лет), получающим ПИТРС (интерферон бета-1a** или интерферон бета-1b**), с целью профилактики появления и контроля гриппоподобного синдрома рекомендуется [252]:
— при начале терапии — титровать дозу препарата согласно инструкции по медицинскому применению лекарственного препарата;
— выполнять инъекцию в вечернее время или на ночь, за исключением лекарственного препарата пэгинтерферон бета-1a**, инъекции которого желательно проводить в утренние или дневные часы;
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
- Пациентам с РС (с 12 лет), получающим ПИТРС (интерферон бета-1a** или интерферон бета-1b**), с целью профилактики появления и контроля гриппоподобного синдрома рекомендуется [284]:
— при старте терапии — начинать терапию с половины рекомендуемой дозы для взрослых, достигая полной дозы в течение 1 — 3 месяцев;
— выполнять инъекцию в вечернее время или на ночь;
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Данные рекомендации по мнению экспертов-членов рабочей группы позволят снизить риск развития НПР.
- У пациентов с РС, получающих терапию ПИТРС, с целью контроля функции печени рекомендуется определение уровня печеночных ферментов (определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, при необходимости – определение активности гамма-глютамилтрансферазы в крови и определение активности щелочной фосфатазы в крови), исследование уровня общего билирубина в крови и исследование уровня свободного и связанного билирубина в крови по окончании первого месяца терапии, затем с частотой не менее 1 раза в 3 месяца для пациентов с РС, получающих терапию интерферонами бета-1a**, пэгинтерфероном бета-1a** и интерфероном бета-1b**, глатирамера ацетатом**, диметилфумаратом**, кладрибином**, натализумабом** (для натализумаба** – перед каждым введением препарата), финголимодом**, терифлуномидом** (для терифлуномида** — первые 6 месяцев 1 раз в месяц). Пациентам, получающим терапию окрелизумабом**, рекомендуется контроль анализов каждые 6 месяцев. Пациентам, получающим терапию алемтузумабом**, рекомендуется контроль анализов каждый месяц в течение 4 лет терапии. [251,253]:
— рекомендуется временное приостановление приема препарата с консультацией врача-гастроэнтеролога и направлением в специализированный центр (кабинет) РС в случае, если: [251]
1) уровень АлАТ/АсАТ превышает 8 верхнюю границу нормы (ВГН);
2) уровень АлАТ/АсАТ превышает 5 ВГН на протяжении 2 недель (в 3
последовательных анализах);
3) уровень АлАТ/АсАТ превышает 3 ВГН в сочетании с повышением общего билирубина свыше 2 ВГН;
4) уровень АлАТ/АсАТ превышает 3 ВГН в сочетании с проявлениями тошноты, рвоты, боли и напряжения в правой подреберье, лихорадкой и/или эозинофилией (> 5%);
5) уровень общего билирубина изолированно превышает 2 ВГН в повторных анализах с промежутком 48 часов.
Для терифлуномида** необходимо приостановление приема препарата с консультацией врача-гастроэнтеролога и направлением в специализированный центр (кабинет) РС в случае, если уровень АЛТ/АСТ превышает 3 ВГН, подтвержденный через 2 недели;
— в случае подтверждения лекарственного гепатита на фоне терапии терифлуномидом** рекомендуется проведение ускоренного курса выведения препарата – #активированный уголь 50 г каждые 12 часов в течение 11 дней (при плохой переносимости ежедневный прием необязателен) [286], дальнейшая терапия – согласно клиническим рекомендация по терапии лекарственного гепатита;
— в случае выявления отклонений уровня АлАТ/АсАТ, превышающих 3 ВГН, но не достигающих критериев отмены, рекомендован еженедельный мониторинг до нормализации показателей, возможно снижение дозы препарата до ½ дозы.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Клиническими исследованиями не определена периодичность выполнения анализов крови и тактика действия в каждом конкретном случае приема терапии ПИТРС. Данные рекомендации по мнению экспертов — членов рабочей группы позволят снизить риск развития и выраженность НПР.
- У пациентов с РС, получающих терапию ПИТРС, с целью контроля функции кроветворения рекомендуется проведение развернутого клинического анализа крови (с подсчетом числа лимфоцитов, нейтрофилов) по окончании первого месяца терапии, затем с частотой не менее 1 раза в 3 месяца для пациентов с РС, получающих терапию интерферонами бета-1a**, пэгинтерферон бета-1a** и интерфероном бета-1b**, глатирамера ацетатом**, диметилфумаратом**, натализумабом** (для натализумаба** – перед каждым введением препарата), финголимодом**, терифлуномидом** [254] в связи с повышенным риском развития инфекционных осложнений [254,255]. Пациентам на терапии окрелизумабом** рекомендуется выполнение исследований каждые 6 месяцев, на терапии алемтузумабом** – каждый месяц в течение 4 лет после проведенной терапии. Пациентам на терапии кладрибином** рекомендуется проведение исследований через два и шесть месяцев после начала лечения на первом и втором годах терапии:
— Для оценки риска возникновения осложнений рекомендуется использовать общую шкалу токсичности (Приложение А3.8);
— В случае обнаружения 2 степени токсичности на фоне терапии интерферонами бета-1a**, пэгинтерфероном бета-1a** и интерфероном бета-1b** или глатирамера ацетатом** рекомендуется снизить дозировку препарата до ½ дозы с повторным анализом через 4 недели, либо мониторировать показатели с периодичность в 2 или 4 недели по решению врача-невролога; на фоне терапии диметилфумаратом** или финголимодом** рекомендуется повторить анализ через 4 недели;
— На фоне терапии интерферонами бета-1a**, пэгинтерфероном бета-1a** и интерфероном бета-1b**, глатирамера ацетатом**, терифлуномидом** в случае обнаружения 3 или 4 степени токсичности рекомендуется отменить препарат, повторить анализ крови в кратчайшие сроки и направить пациента в специализированный центр (кабинет) РС для решения вопроса о дальнейшей тактике;
— На фоне терапии диметилфумаратом** в случае обнаружения 3 или 4 степени токсичности по уровню лимфоцитов (уровень менее 0,5х109/л) либо при сохраняющемся уровне лимфоцитов ниже 0,8х109/л в течение 6 месяцев рекомендуется отменить препарат, повторить анализ крови в кратчайшие сроки и направить пациента в специализированный центр (кабинет) РС для решения вопроса о дальнейшей тактике;
— На фоне терапии финголимодом** в случае обнаружения 4 степени токсичности по уровню лимфоцитов (менее 0,2х109/л) или 3 степени токсичности по уровню тромбоцитов (менее 50х109/л) или 2 степени по уровню нейтрофилов (менее 1,0х109/л) рекомендуется временно отменить препарат, повторить анализ крови в кратчайшие сроки и направить пациента в специализированный центр (кабинет) РС для решения вопроса о дальнейшей тактике.
— На фоне терапии кладрибином** в случае обнаружения 3 токсичности по уровню лимфоцитов (менее 0,5х109/л) активный контроль должен проводиться до восстановления числа лимфоцитов. В случае выявления 4 степени токсичности по уровню лимфоцитов (менее 0,2х109/л), целесообразно рассмотреть вопрос о профилактическом назначении противогерпетической терапии на пока сохранения лимфопении 4 степени токсичности. При необходимости 2-й годовой курс лечения может быть отложен на срок до 6 месяцев до восстановления приемлемого числа лимфоцитов (более 0,8х109/л). В случае, если период восстановления числа лимфоцитов занимает более 6 месяцев, прием кладрибина** должен быть прекращен.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Клиническими исследованиями не определена периодичность выполнения анализов крови и тактика действия в каждом конкретном случае приема терапии ПИТРС. Данные рекомендации по мнению экспертов-членов рабочей группы позволят снизить риск развития и выраженность НПР.
- У пациентов с РС, получающих диметилфумарат**, с целью профилактики появления и контроля гастроинтестинальных НПР (тошнота, рвота, боли в животе), рекомендуется [91]:
— при начале терапии — титровать дозу препарата согласно инструкции по медицинскому применению лекарственного препарата;
— принимать препарат вместе с приемом пищи;
— консультация врача-гастроэнтеролога;
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- У пациентов с РС, получающих финголимод**, с целью профилактики появления и контроля кардиальных НПР(брадикардия, блокады) рекомендуется проводить мониторинг приема первой дозы препарата в условиях специализированного центра (кабинета) РС [123,256]. Перед решением вопроса о назначение лекарственного препарата финголимод** пациент должен быть обязательно консультирован врачом-кардиологом с проведением холтеровского мониторирования сердечного ритма. При благоприятном решении:
— до приема препарата рекомендуется провести измерение артериального давления и пульса, регистрация электрокардиограммы на предмет наличия противопоказаний к приему первой дозы: 1) ЧСС в покое менее 55 ударов/мин); 2)
атриовентрикулярной блокады II и III степени (текущей или в анамнезе), 3) синоатриальной блокады; 4) синдрома слабости синусового узла; 5) удлинения QT (QTc > 470 мс у женщин, QTc > 450 мс у мужчин);
— после приема дозы препарата – каждый час в течение 6 часов необходимо провести измерение артериального давления и пульса; через 6 часов – регистрацию электрокардиограммы;
— пациенты могут быть отпущены домой, если соблюдаются все условия: 1) частота пульса выше минимального значения в ходе 6-часового наблюдения, 2) нет симптомов брадикардии (головокружение, усталость, ощущение сердцебиения и т.д.), 3) на ЭКГ нет удлинения QT ≥ 500 мс, 4) нет признаков впервые выявленной атриовентрикулярной блокады второй или более высокой степени, 5) прошло 6 часов от момента приёма первой дозы финголимода**;
— если ЧСС через 6 часов после приема финголимода** минимальна, то необходимо продлить мониторинг на 2 часа и более, до увеличения ЧСС;
— если у пациента ЧСС < 45, QTc > 500 мс, впервые возникшая АВ-блокада 2 степени или в любое время АВ-блокада 3 степени – продлить мониторинг до 24 часов;
— аналогичный мониторинг необходимо организовать в случае перерыва в приёме препарата свыше 7 дней.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарий: Указанные рекомендации помогут предотвратить развитие клинически значимой брадикардии.
- У пациентов с РС, получающих натализумаб**, для профилактики появления оппортунистических инфекций (прогрессирующая мультифокальная энцефалопатия (ПМЛ)) рекомендуется проводить стратификацию пациентов по риску развития ПМЛ и действовать в соответствии с выбранным алгоритмом (Приложение А3.10) [257].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Несмотря на то, что большинство ПМЛ у пациентов с РС возникли на терапии натализумабом**, следует учитывать, что развитие данной оппортунистической инфекции возможно на фоне терапии финголимодом**, терифлуномидом**, диметилфумаратом**, алемтузумабом**, окрелизумабом** [258].
- У пациентов с РС, получающих терапию интерферонами бета-1a** и интерфероном бета-1b**, с целью установления причины субоптимального ответа на терапию ПИТРС рекомендуется исследование титра нейтрализующих антител (НАТ) к препаратам интерферона бета-1a** и интерферона бета-1b** в крови через 12 месяцев от начала терапии. У НАТ-негативных пациентов повторный анализ рекомендуется повторять не реже 1 раза в 12 месяцев. У пациентов со стойким низким титром НАТ рекомендуется исследование активности МхА-протеина, при отсутствии активности которого рекомендуется смена терапии на препарат с другим механизмом действия. У пациентов с высоким титром НАТ, сохраняющимся в повторных анализах, рекомендована смена терапии на препарат ПИТРС с другим механизмом действия [259].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарий: Определение клинической значимости выявления НАТ является сложным по нескольким причинам: многие исследования этой проблемы не имели достаточного количества участников, за которыми бы наблюдали в течение достаточно длительного времени; забор образцов для анализа проводился в разное время от начала терапии; не были определены единые референтные значения для низкого, среднего и высокого титра, особенно для разных видов интерферона бета [259–261]. Некоторые пациенты из НАТ-позитивных могут со временем стать НАТ-негативными [262]. Исследование Kappos и соавт. показывает, что определение НАТ в высоком титре через 1 год от начала терапии снижает эффективность терапии препаратами интерферона бета-1a** через 4 года [263]. Рекомендации Goodin c соавт. определяют консенсусные значения титров НАТ и тактику терапии в каждом конкретном случае [259].
- У пациентов, получающих окрелизумаб**, алемтузумаб**, с целью профилактики реактивации хронических инфекций рекомендуется определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови,определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови,определение антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител классов к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к бледной трепонеме (Treponema pallidum) в нетрепонемных тестах (RPR, РМП) (качественное и полуколичественное исследование) в сыворотке крови и внутрикожной пробы с туберкулезным аллергеном перед каждым введением препарата [25,264–266].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Введение указанных ПИТРС может приводить к реактивации хронических инфекций, что отражено в инструкции по применению данных препаратов. С целью снижения риска терапии всем пациентам рекомендовано выполнение указанных исследований перед началом терапии.
- Пациентам с ремиттирующим РС, имеющим контакт с пациентами с подтвержденным COVID-19, которым планируется назначение ПИТРС, с целью снижения риска тяжелого течения COVID-19 рекомендуется терапия высокодозным интерфероном бета-1b** 250 мкг; высокодозным интерфероном бета-1а** 44 мкг; интерфероном бета-1а** 30 мкг; пэгинтерфероном бета-1a** 125 мкг; глатирамера ацетатом** 20 мг и 40 мг при соблюдении соотношения польза/риск от рекомендованной терапии [267–271].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Данные рекомендации, по мнению экспертов-членов рабочей группы, позволят снизить риск развития тяжелого течения коронавирусной инфекции SARS-CoV-2 в период эпидемических вспышек. Решение о начале рекомендованной терапии следует принимать совместно с пациентом при соблюдении соотношения польза/риск от рекомендованной терапии.
- Пациентам с быстропрогрессирующим РС, имеющим контакт с пациентами с подтвержденным COVID-19, которым планируется назначение ПИТРС, с целью снижения риска тяжелого течения COVID-19 рекомендуется терапия натализумабом** 300 мг внутривенно 1 раз в 28 дней [267–271].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Данная рекомендация, по мнению экспертов-членов рабочей группы, позволят снизить риск развития тяжелого течения коронавирусной инфекции SARS-CoV-2в период эпидемических вспышек у пациентов с быстропрогрессирующим РС, которым по жизненным показаниям рекомендована терапия ПИТРС второй линии.
- Пациентам с первично-прогрессирующим РС, имеющим контакт с пациентами с подтвержденным COVID-19, которым планируется назначение ПИТРС, с целью снижения риска тяжелого течения COVID-19 рекомендуется отложить терапию окрелизумабом** 600 мг внутривенно капельно на 1 месяц [267–271].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Данная рекомендация, по мнению экспертов-членов рабочей группы, позволят снизить риск развития тяжелого течения коронавирусной инфекции SARS-CoV-2 в период эпидемических вспышек у пациентов с ППРС.
- Пациентам с РС, имеющим контакт с пациентами с подтвержденным COVID-19 и получающим ПИТРС, с целью снижения риска тяжелого течения СOVID-19 рекомендуется в отношении определенных ПИТРС следующая тактика, с целью соблюдения соотношения польза/риск от проводимой терапии:
— натализумаб**: увеличить интервал между инфузиями до 6 недель после 6 месяцев терапии с интервалом 4 недели между инфузиями;
— окрелизумаб**: отложить планируемую инфузию на 1 месяц;
— алемтузумаб**: увеличить интервал между 1-м и 2-м лечебными циклами до 18 месяцев; при запланированном 3-м или 4-м лечебных курсах терапии проведение инфузии отложить до 6 месяцев;
— кладрибин**: отложить начало терапии на 1 месяц [267–271].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Данная рекомендация, по мнению экспертов — членов рабочей группы, позволят снизить риск развития тяжелого течения коронавирусной инфекции SARS-CoV-2 в период эпидемических вспышек.
- Пациентам с РС с подтвержденным COVID-19, получающим ПИТРС, с целью снижения риска тяжелого течения COVID-19 рекомендуется приостановить до реконвалесценции по вирусному заболеванию все ПИТРС, кроме интерферона бета-1b** 250 мкг; интерферона бета-1а** 44 мкг; интерферона бета-1а** 30 мкг; пэгинтерферона бета-1a** 125 мкг; глатирамера ацетата** 20 мг и 40 мг, при соблюдении соотношения польза/риск от проводимой терапии [267–271].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Данная рекомендация, по мнению экспертов-членов рабочей группы, позволят снизить риск развития тяжелого течения коронавирусной инфекции SARS-CoV-2 в период эпидемических вспышек. Требуются дальнейшие исследования по влиянию терапии ПИТРС на течение коронавирусной инфекции SARS-CoV-2.
Информация
Источники и литература
-
Клинические рекомендации Всероссийского общества неврологов
- 1. Гусев ЕИ, Бойко А, Столяров И. Рассеянный Склероз. Москва: РеалТайм; 2009.
2. Ramagopalan S V., Dobson R, Meier UC, Giovannoni G. Multiple sclerosis: risk factors,
prodromes, and potential causal pathways. Lancet Neurol. 2010;9(7):727-739.
doi:10.1016/S1474-4422(10)70094-6
3. Loma I, Heyman R. Multiple Sclerosis: Pathogenesis and Treatment. Curr
Neuropharmacol. 2011;9(3):409-416. doi:10.2174/157015911796557911
4. Thompson AJ, Baneke P. Multiple Sclerosis International Federation (MSIF) Design and
Editorial Support by Summers Editorial & Design Graphics by Nutmeg Productions
Printed by Modern Colour Solutions.; 2013. www.msif.org. Accessed April 13, 2020.
5. Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017
revisions of the McDonald criteria. Lancet Neurol. 2018;17(2):162-173.
doi:10.1016/S1474-4422(17)30470-2
6. Gusev E, Boiko A, Bikova O, et al. The natural history of early onset multiple sclerosis:
Comparison of data from Moscow and Vancouver. In: Clinical Neurology and
Neurosurgery. Vol 104. Clin Neurol Neurosurg; 2002:203-207. doi:10.1016/S0303-
8467(02)00039-2
7. Simone IL, Carrara D, Tortorella C, et al. Course and prognosis in early-onset MS:
Comparison with adult-onset forms. Neurology. 2002;59(12):1922-1928.
doi:10.1212/01.WNL.0000036907.37650.8E
8. Etemadifar M, Afzali P, Tabrizi N, Hosseini S-A. Pediatric Multiple Sclerosis with
Primary Progressive Course—Report of a Retrospective Cohort Study in Iran.
Neuropediatrics. 2012;44(03):167-170. doi:10.1055/s-0032-1329614
9. Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple
sclerosis: The 2013 revisions. Neurology. 2014;83(3):278-286.
doi:10.1212/WNL.0000000000000560
10. CHMP. Committee for Medicinal Products for Human Use (CHMP) Assessment Report.;
2014. www.ema.europa.eu. Accessed April 13, 2020.
11. Huisman E, Papadimitropoulou K, Jarrett J, et al. Systematic literature review and
network meta-analysis in highly active relapsing-remitting multiple sclerosis and rapidly
evolving severe multiple sclerosis. BMJ Open. 2017;7(3):e013430. doi:10.1136/bmjopen-
2016-013430
12. Van Der Vuurst De Vries RM, Mescheriakova JY, Wong YYM, et al. Application of the 2017 Revised McDonald Criteria for Multiple Sclerosis to Patients with a Typical
Clinically Isolated Syndrome. JAMA Neurol. 2018;75(11):1392-1398.
doi:10.1001/jamaneurol.2018.2160
13. Lee DH, Peschke M, Utz KS, Linker RA. Diagnostic value of the 2017 McDonald criteria
in patients with a first demyelinating event suggestive of relapsing–remitting multiple
sclerosis. Eur J Neurol. 2019;26(3):540-545. doi:10.1111/ene.13853
14. Miclea A, Salmen A, Wiest R, et al. Prediction of conversion to multiple sclerosis using
the 2017 McDonald and 2016 MAGNIMS criteria in patients with clinically isolated
syndrome: a retrospective single-centre study. Ther Adv Neurol Disord. 2019;12.
doi:10.1177/1756286419835652
15. Wong YYM, De Mol CL, Van Der Vuurst De Vries RM, et al. Real-world validation of
the 2017 McDonald criteria for pediatric MS. Neurol Neuroimmunol NeuroInflammation.
2019;6(2). doi:10.1212/NXI.0000000000000528
16. Fadda G, Brown RA, Longoni G, et al. MRI and laboratory features and the performance
of international criteria in the diagnosis of multiple sclerosis in children and adolescents: a
prospective cohort study. Lancet Child Adolesc Heal. 2018;2(3):191-204.
doi:10.1016/S2352-4642(18)30026-9
17. Krupp LB, Tardieu M, Amato MP, et al. International Pediatric Multiple Sclerosis Study
Group criteria for pediatric multiple sclerosis and immune-mediated central nervous
system demyelinating disorders: Revisions to the 2007 definitions. Mult Scler J.
2013;19(10):1261-1267. doi:10.1177/1352458513484547
18. Solomon AJ, Bourdette DN, Cross AH, et al. The contemporary spectrum of multiple
sclerosis misdiagnosis. Neurology. 2016;87(13):1393-1399.
doi:10.1212/WNL.0000000000003152
19. Yamout BI, Khoury SJ, Ayyoubi N, et al. Alternative diagnoses in patients referred to
specialized centers for suspected MS. Mult Scler Relat Disord. 2017;18:85-89.
doi:10.1016/j.msard.2017.09.016
20. Solomon AJ, Klein EP, Bourdette D. ‘Undiagnosing’ multiple sclerosis: The challenge of
misdiagnosis in MS. Neurology. 2012;78(24):1986-1991.
doi:10.1212/WNL.0b013e318259e1b2
21. Ghezzi A, Martinelli V, Torri V, et al. Long-term follow-up of isolated optic neuritis: The
risk of developing multiple sclerosis, its outcome, and the prognostic role of paraclinical
tests. J Neurol. 1999;246(9):770-775. doi:10.1007/s004150050453
22. Meyer-Moock S, Feng YS, Maeurer M, Dippel FW, Kohlmann T. Systematic literature
review and validity evaluation of the Expanded Disability Status Scale (EDSS) and the
Multiple Sclerosis Functional Composite (MSFC) in patients with multiple sclerosis. BMC
Neurol. 2014;14(1):58. doi:10.1186/1471-2377-14-58
23. Bin Sawad A, Seoane-Vazquez E, Rodriguez-Monguio R, Turkistani F. Evaluation of the
Expanded Disability Status Scale and the Multiple Sclerosis Functional Composite as
clinical endpoints in multiple sclerosis clinical trials: quantitative meta-analyses. Curr
Med Res Opin. 2016;32(12):1969-1974. doi:10.1080/03007995.2016.1222516
24. Perry M, Swain S, Kemmis-Betty S, et al. Multiple sclerosis: Summary of NICE
guidance. BMJ. 2014;349. doi:10.1136/bmj.g5701
25. Epstein D. J., Dunn J., Deresinski S. Infectious complications of multiple sclerosis
therapies: implications for screening, prophylaxis, and management //Open forum
infectious diseases. – US : Oxford University Press, 2018; 5 (8):ofy174.
26. Wei LK, Griffiths LR, Irene L, Kooi CW. Association of NOTCH3 gene polymorphisms
with ischemic stroke and its subtypes: A meta-analysis. Med. 2019;55(7).
doi:10.3390/medicina55070351
27. Senol MG, Sonmez G, Ozdag F, Saracoglu M. Reversible myelopathy with vitamin B12
deficiency. Singapore Med J. 2008;49(11):e330-2.
http://www.ncbi.nlm.nih.gov/pubmed/19037544. Accessed April 14, 2020.
28. Hammarin AL, Bogdanovic G, Svedhem V, Pirskanen R, Morfeldt L, Grandien M.
Analysis of PCR as a tool for detection of JC virus DNA in cerebrospinal fluid for
diagnosis of progressive multifocal leukoencephalopathy. J Clin Microbiol.
1996;34(12):2929-2932. doi:10.1128/jcm.34.12.2929-2932.1996
29. Giovannoni G, Marta M, Davis A, Turner B, Gnanapavan S, Schmierer K. Switching
patients at high risk of pml from natalizumab to another disease-modifying therapy. Pract
Neurol. 2016;16(5):389-393. doi:10.1136/practneurol-2015-001355
30. Ruiz-Gaviria R, Baracaldo I, Castañeda C, Ruiz-Patiño A, Acosta-Hernandez A, Rosselli
D. Specificity and sensitivity of aquaporin 4 antibody detection tests in patients with
neuromyelitis optica: A meta-analysis. Mult Scler Relat Disord. 2015;4(4):345-349.
doi:10.1016/j.msard.2015.06.003
31. Slater CA, Davis RB, Shmerling RH. Antinuclear antibody testing: A study of clinical
utility. Arch Intern Med. 1996;156(13):1421-1425. doi:10.1001/archinte.156.13.1421
- 1. Гусев ЕИ, Бойко А, Столяров И. Рассеянный Склероз. Москва: РеалТайм; 2009.
Информация
Список сокращений
АФС – антифосфолипидный синдром
ВАРС – высокоактивный рассеянный склероз
ВГН – верхняя граница нормы
ВИ – взвешенное изображение
ВПРС – вторично-прогрессирующий рассеянный склероз
ГК – глюкокортикоиды
ГГТ – гамма-глутамилтрансфераза
ИТП – иммунная тромбоцитопения
КВ – контрастное вещество
КИС – клинически изолированный синдром
МЗ – Министерство здравоохранения
МРТ – магнитно-резонансная томография
МЭС – медико-экономические стандарты
НДАЗ – нет данных за активность заболевания
НПР – нежелательная побочная реакция
ОНМ – оптиконейромиелит
ЗСОНМ – заболевания спектра оптиконейромиелита
ОРЭМ – острый рассеянный энцефаломиелит
ПИТРС – препараты, изменяющие течение рассеянного склероза
ППРС – первично-прогрессирующий рассеянный склероз
ПЦР – полимеразная цепная реакция
РИС – радиологически изолированный синдром
РКИ – рандомизированное клиническое исследование
РРС – ремиттирующий рассеянный склероз
РС – рассеянный склероз
СКВ – системная красная волчанка
СОЭ – скорость оседания эритроцитов
ТТГ – тиреотропный гормон
ЦНС – центральная нервная система
СМЖ – спинномозговая жидкость
EDSS – Расширенная шкала статуса инвалидизации пациента (РШСИ)
ФС – Функциональные системы (шкала функциональных систем Куртцке)
IgG – иммуноглобулин класса G
IgM– иммуноглобулин класса М
MSIF – Международная Федерация пациентов с рассеянным склерозом
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Активность РС по данным МРТ – состояние, определяемое по данным МРТ, характеризующееся появлением новых и/или увеличением размера старых очагов на Т2-ВИ и/или наличием накапливающих парамагнитный контраст очагов на Т1-ВИ в головном и/или спинном мозге.
Диссеминация в пространстве – классический критерий РС, входящий в состав критериев МакДональда 2010 и 2017 года (Приложения А 3.2 и А 3.1), согласно которому пациент должен иметь клинические признаки поражения не менее двух различных участков центральной системы (ЦНС), либо соответствовать критериям диссеминации в пространстве по данным МРТ, либо комбинацию этих признаков
Диссеминация во времени – классический критерий РС, входящий в состав критериев МакДональда 2010 и 2017 года (Приложения А 3.2 и А 3.1), согласно которому пациент должен иметь не менее двух клинических обострений, либо соответствовать критериям диссеминации во времени по данным МРТ, либо комбинацию этих признаков.
Клинически изолированный синдром (КИС) – первый и единственный клинический эпизод нарушения неврологических функций, вызванный повреждением одного или нескольких отделов центральной нервной системы (ЦНС), длящийся свыше 24 часов, при этом имеющиеся данные клиники и МРТ-картины не удовлетворяют критериям диагностики РС (критерии Мак Дональда 2010 и 2017).
Оптимальный ответ на терапию (нет данных за активность заболевания, НДАЗ) – отсутствие обострений, отсутствие прогрессирования неврологического дефицита в течение периода наблюдения, отсутствие активности по данным МРТ.
Острый демиелинизирующий эпизод – остро возникшая симптоматика, клинически подозрительная на проявления РС или другое демиелинизирующее заболевание.
ПИТРС первой линии – ПИТРС, назначаемые в качестве препаратов первого выбора при РС.
ПИТРС второй линии – ПИТРС, назначаемые в качестве препаратов последующего выбора в случае неэффективности или непереносимости препаратов первой линии, либо в случае наличия быстропрогрессирующего течения РС в качестве препаратов первого выбора. При оценке безопасности терапии требуется проведение дополнительных специальных анализов и консультаций иных специалистов, кроме врача-невролога.
Резистентность к терапии – это клинико-радиологические характеристики течения РС, возникающие на фоне проводимой терапии, на основании которых необходимо принятие решения об эскалации терапии (Приложение А 3.7).
Субоптимальный ответ на терапию – это клинико-радиологические характеристики течения РС и лабораторные показатели на фоне проводимой терапии, на основании которых необходимо принятие решения о смене терапии на препарат с иным механизмом действия в рамках той же линии ПИТРС (Приложение А 3.7).
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Все члены рабочей группы заявили об отсутствии финансовой или нематериальной заинтересованности по теме разработанной клинической рекомендации. Член(ы)рабочей группы, сообщившие об обстоятельствах, которые могут повлечь за собой конфликт интересов, был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. Главные врачи (начальники) медицинских организаций
2. Заместители руководителя (начальника) медицинских организаций
3. Заведующие (начальники) структурных подразделений
4. Главные медицинские сестры
5. Врачи-специалисты:
— Врачи-неврологи, код специальности 31.08.42
— Врачи-рентгенологи, код специальности 31.08.09
— Врачи-клинические фармакологи, код специальности 31.08.37
— Врачи по лечебной физкультуре и спортивной медицине, код специальности 31.08.39
— Врачи по физической и реабилитационной медицине
— Врачи скорой медицинской помощи, код специальности 31.08.48
— Врачи-терапевты, код специальности 31.08.49
— Врачи-физиотерапевты, код специальности 31.08.50
— Врачи общей врачебной практики, код специальности 31.08.54
— Врачи-офтальмологи, код специальности 31.08.59
— Врачи-урологи, код специальности 31.08.68
— Врачи-организаторы здравоохранения и общественного здоровья, код специальности 31.08.71
6. Медицинские сестры:
— медицинская сестра врача общей практики
— медицинская сестра палатная (постовая)
— медицинская сестра (фельдшер) по приему вызовов скорой медицинской помощи и передаче их выездным бригадам скорой медицинской помощи
— медицинская сестра процедурная
— медицинская сестра по реабилитации
— медицинская сестра участковая
— медицинский регистратор
— медицинский статистик
— рентген-лаборант
— старшая медицинская сестра
— фельдшер
— фельдшер скорой медицинской помощи
7. Заведующие аптечными организациями
8. Провизоры
9. Фармацевты
10. Студенты медицинских вузов, ординаторы, аспиранты;
11. Преподаватели медицинских вузов, научные сотрудники.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме (таб. П1, таб. П2).
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица П3. Шкала оценки уровней убедительности рекомендаций
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
1) Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 N 323-ФЗ
2) Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств»
3) Федеральный закон «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций» от 25.12.2018 N 489-ФЗ (последняя редакция)
4) Порядок оказания медицинской помощи взрослому населению при заболеваниях нервной системы (приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. N 926н).
5) Стандарт специализированной медицинской помощи при первом клиническом проявлении рассеянного склероза (клинически изолированном синдроме) Приложение к Приказу Министерства здравоохранения РФ от 20 декабря 2012 г. № 1085н
6) Стандарт первичной медико-санитарной помощи при остром оптиконевромиелите (диагностика) Приложение к Приказу Министерства здравоохранения РФ от 24 декабря 2012 г. № 1533н
7) Стандарт первичной медико-санитарной помощи при рассеянном склерозе в стадии ремиссии Приложение к Приказу Министерства здравоохранения РФ от 24 декабря 2012 г. № 1542н
Федеральный закон от 29.07.2017 N 242-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам применения информационных технологий в сфере охраны здоровья»
Приложение А 3.1. Критерии диагностики РС МакДональда, модификация 2017 года
При типичной картине РС необходимо пользоваться критериями МакДональда в модификации 2017 года [5].
Диссеминация в пространстве:
— Клиническая – признаки наличия двух и более клинических очагов поражения,
— По данным МРТ — наличие 1 или более Т2-гиперинтенсивных очагов в двух или более областях ЦНС:
1) перивентрикулярно,
2) кортикально и/или юкстакортикально,
3) инфратенториально,
4) в спинном мозге.
Диссеминация во времени:
— Клиническая – очередное обострение с вовлечением нового участка ЦНС, клинические проявления обострения должны продолжаться не менее 24 часов, интервал между клиническими атаками должен быть не менее 1 месяца,
— По данным МРТ:
1) одновременное выявление очагов, накапливающих и ненакапливающих контраст на МРТ, выполненной в любое время от начала заболевания; очаги могут быть как симптомными, так и бессимптомными. При соблюдении других критериев, диагноз РС может быть подтвержден без повторной МРТ;
2) появление новых Т2-гиперинтенсивных или накапливающих контраст очагов на повторной МРТ; при этом интервал между первым и вторым МРТ- исследованиями может быть любым.
В реальной клинической практике рассматривается несколько диагностических вариантов:
— Наличие 2 и более клинических обострений И объективно обнаруживаемые повреждения 2 и более функциональных систем («симптомные» очаги) – дополнительных данных для подтверждения РС не требуется
— Наличие 2 и более клинических обострений И объективно обнаруживаемое повреждение 1 функциональной системы («симптомный» очаг), при этом по данным медицинской документации в анамнезе имеются доказательства наличия еще одного «симптомного» очага другой локализации – дополнительных данных для подтверждения РС не требуется
— Наличие 2 и более клинических обострений И объективно обнаруживаемое повреждение 1 функциональной системы («симптомный» очаг) – требуется доказательство диссеминации в пространстве (новое обострение с другой локализацией очага или диссеминация в пространстве по данным МРТ)
— Наличие 1 клинического обострения И объективно обнаруживаемые повреждения 2 и более функциональных систем («симптомные» очаги) – требуется доказательство диссеминации во времени (новое обострение или данные МРТ или наличие олигоклональных иммуноглобулинов в ЦСЖ)
— Наличие 1 клинического обострения И объективно обнаруживаемое повреждение 1 функциональной системы («симптомный» очаг) – требуется доказательство диссеминации в пространстве и во времени (новое обострение с другой локализацией очага или диссеминация в пространстве по данным МРТ)
Критерии диагностики РС (модификация 2017 года) для пациентов с первично-прогрессирующим течением:
— прогрессирование в течение 1 года, подтвержденное ретроспективно или проспективно, несвязанное с возникновением обострений,
И наличие двух признаков из перечисленных:
— наличие 1 или более Т2-гиперинтенсивных очагов в двух или более областях ЦНС: перивентрикулярно, кортикально и/или юкстакортикально, инфратенториально;
— два или более Т2-гиперинтенсивных очага в спинном мозге;
— наличие олигоклональных иммуноглобулинов в СМЖ.
Приложение А 3.2. Критерии диагностики РС МакДональда, модификация 2010 года
При атипичной клинической картине установление диагноза РС возможно в соответствии с критериями 2010 года [279]:
Диссеминация в пространстве:
— Клиническая – признаки наличия двух и более клинических очагов поражения,
— По данным МРТ выявление >1 Т2-гиперинтенсивного очага в двух из четырех областей, типично поражающихся при РС (контрастного усиления не требуется):
а) перивентрикулярной,
б) юкстакортикальной (вблизи коры головного мозга),
в) инфратенториальной,
г) в спинном мозге (в случае наличия симптомов поражения ствола мозга или спинного мозга, очаги, соответствующие клинической картине, не учитываются).
Диссеминация во времени:
— Клиническая – очередное обострение с вовлечением нового участка ЦНС, клинические проявления обострения должны продолжаться не менее 24 часов, интервал между клиническими атаками должен быть не менее 1 месяца,
— По данным МРТ один из следующих критериев:
а) одновременное выявление бессимптомных очагов, накапливающих и ненакапливающих контраст на МРТ, выполненной в любое время от начала заболевания; в этом случае, при соблюдении других критериев, диагноз РС может быть подтвержден без повторной МРТ;
б) появление новых Т2-гиперинтенсивных и/или накапливающих контраст очагов на повторной МРТ; при этом интервал между первым и вторым МРТ-исследованием может быть любым.
В реальной клинической практике рассматривается несколько диагностических вариантов:
— Наличие 2 и более клинических обострений И объективно обнаруживаемые повреждения 2 и более функциональных систем (2 и более клинических очага) или объективное клиническое подтверждение поражения 1 функциональной системы (1 клинического очага) с анамнестическими объективными доказательствами наличия повреждения еще 1 функциональной системы по данным медицинской документации – при отсутствии объективных данных других неврологических заболеваний дополнительных данных для подтверждения диагноза РС не требуется;
— Наличие 2 и более клинических обострений И объективно обнаруживаемое повреждение 1 функциональной системы (1 клинический очаг) – необходимо доказательство диссеминации в пространстве по данным МРТ либо появление нового клинического обострения с поражением иной функциональной системы;
— Наличие 1 клинического обострения И объективно обнаруживаемые повреждения 2 и более функциональных систем (2 и более клинических очага) – необходимо доказательство диссеминации во времени по данным МРТ либо появление нового клинического обострения;
— Наличие 1 клинического обострения И объективно обнаруживаемое повреждение 1 функциональной системы (1 клинический очаг) – необходимо доказательство диссеминации во времени и в пространстве по данным МРТ либо появление нового клинического обострения с поражением иной функциональной системы;
— Наличие неуклонного прогрессирования, предполагающее РС либо установление диагноза первично-прогрессирующего РС И объективно обнаруживаемые повреждение 1 функциональной системы (1 клинический очаг) – необходимо доказательство диссеминации во времени — неуклонное прогрессирование в течение 1 года и более (+1 балл EDSS за 6 месяцев) и диссеминации в пространстве (2 критерия из 3-х):
- при проведении МРТ головного мозга 1 Т2-очага в не менее, чем одном участке ЦНС, типичном для РС (перивентрикулярно, юкстакортикально, инфратенториально)
- при проведении МРТ спинного мозга 2 Т2-очагов в спинном мозге
- положительный анализ ликвора (олигоклональные группы IgG или повышенный индекс IgG, или оба параметра).
Приложение А 3.3. Дифференциальная диагностика РС
Диагноз РС ставится методом исключения при отсутствии других (лучших) объяснений симптоматики, при этом дифференциальная диагностика проводится с несколькими основными группами заболеваний:
1. Системные воспалительные заболевания с аутоиммунными механизмами
развития:
— Клиническая дифференциальная диагностика основывается на исключении системности поражения:
- Ретинопатия с явлениями васкулита (васкулит).
- Увеит (СКВ, болезнь Бехчета).
- Рецидивирующие язвы слизистых (болезнь Бехчета, СКВ).
- Сухой синдром – сухой кератоконъюктивит (Болезнь Шегрена).
- Вовлечение почек (СКВ, васкулиты).
- Артриты, полиартралгии, миалгии (СКВ).
- Антифосфолипидный синдром (АФС) – диффузное заболевание соединительной ткани, характеризующееся поражением сосудов микроциркуляторного русла вследствие формирования аутоиммунных антител к фосфолипидам мембран клеток, которые включают в себя волчаночный антикоагулянт, антитела к кардиолипину IgG и/или IgM и антитела к бета-2-гликопротеину 1 IgG и/или IgM.
- Сетчатое ливедо (АФС).
- Привычное невынашивание беременности (АФС).
— Параклинические методы исключения ревматических заболеваний.
- Общеклинические – воспалительные изменения в анализах крови (лейкоцитоз, повышение скорости оседания эритроцитов (СОЭ), появление С-реактивного белка), анемия.
- Серологические – поиск диагностически значимых титров антител к фосфолипидам мембран клеток, эндотелию, нейтрофилам, нативной ДНК, париетальным клеткам желудка, слюнной железе, а также циркулирующих иммунных комплексов.
- Нейровизуализационные – множественные мелкие очаги (до 5 мм), наличие ишемических очагов и кист, очаги в сером веществе.
— Основные заболевания, требующие дифференциальной диагностики с РС:
- Первичные системные васкулиты – группа заболеваний, в основе которых лежит различное генерализованное аутоиммунное поражение сосудов с воспалением и некрозом сосудистой стенки, что приводит к ишемическим изменениям органов и тканей, в том числе и мозга, а также повреждение циркулирующими иммунными комплексами, антителами к эндотелию, антителами к цитоплазме нейтрофилов.
- Ревматические заболевания с вторичным васкулитом: синдром Шегрена – хроническое аутоиммунное заболевание; которое характеризуется лимфоцитарной инфильтрацией экзокринных желез, приводящей к развитию ксеростомии и ксерофтальмии, сухости слизистых оболочек носа, гортани, трахеи, бронхов, женских половых органов, атрофическому гастриту; болезнь Бехчета – системный васкулит неустановленной этиологии, характеризующийся преимущественным язвенным поражением слизистой оболочки глаз, полости рта, кожи, половых органов и нервной системы; системная красная волчанка (СКВ) – диффузное заболевание соединительной ткани, характеризующееся системным иммунокомплексным поражением соединительной ткани и её производных, с поражением сосудов микроциркуляторного русла вследствие формирования аутоиммунных антител к ДНК.
- Саркоидоз – мультисистемное гранулематозное заболевание неизвестной этиологии, при этом субстратом являются гранулемы в различных органах и тканях, состоящие из эпителиоидных и гигантских клеток, а также макрофагов, приводящие к периваскулиту или лептоменингиту.
- Изолированные васкулиты ЦНС — Th1-опосредованное гранулематозное воспаление артерий и вен мелкого и среднего калибра, особенно мягких мозговых оболочек и субкортикальных областей, в качестве подтверждения используются данные ангиографии.
2. Инфекционные заболевания (с развитием аутоиммунного компонента):
— Клиническая дифференциальная диагностика основывается на поиске признаков инфекционного процесса:
- данные эпидемиологического анамнеза,
- общесоматический статус (лихорадка, системность поражения),
- неврологический статус (общемозговой синдром, вовлеченность периферической нервной системы, признаки страдания серого вещества, ранний когнитивный дефицит).
— Параклинические методы исключения нейроинфекций:
- Серологические – поиск диагностически значимых титров антител IgM к предполагаемому инфекционному агенту, (в ряде случаев – нарастание титров IgG при динамическом исследовании), при необходимости – уточнение с помощью полимеразной цепной реакции (ПЦР).
- Ликворологические – плеоцитоз, наличие в ликворе антител к предполагаемому инфекционному агенту и/или его обнаружение с помощью ПЦР.
- Нейровизуализационные – очаги различных размеров и локализации в белом веществе полушарий (в том числе субкортикально и перивентрикулярно), очаги в сером веществе, реже — мозжечке, таламусе, базальных ядрах. У большинства – сочетанное поражение нескольких областей головного мозга, очаги накапливают контраст.
— Основные заболевания, требующие дифференциальной диагностики с РС:
- Спирохетозные энцефалиты и энцефаломиелиты (нейроборрелиоз, нейросифилис).
- Иммунодефицитарные энцефалиты и энцефаломиелиты – ретровирусные (ВИЧ-энцефалопатия), паповавирусные (прогрессирующая мультифокальная лейкодистрофия).
- Флавивирусные энцефалиты и энцефаломиелиты (японский комариный, клещевой, Сент-Луис, Западного Нила).
- Герпесвирусные энцефалиты и энцефаломиелиты (простого герпеса, цитомегаловирусный, Эпштейн — Барр).
- Экзантемные энцефалиты и энцефаломиелиты – герпесвирусные (ветряночный); тогавирусные (краснушечный); парамиксовирусные (коревой).
- Нейробруцеллез.
- Тропический спинальный парапарез (HTLV-1-миелопатия).
- Болезнь Уиппла.
3. Сосудистые заболевания с поражением ЦНС:
— Основные заболевания, требующие дифференциальной диагностики с РС.
- Болезнь Бинсвангера (субкортикальная артериосклеротическая энцефалопатия).
- Мигрень.
- Семейная кавернозная гемангиома.
- Синдром Сусака (ретинокохлеоцеребральная аутоиммунная васкулопатия).
4. Наследственные заболевания с поражением ЦНС:
— Основные заболевания, требующие дифференциальной диагностики с РС.
- Адренолейкодистрофия.
- Метахроматическая лейкодистрофия.
- Спиноцеребеллярные атаксии.
- Семейная спастическая параплегия (Штрюмпеля).
- Наследственная атрофия зрительного нерва (Лебера).
- Митохондриальная энцефалопатия (CADASIL, MELAS и пр.).
5. Дисметаболические и токсические заболевания:
— Основные заболевания, требующие дифференциальной диагностики с РС.
- Острая интермиттирующая порфирия.
- Центральный понтинный миелинолиз.
- Фуникулярный миелоз (дефицит витамина В12 – цианкобаламина – и/или В9 – фолиевой кислоты).
- Целиакия (глютеновая недостаточность).
- Токсическая энцефалопатия (в том числе пострадиационная)
6. Метастатические опухоли спинного и головного мозга.
7. Другие формы воспалительных демиелинизирующих заболеваний:
— Острый рассеянный энцефаломиелит (ОРЭМ) [17]:
- впервые развившийся эпизод мультифокального поражения ЦНС предположительно воспалительного демиелинизирующего характера,
- острая энцефалопатия (изменение сознания или поведения, несвязанные с лихорадкой, соматическим заболеванием, постиктальным периодом эпилептического припадка),
- при МРТ-исследовании в течение трех месяцев от начала эпизода выявляются следующие типичные изменения: 1) остро возникшие, 2) множественные (реже возможен один большой очаг), 3) супра- или/и инфратенториальные; 4) обычно имеется хотя бы один большой очаг (1-2 см в диаметре); 5) в очагах имеется накопление контраста (в острый период все очаги накапливают контраст, при более позднем проведении МРТ часть очагов могут уже не накапливать контраст, но это не является подтверждением диссеминации во времени).
- в течение трех месяцев или более после начала эпизода отсутствуют новые клинические или МРТ очаги
- в течение трех месяцев от начала заболевания допускается появление новых симптомов, моно- или мультифокальных, например, оптического неврита, миелита, при условии, что они не отделены периодом полной ремиссии от начальных симптомов (в случае полной ремиссии устанавливается диагноз РС)
- имеется последующее уменьшение или полное восстановление, хотя возможно сохранение резидуального неврологического дефицита.
— ЗСОНМ с наличием антител к аквапорину-4 [280]:
- наличие хотя бы одного основного клинического синдрома: 1) оптический неврит, 2) острый миелит, 3) синдром area postrema (синдром самого заднего поля): эпизод необъяснимой икоты или тошноты и рвоты, 4) остро возникший стволовой синдром, 5) клинически значимая нарколепсия или острый гипоталамический синдром с наличием на МРТ головного мозга очагов в гипоталамической области, типичных для ЗСОНМ, 6) клинически значимый церебральный синдром с наличием очагов в головном мозге, типичных для ЗСОНМ.
- положительный результат исследования сыворотки крови на иммуноглобулины класса G к аквапорину-4 наиболее чувствительным методом (рекомендуется исследование методами с клеточной презентацией антигена, cell-based assay),
- исключение альтернативных заболеваний.
— ЗСОНМ – заболевания спектра оптиконейромиелита без антител к аквапорину-4 или при невозможности определения антител [280]:
- наличие хотя бы двух основных клинических синдромов, появившихся во время одного или более клинических обострений и соответствующих следующим условиям: а) хотя бы один основной клинический синдром – это оптический неврит, острый миелит с продольно-распространенным поперечным миелитом (LETM, longiudinally extensive transverse myelitis) или синдром area postrema, б) диссеминация в пространстве (два или более различных основных клинических синдрома),
- наличие дополнительных МРТ-признаков при остром оптическом неврите: а) отсутствие изменений или неспецифические очаги в белом веществе ИЛИ б) очаг в зрительном нерве гиперинтенсивный на Т2 взвешенном изображении (ВИ) или накапливающий контрастное вещество на Т1-ВИ, распространяется на более чем половину длины зрительного нерва или вовлекает хиазму.
- наличие дополнительных МРТ-признаков при остром миелите: а) интрамедуллярный очаг, длина которого больше или равна длине трех позвоночных сегментов (longiudinally extensive transverse myelitis, продольно-распространенный поперечный миелит) ИЛИ б) наличие участка атрофии спинного мозга, длина которого больше или равна длине трех сегментов спинного мозга, у пациентов с наличием в анамнезе острого миелита соответствующей локализации.
- наличие дополнительных МРТ-признаков при синдроме area postrema: наличие очагов в дорзальной части продолговатого мозга, очагов в области area postrema.
- наличие дополнительных МРТ-признаков при остром стволовом синдроме: наличие периэпендимальных очагов в стволе.
Приложение А 3.4. Дополнения MAGNIMS по применению МРТ при установлении диагноза РС по критериям МакДональда 2010 года
Данные дополнения сформулированы рабочей группой экспертов в 2016 году [54].
Диссеминация в пространстве устанавливается при наличии двух признаков из пяти:
— три или более перивентрикулярных очага
— один или более инфратенториальный очаг
— один или более спинальный очаг
— один очаг или более с локализацией в зрительном нерве
— один очаг или более с кортикальной или юкстакортикальной локализацией (это означает расширение термина «юкстакортикальный» – очаг в белом веществе вблизи коры, очаг с вовлечением коры)
Комментарий: При определении диссеминации в пространстве считаются все очаги, в том числе вызывающие клинические симптомы. Например, если у пациента имеются клинические симптомы поражения ствола, спинного мозга или зрительного нерва, очаги в этих областях нервной системы учитываются (в отличие от предыдущей редакции критериев). Критерии диссеминации во времени остаются без изменений (см. Критерии 2010 года).
Приложение А 3.5. Форма структурированного протокола заключения МРТ
С целью оценки динамики очаговых изменений при оформлении заключения МРТ головного мозга у пациентов при подозрении на РС и у всех пациентов с РС. В полях «Результат» и «Предыдущий результат» рекомендуется указывать точное количество очагов демиелинизации. Форма носит рекомендательный характер, является структурной частью заключения и не заменяет описательной части или репортирования других находок на МРТ.
* Если общее количество очагов превышает более 20 и не поддается подсчету, указывать – более 20 (>20).
** Если пациент выполняет МРТ исследование впервые, то поля Предыдущего результата остаются пустыми.
Приложение А 3.6. Принципы формулировки клинического диагноза
Формулировку клинического диагноза рекомендуется выполнять с учетом МКБ-10 и действующих классификаций заболевания по типу течения, стадии заболевания и выраженности функциональных нарушений [281]:
1) Название болезни – Рассеянный склероз, Код МКБ-10 G 35.0.
2) Течение – ремиттирующее, вторично-прогрессирующее, первично-прогрессирующее.
3) Стадия:
а) при ремиттирующем – ремиссия, обострение, при осмотре пациента в течение одного месяца от начала обострения можно указать дату начала обострения, основные неврологические синдромы в порядке убывания их функциональной значимости с указанием их выраженности (выраженный/глубокий, умеренный, легкий).
б) при вторично-прогрессирующем – прогрессирование, стабилизация, обострение, при осмотре пациента в течение одного месяца от начала обострения можно указать дату начала обострения, основные неврологические синдромы в порядке убывания их функциональной значимости с указанием их выраженности (выраженный/глубокий, умеренный, легкий).
в) при первично-прогрессирующем – прогрессирование, стабилизация, обострение, при осмотре пациента в течение одного месяца от начала обострения можно указать дату начала обострения, основные неврологические синдромы в порядке убывания их функциональной значимости с указанием их выраженности (выраженный/глубокий, умеренный, легкий).
4) оценка по шкале EDSS.
Примеры формулировки клинического диагноза:
— Рассеянный склероз, ремиттирующее течение, стадия обострения (от 01.08.2016), умеренный парез правой ноги, умеренная мозжечковая атаксия. EDSS 4,5.
— Рассеянный склероз, ремиттирующее течение, стадия ремиссии, легкая мозжечковая атаксия. EDSS 2,0.
— Рассеянный склероз, вторично-прогрессирующее течение, стадия стабилизации, умеренный нижний парапарез, умеренная мозжечковая атаксия, легкие проводниковые чувствительные нарушения. EDSS 6,0.
При формулировке диагноза важно указывать функциональные нарушения (в соответствии с данными действующего законодательства (на момент написания рекомендаций — Приказа Министерства труда и социальной защиты РФ от 17 декабря 2015 №1024н «О классификационных критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной защиты»):
— Незначительные нарушения моторики, незначительные нарушения функций тазовых органов; по шкале EDSS в пределах 1 — 2,5 баллов — степень выраженности – 10-30%;
— Умеренные парезы верхних и/или нижних конечностей, умеренные нарушения функций тазовых органов; по шкале EDSS в пределах 3 — 4,5 баллов — степень выраженности – 40 — 60%;
— Выраженные парезы верхних и/или нижних конечностей, выраженные нарушения функций тазовых органов; по шкале EDSS в пределах 5 — 7 баллов — степень выраженности – 70 — 80%;
— Значительно выраженные парезы или параличи верхних и/или нижних конечностей, значительно выраженные нарушения функций тазовых органов (полное недержание мочи и/или кала с полной нечистоплотностью); по шкале EDSS в пределах 7,5 — 9,5 баллов — степень выраженности – 90 — 100%.
Приложение А 3.7. Принципы замены ПИТРС
Ниже представлены рекомендации для определения действий врача в зависимости от ответа на терапию [105 — 114].
Все критерии применимы на продолжительность периода измерения 12 месяцев с момента, когда начал действовать ПИТРС. С последующими годовыми интервалами.
Попадание одного критерия в первые 12 месяцев, а второго критерия во вторые 12 месяцев измерения должны расцениваться как не состоявшиеся.
Данные критерии применимы только к пациентам с РРС (не проводились исследования шкал для пациентов с ППРС и ВПРС).
Характеристики активности по данным МРТ – новый очаг в режиме Т2-ВИ или увеличившийся очаг в режиме Т2-ВИ или очаг, накапливающий контрастный препарат в режиме Т1-ВИ. Новый очаг, накапливающий контрастное вещество, считается как один очаг.
* Вариабельность ситуаций, которые могут попадать под данную категорию очень большая, поэтому лечащий врач принимает решение исходя из конкретной клинической ситуации.
Приложение А 3.8. Общая шкала токсичности
Изменение показателей белой и красной крови является наиболее частым побочным эффектом терапии ПИТРС и оценивается по Общей шкале токсичности
Действия при выявлении токсичности:
• Степень 1 – терапию продолжать
• Степень 2 – терапию продолжать (мониторировать показатели с периодичностью от 2 недель до 1 месяца по решению врача-невролога)
• Степень 3 – отмена терапии до восстановления показателей и направление на комиссию по назначению ПИТРС
• Степень 4 – отмена терапии до восстановления показателей и направление на комиссию по назначению ПИТРС.
Детально рекомендации по наблюдению за пациентами на терапии препаратами первой и второй линии, включая частоту и характер мониторируемых показателей (показатели белой и красной крови, биохимические показатели и др.), а также действия при выявлении токсичности при терапии отдельными ПИТРС, представлены в Приложении Б, разделе 3.3., а также в разделах 3.1.17.3 и 3.1.17.4, посвященных консервативному лечению.
Приложение А 3.9. Форма заявления об отмене ПИТРС
ФОРМА ЗАЯВЛЕНИЯ ОБ ОТМЕНЕ ПИТРС
(оригинал в амбулаторной карте, копия в материалах комиссии)
В региональный центр (кабинет) РС
от гр._____________________________________,
проживающего(ей) по адресу:___________________
_____________________________________
ЗАЯВЛЕНИЕ
Прошу отменить препарат________________________, принимаемый мной по
Федеральной (или региональной) льготе с__________________, по поводу заболевания
рассеянный склероз в связи с (причина)__________________________________________
Я информирован(а) врачами о последствиях прекращения приема препарата. Я
задал все интересующие вопросы и получил на них ответы.
Данное решение принято мной добровольно и осознанно, претензий к органам
здравоохранения и врачам не имею.
Дата Подпись:
______________________
Приложение А 3.10. План управления рисками ПМЛ при терапии натализумабом**
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) — редкая, прогрессирующая, потенциально фатальная инфекция головного мозга, вызывается JC вирусом. Поражаются пациенты со сниженным иммунитетом: пациенты со СПИДом до назначения высокоактивной антиретровирусной терапии (ВААРТ) 1 — 8%, пациенты, перенесшие трансплантацию органов (редко, << 1%), пациенты со злокачественными опухолями кроветворной системы; пациенты, получавшие противоопухолевую или иммуносупрессивную терапию; редкие случаи ПМЛ ассоциированы с применением натализумаба**.
Диагностика ПМЛ: Клиническая картина: неврологический дефицит нарастает в течение нескольких недель. Клиника: изменения личности, поведения, когнитивных функций, афазия, миоклонические судороги, гемипарезы и гемиплегии, корковые нарушения зрения, в конечной стадии — деменция, кома и гибель пациента – необходимо дифференцировать с обострениями и прогрессированием при РС. Течение вариабельно, летальный исход без лечения наступает в течение 6 — 12 месяцев.
МРТ-признаки: крупные гиперинтенсивные очаги на T2-взвешенных или FLAIR изображениях, чаще монофокальные, располагаются в субкортикальном БВ, чаще поражаются U-волокна, типичные очаги не формируют масс-эффекта или отека – дифференцировать с очагами при РС. В 40 — 50% случаев в очагах присутствуют признаки контрастного усиления.
Анализ СМЖ — исследование ДНК JC вируса с помощью ПЦР в реальном времени (примерно у половины пациентов число копий ДНК JCV было небольшим < 500 копий/мл).
При наличии клинической картины ПМЛ рекомендуется немедленная отмена препарата.
Риск ПМЛ при использовании натализумаба**.
Факторы риска развития ПМЛ:
1) присутствие вируса JC (серопозитивность);
2) наличие иммуносупрессии (ИС) в анамнезе;
3) длительность терапии.
К пациентам высокого риска ПМЛ относятся:
— Пациенты с тремя факторами риска ПМЛ:
o Иммуносупрессия (ИС) в анамнезе;
o Длительность терапии натализумабом**> 2 лет;
o Серопозитивный статус;
— Пациенты, получающие натализумаб** более 2 лет и имеющие титр выше 1,5.
Стратификация риска развития ПМЛ и рекомендации по ведению пациента представлены на рисунках Г12.1 и Г12.2
Рисунок А 3.10.1 Обновленная стратификация риска развития ПМЛ
Рисунок А 3.10.2 Рекомендации по ведению пациентов на натализумабе** с учетом рисков ПМЛ
Клиническое обследование пациента с подозрением на ПМЛ включает несколько этапов (рисунок А 3.10.2).
Рисунок А 3.10.3. Клиническое обследование при развитии новых или усугублении имеющихся симптомов, либо при появлении изменений на МРТ, предположительно указывающих на ПМЛ у пациентов, получающих натализумаб**
Приложение А 3.11. Критерии Международной группы по изучению детского рассеянного склероза, 2013 г.
У пациентов младше 18 лет рекомендуется использовать указанные критерии в случаях, определенных соответствующими рекомендациями [16].
Детский рассеянный склероз (любой из следующих):
• Два или более клинических эпизода, разделенные более чем 30 днями, признаки повреждения более чем в одной функциональной сфере центральной нервной системы;
• Одно из клинических событий ассоциировано с изменениями по МРТ, соответствующих критериям ДВП и последующее МРТ показывает, по крайней мере, одно новое поражение в соответствие с критерием ДВВ;
• Через 3 месяца после первых проявлений ОРЭМ-подобной атаки возникает новое клиническое событие, которое связано с новым очагом по МРТ в соответствии с критериями ДВП;
• Клинический изолированный синдром при котором данные МРТ согласуются с критериями ДВП и ДВВ.
Детский клинически изолированный синдром (КИС) (все обязательно):
• Клиническое событие поражения ЦНС с предполагаемой причиной — воспалительная демиелинизация;
• Отсутствие в анамнезе предшествующего демиелинизирующего заболевания ЦНС;
• Нет данных за энцефалопатию (за исключением случаев, когда можно объяснить лихорадкой);
• Нет соответствия критериям ДВП и ДВВ на базовой МРТ.
Детский острый рассеянный энцефаломиелит (ОРЭМ) (все обязательные):
• Первое полифокальное клиническое событие поражения ЦНС с предполагаемой причиной — воспалительная демиелинизация.
• Энцефалопатия, которая не может быть объяснена повышением температуры тела.
• Нет новых клинических или МРТ событий 3 или более месяцев после первых симптомов;
МРТ головного мозга и патологическими изменениями во время острой фазы (3 месяца) с типичными диффузными плохо разграниченными крупными очагами располагающиеся преимущественно в белом веществе головного мозга.
Приложение А 3.12. Критерии оценки тяжести обострений
Представленная классификация адаптирована из Freedman и соавт. [66] и рекомендована к оценке тяжести обострений для принятия решения о тактике ведения пациентов.
Приложение Б. Алгоритмы действий врача
1. Алгоритм диагностики рассеянного склероза
1.1. Алгоритм установления диагноза РС
1.2. Алгоритм постановки диагноз РС, первично-прогрессирующий тип течения
2. Алгоритм ведения пациента с обострением РС
3. Алгоритм: Принципы замены ПИТРС [105–114]
4. Планы наблюдения за пациентами на терапии ПИТРС
4.1. Рекомендации по наблюдению за пациентами на терапии интерферонами бета-1a** и интерферонами бета-1b**
4.2. Рекомендации по наблюдению за пациентами на терапии глатирамера ацетатом**
4.3. Рекомендации по наблюдению за пациентами на терапии терифлуномидом**
4.4. Рекомендации по наблюдению за пациентами на терапии диметилфумаратом**
4.5. Рекомендации по наблюдению за пациентами на терапии #митоксантроном**
4.6. Рекомендации по наблюдению за пациентами на терапии натализумабом**
4.7. Рекомендации по наблюдению за пациентами на терапии финголимодом**
4.8. Рекомендации по наблюдению за пациентами на терапии алемтузумабом**
4.9. Рекомендации по наблюдению за пациентами на терапии окрелизумабом**
4.10. Рекомендации по наблюдению за пациентами на терапии кладрибином**.
Приложение В. Информация для пациента
1. Информация для пациента на этапе диагностики:
1.1. Информация о природе неврологического дефицита при демиелинизирующих заболеваниях, а также о возможных проявлениях РС;
1.2. Информация об этиологии РС, факторах риска развития РС;
1.3. Информация о риске передачи РС по наследству;
1.4. Информация о неблагоприятных прогностических факторах, повышающих риск конверсии в РС после первого обострения и факторах более быстрой инвалидизации
1.5. Информацию о профилактике коморбидности и здоровом образе жизни, мотивация отказа от вредных привычек;
1.6. Информация о работе локального центра/кабинета РС;
1.7. Информация о возможности получить психологическую поддержку, группах поддержки для пациентов, сообществах пациентов, информационных школах для пациентов по вопросам лечения;
2. Информация для пациента на этапе лечения и диспансерного наблюдения:
2.1. Информация о возможностях терапии РС с помощью ПИТРС, зарегистрированных на территории Российской Федерации и подходящих для лечения конкретного пациента в соответствии с его типом течения РС (представляется индивидуально для каждого пациента);
2.2. Информация о профиле эффективности и безопасности ПИТРС, выбранного для терапии, а также об альтернативных ПИТРС, профиль их эффективности и безопасности;
2.3. Рекомендации по наблюдению в рамках плана управления рисками: кратность визитов, сдачи лабораторных анализов, выполнения МРТ, вакцинации и других профилактических и лечебно-диагностических мероприятий;
2.4. Информация о возможности получения медицинской и социальной реабилитации;
2.5. Информация о возможности получения инвалидности;
2.6. В случае необходимости смены терапии – предоставить информацию о критериях смены терапии, возможности смены терапии, профиле безопасности и эффективности предложенных для смены ПИТРС;
3. На этапе медицинской реабилитации:
3.1. Предоставить информацию о целях реабилитации;
3.2. Предоставить информацию о природе ограничений повседневной жизнедеятельности пациента;
3.3. Индивидуальная программа реабилитации для выполнения в домашних условиях;
3.4. Информация о необходимости использования технических средств реабилитации и возможности их получения.
Приложение Г1 — ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала повреждения функциональных систем (ФС) по J.F.Kurtzke
Название на русском: Шкала повреждения функциональных систем (ФС) по J.F.Kurtzke
Оригинальное название: Kurtzke Functional Systems Scores
Источник (официальный сайт разработчиков, публикация с валидацией): Kurtzke JF. Rating neurologic impairment in multiple sclerosis: An expanded disability status scale (EDSS). Neurology. 1983;33(11):1444-1452. doi:10.1212/wnl.33.11.1444
Тип: шкала оценки
Назначение: оценка типа и тяжести неврологического дефицита ц пациентов с рассеянным склерозом.
Содержание (шаблон):
1. Поражение зрительного нерва (необходимы данные осмотра офтальмолога):
0 баллов – нет изменений.
1 балл:
бледность диска ЗН;
«маленькая» скотома (о ней пациент не знает = отрицательная);
острота зрения (с коррекцией) худшего глаза меньше 1,0, но лучше, чем
0,67.
2 балла:
худший глаз с «большой» скотомой (пациент жалуется на наличие скотомы);
острота зрения (с коррекцией) худшего глаза 0,67 — 0,34.
3 балла (для расчета EDSS конвертируется в 2 балла):
худший глаз с «большой» скотомой;
умеренное сужение полей зрения (= пациент замечает сужение полей
зрения, но гемианопсия неполная);
острота зрения худшего глаза (с коррекцией) 0,33 — 0,2.
4 балла (для расчета EDSS конвертируется в 3 балла):
худший глаз с выраженным сужением полей зрения (= полная гомонимная гемианопсия);
острота зрения худшего глаза (с коррекцией) 0,2 — 0,1;
изменения, соответствующие 3 баллам, но острота зрения лучшего глаза 0,3 и меньше.
5 баллов (для расчета EDSS конвертируется в 3 балла):
острота зрения худшего глаза (с коррекцией) меньше 0,1;
изменения, соответствующие 4 баллам, но острота зрения лучшего глаза 0,3 и меньше.
6 баллов (для расчета EDSS конвертируется в 4 балла):
изменения, соответствующие 5 баллам, но острота зрения лучшего глаза 0,3 и меньше.
2. Нарушение функции других черепных нервов (функция глазодвигателей, жевательная и мимическая мускулатура лица, бульбарная группа нервов):
0 баллов – нет изменений.
1 балл — симптомы без нарушений функций:
легкие нарушения, выявляемые при неврологическом осмотре, у пациента жалоб нет;
нистагм в крайних отведениях;
симптомы нарушения функции со стороны тройничного, лицевого нервов.
2 балла – легкие нарушения – у пациента есть жалобы на нарушение функции, есть изменения легкой степени выраженности (в некоторых случаях умеренной степени) при неврологическом осмотре:
умеренно выраженный нистагм (=постоянный нистагм при отведении глаз по горизонтали или вертикали на 30 градусов, отсутствие нистагма при взгляде прямо);
легкое нарушение движений глаз, пациент жалуется на двоение;
парез какой-либо одной наружной мышцы глаза, у пациента жалоб нет;
снижение чувствительности на лице, пациент жалуется на онемение;
пациент жалуется на асимметрию лица, она заметна при осмотре;
пациент жалуется на нечеткость речи, дизартрия заметна при беседе;
трудности при проглатывании жидкости.
3 балла – умеренные нарушения:
выраженный нистагм:
— постоянный нистагм при взгляде прямо;
— крупноразмашистый нистагм в любом направлении, снижающий остроту зрения;
— полная межъядерная офтальмоплегия с постоянным нистагмом при отведении глаза;
— осциллопсия (ощущение покачивания перед глазами окружающего пространства).
умеренное нарушение движений глаз:
— парез какой-либо одной наружной мышцы глаза, у пациента есть жалобы на двоение;
— паралич взора в одном направлении;
— снижена поверхностная чувствительность на лице с одной стороны;
— тригеминальная невралгия (хотя бы один приступ за последние 24 часа).
парез половины лица (слабость круговой мышцы глаза, на ночь требуется повязка на глаз; слабость круговой мышцы рта со слюнотечением);
снижение слуха (не слышит несколько слов при проверке различения шепотной речи);
дизартрия заметна при беседе, речь пациента трудно понять;
трудности при глотании жидкой и твердой пищи.
4 балла – выраженные нарушения:
паралич взора в одном или более направлениях;
полная потеря чувствительности на лице с одной или обеих сторон;
паралич мышц лица с одной или обеих сторон (есть лагофтальм, вытекание жидкой пищи изо рта);
не слышит шепотную речь;
речь пациента неразборчива из-за дизартрии;
постоянные трудности при глотании, может глотать только кашицеобразную пищу.
5 баллов — невозможность глотать или говорить.
3. Симптомы поражения пирамидного пути:
0 баллов – нет изменений.
1 балл — патологические пирамидные рефлексы без снижения силы.
2 балла – легкие нарушения:
пациент жалуется на утомляемость;
нарушение выполнения функциональных проб (проба Барре для рук и для ног, 10 прыжков на одной ноге);
снижение силы до 4 баллов в одной-двух мышечных группах.
3 балла:
легкий или умеренный пара- или гемипарез:
cнижение силы до 4 баллов в трех мышечных группах и более
cнижение силы в одной-двух группах до 3 баллов
глубокий монопарез (снижение силы в одной группе мышц до 2 баллов)
4 балла:
глубокий пара- или гемипарез (снижение силы до 2 баллов в двух конечностях);
умеренный тетрапарез (снижение силы до 3 баллов в трех или четырех конечностях);
моноплегия (снижение силы до 0 — 1 баллов в одной конечности).
5 баллов:
параплегия;
гемиплегия;
глубокий тетрапарез (сила 2 балла и меньше в трех или четырех конечностях).
6 баллов:
тетраплегия (сила 0 — 1 балл в руках и ногах).
4. Симптомы нарушения координаторной сферы (дополнительно отмечается, если у пациента есть снижение силы до 3 баллов, влияющее на выполнение координаторных проб):
0 баллов – нет изменений.
1 балл — неврологические симптомы без нарушения функции.
2 балла – легкая атаксия:
пошатывание в позе Ромберга и в положении сидя при закрытых глазах;
тремор и неловкость заметны, немного затрудняют движения;
ходьба по одной линии затруднена.
3 балла — умеренная атаксия:
неустойчив в позе Ромберга при закрытых глазах;
покачивание сидя при открытых глазах;
тремор и неловкость значительно затрудняют движения;
атаксия при обычной ходьбе;
требуется поддержка при ходьбе.
4 балла – выраженная атаксия:
не может сидеть без поддержки;
выполнение координаторных проб затруднено в трех-четырех конечностях;
неустойчив в позе Ромберга при открытых глазах.
5 баллов — координированные движения невозможны из-за атаксии.
5. Симптомы нарушения чувствительности:
0 баллов – нет изменений.
1 балл – легкие нарушения — в одной или двух конечностях следующие изменения;
вибрационная чувствительность – ощущает вибрацию больше 10 секунд, но хуже, чем врач (снижение до 5/8 – 7/8 по градуированному камертону);
снижение температурной чувствительности;
снижение двумерно-пространственного чувства;
легкое снижение мышечно-суставного чувства (1 — 2 неверных ответа при проверке в дистальных суставах).
2 балла –
в одной или двух конечностях отмечаются следующие изменения:
легкое нарушение поверхностной чувствительности (пациент ощущает снижение чувствительности, но различает «острое-тупое»);
умеренное нарушение вибрационной (ощущает вибрацию 2 — 10 секунд; 1/8 — 4/8 по градуированному камертону);
в трех-четырех конечностях отмечаются следующие изменения:
легкое снижение вибрационной или двумерно-пространственного чувства, или температурной чувствительности.
3 балла –
в одной или двух конечностях отмечаются следующие изменения:
— плохо различает «острое-тупое»;
— много неверных ответов при проверке мышечно-суставного чувства, есть нарушения в проксимальных суставах;
— потеря вибрационной чувствительности.
в трех-четырех конечностях отмечаются следующие изменения:
— легкое нарушение поверхностной чувствительности (пациент ощущает снижение чувствительности, но различает «острое-тупое»);
— много неверных ответов при проверке мышечно-суставного чувства, есть нарушения в проксимальных суставах;
— умеренное нарушение вибрационной (ощущает вибрацию 2 — 10 секунд; 1/8 — 4/8 по градуированному камертону).
4 балла –
в одной-двух конечностях отмечаются следующие изменения:
— не различает «острое-тупое»;
— потеря мышечно-суставного чувства.
в трех-четырех конечностях отмечаются следующие изменения:
— плохо различает «острое-тупое»;
— потеря мышечно-суставного чувства.
5 баллов –
в одной-двух конечностях утрата всех видов чувствительности;
в трех-четырех конечностях:
— плохо различает «острое-тупое»;
— потеря мышечно-суставного чувства.
6 баллов — утрата всех видов чувствительности во всех конечностях и на туловище.
6. Симптомы нарушения функций тазовых органов:
0 баллов – нет изменений.
1 балл — незначительные нарушения мочеиспускания: императивные позывы, задержки мочеиспускания, запоры, не влияющие на повседневный распорядок жизни.
2 балла –
умеренно выраженные задержки;
частые инфекции мочевых путей;
частые императивные позывы;
эпизоды недержания не более 1 раза в неделю, необходимы прокладки.
3 балла –
частые эпизоды недержания мочи (от нескольких раз в неделю до одного и более в день);
пользуется памперсами или мочеприемником;
иногда требуется самокатетеризация;
для опорожнения кишечника требуется клизма.
4 балла — необходимость в постоянной катетеризации и постоянных дополнительных мероприятий для опорожнения кишечника (для расчета EDSS конвертируется в 3)
5 баллов – потеря контроля за функцией мочевого пузыря или кишечника, требуется постоянный катетер (для расчета EDSS конвертируется в 4).
6 баллов — полное недержание мочи и кала (для расчета EDSS конвертируется в 5).
0 баллов – нет изменений.
1 балл –
изменения настроения (только депрессия или только эйфория, не влияет на EDSS):
легкая утомляемость (не влияет на работоспособность) (учитывается при подсчете EDSS);
минимальное снижение когнитивных функций (незаметны для пациента и окружающих, выявляются только при тестах) (учитывается при подсчете EDSS).
2 – легкое снижение когнитивных функций:
пациент или окружающие замечают наличие расстройств;
снижение скорости принятия решений;
легкие ошибки при решении сложных задач;
справляется с повседневными делами, но возникают трудности в стрессовых ситуациях;
снижение производительности;
небрежность в делах, объясняемая усталостью или забывчивостью;
умеренная утомляемость (снижает повседневную активность не более чем на 50%);
выраженная утомляемость (снижает повседневную активность более чем на 50%).
3 — умеренное снижение когнитивных функций:
ориентирован в месте, времени, собственной личности, имеются явные нарушения при скрининговом тестировании.
4 – выраженное снижение когнитивных функций:
потеря ориентации по одному или двум параметрам (место, время, собственная личность);
снижение повседневной активности.
5 – деменция.
Приложение Г2. Расширенная шкала статуса инвалидизации пациента (EDSS)
Название на русском: Расширенная шкала статуса инвалидизации пациента (EDSS)
Оригинальное название: An expanded disability status scale (EDSS)
Источник (официальный сайт разработчиков, публикация с валидацией): Kurtzke JF. Rating neurologic impairment in multiple sclerosis: An expanded disability status scale (EDSS). Neurology. 1983;33(11):1444-1452. doi:10.1212/wnl.33.11.1444
Тип: шкала оценки
Назначение: оценка типа и тяжести неврологического дефицита ц пациентов с рассеянным склерозом.
Приложение Г3. Шкала баланса Берг
Название на русском: Шкала баланса Берг
Оригинальное название: Berg Balance Scale (BBS)
Источник (официальный сайт разработчиков, публикация с валидацией): Berg K, Wood-Dauphine S, Williams J, Gayton D. Measuring balance in the elderly: preliminary development of an instrument. Physiother Can 1989;41(6):304–11.
Тип: шкала оценки
Назначение: оценка способностей человека к статическому и динамическому равновесию
Если у больного выраженный когнитивный дефицит или речевые нарушения, препятствующие пониманию команд, следует использовать альтернативные источники коммуникации.
Если пациент находится без сознания, то он получает 0 баллов. Если у пациента ампутирована одна нога, то тест выполняется с протезом отсутствующей части. В случае если протез отсутствует — тест не проводится.
1. Задание: встать со стула
Инструкция: попросите пациента встать со стула. Если при исполнении пациент держится за подлокотники, попросите повторить задание, не используя руки. Следите за тем, чтобы ноги не упирались в край стула. Используйте стул с подлокотниками.
Оценка:
4 – встает самостоятельно без помощи рук и самостоятельно удерживает равновесие;
3 – встает самостоятельно с первой попытки, использует руки, самостоятельно удерживает равновесие;
2 – встает самостоятельно при помощи рук, требуется несколько попыток, чтобы встать;
1 – требуется минимальная помощь для того, чтобы встать со стула или принять устойчивое положение стоя;
0 – для того, чтобы встать требуется помощь (умеренная или значительная).
2. Задание: стоять без поддержки
Инструкция: попросите пациента самостоятельно стоять в течение 2х минут.
Пациент не должен касаться ногами стула (отодвиньте стул от пациента). Следите за пациентом, будьте готовы, если он будет терять равновесие.
Оценка:
4 – уверенно стоит в течение 2 мин;
3 – стоит в течение 2 мин с вашим контролем (без мануального контакта с пациентом, вы стоите ближе, чем этого требует выполнение задания на 4 балла);
2 – стоит без поддержки 30 сек;
1 – требуется несколько попыток для того, чтобы стоять в течение 30 сек;
0 – не может стоять 30 сек без поддержки.
Если пациент стоит уверенно 2 минуты, отметьте высший балл для пункта 3 (выполнять проверку не нужно). Приступайте к пункту 4.
3. Задание: сидеть на стуле, ноги на полу, руки скрещены на груди
Инструкция: сидеть без опоры на спину, руки скрещены на груди, ноги стоят на полу, в коленях 90°, стопы на комфортном расстоянии для пациента в течение 2-х мин. Используйте стул без подлокотников и секундомер.
Оценка:
4 – уверенно сидит в течение 2 мин;
3 – сидит в течение 2 мин с контролем со стороны (без мануального контакта с пациентом, вы стоите ближе, чем этого требует выполнение задания на 4 балла, также для 2 и 1 баллов);
2 – сидит 30 сек под контролем со стороны;
1 – сидит 10 сек под контролем со стороны;
0 – не может сидеть 10 сек без поддержки.
4. Задание: перейти из положения стоя в положение сидя
Инструкция: попросить пациента сесть на стул, не используя руки. Тщательно наблюдайте за контактом ног и стула. Отодвиньте стул на 5 — 8 см от стены, чтобы контакт был очевиден (например, стул сдвинется). Используйте стул с подлокотниками.
Оценка:
4 – уверенно садиться, минимально использует руки;
3 – контролирует посадку при помощи рук;
2– для контроля посадки опирается задней поверхностью ног на стул;
1 – садится самостоятельно, но посадка не контролируется (плюхается на стул) ;
0 – для посадки требуется помощь.
5. Задание: пересесть со стула с подлокотниками на стул без подлокотников и обратно
Инструкция: перемещаться от стула с подлокотниками к стулу без подлокотников и обратно. Поставьте стулья под углом 90°, расстояние между стульями до 10 см. Инструкция дается перед выполнением задания, можно продемонстрировать. Помощь рук означает, что пациент переносит вес на руки. Используйте стул с подлокотниками и стул без подлокотников.
Оценка:
4 – уверенное перемещение с минимальным использованием рук;
3 – уверенное перемещение с некоторым использованием рук (использует руки при вставании и при посадке);
2 – требуются устные подсказки и/или контроль со стороны;
1 – требуется помощь одного человека;
0 – требуется помощь/контроль двумя людьми.
6. Задание: стоять без поддержки с закрытыми глазами
Инструкция: закрыть глаза и стоять неподвижно в течение 10 сек. Ноги на ширине плеч, руки по бокам. Используйте секундомер.
Оценка:
4 – уверенно стоит в течение 10 сек;
3 – уверенно стоит в течение 10 сек при наблюдении (без мануального контакта с пациентом, вы стоите ближе, чем этого требует выполнение задания на 4 балла);
2 – стоит в течение 3 сек;
1 – не может держать глаза закрытыми в течение 3 сек, но стоит уверенно;
0 – нужна поддержка для того, чтобы избежать падения.
7. Задание: стоять без поддержки, ноги вместе
Инструкция: попросите пациента поставить ноги вместе (пятки и носки соприкасаются) и стоять 1 мин. Используйте секундомер.
Оценка:
4 – ноги вместе, может независимо стоять в течение 1 мин;
3 – ноги вместе, может независимо стоять в течение 1 мин при наблюдении (без мануального контакта с пациентом, вы стоите ближе, чем этого требует выполнение задания на 4 балла);
2 – может поставить ноги вместе, но не может продержаться 30 сек;
1 – нужна помощь для принятия позиции (соединить ноги), но может стоять в течение 15 сек. (0) нужна помощь для принятия позиции (соединить ноги), не может стоять в течение 15 сек.
Если пациент не в состоянии сдвинуть ноги вместе по причинам, не связанным с равновесием (т.е. из-за ожирения или Х-образной формы ног), и не снимайте баллы. В таких случаях отметьте положение ног в качестве контрольного для проведения оценивания в будущем.
8. Задание: наклониться вперед с вытянутыми руками
Инструкция: попросите пациента поднять руку на 90°, распрямить/вытянуть пальцы вперед насколько возможно, ноги на ширине плеч, стопы параллельно. Экзаменатор помещает линейку у кончиков пальцев пациента, не касаясь линейкой пальцев пациента. Далее попросите пациента наклониться вперед с вытянутой рукой вдоль линейки, насколько это возможно, не перемещая ноги. Оценивается расстояние, на которое перемещаются пальцы при максимальном наклоне вперед. По достижении максимального наклона, пациент должен вернуться в исходное положение. Если для малейшего наклона требуется контроль со стороны — это 3 балла. Для выполнения задания потребуется линейка.
Оценка:
4 – уверенно наклоняется вперед на 25 см;
3 – наклоняется вперед от 24 см до 12 см;
2 – наклоняется вперед от 11 см до 5 см;
1 – наклоняется вперед, но нужно наблюдение (без мануального контакта с пациентом, вы стоите ближе, чем этого требует выполнение задания на 4 балла);
0 – нужна поддержка для того, чтобы избежать падения (теряет равновесие).
9. Задание: поднять предмет с пола
Инструкция: попросите пациента поднять с пола ботинок, который следует положить перед пациентом по средней линии. Отведите пациента от стула, чтобы он не упирался в него ягодицами. Пациент может ставить ноги в любом удобном для него положении.
Оценка:
4 – легко и уверенно поднимает тапочек;
3 – поднимает тапочек, но нужно наблюдение;
2 – не может поднять, но самостоятельно наклоняется на 2-4 см от ботинка, удерживает равновесие;
1 – не может поднять, требуется помощь при попытке выполнить задание;
0 – не получается поднять и нужна поддержка для того, чтобы избежать падения
Если пациент не может выполнить задание из-за избыточного веса, предложите пациенту «присесть» и выполнить задание (в этом случае оценивать выполнение задания следует по предложенным баллам). Если не получается «присесть», задание пропускается. В обоих случаях необходимо сделать пометку о том, как было выполнено или почему было не выполнено задание, для возможности оценке в динамике.
10. Задание: обернуться и посмотреть через левое и правое плечо
Инструкция: попросите пациента обернуться и посмотреть через левое плечо и вернуться в исходное положение. Затем после небольшой паузы повторить через поворот правое плечо. Перемещать ноги нельзя. Стойте напротив пациента, чтобы наблюдать за симметрией поворота головы и шеи и переносом веса тела. Поворот влево или вправо подразумевает поворот приблизительно на 90°. Можно попросить пациента визуально определить какие –то объекты сзади них, чтобы отметить полный разворот.
Оценка:
4 – смотрит по обе стороны, вес тела переносит хорошо;
3 – смотрит только через одно плечо, на другой стороне вес тела переносит хуже;
2 – поворачивается только в сторону, но удерживает равновесие;
1 – при повороте требуется контроль со стороны;
0 – нужна поддержка для того, чтобы избежать падения.
11. Задание: обернуться на 360°
Инструкция: попросите пациента обернуться вокруг себя, затем остановиться и обернуться полный круг в другую сторону. Продемонстрируйте пациенту, как следует выполнять задание. Засекайте время каждого поворота отдельно. Повторите попытку, если пациент прикоснулся к стулу. Площадь поверхности пола, которая требуется пациенту для совершения разворота, не имеет значения.
Оценка:
4 – может обернуться в обе стороны на 360°, менее чем за 4 сек;
3 – может обернуться в одну сторону на 360°, менее чем за 4 сек;
2 – может обернуться на 360°, но медленно;
1 – требуется наблюдение или устные подсказки;
0 – в процессе поворота требуется помощь.
12. Задание: попеременные шаги на подставку
Инструкция: попросите пациента поочередно ступать на подставку, по 4 шага каждой ногой. Поставьте ступеньку перед пациентом, высота ступеньки. Продемонстрируйте пациенту, как следует выполнять задание. Если для выполнения задания потребовалась посторонняя помощь, выберите оценку не более 2 баллов.
Оценка:
4 – стоит без поддержки и уверенно, может выполнить 8 шагов за 20 сек;
3 – стоит без поддержки, может выполнить 8 шагов больше, чем за 20 сек;
2 – совершает 4 шага без помощи под наблюдением;
1 – может выполнить меньше шагов (2-3), нужна минимальная помощь ;
0 – нужна поддержка для того, чтобы избежать падения/ не в состоянии совершить попытку.
13. Задание: устоять в положении «стопы друг перед другом на одной линии»
Инструкция: попросите пациента поставить одну ногу прямо перед второй (пятка одной ноги касается носка другой ноги). Если не получается поставить стопы четко одну перед другой, то возможны варианты расположения стоп относительно друг друга.
Оценка:
4 – получается поставить одну ногу прямо перед второй (пятка одной ноги касается носка другой ноги) и держать равновесие в течение 30 сек;
3 – получается, поставить одну ногу перед второй на расстоянии и держать равновесие в течение 30 сек;
2 – делает небольшой шаг вперед, удерживает равновесие 30 сек;
1 – нужна помощь чтобы сделать шаг вперед, но удерживает равновесие 15 сек;
0 – теряет равновесие при положении стоя или при шаге вперед/не в состоянии совершить попытку.
В случае если не получились поставить одну ногу прямо перед второй (пятка одной ноги касается носка другой ноги) и задание выполнялось в другой позиции стоп, не забудьте отметить и учесть при выполнении повторного тестирования.
14. Задание: стоять на одной ноге
Инструкция: попросите пациента постоять на одной ноге столько, сколько он/она может, не пользуясь посторонней помощью. Ногу необходимо поднимать на заметную высоту, следите за тем, чтобы ноги пациента не касались друг друга. Если потребовалась посторонняя помощь, выберите оценку не более 1 балла. На какой ноге стоять пациент выбирает сам.
Оценка:
4 – может поднять ногу и держаться > 10 сек;
3 – может поднять ногу и держаться 5 — 10 сек;
2 – может поднять ногу и держаться 3 сек;
1 – попытка поднять ногу, но не может держать равновесие в течение 3 секунд, но стоит независимо;
0 – нужна поддержка для того, чтобы избежать падения.
— Если пациент выполнил два пункта подряд на оценку ноль, то дальше тестирование не продолжается.
— Когда пациент получает 4 балла за выполненное задание, экзаменатор должен находиться недалеко, но не настолько близко, чтобы пациент чувствовал поддержку от присутствия экзаменатора рядом. Если Вы стоите очень близко к пациенту, то это оценка не более 3-х баллов.
— Если Вы не уверены, как правильно оценить выполнение задания, например пациент, выполнил задание вроде на 3 балла, но с погрешностями, ставьте балл 2. То есть, если есть сомнения, всегда выбирайте меньший балл.
— Любое задание может быть продемонстрировано вами пациенту, перед его выполнением — Если пациент перемещается с дополнительными средствами опоры (ходунки, трость), то задания из шкалы следует выполнять без дополнительной опоры.
Ключ (интерпретация): менее 43 баллов из 56 – высокий риск падения.
Приложение Г4. Тест функциональной независимости (FIM)
Название на русском: Тест функциональной независимости (FIM)
Оригинальное название: Functional Independence Measure (FIM)
Источник (официальный сайт разработчиков, публикация с валидацией): Kidd D, Stewart G, Baldry J et al. The Functional Independence Measure: A comparative validity and reliability study. Disabil Rehabil. 1995;17(1):10-14. doi:10.3109/09638289509166622
Тип: шкала оценки
Назначение: оценка функциональной независимости пациента.
Оценка проводится специалистом, наблюдающим пациента постоянно или несколькими специалистами и медсестрами. Шкала заполняется по результатам совокупных наблюдений за пациентом в течение 2 — 4 дней. Специалисты, проводящие оценку, могут заполнить шкалу в процессе наблюдений поочередно или в процессе консилиума. Шкала функциональной независимости FIM включает 18 пунктов, при этом пункты 1 — 13 отражают состояние двигательных функций, а пункты 14 — 18 — состояние интеллектуальных функций.
Семибалльная градация оценки:
7 – полная независимость в выполнении соответствующей функции (все действия выполняются самостоятельно, в общепринятой манере и с разумными затратами времени);
6 – ограниченная независимость (больной выполняет все действия самостоятельно, но медленнее, чем обычно, либо нуждается в постороннем совете);
5 – минимальная зависимость (при выполнении действий требуется наблюдение персонала, либо помощь при надевании протеза/ортеза);
4 – незначительная зависимость (при выполнении действий нуждается в посторонней помощи, однако более 75% задания выполняет самостоятельно);
3 – умеренная зависимость (самостоятельно выполняет 50 — 75 % необходимых для исполнения задания действий);
2 – значительная зависимость (самостоятельно выполняет 25 — 50% действий)
1 — полная зависимость от окружающих (самостоятельно может выполнить менее 25% необходимых действий).
Ключ (интерпретация): каждая из указанных функций оценивается по семибальной шкале. Таким образом, суммарная оценка по шкале FIM может составлять от 18 до 126 баллов: чем ниже суммарная оценка FIM, тем в большей степени пациент зависим от окружающих в повседневной жизни.
Приложение Г5. Тест 9 колышков и отверстий
Название на русском: Тест 9 колышков и отверстий
Оригинальное название: The Nine-Hole Peg Test
Источник (официальный сайт разработчиков, публикация с валидацией): Feys P, Lamers I, Francis G et al. The Nine-Hole Peg Test as a manual dexterity performance measure for multiple sclerosis. Multiple Sclerosis Journal. 2017;23(5):711-720. doi:10.1177/1352458517690824
Тип: шкала оценки
Назначение: оценка моторики рук.
Пациент сидит за столом. Контейнер с отверстиями располагается на столе перед пациентом таким образом, чтобы углубление в контейнере для сбора колышков находилось с той же стороны, что и проверяемая рука. Исследование всегда начинается с доминирующей руки. Пациент должен вставить колышки в отверстия и вынуть их по одному одной рукой. Регистрируется время от начала перемещения первого колышка в одно из 9 отверстий и до складывания последнего колышка в углубление контейнера. Затем нужно повторить все действия другой рукой. Время выполнения теста каждой рукой фиксируется с помощью секундомера.
Если во время выполнения задания колышек падает на стол, тестируемый должен его поднять и продолжить задание; если колышек падает на пол, его поднимает не пациент, а лицо, проводящее обследование.
Ключ (интерпретация): снижение скорости выполнения при повторном тестировании более чем на 20% расценивается как клинически значимое ухудшение.
Приложение Г6. Тест для руки Френчай
Название на русском: Тест для руки Френчай
Оригинальное название: The Frenchay Arm Test
Источник (официальный сайт разработчиков, публикация с валидацией): Heller A, Wade D, Wood V, Sunderland A, Hewer R, Ward E. Arm function after stroke: measurement and recovery over the first three months. Journal of Neurology, Neurosurgery & Psychiatry. 1987;50(6):714-719. doi:10.1136/jnnp.50.6.714
Тип: шкала оценки
Назначение: оценка функции поражённой руки.
Если у больного выраженный когнитивный дефицит или речевые нарушения, препятствующие пониманию команд, следует использовать альтернативные источники коммуникации. Если пациент находится без сознания, то он получает 0 баллов.
Инструкция:
• Исходное положение для каждого задания: сидя за столом, руки лежат на коленях
• Все задания выполняются пораженной рукой
• За каждое успешно выполненное задание больной получает 1 балл (максимум 5 балл)
• За невыполненное – 0 баллов
Задания:
1. Удержать линейку паретичной рукой и с ее помощью начертить линию, держа карандаш в другой (непораженной) руке. Задание считается выполненным успешно, если линейка удерживается стабильно.
2. Взять в руку цилиндр диаметром 1,2 и длиной 5 см, поставленный вертикально на расстоянии 15 – 30 см от края стола, поднять на высоту около 30 см и затем опустить на место, не уронив при этом.
3. Взять стакан, наполовину наполненный водой и поставленный на расстоянии 15 – 30 см от края стола, отпить воды и поставить стакан на место, не расплескав при этом воду.
4. Снять, а затем установить на прежнее место бельевую прищепку, укрепленную на вертикальном колышке длиной 15 и диаметром 1 см. Колышек укреплен на квадратной дощечке (длина стороны 10 см), расположенной на расстоянии 15 – 30 см от края стола. Пациент не должен уронить прищепку или колышек
5. Причесать волосы (или имитировать причесывание). Пациент должен расчесать волосы на макушке, на затылке, с правой и левой стороны.
Приложение Г7. Индекс мобильности Ривермид
Название на русском: Индекс мобильности Ривермид
Оригинальное название: Rivermead Mobility Index
Источник (официальный сайт разработчиков, публикация с валидацией): Whiting S, Lincoln N, Bhavnani G, Cockburn J. Rivermead Perceptual Assessment Battery. Occup Ther Health Care. 1986;3(3-4):209-210. doi:10.1080/j003v03n03_18
Тип: шкала оценки
Назначение: методика для клинической оценки мобильности пациента.
Если пациент с афазией или иными проблемами с коммуникацией (Интубация, ИВЛ) тест не проводится.
Если пациент находится в лежачем состоянии тест не проводится.
Если больной не говорит, но способен перемещаться, тест проводится с визуальной подсказкой, по результатам наблюдения за его действиями либо при помощи карточек альтернативной коммуникации (обозначения действия).
Если пациент находится без сознания тест не проводится.
Если у пациента выраженный когнитивный дефицит тест проводится по результатам наблюдения за его деятельностью.
Если пациент не способен понять вопрос и (или) выполнить действие – выставляется оценка 1.
Если у пациента нет когнитивного дефицита и он способен отвечать на вопросы, оценка проводится со слов пациента, либо пациент сам заполняет опросник при помощи опрашивающего специалиста.
Начисляется следующее количество баллов:
1 — зависим от посторонней помощи (то есть самостоятельное выполнение действия невозможно, или небезопасно, или требует неразумных затрат времени);
2 — требуется присмотр (вербальная помощь и подсказка);
3 — независим (может использовать вспомогательные приспособления).
Приложение Г8. Опросник оценки качества жизни SF-36
Название на русском: Опросник оценки качества жизни SF-36
Оригинальное название: The 36-Item Short Form Health Survey questionnaire
Источник (официальный сайт разработчиков, публикация с валидацией): Saris-Baglama RN, Dewey CJ, Chisholm GB, et al. Quality Metric health outcomes™ scoring software 4.0. Lincoln, RI: Quality Metric Incorporated, 2010, p. 138.
Тип: шкала оценки
Назначение: опросник для оценки качества жизни пациента.
Пожалуйста, ответьте на 36 вопросов обследования состояния здоровья полностью, честно и не прерываясь.
ОБЩЕЕ СОСТОЯНИЕ ЗДОРОВЬЯ:
В целом Вы бы оценили состояние здоровья как:
⬜ Отличное ⬜ Очень хорошее ⬜ Хорошее ⬜ Посредственное ⬜Плохое
Как бы вы оценили свое здоровье сейчас по сравнению с тем, что было год назад?
⬜ Значительно лучше, чем год назад
⬜ Несколько лучше, чем год назад
⬜ Примерно так же
⬜ Несколько хуже, чем год назад
⬜ Намного хуже, чем год назад
ОГРАНИЧЕНИЕ ФИЗИЧЕСКИХ НАГРУЗОК:
Следующие вопросы касаются физических нагрузок, с которыми Вы, возможно, сталкиваетесь в течение своего обычного дня. Ограничивает ли Вас состояние Вашего здоровья в настоящее время в выполнении этих физических нагрузок? Если да, то в какой степени?
Тяжелые физические нагрузки, такие как бег, поднятие тяжестей, занятие силовыми видами спорта
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Умеренные физические нагрузки, такие как передвинуть стол, пропылесосить, боулинг или игра в гольф
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Поднять или нести сумку с продуктами
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Подняться пешком по лестнице на несколько пролетов
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Подняться пешком по лестнице на один пролет
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Наклониться, встать на колени, согнуться
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Пройти расстояние более одного километра
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Пройти расстояние в несколько кварталов
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Пройти расстояние в один квартал
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
Самостоятельно вымыться, одеться
⬜ Да, значительно ограничивает ⬜ Да, немного ограничивает ⬜ Нет, совсем не ограничивает
ПРОБЛЕМЫ С ФИЗИЧЕСКИМ ЗДОРОВЬЕМ:
Бывало ли у Вас в течение последних 4 недель, что Ваше физическое состояние вызывало затруднения в Вашей работе или другой обычной повседневной деятельности, вследствие чего:
Пришлось сократить количество времени, затрачиваемого на работу или другие дела
⬜ Да ⬜ Нет
Вы выполнили меньше, чем хотели
⬜ Да ⬜ Нет
Вы были ограничены в выполнении какого-либо определенного вида работы или другой деятельности
⬜ Да ⬜ Нет
Были трудности при выполнении работы или других дел (например, они потребовали дополнительных усилий)
⬜ Да ⬜ Нет
ПРОБЛЕМЫ С ЭМОЦИОНАЛЬНЫМ ЗДОРОВЬЕМ:
Бывало ли у Вас в течение последних 4 недель, что какие-либо из перечисленных ниже проблем вызывали затруднения на работе или другой обычной повседневной деятельности в результате каких-либо эмоциональных проблем (таких как чувство депрессии или беспокойства)?
Пришлось сократить количество времени, затрачиваемого на работу или другие дела
⬜ Да ⬜ Нет
Вы выполнили меньше, чем хотели
⬜ Да ⬜ Нет
Выполняли свою работу или другие дела не так аккуратно, как обычно
⬜ Да ⬜ Нет
ОБЩЕСТВЕННАЯ ДЕЯТЕЛЬНОСТЬ (ДОСУГ):
Насколько Ваши эмоциональные проблемы мешали Вам проводить совместное время с семьей, друзьями, соседями или в коллективе?
⬜ Совсем не мешало ⬜ Немного ⬜ Умеренно ⬜ Сильно ⬜ Очень сильно
Насколько сильную физическую боль Вы испытывали за последние 4 недели?
⬜ Совсем не испытывал(а) ⬜ Очень слабую ⬜ Слабую ⬜ Умеренную ⬜ Сильную ⬜ Очень сильную
В какой степени боль в течение последних 4 недель мешала Вам заниматься Вашей нормальной работой (включая работу вне дома и по дому)?
⬜ Совсем не мешало ⬜ Немного ⬜ Умеренно ⬜ Сильно ⬜ Очень сильно
ЭНЕРГИЯ И ЭМОЦИИ
Эти вопросы касаются того, как Вы себя чувствовали и каким было Ваше настроение в течение последних 4 недель. Пожалуйста, на каждый вопрос дайте ответ, который наиболее соответствует Вашим ощущениям.
Вы чувствовали себя полным(ой) бодрости?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
Вы чувствовали себя таким подавленным(ой), что ничто не могло Вас взбодрить?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
Вы чувствовали себя спокойным(ой), и умиротворенным(ой)?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
Вы чувствовали себя полным(ой) сил и энергии?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
Вы чувствовали себя упавшим(ой) духом и печальным?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
Вы чувствовали себя измученным(ой)?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
Вы чувствовали себя счастливым(ой)?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
Вы чувствовали себя уставшим(ой)?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
ОБЩЕСТВЕННАЯ ДЕЯТЕЛЬНОСТЬ (ДОСУГ):
Как часто за последние 4 недели Ваше физическое или эмоциональное состояние мешало Вам активно общаться с людьми (например, навещать друзей, родственников и т.п.)?
⬜ Все время
⬜ Большую часть времени
⬜ Часто
⬜ Иногда
⬜ Редко
⬜ Ни разу
ОБЩЕЕ СОСТОЯНИЕ ЗДОРОВЬЯ:
Насколько верным или неверным представляется по отношению к Вам каждое из нижеперечисленных утверждений?
Мне кажется, что я более склонен(на) к болезням, чем другие люди
⬜ Определенно верно
⬜ В основном верно
⬜ Не знаю
⬜ В основном не верно
⬜ Определенно неверно
Мое здоровье не хуже, чем у большинства моих знакомых
⬜ Определенно верно
⬜ В основном верно
⬜ Не знаю
⬜ В основном не верно
⬜ Определенно неверно
Я ожидаю, что мое здоровье ухудшится
⬜ Определенно верно
⬜ В основном верно
⬜ Не знаю
⬜ В основном не верно
⬜ Определенно неверно
⬜ Определенно верно
⬜ В основном верно
⬜ Не знаю
⬜ В основном не верно
⬜ Определенно неверно
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Рассеянный склероз: причины появления, симптомы, диагностика и способы лечения.
Определение
Рассеянный склероз (множественный склероз, Multiple Sclerosis) – это хроническое прогрессирующее нейродегенеративное аутоиммунное заболевание центральной нервной системы, которое поражает головной мозг, спинной мозг и зрительные нервы.
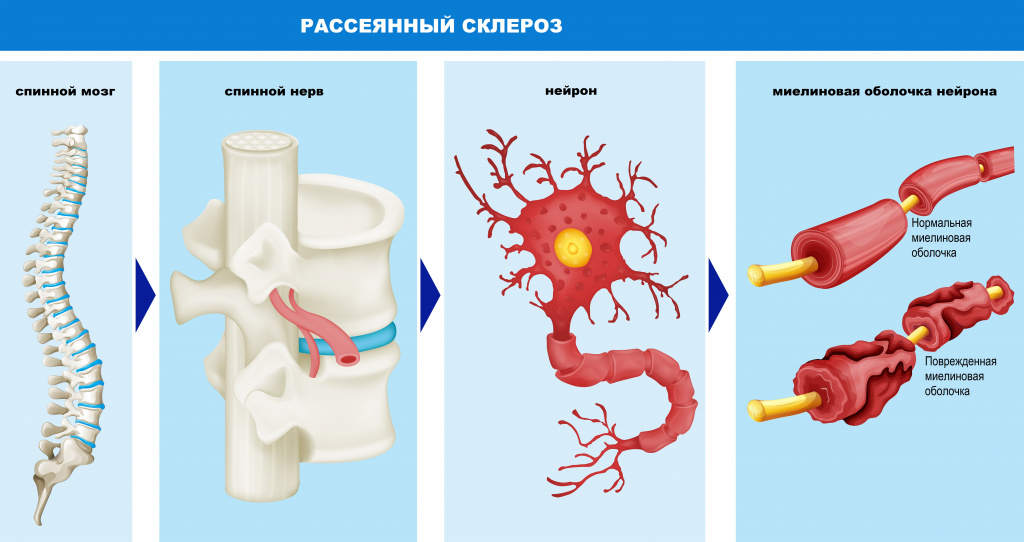
Большинство нервных волокон покрыто миелиновой оболочкой. Мозг направляет электрические импульсы по нервам в различные части тела. Данные импульсы управляют всеми нашими произвольными и непроизвольными движениями. Здоровые нервы изолированы при помощи миелиновой оболочки, которая является защитным слоем, обеспечивает питание аксона, поддерживает его структуру, предохраняет от повреждения, ускоряет передачу нервного импульса.
При рассеянном склерозе собственная иммунная система человека ошибочно атакует и разрушает миелиновую оболочку нервных волокон.
В области потери миелина образуется рубцовая соединительная ткань, которая может исказить либо полностью заблокировать передаваемые импульсы. Какое-то время нервная система компенсирует сбои, но по мере прогрессирования заболевания выраженность симптоматики неуклонно нарастает от легкого онемения конечностей до паралича и/или слепоты.
Термин «рассеянный склероз» означает наличие множественных рассеянных на различных участках головного и спинного мозга рубцовых очагов (или демиелинизирующих бляшек).
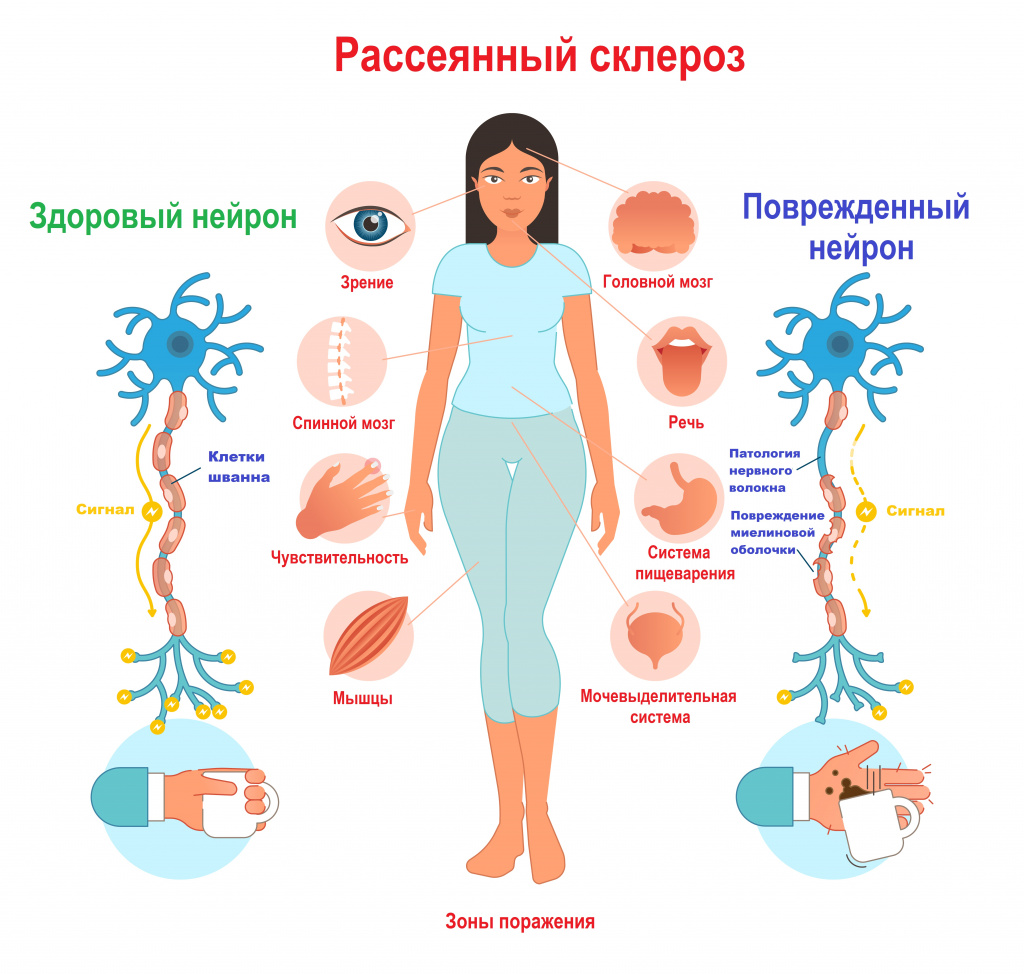
Заболевание чаще диагностируют в возрасте 20–45 лет, но может встречаться и у детей. Мужчины болеют в 2 раза реже женщин, но именно у них патология протекает тяжелее и хуже поддается терапии.
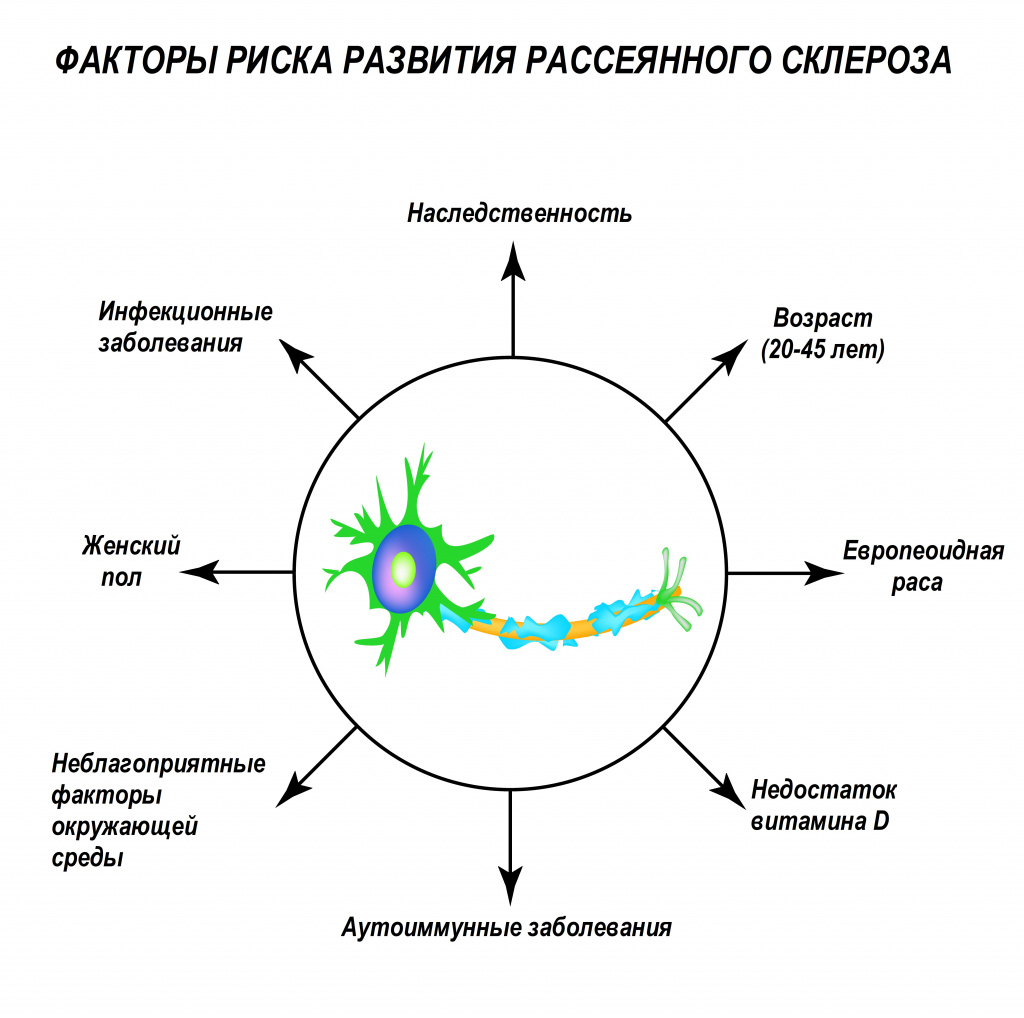
Выделяют некоторые типичные варианты течения рассеянного склероза:
- Ремиттирующее течение – наиболее частый вариант в дебюте заболевания. Характеризуется периодами обострений, чередующихся с периодами ремиссий (с полным или неполным восстановлением функций в периоды между обострениями), отсутствием нарастания симптомов в периоды ремиссий. У многих пациентов ремиттирующее течение в последующем переходит во вторичное прогрессирование (с обострениями или без обострений);
- Прогрессирующее течение:
- первично-прогрессирующее – с самого начала заболевания в течение не менее одного года наблюдается нарастание тяжести симптомов заболевания без периодов улучшения;
- вторично-прогрессирующее – тяжесть симптомов заболевания нарастает на протяжении не менее 6 месяцев без стабилизации или улучшения после ремиттирующей фазы болезни, возможно прогрессирование с обострениями или без них.
Также рассеянный склероз классифицируют по активности заболевания — обострение или обнаружение новых очагов в головном и/или спинном мозге при МРТ-исследовании. Можно выделить следующие формы:
- активный рассеянный склероз (при наличии обострений или признаков активности заболевания по данным МРТ);
- неактивный рассеянный склероз (без обострений и без признаков активности по данным МРТ);
- рассеянный склероз с прогрессированием (выявляются новые очаги поражения);
- рассеянный склероз без прогрессирования (новые очаги поражения нервной системы не выявлены).
Различают также несколько особых форм заболевания, которые нуждаются в агрессивных методах лечения:
- злокачественная форма (болезнь Марбурга) характеризуется очень быстрым прогрессированием без периодов ремиссии, в самых тяжелых случаях может приводить к смерти пациента;
- агрессивная, или быстропрогрессирующая форма, при которой в течение года наблюдается два и более эпизода обострения, ведущих к нарастанию уровня инвалидизации;
- высокоактивная форма характеризуется двумя и более обострениями за год и значительным увеличением очагов поражения нервной системы по данным МРТ.
Симптомы рассеянного склероза
Самые первые симптомы появляются тогда, когда поражено уже около 50% нервных волокон – то есть сначала заболевание никак себя не проявляет. Это объясняется тем, что здоровые клетки мозга берут на себя функцию пораженных участков.
Признаки рассеянного склероза зависят от локализации основной части патологических очагов. По мере поражения новых зон симптоматика нарастает и становится более разнообразной.
Поражение мозжечка и его путей: выраженное напряжение в ногах или в руках (за счет повышения мышечного тонуса), возможны параличи, нарушение координации движений, пошатывание при ходьбе, непроизвольные движения, тремор рук и ног, нарушение речевой функции, головокружения.
Поражение зрительного нерва: снижение зрения на один глаз вплоть до полной слепоты; черная точка в центре поля зрения; ощущение мутного стекла, пелены перед глазом — это проявления ретробульбарного неврита (патологии зрительного нерва на участке за глазным яблоком в результате поражения его миелиновой оболочки). Возникает нарушение движения глазного яблока, развивается двоение изображения (диплопия).
Поражение спинного мозга: постоянная усталость и утомляемость, потеря контроля над опорожнением кишечника и мочевого пузыря, запоры и задержка мочеиспускания, изменения сексуальной функции, радикулопатии, симптом Лермитта (при наклоне головы вперед возникает ощущение прохождения электрического тока по позвоночнику, иногда отдающее в конечности), чувство жжения или боль в ответ на прикосновение, покалывание или онемение в конечностях, развитие спастического парапареза.
Поражение ствола головного мозга: слабость или спазм мышц лица, перемежающееся онемение одной половины лица, центральный или периферический парез лицевого нерва, снижение слуха, снижение вкусовой чувствительности.
Поражение больших полушарий головного мозга: снижение памяти и внимания, скорости выполнения нейропсихологических тестов, нарушения поведения, излишняя тревожность, плохое настроение, депрессия или эйфория.
После приема горячей ванны и под действием жаркого климата состояние больного временно ухудшается.
Это необходимо учитывать и стараться избегать перегрева, который может спровоцировать приступ. Лишенные миелиновой оболочки нервные волокна крайне чувствительны к повышению температуры.
Диагностика рассеянного склероза
В целом клинические проявления болезни очень разнообразны, что затрудняет постановку диагноза. Два основных клинических признака, подтверждающие наличие рассеянного склероза:
- симптомы проявляются в различных отделах центральной нервной системы;
- наличие по крайней мере двух приступов болезни, возникновение которых разделено по времени периодом не менее одного месяца.
Диагноз «рассеянный склероз» ставится в последнюю очередь, то есть после исключения других причин подобного многоочагового поражения мозга.
Методы диагностики:
Оценка жалоб, симптоматики, клинических нарушений.
При неврологическом осмотре врач проверяет функцию нервной системы: рефлексы, равновесие, координацию и зрение, а также проводит поиск областей онемения.
Офтальмологическое обследование с обязательной оценкой остроты зрения, полей зрения, состояния глазного дна.
Пациенту с подозрением на рассеянный склероз рекомендованы следующие лабораторные анализы для оценки общего состояния организма и определения возможности назначения последующей терапии:
- клинический анализ крови развернутый;
Пункция спинного мозга проводится с целью обнаружения признаков заболевания в спинномозговой жидкости.
- Оценка уровня терифлуномида в крови – активной формы препаратов, применяемых для лечения взрослых пациентов с рецидивирующе-ремиттирующим рассеянным склерозом.
Может потребоваться проведение анализа крови для исключения системных заболеваний и инфекций, которые в некоторых случаях обусловливают похожую клиническую картину.
Диагноз подтверждается при обнаружении бляшек демиелинизации при магнитно-резонансной томографии головного и спинного мозга. Наиболее достоверно исследование на аппаратах от 1.5 Т с введением контраста. Отсутствие бляшек диагноз не опровергает.
МРТ головного мозга
Безопасное и информативное сканирование структур головного мозга для диагностики его патологий.
Компьютерная томография позволяет получить подробные рентгеновские снимки головного и спинного мозга.
КТ головного мозга и черепа
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Методом «вызванных потенциалов» можно измерить точность и быстроту реакции центральной нервной системы на определенный импульс.
К каким врачам обращаться
При рассеянном склерозе требуется динамическое наблюдение у
врача-невролога
, осмотры окулиста с проверкой полей зрения и глазного дна. Часто бывают необходимы консультации узких специалистов, лабораторные и инструментальные исследования для исключения другой причины появления того или иного симптома.
Лечение рассеянного склероза
Лечение назначается индивидуально и зависит от стадии и тяжести заболевания.
Гормональная терапия: пульс-терапия большими дозами гормонов (кортикостероидов). Капельницы с этими противовоспалительными и угнетающими иммунитет препаратами ускоряют восстановительные процессы и уменьшают продолжительность обострения. Гормоны вводятся коротким курсом, поэтому выраженность их побочных эффектов минимальна, но для подстраховки вместе с ними принимают препараты, защищающие слизистую желудка, препараты калия и магния, витаминно-минеральные комплексы.
Применение высокообъемного плазмофереза рекомендуется в случае неэффективности курса терапии глюкокортикостероидами.
Иммуномодулирующее действие плазмафереза связано с выведением антител, продуктов распада миелина, провоспалительных цитокинов, циркулирующих иммунных комплексов и других иммунологически активных веществ.
При наличии обострения возможно использование метаболической терапии альфа-липоевой кислотой.
В случае наличия обострения у пациентов младше 18 лет и беременных женщин применяют высокодозные иммуноглобулины.
β-интерфероны назначают для профилактики обострений заболевания, уменьшения тяжести обострений, торможения активности процесса, продления активной социальной адаптации и трудоспособности.
Иммуномодуляторы предотвращают разрушение миелина, смягчают течение болезни, снижают частоту и тяжесть обострений.
При неуклонно прогрессирующих вариантах течения рассеянного склероза используют иммуносупрессоры и цитостатики. Их назначение оправдано при неэффективности гормональной и другой иммуномодулирующей терапии.
Симптоматическая терапия включает антиоксиданты, ноотропные средства, аминокислоты, витамины Е и группы В, антихолинэстеразные препараты, миорелаксанты, энтеросорбенты, антидепрессанты.
В периоды ремиссии рекомендуется санаторно-курортное лечение, лечебная физкультура, массаж, гидротерапия – за исключением всех тепловых процедур и инсоляции.
К сожалению, полностью рассеянный склероз не излечим, можно лишь уменьшить проявления этого заболевания, улучшить качество жизни и продлить периоды ремиссии. Схема лечения должна соблюдаться не только во время обострений, но и в периоды ремиссий, когда болезнь внешне не проявляется.
Осложнения
Большинство больных рассеянным склерозом могут передвигаться самостоятельно. Вместе с тем, есть и те, кому необходимы костыли, инвалидное кресло или другие вспомогательные средства, облегчающие передвижение.
Без надлежащего или из-за неправильно подобранного и неэффективного лечения у больных регистрируются судорожные припадки, паралич (чаще – ног), существенно снижаются показателя когнитивной сферы, депрессия, эпилепсия, пневмония, вторичный пиелонефрит, гиперкератоз стоп, у лежачих больных – пролежни и сепсис. При поражении сердечного и дыхательного центров нервной системы наступает летальный исход.
Прогнозы относительно рассеянного склероза не очень радостные, однако при своевременной диагностике и назначении адекватного лечения можно сохранять относительное здоровье еще многие годы.
Профилактика рассеянного склероза
Диагноз «рассеянный склероз» – не приговор. С ним можно жить, заниматься спортом, путешествовать, работать, создавать семью. Нужно только бережнее относиться к своему здоровью: избегать стрессов, инфекционных заболеваний, отказаться от курения, алкоголя и регулярно проходить медицинские осмотры. Главная задача больного – вовремя принимать необходимые препараты.
Источники:
- Рассеянный склероз. Клинические рекомендации. Минздрав России, 2018.
- Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание, том 21.
- Якушина Т.И. Рассеянный склероз и беременность. Влияние патогенетической терапии рассеянного склероза на состояние здоровья новорожденных. Русский журнал детской неврологии. 2020;15(3-4):19-25.
- Filippi M, Rocca MA, Ciccarelli O, et al. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurol 15 (3):292–303, 2016. doi: 10.1016/S1474-4422(15)00393-2.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
2410
05 Марта
-
13068
01 Марта
-
13065
23 Февраля
Похожие статьи
Выкидыш
Выкидыш: причины появления, симптомы, диагностика и способы лечения.
Генитальный герпес
Генитальный герпес: причины появления, классификация, симптомы, диагностика и способы лечения.
Простуда
Простуда: причины появления, симптомы, диагностика и способы лечения.
Герпес
Герпес: причины появления, симптомы, диагностика и способы лечения.
«Симптомы непредсказуемы»: что такое рассеянный склероз и как с ним жить
30.05.2022
Около 3-х миллионов человек по всему миру живут с рассеянным склерозом — аутоиммунным заболеванием центральной нервной системы, которое препятствует связи мозга с другими частями тела. Нередко такие нарушения — в зависимости от зоны поражения — приводят к ухудшению координации, зрения, а иногда и речи.
Есть мнение, что болезни подвержены только люди пожилого возраста. Но это не так. Рассеянный склероз — самое распространенное заболевание центральной нервной системы среди молодых людей (средний возраст начала — 30 лет), за исключением травм.
Как распознать ранние признаки и не начать обследоваться, когда этого делать не нужно? Как правильно подобрать терапию, чтобы замедлить течение болезни? Можно ли облегчить симптомы и почему важна реабилитация?
Читайте в инструкции, которую мы подготовили к Международному дню рассеянного склероза — он проходит ежегодно 30 мая.
Что такое рассеянный склероз и какие формы он принимает
Рассеянный склероз — это хроническое аутоиммунное заболевание, при котором собственные иммунные клетки разрушают оболочку, покрывающую нервные волокна (отростки нейронов) в центральной нервной системе. Когда оболочка разрушается, нервные импульсы начинают посылаться в мозг медленнее, и, в зависимости от зоны повреждения, длительности и формы заболевания, человек может начать терять координацию движений и чувствительность.
Форма и течение болезни подразделяются на несколько подтипов:
— Клинически изолированный синдром — это начальная стадия заболевания. Человек может заметить изменения в самочувствии — например, потерю чувствительности при прикосновении к некоторым участкам тела, сильную утомляемость, ухудшение зрения на один глаз, а на МРТ в некоторых случаях (не всегда) появляются характерные для рассеянного склероза очаги.
— Радиологически-изолированный синдром — это еще один подтип начальной стадии заболевания, когда нет никаких симптомов и внешних признаков болезни, но при этом результаты МРТ головного и спинного мозга показывают очаги рассеянного склероза. Как правило, это выясняется случайно, а МРТ проводится по другому поводу.
— Рецидивирующе-ремиттирующий синдром — это самый распространенный тип рассеянного склероза. Чаще встречается у женщин, средний возраст начала — около 30 лет.
- Течение болезни в этот период, как правило, волнообразное. Сначала могут возникать кратковременные эпизоды обострений (рецидив), когда появляются новые нарушения, например, шаткость и неуверенность при ходьбе, потеря чувствительности при прикосновении к некоторым участкам тела или ухудшение зрения на один глаз — изменения могут быть самыми разными. А после наступает длительный период ремиссии — от нескольких месяцев до нескольких лет.
Консультация у невролога. Фотография благотворительного фонда «Весна
— Первичный прогрессирующий рассеянный склероз — этому типу течения болезни свойственно неуклонное нарастание симптомов. Но оно может быть достаточно медленным — около четверти людей спустя 25 лет с момента постановки диагноза продолжают передвигаться самостоятельно. Первично-прогрессирующий рассеянный склероз встречается у 10-15% пациентов: одинаково часто и у мужчин, и у женщин, средний возраст которых около 40 лет.
— Вторичный прогрессирующий рассеянный склероз развивается только после ремиттирующего (волнообразного) течения болезни. Не существует признаков, которые сигнализировали бы о новой фазе заболевания, поэтому диагноз чаще ставится ретроспективно по клиническим проявлениям и МРТ.
Определить, что болезнь прогрессирует, кроме изменений в самочувствии, помогут два чувствительных параметра — атрофия мозга (уменьшение объема вещества мозга) и изменения толщины сетчатки глаза. Для оценки этих параметров используется специальное оборудование и программное обеспечение.
- Для вторичного прогрессирующего рассеянного склероза не характерны «волны» — обострения с последующими ремиссиями. Симптомы (спастика, нарушения координации движений, тремор) нарастают постепенно. Как правило, переход к этому типу заболевания происходит спустя 15-20 лет после начала болезни. Но если вовремя и правильно подобрать терапию, переход может отсрочиться на несколько лет или вовсе не произойти.
Почему возникает рассеянный склероз и кто находится в группе риска
Не существует какой-то одной причины возникновения рассеянного склероза. Это совокупность генетических и факторов окружающей среды, которые нарушают равновесие в иммунной системе и настраивают ее против самой себя.
К внутренним, генетическим факторам риска относятся определенные сочетания генов — генетические ассоциации, этническая принадлежность и пол.
Есть определенные сочетания генов, которые могут повысить риск возникновения рассеянного склероза. Но даже если оба родителя больны, это не обязательно приведет к предрасположенности и тем более к болезни.
Исследования показали, что общая распространенность рассеянного склероза составляет в среднем 0,15-0,3%, а риск развития этого заболевания в семье с заболевшим отцом или матерью — 2,5-3%.
Распространенность рассеянного склероза зависит от географии проживания. В северных широтах болеют рассеянным склерозом чаще, чем в южных.
- Если привести пример относительно России, то распространенность рассеянного склероза в Санкт-Петербурге в два раза выше, чем в Краснодарском крае.
К областям мира с высокой частотой заболеваемости (более 60 человек на 100 000) относятся Европа, юг Канады, север США, Новая Зеландия и юго-восток Австралии. Что интересно, при смене региона до 10 лет у человека снижается риск заболеть рассеянным склерозом, а если переезжает ребенок более старшего возраста, то риски для него остаются прежними.
Эмблема Всемирного дня рассеянного склероза
Считается, что распространенность рассеянного склероза частично связана с расовыми различиями. Например, у людей азиатского, африканского или индейского происхождения — самые низкие риски. Тем не менее, более поздние исследования показали высокую заболеваемость рассеянным склерозом и у темнокожих взрослых и детей.
Триггером для сбоя в иммунной системе могут быть инфекции. Особое внимание уделяется одной из самых распространенных — вирусу герпеса человека 4 типа или, как его еще называют, вирусу Эпштейна-Барра.
- 90-95% пациентов с рассеянным склерозом — то есть практически все — перенесли эту инфекцию. Считается, что у людей, у которых ее не было, вероятность заболеть рассеянным склерозом очень низкая. Но, несмотря на очевидную связь между вирусом и заболеванием, методы профилактики и вакцины против Эпштейна-Барра пока не разработаны.
Несколько исследований подтвердили связь между курением и возникновением рассеянного склероза. Также курение может способствовать прогрессированию заболевания, а отказ от этой привычки — наоборот приостановить течение болезни. Что интересно, нюхательный табак не провоцирует рассеянный склероз. Можно предположить, что риск среди курильщиков не связан с никотином, но для этого нужны дополнительные данные.
- Так как в развитии рассеянного склероза участвует иммунная система, многие думают, что заболевание может спровоцировать вакцинация. Но ни одно из исследований не подтвердило связи между вакцинами и рассеянным склерозом.
Умеренное ультрафиолетовое излучение в сочетании с витамином Д позволяют снизить риск рассеянного склероза. Но злоупотреблять солнечными ваннами не стоит, а необходимую дозировку витамина Д должен подобрать врач.
Какие симптомы должны насторожить и как грамотно диагностировать рассеянный склероз
Рассеянный склероз может вызывать множество различных симптомов, но не у всех пациентов они проявляются на начальном этапе заболевания.

Невролог Лев Брылев
«Иногда болезнь начинается с симптомов, но на МРТ нет никаких изменений и диагноз поставить невозможно. А бывает, что ничего относящегося к этому заболеванию в самочувствии нет, но на МРТ есть очаги, — рассказывает врач-невролог, заведующий отделением неврологии Московской городской клинической больницы им. В. М. Буянова, эксперт фонда «Весна» Лев Брылев. — Более того, при рассеянном склерозе могут поражаться самые разные отделы нервной системы, поэтому симптомы тоже могут быть разнообразными. Конечно, есть статистика самых распространенных признаков заболевания, но на практике все очень непредсказуемо».
Характерные симптомы:
- онемение, покалывание, потеря чувствительности при прикосновении к некоторым участкам тела;
- мышечная слабость и неловкость в руке или прихрамывание и слабость в ноге (обычно держится больше суток и постепенно нарастает);
- ухудшение зрения на один глаз (ретробульбарный неврит), которое сопровождается болью при движении и нарушением цветоощущения;
Важно: В этом случае нужно проконсультироваться не только у окулиста, но и у невролога.
- головокружение, но не головная боль;
Головная боль — не симптом рассеянного склероза. Без назначения врача в этом случае МРТ делать не нужно.
- шаткость и неуверенность при ходьбе, которая заметна для окружающих, держится больше суток и нарастает;
- прохождение тока при наклоне головы вперед — очень характерный симптом;
- изменение характера речи: она может стать более медленной;
- избыточная нетипичная утомляемость — невозможность выполнять повседневные дела.
Схожие симптомы могут быть и при других заболеваниях, поэтому если вы заметили у себя какие-то из этих проявлений, запишитесь на прием к врачу, чтобы правильно поставить диагноз.
Самый доступный и распространенный способ диагностики рассеянного склероза — это магнитно-резонансная томография (МРТ) головного и спинного мозга без контраста и с контрастом.
Это визуализирующий тест, который создает изображения внутренней части тела и может показать, есть ли в головном или спинном мозге очаги рассеянного склероза. Но на ранних этапах заболевания очаги видны не всегда, и во многих случаях врачи могут диагностировать заболевание только по симптомам и результатам анализов.
- Невролог Лев Брылев не рекомендует делать МРТ просто так, без показаний.
Невролог Лев Брылев
«Классический пример, когда молодая женщина с головной болью делает себе МРТ и находит там демиелинизирующие очаги, тогда как это просто неспецифические изменения, характерные для мигрени, — говорит Лев Брылев. — Проводились исследования, когда перепроверили пациентов, получающих специфическое лечение от рассеянного склероза, и потом выяснили, что у них мигрень. Поэтому к диагностике нужно относиться с осторожностью. Даже если на МРТ есть подозрения на демиелинизацию или очаги рассеянного склероза, паниковать не надо — скорее всего, это не рассеянный склероз, и только в небольшом проценте случаев может оказаться, что вы застали самое начало болезни».
Какие анализы вам могут предложить сделать дополнительно:
- Люмбальная или спинномозговая пункция. Во время этой процедуры врач вводит тонкую иглу в поясницу и делает забор небольшого количества спинномозговой жидкости для проверки признаков рассеянного склероза. Люмбальную пункцию назначают не всем, но в некоторых случаях ее применяют для повышения диагностической достоверности — например, если у пациента нетипичные признаки заболевания.
- «Вызванные потенциалы» или «вызванные реакции». Это способ изучения реакций и сигналов различных структур головного мозга на внешние стимулы. Во время обследования врач приклеивает к коже «электроды» и изучает нервные сигналы в мозгу пациента — например, когда тот смотрит на свет, слушает звуки или чувствует слабый электрический ток.
- Оптическая когерентная томография. В этом тесте используется специальный свет для осмотра внутреннего устройства глаза. Это помогает увидеть признаки рассеянного склероза — например, изменение толщины сетчатки.
Какое лечение и реабилитация нужны при рассеянном склерозе
Как правило, болезнь начинается задолго до клинических проявлений и видимых на МРТ очагов воспалений. Поэтому после постановки диагноза нужно сразу начинать лечение — раннее начало снижает частоту рецидивов и замедляет рост очагов поражения головного мозга.
- Самой эффективной считается модифицирующая терапия — меняющая ход течения заболевания. Выбирать препарат нужно индивидуально, в зависимости от активности заболевания, ценностей и предпочтений пациента. Важно оценивать потенциальную пользу и риски на момент начала лечения, а также риски, которые могут возникнуть при длительном применении.
Если у человека рецидивирующе-ремиттирующее (то есть с периодами обострений и ремиссии) течение болезни, то во время терапии применяются моноклональные антитела — иммуноглобулины, которые вызывают прицельный ответ организма для защиты от чужеродных антител. Используются такие препараты, как натализумаб, окрелизумаб, ритуксимаб, офатумумаб и алемтузумаб. Эта терапия предпочтительна для пациентов с более активным заболеванием и для тех, кто готов к возможным побочным эффектам, в том числе к серьезным — обсудить их нужно с лечащим врачом.
При рецидивирующе-ремиттирующем типе также возможна пероральная терапия (таблетки, например, диметилфумарат, терифлуномид, финголимод): в отличие от инфузий пациент может принимать лекарства независимо от врача. А также инъекционная терапия — интерфероны и глатирамера ацетат, которые были первыми одобрены для лечения рассеянного склероза и подходят пациентам, для которых безопасность (минимальные побочные эффекты) предпочтительнее, чем удобство и максимальная эффективность.
При первично прогрессирующем рассеянном склерозе молодым пациентам (до 55 лет) с активным заболеванием предлагают лечение окрелизумабом. Пожилым пациентам с неактивным заболеванием больше подходит симптоматическая терапия, так как лечение может вызвать сильные побочные эффекты и принести больше вреда, чем пользы.
Большинству пациентов, у которых рецидивирующе-ремиттирующий рассеянный склероз перешел в стадию вторично-прогрессирующего, врачи предлагают продолжать модифицирующую болезнь терапию. Выбор препаратов также зависит от активности и прогрессирования заболевания, побочных эффектов и предпочтений пациента. В России для лечения вторично-прогрессирующего рассеянного склероза зарегистрирован препарат сипонимод.
- Кроме терапии, замедляющей течение болезни, важно получать симптоматическое лечение. Если есть такие проявления, как сильная усталость, боли, нарушение походки, дисфункция мочевого пузыря или кишечника, а также нарушения речи, глотания и дыхания, необходима комплексная реабилитация. Основные ее задачи — помочь человеку адаптироваться к новым обстоятельствам и оставаться максимально независимым в уходе за собой.
Занятие с реабилитологом. Фотография благотворительного фонда «Весна
Так, лечение проблем с походкой в основном построено на физической терапии с использованием, если необходимо, дополнительных средств передвижения. Это могут быть трости, костыли для предплечья, инвалидные коляски, ортезы на голеностопный сустав. Эрготерапевт* поможет адаптироваться в социально-бытовой сфере — например, подберет новое рабочее место, научит спускаться по лестнице, выполнять гигиенические процедуры или готовить себе еду.
* Эрготерапевт — это специалист по восстановлению социальных, бытовых, рабочих, функциональных и двигательных навыков.
Комплексная реабилитация может включать и медикаментозное лечение. Если у пациента депрессия, психиатр назначит антидепрессанты. При недержании мочи и никтурии (частое мочеиспускание в ночное время) уролог подберет антихолинергические и антимускариновые препараты, которые считаются наиболее эффективными для решения этой проблемы. Даже пациентам с нарушением ходьбы назначают лекарства — например, дальфампридин.
Нарушения, связанные со стволом головного мозга, — например, дисфагия (нарушения глотания), дизартрия (нарушения произношения) или дыхательная дисфункция (особенно сильный кашель и неспособность отхаркивать выделения), говорят о прогрессирующей форме рассеянного склероза. При появлении таких симптомов обязательно нужно обратиться к логопеду, чтобы он оценил глотательную функцию. Некоторым пациентам с дисфагией нужен специальный зонд для кормления.
Также возможны нарушения зрения, особенно ухудшение на один глаз. Это характерный признак для рассеянного склероза, который возникает у большинства пациентов в какой-то момент течения заболевания. Если такие нарушения есть, важно вовремя получить консультацию офтальмолога и невролога.
- Важно не пренебрегать симптомами и не заниматься самолечением. Если вы заметили у себя какие-то из этих проявлений, обязательно обратитесь к врачу.
Где могут помочь пациентам и их близким
- Израильская ассоциация рассеянного склероза.
- Американская ассоциация рассеянного склероза.
- Центр реабилитации «Апрель» (лекции).
- Благотворительный фонд «Весна — помогает людям с тяжелыми двигательными нарушениями.
- Общественная организация «Московское общество рассеянного склероза».
Рассеянный склероз
Рассеянный склероз – хроническое заболевание, вызванное расстройством со стороны иммунной системы, сопровождающееся поражением миелиновой оболочки нервных волокон, в результате чего нарушается проводимость импульсов в мозг. Патология дебютирует в еще молодом возрасте, а в дальнейшем может послужить причиной развития тяжелых осложнений, вплоть до инвалидизации.
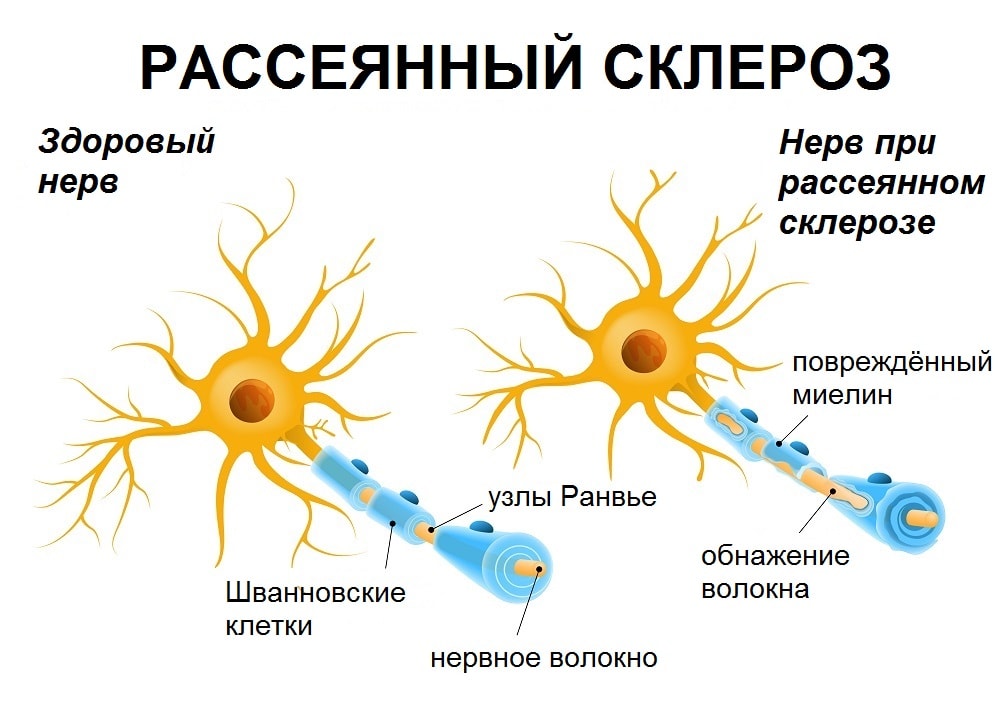
Полностью вылечиться от рассеянного склероза невозможно, однако своевременное обращение за помощью, грамотная диагностика и правильно подобранная терапия повышают шансы на остановку его прогрессирования и длительную ремиссию.
Первые признаки болезни начинают беспокоить в промежутке 20-40 лет. Как правило, их выраженность снижается, но потом усиливается вновь. Пациент может жаловаться только на что-то одно, затем месяцы или даже годы могут проходить совершенно бессимптомно. Кроме того, иногда патология проявляется лишь единожды, никак о себе не напоминая. Иногда РС прогрессирует крайне быстро – проблема усугубляется в течение нескольких недель или месяцев.
Классификация болезни
Заболевание классифицируется по формам с учетом характера течения:
-
Ремитирующий РС. Обострения случаются не часто, в период улучшения состояния функции мозга нормализуются (иногда полностью).
-
Первично-прогрессирующий РС. Развивается медленно, выраженность усиливается постепенно, функции мозга не нормализуются.
-
Вторично-прогрессирующий РС. Характеризуется редкими обострениями, симптоматика планомерно прогрессирует.
-
Прогрессирующе-ремитирующий РС. Сопровождается редкими обострениями, со временем приобретает тяжелое течение.
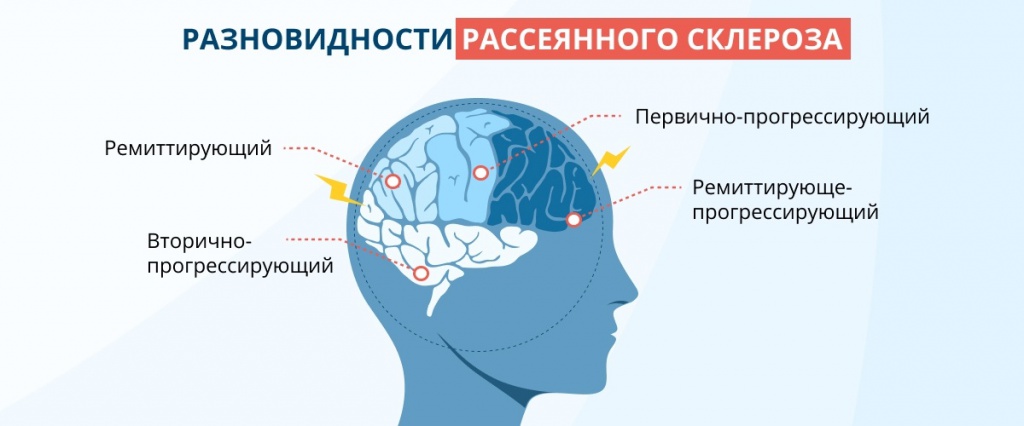
В зависимости от интенсивности заболевания выделяют такие стадии:
-
острая – занимает до 2-х недель с момента возникновения симптомов;
-
подострая – занимает до 2-х месяцев;
-
стабилизация – обострения не наблюдаются на протяжении нескольких месяцев и дольше.
Клиническая картина
Клиническая картина варьируется в зависимости от того, где расположен главный патологический очаг. По мере вовлечения в процесс новых участков, признаки усиливаются, их становится больше.
Поражение черепно-мозговых нервов
При поражении зрительного нерва (диагностируется очень часто), который участвует в процессе восприятия картинки, наблюдаются такие признаки:
-
один глаз резко начинает хуже видеть;
-
присутствует пелена, мушки, ощущение «песка» в глазах;
-
изображение воспринимается размыто, очертания предметов нечеткие, моргание не улучшает ситуацию;
-
происходит выпадение полей зрения;
-
наблюдается временный, частичный или полный дальтонизм;
-
беспокоит боль в глазах, которая увеличивается при движении ими.
Симптоматика не проходит в течение нескольких недель, затем исчезает (некоторые проявления могут сохраняться). Регулярно происходят обострения.
При поражении глазодвигательного и отводящего нервов, клиническая картина дополняется косоглазием и асимметрией век. Человек жалуется на раздвоение картинки, синхронное движение обоими глазами становится невозможным.
В редких случаях страдают тройничный и лицевой нервы, что сопровождается признаками их воспаления.
Поражение мозжечка
Благодаря мозжечку мы сохраняем равновесие и координацию. При данной форме заболевания возникает ряд характерных проявлений:
-
кружится голова, равновесие нарушается, использование транспортных средств становится крайне затруднительным;
-
походка меняется, у человека появляется чувство «шатания» и падения;
-
почерк становится неразборчивым;
-
при взгляде на изображение, оно двоится или дрожит;
-
при попытке посмотреть в сторону или вверх, отмечается незначительное подрагивание глазных яблок.
Подобная симптоматика одной из первых сигнализирует о начале развития болезни.
Чувствительные нарушения
При поражении височной и теменной долей мозга нарушается чувствительность, что выражается в расстройстве восприятия ощущений. У человека могут беспричинно возникать:
-
покалывание;
-
зуд и жжение;
-
чувство стянутости кожи и мурашек;
-
снижение чувствительности.
Как правило, ощущения локализуются только в одной определенной зоне – на лице или в конечностях и быстро отступают. В незначительной выраженности признаков, и в том, что их легко можно принять за обычное состояние, и кроется вся опасность. Со временем, интенсивность неизбежно усиливается, и уже тогда не придавать значения симптоматике трудно.
Иногда отмечаются нарушения температурной, болевой и вибрационной чувствительности – она повышается или снижается.
Нарушения тазовых функций
Если патологические очаги локализуются в области определенных отделов спинного мозга, появляются урологические симптомы:
-
нарушение мочеиспускания – позывы учащаются или напротив, становятся реже, могут быть очень интенсивными и внезапными;
-
возникает чувство, что полностью опорожниться невозможно;
-
половая дисфункция у мужчин (снижение эрекции), отсутствие оргазмов у женщин.
Двигательные расстройства
Развиваются вне зависимости от стадии РС, сопровождаются обширным симптомокомплексом:
-
мелкая моторика ухудшается – элементарные действия, требующие сосредоточенности, осложняются (проблемы с завязыванием шнурков и т.д.);
-
возникает парез и судороги (в основном в ночное время) мышц;
-
рефлексы снижаются (симптом выявляется только при специализированном обследовании).
Эмоциональные, умственные нарушения
Неспецифичены при рассеянном склерозе. Однако с течением времени у пациента могут наблюдаться эмоциональные всплески, тревожность, агрессия, подавленность, проблемы с памятью.
РС отличается обширной локализацией патологических очагов, поэтому симптоматика может быть довольно разнообразной. В основном, проявляется группа определенных признаков, которые возникают все сразу либо чередуются. Следовательно, перед специалистом встает важная задача – объединить все в общую картину и провести комплексную диагностику, позволяющую установить точный диагноз.
Диагностика на ранних этапах
Первостепенная цель врача – осуществить неврологическое обследование, собрать анамнез, выполнить ряд тестов, которые помогут выявить рассеянный склероз у больного.
Диагностика включает в себя следующие методы:
-
МРТ-сканирование. Позволяет определить активные и неактивные поражения в головном и спинном мозге.
-
Визуальный тест вызванных потенциалов. Предполагает раздражение нервных путей для оценки электрической активности мозга.
-
Обследование позвоночника на предмет нарушений в спинномозговой жидкости дабы исключить инфекционный фактор.
-
Анализ крови. Проводится для дифференциации РС от иных заболеваний.
Последним шагом вынесения «вердикта» о наличии рассеянного склероза будет выявление демиелинизации в нескольких отделах головного и спинного мозга или зрительных нервов в разное время.
Демиелинизация – это процесс, при котором поражается миелиновая оболочка вокруг нервных волокон.
Записаться на диагностику
Прогноз при РС
Рассеянный склероз – хроническое заболевание, и вылечится от него навсегда в виду отсутствия единственно верного терапевтического способа, не представляется возможным. Тем не менее, реально значительно повысить качество жизни больного. Само по себе заболевание не представляет смертельной опасности, поэтому продолжительность жизни пациента с таким диагнозом, вполне может быть как у здорового человека.
Как показывает практика, в основном, лица, страдающие РС, живут примерно на 7 лет меньше, чем остальные. Такие люди умирают из-за других патологий (неполадки с сердцем, онкология). Кроме случаев тяжелой формы заболевания (что бывает крайне редко), прогноз достаточно положительный.
Однако стоит учитывать, что РС сопровождается рядом проблем, снижающих качество жизни. И хотя болезнь в большинстве ситуаций не приводит к инвалидности, она провоцирует болезненные ощущения, дискомфорт и другие неприятности.
Другой способ оценить прогноз при РС – анализ последствий инвалидности. По медицинским данным, 2/3 пациентов даже спустя 20 лет после оглашения диагноза не нуждаются в использовании инвалидной коляски. Некоторые люди прибегают к помощи костылей или палочки. Другие эксплуатируют коляску или электрический скутер с целью снизить нагрузку и легче переносить усталость.
Также прогноз напрямую зависит от разновидности заболевания. При первичной прогрессирующей стадии наблюдается стабильное уменьшение функций без периодов обострений и ремиссий. Иногда могут быть умеренные снижения функций – все зависит от конкретного случая.
Несмотря на то, что продолжительность жизни при рассеянном склерозе может быть нормальной, специалист не никогда не скажет точно, будет ли состояние больного ухудшаться или оно со временем улучшится. Такая неясность обусловлена невозможностью спрогнозировать, как дальше будет развиваться и протекать патология.
Меры первичной профилактики
Профилактические меры при РС нельзя назвать специфическими, поскольку они применимы и при других болезнях, однако при соблюдении нижеперечисленных рекомендаций, можно добиться хороших результатов:
-
Взять за правило выполнять физические нагрузки, но они не должны быть слишком интенсивными. Также очень важна систематичность.
-
Избегать любых стрессовых ситуаций, стараться не нервничать, контролировать свой эмоциональный фон.
-
Бросить курить и употреблять алкогольные напитки (даже в малых дозах).
-
Питаться разумно – не сидеть на диетах, но и не переедать. Есть как можно больше овощей, фруктов, зелени.
-
Делать все, дабы предупредить инфекционные заболевания – не общаться с больными людьми, при невозможности отказаться от контакта, надевать маску, избегать нахождения в людных местах, в период вспышек таких болезней.
-
Жить в хороших экологических условиях, если это неосуществимо, хотя бы как можно чаще и дольше находиться на природе.
-
Постоянно «тренировать» свой мозг посредством различных интеллектуальных занятий (освоение новых навыков, чтение книг, разгадывание кроссвордов, прохождение интересных тестов и т.д.)
Методы вторичной профилактики
Если случилось неизбежное, и врач огласил неутешительный диагноз, опускать руки и впадать в отчаяние не стоит ни в коем случае. Да, на данный момент рассеянный склероз не вылечивается до конца, но это вовсе не приговор. При правильном подходе и выполнении всех предписаний, данных специалистом, можно жить вполне нормальной жизнью.
Медицина не стоит на месте, и сегодня можно нивелировать большую часть проявлений РС, а также сильно отсрочить наступление обострений. Чтобы предупредить вероятность рецидива и ухудшение состояния, важно кардинально пересмотреть свой образ жизни, тщательно следить за здоровьем и свести к минимуму влияние факторов, способных послужить пусковым сигналом к развитию патологии. К примеру, нужно всегда помнить о режиме сна и отдыха, опасности эмоционального перенапряжения, беречь себя от агрессивного ультрафиолета и высоких температур, не прибегать к голоданию даже в лечебных целях.
Наши специалисты
Детский невролог
Стаж: 23 года
Врач-невролог
Стаж: 13 лет
Невролог, главный внештатный детский невролог МЗ СК, профессор, доктор медицинских наук, Заслуженный врач РФ
Стаж: 41 год
Врач-эпилептолог, главный внештатный эпилептолог МЗ СК, руководитель хозрасчетного эпилептологического центра
Стаж: 42 года
Лечение заболевания «Рассеянный склероз» в нашем центре
| group | Номенклатура | Номенклатура | Цена | Цена |
|---|