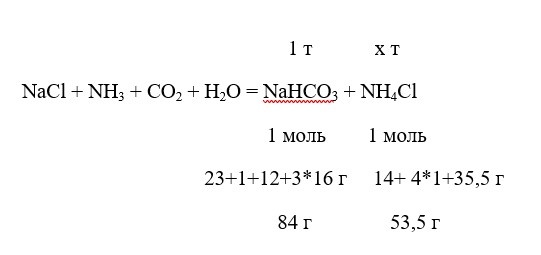From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Ammonium tetraoxosulfate (VI)[citation needed] |
|
| Other names
Ammonium sulphate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.076 |
| EC Number |
|
| E number | E517 (acidity regulators, …) |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
(NH4)2SO4 |
| Molar mass | 132.14 g/mol |
| Appearance | Fine white hygroscopic granules or crystals |
| Density | 1.77 g/cm3 |
| Melting point | 235 to 280 °C (455 to 536 °F; 508 to 553 K) (decomposes) |
|
Solubility in water |
70.6 g per 100 g water (0 °C) 74.4 g per 100 g water (20 °C) 103.8 g per 100 g water (100 °C)[1] |
| Solubility | Insoluble in acetone, alcohol and ether |
|
Magnetic susceptibility (χ) |
-67.0·10−6 cm3/mol |
|
Critical relative humidity |
79.2% (30 °C) |
| Structure | |
|
Crystal structure |
orthorhombic |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Warning |
|
Hazard statements |
H315, H319, H335 |
|
Precautionary statements |
P261, P264, P270, P271, P273, P280, P301+P312, P302+P352, P304+P340, P305+P351+P338, P312, P321, P330, P332+P313, P337+P313, P362, P391, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
2 1 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
2840 mg/kg, rat (oral) |
| Related compounds | |
|
Other anions |
Ammonium thiosulfate Ammonium sulfite Ammonium bisulfate Ammonium persulfate |
|
Other cations |
Sodium sulfate Potassium sulfate |
|
Related compounds |
Ammonium iron(II) sulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Ammonium sulfate (American English and international scientific usage; ammonium sulphate in British English); (NH4)2SO4, is an inorganic salt with a number of commercial uses. The most common use is as a soil fertilizer. It contains 21% nitrogen and 24% sulfur.
Uses[edit]
The primary use of ammonium sulfate is as a fertilizer for alkaline soils. In the soil the ammonium ion is released and forms a small amount of acid, lowering the pH balance of the soil, while contributing essential nitrogen for plant growth. The main disadvantage to the use of ammonium sulfate is its low nitrogen content relative to ammonium nitrate, which elevates transportation costs.[2]
It is also used as an agricultural spray adjuvant for water-soluble insecticides, herbicides, and fungicides. There, it functions to bind iron and calcium cations that are present in both well water and plant cells. It is particularly effective as an adjuvant for 2,4-D (amine), glyphosate, and glufosinate herbicides.
Laboratory use[edit]
Ammonium sulfate precipitation is a common method for protein purification by precipitation. As the ionic strength of a solution increases, the solubility of proteins in that solution decreases. Ammonium sulfate is extremely soluble in water due to its ionic nature, therefore it can «salt out» proteins by precipitation.[3] Due to the high dielectric constant of water, the dissociated salt ions being cationic ammonium and anionic sulfate are readily solvated within hydration shells of water molecules. The significance of this substance in the purification of compounds stems from its ability to become more so hydrated compared to relatively more nonpolar molecules and so the desirable nonpolar molecules coalesce and precipitate out of the solution in a concentrated form. This method is called salting out and necessitates the use of high salt concentrations that can reliably dissolve in the aqueous mixture. The percentage of the salt used is in comparison to the maximal concentration of the salt in the mixture can dissolve. As such, although high concentrations are needed for the method to work adding an abundance of the salt, over 100%, can also oversaturate the solution, therefore, contaminating the nonpolar precipitate with salt precipitate.[4] A high salt concentration, which can be achieved by adding or increasing the concentration of ammonium sulfate in a solution, enables protein separation based on a decrease in protein solubility; this separation may be achieved by centrifugation. Precipitation by ammonium sulfate is a result of a reduction in solubility rather than protein denaturation, thus the precipitated protein can be solubilized through the use of standard buffers.[5] Ammonium sulfate precipitation provides a convenient and simple means to fractionate complex protein mixtures.[6]
In the analysis of rubber lattices, volatile fatty acids are analyzed by precipitating rubber with a 35% ammonium sulfate solution, which leaves a clear liquid from which volatile fatty acids are regenerated with sulfuric acid and then distilled with steam. Selective precipitation with ammonium sulfate, opposite to the usual precipitation technique which uses acetic acid, does not interfere with the determination of volatile fatty acids.[7]
Food additive[edit]
As a food additive, ammonium sulfate is considered generally recognized as safe (GRAS) by the U.S. Food and Drug Administration,[8] and in the European Union it is designated by the E number E517. It is used as an acidity regulator in flours and breads.[9][10][11]
Other uses[edit]
In the treatment of drinking water, ammonium sulfate is used in combination with chlorine to generate monochloramine for disinfection.[12]
Ammonium sulfate is used on a small scale in the preparation of other ammonium salts, especially ammonium persulfate.
Ammonium sulfate is listed as an ingredient for many United States vaccines per the Centers for Disease Control.[13]
A saturated solution of ammonium sulfate in heavy water (D2O) is used as an external standard in sulfur (33S) NMR spectroscopy with shift value of 0 ppm.
Ammonium sulfate has also been used in flame retardant compositions acting much like diammonium phosphate. As a flame retardant, it increases the combustion temperature of the material, decreases maximum weight loss rates, and causes an increase in the production of residue or char.[14] Its flame retardant efficacy can be enhanced by blending it with ammonium sulfamate.[citation needed] It has been used in aerial firefighting.
Ammonium sulfate has been used as a wood preservative, but due to its hygroscopic nature, this use has been largely discontinued because of associated problems with metal fastener corrosion, dimensional instability, and finish failures.
Preparation[edit]
Ammonium sulfate is made by treating ammonia with sulfuric acid:
- 2 NH3 + H2SO4 → (NH4)2SO4
A mixture of ammonia gas and water vapor is introduced into a reactor that contains a saturated solution of ammonium sulfate and about 2 to 4% of free sulfuric acid at 60 °C. Concentrated sulfuric acid is added to keep the solution acidic, and to retain its level of free acid. The heat of reaction keeps reactor temperature at 60 °C. Dry, powdered ammonium sulfate may be formed by spraying sulfuric acid into a reaction chamber filled with ammonia gas. The heat of reaction evaporates all water present in the system, forming a powdery salt. Approximately 6,000 million tons were produced in 1981.[2]
Ammonium sulfate also is manufactured from gypsum (CaSO4·2H2O). Finely divided gypsum is added to an ammonium carbonate solution. Calcium carbonate precipitates as a solid, leaving ammonium sulfate in the solution.
- (NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3
Ammonium sulfate occurs naturally as the rare mineral mascagnite in volcanic fumaroles and due to coal fires on some dumps.[15]
Properties[edit]
Ammonium sulfate becomes ferroelectric at temperatures below –49.5 °C. At room temperature it crystallises in the orthorhombic system, with cell sizes of a = 7.729 Å, b = 10.560 Å, c = 5.951 Å. When chilled into the ferrorelectric state, the symmetry of the crystal changes to space group Pna21.[16]
Reactions[edit]
Ammonium sulfate decomposes upon heating above 250 °C (482 °F), first forming ammonium bisulfate. Heating at higher temperatures results in decomposition into ammonia, nitrogen, sulfur dioxide, and water.[17]
As a salt of a strong acid (H2SO4) and weak base (NH3), its solution is acidic; pH of 0.1 M solution is 5.5. In aqueous solution the reactions are those of NH4+ and SO4−2 ions. For example, addition of barium chloride, precipitates out barium sulfate. The filtrate on evaporation yields ammonium chloride.
Ammonium sulfate forms many double salts (ammonium metal sulfates) when its solution is mixed with equimolar solutions of metal sulfates and the solution is slowly evaporated. With trivalent metal ions, alums such as ferric ammonium sulfate are formed. Double metal sulfates include ammonium cobaltous sulfate, ferrous diammonium sulfate, ammonium nickel sulfate which are known as Tutton’s salts and ammonium ceric sulfate.[2] Anhydrous double sulfates of ammonium also occur in the Langbeinites family. The ammonia produced has a pungent smell and is toxic.
Airborne particles of evaporated ammonium sulfate comprise approximately 30% of fine particulate pollution worldwide.[18]
Legislation and control[edit]
In November 2009, a ban on ammonium sulfate, ammonium nitrate and calcium ammonium nitrate fertilizers was imposed in the former Malakand Division—comprising the Upper Dir, Lower Dir, Swat, Chitral and Malakand districts of the North West Frontier Province (NWFP) of Pakistan, by the NWFP government, following reports that they were used by militants to make explosives. In January 2010, these substances were also banned in Afghanistan for the same reason.[19]
See also[edit]
- Ammonium sulfate precipitation
References[edit]
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ a b c Karl-Heinz Zapp «Ammonium Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243
- ^ Duong-Ly, Krisna C.; Gabelli, Sandra B. (2014-01-01). «Salting out of Proteins Using Ammonium Sulfate Precipitation». In Lorsch, Jon (ed.). Methods in Enzymology. Laboratory Methods in Enzymology: Protein Part C. Vol. 541. Academic Press. pp. 85–94. doi:10.1016/B978-0-12-420119-4.00007-0. ISBN 9780124201194. PMID 24674064.
- ^ Duong-Ly, Krisna C.; Gabelli, Sandra B. (2014-01-01). «Salting out of proteins using ammonium sulfate precipitation». Methods in Enzymology. 541: 85–94. doi:10.1016/B978-0-12-420119-4.00007-0. ISBN 9780124201194. ISSN 1557-7988. PMID 24674064.
- ^ Wingfield, Paul T. (2017-05-05). «Protein Precipitation Using Ammonium Sulfate». Current Protocols in Protein Science. 13 (1): A.3F.1–8. doi:10.1002/0471140864.psa03fs13. ISBN 978-0471140863. ISSN 1934-3655. PMC 4817497. PMID 18429073.
- ^ «Ammonium Sulfate Calculator». EnCor Biotechnology Inc. 2013. Archived from the original on January 26, 2016. Retrieved March 2, 2013.
- ^ ASTM Standard Specification for Rubber Concentrates D 1076-06
- ^ «Select Committee on GRAS Substances (SCOGS) Opinion: Ammonium sulfate». U.S. Food and Drug Administration. August 16, 2011. Archived from the original on February 11, 2012. Retrieved March 2, 2013.
- ^ «Panera Bread › Menu & Nutrition › Nutrition Information Profile». Archived from the original on August 19, 2009. Retrieved March 2, 2013.
- ^ «Official Subway Restaurants U.S. Products Ingredients Guide». Archived from the original on August 14, 2011. Retrieved March 2, 2013.
- ^ Sarah Klein (May 14, 2012). «Gross Ingredients In Processed Foods». The Huffington Post. Archived from the original on May 18, 2012. Retrieved March 2, 2013.
- ^ McCool, Pat. «Feeding Ammonium Sulfate to Form Combined Chlorine Residual» (PDF). The Kansas Lifeline. Kansas Rural Water Association. Archived (PDF) from the original on 6 June 2019. Retrieved 6 June 2019.
- ^ «Vaccine Excipient & Media Summary» (PDF). Centers for Disease Control and Prevention (CDC). February 2012. Archived (PDF) from the original on February 5, 2011. Retrieved March 2, 2013.
- ^ George, C. W.; Susott, R. A. (April 1971). «Effects of Ammonium Phosphate and Sulfate on the Pyrolysis and Combustion of Cellulose». Research Paper INT-90. Intermountain Forest and Range Experiment Station: USDA Forest Service.
- ^ «Mascagnite». Mindat. Archived from the original on January 19, 2013. Retrieved March 2, 2013.
- ^ Okaya, Y.; K. Vedam; R. Pepinsky (1958). «Non-isomorphism of ferroelectric phases of ammonium sulfate and ammonium fluoberyllate». Acta Crystallographica. 11 (4): 307. doi:10.1107/s0365110x58000803. ISSN 0365-110X.
- ^ Liu Ke-wei, Chen Tian-lang (2002). «Studies on the thermal decomposition of ammonium sulfate». Chemical Research and Application (in Chinese). 14 (6). doi:10.3969/j.issn.1004-1656.2002.06.038.
- ^ «Where Does Air Pollution Come From?». www.purakamasks.com. 2019-02-15. Archived from the original on 2019-02-20. Retrieved 2019-02-20.
- ^ «PAKISTAN: ‘Anti-terrorist’ fertilizer ban hinders farmers». IRIN Humanitarian News and Analysis. 2010. Archived from the original on May 13, 2013. Retrieved April 24, 2013.
Further reading[edit]
- Properties: UNIDO and International Fertilizer Development Center (1998), Fertilizer Manual, Kluwer Academic Publishers, ISBN 0-7923-5032-4.
External links[edit]
- Ammonium sulfate in the Pesticide Properties DataBase (PPDB)
- Calculators: surface tensions, and densities, molarities and molalities of aqueous ammonium sulfate
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Ammonium tetraoxosulfate (VI)[citation needed] |
|
| Other names
Ammonium sulphate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.076 |
| EC Number |
|
| E number | E517 (acidity regulators, …) |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
(NH4)2SO4 |
| Molar mass | 132.14 g/mol |
| Appearance | Fine white hygroscopic granules or crystals |
| Density | 1.77 g/cm3 |
| Melting point | 235 to 280 °C (455 to 536 °F; 508 to 553 K) (decomposes) |
|
Solubility in water |
70.6 g per 100 g water (0 °C) 74.4 g per 100 g water (20 °C) 103.8 g per 100 g water (100 °C)[1] |
| Solubility | Insoluble in acetone, alcohol and ether |
|
Magnetic susceptibility (χ) |
-67.0·10−6 cm3/mol |
|
Critical relative humidity |
79.2% (30 °C) |
| Structure | |
|
Crystal structure |
orthorhombic |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Warning |
|
Hazard statements |
H315, H319, H335 |
|
Precautionary statements |
P261, P264, P270, P271, P273, P280, P301+P312, P302+P352, P304+P340, P305+P351+P338, P312, P321, P330, P332+P313, P337+P313, P362, P391, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
2 1 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
2840 mg/kg, rat (oral) |
| Related compounds | |
|
Other anions |
Ammonium thiosulfate Ammonium sulfite Ammonium bisulfate Ammonium persulfate |
|
Other cations |
Sodium sulfate Potassium sulfate |
|
Related compounds |
Ammonium iron(II) sulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Ammonium sulfate (American English and international scientific usage; ammonium sulphate in British English); (NH4)2SO4, is an inorganic salt with a number of commercial uses. The most common use is as a soil fertilizer. It contains 21% nitrogen and 24% sulfur.
Uses[edit]
The primary use of ammonium sulfate is as a fertilizer for alkaline soils. In the soil the ammonium ion is released and forms a small amount of acid, lowering the pH balance of the soil, while contributing essential nitrogen for plant growth. The main disadvantage to the use of ammonium sulfate is its low nitrogen content relative to ammonium nitrate, which elevates transportation costs.[2]
It is also used as an agricultural spray adjuvant for water-soluble insecticides, herbicides, and fungicides. There, it functions to bind iron and calcium cations that are present in both well water and plant cells. It is particularly effective as an adjuvant for 2,4-D (amine), glyphosate, and glufosinate herbicides.
Laboratory use[edit]
Ammonium sulfate precipitation is a common method for protein purification by precipitation. As the ionic strength of a solution increases, the solubility of proteins in that solution decreases. Ammonium sulfate is extremely soluble in water due to its ionic nature, therefore it can «salt out» proteins by precipitation.[3] Due to the high dielectric constant of water, the dissociated salt ions being cationic ammonium and anionic sulfate are readily solvated within hydration shells of water molecules. The significance of this substance in the purification of compounds stems from its ability to become more so hydrated compared to relatively more nonpolar molecules and so the desirable nonpolar molecules coalesce and precipitate out of the solution in a concentrated form. This method is called salting out and necessitates the use of high salt concentrations that can reliably dissolve in the aqueous mixture. The percentage of the salt used is in comparison to the maximal concentration of the salt in the mixture can dissolve. As such, although high concentrations are needed for the method to work adding an abundance of the salt, over 100%, can also oversaturate the solution, therefore, contaminating the nonpolar precipitate with salt precipitate.[4] A high salt concentration, which can be achieved by adding or increasing the concentration of ammonium sulfate in a solution, enables protein separation based on a decrease in protein solubility; this separation may be achieved by centrifugation. Precipitation by ammonium sulfate is a result of a reduction in solubility rather than protein denaturation, thus the precipitated protein can be solubilized through the use of standard buffers.[5] Ammonium sulfate precipitation provides a convenient and simple means to fractionate complex protein mixtures.[6]
In the analysis of rubber lattices, volatile fatty acids are analyzed by precipitating rubber with a 35% ammonium sulfate solution, which leaves a clear liquid from which volatile fatty acids are regenerated with sulfuric acid and then distilled with steam. Selective precipitation with ammonium sulfate, opposite to the usual precipitation technique which uses acetic acid, does not interfere with the determination of volatile fatty acids.[7]
Food additive[edit]
As a food additive, ammonium sulfate is considered generally recognized as safe (GRAS) by the U.S. Food and Drug Administration,[8] and in the European Union it is designated by the E number E517. It is used as an acidity regulator in flours and breads.[9][10][11]
Other uses[edit]
In the treatment of drinking water, ammonium sulfate is used in combination with chlorine to generate monochloramine for disinfection.[12]
Ammonium sulfate is used on a small scale in the preparation of other ammonium salts, especially ammonium persulfate.
Ammonium sulfate is listed as an ingredient for many United States vaccines per the Centers for Disease Control.[13]
A saturated solution of ammonium sulfate in heavy water (D2O) is used as an external standard in sulfur (33S) NMR spectroscopy with shift value of 0 ppm.
Ammonium sulfate has also been used in flame retardant compositions acting much like diammonium phosphate. As a flame retardant, it increases the combustion temperature of the material, decreases maximum weight loss rates, and causes an increase in the production of residue or char.[14] Its flame retardant efficacy can be enhanced by blending it with ammonium sulfamate.[citation needed] It has been used in aerial firefighting.
Ammonium sulfate has been used as a wood preservative, but due to its hygroscopic nature, this use has been largely discontinued because of associated problems with metal fastener corrosion, dimensional instability, and finish failures.
Preparation[edit]
Ammonium sulfate is made by treating ammonia with sulfuric acid:
- 2 NH3 + H2SO4 → (NH4)2SO4
A mixture of ammonia gas and water vapor is introduced into a reactor that contains a saturated solution of ammonium sulfate and about 2 to 4% of free sulfuric acid at 60 °C. Concentrated sulfuric acid is added to keep the solution acidic, and to retain its level of free acid. The heat of reaction keeps reactor temperature at 60 °C. Dry, powdered ammonium sulfate may be formed by spraying sulfuric acid into a reaction chamber filled with ammonia gas. The heat of reaction evaporates all water present in the system, forming a powdery salt. Approximately 6,000 million tons were produced in 1981.[2]
Ammonium sulfate also is manufactured from gypsum (CaSO4·2H2O). Finely divided gypsum is added to an ammonium carbonate solution. Calcium carbonate precipitates as a solid, leaving ammonium sulfate in the solution.
- (NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3
Ammonium sulfate occurs naturally as the rare mineral mascagnite in volcanic fumaroles and due to coal fires on some dumps.[15]
Properties[edit]
Ammonium sulfate becomes ferroelectric at temperatures below –49.5 °C. At room temperature it crystallises in the orthorhombic system, with cell sizes of a = 7.729 Å, b = 10.560 Å, c = 5.951 Å. When chilled into the ferrorelectric state, the symmetry of the crystal changes to space group Pna21.[16]
Reactions[edit]
Ammonium sulfate decomposes upon heating above 250 °C (482 °F), first forming ammonium bisulfate. Heating at higher temperatures results in decomposition into ammonia, nitrogen, sulfur dioxide, and water.[17]
As a salt of a strong acid (H2SO4) and weak base (NH3), its solution is acidic; pH of 0.1 M solution is 5.5. In aqueous solution the reactions are those of NH4+ and SO4−2 ions. For example, addition of barium chloride, precipitates out barium sulfate. The filtrate on evaporation yields ammonium chloride.
Ammonium sulfate forms many double salts (ammonium metal sulfates) when its solution is mixed with equimolar solutions of metal sulfates and the solution is slowly evaporated. With trivalent metal ions, alums such as ferric ammonium sulfate are formed. Double metal sulfates include ammonium cobaltous sulfate, ferrous diammonium sulfate, ammonium nickel sulfate which are known as Tutton’s salts and ammonium ceric sulfate.[2] Anhydrous double sulfates of ammonium also occur in the Langbeinites family. The ammonia produced has a pungent smell and is toxic.
Airborne particles of evaporated ammonium sulfate comprise approximately 30% of fine particulate pollution worldwide.[18]
Legislation and control[edit]
In November 2009, a ban on ammonium sulfate, ammonium nitrate and calcium ammonium nitrate fertilizers was imposed in the former Malakand Division—comprising the Upper Dir, Lower Dir, Swat, Chitral and Malakand districts of the North West Frontier Province (NWFP) of Pakistan, by the NWFP government, following reports that they were used by militants to make explosives. In January 2010, these substances were also banned in Afghanistan for the same reason.[19]
See also[edit]
- Ammonium sulfate precipitation
References[edit]
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ a b c Karl-Heinz Zapp «Ammonium Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243
- ^ Duong-Ly, Krisna C.; Gabelli, Sandra B. (2014-01-01). «Salting out of Proteins Using Ammonium Sulfate Precipitation». In Lorsch, Jon (ed.). Methods in Enzymology. Laboratory Methods in Enzymology: Protein Part C. Vol. 541. Academic Press. pp. 85–94. doi:10.1016/B978-0-12-420119-4.00007-0. ISBN 9780124201194. PMID 24674064.
- ^ Duong-Ly, Krisna C.; Gabelli, Sandra B. (2014-01-01). «Salting out of proteins using ammonium sulfate precipitation». Methods in Enzymology. 541: 85–94. doi:10.1016/B978-0-12-420119-4.00007-0. ISBN 9780124201194. ISSN 1557-7988. PMID 24674064.
- ^ Wingfield, Paul T. (2017-05-05). «Protein Precipitation Using Ammonium Sulfate». Current Protocols in Protein Science. 13 (1): A.3F.1–8. doi:10.1002/0471140864.psa03fs13. ISBN 978-0471140863. ISSN 1934-3655. PMC 4817497. PMID 18429073.
- ^ «Ammonium Sulfate Calculator». EnCor Biotechnology Inc. 2013. Archived from the original on January 26, 2016. Retrieved March 2, 2013.
- ^ ASTM Standard Specification for Rubber Concentrates D 1076-06
- ^ «Select Committee on GRAS Substances (SCOGS) Opinion: Ammonium sulfate». U.S. Food and Drug Administration. August 16, 2011. Archived from the original on February 11, 2012. Retrieved March 2, 2013.
- ^ «Panera Bread › Menu & Nutrition › Nutrition Information Profile». Archived from the original on August 19, 2009. Retrieved March 2, 2013.
- ^ «Official Subway Restaurants U.S. Products Ingredients Guide». Archived from the original on August 14, 2011. Retrieved March 2, 2013.
- ^ Sarah Klein (May 14, 2012). «Gross Ingredients In Processed Foods». The Huffington Post. Archived from the original on May 18, 2012. Retrieved March 2, 2013.
- ^ McCool, Pat. «Feeding Ammonium Sulfate to Form Combined Chlorine Residual» (PDF). The Kansas Lifeline. Kansas Rural Water Association. Archived (PDF) from the original on 6 June 2019. Retrieved 6 June 2019.
- ^ «Vaccine Excipient & Media Summary» (PDF). Centers for Disease Control and Prevention (CDC). February 2012. Archived (PDF) from the original on February 5, 2011. Retrieved March 2, 2013.
- ^ George, C. W.; Susott, R. A. (April 1971). «Effects of Ammonium Phosphate and Sulfate on the Pyrolysis and Combustion of Cellulose». Research Paper INT-90. Intermountain Forest and Range Experiment Station: USDA Forest Service.
- ^ «Mascagnite». Mindat. Archived from the original on January 19, 2013. Retrieved March 2, 2013.
- ^ Okaya, Y.; K. Vedam; R. Pepinsky (1958). «Non-isomorphism of ferroelectric phases of ammonium sulfate and ammonium fluoberyllate». Acta Crystallographica. 11 (4): 307. doi:10.1107/s0365110x58000803. ISSN 0365-110X.
- ^ Liu Ke-wei, Chen Tian-lang (2002). «Studies on the thermal decomposition of ammonium sulfate». Chemical Research and Application (in Chinese). 14 (6). doi:10.3969/j.issn.1004-1656.2002.06.038.
- ^ «Where Does Air Pollution Come From?». www.purakamasks.com. 2019-02-15. Archived from the original on 2019-02-20. Retrieved 2019-02-20.
- ^ «PAKISTAN: ‘Anti-terrorist’ fertilizer ban hinders farmers». IRIN Humanitarian News and Analysis. 2010. Archived from the original on May 13, 2013. Retrieved April 24, 2013.
Further reading[edit]
- Properties: UNIDO and International Fertilizer Development Center (1998), Fertilizer Manual, Kluwer Academic Publishers, ISBN 0-7923-5032-4.
External links[edit]
- Ammonium sulfate in the Pesticide Properties DataBase (PPDB)
- Calculators: surface tensions, and densities, molarities and molalities of aqueous ammonium sulfate
АММОНИЯ СУЛЬФАТ
- АММОНИЯ СУЛЬФАТ
-
(NH4)2SO4, бесцв. кристаллы с ор-торомбич. решеткой ( а =0,7782 нм, b= 5993 нм, с Ч= 1,0636 нм, z = 4, пространств, группа Ршгш); плотн. 1,766 г/см 3; С p
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Смотреть что такое «АММОНИЯ СУЛЬФАТ» в других словарях:
-
АММОНИЯ СУЛЬФАТ — (NH4)2SO4, бесцветные кристаллы. Хорошо растворяется в воде. Применяют как удобрение, в производстве вискозного волокна … Большой Энциклопедический словарь
-
аммония сульфат — (NH4)2SO4, бесцветные кристаллы. Хорошо растворяется в воде. Применяют как удобрение, в производстве вискозного волокна. * * * АММОНИЯ СУЛЬФАТ АММОНИЯ СУЛЬФАТ, (NH4)2SO4, бесцветные кристаллы. Хорошо растворяется в воде. Применяют как удобрение,… … Энциклопедический словарь
-
аммония сульфат — amonio sulfatas statusas T sritis chemija formulė (NH₄)₂SO₄ atitikmenys: angl. ammonium sulfate rus. аммоний сернокислый; аммония сульфат ryšiai: sinonimas – diamonio tetraoksosulfatas … Chemijos terminų aiškinamasis žodynas
-
Аммония сульфат — сернокислый аммоний, (NH4)2SO4, соль, бесцветные кристаллы с плотностью 1770 кг/м3. При нагревании до 357°С частично разлагается с выделением аммиака и образованием кислого А. с., последний плавится при 251 °С, кипит при 490°С (без… … Большая советская энциклопедия
-
Аммония сульфат — … Википедия
-
АММОНИЯ СУЛЬФАТ — сернокислый аммоний, (NH4) 2SO4, аммиачное азотное удобрение. Кристаллич. в во, физиологически кислое, слабо гигроскопичное, хорошо растворяется в воде, содержит 20,5 21,5% N. Получают при соединении аммиака с серной к той. Применяют на… … Сельско-хозяйственный энциклопедический словарь
-
аммония сульфат — аммония сульфат, сернокислый аммоний, (NH4)2SO4, аммиачное азотное удобрение. Кристаллическое вещество, физиологически кислое, слабо гигроскопичное, хорошо растворяется в воде, содержит 20,5—21,5% N. Получают при соединении аммиака с серной… … Сельское хозяйство. Большой энциклопедический словарь
-
Сульфат аммония — Общие … Википедия
-
Сульфат ванадила — Общие … Википедия
-
Сульфат магния — Общие Систематическое наименование Сульфат магния Традиционные названия Сернокислый магния, эпсомская соль Химическая формула MgSO4 Физические свойства Мол … Википедия
 |
|
 |
|
| Имена | |
|---|---|
| Название IUPAC Тетраоксосульфат аммония (VI) | |
| Другие имена Сульфат аммония. Сульфат аммония (2: 1). Сульфат диаммония. Диаммониевая соль серной кислоты. Маскагнит. Actamaster. Доламин | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.076 |
| Номер ЕС |
|
| Номер E | E517 (регуляторы кислотности,…) |
| KEGG |
|
| PubChem CID |
|
| UNII |
|
| CompTox Dashboard (EPA ) |
|
InChI
|
|
УЛЫБКА
|
|
| Свойства | |
| Химическая формула | (NH 4)2SO4 |
| Мол. масса | 132,14 г / моль |
| Внешний вид | Мелкие белые гигроскопичные гранулы или кристаллы |
| Плотность | 1,77 г / см |
| Температура плавления | От 235 до 280 ° C (от 455 до 536 ° F; От 508 до 553 K) (разлагается) |
| Растворимость в воде | 70,6 г на 100 г воды (0 ° C). 74,4 г на 100 г воды (20 ° C). 103,8 г на 100 г вода (100 ° C) |
| Растворимость | Не растворим в ацетоне, спирте и эфире |
| Магнитная восприимчивость (χ) | — 67,0 · 10 см / моль |
| Критическая относительная влажность | 79,2% (30 ° C) |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Предупреждение |
| Предупреждения об опасности GHS | H315, H319, H335 |
| Меры предосторожности GHS | P261, P264, P270, P271, P273, P280, P301 + 312, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P330, P332 + 313, P337 + 313, P362, P391, P403 + 233, P405, P501 |
| NFPA 704 (огненный алмаз) |  1 2 0 1 2 0 |
| Температура вспышки | Невоспламеняющийся |
| Смертельная доза или концентрация (LD, LC): | |
| LD50(средняя доза ) | 2840 мг / кг, ra t (перорально) |
| Родственные соединения | |
| Другие анионы | Тиосульфат аммония. Сульфит аммония. Бисульфат аммония. Персульфат аммония |
| Другие катионы | Сульфат натрия. Сульфат калия |
| Родственные соединения | Сульфат железа (II) аммония |
| Если не указано иное, данные приводятся для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Сульфат аммония (американский английский и международное научное использование; сульфат аммония в британском английском ); (NH 4)2SO4, неорганическая соль, имеющая ряд коммерческих применений. Чаще всего используется в качестве почвенного удобрения. Она содержит 21% азота и 24% сера.
Содержание
- 1 Использование
- 1.1 Лабораторное использование
- 1.2 Пищевая добавка
- 1.3 Другое использование
- 2 Приготовление
- 3 Свойства
- 4 Реакции
- 5 Законодательство и контроль
- 6 См. Также
- 7 Ссылки
- 8 Дополнительная литература
- 9 Внешние ссылки
Использует
В основном сульфат аммония используется в качестве удобрения для щелочные почвы. В почве выделяется ион аммония и образует небольшое количество кислоты, снижая pH баланс почвы, обеспечивая при этом необходимый азот для роста растений. Основным недостатком использования сульфата аммония является его низкое содержание азота по сравнению с нитратом аммония, что увеличивает транспортные расходы.
Он также используется как сельскохозяйственный спрей адъювант для водорастворимых инсектицидов, гербицидов и фунгициды. Там он связывает катионы железа и кальция, которые присутствуют как в колодезной воде, так и в клетках растений. Он особенно эффективен в качестве адъюванта для гербицидов 2,4-D (амин), глифосат и глюфосинат.
Использование в лабораториях
Осаждение сульфатом аммония является распространенным методом очистки белка осаждением. По мере увеличения ионной силы раствора растворимость белков в этом растворе уменьшается. Сульфат аммония чрезвычайно растворим в воде из-за его ионной природы, поэтому он может «высолить» белки путем осаждения. Из-за высокой диэлектрической проницаемости воды диссоциированные солевые ионы, представляющие собой катионный аммоний и анионный сульфат, легко сольватируются в гидратных оболочках молекул воды. Значение этого вещества в очистке соединений проистекает из его способности становиться более гидратированными по сравнению с относительно большим количеством неполярных молекул, и поэтому желаемые неполярные молекулы объединяются и выпадают в осадок из раствора в концентрированной форме. Этот метод называется высаливанием и требует использования высоких концентраций соли, которая может надежно растворяться в водной смеси. Процент используемой соли сравнивается с максимальной концентрацией соли в смеси, которая может растворяться. Таким образом, хотя для того, чтобы метод работал, требуются высокие концентрации, добавление большого количества соли, более 100%, также может перенасыщать раствор, следовательно, загрязнять неполярный осадок солевым осадком. Высокая концентрация соли, которая может быть достигнута путем добавления или увеличения концентрации сульфата аммония в растворе, позволяет разделить белок на основе снижения растворимости белка; это разделение может быть достигнуто центрифугированием. Осаждение сульфатом аммония является результатом снижения растворимости, а не денатурации белка, поэтому осажденный белок может быть солюбилизирован с использованием стандартных буферов. Осаждение сульфатом аммония обеспечивает удобный и простой способ фракционирования сложных белковых смесей.
При анализе решеток каучука летучие жирные кислоты анализируются путем осаждения каучука 35% -ным раствором сульфата аммония, который оставляет прозрачную жидкость из летучие жирные кислоты регенерируются серной кислотой, а затем перегоняются паром. Селективное осаждение сульфатом аммония, в отличие от обычного метода осаждения с использованием уксусной кислоты, не мешает определению летучих жирных кислот.
Пищевая добавка
В качестве пищевой добавки сульфат аммония является считается общепризнанным безопасным (GRAS) Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, а в Европейском Союзе он обозначается номером E E517. Он используется как регулятор кислотности в муке и хлебе.
Другое применение
В очистке питьевой воды, сульфат аммония используется в сочетании с хлором для получения монохлорамина для дезинфекции.
Сульфат аммония используется в небольших масштабах при получении других солей аммония, особенно персульфат аммония.
Сульфат аммония указан в качестве ингредиента для многих вакцин в США согласно Центру по контролю за заболеваниями.
Используется насыщенный раствор сульфата аммония в тяжелой воде (D2O) в качестве внешнего стандарта в спектроскопии ЯМР серы (S) со значением сдвига 0 ppm.
Сульфат аммония также использовался в огнестойких композициях, действующих подобно диаммонийфосфату. В качестве антипирена он увеличивает температуру горения материала, снижает максимальную скорость потери веса и вызывает увеличение образования остатков или полукокса. Его огнезащитная эффективность может быть повышена путем смешивания его с сульфаматом аммония. Он использовался в тушении пожаров с воздуха.
Сульфат аммония использовался в качестве консерванта для древесины, но из-за его гигроскопичности его использование было в значительной степени прекращено из-за связанных с этим проблем с коррозией металлических креплений, нестабильностью размеров и отделкой неудачи.
Получение
Сульфат аммония получают путем обработки аммиака, часто как побочного продукта коксовых печей, серной кислотой :
- 2 NH 3 + H 2SO4→ (NH 4)2SO4
Смесь газообразного аммиака и водяного пара вводится в реактор, содержащий насыщенный раствор сульфата аммония и примерно от 2 до 4% свободная серная кислота при 60 ° C.Концентрированная серная кислота добавляется для поддержания кислотности раствора и сохранения в нем уровня свободной кислоты. Теплота реакции поддерживает температуру реактора на уровне 60 ° C.Сухой порошкообразный сульфат аммония может быть образован распылением серной кислоты в реакционную камеру, заполненную газообразным аммиаком. Теплота реакции испаряет всю воду, присутствующую в системе, с образованием порошкообразной соли. В 1981 году было произведено около 6000 млн тонн.
Сульфат аммония также производится из гипса (CaSO 4 · 2H 2 O). Мелкодисперсный гипс добавляется к карбонату аммония раствор. карбонат кальция е выпадает в осадок в виде твердого вещества, оставляя сульфат аммония в растворе.
- (NH 4)2CO3+ CaSO 4 → (NH 4)2SO4+ CaCO 3
Сульфат аммония встречается в природе как редкий минерал маскагнит в вулканических фумаролах и из-за угольных пожаров на некоторых отвалах.
Свойства
Сульфат аммония становится сегнетоэлектрическим при температурах ниже -49,5 ° C.При комнатной температуре он кристаллизуется в орторомбическая система с размерами ячеек a = 7,729 Å, b = 10,560 Å, c = 5,951 Å. При охлаждении до сегнетоэлектрического состояния симметрия кристалла изменяется на пространственная группа Pna2 1.
Реакции
Сульфат аммония разлагается при нагревании выше 250 ° C, сначала образуя бисульфат аммония. Нагревание при более высоких температурах приводит к разложению на аммиак, азот, диоксид серы и вода.
В виде соли сильной кислоты (H 2SO4) и слабого основания (NH 3), его раствор кислый; pH 0,1 М раствора составляет 5,5. В водном растворе протекают реакции NH 4 и SO 4 io. нс Например, добавление хлорида бария приводит к осаждению сульфата бария. Фильтрат при выпаривании дает хлорид аммония.
Сульфат аммония образует множество двойных солей (сульфатов металла аммония), когда его раствор смешивают с эквимолярными растворами сульфатов металлов и раствор медленно выпаривают. С ионами трехвалентного металла образуются квасцы, такие как сульфат трехвалентного аммония. Двойные сульфаты металлов включают сульфат кобальта аммония, сульфат диаммония железа, сульфат никеля аммония, которые известны как соли Туттона и сульфат церия аммония. Безводные двойные сульфаты аммония также встречаются в семействе Langbeinites.
Перенесенные в воздух частицы испарившегося сульфата аммония составляют примерно 30% всех загрязняющих веществ в виде мелких твердых частиц во всем мире.
Законодательство и контроль
В ноябре 2009 г. был введен запрет на сульфат аммония, аммиачная селитра и кальций-аммиачная селитра удобрения вводились в бывшем Малакандском округе, включающем Верхний Директ, Нижний Директор, Сват, Читрал и Малаканд районы Северо-Западной пограничной провинции (СЗПП) Пакистан, Правительство СЗПП после сообщений о том, что они использовались боевиками для изготовления взрывчатки. В январе 2010 года эти вещества также были запрещены в Афганистане по той же причине.
См. Также
- Осаждение сульфатом аммония
Ссылки
Дополнительная литература
- Свойства: UNIDO и Международный центр разработки удобрений (1998), Руководство по удобрениям, Kluwer Academic Publishers, ISBN 0-7923-5032-4.
Внешние ссылки
- Сульфат аммония в базе данных свойств пестицидов (PPDB)
- Калькуляторы: поверхностное натяжение и плотности, молярности и моляльности водного раствора сульфата аммония
.
Значение словосочетания «сульфат аммония»

- Сульфа́т аммо́ния (аммоний серноки́слый, лат. ammonium sulphate), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Источник: Википедия
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: перистальтический — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «сульфат»
Ассоциации к слову «аммоний»
Синонимы к словосочетанию «сульфат аммония»
Предложения со словосочетанием «сульфат аммония»
- К недостаткам сульфата аммония можно отнести его свойство слёживаться при хранении.
- Сульфат аммония обычно применяют на почвах с избыточным увлажнением.
- Также подземные жители не любят внесения сульфата аммония и аммиачной селитры под весеннюю перекопку.
- (все предложения)
Цитаты из русской классики со словосочетанием «сульфат аммония»
- И тут же, хотя никто и не требовал от меня в одиночестве у лампы ипекакуанки, я малодушно перелистал рецептурный справочник, проверил ипекакуанку, а попутно прочитал машинально и о том, что существует на свете какой-то «инсипин». Он не кто иной, как «сульфат эфира хининдигликолевой кислоты»… Оказывается, вкуса хинина не имеет! Но зачем он? И как его выписать? Он что, порошок? Черт его возьми!
- (все
цитаты из русской классики)
Понятия со словосочетанием «сульфат аммония»
-
Сульфа́т аммо́ния (аммоний серноки́слый, лат. ammonium sulphate), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность…
- (все понятия)
Отправить комментарий
Дополнительно
Неорганическая, бинарная соль, образованная слабым основанием (NH4OH) и сильной кислотой (H2SO4).
Альтернативное название
Аммоний сернокислый
(NH4)2SO4(NH_4)_2SO_4
Свойства сульфата аммония
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветные прозрачные кристаллы или белый порошок без запаха и слабой гигроскопичностью |
| Молярная масса | 132,14052 г/моль |
| Плотность | 1,769 г/см³ (20°C) |
| Температура плавления | 235-280°C |
| Температура разложения | 218°C |
| Растворимость | Растворим в воде (75,4 г/100 г при 20 °C), нерастворим в органических растворителях (ацетон, этанол, диэтиловый эфир) |
Химические свойства
В водном растворе сульфат аммония диссоциирует на ионы:
(NH4)2SO4↔SO42−+2NH4+(NH_4)_2SO_4 ↔ SO_4^{2-} + 2NH_4^+
Уравнение гидролиза:
NH4++SO42−+HOH↔NH4OH+SO42−+H+NH_4^+ + SO_4^{2-} + HOH ↔ NH_4OH + SO_4^{2-} + H^{+}
Гидролиз осуществляется по катиону, накапливающиеся в системе ионы водорода обуславливают кислую среду раствора (pH < 7).
Сульфат аммония вступают в обменную реакцию с кислотами и другими солями:
(NH4)2SO4+2HCl=2NH4Cl+H2SO4(NH_4)_2SO_4 + 2HCl = 2NH_4Cl + H_2SO_4
(NH4)2SO4+Ba(NO3)2=BaSO4↓+2NH4NO3(NH_4)_2SO_4 + Ba(NO_3)_2 = BaSO_4↓ + 2NH_4NO_3
Взаимодействие с солями нитрата выступает качественной реакцией на сульфат-ион, т.к. позволяет его идентифицировать по образовавшемуся белому осадку сульфата бария.
Сульфат аммония вступает в обменную реакцию с оксидами, щелочами и гидроксидами щелочноземельных металлов:
(NH4)2SO4+CaO=CaSO4+2NH3↑+Н2О(NH_4)_2SO_4 + CaO = CaSO_4 + 2NH_3↑ + Н_2О
(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2Н2О(NH_4)_2SO_4 + 2NaOH = Na_2SO_4 + 2NH_3↑ + 2Н_2О
Реакции, протекающие с выделением аммиака, позволяют качественно идентифицировать ион аммония по появлению едкого запаха аммиака и посинению лакмусовой бумаги.
Сульфат аммония вступает в реакцию разложения при нагревании до 147 °С:
(NH4)2SO4=NH4HSO4+NH3↑(NH_4)_2SO_4 = NH_4HSO_4 + NH_3↑
При повышении температуры выше 500 °С образованный гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
NH4HSO4=NH3↑+SO3↑+H2ONH_4HSO_4 = NH_3↑ + SO_3↑ + H_2O
Сульфат аммония окисляется сильными окислителями, например, перманганатом калия, до молекулярного азота с образованием бурого осадка оксида марганца (IV):
(NH4)2SO4+2KMnO4=2MnO2↓+K2SO4+N2↑+4H2O(NH_4)_2SO_4 + 2KMnO_4 = 2MnO_2↓ + K_2SO_4 + N_2↑ + 4H_2O
Получение
Получение в лаборатории
Соль получают действием концентрированной серной кислоты на концентрированный раствор аммиака в приборе для получения растворимых веществ в твердом виде:
2NH3+H2SO4=(NH4)2SO42NH_3 + H_2SO_4 = (NH_4)_2SO_4
Промышленный синтез
К основным способам получения относят синтез при переработки отходов, остающихся после производства капролактама, получение в результате обработки гипса (CaSO4) растворами карбоната аммония или газами – аммиаком и диоксидом углерода:
CaSO4+(NH4)2CO3=(NH4)2SO4+CaCO3CaSO_4 + (NH_4)_2CO_3 = (NH_4)_2SO_4 + CaCO_3
CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3CaSO_4 + 2NH_3 + CO_2 + H_2O = (NH_4)_2SO_4 + CaCO_3
Известен способ получения данной соли как побочный продукт синтеза соды (NaHCO3):
Na2SO4+2СO2+2NH3+2Н2O=2NaHCO3+(NH4)2SO4Na_2SO_4 + 2СO_2 + 2NH_3 + 2Н_2O = 2NaHCO_3 + (NH_4)_2SO_4
Применение
Сульфат аммония широко применяется в сельском хозяйстве в виде минерального удобрения, легко поглощаемого почвой. Аммонийный азот сульфата аммония легко усваивается растениями, а сера необходима для питания растительных культур, т.к. входит в состав некоторых синтезируемых растениями незаменимых аминокислот.
В биологической и токсикологической химии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности сульфат аммония зарегистрирован в качестве безопасной пищевой добавки E517, разрешенной к применению во всех странах.
Сульфат аммония применяют в производстве вискозного волокна, используют в технологии хлорирования воды с аммонизацией, благодаря чему сокращается расход хлора и образование вредной для человека хлорорганики, уменьшается коррозия труб.
Кроме того, сульфат аммония применяется для производства гербицидов, кормов для животных, выделки кож, строительной изоляции, а в средствах тушения пожаров выступает в качестве антипирена.
Примеры решения задач
Задача 1
Сколько сульфата аммония получается при производстве 1 т пищевой соды по аммиачному методу?
Решение
Составляем пропорцию:
84 г NaHCO3 – 53,5 г NH4Cl,
1 т NaHCO3 – х т NH4Cl
отсюда
х=1*53,5 / 84 = 0,637 т = 637 кг.
Ответ: 637 кг.
Задача 2
Сколько тепла выделится при сгорания 34 г аммиака в атмосфере хлора?
Решение
34 г
8NH3 + 3Cl2 = N2 + 6NH4Cl
8 моль
8 (1+16) г
136 г
Изменение энтальпии в ходе химической реакции:
∆Hхр0=∆Hпрод0−∆Hисх0=∆HN2(г)0+6∆HNH4Cl(к)0−8∆HNH3(г)0−3∆HCl2(г)0==0+6⋅(−314,2)−8⋅(−46,19)−3⋅0=−1515,68кДж∆Hхр_0= ∆H_{прод}^0-∆H_{исх}^0 = ∆HN_{2(г)}^0+ 6∆H_{NH4Cl(к)}^0-8 ∆H_{NH3(г)}^0-3 ∆HCl_{2(г)}^0=
= 0 + 6cdot(-314,2) — 8cdot(-46,19) -3cdot0 = -1515,68 кДж.
Составляем пропорцию:
136 г NH3 – 1515,68 кДж,
34 г NH3 – х кДж,
отсюда
х=34* 1515,68 / 136 = 378,92 кДж.
Ответ: 378,92 кДж.
Содержание:
- Физические и химические свойства
- Применение
- Сельское хозяйство
- Промышленность
- Поведение в почве
- Применение на различных типах почв
- На кислых почвах
- На черноземах
- На каштановых почвах
- На легких почвах
- Способы внесения
- Влияние на сельскохозяйственные культуры
- Овес, озимая рожь, лен
- Свекла, кукуруза, конопля, ячмень, пшеница яровая
- Рапс, капуста, редька масличная и другие крестоцветные
- Картофель
- Получение
Физические и химические свойства
Сульфат аммония (NH4)2SO4 – бесцветные кристаллы, плотность – 1,766 г/см3. При температуре выше +100°C разлагается с выделением аммиака NH3и образованием сначала NH4HSO4, а впоследствии (NH4)2S2O7 и сульфаниловой кислоты.
Растворимость в воде: при 0°C – 70,5 г/100 г, при +25°C – 76,4 г/100 г, при +100°C – 101,7 г/100 г. Окисляется до N2 под действием сильных окислителей, например, марганцевокислого калия KMnO4.[8]
Сульфат аммония содержит:
- азота по массовой доле в пересчете на сухое вещество – не менее 21 %;
- воды – 0,2 %;
- серной кислоты – не более 0,03 %.
Фракционный состав удобрения:
- массовая доля фракции размером более 0,5 мм – не менее 80 %;
- менее 6 мм – 100 %.
Рассыпчатость – 100 %.
Массовая доля остатка, не растворимого в воде, не превышает 0,02 %.[3]
Применение
Сельское хозяйство
Сульфат аммония в сельском хозяйстве используют как основное удобрение под различные культуры.[8]
Промышленность
Сульфат аммония в химической промышленности используют как компонент осадительной ванны при формировании вискозного волокна. В стекольной промышленности – в качестве добавки к стекольной шихте для улучшения ее плавкости.[8]
Схема реакции
Схема реакции

Схема реакции обменных процессов между сульфатами аммония и катионами почвенного поглощающего комплекса (ППК), согласно:[9]
Поведение в почве
При внесении в почву сульфат аммония быстро растворяется, и значительная часть катионов NH4+ входит в почвенно-поглощающий комплекс. Одновременно в почвенный раствор переходит эквивалентное количество вытесненных катионов. При этом ион аммония теряет подвижность. Это устраняет опасность его вымывания при промывном режиме почв.
Находясь в обменно-поглощенном состоянии, ионы аммония хорошо усваиваются растениями. (Изображение)
Вследствие нитрификации аммонийный азот переходит в нитратную форму. Скорость перехода аммонийного азота в нитратный зависит от необходимых для нитрификации условий: температуры, аэрации, влажности, биологической активности и реакции почвы. Одним из основных факторов, влияющим на скорость нитрификации, является степень окультуренности почв.
Переувлажнение и повышенная кислотность почв тормозят нитрификацию. Известкование кислых почв значительно ускоряет этот процесс. После превращения аммонийного азота в нитратный он приобретает все свойства нитратных удобрений. В результате процесса нитрификации в почве образуется азотная кислота и освобождается серная кислота.
(NH4)2SO4 + 4O2 → 2HNO3 + H2SO4 + 2H2O
В почве эти кислоты нейтрализуются, вступая во взаимодействие с бикарбонатами почвенного раствора и катионами почвенного поглощающего комплекса.
Нейтрализация минеральных кислот сопровождается использованием бикарбонатов почвенного раствора и вытеснением оснований из ППК водородом. Это ослабляет буферную способность почв и повышает их кислотность.
Однократное внесение сульфата аммония может и не повлиять на реакцию почвы. При систематическом использовании данного удобрения почвенная среда может значительно подкислиться. Степень подкисления увеличивается при меньшей буферной способности почв.[9]
Применение на различных типах почв
Сульфат аммония при длительном использовании оказывает на почву окисляющее действие.
На кислых почвах
окисляющее действие этого удобрения проявляется уже через несколько лет. Для регулирования реакции почвы и усиления действия удобрения рекомендуется проводить известкование либо нейтрализовать сульфат аммония до внесения в почву. Для этого на 1 ц удобрения добавляют 1,3 ц извести.[5]
На черноземах
кислотность почв повышается спустя 10–15 лет. Однако на урожайности подкисливание черноземов практически не сказывается, поскольку эти типы почв обладают высоким содержанием гумуса, большой буферностью и емкостью поглощения.[5]
На каштановых почвах
и сероземах оснований опасаться подкисления карбонатных почв нет.[5]
На легких почвах
в районах достаточного увлажнениясульфат аммония наиболее эффективен вследствие слабой миграции аммония.[5]
Способы внесения
Сульфат аммония более всего подходит для основного внесения. Но допустимо и применение для поверхностных подкормок озимых зерновых культур, сенокосов и пастбищ,[1] а также фертигации.[7]
Сроки внесения и способы заделки основного удобрения определяются свойствами почвы и климатическими условиями зоны.[6]
Влияние на сельскохозяйственные культуры
Сульфат аммония обеспечивает сельскохозяйственные растения азотом на весь вегетационный период и положительно влияет на их рост, развитие и урожайность.
Овес, озимая рожь, лен
на подкисляющее действие сульфата аммония реагируют слабо.[5]
Свекла, кукуруза, конопля, ячмень, пшеница яровая
на подкисляющее действие удобрения реагируют сильно.[5]
Рапс, капуста, редька масличная и другие крестоцветные
. Применение сульфата аммония особенно эффективно, поскольку они положительно отзываются на серу.[5]
Картофель
– лучшая форма азотных удобрений, посколькупри использовании сульфата аммония в клубнях накапливается гораздо меньше нитратов по сравнению с другими формами азотных удобрений.[1]
Получение
Сульфат аммония получают двумя способами:
- путем нейтрализации серной кислоты аммиаком;[6]
H2SO4 + 2NH3 → (NH4)2SO4
- из природных минералов (гипса, мирабилита, фосфогипсом) путем их измельчения и взаимодействия с аммиаком и углекислотой.[5]
При написании статьи, также использовались следующие источники:[4]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Вильдфлуш И. Р., Цыганов А. Р., Лапа В. В., Персикова Т. Ф. Рациональное применение удобрений: Пособие. – Горки: Белорусская государственная сельскохозяйственная академия, 2002.– 324 с.
2.
Вильдфлуш И.Р., Кукреш С.П., Ионас В.А. Агрохимия: Учебник – 2-е изд., доп. И перераб. – Мн.: Ураджай, 2001 – 488 с., ил.
3.
ГОСТ 9097-82 Сульфат аммония. Технические условия. Издание официальное. Москва. Дата введения 01.01. 1984
4.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
5.
Минеев В.Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., [16] л. ил.: ил. – (Классический университетский учебник).
6.
Мязин Н.Г. Система удобрения: учебное пособие. – Воронеж: ФГОУ ВПО ВГАУ, 2009.- 350 с
7.
Налойченко А.О, Атаканов А.Ж.,Удобрительное орошение посредством внесения жидких минеральных удобрений с поливной водой (фертигация). Ассоциация НИЦ – ИВМИ. Проект повышения продуктивности воды на уровне поля (ППВ) (Кыргыз. НИИ ирригации), Бишкек 2009 г.. – 24с
8.
Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
9.
Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Свернуть
Список всех источников