From Wikipedia, the free encyclopedia
(Redirected from H and K lines)
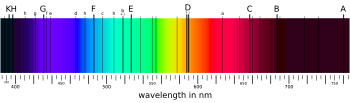
Wavelengths of the visual spectrum, 380 to about 740 nanometers (nm).[1] Dips in intensity are observed as dark lines (absorption) at the wavelengths of the Fraunhofer lines, (e.g., the features G, F, b, E, B). The «spectrum of blue sky» presents across 450–485 nm, the wavelengths of the color blue.
In physics and optics, the Fraunhofer lines are a set of spectral absorption lines named after the German physicist Joseph von Fraunhofer (1787–1826). The lines were originally observed as dark features (absorption lines) in the optical spectrum of the Sun (white light) .
Discovery[edit]
Solar spectrum with Fraunhofer lines as it appears visually.
In 1802, the English chemist William Hyde Wollaston[2] was the first person to note the appearance of a number of dark features in the solar spectrum.[3] In 1814, Fraunhofer independently rediscovered the lines and began to systematically study and measure the wavelengths where these features are observed. He mapped over 570 lines, designating the principal features (lines) with the letters A through K and weaker lines with other letters.[4][5][6] Modern observations of sunlight can detect many thousands of lines.
About 45 years later, Kirchhoff and Bunsen[7] noticed that several Fraunhofer lines coincide with characteristic emission lines identified in the spectra of heated elements.[8] It was correctly deduced that dark lines in the solar spectrum are caused by absorption by chemical elements in the solar atmosphere.[9] Some of the observed features were identified as telluric lines originating from absorption by oxygen molecules in the Earth’s atmosphere.
Sources[edit]
The Fraunhofer lines are typical spectral absorption lines. Absorption lines are dark lines, narrow regions of decreased intensity, that are the result of photons being absorbed as light passes from the source to the detector. In the Sun, Fraunhofer lines are a result of gas in the photosphere, the outer region of the sun. The photosphere gas has lower temperatures than gas in the inner regions, and absorbs a little of the light emitted from those regions.
Naming[edit]
The major Fraunhofer lines, and the elements they are associated with, are shown in the following table:
Solar Spectral Irradiance measured with a calibrated optical spectrometer mounted with a cosine corrector. Some of the characteristic Fraunhofer lines and their corresponding elements are indicated for the extended visible spectrum (highlighted area in the graph).
For photometry and colorimetry, standard measurements are usually carried out in the range 360 — 830 nm. From these data and for this spectral range, the correlated color temperature (CCT) is 5470 K.
|
|
A demonstration of the 589 nm D2 (left) and 590 nm D1 (right) emission sodium D lines using a wick with salt water in a flame
The Fraunhofer C, F, G’, and h lines correspond to the alpha, beta, gamma and delta lines of the Balmer series of emission lines of the hydrogen atom. The Fraunhofer letters are now rarely used for those lines.
The D1 and D2 lines form the well-known «sodium doublet», the centre wavelength of which (589.29 nm) is given the designation letter «D». This historical designation for this line has stuck and is given to all the transitions between the ground state and the first excited state of the other alkali atoms as well. The D1 and D2 lines correspond to the fine-structure splitting of the excited states. This may be confusing because the excited state for this transition is the P-state of the alkali and should not be confused with the higher D-states.
The Fraunhofer H and K letters are also still used for the calcium-II doublet in the violet part of the spectrum, important in astronomical spectroscopy.
Note that there is disagreement in the literature for some line designations; e.g., the Fraunhofer d-line may refer to the cyan iron line at 466.814 nm, or alternatively to the yellow helium line (also labeled D3) at 587.5618 nm. Similarly, there is ambiguity with reference to the e-line, since it can refer to the spectral lines of both iron (Fe) and mercury (Hg). In order to resolve ambiguities that arise in usage, ambiguous Fraunhofer line designations are preceded by the element with which they are associated (e.g., Mercury e-line and Helium d-line).
Because of their well-defined wavelengths, Fraunhofer lines are often used to characterize the refractive index and dispersion properties of optical materials.
See also[edit]
- Abbe number, measure of glass dispersion defined using Fraunhofer lines
- Timeline of solar astronomy
- Spectrum analysis
References[edit]
- ^ Starr, Cecie (2005). Biology: Concepts and Applications. Thomson Brooks/Cole. p. 94. ISBN 978-0-534-46226-0.
- ^ Melvyn C. Usselman: William Hyde Wollaston Encyclopædia Britannica, retrieved 31 March 2013
- ^ William Hyde Wollaston (1802) «A method of examining refractive and dispersive powers, by prismatic reflection,» Philosophical Transactions of the Royal Society, 92: 365–380; see especially p. 378.
- ^ Hearnshaw, J.B. (1986). The analysis of starlight. Cambridge: Cambridge University Press. p. 27. ISBN 978-0-521-39916-6.
- ^ Joseph Fraunhofer (1814 — 1815) «Bestimmung des Brechungs- und des Farben-Zerstreuungs — Vermögens verschiedener Glasarten, in Bezug auf die Vervollkommnung achromatischer Fernröhre» (Determination of the refractive and color-dispersing power of different types of glass, in relation to the improvement of achromatic telescopes), Denkschriften der Königlichen Akademie der Wissenschaften zu München (Memoirs of the Royal Academy of Sciences in Munich), 5: 193–226; see especially pages 202–205 and the plate following page 226.
- ^ Jenkins, Francis A.; White, Harvey E. (1981). Fundamentals of Optics (4th ed.). McGraw-Hill. p. 18. ISBN 978-0-07-256191-3.
- ^ See:
- Gustav Kirchhoff (1859) «Ueber die Fraunhofer’schen Linien» (On Fraunhofer’s lines), Monatsbericht der Königlichen Preussische Akademie der Wissenschaften zu Berlin (Monthly report of the Royal Prussian Academy of Sciences in Berlin), 662–665.
- Gustav Kirchhoff (1859) «Ueber das Sonnenspektrum» (On the sun’s spectrum), Verhandlungen des naturhistorisch-medizinischen Vereins zu Heidelberg (Proceedings of the Natural History / Medical Association in Heidelberg), 1 (7) : 251–255.
- ^ G. Kirchhoff (1860). «Ueber die Fraunhofer’schen Linien». Annalen der Physik. 185 (1): 148–150. Bibcode:1860AnP…185..148K. doi:10.1002/andp.18601850115.
- ^ G. Kirchhoff (1860). «Ueber das Verhältniss zwischen dem Emissionsvermögen und dem Absorptionsvermögen der Körper für Wärme und Licht» [On the relation between the emissive power and the absorptive power of bodies towards heat and light]. Annalen der Physik. 185 (2): 275–301. Bibcode:1860AnP…185..275K. doi:10.1002/andp.18601850205.
Further reading[edit]
- Myles W. Jackson; Albert Gallatin Research Excellence Professor of the History of Science at Nyu-Gallatin and Professo Myles W Jackson (2000). Spectrum of Belief: Joseph Von Fraunhofer and the Craft of Precision Optics. MIT Press. ISBN 978-0-262-10084-7.
External links[edit]
From Wikipedia, the free encyclopedia
(Redirected from H and K lines)
Wavelengths of the visual spectrum, 380 to about 740 nanometers (nm).[1] Dips in intensity are observed as dark lines (absorption) at the wavelengths of the Fraunhofer lines, (e.g., the features G, F, b, E, B). The «spectrum of blue sky» presents across 450–485 nm, the wavelengths of the color blue.
In physics and optics, the Fraunhofer lines are a set of spectral absorption lines named after the German physicist Joseph von Fraunhofer (1787–1826). The lines were originally observed as dark features (absorption lines) in the optical spectrum of the Sun (white light) .
Discovery[edit]
Solar spectrum with Fraunhofer lines as it appears visually.
In 1802, the English chemist William Hyde Wollaston[2] was the first person to note the appearance of a number of dark features in the solar spectrum.[3] In 1814, Fraunhofer independently rediscovered the lines and began to systematically study and measure the wavelengths where these features are observed. He mapped over 570 lines, designating the principal features (lines) with the letters A through K and weaker lines with other letters.[4][5][6] Modern observations of sunlight can detect many thousands of lines.
About 45 years later, Kirchhoff and Bunsen[7] noticed that several Fraunhofer lines coincide with characteristic emission lines identified in the spectra of heated elements.[8] It was correctly deduced that dark lines in the solar spectrum are caused by absorption by chemical elements in the solar atmosphere.[9] Some of the observed features were identified as telluric lines originating from absorption by oxygen molecules in the Earth’s atmosphere.
Sources[edit]
The Fraunhofer lines are typical spectral absorption lines. Absorption lines are dark lines, narrow regions of decreased intensity, that are the result of photons being absorbed as light passes from the source to the detector. In the Sun, Fraunhofer lines are a result of gas in the photosphere, the outer region of the sun. The photosphere gas has lower temperatures than gas in the inner regions, and absorbs a little of the light emitted from those regions.
Naming[edit]
The major Fraunhofer lines, and the elements they are associated with, are shown in the following table:
Solar Spectral Irradiance measured with a calibrated optical spectrometer mounted with a cosine corrector. Some of the characteristic Fraunhofer lines and their corresponding elements are indicated for the extended visible spectrum (highlighted area in the graph).
For photometry and colorimetry, standard measurements are usually carried out in the range 360 — 830 nm. From these data and for this spectral range, the correlated color temperature (CCT) is 5470 K.
|
|
A demonstration of the 589 nm D2 (left) and 590 nm D1 (right) emission sodium D lines using a wick with salt water in a flame
The Fraunhofer C, F, G’, and h lines correspond to the alpha, beta, gamma and delta lines of the Balmer series of emission lines of the hydrogen atom. The Fraunhofer letters are now rarely used for those lines.
The D1 and D2 lines form the well-known «sodium doublet», the centre wavelength of which (589.29 nm) is given the designation letter «D». This historical designation for this line has stuck and is given to all the transitions between the ground state and the first excited state of the other alkali atoms as well. The D1 and D2 lines correspond to the fine-structure splitting of the excited states. This may be confusing because the excited state for this transition is the P-state of the alkali and should not be confused with the higher D-states.
The Fraunhofer H and K letters are also still used for the calcium-II doublet in the violet part of the spectrum, important in astronomical spectroscopy.
Note that there is disagreement in the literature for some line designations; e.g., the Fraunhofer d-line may refer to the cyan iron line at 466.814 nm, or alternatively to the yellow helium line (also labeled D3) at 587.5618 nm. Similarly, there is ambiguity with reference to the e-line, since it can refer to the spectral lines of both iron (Fe) and mercury (Hg). In order to resolve ambiguities that arise in usage, ambiguous Fraunhofer line designations are preceded by the element with which they are associated (e.g., Mercury e-line and Helium d-line).
Because of their well-defined wavelengths, Fraunhofer lines are often used to characterize the refractive index and dispersion properties of optical materials.
See also[edit]
- Abbe number, measure of glass dispersion defined using Fraunhofer lines
- Timeline of solar astronomy
- Spectrum analysis
References[edit]
- ^ Starr, Cecie (2005). Biology: Concepts and Applications. Thomson Brooks/Cole. p. 94. ISBN 978-0-534-46226-0.
- ^ Melvyn C. Usselman: William Hyde Wollaston Encyclopædia Britannica, retrieved 31 March 2013
- ^ William Hyde Wollaston (1802) «A method of examining refractive and dispersive powers, by prismatic reflection,» Philosophical Transactions of the Royal Society, 92: 365–380; see especially p. 378.
- ^ Hearnshaw, J.B. (1986). The analysis of starlight. Cambridge: Cambridge University Press. p. 27. ISBN 978-0-521-39916-6.
- ^ Joseph Fraunhofer (1814 — 1815) «Bestimmung des Brechungs- und des Farben-Zerstreuungs — Vermögens verschiedener Glasarten, in Bezug auf die Vervollkommnung achromatischer Fernröhre» (Determination of the refractive and color-dispersing power of different types of glass, in relation to the improvement of achromatic telescopes), Denkschriften der Königlichen Akademie der Wissenschaften zu München (Memoirs of the Royal Academy of Sciences in Munich), 5: 193–226; see especially pages 202–205 and the plate following page 226.
- ^ Jenkins, Francis A.; White, Harvey E. (1981). Fundamentals of Optics (4th ed.). McGraw-Hill. p. 18. ISBN 978-0-07-256191-3.
- ^ See:
- Gustav Kirchhoff (1859) «Ueber die Fraunhofer’schen Linien» (On Fraunhofer’s lines), Monatsbericht der Königlichen Preussische Akademie der Wissenschaften zu Berlin (Monthly report of the Royal Prussian Academy of Sciences in Berlin), 662–665.
- Gustav Kirchhoff (1859) «Ueber das Sonnenspektrum» (On the sun’s spectrum), Verhandlungen des naturhistorisch-medizinischen Vereins zu Heidelberg (Proceedings of the Natural History / Medical Association in Heidelberg), 1 (7) : 251–255.
- ^ G. Kirchhoff (1860). «Ueber die Fraunhofer’schen Linien». Annalen der Physik. 185 (1): 148–150. Bibcode:1860AnP…185..148K. doi:10.1002/andp.18601850115.
- ^ G. Kirchhoff (1860). «Ueber das Verhältniss zwischen dem Emissionsvermögen und dem Absorptionsvermögen der Körper für Wärme und Licht» [On the relation between the emissive power and the absorptive power of bodies towards heat and light]. Annalen der Physik. 185 (2): 275–301. Bibcode:1860AnP…185..275K. doi:10.1002/andp.18601850205.
Further reading[edit]
- Myles W. Jackson; Albert Gallatin Research Excellence Professor of the History of Science at Nyu-Gallatin and Professo Myles W Jackson (2000). Spectrum of Belief: Joseph Von Fraunhofer and the Craft of Precision Optics. MIT Press. ISBN 978-0-262-10084-7.
External links[edit]
| Кальций | |
|---|---|
| Умеренно твёрдый, серебристо-белый металл | |

Кальций в атмосфере аргона |
|
| Название, символ, номер | Кальций/Calcium (Ca), 20 |
| Атомная масса (молярная масса) |
40,078(4) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s2 |
| Радиус атома | 197 пм |
| Ковалентный радиус | 174 пм |
| Радиус иона | (+2e) 99 пм |
| Электроотрицательность | 1,00 (шкала Полинга) |
| Электродный потенциал | −2,76 В |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) |
589,4 (6,11) кДж/моль (эВ) |
| Плотность (при н. у.) | 1,55 г/см³ |
| Температура плавления | 1112 К; 838,85 °C |
| Температура кипения | 1757 К; 1483,85 °C |
| Уд. теплота плавления | 9,20 кДж/моль |
| Уд. теплота испарения | 153,6 кДж/моль |
| Молярная теплоёмкость | 25,9 Дж/(K·моль) |
| Молярный объём | 29,9 см³/моль |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 5,580 Å |
| Температура Дебая | 230 K |
| Теплопроводность | (300 K) (201) Вт/(м·К) |
| Номер CAS | 7440-70-2 |
Кальций (Ca от лат. Calcium) — элемент второй группы (по старой классификации — главной подгруппы второй группы), четвёртого периода, с атомным номером 20. Простое вещество кальций — мягкий, химически активный щёлочноземельный металл серебристо-белого цвета. Впервые получен в чистом виде Г. Дэви в 1808 году.
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 2.1 Изотопы
- 2.2 В горных породах и минералах
- 2.3 Миграция в земной коре
- 2.4 В биосфере
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Применение
- 7 Биологическая роль
История и происхождение названия
Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Гемфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием.
Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад. Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные.
Нахождение в природе
Из-за высокой химической активности кальций в свободном виде в природе не встречается.
На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности (3-е среди металлов) после кислорода, кремния, алюминия и железа). Содержание элемента в морской воде — 400 мг/л.
Изотопы
Основная статья: Изотопы кальция
Кальций встречается в природе в виде смеси шести изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca и 48Ca, среди которых наиболее распространённый — 40Ca — составляет 96,97 %. Ядра кальция содержат магическое число протонов: Z = 20. Изотопы 40
20Ca20
и 48
20Ca28
являются двумя из пяти существующих в природе дважды магических ядер.
Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48Ca, самый тяжёлый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), испытывает двойной бета-распад с периодом полураспада (4,39 ± 0,58)⋅1019 лет.
В горных породах и минералах
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Осадочная порода, состоящая в основном из скрытокристаллического кальцита — известняк (одна из его разновидностей — мел). Под действием регионального метаморфизма известняк преобразуется в мрамор.
Миграция в земной коре
В естественной миграции кальция существенную роль играет «карбонатное равновесие», связанное с обратимой реакцией взаимодействия карбоната кальция с водой и углекислым газом с образованием растворимого гидрокарбоната:
-
- CaCO3 + H2O + CO2 ⇄ Ca(HCO3)2 ⇄ Ca2+ + 2HCO3−
(равновесие смещается влево или вправо в зависимости от концентрации углекислого газа).
Огромную роль играет биогенная миграция.
В биосфере
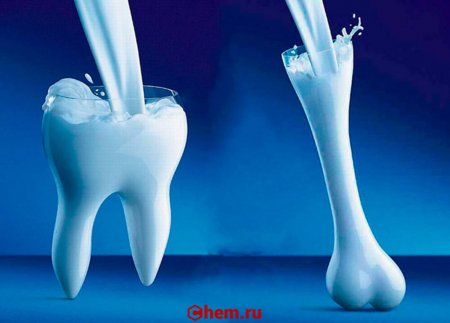
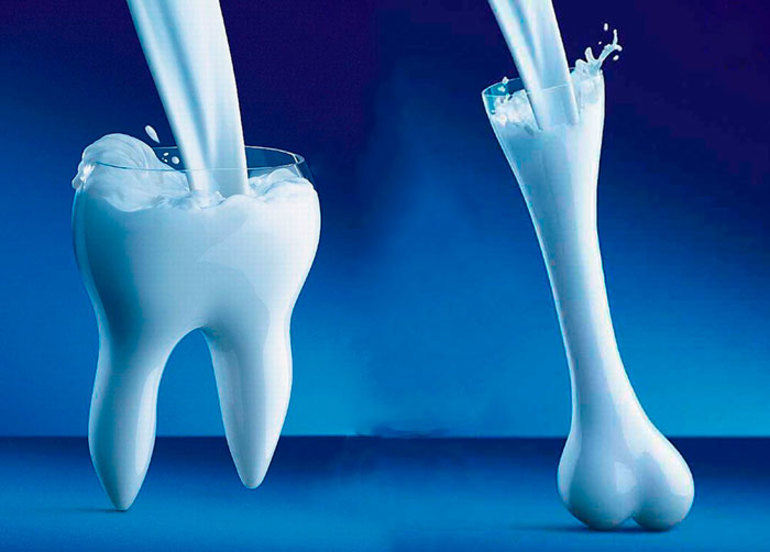
Соединения кальция находятся практически во всех животных и растительных тканях (см. ниже). Значительное количество кальция входит в состав живых организмов. Так, гидроксиапатит Ca5(PO4)3OH, или, в другой записи, 3Ca3(PO4)2·Ca(OH)2 — основа костной ткани позвоночных, в том числе и человека; из карбоната кальция CaCO3 состоят раковины и панцири многих беспозвоночных, яичная скорлупа и др. В живых тканях человека и животных 1,4—2 % Ca (по массовой доле); в теле человека массой 70 кг содержание кальция — около 1,7 кг (в основном в составе межклеточного вещества костной ткани).
Получение
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75—80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C 4CaO + 2Al → CaAl2O4 + 3Ca
Физические свойства
Металл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α-Ca с кубической гранецентрированной решеткой (параметр а = 0,558 нм), выше устойчив β-Ca с кубической объемно-центрированной решеткой типа α-Fe (параметр a = 0,448 нм). Стандартная энтальпия ΔH0 перехода α → β составляет 0,93 кДж/моль.
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является). При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы). Уникальное поведение кальция похоже во многом на стронций (то есть параллели в периодической системе сохраняются).
Химические свойства
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло-серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 −2,84 В, так что кальций активно реагирует с водой, но без воспламенения:
-
- Ca + 2H2O → Ca(OH)2 + H2↑
С активными неметаллами (кислородом, хлором, бромом, йодом) кальций реагирует при обычных условиях:
-
- 2Ca + O2 → 2CaO
-
- Ca + Br2 → CaBr2
При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком («кирпично-красным»). С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
-
- Ca + H2 → CaH2
-
- Ca + 6B → CaB6
-
- 3Ca + N2 → Ca3N2
-
- Ca + 2C → CaC2
-
- 6Ca + P4 → 2Ca3P2
-
- 2Ca + Si → Ca2Si
Кроме получающихся в этих реакциях фосфида кальция Ca3P2 и силицида кальция Ca2Si, известны также фосфиды кальция составов CaP и CaP5 и силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты. Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
-
- CaH2 + 2H2O → Ca(OH)2 + 2H2↑
-
- Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3↑
Ион Ca2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, йодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат CaC2O4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция CaCO3, кислый карбонат кальция (гидрокарбонат) Ca(HCO3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение, а в тех местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция
-
- CaCO3 + CO2 + H2O ⇄ Ca(HCO3)2
Так в природе происходит перенос больших масс веществ. В результате под землёй могут образоваться огромные карстовые полости и провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворенного гидрокарбоната кальция во многом определяет вре́менную жёсткость воды. Вре́менной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает CaCO3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Применение
Главное применение металлического кальция — это использование его как восстановителя при получении металлов, особенно никеля, меди и нержавеющей стали. Кальций и его гидрид используются также для получения трудно восстанавливаемых металлов, таких, как хром, торий и уран. Сплавы кальция со свинцом применяются в некоторых видах аккумуляторных батарей и при производстве подшипников. Кальциевые гранулы используются также для удаления следов воздуха из электровакуумных приборов. Чистый металлический кальций широко применяется в металлотермии при получении редкоземельных элементов.
Кальций широко применяется в металлургии для раскисления стали наряду с алюминием или в сочетании с ним. Внепечная обработка кальцийсодержащими проволоками занимает ведущее положение в связи с многофакторностью влияния кальция на физико-химическое состояние расплава, макро- и микроструктуры металла, качество и свойства металлопродукции и является неотъемлемой частью технологии производства стали. В современной металлургии для ввода в расплав кальция используется инжекционная проволока, представляющая из себя кальций (иногда силикокальций или алюмокальций) в виде порошка или прессованного металла в стальной оболочке. Наряду с раскислением (удалением растворенного в стали кислорода) использование кальция позволяет получить благоприятные по природе, составу и форме неметаллические включения, не разрушающиеся в ходе дальнейших технологических операций.
Изотоп 48Ca — один из эффективных и употребительных материалов для производства сверхтяжёлых элементов и открытия новых элементов таблицы Менделеева. Это связано с тем, что кальций-48 является дважды магическим ядром, поэтому его устойчивость позволяет ему быть достаточно нейтроноизбыточным для лёгкого ядра; при синтезе сверхтяжёлых ядер необходим избыток нейтронов.
Биологическая роль
Основная статья: Кальций в живых организмах
Кальций — распространённый макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Концентрация кальция в цитоплазме клеток человека составляет около 10−4 ммоль/л, в межклеточных жидкостях около 2,5 ммоль/л.
Потребность в кальции зависит от возраста. Для взрослых в возрасте 19—50 лет и детей 4—8 лет включительно дневная потребность (RDA) составляет 1000 мг, а для детей в возрасте от 9 до 18 лет включительно — 1300 мг в сутки . В подростковом возрасте потребление достаточного количества кальция очень важно из-за интенсивного роста скелета. Однако по данным исследований в США всего 11 % девочек и 31 % мальчиков в возрасте 12—19 лет достигают своих потребностей. В сбалансированной диете большая часть кальция (около 80 %) поступает в организм ребёнка с молочными продуктами. Оставшийся кальций приходится на зерновые (в том числе цельнозерновой хлеб и гречку), бобовые, апельсины, зелень, орехи. Всасывание кальция в кишечнике происходит двумя способами: через клетки кишечника (трансцеллюлярно) и межклеточно (парацелюллярно). Первый механизм опосредован действием активной формы витамина D (кальцитриола) и её кишечными рецепторами. Он играет большую роль при малом и умеренном потреблении кальция. При большем содержании кальция в диете основную роль начинает играть межклеточная абсорбция, которая связана с большим градиентом концентрации кальция. За счёт чрезклеточного механизма кальций всасывается в большей степени в двенадцатиперстной кишке (из-за наибольшей концентрации там рецепторов в кальцитриолу). За счёт межклеточного пассивного переноса абсорбция кальция наиболее активна во всех трёх отделах тонкого кишечника. Всасыванию кальция парацеллюлярно способствует лактоза (молочный сахар).
Усвоению кальция препятствуют некоторые животные жиры (включая жир коровьего молока и говяжий жир, но не сало) и пальмовое масло. Содержащиеся в таких жирах пальмитиновая и стеариновая жирные кислоты отщепляются при переваривании в кишечнике и в свободном виде прочно связывают кальций, образуя пальмитат кальция и стеарат кальция (нерастворимые мыла). В виде этого мыла со стулом теряется как кальций, так и жир. Этот механизм ответственен за снижение всасывания кальция, снижение минерализации костей и снижение косвенных показателей их прочности у младенцев при использовании детских смесей на основе пальмового масла (пальмового олеина). У таких детей образование кальциевых мыл в кишечнике ассоциируется с уплотнением стула, уменьшением его частоты, а также более частым срыгиванием и коликами.
Концентрация кальция в крови из-за её важности для большого числа жизненно важных процессов точно регулируется, и при правильном питании и достаточном потреблении обезжиренных молочных продуктов и витамина D дефицита не возникает. Длительный дефицит кальция и/или витамина D в диете приводит к увеличению риска остеопороза, а в младенчестве вызывает рахит.
Избыточные дозы кальция и витамина D могут вызвать гиперкальцемию. Максимальная безопасная доза для взрослых в возрасте от 19 до 50 лет включительно составляет 2500 мг в сутки (около 340 г сыра Эдам).
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
100% гарантия натуральности каждого камня — доставка в любую точку мира
Этот химический элемент жизненно важен в буквальном смысле: из него состоят наши кости и зубы. Кальций – это также морские раковины, цветные мелки, сталактиты и сталагмиты в пещерах.
Содержание
- Что представляет собой
- История
- Физико-химические характеристики
- Присутствие в природе
- Технология получения
- Где используется
- Промышленность
- Наука
- Другие сферы
- Биологическое влияние
- Жизненные процессы
- Питание
- Нормы
- Симптомы нехватки/переизбытка
- Цены
Что представляет собой
Кальций – это химический элемент периодической системы Д. И. Менделеева под №20. Мягкий серебристо-белый металл блестит, но затем тускнеет под пленкой-оксидом.
Состоит из шести стабильных изотопов, при этом 97% состава приходится на Ca40.
Относится к щелочноземельным металлам.
Международное обозначение – Calcium (Ca).
История
Применение кальциевых минералов – мрамора, гипса, известняка – исчисляется тысячелетиями.
Чистый металл первым в истории получил британский химик Гемфри Дэви (1808 год). Для этого он применил электролиз к смеси из оксида ртути и мокрой гашеной извести. Получив амальгаму, отделил ртуть.
Он же предложил латинское название элемента: calcis означает мягкий камень, известка.
-50%
Большой выбор украшений из натуральных камней и минералов со скидкой -50%
Физико-химические характеристики
Кальций представлен двумя модификациями кубической решетки: с гране- и объемноцентрированной структурой.
Металл наделен многими достоинствами: пластичен, режется ножом, обрабатывается прессованием, прокаткой.
Химические свойства проявляются при нагревании:
- Взаимодействие с горячей водой приводит к образованию водородного «фонтана». Но реакция проходит без взрывов или горения.
- Взаимодействует с кислотами, неметаллами, образуя соединения.
- Даже при комнатной температуре во влажном микроклимате покрывается пленкой.
Нагреваясь в кислороде либо на воздухе, кальций, его растворимые соли горят. Пламя получается красно-оранжевым. По цвету его легко отличить от других металлов.
Химическая активность вещества зашкаливает. Для устранения этого недостатка металл хранят в керосине, растопленном парафине либо закупоренном сосуде.
| Свойства атома | |
|---|---|
| Название, символ, номер | Ка́льций/Calcium (Ca), 20 |
| Атомная масса (молярная масса) |
40,078(4) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s2 |
| Радиус атома | 197 пм |
| Химические свойства | |
| Ковалентный радиус | 174 пм |
| Радиус иона | (+2e) 99 пм |
| Электроотрицательность | 1,00 (шкала Полинга) |
| Электродный потенциал | −2,76 В |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) |
589,4 (6,11) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 1,55 г/см³ |
| Температура плавления | 1112 К; 838,85 °C |
| Температура кипения | 1757 К; 1483,85 °C |
| Уд. теплота плавления | 9,20 кДж/моль |
| Уд. теплота испарения | 153,6 кДж/моль |
| Молярная теплоёмкость | 25,9 Дж/(K·моль) |
| Молярный объём | 29,9 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированная |
| Параметры решётки | 5,580 Å |
| Температура Дебая | 230 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) (201) Вт/(м·К) |
| Номер CAS | 7440-70-2 |
Уникальные свойства кальция как металла проявляются при усилении давления.
Под давлением он ведет себя как полупроводник, затем как металл, потом подобно сверхпроводнику. По проводимости в разы превосходит все химические элементы (например, ртуть – вшестеро).
Присутствие в природе
Кальций – третий по распространенности в земной коре среди металлов, пятый среди всех элементов. Четвертый по количеству минералов (385).
Однако высокая химическая активность исключает присутствие элемента в свободном виде:
- Это компонент минералов и соединений. Самые распространенные минералы – гипс, кальцит, алебастр, флюорит, апатит, доломит.
Апатит - Из кальцита состоит известняк. Метаморфизм превращает его в мрамор. Самая известная разновидность известняка – мел.
Горная порода кальцит
Вещество с формулой СаСО3 – обычный мел.
- Щелочноземельный металл обнаружен в каменных метеоритах – как почти ненаходимые на земле сульфиды.
Тонна земной коры содержит 32,7 кг кальция, литр морской воды – 410 мг.
Из морской воды кальций как строительный материал вытаскивают моллюски, кораллы.
Концентрацией кальция в составе определяется степень жесткости воды.
Технология получения
Конечный продукт промышленного производства – металлический кальций.
Получение металла проходит двумя методами:
Более 8000 видов товара из 500 разновидностей натурального камня. Ежедневное обновление!
- Электролиз. Расплавляют CaCl2, задействуя медно-кальциевый анод. Из полученного медно-кальциевого сплава (2:1) отгоняют металл.
- Алюминотермия. Прокаливается смесь CaO и порошковый алюминий. Конденсат из кальциевых паров аккумулируется на охлаждаемой поверхности.
Для обоих способов получения металла требуется вакуум и 960-1900°С.
Единственный производитель кальция в Европе – Чепецкий механический завод. Его открыли в 1949 году для нужд отечественной урановой промышленности. Уже тогда СССР отработал процесс восстановления урана кальцием. Сегодняшний ассортимент шире.
Где используется
Утилитарные характеристики металла обусловили сферы применения.
Промышленность
Львиная доля продукции металлургических комбинатов достается промышленному комплексу.
Здесь миссия кальция многогранна:
- Восстановление редкоземельных, тугоплавких элементов из соединений. Речь о хроме, никеле, меди, тории, уране.
- Удаление серы из бензина, керосина, других нефтепродуктов.
- Раскисление стали и сплавов цветных металлов.
- Получение антифрикционных сплавов.
- Очистка электровакуумных приборов от воздуха, других газов.
- Обезвоживание органических растворителей.
Металл используется при производстве аккумуляторных батарей, подшипников, оболочек кабелей.
Наука
Изотоп Ca-48 – материал с высоким КПД для производства сверхтяжелых элементов.
Кальцием восстанавливают уран.
С его помощью ученые пополняют таблицу Менделеева.
Другие сферы
Кальциевые материалы нашли применение на бытовом уровне:
- Строительный материал (известняк, гипс, мрамор).
- Сырье при производстве гипса, включая медицинский.
- Дезинфектор (хлорка).
- Мелки для рисования.
- Аптечные препараты, БАДы (особенно с витамином D).
Эстетично выглядящие образцы (флюорит, кальцинит, мрамор) попадают в минералогические коллекции.
Биологическое влияние
Кальций – важный для биологических организмов макроэлемент (1,6-2,1% по массе): он есть в растениях, организме животных, человека.
Жизненные процессы
Макроэлемент аккумулируется костями и зубами.
Известь (карбонат кальция) – строительный материал ракушек, кораллов, яичной скорлупы, накипи в чайнике.
Вещество задействовано в следующих процессах:
- Свертывание крови.
- Сокращение мышц.
- Секреция гормонов.
Тело человека массой 60 кг содержит полтора килограмма кальция.
Достаточное количество металла критично для детей и подростков: их скелет растет каждую минуту. У младенцев может проявиться рахитичность.
Питание
Макроэлемент поступает в организм во время еды. В детском возрасте продукт номер один – молоко.
Рацион взрослых разнообразнее. Веществом насыщены продукты всех групп:
- Цельнозерновой хлеб, гречка.
- Морепродукты, рыба (особенно мягкие кости).
- Бобовые.
- Орехи, свежий кунжут.
- Листовой салат, укроп, петрушка, спаржа.
Всасыванию кальция содействует лактоза, препятствуют кофе, углеводы, пальмовое масло, животные жиры (кроме сала).
Нормы
Суточная потребность в макроэлементе определяется возрастом (г):
| Возраст (лет) | Количество кальция (мг) |
| 0-6 | 1490 |
| 7-9 | 750 |
| 10-12 (мальчики) | 910 |
| 10-12 (девочки) | 1250 |
| 13-19 | 1250 |
| 20-49 | 1050 |
| 49+ | 1150-1350 |
Беременным и кормящим матерям требуется повышенная норма вещества.
Симптомы нехватки/переизбытка
Дефицит металла в организме проявляется многопланово:
- судороги, онемение конечностей, суставная боль;
- тахикардия;
- гипертония;
- расслоение, ломкость ногтей.
На ментальном плане это депрессия, нервозность.
Хроническая нехватка макроэлемента ведет к хрупкости костей (остеопорозу).
Об избытке макроэлемента сигнализируют отвращение к еде, неутолимая жажда, расстройство ЖКТ (тошнота, рвота), повышенное мочеотделение, слабость.
Избыток вещества опасен: организм «цементируется».
Максимальная суточная доза кальция для взрослых – 2,5 г.
Цены
На российском рынке представлена промышленная и аптечная продукция.
Цены на промышленный кальций (руб. / кг):
- металлический – 450;
- кусковой (чистота: 99,82%) – 1500;
- хлористый технический – 47;
- хлористый пищевой – 95.
Аптечный сегмент представлен отечественной и зарубежной продукцией. Упаковка глюконата кальция (10 таблеток) российского производства стоит 15-25 руб., препарата «Кальций-Д3 Никомед» – 300 — 700 руб.
100% гарантия натуральности каждого камня — доставка в любую точку мира
История кальция
Кальций был открыт в 1808 году Хэмфри Дэви, который путём электролиза гашеной извести и оксида ртути получил амальгаму кальция, в результате процесса выгонки ртути из которой и остался металл, получивший название кальций. На латыни известь звучит как calx, именно это название и было выбрано английским химиком для открытого вещества.
Общая характеристика кальция
Кальций является элементом главной подгруппы II группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 20 и атомную массу 40,08. Принятое обозначение – Ca (от латинского – Calcium).
Физические и химические свойства
Кальций является химически активным мягким щелочным металлом серебристо-белого цвета. Из-за взаимодействия с кислородом и углекислым газом поверхность металла тускнеет, поэтому кальций нуждается в особом режиме хранения – в обязательном порядке плотно закрытая ёмкость, в которой металл заливают слоем жидкого парафина или керосина.
Суточная потребность в кальции
Кальций – наиболее известный из необходимых человеку микроэлементов, суточная потребность в нём составляет от 700 до 1500 мг для здорового взрослого человека, но она увеличивается во время беременности и лактации, это нужно учитывать и получать кальций в виде препаратов.
Нахождение в природе
Кальций имеет очень высокую химическую активность, поэтому в свободном (чистом) виде не встречается в природе. Тем не менее, является пятым по распространённости в земной коре, в виде соединений имеется в осадочных (известняк, мел) и горных породах (гранит), много кальция содержит полевой шпат анорит.
В живых организмах распространён достаточно широко, его наличие обнаружено в растениях, организмах животных и человека, где он присутствует, в основном, в составе зубов и костной ткани.
Продукты питания богатые кальцием
Источники кальция: молочные и кисломолочные продукты (основной источник кальция), брокколи, капуста, шпинат, листья репы, капуста цветная, спаржа. Кальций содержат также яичные желтки, бобы, чечевица, орехи, инжир (calorizator). Ещё хороший источник пищевого кальция – мягкие кости лосося и сардин, любые морепродукты. Чемпионом по содержанию кальция является кунжут, но только в свежем виде.
В организм кальций должен поступать в определенном соотношении с фосфором. Оптимальным соотношением этих элементов принято считать 1 : 1,5 (Са : Р). Поэтому правильно употреблять продукты питания, богатые этими минералами одновременно, например, говяжью печень и печень жирных сортов рыб, зелёный горошек, яблоки и редис.
Усвояемость кальция
Препятствием для нормального усвоения кальция из пищевых продуктов является употребление в пищу углеводов в виде сладостей и щелочей, которые нейтрализуют соляную кислоту желудка, необходимую для растворения кальция. Процесс усвоения кальция достаточно сложен, поэтому иногда недостаточно получать его только с пищей, необходим дополнительный приём микроэлемента.
Взаимодействие с другими
Для улучшения всасывания кальция в кишечнике необходим витамин D, который имеет свойство облегчать процесс усвоения кальция. При приёме кальция (в виде добавок) в процессе еды происходит блокировка всасывания железа, но приём препаратов кальция отдельно от пищи никак не влияет на этот процесс.
Полезные свойства кальция и его влияние на организм
Почти весь кальций организма (от 1 до 1,5 кг) находится в костях и зубах. Кальций участвует в процессах возбудимости нервной ткани, сократимости мышц, процессах свертываемости крови, входит в состав ядра и мембран клеток, клеточных и тканевых жидкостей, обладает антиаллергическим и противовоспалительным действием, предотвращает ацидоз, активирует ряд ферментов и гормонов. Кальций также участвует в регуляции проницаемости клеточных мембран, оказывает действие, противоположное натрию.
Признаки нехватки кальция
Признаками нехватки кальция в организме являются такие, на первый взгляд, не связанные между собой симптомы:
- нервозность, ухудшение настроения;
- учащённое сердцебиение;
- судороги, онемение конечностей;
- замедление роста и детей;
- повышенное артериальное давление;
- расслоение и ломкость ногтей;
- боль в суставах, понижение «болевого порога»;
- обильные менструации.
Причины нехватки кальция
Причинами нехватки кальция могут служить несбалансированные диеты (особенно голодания), низкое содержание кальция в пище, курение и увлечение кофе и кофеинсодержащими напитками, дисбактериоз, болезни почек, щитовидной железы, беременность, периоды лактации и менопаузы.
Признаки избытка кальция
Избыток кальция, который может возникнуть при чрезмерном употреблении молочных продуктов или неконтролируемом приёме препаратов, характеризуется сильной жаждой, тошнотой, рвотой, потерей аппетита, слабостью и усиленным мочеотделением.
Применение кальция в жизни
Кальций нашёл применение в металлотермическом получении урана, в виде природных соединений используется как сырьё для производства гипса и цемент, как средство дезинфекции (всем известная хлорка).
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
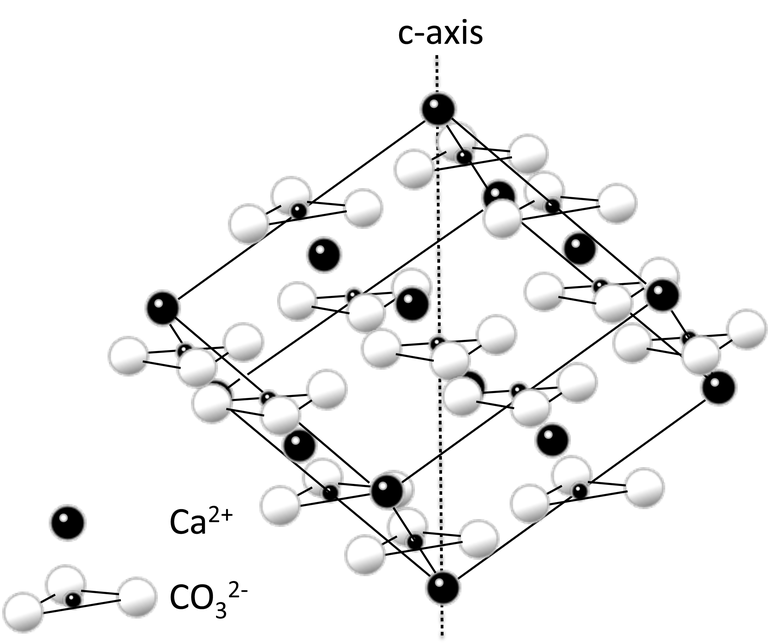
(от лат. calx, род. падеж calcis — известь; лат. Calcium), Са, хим. элемент II гр. периодич. системы, относится к щелочноземельным элементам, ат. н. 20, ат. м. 40,08. Прир. К. состоит из шести стабильных изотопов — 40 Са (96,94%), 44 Са (2,09%), 42 Са (0,667%), 48 Са (0,187%), 43 Са (0,135%) и 46 Са (0,003%). Поперечные сечения (10-28 м 2) захвата тепловых нейтронов изотопов с маc. ч. 40, 42, 44, 46 и 48 равны соотв. 0,22, 40, 0,63, 0,25 и 1,1. Конфигурация внеш. электронной оболочки 4s2; степень окисления +2, очень редко +1; энергии ионизации Са 0 : Са + : Са 2+ соотв. равны 6,11308 и 11,8714 эВ; электроотрицательность по Полингу 1,0; атомный радиус 0,197 нм, ионный радиус (в скобках указано координац. число) Са 2+ 0,114 нм (6), 0,126 нм (8), 0,137 нм (10), 0,148 нм (12). По распространенности в земной коре К. занимает пятое место (после О, Si, Al, Fe), его содержание в земной коре составляет 3,38% по массе. Встречается только в виде соед., в основном солей кислородсодержащих к-т; известно ок. 400 минералов, содержащих К. Очень распространены разл. силикаты и алюмосиликаты, напр., анортит Са[Al2Si2O8], диопсид CaMg[Si2O6], волластонит Са 3[Si3O9]. Кроме них пром. значение имеют кальцит СаСО 3 (прир. формы — известняк, мел, мрамор), доломит CaMg(CO3)2, фосфорит Са 5 (РО 4)3 (ОН, СО 3) (с разл. примесями), апатиты Са 5(PO4)3(F, Cl), гипс CaSO4.2H2O, флюорит CaF2 и др. Большое кол-во К. находится в прир. водах вследствие существования глобального карбонатного равновесия между практически нерастворимым СаСО 3, хорошо р-римым Са(НСО 3)2 и находящимся в воде и воздухе СО 2. Значительное кол-во К. содержится в организмах мн. животных, напр., гидроксилапатит — в костной ткани позвоночных, СаСО 3 — в раковинах моллюсков, яичной скорлупе.
Свойства. К. — серебристо-белый металл. Существует в двух аллотропных модификациях: до 443 °С устойчив a-Са с кубич. гранецентрир. решеткой типа Сu, а= 0,558 нм, z =4, пространств. группа Fm3m, плотн. 1,54 г/см 3; в интервале 443-842 °С — b-Са с кубич. объемноцентрир. решеткой типа a-Fe, а =0,448 нм, z = 2, пространств. группа Im3m; DH0 перехода a Db 0,93 кДж/моль. Т. пл. 842 °С, т. кип. 1495 °С DH0 пл 8,54 кДж/моль, DH0 исп 151,9 кДж/моль; для a-Са: С° р 25,9 Дж/(моль. К), S0298 41,6 Дж/(моль. К); для b-Са: С°p [Дж/(моль. К)] = 6,276 + 32,384.10-3T + 10,460.105T-2 (716-1115 К); для жидкого К. С° р31 Дж/(моль. К); ур-ния температурной зависимости давления пара над твердым и жидким К. соотв. (в мм рт. ст.): lgp = 6,090 — 9051 /Т — 0,783.10-3T + l,030 lgT (500-1700 К), lgp = 53,652 — 12827/T + 2,002.10-3 Т —14,485 lgT (490-2700 К); температурный коэф. линейного расширения 22.10-6 К -1 (273-573 К); r 4,6.10-8 Ом. м (293 К); теплопроводность 125,6 Вт/(м. К) при 293 К. Пластичен; модуль упругости 26 ГПа, spаст 60 МПа, s сж 4 МПа, предел текучести 38 МПа, твердость по Бринеллю 200-300 МПа. Стандартный электродный потенциал Ca2+/Ca0 Ч 2,84 В. На воздухе, содержащем пары воды, К. быстро покрывается слоем смеси оксида СаО и гидроксида Са(ОН)2. Он интенсивно окисляется кислородом до СаО; при нагр. в кислороде и на воздухе воспламеняется. С водой К. реагирует с выделением Н 2 и образованием Са(ОН)2, причем в холодной воде скорость р-ции постепенно уменьшается вследствие образования на пов-сти металла слоя малорастворимого Са(ОН)2. Интенсивно реагирует с галогенами, давая СаХ 2. При нагр. К. с расплавами его галогенидов образуются моногалогениды СаХ, к-рые стабильны только выше т-р плавления дигалогенидов (они диспропорционируют при охлаждении с образованием Са и СаХ 2). С Н 2 при нагр. К. дает гидрид СаН 2, в к-ром водород является анионом. При нагр. в атмосфере азота загорается и образует нитрид Ca3N2, известный в двух кристаллич. формах — высокотемпературной a (плотн. 2,63 г/см 3) и низкотемпературной b (коричневого цвета); т. пл. 1195°С. Нитрид Ca3N4 получен при нагр. в вакууме амида Ca(NH2)2. С углеродом К. образует кальция карбид СаС 2, с бором -борид СаВ 6 (т. пл. 2235 °С), с кремнием — силициды Ca2Si (т. пл. ~ 900 °С, с разл.), CaSi (т. пл. 1245°С), Ca3Si4 (т. пл. 1020 °С, с разл.) и CaSi2 (т. пл. 1000 °С), с фосфором — фосфиды Са 3 Р 2, СаР и СаР 3, с халькогенами — халькогениды CaS (т. пл. 2525°С), CaSe (т. пл. 1470°С), СаТе (т. пл. 1510°С). Известны также полихалькогениды CaS4, CaS5, Са 2 Те 3. К. образует соединения с мн. металлами, в частности с Ag, Au, Al, Cu, Mg, Rb. Металлич. К. вытесняет из расплавов солей большинство др. металлов. К. хорошо раств. в жидком NH3 с образованием синего р-ра, при испарении к-рого выделяется аммиакат [Са(NН 3)6] — твердое соед. золотистого цвета с металлич. проводимостью; разлагается на Са и NH3 при 12°С; воспламеняется на воздухе. К. медленно реагирует с жидким NH3 (быстро — в присут. Pt) с выделением Н 2 и образованием амида Ca(NH2)2. Соли К. обычно получают взаимод. кислотных оксидов с СаО, действием к-т на Са(ОН)2 или СаСО 3, обменными р-циями в водных р-рах электролитов. Мн. соли хорошо раств. в воде, они почти всегда образуют кристаллогидраты. В структуре богатых водой кристаллогидратов ион Са 2+ обычно окружен 6, иногда 7-9 молекулами Н 2 О, расстояние Са — Н 2 О равно 0,233-0,241 нм. Соли К. бесцветны (если бесцветен анион). Пероксид СаО 2 получают по р-ции Са(ОН)2 + Н 2 О 2 : СаО 2 + 2Н 2 О. Из р-ра выделяется октагидрат, удалением воды из него получают безводный СаО 2. Комплексы, содержащие ион Са 2+, образуются в водных р-рах, преим. с кислородсодержащими хелатообразующими лигандами, в частности комплексонами, напр. [Са(ЭДТА)]2- (ЭДТА — анион этилендиаминотетрауксусной к-ты). На образовании хелатных комплексов ионов Са 2+ с анионами полифосфорных к-т основано действие полифосфатов Na как умягчителей воды. В неводных р-рителях ион Са 2+ образует комплексы с молекулами р-рителя; из таких р-ров часто кристаллизуются сольваты солей К. В водной среде сольватокомплексы обычно разрушаются и превращаются в аквакомплексы.
Получение. В пром-сти К. получают электролизом расплава СаСl2 (75-85%) + КСl, а также алюмотермич. восстановлением СаО. Необходимый для электролиза чистый безводный СаСl2 производят хлорированием СаО при нагр. в присут. угля или обезвоживанием СаСl2.6Н 2 О, полученного действием соляной к-ты на известняк. По мере выделения К. в электролит добавляют СаСl2. Электролиз ведут с графитовым анодом, катодом служит жидкий сплав Са (62 65%) + Сu. Содержание К. в сплаве постоянно возрастает. Часть обогащенного сплава периодически извлекают и добавляют сплав, обедненный К. (30-35% Са). Т-ра процесса 680-720 °С; при более низкой т-ре обогащенный К. сплав всплывает на пов-сть электролита, а при более высокой происходит растворение К. в электролите с образованием СаСl. На 1 кг Са расходуется энергии 40-50 кВт. ч. Из сплава Са + Сu К. отгоняют в вакуумной реторте при 1000-1080 °С и остаточном давлении 13-20 кПа. Для получения высокочистого К. его перегоняют дважды. При электролизе с жидкими катодами из сплавов Са + Рb или Са + Zn непосредственно получают используемые в технике сплавы К. с Рb (для подшипников) и с Zn (для получения пенобетона — при взаимод. сплава с влагой выделяется Н 2 и создается пористая структура). Иногда процесс ведут с железным охлаждаемым катодом, к-рый только соприкасается с пов-стью расплавл. электролита. По мере выделения К. катод постепенно поднимают, вытягивают из расплава стержень из К., защищенный от кислорода воздуха слоем затвердевшего электролита. Алюмотермич. метод основан на р-ции: 6СаО + 2Аl : 3СаО. Аl2 О 3 + 3Са. Из смеси СаО с порошкообразным Аl прессуют брикеты; их помещают в реторту из хромоникелевой стали и отгоняют образовавшийся К. при 1170-1200 °С и остаточном давлении 0,7-2,6 Па. Аналогично К. может быть также получен восстановлением СаО ферросилицием или силикоалюминием. К. выпускают в виде слитков или листов с чистотой 98-99%.
Определение. Качественно К. обнаруживают микрокристаллич. методом путем осаждения его в виде оксалата, сульфата, (NH4)2Ca[Fe(CN)6], тартрата, иодата, комплексов К. с пикролоновой к-той, 8-гидроксихинолином и др. труднорастворимых соед. (ион К. образует правильные кристаллы с мн. реагентами). Количественно К. определяют комплексонометрич. титрованием в щелочной среде трилоном Б (натриевая соль этилендиаминотетрауксусной к-ты) в присут. индикаторов (эриохром черный Т, мурексид, флуорексон и др.). Применяют также гравиметрич. методы определения К. в виде сульфата, молибдата, оксалата. Для определения малых концентраций и следовых кол-в используют эмиссионный спектральный анализ, атомно-абсорбц. спектроскопию, пламенную фотометрию и рентгеновскую флуоресценцию. Чувствительность этих методов 10-2-10-6% по массе К. От др. элементов К. отделяют осаждением в виде сульфата, молибдата или оксалата, экстракцией трибутилфосфатом, экстрагентом азо-окси-БН в полярных р-рителях, ионным обменом либо хроматографически.
Применение. К. применяют при металлотермич. получении U, Th, Ti, Zr, Cs, Rb и нек-рых лантаноидов из их соед., для удаления примесей кислорода, азота, серы, фосфора из сталей, бронз и др. сплавов, обезвоживания орг. жидкостей, очистки Аr от примеси N2, как геттер в вакуумных устройствах, легирующий элемент для алюминиевых сплавов, как модифицирующую добавку для магниевых сплавов. Сплавы Са + Рb антифрикц. материалы в произ-ве подшипников. Несравненно большее применение находят соед. К. См., напр., Вяжущие материалы, Кальция алюминаты, Кальция гипохлорит, Кальция карбид, Кальция оксид, Кальция силикаты, Кальция фосфаты, Кальция фторид. Мировое произ-во соед. К. и материалов, содержащих К. (в т. ч. сплавов), ок. 1 млрд. т/год. Металлич. К. впервые получил в 1808 Г. Дэви. Лит.: Родякин В. В., Кальций, его соединения и сплавы, М., 1967; Фрумина Н С., Кручкова Е. С., Муштакова С. П., Аналитическая химия кальция, М., 1974. С. И. Дракин, П. М. Чукуров.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
История открытия
Считается, что кальций был известен человеку еще с древних времён. В Древнем Риме, в Месопотамии и других цивилизациях Востока с использованием гашеной и негашеной извести возводили массивные и долговечные здания и сооружения. Но в чистом виде этот микроэлемент удалось получить лишь в XIX веке. Английский химик Гемфри Дэви в 1808 году проводил опыты и путём электролизации гашеной извести получил оксиды ртути, из которой выплавил новый металл, названный кальцием.
Ученый смог определить молярную формулу, вычислить уравнение и степень валентности этого микроэлемента.
В последующем человек научился получать чистый кальций путем использования различных технологий. Проведенные в последующем исследования показали, что этот микроэлемент содержится в большом количестве в земле, причём по мере приближения к ядру его массовая доля увеличивается. Он находится в различных горных породах, но в чистом виде в природе не встречается.
Нахождение в природе
Считается, что кальций — это один из самых распространённых элементов на Земле. Его общая доля составляет 3,38% всей массы коры. Однако из-за высокой активности его большая часть содержится в составе различных оксидов. Также он встречается в горных породах, в том числе в граните, различных силикатах и алюмосиликатах. В осадочных породах это соединение представлено в виде известняка, мела и различных минералов.
Природными источниками являются:
- доломит;
- флюорит;
- кальцит;
- гипс;
- алебастр;
- апатиты.
Также широко распространены в природе минералы кальция, в том числе ангидрид, известняк, доломит, апатиты и флюорит. Соли этого элемента содержатся в пресной или морской воде, определяя её показатели жесткости.
Экспериментальным путем установлено, что кальций входит в состав различных живых организмов, в том числе в костную ткань позвоночных видов, к которым относится человек. Из карбоната состоят жёсткие панцири и раковины различных беспозвоночных, скорлупа яиц птиц с пресмыкающимися.
Характеристики вещества
В естественных условиях кальций представляет собой металл с характерным серебристо-белым цветом. Он имеет высокую химическую активность, поэтому часто образует множество различных классов и всевозможных соединений с оксидами. Этот элемент представляет большую ценность для промышленного и технического химического синтеза, он необходим для правильной жизнедеятельности большинства живых видов на планете Земля. По своим физическим свойствам кальций относится к категории щелочноземельных, он отлично растворяется в воде, в особенности много этого соединения содержится в морской воде.
Его химические и физические характеристики зависят от особенностей схемы кристаллической решетки этого элемента. Строение атома кальция стандартно и отличается простотой. В зависимости от содержащихся в нем примесей, строение решетки этого микроэлемента может быть объемно-центрическим или кубическо-гранецентрическим. За счёт наличия металлического типа связи в молекуле обеспечивается максимально возможная прочность такого соединения.
Основные свойства:
- способность быстро окисляться на воздухе;
- образует многочисленные оксиды;
- применяется в восстановительных реакциях редкоземельных металлов.
Характеристики и химические свойства кальция могут изменяться в зависимости от наличия примесей и температуры окружающей среды. В обычных условиях этот металл имеет агрегатное твердое состояние. Его температура плавления составляет 842 градусов по Цельсию. Он является отличным тепло и электропроводником. Он реагирует на изменения показателей давления, которое модифицирует конфигурацию и положение его атомной решетки. При нагревании выше температуры плавления металл становится жидким, в последующем теряет свои свойства и переходит в парообразное состояние. Температура кипения составляет 1448 градусов.
Опытным путем установлена крайне интересная способность этого элемента. Под воздействием высокого давления это соединение теряет свою способность электропроводимости и другие характеристики кальция.
Однако в последующем после остывания все параметры восстанавливаются при этом отмечаются признаки сверхпроводника, которые в несколько раз превышают аналогичные показатели других элементов. Подобное делает кальций перспективным материалом при изготовлении микрочипов и изделий точной электроники.
Основные способы получения
Кальций обладает повышенной активностью, поэтому часто входит в различные соединения с другими элементами. Именно по этой причине длительное время не удавалось получить чистый материал без содержания различных примесей. Только лишь в начале XIX века англичанину Гемфри Дэви удалось путем электролиза синтезировать металл без содержания примесей. Ученый смог обнаружить взаимодействие электрического тока и расплавов солей с твердыми минералами.
Даже сегодня по прошествии стольких лет технология электролиза солей является наиболее востребованной, что объясняется её простотой и эффективностью. В металлургии применяется способ алюминотермии, который позволяет получить металл с чистотой порядка 98%. Развитие технологий и методов получения этого металла ограничено тем фактом, что такой процесс является ресурсоемким, требуя большого количества тепловой энергии и электрического тока огромной мощности.
Чистый металл хранят в герметичных емкостях с ограниченным доступом кислорода. Для предупреждения реакции с кислородом и водой кальций заливают слоем специальной жидкости (керосином или жидким парафином), что позволяет осуществлять транспортировку и длительное хранение этого металла, предупреждая его окисление и потерю химической чистоты.
На открытом воздухе кальций быстро начинает взаимодействовать с углекислым газом и кислородом, покрываясь характерным темным налетом.
Применение кальция
В чистом виде металл кальций применяют в качестве восстановителя при химических реакциях изготовления редкоземельных сплавов. Также этот элемент незаменим как раскислитель для бронзы, стали и других различных соединений. В химической промышленности он применяется при производстве бензина, позволяя удалять из топлива лишнюю серу. Из оксидов этого элемента изготавливают оболочки электрических кабелей, также из него выполняют антифрикционные материалы, которые незаменимы в радиоэлектронике и электронной промышленности.
Кальций — это биогенный элемент, необходимый для правильного протекания всех жизненных процессов в организме человека. Он присутствует в жидкостях и тканях растений и животных, поэтому играет важнейшую роль в правильной регенерации клеток. Польза и значение этого элемента для организма была установлена в начале прошлого века, а сегодня выводы ученых подтверждены многочисленными исследованиями. У человека содержание кальция достигает 2%, а у некоторых микроорганизмов — до 38%. Ученым известно лишь несколько видов простейших животных, жизнедеятельность которых может происходить без этого микроэлемента.
Большинство растений насыщаются кальцием из почвы, потребляя чистые микроэлементы с помощью специальных окислителей, выделяемых их клетками. Животные, в том числе человек, получают этот минерал с водой и пищей. Кальций необходим для образования клеточных мембран, также этот микроэлемент требуется для правильного обмена веществ. Его нехватка в организме приводит к развитию различных опасных заболеваний, вплоть до смерти человека.
Отдельные виды беспозвоночных научились запасаться кальцием, который необходим им для построения нового скелета и защитного панциря. К сожалению, у высших животных такой способности нет, поэтому им требуется постоянно получать этот микроэлемент извне, в том числе употребляя в пищу различные овощи и фрукты. Последние исследования показали, что обеспечить правильное всасывание кальция в организме человека можно лишь при наличии большого количества витамина D и других различных ферментов.