Человечество знакомо с калием больше полутора веков. В лекции, прочитанной в Лондоне 20 ноября 1807 г. Хэмфри Дэви сообщил, что при электролизе едкого калия он получил «маленькие шарики с сильным металлическим блеском… Некоторые из них сейчас же после своего образования сгорали со взрывом». Это и был калий.

Обратите внимание: его атомный номер 19, атомная масса 39, во внешнем электронном слое — один электрон, валентность 1+. Как считают химики, именно этим объясняется исключительная подвижность калия в природе. Он входит в состав нескольких сотен минералов. Он находится в почве, в растениях, в организмах людей и животных. Он — как классический Фигаро: здесь — там — повсюду.
Калий и почва
Вряд ли можно объяснить случайностью или прихотью лингвистов тот факт, что в русском языке одним словом обозначаются и сама наша планета, и ее верхний слой — почва. «Земля-матушка», «земля-кормилица» — это, скорее, о почве, чем о планете в целом…
Но что такое почва? Самостоятельное и весьма своеобразное природное тело. Оно образуется из поверхностных слоев разнообразных горных пород под действием воздуха, воды, температурных перепадов, жизнедеятельности всевозможных обитателей Земли. Ниже, под почвой, скрыты так называемые материнские горные породы, сложенные из различных минералов. Они постепенно разрушаются и пополняют «запасы» почвы. А в почве, помимо чисто механического, постоянно происходит и другое разрушение. Его называют химическим выветриванием. Вода и углекислый газ (в меньшей мере другие вещества) постепенно разрушают минералы.
Почти 18% веса земной коры приходится на долю калийсодержащего минерала — ортоклаза. Это двойная соль кремневой кислоты K2Al2Si6O16 или K2O-Al2O3-BSiO2. Вот что происходит с ортоклазом в результате химического выветривания:
K2O*AI2O3*6SO2 + 2Н2О + CO2 → K2CO3+ Al2O3*2SO2*2H2O + + 4SiO2.
Ортоклаз превращается в каолин (разновидность глины), песок и поташ. Песок и глина идут на построение минерального костяка почвы, а K, перешедший из ортоклаза в поташ, «раскрепощается», становится доступным для растений. Но не весь сразу.
В почвенных водах молекулы K2CO3 диссоциируют: К2СO3 ↔ + К+ + КСO3— ↔ 2К+ + CO32-. Часть ионов калия остается в почвенном растворе, который для растений служит источником питания. Но большая часть ионов калия поглощается коллоидными частицами почвы, откуда корням растений извлечь их довольно трудно. Вот и получается, что, хотя калия в земле много, часто растениям его не хватает. Из-за того, что комочки почвы «запирают» большую часть калия, содержание этого элемента в морской воде почти в 50 раз меньше, чем натрия. Подсчитано, что из тысячи атомов калия, освобождающихся при химическом выветривании, только два достигают морских бассейнов, а 998 остаются в почве. «Почва поглощает калий, и в этом ее чудодейственная сила», — писал академик А. Е. Ферсман.
Калий и растения
Калий содержится во всех растениях. Отсутствие калия приводит растение к гибели. Почти весь калий находится в растениях в ионной форме — K+. Часть ионов находится в клеточном соке, другая часть поглощена структурными элементами клетки. Ионы калия участвуют во многих биохимических процессах, происходящих в растении. Установлено, что в клетках растений эти ионы находятся главным образом в протоплазме. В клеточном ядре они не обнаружены. Следовательно, в процессах размножения и в передаче наследственных признаков элемент № 19 не участвует. Но и без этого роль калия в жизни растения велика и многообразна.
Калий входит и в плоды, и в корни, и в стебли, и в листья, причем в вегетативных органах его, как правило, больше, чем в плодах. Еще одна характерная особенность: в молодых растениях больше калия, чем в старых. Замечено также, что по мере старения отдельных органов растений ионы калия перемещаются в точки наиболее интенсивного роста. При недостатке калия растения медленнее растут, их листья, особенно старые, желтеют и буреют по краям, стебель становится тонким и непрочным, а семена теряют всхожесть.
Установлено, что ионы калия активизируют синтез органических веществ в растительных клетках. Особенно сильно влияют они на процессы образования углеводов. Если калия не хватает, растение хуже усваивает углекислый газ, и для синтеза новых молекул углеводов ему недостает углеродного «сырья». Одновременно усиливаются процессы дыхания, и сахара, содержащиеся в клеточном соке, окисляются. Таким образом, запасы углеводов в растениях, оказавшихся на голодном пайке (по калию), не пополняются, а расходуются. Плоды такого растения — это особенно заметно на фруктах — будут менее сладкими, чем у растений, получивших нормальную дозу калия. Крахмал — тоже углевод, поэтому и на его содержание в плодах сильно влияет элемент № 19.
Но и это не все. Растения, получившие достаточно калия, легче переносят засуху и морозные зимы. Это объясняется тем, что элемент № 19 влияет на способность коллоидных веществ растительных клеток поглощать воду и набухать. Не хватает калия — клетки хуже усваивают и удерживают влагу, сжимаются, отмирают.
Ионы калия влияют и на азотный обмен веществ. При недостатке калия в клетках накапливается избыток аммиака. Это может привести к отравлению и гибели растения.
Уже упоминалось, что K влияет и на дыхание растений, а усиление дыхания сказывается не только на содержании углеводов. Чем интенсивнее дыхание, тем активнее идут все окислительные процессы, и многие органические вещества превращаются в органические кислоты. Избыток кислот может вызвать распад белков. Продукты этого распада — весьма благоприятная среда для грибков и бактерий. Вот почему при калийном голодании растения намного чаще поражаются болезнями и вредителями. Фрукты и овощи, содержащие продукты распада белков, плохо переносят транспортировку, их нельзя долго хранить.Одним словом, хочешь получать вкусные и хорошо сохраняющиеся плоды — корми растение калием вволю. А для зерновых калий важен еще по одной причине: он увеличивает прочность соломы и тем самым предупреждает полегание хлебов…
Интересное о калии
- ВСТРЕЧА С КАЛИЕМ? Если на складе или на товарной станции вы увидите стальные ящики с надписями: «Огнеопасно!», «От воды взрывается», то весьма вероятно, что вы встретились с калием.
Много предосторожностей предпринимают при перевозке этого металла. Поэтому, вскрыв стальной ящик, вы не увидите калия, а увидите тщательно запаянные стальные банки. В них — калий и инертный газ — единственная безопасная для калия среда. Большие партии калия перевозят в герметических контейнерах под давлением инертного газа, равным 1,5 атм.
- ЗАЧЕМ НУЖЕН МЕТАЛЛИЧЕСКИЙ КАЛИЙ? Металлический K используют как катализатор в производстве некоторых видов синтетического каучука, а также в лабораторной практике. В последнее время основным применением этого металла стало производство перекиси калия K2O2, используемой для регенерации кислорода. Сплав калия с натрием служит теплоносителем в атомных реакторах, а в производстве титана — восстановителем.
- ИЗ СОЛИ И ЩЕЛОЧИ. Получают элемент №19 чаще всего в обменной реакции расплавленных едкого калия и металлического натрия: KOH + Na → NaOH + K. Процесс идет в ректификационной колонне из никеля при температуре 380-440°С. Подобным образом получают элемент № 19 и из хлористого калия, только в этом случае температура процесса выше — 760-800°С. При такой температуре и натрий, и калий превращаются в пар, а хлористый калий (с добавками) плавится. Пары натрия пропускают через расплавленную соль и конденсируют полученные пары калия. Этим же способом получают и сплавы натрия с калием. Состав сплава в большой мере зависит от условий процесса.
- КАК БЫТЬ, ЕСЛИ вы впервые имеете дело с металлическим калием. Необходимо помнить о высочайшей реакционной способности этого металла, о том, что калий воспламеняется от малейших следов воды. Работать с калием обязательно в резиновых перчатках и защитных очках, а лучше — в маске» закрывающей все лицо. С большими количествами калия работают в специальных камерах, заполненных азотом или аргоном. (Разумеется, в специальных скафандрах.) А если K все-таки воспламенился, его тушат не водой, а содой или поваренной солью.
- КАК БЫТЬ С ОТХОДАМИ. Правила безопасности категорически запрещают накапливать в лабораториях больше двух граммов остатков или отходов какого-либо щелочного металла, калия в том числе. Отходы подлежат уничтожению на месте. Классический способ — образование под действием этилового спирта этилата калия C2H5OK: просто льют в отходы спирт. Но есть и другой — безспиртовой способ. Отходы заливают керосином или бензином. Калий с ними не реагирует и, будучи легче воды, но тяжелее этих органических жидкостей, оседает на дно. И тогда в наклоненный сосуд начинают по каплям добавлять воду. Когда вода доберется до металла, произойдет реакция и K превратится в едкое кали. Слои щелочного раствора и керосина или бензина довольно легко разделяются на делительной воронке.
- ЕСТЬ ЛИ В РАСТВОРЕ ИОНЫ КАЛИЯ? Выяснить это несложно. Проволочное колечко опустите в раствор, а затем внесите в пламя газовой горелки. Если калий есть, пламя окрасится в фиолетовый цвет, правда, не в такой яркий, как желтый цвет, придаваемый пламени соединениями натрия. Сложнее определить, сколько калия в растворе. Нерастворимых в воде соединений у этого металла немного. Обычно калий осаждают в виде перхлората — соли очень сильной хлорной кислоты HClO4. Кстати, перхлорат калия — очень сильный окислитель и в этом качестве применяется в производстве некоторых взрывчатых веществ и ракетных топлив.
- ДЛЯ ЧЕГО НУЖЕН ЦИАНИСТЫЙ КАЛИЙ? Для извлечения золота и серебра из руд. Для гальванического золочения и серебрения неблагородных металлов. Для получения многих органических веществ. Для азотирования стали — это придает ее поверхности большую прочность. К сожалению, это очень нужное вещество чрезвычайно ядовито. А выглядит KCN вполне безобидно: мелкие кристаллы белого цвета с коричневатым или серым оттенком.
- ЧТО ТАКОЕ ХРОМПИК? Точнее — хромпик калиевый. Это оранжевые кристаллы состава K2Cr2O7. Хромпик используют в производстве красителей, а его растворы — для «хромового» дубления кож, а также в качестве протравы при окраске и печатании тканей. Раствор хромпика в серной кислоте — хромовая смесь, которую во всех лабораториях применяют для мытья стеклянной посуды.
- ЗАЧЕМ НУЖНО ЕДКОЕ КАЛИ? В самом деле, зачем? Ведь свойства этой щелочи и более дешевого едкого натра практически одинаковы. Разницу между этими веществами химики обнаружили лишь в XVIII в. Самое заметное различие между NaOH и KOH в том, что едкое кали в воде растворяется еще лучше, чем едкий натр. KOH получают электролизом растворов хлористого калия. Чтобы примесь хлоридов была минимальной, используют ртутные катоды. А нужно это вещество прежде всего как исходный продукт для получения различных солей калия. Кроме того, без едкого кали не обойтись в производстве жидких мыл, некоторых красителей и органических соединений. Раствор едкого кали используется в качестве электролита в щелочных аккумуляторах.
- СЕЛИТРА ИЛИ СЕЛИТРЫ? Правильнее — селитры. Это общее название азотнокислых солей щелочных и щелочноземельных металлов. Если же говорят просто «селитра» (не «натриевая» или «кальциевая» или «аммиачная», а просто — «селитра»), то имеют в виду нитрат калия. Этим веществом человечество пользуется уже больше тысячи лет — для получения черного пороха. Кроме того, селитра — первое двойное удобрение: из трех важнейших для растений элементов в ней есть два — азот и калий. Вот как описал селитру Д. И. Менделеев в «Основах химии»:
«Селитра представляет бесцветную соль, имеющую особый прохладительный вкус. Она легко кристаллизуется длинными, по бокам бороздчатыми, ромбическими, шестигранными призмами, оканчивающимися такими же пирамидами. Ее кристаллы (уд. вес 1,93) не содержат воды. При слабом накаливании (339°) селитра плавится в совершенно бесцветную жидкость. При обыкновенной температуре в твердом виде KNO3 малодеятельна и неизменна, но при возвышенной температуре она действует как весьма сильное окисляющее средство, потому что может отдать смешанным с нею веществам значительное количество кислорода. Брошенная на раскаленный уголь селитра производит быстрое его горение, а механическая смесь ее с измельченным углем загорается от прикосновения с накаленным телом и продолжает сама собою гореть. При этом выделяется азот, а кислород селитры идет на окисление угля, вследствие чего и получаются углекалиевая соль и углекислый газ…
В химической практике и технике селитра употребляется во многих случаях как окислительное сродство, действующее при высокой температуре. На этом же основано применение ее для обыкновенного пороха, который есть механическая смесь мелко измельченных: серы, селитры и угля».
- ГДЕ И ДЛЯ ЧЕГО ПРИМЕНЯЮТСЯ ПРОЧИЕ СОЛИ КАЛИЯ? Бромистый калий KBr — в фотографии, чтобы предохранить негатив или отпечаток от вуали.
- Йодистый калий KI — в медицине и как химический реактив.
- Фтористый калий KF — в составе металлургических флюсов и для введения фтора в органические соединения.
- Углекислый калий (поташ) K2CO3 — в стекольном и мыловаренном производствах, а также как удобрение.
- Фосфаты калия, в частности K4P2O7 и K5P3O10, — как компоненты моющих средств.
- Хлорат калия (бертолетова соль) KClO3 — в спичечном производстве и пиротехнике.
- Кремнефтористый калий K2SiF6 — как добавка к шихте при извлечении редкоземельных элементов из минералов.
- Железистосинеродистый калий (желтая кровяная соль) K4Fe(CN)6-SH2O — как протрава при крашении тканей и в фотографии.
- ПОЧЕМУ КАЛИЙ НАЗВАЛИ КАЛИЕМ? Слово это арабского происхождения. По-арабски, «аль-кали» — зола растений. Впервые калий получен из едкого кали, а едкое кали — из поташа, выделенного из золы растений… Впрочем, в английском и других европейских языках сохранилось название potassium, данное калию его первооткрывателем X. Дэви. В русскую химическую номенклатуру название «калий» введено в 1831 г. Г. И. Гессом.
- ОТНЮДЬ HE ТОЛЬКО В КУРАГЕ. Сердечникам, в первую очередь людям, перенесшим инфаркт, для восполнения потерь калия в организме настоятельно рекомендуют есть курагу. Или в крайнем случае изюм. В 100 граммах кураги до 2 г калия. Столько же ее в урюке (но для точности при расчете надо вычесть вес косточек). Изюм содержит калия примерно вдвое меньше. Но не надо думать, будто сухофрукты — единственный источник калия. Его довольно много почти в любой растительной пище. Например, сорок граммов жареного картофеля эквивалентны 10 граммам отборной кураги. Богаты калием бобовые, чай, порошок какао. Одним словом, суточную дозу калия (2,5-5 г) при нормальном питании получить нетрудно.
Калий встречается в природе в виде двух стабильных нуклидов: 39К (93, 10% по массе) и 41К (6, 88%), а также одного радиоактивного 40К (0, 02%). Период полураспада калия-40 Т1/2 примерно в 3 раза меньше, чем Т1/2 урана-238 и составляет 1, 28 миллиарда лет. При β-распаде калия-40 образуется стабильный кальций-40, а при распаде по типу электронного захвата образуется инертный газ аргон-40.
Калий принадлежит к числу щелочных металлов. В периодической системе Менделеева калий занимает место в четвертом периоде в подгруппе IА. Конфигурация внешнего электронного слоя 4s1, поэтому калий всегда проявляет степень окисления +1 (валентность I).
Атомный радиус калия 0, 227 нм, радиус иона K+ 0, 133 нм. Энергии последовательной ионизации атома калия 4, 34 и 31, 8 эВ. Электроотрицательность калия по Полингу 0, 82, что говорит о его ярко выраженных металлических свойствах.
В свободном виде — мягкий, легкий, серебристый металл.
Соединения калия, как и его ближайшего химического аналога — натрия, были известны с древности и находили применение в различных областях человеческой деятельности. Однако сами эти металлы были впервые выделены в свободном состоянии только в 1807 году в ходе экспериментов английского ученого Г. Дэви. Дэви, используя гальванические элементы как источник электрического тока, провел электролиз расплавов поташа и каустической соды и таким образом выделил металлические калий и натрий, которые назвал «потассием» (отсюда сохранившееся в англоязычных странах и Франции название калия — potassium) и «содием». В 1809 году английский химик Л. В. Гильберт предложил название «калий» (от арабского аль-кали — поташ).
Содержание калия в земной коре 2, 41% по массе, калий входит в первую десятку наиболее распространенных в земной коре элементов. Основные минералы, содержащие калий: сильвин KСl (52, 44% К), сильвинит (Na, K)Cl (этот минерал представляет собой плотно спрессованную механическую смесь кристалликов хлорида калия KCl и хлорида натрия NaCl), карналлит KCl·MgCl2·6H2O (35, 8% К), различные алюмосиликаты, содержащие калий, каинит KCl·MgSO4·3H2O, полигалит K2SO4·MgSO4·2CaSO4·2H2O, алунит KAl3(SO4)2(OH)6. В морской воде содержится около 0, 04% калия.
В настоящее время калий получают при взаимодействии с жидким натрием расплавленных KOH (при 380-450°C) или KCl (при 760-890°C):
Na + KOH = NaOH + K
Калий также получают электролизом расплава KCl в смеси с K2CO3 при температурах, близких к 700°C:
2KCl = 2K + Cl2
От примесей калий очищают вакуумной дистилляцией.
Металлический калий мягок, он легко режется ножом и поддается прессованию и прокатке. Обладает кубической объемно центрированной кубической решеткой, параметр а = 0, 5344 нм. Плотность калия меньше плотности воды и равна 0, 8629 г/см3. Как и все щелочные металлы, калий легко плавится (температура плавления 63, 51°C) и начинает испаряться уже при сравнительно невысоком нагревании (температура кипения калия 761°C).
Калий, как и другие щелочные металлы, химически очень активен. Легко взаимодействует с кислородом воздуха с образованием смеси, преимущественно состоящей из пероксида К2О2 и супероксида KO2 (К2О4):
2K + O2 = K2O2, K + O2 = KO2.
При нагревании на воздухе калий сгорает фиолетово-красным пламенем. С водой и разбавленными кислотами калий взаимодействует со взрывом (воспламеняется образующийся водород):
2K + 2H2O = 2KOH + H2
Кислородсодержащие кислоты при таком взаимодействии могут восстанавливаться. Например, атом серы серной кислоты восстанавливается до S, SO2 или S2–:
8К + 4Н2SO4 = K2S + 3K2SO4 + 4H2O.
При нагревании до 200-300 °C калий реагирует с водородом с образованием солеподобного гидрида КН:
2K + H2 = 2KH
С галогенами калий взаимодействует со взрывом. Интересно отметить, что с азотом калий не взаимодействует.
Как и другие щелочные металлы, калий легко растворяется в жидком аммиаке с образованием голубых растворов. В таком состоянии калий используют для проведения некоторых реакций. При хранении калий медленно реагирует с аммиаком с образованием амида KNH2:
2K + 2NH3 жидк. = 2KNH2 + H2
Важнейшие соединения калия: оксид К2О, пероксид К2О2, супероксид К2О4, гидроксид КОН, иодид KI, карбонат K2CO3 и хлорид KCl.
Оксид калия К2О, как правило, получают косвенным путем за счет реакции пероксида и металлического калия:
2K + K2O2 = 2K2O
Этот оксид проявляет ярко выраженные основные свойства, легко реагирует с водой с образованием гидроксида калия КОН:
K2O + H2O = 2KOH
Гидроксид калия, или едкое кали, хорошо растворим в воде (до 49, 10% массе при 20°C). Образующийся раствор — очень сильное основание, относящееся к щелочам. КОН реагирует с кислотными и амфотерными оксидами:
SO2 + 2KOH = K2SO3 + H2O,
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4] (так реакция протекает в растворе) и
Al2O3 + 2KOH = 2KAlO2 + H2O (так реакция протекает при сплавлении реагентов).
В промышленности гидроксид калия KOH получают электролизом водных растворов KCl или K2CO3 c применением ионообменных мембран и диафрагм:
2KCl + 2H2O = 2KOH + Cl2+ H2,
или за счет обменных реакций растворов K2CO3 или K2SO4 с Ca(OH)2 или Ba(OH)2:
K2CO3 + Ba(OH)2 = 2KOH + BaCO3
Попадание твердого гидроксида калия или капель его растворов на кожу и в глаза вызывает тяжелые ожоги кожи и слизистых оболочек, поэтому работать с этими едкими веществами следует только в защитных очках и перчатках. Водные растворы гидроксида калия при хранении разрушают стекло, расплавы — фарфор.
Карбонат калия K2CO3 (обиходное название поташ) получают при нейтрализации раствора гидроксида калия углекислым газом:
2KOH + CO2 = K2CO3 + Н2О.
В значительных количествах поташ содержится в золе некоторых растений.
Металлический калий — материал для электродов в химических источниках тока. Сплав калия с другим щелочным металлом — натрием находит применение в качестве теплоносителя в ядерных реакторах.
В гораздо больших масштабах, чем металлический калий, находят применение его соединения. Калий — важный компонент минерального питания растений, он необходим им в значительных количествах для нормального развития, поэтому широкое применение находят калийные удобрения: хлорид калия КСl, нитрат калия, или калийная селитра, KNO3, поташ K2CO3 и другие соли калия. Поташ используют также при производстве специальных оптических стекол, как поглотитель сероводорода при очистке газов, как обезвоживающий агент и при дублении кож.
В качестве лекарственного средства находит применение иодид калия KI. Иодид калия используют также в фотографии и в качестве микроудобрения. Раствор перманганата калия КMnO4 («марганцовку») используют как антисептическое средство.
По содержанию в горных породах радиоактивного 40К определяют их возраст.
Калий — один из важнейших биогенных элементов, постоянно присутствующий во всех клетках всех организмов. Ионы калия К+ участвуют в работе ионных каналов и регуляции проницаемости биологических мембран, в генерации и проведении нервного импульса, в регуляции деятельности сердца и других мышц, в различных процессах обмена веществ. Содержание калия в тканях животных и человека регулируется стероидными гормонами надпочечников. В среднем организм человека (масса тела 70 кг) содержит около 140 г калия. Поэтому для нормальной жизнедеятельности с пищей в организм должно поступать 2-3 г калия в сутки. Богаты калием такие продукты, как изюм, курага, горох и другие.
Металлический калий может вызвать очень сильные ожоги кожи, при попадании мельчайших частичек калия в глаза возникают тяжелые поражения с потерей зрения, поэтому работать с металлическим калием можно только в защитных перчатках и очках. Загоревшийся калий заливают минеральным маслом или засыпают смесью талька и NaCl. Хранят калий в герметично закрытых железных контейнерах под слоем обезвоженного керосина или минерального масла.
- Коренман И. М. Аналитическая химия калия. М. 1964.
Калий — химический элемент, находящийся под номером 19 в периодической таблице Д.И.Менделеева. Как вещество, он представляет собой мягкий щёлочный металл с серебристо-белым цветом.
История открытия
О калии знали ещё с 11 века в Древней Греции и Риме, когда производили моющее средство под названием «поташа». Принцип его производства базировался на сжигании древесины или соломы. В получившуюся золу добавляли воду — образовывался щёлок. Консистенцию сперва фильтровали, а затем выпаривали. Остаток представлял собой соединения из карбоната калия, сульфата калия, соды и хлорида калия.
Как чистый металл, элемент начали выводить с 1807 года. Экспериментами занимались такие выдающиеся учёные, как английский химик Хэмфри Дэви, французские химики Гей-Люссак и Л. Тенар и немецкий физик Л.В. Гильберт. Обнаружить мягкий металл и отделить его от остальных веществ помог электролиз и прокаливание.
Название элемента переводится с арабского как «поташ» — смесь, получаемая после сжигания дерева. Иными словами — зола.
Где находится
Данный элемент, благодаря своей химической активности, встречается в природе исключительно в соединениях с другими веществами — с водой или минералами. Калий является 5-м металлом по распространённости в земной коре. Его добывают в России, Беларуси и Канаде.
В большом количестве металл находится в клетках человека. Он нормализует водный и кислотно-щёлочный баланс в организме, поддерживает общую концентрацию всех частиц в крови. Элемент необходим для нервной и сердечно-сосудистой системы. При его недостатке может развиться гипокалиемия.
Данная частица содержится в таких продуктах, как чечевица, шоколад, миндаль, арахис, какао, курага. Витамин В6 помогает усваиваться полезному компоненту в организме человека, а вот алкоголь наоборот, тормозит этот процесс.
Изотопы
Природный калий состоит из 3 изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным.
Химические и физические свойства
Калий моментально вступает в реакцию практически со всеми веществами. На воздухе срез этого металла быстро тускнеет, образуя оксидно-карбонатную плёнку. Если контакт с воздухом будет продолжительным — он может полностью разрушиться. А в контакте с водой взрывается.
Для безопасного хранения металла следует исключить его взаимодействие с воздухом. Его поверхность необходимо покрыть слоем силиконового масла, бензина или керосина.
Калий образует интерметаллиды (химическое соединение двух или более металлов) со следующими элементами:
- натрий;
- таллий;
- олово;
- свинец;
- висмут.
Цвет мягкого металла — серебристый с характерным блеском. Но если данный элемент или соединения с ним внести в пламя горелки, то образуется фиолетовый цвет.
Как вещество, калий мало весит и легко плавится. Например, если его растворить в ртути, то образуются амальгамы — твёрдые или жидкие сплавы ртути с другими металлами.
Где применяется
В технической промышленности калий в соединении с натрием применяется в замкнутых системах для передачи тепловой энергии. Важную биологическую роль данный химический элемент играет в питании растений. От его недостатка листья культур желтеют. В агропромышленности этот металл, наряду с фосфором и азотом, используется как удобрение.
Соединения с данным элементом применяются в медицине для создания успокаивающих или антисептических средств. В составе пороха, спичек, осветительных зарядов и взрывчатых веществ также присутствует калий.
ка́лий
ка́лий, -я
Источник: Орфографический
академический ресурс «Академос» Института русского языка им. В.В. Виноградова РАН (словарная база
2020)
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова веха (существительное):
Ассоциации к слову «калий»
Синонимы к слову «калий»
Предложения со словом «калий»
- Я возбуждённо шлёпнула по воде, приходя в восторг при мысли о том, что они здесь, что в этот самый миг вода уносит следы цианистого калия и стрихнина.
- Например, в кайсе, кураге и урюке содержание солей калия превышает 1,7 мг/100 г.
- При повышении содержания ионов калия также могут возникнуть нарушения ритма.
- (все предложения)
Цитаты из русской классики со словом «калий»
- Институт наполнился запахом эфира и цианистого калия, которым чуть-чуть не отравился Панкрат, не вовремя снявший маску.
- Больше всего было пометок именно о вторичном люэсе. Реже попадался третичный. И тогда йодистый калий размашисто занимал графу «лечение».
- От сигары и двух глотков вина у него закружилась голова и началось сердцебиение, так что понадобилось принимать бромистый калий.
- (все
цитаты из русской классики)
Значение слова «калий»
-
КА́ЛИЙ, -я, м. Химический элемент, металл серебристо-белого цвета, добываемый из углекалиевой соли (поташа). (Малый академический словарь, МАС)
Все значения слова КАЛИЙ
Смотрите также
КА́ЛИЙ, -я, м. Химический элемент, металл серебристо-белого цвета, добываемый из углекалиевой соли (поташа).
Все значения слова «калий»
-
Я возбуждённо шлёпнула по воде, приходя в восторг при мысли о том, что они здесь, что в этот самый миг вода уносит следы цианистого калия и стрихнина.
-
Например, в кайсе, кураге и урюке содержание солей калия превышает 1,7 мг/100 г.
-
При повышении содержания ионов калия также могут возникнуть нарушения ритма.
- (все предложения)
- поташ
- потассий
- щёлочь
- витамин
- вещество
- (ещё синонимы…)
- натрий
- кальций
- соль
- марганцовка
- химия
- (ещё ассоциации…)
- цианистый
- хлористый
- углекислый
- едкий
- йодистый
- (ещё…)
- Склонение
существительного «калий» - Разбор по составу слова «калий»
×òî òàêîå «ÊÀËÈÉ»? Êàê ïðàâèëüíî ïèøåòñÿ äàííîå ñëîâî. Ïîíÿòèå è òðàêòîâêà.
ÊÀËÈÉ (îò àðàá. àëü-êàëè — ïîòàø; ëàò. Kalium) Ê, õèì. ýëåìåíò I ãð. ïåðèîäè÷. ñèñòåìû; îòíîñèòñÿ ê ùåëî÷íûì ìåòàëëàì, àò. í. 19, àò. ì. 39,0983. Ñîñòîèò èç äâóõ ñòàáèëüíûõ èçîòîïîâ 39 Ê (93,259%) è 41 Ê (6,729%), à òàêæå ðàäèîàêòèâíîãî èçîòîïà 40 Ê (Ò 1/2 1,32.109 ëåò). Ïîïåðå÷íîå ñå÷åíèå çàõâàòà òåïëîâûõ íåéòðîíîâ äëÿ ïðèð. ñìåñè èçîòîïîâ 1,97.10-28 ì 2. Êîíôèãóðàöèÿ âíåø. ýëåêòðîííîé îáîëî÷êè 4s1; ñòåïåíü îêèñëåíèÿ +1; ýíåðãèÿ èîíèçàöèè Ê 0 : Ê + : Ê 2+ ñîîòâ. 4,34070 ý è 31,8196 ýÂ; ñðîäñòâî ê ýëåêòðîíó 0,47 ýÂ; ýëåêòðîîòðèöàòåëüíîñòü ïî Ïîëèíãó 0,8; àòîìíûé ðàäèóñ 0,2313 íì, èîííûé ðàäèóñ (â ñêîáêàõ óêàçàíî êîîðäèíàö. ÷èñëî) Ê + 0,151 íì (4), 0,152 íì (6), 0,160 íì (7), 0,165 íì (8), 0,178 íì (12). Ñîäåðæàíèå â çåìíîé êîðå 2,41% ïî ìàññå. Îñí. ìèíåðàëû: ñèëüâèí ÊÑl, êàðíàëëèò KCl.MgCl2.6H2O, êàëèåâûé ïîëåâîé øïàò (îðòîêëàç) K[AlSi3O8], ìóñêîâèò êàëèåâàÿ ñëþäà) KAl2[AlSi3O10](OH, F)2, êàèíèò ÊÑl.MgSO4.3H2O, ïîëèãàëèò K2SO4.MgSO4.2CaSO4.2Í 2 Î, àëóíèò KAl3(SO4)2(OH)6. Ñâîéñòâà. Ê. — ìÿãêèé ñåðåáðèñòî-áåëûé ìåòàëë ñ êóáè÷. ðåøåòêîé, à =0,5344 íì, z =2, ïðîñòðàíñòâ. ãðóïïà Im3m. Ò. ïë. 63,51 °Ñ, ò. êèï. 761 °Ñ; ïëîòí. 0,8629 ã/ñì 3; Ñ 0p 29,60 Äæ/(ìîëü. Ê); DH0 ïë 2,33 êÄæ/ìîëü, DH0 âîçã 89,0 êÄæ/ìîëü; S029864,68 Äæ/(ìîëü. Ê); óð-íèå òåìïåðàòóðíîé çàâèñèìîñòè äàâëåíèÿ ïàðà (â ìì ðò. ñò.): lgp =7,34 — 4507/T(373-474 Ê); r 6,23.10-8 Îì. ì (0°Ñ), 8,71.10-8 Îì. ì (25°C) è 13,38.10-8 Îì. ì (77°Ñ); g 0,114 Í/ì (334 Ê), h 5,096.10-4 Í. ñ/ì 2 (350 Ê); òåïëîïðîâîäíîñòü 99,3 Âò/(ì. Ê) ïðè 273 Ê è 44,9 Âò/(ì. Ê) ïðè 473 Ê; ïðè 273-323 Ê òåìïåðàòóðíûå êîýô. ëèíåéíîãî è îáúåìíîãî ðàñøèðåíèÿ ñîñòàâëÿþò ñîîòâ. 8,33.10-5 Ê -1 è 2,498.10-4 Ê -1. Ê. ìîæåò îáðàáàòûâàòüñÿ ïðåññîâàíèåì è ïðîêàòêîé. Ê. õèìè÷åñêè î÷åíü àêòèâåí. Ëåãêî âçàèìîä. ñ Î 2 âîçäóõà, îáðàçóÿ êàëèÿ îêñèä Ê 2 Î, ïåðîêñèä Ê 2 Î 2 è íàäïåðîêñèä ÊÎ 2; ïðè íàãð. íà âîçäóõå çàãîðàåòñÿ. Ñ âîäîé è ðàçá. ê-òàìè âçàèìîä. ñî âçðûâîì è âîñïëàìåíåíèåì, ïðè÷åì H2SO4 âîññòàíàâëèâàåòñÿ äî S2-, S0 è SO2, à ÍNÎ 3 — äî NO, N2O è N2. Ïðè íàãð. äî 200-350 °Ñ ðåàãèðóåò ñ Í 2 ñ îáðàçîâàíèåì ãèäðèäà ÊÍ. Âîñïëàìåíÿåòñÿ â àòìîñôåðå F2, ñëàáî âçàèìîä. ñ æèäêèì Ñl2, íî âçðûâàåòñÿ ïðè ñîïðèêîñíîâåíèè ñ Âr2 è ðàñòèðàíèè ñ I2; ïðè êîíòàêòå ñ ìåæãàëîãåííûìè ñîåä. âîñïëàìåíÿåòñÿ èëè âçðûâàåòñÿ. Ñ S, Se è Òå ïðè ñëàáîì íàãðåâàíèè îáðàçóåò ñîîòâ. K2S, K2Se è Ê 2 Òå, ïðè íàãð. ñ Ð â àòìîñôåðå àçîòà — Ê 3 Ð è Ê 2 Ð 5, ñ ãðàôèòîì ïðè 250-500 °Ñ — ñëîèñòûå ñîåä. ñîñòàâà Ñ 8 Ê-Ñ 60 Ê. Ñ ÑÎ 2 íå ðåàãèðóåò çàìåòíî ïðè 10-30°Ñ; ñòåêëî è ïëàòèíó ðàçðóøàåò âûøå 350-400 °Ñ. Ê. ðàñòâ. â æèäêîì NH3 (35,9 ã â 100 ìë ïðè — 70 °Ñ), àíèëèíå, ýòèëåíäèàìèíå, ÒÃÔ è äèãëèìå ñ îáðàçîâàíèåì ð-ðîâ ñ ìåòàëëè÷. ïðîâîäèìîñòüþ. Ð-ð â NH3 èìååò òåìíî-ñèíèé öâåò, â ïðèñóò. Pt è ñëåäîâ âîäû ðàçëàãàåòñÿ, äàâàÿ KNH2 è Í 2. Ñ àçîòîì Ê. íå âçàèìîä. äàæå ïîä äàâëåíèåì ïðè âûñîêèõ ò-ðàõ. Ïðè âçàèìîä. ñ NH4N3 â æèäêîì NH3 îáðàçóåòñÿ àçèä KN3. Ê. íå ðàñòâ. â æèäêèõ Li, Mg, Cd, Zn, Al è Ga è íå ðåàãèðóåò ñ íèìè. Ñ íàòðèåì îáðàçóåò èíòåðìåòàëëèä KNa2 (ïëàâèòñÿ èíêîíãðóýíòíî ïðè 7°Ñ), ñ ðóáèäèåì è öåçèåì -òâåðäûå ð-ðû, äëÿ ê-ðûõ ìèíèì. ò-ðû ïëàâëåíèÿ ñîñòàâëÿþò ñîîòâ. 32,8 °Ñ (81,4% ïî ìàññå Rb) è — 37,5 °Ñ (77,3% Cs). Ñ ðòóòüþ äàåò àìàëüãàìó, ñîäåðæàùóþ äâà ìåðêóðèäà -KHg2 è KHg (ò. ïë. ñîîòâ. 270 °Ñ è 180°Ñ). Ñ òàëëèåì îáðàçóåò ÊÒl (ò. ïë. 335 °Ñ), ñ îëîâîì — K2Sn, KSn, KSn2 è KSn4, ñî ñâèíöîì — ÊÐb (ò. ïë. 568 °Ñ) è ôàçû ñîñòàâà Ê 2 Ðb3, ÊÐb2 è ÊÐb4, ñ ñóðüìîé — Ê 3Sb è KSb (ò. ïë. ñîîòâ. 812 è 605 °Ñ), ñ âèñìóòîì — K3Bi, K3Bi2 è KBi2 (ò. ïë. ñîîòâ. 671, 420 è 553 °C). Ê. ýíåðãè÷íî âçàèìîä. ñ îêñèäàìè àçîòà, à ïðè âûñîêèõ ò-ðàõ — ñ ÑÎ è ÑÎ 2. Âîññòàíàâëèâàåò  2 Î 3 è SiO2 ñîîòâ. äî  è Si, îêñèäû Al, Hg, Ag, Ni è äð. — äî ñâîá. ìåòàëëîâ, ñóëüôàòû, ñóëüôèòû, íèòðàòû, íèòðèòû, êàðáîíàòû è ôîñôàòû ìåòàëëîâ — äî îêñèäîâ èëè ñâîá. ìåòàëëîâ. Ñî ñïèðòàìè Ê. îáðàçóåò àëêîãîëÿòû, ñ ãàëîãåíàëêèëàìè è ãàëîãåíàðèëàìè — ñîîòâ. êàëèéàëêèëû è êàëèéàðèëû. Âàæíåéøèì ñîåä. Ê. ïîñâÿùåíû îòä. ñòàòüè (ñì., íàïð., Êàëèÿ ãèäðîêñèä, Êàëèÿ èîäèä, Êàëèÿ êàðáîíàò, Êàëèÿ õëîðèä). Íèæå ïðèâîäÿòñÿ ñâåäåíèÿ î äð. âàæíûõ ñîåäèíåíèÿõ. Ïåðîêñèä Ê 2 Î 2 — áåñöâ. êðèñòàëëû ñ ðîìáè÷. ðåøåòêîé ( à =0,6736 íì, b= 0,7001 íì, ñ =0,6479 íì, z = 4, ïðîñòðàíñòâ. ãðóïïà Ðïïï); ò. ïë. 545 °Ñ; ïëîòí. 2,40 ã/ñì 3; C0p 90,8 Äæ/(ìîëü. Ê); DH0 ïë 20,5 êÄæ/ìîëü, DH0 îáð -443,0 êÄæ/ìîëü; S0298 117 Äæ/(ìîëü. Ê). Íà âîçäóõå Ê 2 Î 2 ìãíîâåííî îêèñëÿåòñÿ äî ÊÎ 2; ýíåðãè÷íî âçàèìîä. ñ âîäîé ñ îáðàçîâàíèåì ÊÎÍ è Î 2, ñ ÑÎ 2 äàåò Ê 2 ÑÎ 3 è Î 2. Ïîëó÷àþò ïåðîêñèä ïðîïóñêàíèåì äîçèðîâàííîãî êîë-âà Î 2 ÷åðåç ð-ð Ê. â æèäêîì NH3, ðàçëîæåíèåì ÊÎ 2 â âàêóóìå ïðè 340-350 °Ñ. Íàäïåðîêñèä ÊÎ 2 — æåëòûå êðèñòàëëû ñ òåòðàãîí. ðåøåòêîé ( à ×0,5704 íì, ñ ×0,6699 íì, z = 4, ïðîñòðàíñòâ. ãðóïïà I4/mmm; ïëîòí. 2,158 ã/ñì 3); âûøå 149°Ñ ïåðåõîäèò â êóáè÷. ìîäèôèêàöèþ (à= 0,609 íì); ò. ïë. 535 °Ñ; Ñ 0p 77,5 Äæ/(ìîëü. Ê); DH0 îáð — 283,2 êÄæ/ìîëü, DH0 ïë 20,6 êÄæ/ìîëü; S0298 125,4 Äæ/(ìîëü. Ê); ïàðàìàãíåòèê. Ñèëüíûé îêèñëèòåëü. Âçàèìîä. ñ âîäîé ñ îáðàçîâàíèåì ÊÎÍ è Î 2. Äèññîöèèðóåò, íàïð., â áåíçîëå, äàâàÿ àíèîí-ðàäèêàë Î 2-. Ñåðà ïðè íàãð. ñ ÊÎ 2 âîñïëàìåíÿåòñÿ è äàåò K2SO4. Ñ âëàæíûìè ÑÎ 2 è ÑÎ íàäïåðîêñèä îáðàçóåò Ê 2 ÑÎ 3 è Î 2, ñ NO2 — KNO3 è Î 2, ñ SO2 — K2SO4 è Î 2. Ïðè äåéñòâèè êîíö. H2SO4 âûäåëÿåòñÿ Î 3, ïðè ð-öèè ñ NH3 îáðàçóþòñÿ N2, H2O è ÊÎÍ. Ñìåñü ÊÎ 2 ñ ãðàôèòîì âçðûâàåò. Ïîëó÷àþò íàäïåðîêñèä ñæèãàíèåì Ê. â âîçäóõå, îáîãàùåííîì âëàæíûì Î 2 è íàãðåòîì äî 75-80 °Ñ. Îçîíèä ÊÎ 3 — êðàñíûå êðèñòàëëû ñ òåòðàãîí. ðåøåòêîé ( à =0,8597 íì, ñ= 0,7080 íì, ïðîñòðàíñòâ. ãðóïïà I4/mcm); ïëîòí. 1,99 ã/ñì 3; óñòîé÷èâ òîëüêî ïðè õðàíåíèè â ãåðìåòè÷åñêè çàêðûòûõ ñîñóäàõ íèæå 0°Ñ, ïðè áîëåå âûñîêîé ò-ðå ðàñïàäàåòñÿ íà ÊÎ 2 è Î 2; Ñ 0p >75 Äæ/(ìîëü. Ê); S0298 105 Äæ/(ìîëü. Ê); ïàðàìàãíåòèê. Ð-ðèìîñòü â æèäêîì NH3 (ã â 100 ã); 14,82 (-35°Ñ), 12,00 (-63,5°Ñ), ýâòåêòèêà NH3 — KO3 (5 ã â 100 ã NH3) èìååò ò. ïë. — 80 °Ñ; ïðè äëèò. õðàíåíèè àììèà÷íûå ð-ðû ðàçëàãàþòñÿ íà NH4O3 è KNH2. Ðàñòâ. â ôðåîíàõ. ÊÎ 3 — ñèëüíûé îêèñëèòåëü; ìãíîâåííî ðåàãèðóåò ñ âîäîé óæå ïðè 0 °Ñ, äàâàÿ ÊÎÍ è Î 2; ñ âëàæíûì ÑÎ 2 îáðàçóåò Ê 2 ÑÎ 3 è ÊÍÑÎ 3. Ïîëó÷àþò: âçàèìîä. ñìåñè Î 3 è Î 2 ñ ÊÎÍ èëè ÊÎ 2 ïðè ò-ðå íèæå 0°Ñ ñ ïîñëåä. ýêñòðàêöèåé æèäêèì NH3; îçîíèðîâàíèåì ñóñïåíçèè ÊÎ 2 èëè ÊÎÍ âî ôðåîíå 12. Íàäïåðîêñèä, ïåðîêñèä è îçîíèä Ê. — êîìïîíåíòû ñîñòàâîâ äëÿ ðåãåíåðàöèè âîçäóõà â çàìêíóòûõ ñèñòåìàõ (øàõòû, ïîäâîäíûå ëîäêè, êîñìè÷. êîðàáëè). Ãèäðèä ÊÍ — áåñöâ. êðèñòàëëû ñ êóáè÷. ðåøåòêîé ( à =0,570 íì, z = 4, ïðîñòðàíñòâ. ãðóïïà Fm3m); ò. ïë. 619 °Ñ ïðè äàâëåíèè âîäîðîäà 6,86 ÌÏà; ïëîòí. 1,52 ã/ñì 3; Ñ 0p38,1 Äæ/(ìîëü. Ê); DH0 îáð -57,8 êÄæ/ìîëü, DH0 ïë 21,3 êÄæ/ìîëü; S0298 50,2 Äæ/(ìîëü. Ê). Ðàçëàãàåòñÿ ïðè íàãð. íà Ê. è Í 2. Ñèëüíûé âîññòàíîâèòåëü. Âîñïëàìåíÿåòñÿ âî âëàæíîì âîçäóõå, â ñðåäå F2 è Ñl2. Ýíåðãè÷íî âçàèìîä. ñ âîäîé, äàâàÿ ÊÎÍ è Í 2. Ïðè íàãð. ñ N2 èëè NH3 îáðàçóåò KNH2, ñ H2S — K2S è Í 2, ñ ðàñïëàâë. ñåðîé — K2S è H2S, ñ âëàæíûì ÑO2 — ÍÑÎÎÊ, ñ ÑÎ — ÍÑÎÎÊ è Ñ. Ïîëó÷àþò ÊÍ âçàèìîä. Ê. ñ èçáûòêîì Í 2 ïðè 300-400 °Ñ. Ãèäðèä âîññòàíîâèòåëü â íåîðã. è îðã. ñèíòåçàõ. Àçèä ÊN3 — áåñöâ. êðèñòàëëû ñ òåòðàãîí. ðåøåòêîé (à= 0,6094 íì, ñ= 0,7056 íì, z = 4, ïðîñòðàíñòâ. ãðóïïà I4/mcm); Ñ 0 ð >76,9 Äæ/(ìîëü. Ê); DH0 îáð -1,7 êÄæ/ìîëü; S0298 104,0 Äæ/(ìîëü. Ê); ò. ïë. 354 °Ñ, âûøå ðàçëàãàåòñÿ íà Ê. è àçîò; ïëîòí. 2,056 ã/ñì 3. Ð-ðèìîñòü (ã â 100 ã ð-ðèòåëÿ): âîäà -41,4 (0°Ñ), 105,7 (100°Ñ), ýòàíîë — 0,137 (16°Ñ).  ýôèðå è áåíçîëå ðàñòâ. ïëîõî. Âîäîé ãèäðîëèçóåòñÿ; ýâòåêòèêà Í 2 Î -KN3 (35,5 ã â 100 ã) èìååò ò. ïë. — 12°Ñ. Ïîëó÷àþò: âçàèìîä. N2O ñ ðàñïëàâë. KNH2 ïðè 280 °Ñ; äåéñòâèåì ÊÎÍ íà ð-ð HN3. Ïîëó÷åíèå. Ê. ïðîèçâîäÿò âçàèìîä. Na ñ ÊÎÍ ïðè 380-450 °Ñ èëè ÊÑl ïðè 760-890 °Ñ. Ð-öèè ïðîâîäÿò â àòìîñôåðå N2. Âçàèìîä. ÊÎÍ ñ æèäêèì Na îñóùåñòâëÿþò ïðîòèâîòîêîì â òàðåëü÷àòîé êîëîííå èç Ni. Ïðè ð-öèè ñ ÊÑl ïàðû Na ïðîïóñêàþò ÷åðåç ðàñïëàâ ÊÑl. Ïðîäóêò ð-öèé -ñïëàâ Ê — Na. Åãî ïîäâåðãàþò ðåêòèôèêàöèè è ïîëó÷àþò Ê. ñ ñîäåðæàíèåì ïðèìåñåé (â % ïî ìàññå): 1.10-3 Na è 1.10-4 Ñ1. Êðîìå òîãî, Ê. ïîëó÷àþò: âàêóóì-òåðìè÷. âîññòàíîâëåíèåì ÊÑl êàðáèäîì ÑàÑ 2, ñïëàâàìè Si-Fe èëè Si-Al ïðè 850-950 °Ñ è îñòàòî÷íîì äàâëåíèè 1,33 13,3 Ïà; íàãðåâàíèåì Ê 2 Ñr2 Î 7 ñ Zr ïðè 400 °Ñ; ýëåêòðîëèçîì ÊÎÍ ñ æåëåçíûì êàòîäîì; ýëåêòðîëèçîì ÊÑl (èëè åãî ñìåñè Ê 2 ÑÎ 3) ñ æèäêèì ñâèíöîâûì êàòîäîì ïðè 680-720 °Ñ ñ ïîñëåä. ðàçäåëåíèåì Ê è Ðb âàêóóìíîé äèñòèëëÿöèåé; ýëåêòðîëèçîì 50%-íîãî ð-ðà KNH2 â æèäêîì NH3 ïðè 25 °Ñ è äàâëåíèè 0,75 ÌÏà ñ àìàëüãàìîé Ê. â êà÷åñòâå àíîäà è êàòîäîì èç íåðæàâåþùåé ñòàëè, ïðè ýòîì îáðàçóåòñÿ 30%-íûé ð-ð Ê. â æèäêîì NH3, ê-ðûé âûâîäèòñÿ èç àïïàðàòà äëÿ îòäåëåíèÿ Ê. Îïðåäåëåíèå. Êà÷åñòâåííî Ê. îáíàðóæèâàþò ïî ðîçîâî-ôèîëåòîâîìó îêðàøèâàíèþ ïëàìåíè è ïî õàðàêòåðíûì ëèèíèÿì ñïåêòðà: 404,41, 404,72, 766,49, 769,90 íì. Íàèá. ðàñïðîñòðàíåííûå êîëè÷åñòâ. ìåòîäû, îñîáåííî â ïðèñóò. äð. ùåëî÷íûõ ìåòàëëîâ, — ýìèññèîííàÿ ïëàìåííàÿ ôîòîìåòðèÿ (÷óâñòâèòåëüíîñòü 1.10-4 ìêã/ìë) è àòîìíî-àáñîðáö. ñïåêòðîìåòðèÿ (÷óâñòâèòåëüíîñòü 0,01 ìêã/ìë).  ìåíüøåé ñòåïåíè èñïîëüçóþòñÿ õèìèêî-ñïåêòðàëüíûé è ñïåêòðîôîòîìåòðè÷. ìåòîäû ñ ïðèìåíåíèåì äèïèêðèëàìèíà (÷óâñòâèòåëüíîñòü 0,2-1,0 ìêã/ìë). Ïðè áîëüøîì ñîäåðæàíèè Ê. â ïðîáå ïðèìåíÿþò ãðàâèìåòðè÷. ìåòîä ñ îñàæäåíèåì Ê. â âèäå òåòðàôåíèëáîðàòà, K2[PtCl6] èëè ÊÑlO4 â ñðåäå áóòàíîëà. Ïðèìåíåíèå. Ê. — ìàòåðèàë ýëåêòðîäîâ â õèì. èñòî÷íèêàõ òîêà; êîìïîíåíò êàòîäîâ-ýìèòòåðîâ ôîòîýëåìåíòîâ è òåðìîýìèññèîííûõ ïðåîáðàçîâàòåëåé, à òàêæå ôîòîýëåêòðîííûõ óìíîæèòåëåé; ãåòòåð â âàêóóìíûõ ðàäèîëàìïàõ; àêòèâàòîð êàòîäîâ ãàçîðàçðÿäíûõ óñòðîéñòâ. Ñïëàâ Ê. ñ Na -òåïëîíîñèòåëü â ÿäåðíûõ ðåàêòîðàõ. Ðàäèîàêòèâíûé èçîòîï 40 Ê ñëóæèò äëÿ îïðåäåëåíèÿ âîçðàñòà ãîðíûõ ïîðîä (êàëèéàðãîíîâûé ìåòîä). Èñêóññòâ. èçîòîï 42 Ê (T1/2 12,52 ãîäà) -ðàäèîàêòèâíûé èíäèêàòîð â ìåäèöèíå è áèîëîãèè. Ê. — âàæíåéøèé ýëåìåíò (â âèäå ñîåä.) äëÿ ïèòàíèÿ ðàñòåíèé (ñì. Êàëèéíûå óäîáðåíèÿ). Ê. âûçûâàåò ñèëüíûå îæîãè êîæè, ïðè ïîïàäàíèè ìåëü÷àéøèõ åãî êðîøåê â ãëàçà òÿæåëî èõ ïîðàæàåò, âîçìîæíà ïîòåðÿ çðåíèÿ. Çàãîðåâøèéñÿ Ê. çàëèâàþò ìèíåð. ìàñëîì èëè çàñûïàþò ñìåñüþ òàëüêà è NaCl. Õðàíÿò Ê. â ãåðìåòè÷åñêè çàêðûòûõ æåëåçíûõ êîðîáêàõ ïîä ñëîåì îáåçâîæåííîãî êåðîñèíà èëè ìèíåð. ìàñëà. Îòõîäû Ê. óòèëèçèðóþò îáðàáîòêîé èõ ñóõèì ýòàíîëîì èëè ïðîïàíîëîì ñ ïîñëåä. ðàçëîæåíèåì îáðàçîâàâøèõñÿ àëêîãîëÿòîâ âîäîé. Ê. îòêðûë Ã. Äýâè â 1807. Ëèò.: Íàòðèé è êàëèé, Ë., 1959; Êîðåíìàí È. Ì., Àíàëèòè÷åñêàÿ õèìèÿ êàëèÿ, Ì., 1964; Òåïëîôèçè÷åñêèe ñâîéñòâà ùåëî÷íûõ ìåòàëëîâ, Ì., 1970, (Òð. ÌÝÈ, â. 75); Âîëüíîâ È. È., Ïåðåêèñíûå ñîåäèíåíèÿ ùåëî÷íûõ ìåòàëëîâ, Ì., 1980. Á. Ä. Ñòåïèí.
ÊÀËÈÉ — ÊÀËÈÉ ì. ïîòàñèé, ìåòàëë, ñîñòàâëÿþùèé îñíîâàíüå êàëè, âåñüìà ñõîäíûé ñ íàòðèåì (ñîäèåì). Êàëè ñð. í… Òîëêîâûé ñëîâàðü Äàëÿ
ÊÀËÈÉ — ÊÀËÈÉ, Öÿ, ì. Õèìè÷åñêèé ýëåìåíò, ìÿãêèé ìåòàëë ñåðåáðèñòî-áåëîãî öâåòà…. Òîëêîâûé ñëîâàðü Îæåãîâà
ÊÀËÈÉ —
(Kalium)
Ê, õèìè÷åñêèé ýëåìåíò 1 ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû Ìåíäåëååâà; àòîìíûé íîìåð 19,… Áîëüøàÿ Ñîâåòñêàÿ ýíöèêëîïåäèÿ
ÊÀËÈÉ — ÊÀËÈÉ, êàëèÿ, ìí. íåò, ì., è êàëè, íåñêë., ñð. (àðàá. — ïîòàø) (õèì.). Õèìè÷åñêèé ýëåìåíò — ùåëî÷íûé… Òîëêîâûé ñëîâàðü Óøàêîâà
ÊÀËÈÉ — ì. 1. Õèìè÷åñêèé ýëåìåíò, ñåðåáðèñòî-áåëûé, ìÿãêèé, ëåãêîïëàâêèé ìåòàëë, ïðèìåíÿþùèéñÿ (â ñîåäèíåíè… Òîëêîâûé ñëîâàðü Åôðåìîâîé
ÊÀËÈÉ — ÊÀËÈÉ (Kalium), K, õèìè÷åñêèé ýëåìåíò I ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû, àòîìíûé íîìåð 19, àòîìíàÿ ìàññ… Ñîâðåìåííàÿ ýíöèêëîïåäèÿ
ÊÀËÈÉ — ÊÀËÈÉ (ëàò. Kalium) — Ê, õèìè÷åñêèé ýëåìåíò I ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû, àòîìíûé íîìåð 19, àòîìíà… Áîëüøîé ýíöèêëîïåäè÷åñêèé ñëîâàðü
ÊÀËÈÉ —
I
(Kalium, Ê)
õèìè÷åñêèé ýëåìåíò ãëàâíîé ïîäãðóïïû I ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû ýëåìåíòîâ Ä.È. Ìå… Ìåäèöèíñêàÿ ýíöèêëîïåäèÿ
ÊÀËÈÉ —
K (îò àðàá, àëü-êàëè — ïîòàø * a. Potassium, potash; í. Kalium; ô. potassium; è. potasio), … Ãåîëîãè÷åñêàÿ ýíöèêëîïåäèÿ

Potassium pearls (in paraffin oil, ~5 mm each) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Potassium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (pə-TASS-ee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery white, faint bluish-purple hue when exposed to air | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Potassium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 1: hydrogen and alkali metals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 336.7 K (63.5 °C, 146.3 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1030.793 K (757.643 °C, 1395.757 °F)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 0.89 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 0.82948 g/cm3[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 2223 K, 16 MPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 2.33 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 76.9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 29.6 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −1, +1 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 0.82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 227 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 203±12 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 275 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of potassium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2000 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 83.3 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 102.5 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 72 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +20.8×10−6 cm3/mol (298 K)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 3.53 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 1.3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 3.1 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 0.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 0.363 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-09-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Humphry Davy (1807) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «K»: from New Latin kalium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of potassium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Potassium is the chemical element with the symbol K (from Neo-Latin kalium) and atomic number 19. It is a silvery white metal that is soft enough to easily cut with a knife.[6] Potassium metal reacts rapidly with atmospheric oxygen to form flaky white potassium peroxide in only seconds of exposure. It was first isolated from potash, the ashes of plants, from which its name derives. In the periodic table, potassium is one of the alkali metals, all of which have a single valence electron in the outer electron shell, which is easily removed to create an ion with a positive charge (which combines with anions to form salts). In nature, potassium occurs only in ionic salts. Elemental potassium reacts vigorously with water, generating sufficient heat to ignite hydrogen emitted in the reaction, and burning with a lilac-colored flame. It is found dissolved in seawater (which is 0.04% potassium by weight),[7][8] and occurs in many minerals such as orthoclase, a common constituent of granites and other igneous rocks.[9]
Potassium is chemically very similar to sodium, the previous element in group 1 of the periodic table. They have a similar first ionization energy, which allows for each atom to give up its sole outer electron. It was suspected in 1702 that they were distinct elements that combine with the same anions to make similar salts,[10] and this was proven in 1807 through using electrolysis. Naturally occurring potassium is composed of three isotopes, of which 40
K is radioactive. Traces of 40
K are found in all potassium, and it is the most common radioisotope in the human body.
Potassium ions are vital for the functioning of all living cells. The transfer of potassium ions across nerve cell membranes is necessary for normal nerve transmission; potassium deficiency and excess can each result in numerous signs and symptoms, including an abnormal heart rhythm and various electrocardiographic abnormalities. Fresh fruits and vegetables are good dietary sources of potassium. The body responds to the influx of dietary potassium, which raises serum potassium levels, by shifting potassium from outside to inside cells and increasing potassium excretion by the kidneys.
Most industrial applications of potassium exploit the high solubility of its compounds in water, such as saltwater soap. Heavy crop production rapidly depletes the soil of potassium, and this can be remedied with agricultural fertilizers containing potassium, accounting for 95% of global potassium chemical production.[11]
Etymology
The English name for the element potassium comes from the word potash,[12] which refers to an early method of extracting various potassium salts: placing in a pot the ash of burnt wood or tree leaves, adding water, heating, and evaporating the solution. When Humphry Davy first isolated the pure element using electrolysis in 1807, he named it potassium, which he derived from the word potash.
The symbol K stems from kali, itself from the root word alkali, which in turn comes from Arabic: القَلْيَه al-qalyah ‘plant ashes’. In 1797, the German chemist Martin Klaproth discovered «potash» in the minerals leucite and lepidolite, and realized that «potash» was not a product of plant growth but actually contained a new element, which he proposed calling kali.[13] In 1807, Humphry Davy produced the element via electrolysis: in 1809, Ludwig Wilhelm Gilbert proposed the name Kalium for Davy’s «potassium».[14] In 1814, the Swedish chemist Berzelius advocated the name kalium for potassium, with the chemical symbol K.[15]
The English and French-speaking countries adopted Davy and Gay-Lussac/Thénard’s name Potassium, whereas the Germanic countries adopted Gilbert/Klaproth’s name Kalium.[16] The «Gold Book» of the International Union of Pure and Applied Chemistry has designated the official chemical symbol as K.[17]
Properties
Physical
Potassium is the second least dense metal after lithium. It is a soft solid with a low melting point, and can be easily cut with a knife. Freshly cut potassium is silvery in appearance, but it begins to tarnish toward gray immediately on exposure to air.[18] In a flame test, potassium and its compounds emit a lilac color with a peak emission wavelength of 766.5 nanometers.[19]
Neutral potassium atoms have 19 electrons, one more than the configuration of the noble gas argon. Because of its low first ionization energy of 418.8 kJ/mol, the potassium atom is much more likely to lose the last electron and acquire a positive charge, although negatively charged alkalide K− ions are not impossible.[20] In contrast, the second ionization energy is very high (3052 kJ/mol).
Chemical
Potassium reacts with oxygen, water, and carbon dioxide components in air. With oxygen it forms potassium peroxide. With water potassium forms potassium hydroxide (KOH). The reaction of potassium with water can be violently exothermic, especially since the coproduced hydrogen gas can ignite. Because of this, potassium and the liquid sodium-potassium (NaK) alloy are potent desiccants, although they are no longer used as such.[21]
Compounds
Structure of solid potassium superoxide (
KO2).
Four oxides of potassium are well studied: potassium oxide (K2O), potassium peroxide (K2O2), potassium superoxide (KO2)[22] and potassium ozonide (KO3). The binary potassium-oxygen compounds react with water forming KOH.
KOH is a strong base. Illustrating its hydrophilic character, as much as 1.21 kg of KOH can dissolve in a single liter of water.[23][24] Anhydrous KOH is rarely encountered. KOH reacts readily with carbon dioxide (CO2) to produce potassium carbonate (K2CO3), and in principle could be used to remove traces of the gas from air. Like the closely related sodium hydroxide, KOH reacts with fats to produce soaps.
In general, potassium compounds are ionic and, owing to the high hydration energy of the K+ ion, have excellent water solubility. The main species in water solution are the aquo complexes [K(H2O)n]+ where n = 6 and 7.[25]
Potassium heptafluorotantalate (K2[TaF7]) is an intermediate in the purification of tantalum from the otherwise persistent contaminant of niobium.[26]
Organopotassium compounds illustrate nonionic compounds of potassium. They feature highly polar covalent K–C bonds. Examples include benzyl potassium KCH2C6H5. Potassium intercalates into graphite to give a variety of graphite intercalation compounds, including KC8.
Isotopes
There are 25 known isotopes of potassium, three of which occur naturally: 39
K (93.3%), 40
K (0.0117%), and 41
K (6.7%) (by mole fraction). Naturally occurring 40
K has a half-life of 1.250×109 years. It decays to stable 40
Ar by electron capture or positron emission (11.2%) or to stable 40
Ca by beta decay (88.8%).[27] The decay of 40
K to 40
Ar is the basis of a common method for dating rocks. The conventional K-Ar dating method depends on the assumption that the rocks contained no argon at the time of formation and that all the subsequent radiogenic argon (40
Ar) was quantitatively retained. Minerals are dated by measurement of the concentration of potassium and the amount of radiogenic 40
Ar that has accumulated. The minerals best suited for dating include biotite, muscovite, metamorphic hornblende, and volcanic feldspar; whole rock samples from volcanic flows and shallow instrusives can also be dated if they are unaltered.[27][28] Apart from dating, potassium isotopes have been used as tracers in studies of weathering and for nutrient cycling studies because potassium is a macronutrient required for life[29] on Earth.
40
K occurs in natural potassium (and thus in some commercial salt substitutes) in sufficient quantity that large bags of those substitutes can be used as a radioactive source for classroom demonstrations. 40
K is the radioisotope with the largest abundance in the human body. In healthy animals and people, 40
K represents the largest source of radioactivity, greater even than 14
C. In a human body of 70 kg, about 4,400 nuclei of 40
K decay per second.[30] The activity of natural potassium is 31 Bq/g.[31]
Cosmic formation and distribution
Potassium is formed in supernovae by nucleosynthesis from lighter atoms. Potassium is principally created in Type II supernovae via an explosive oxygen-burning process.[32] (These are fusion reactions; do not confuse with chemical burning between potassium and oxygen.) 40
K is also formed in s-process nucleosynthesis and the neon burning process.[33]
Potassium is the 20th most abundant element in the solar system and the 17th most abundant element by weight in the Earth. It makes up about 2.6% of the weight of the Earth’s crust and is the seventh most abundant element in the crust.[34] The potassium concentration in seawater is 0.39 g/L[7] (0.039 wt/v%), about one twenty-seventh the concentration of sodium.[35][36]
Potash
Potash is primarily a mixture of potassium salts because plants have little or no sodium content, and the rest of a plant’s major mineral content consists of calcium salts of relatively low solubility in water. While potash has been used since ancient times, its composition was not understood. Georg Ernst Stahl obtained experimental evidence that led him to suggest the fundamental difference of sodium and potassium salts in 1702,[10] and Henri Louis Duhamel du Monceau was able to prove this difference in 1736.[37] The exact chemical composition of potassium and sodium compounds, and the status as chemical element of potassium and sodium, was not known then, and thus Antoine Lavoisier did not include the alkali in his list of chemical elements in 1789.[38][39] For a long time the only significant applications for potash were the production of glass, bleach, soap and gunpowder as potassium nitrate.[40] Potassium soaps from animal fats and vegetable oils were especially prized because they tend to be more water-soluble and of softer texture, and are therefore known as soft soaps.[11] The discovery by Justus Liebig in 1840 that potassium is a necessary element for plants and that most types of soil lack potassium[41] caused a steep rise in demand for potassium salts. Wood-ash from fir trees was initially used as a potassium salt source for fertilizer, but, with the discovery in 1868 of mineral deposits containing potassium chloride near Staßfurt, Germany, the production of potassium-containing fertilizers began at an industrial scale.[42][43][44] Other potash deposits were discovered, and by the 1960s Canada became the dominant producer.[45][46]
Metal
Pieces of potassium metal
Potassium metal was first isolated in 1807 by Humphry Davy, who derived it by electrolysis of molten KOH with the newly discovered voltaic pile. Potassium was the first metal that was isolated by electrolysis.[47] Later in the same year, Davy reported extraction of the metal sodium from a mineral derivative (caustic soda, NaOH, or lye) rather than a plant salt, by a similar technique, demonstrating that the elements, and thus the salts, are different.[38][39][48][49] Although the production of potassium and sodium metal should have shown that both are elements, it took some time before this view was universally accepted.[39]
Because of the sensitivity of potassium to water and air, air-free techniques are normally employed for handling the element. It is unreactive toward nitrogen and saturated hydrocarbons such as mineral oil or kerosene.[50] It readily dissolves in liquid ammonia, up to 480 g per 1000 g of ammonia at 0 °C. Depending on the concentration, the ammonia solutions are blue to yellow, and their electrical conductivity is similar to that of liquid metals. Potassium slowly reacts with ammonia to form KNH
2, but this reaction is accelerated by minute amounts of transition metal salts.[51] Because it can reduce the salts to the metal, potassium is often used as the reductant in the preparation of finely divided metals from their salts by the Rieke method.[52] Illustrative is the preparation of magnesium:
- MgCl2 + 2 K → Mg + 2 KCl
Geology
Elemental potassium does not occur in nature because of its high reactivity. It reacts violently with water (see section Precautions below)[50] and also reacts with oxygen. Orthoclase (potassium feldspar) is a common rock-forming mineral. Granite for example contains 5% potassium, which is well above the average in the Earth’s crust. Sylvite (KCl), carnallite (KCl·MgCl2·6H2O), kainite (MgSO4·KCl·3H2O) and langbeinite (MgSO4·K2SO4) are the minerals found in large evaporite deposits worldwide. The deposits often show layers starting with the least soluble at the bottom and the most soluble on top.[36] Deposits of niter (potassium nitrate) are formed by decomposition of organic material in contact with atmosphere, mostly in caves; because of the good water solubility of niter the formation of larger deposits requires special environmental conditions.[53]
Biological role
Potassium is the eighth or ninth most common element by mass (0.2%) in the human body, so that a 60 kg adult contains a total of about 120 g of potassium.[54] The body has about as much potassium as sulfur and chlorine, and only calcium and phosphorus are more abundant (with the exception of the ubiquitous CHON elements).[55] Potassium ions are present in a wide variety of proteins and enzymes.[56]
Biochemical function
Potassium levels influence multiple physiological processes, including[57][58][59]
- resting cellular-membrane potential and the propagation of action potentials in neuronal, muscular, and cardiac tissue. Due to the electrostatic and chemical properties, K+ ions are larger than Na+ ions, and ion channels and pumps in cell membranes can differentiate between the two ions, actively pumping or passively passing one of the two ions while blocking the other.[60]
- hormone secretion and action
- vascular tone
- systemic blood pressure control
- gastrointestinal motility
- acid–base homeostasis
- glucose and insulin metabolism
- mineralocorticoid action
- renal concentrating ability
- fluid and electrolyte balance
Homeostasis
Potassium homeostasis denotes the maintenance of the total body potassium content, plasma potassium level, and the ratio of the intracellular to extracellular potassium concentrations within narrow limits, in the face of pulsatile intake (meals), obligatory renal excretion, and shifts between intracellular and extracellular compartments.
Plasma levels
Plasma potassium is normally kept at 3.5 to 5.5 millimoles (mmol) [or milliequivalents (mEq)] per liter by multiple mechanisms.[61] Levels outside this range are associated with an increasing rate of death from multiple causes,[62] and some cardiac, kidney,[63] and lung diseases progress more rapidly if serum potassium levels are not maintained within the normal range.
An average meal of 40–50 mmol presents the body with more potassium than is present in all plasma (20–25 mmol). This surge causes the plasma potassium to rise up to 10% before clearance by renal and extrarenal mechanisms.[64]
Hypokalemia, a deficiency of potassium in the plasma, can be fatal if severe. Common causes are increased gastrointestinal loss (vomiting, diarrhea), and increased renal loss (diuresis).[65] Deficiency symptoms include muscle weakness, paralytic ileus, ECG abnormalities, decreased reflex response; and in severe cases, respiratory paralysis, alkalosis, and cardiac arrhythmia.[66]
Control mechanisms
Potassium content in the plasma is tightly controlled by four basic mechanisms, which have various names and classifications. The four are 1) a reactive negative-feedback system, 2) a reactive feed-forward system, 3) a predictive or circadian system, and 4) an internal or cell membrane transport system. Collectively, the first three are sometimes termed the «external potassium homeostasis system»;[67] and the first two, the «reactive potassium homeostasis system».
- The reactive negative-feedback system refers to the system that induces renal secretion of potassium in response to a rise in the plasma potassium (potassium ingestion, shift out of cells, or intravenous infusion.)
- The reactive feed-forward system refers to an incompletely understood system that induces renal potassium secretion in response to potassium ingestion prior to any rise in the plasma potassium. This is probably initiated by gut cell potassium receptors that detect ingested potassium and trigger vagal afferent signals to the pituitary gland.
- The predictive or circadian system increases renal secretion of potassium during mealtime hours (e.g. daytime for humans, nighttime for rodents) independent of the presence, amount, or absence of potassium ingestion. It is mediated by a circadian oscillator in the suprachiasmatic nucleus of the brain (central clock), which causes the kidney (peripheral clock) to secrete potassium in this rhythmic circadian fashion.
The action of the sodium-potassium pump is an example of primary active transport. The two carrier proteins embedded in the cell membrane on the left are using ATP to move sodium out of the cell against the concentration gradient; The two proteins on the right are using secondary active transport to move potassium into the cell. This process results in reconstitution of ATP.
- The ion transport system moves potassium across the cell membrane using two mechanisms. One is active and pumps sodium out of, and potassium into, the cell. The other is passive and allows potassium to leak out of the cell. Potassium and sodium cations influence fluid distribution between intracellular and extracellular compartments by osmotic forces. The movement of potassium and sodium through the cell membrane is mediated by the Na⁺/K⁺-ATPase pump.[68] This ion pump uses ATP to pump three sodium ions out of the cell and two potassium ions into the cell, creating an electrochemical gradient and electromotive force across the cell membrane. The highly selective potassium ion channels (which are tetramers) are crucial for hyperpolarization inside neurons after an action potential is triggered, to cite one example. The most recently discovered potassium ion channel is KirBac3.1, which makes a total of five potassium ion channels (KcsA, KirBac1.1, KirBac3.1, KvAP, and MthK) with a determined structure. All five are from prokaryotic species.[69]
Renal filtration, reabsorption, and excretion
Renal handling of potassium is closely connected to sodium handling. Potassium is the major cation (positive ion) inside animal cells [150 mmol/L, (4.8 g)], while sodium is the major cation of extracellular fluid [150 mmol/L, (3.345 g)]. In the kidneys, about 180 liters of plasma is filtered through the glomeruli and into the renal tubules per day.[70] This filtering involves about 600 g of sodium and 33 g of potassium. Since only 1–10 g of sodium and 1–4 g of potassium are likely to be replaced by diet, renal filtering must efficiently reabsorb the remainder from the plasma.
Sodium is reabsorbed to maintain extracellular volume, osmotic pressure, and serum sodium concentration within narrow limits. Potassium is reabsorbed to maintain serum potassium concentration within narrow limits.[71] Sodium pumps in the renal tubules operate to reabsorb sodium. Potassium must be conserved, but because the amount of potassium in the blood plasma is very small and the pool of potassium in the cells is about 30 times as large, the situation is not so critical for potassium. Since potassium is moved passively[72][73] in counter flow to sodium in response to an apparent (but not actual) Donnan equilibrium,[74] the urine can never sink below the concentration of potassium in serum except sometimes by actively excreting water at the end of the processing. Potassium is excreted twice and reabsorbed three times before the urine reaches the collecting tubules.[75] At that point, urine usually has about the same potassium concentration as plasma. At the end of the processing, potassium is secreted one more time if the serum levels are too high.[citation needed]
With no potassium intake, it is excreted at about 200 mg per day until, in about a week, potassium in the serum declines to a mildly deficient level of 3.0–3.5 mmol/L.[76] If potassium is still withheld, the concentration continues to fall until a severe deficiency causes eventual death.[77]
The potassium moves passively through pores in the cell membrane. When ions move through Ion transporters (pumps) there is a gate in the pumps on both sides of the cell membrane and only one gate can be open at once. As a result, approximately 100 ions are forced through per second. Ion channel have only one gate, and there only one kind of ion can stream through, at 10 million to 100 million ions per second.[78] Calcium is required to open the pores,[79] although calcium may work in reverse by blocking at least one of the pores.[80] Carbonyl groups inside the pore on the amino acids mimic the water hydration that takes place in water solution[81] by the nature of the electrostatic charges on four carbonyl groups inside the pore.[82]
Nutrition
Dietary recommendations
The U.S. National Academy of Medicine (NAM), on behalf of both the U.S. and Canada, sets Dietary Reference Intakes, including Estimated Average Requirements (EARs) and Recommended Dietary Allowances (RDAs), or Adequate Intakes (AIs) for when there is not sufficient information to set EARs and RDAs.
For both males and females under 9 years of age, the AIs for potassium are: 400 mg of potassium for 0-6-month-old infants, 860 mg of potassium for 7-12-month-old infants, 2,000 mg of potassium for 1-3-year-old children, and 2,300 mg of potassium for 4-8-year-old children.
For males 9 years of age and older, the AIs for potassium are: 2,500 mg of potassium for 9-13-year-old males, 3,000 mg of potassium for 14-18-year-old males, and 3,400 mg for males that are 19 years of age and older.
For females 9 years of age and older, the AIs for potassium are: 2,300 mg of potassium for 9-18-year-old females, and 2,600 mg of potassium for females that are 19 years of age and older.
For pregnant and lactating females, the AIs for potassium are: 2,600 mg of potassium for 14-18-year-old pregnant females, 2,900 mg for pregnant females that are 19 years of age and older; furthermore, 2,500 mg of potassium for 14-18-year-old lactating females, and 2,800 mg for lactating females that are 19 years of age and older. As for safety, the NAM also sets tolerable upper intake levels (ULs) for vitamins and minerals, but for potassium the evidence was insufficient, so no UL was established.[83][84]
As of 2004, most Americans adults consume less than 3,000 mg.[85]
Likewise, in the European Union, in particular in Germany, and Italy, insufficient potassium intake is somewhat common.[86] The British National Health Service recommends a similar intake, saying that adults need 3,500 mg per day and that excess amounts may cause health problems such as stomach pain and diarrhea.[87]
In 2019, the National Academies of Sciences, Engineering, and Medicine revised the Adequate Intake for potassium to 2,600 mg/day for females 19 years of age and older who are not pregnant or lactating, and 3,400 mg/day for males 19 years of age and older.[88][89]
Food sources
Potassium is present in all fruits, vegetables, meat and fish. Foods with high potassium concentrations include yam, parsley, dried apricots, milk, chocolate, all nuts (especially almonds and pistachios), potatoes, bamboo shoots, bananas, avocados, coconut water, soybeans, and bran.[90]
The United States Department of Agriculture lists tomato paste, orange juice, beet greens, white beans, potatoes, plantains, bananas, apricots, and many other dietary sources of potassium, ranked in descending order according to potassium content. A day’s worth of potassium is in 5 plantains or 11 bananas.[91]
Deficient intake
Diets low in potassium can lead to hypertension[92] and hypokalemia.
Supplementation
Supplements of potassium are most widely used in conjunction with diuretics that block reabsorption of sodium and water upstream from the distal tubule (thiazides and loop diuretics), because this promotes increased distal tubular potassium secretion, with resultant increased potassium excretion.[medical citation needed] A variety of prescription and over-the counter supplements are available.[citation needed] Potassium chloride may be dissolved in water, but the salty/bitter taste makes liquid supplements unpalatable.[93] Typical doses range from 10 mmol (400 mg), to 20 mmol (800 mg).[medical citation needed] Potassium is also available in tablets or capsules, which are formulated to allow potassium to leach slowly out of a matrix, since very high concentrations of potassium ion that occur adjacent to a solid tablet can injure the gastric or intestinal mucosa.[medical citation needed] For this reason, non-prescription potassium pills are limited by law in the US to a maximum of 99 mg of potassium.[citation needed]
A meta-analysis concluded that a 1640 mg increase in the daily intake of potassium was associated with a 21% lower risk of stroke.[94] Potassium chloride and potassium bicarbonate may be useful to control mild hypertension.[95] In 2020, potassium was the 33rd most commonly prescribed medication in the U.S., with more than 17 million prescriptions.[96][97]
Detection by taste buds
Potassium can be detected by taste because it triggers three of the five types of taste sensations, according to concentration. Dilute solutions of potassium ions taste sweet, allowing moderate concentrations in milk and juices, while higher concentrations become increasingly bitter/alkaline, and finally also salty to the taste. The combined bitterness and saltiness of high-potassium solutions makes high-dose potassium supplementation by liquid drinks a palatability challenge.[93][98]
Commercial production
Mining
Potassium salts such as carnallite, langbeinite, polyhalite, and sylvite form extensive evaporite deposits in ancient lake bottoms and seabeds,[35] making extraction of potassium salts in these environments commercially viable. The principal source of potassium – potash – is mined in Canada, Russia, Belarus, Kazakhstan, Germany, Israel, the U.S., Jordan, and other places around the world.[99][100][101] The first mined deposits were located near Staßfurt, Germany, but the deposits span from Great Britain over Germany into Poland. They are located in the Zechstein and were deposited in the Middle to Late Permian. The largest deposits ever found lie 1,000 meters (3,300 feet) below the surface of the Canadian province of Saskatchewan. The deposits are located in the Elk Point Group produced in the Middle Devonian. Saskatchewan, where several large mines have operated since the 1960s pioneered the technique of freezing of wet sands (the Blairmore formation) to drive mine shafts through them. The main potash mining company in Saskatchewan until its merge was the Potash Corporation of Saskatchewan, now Nutrien.[102] The water of the Dead Sea is used by Israel and Jordan as a source of potash, while the concentration in normal oceans is too low for commercial production at current prices.[100][101]
Several methods are used to separate potassium salts from sodium and magnesium compounds. The most-used method is fractional precipitation using the solubility differences of the salts. Electrostatic separation of the ground salt mixture is also used in some mines. The resulting sodium and magnesium waste is either stored underground or piled up in slag heaps. Most of the mined potassium mineral ends up as potassium chloride after processing. The mineral industry refers to potassium chloride either as potash, muriate of potash, or simply MOP.[36]
Pure potassium metal can be isolated by electrolysis of its hydroxide in a process that has changed little since it was first used by Humphry Davy in 1807. Although the electrolysis process was developed and used in industrial scale in the 1920s, the thermal method by reacting sodium with potassium chloride in a chemical equilibrium reaction became the dominant method in the 1950s.
- Na + KCl → NaCl + K
The production of sodium potassium alloys is accomplished by changing the reaction time and the amount of sodium used in the reaction. The Griesheimer process employing the reaction of potassium fluoride with calcium carbide was also used to produce potassium.[36][103]
- 2 KF + CaC2 → 2 K + CaF2 + 2 C
Reagent-grade potassium metal costs about $10.00/pound ($22/kg) in 2010 when purchased by the tonne. Lower purity metal is considerably cheaper. The market is volatile because long-term storage of the metal is difficult. It must be stored in a dry inert gas atmosphere or anhydrous mineral oil to prevent the formation of a surface layer of potassium superoxide, a pressure-sensitive explosive that detonates when scratched. The resulting explosion often starts a fire difficult to extinguish.[104][105]
Cation identification
Potassium is now quantified by ionization techniques, but at one time it was quantitated by gravimetric analysis.
Reagents used to precipitate potassium salts include sodium tetraphenylborate, hexachloroplatinic acid, and sodium cobaltinitrite into respectively potassium tetraphenylborate, potassium hexachloroplatinate, and potassium cobaltinitrite.[50]
The reaction with sodium cobaltinitrite is illustrative:
- 3 K+ + Na3[Co(NO2)6] → K3[Co(NO2)6] + 3 Na+
The potassium cobaltinitrite is obtained as a yellow solid.
Commercial uses
Fertilizer
Potassium sulfate/magnesium sulfate fertilizer
Potassium ions are an essential component of plant nutrition and are found in most soil types.[11] They are used as a fertilizer in agriculture, horticulture, and hydroponic culture in the form of chloride (KCl), sulfate (K2SO4), or nitrate (KNO3), representing the ‘K’ in ‘NPK’. Agricultural fertilizers consume 95% of global potassium chemical production, and about 90% of this potassium is supplied as KCl.[11] The potassium content of most plants ranges from 0.5% to 2% of the harvested weight of crops, conventionally expressed as amount of K2O. Modern high-yield agriculture depends upon fertilizers to replace the potassium lost at harvest. Most agricultural fertilizers contain potassium chloride, while potassium sulfate is used for chloride-sensitive crops or crops needing higher sulfur content. The sulfate is produced mostly by decomposition of the complex minerals kainite (MgSO4·KCl·3H2O) and langbeinite (MgSO4·K2SO4). Only a very few fertilizers contain potassium nitrate.[106] In 2005, about 93% of world potassium production was consumed by the fertilizer industry.[101] Furthermore, potassium can play a key role in nutrient cycling by controlling litter composition.[107]
Medical use
Potassium citrate
Potassium citrate is used to treat a kidney stone condition called renal tubular acidosis.[108]
Potassium chloride
Potassium, in the form of potassium chloride is used as a medication to treat and prevent low blood potassium.[109] Low blood potassium may occur due to vomiting, diarrhea, or certain medications.[110] It is given by slow injection into a vein or by mouth.[111]
Food additives
Potassium sodium tartrate (KNaC4H4O6, Rochelle salt) is a main constituent of some varieties of baking powder; it is also used in the silvering of mirrors. Potassium bromate (KBrO3) is a strong oxidizer (E924), used to improve dough strength and rise height. Potassium bisulfite (KHSO3) is used as a food preservative, for example in wine and beer-making (but not in meats). It is also used to bleach textiles and straw, and in the tanning of leathers.[112][113]
Industrial
Major potassium chemicals are potassium hydroxide, potassium carbonate, potassium sulfate, and potassium chloride. Megatons of these compounds are produced annually.[114]
KOH is a strong base, which is used in industry to neutralize strong and weak acids, to control pH and to manufacture potassium salts. It is also used to saponify fats and oils, in industrial cleaners, and in hydrolysis reactions, for example of esters.[115][116]
Potassium nitrate (KNO3) or saltpeter is obtained from natural sources such as guano and evaporites or manufactured via the Haber process; it is the oxidant in gunpowder (black powder) and an important agricultural fertilizer. Potassium cyanide (KCN) is used industrially to dissolve copper and precious metals, in particular silver and gold, by forming complexes. Its applications include gold mining, electroplating, and electroforming of these metals; it is also used in organic synthesis to make nitriles. Potassium carbonate (K2CO3 or potash) is used in the manufacture of glass, soap, color TV tubes, fluorescent lamps, textile dyes and pigments.[117] Potassium permanganate (KMnO4) is an oxidizing, bleaching and purification substance and is used for production of saccharin. Potassium chlorate (KClO3) is added to matches and explosives. Potassium bromide (KBr) was formerly used as a sedative and in photography.[11]
While potassium chromate (K2CrO4) is used in the manufacture of a host of different commercial products such as inks, dyes, wood stains (by reacting with the tannic acid in wood), explosives, fireworks, fly paper, and safety matches,[118] as well as in the tanning of leather, all of these uses are due to the chemistry of the chromate ion rather than to that of the potassium ion.[119]
Niche uses
There are thousands of uses of various potassium compounds. One example is potassium superoxide, KO2, an orange solid that acts as a portable source of oxygen and a carbon dioxide absorber. It is widely used in respiration systems in mines, submarines and spacecraft as it takes less volume than the gaseous oxygen.[120][121]
- 4 KO2 + 2 CO2 → 2 K2CO3 + 3 O2
Another example is potassium cobaltinitrite, K3[Co(NO2)6], which is used as artist’s pigment under the name of Aureolin or Cobalt Yellow.[122]
The stable isotopes of potassium can be laser cooled and used to probe fundamental and technological problems in quantum physics. The two bosonic isotopes possess convenient Feshbach resonances to enable studies requiring tunable interactions, while 40
K is one of only two stable fermions amongst the alkali metals.[123]
Laboratory uses
An alloy of sodium and potassium, NaK is a liquid used as a heat-transfer medium and a desiccant for producing dry and air-free solvents. It can also be used in reactive distillation.[124] The ternary alloy of 12% Na, 47% K and 41% Cs has the lowest melting point of −78 °C of any metallic compound.[18]
Metallic potassium is used in several types of magnetometers.[125]
Precautions
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H260, H314 |
|
Precautionary statements |
P223, P231+P232, P280, P305+P351+P338, P370+P378, P422[126] |
| NFPA 704 (fire diamond) |
3 3 2
|
Potassium metal can react violently with water producing KOH and hydrogen gas.
- 2 K(s) + 2 H2O(l) → 2 KOH(aq) + H2(g)↑
A reaction of potassium metal with water. Hydrogen is produced, and with potassium vapor, burns with a pink or lilac flame. Strongly alkaline potassium hydroxide is formed in solution.
This reaction is exothermic and releases sufficient heat to ignite the resulting hydrogen in the presence of oxygen. Finely powdered potassium ignites in air at room temperature. The bulk metal ignites in air if heated. Because its density is 0.89 g/cm3, burning potassium floats in water that exposes it to atmospheric oxygen. Many common fire extinguishing agents, including water, either are ineffective or make a potassium fire worse. Nitrogen, argon, sodium chloride (table salt), sodium carbonate (soda ash), and silicon dioxide (sand) are effective if they are dry. Some Class D dry powder extinguishers designed for metal fires are also effective. These agents deprive the fire of oxygen and cool the potassium metal.[127]
During storage, potassium forms peroxides and superoxides. These peroxides may react violently with organic compounds such as oils. Both peroxides and superoxides may react explosively with metallic potassium.[128]
Because potassium reacts with water vapor in the air, it is usually stored under anhydrous mineral oil or kerosene. Unlike lithium and sodium, potassium should not be stored under oil for longer than six months, unless in an inert (oxygen-free) atmosphere, or under vacuum. After prolonged storage in air dangerous shock-sensitive peroxides can form on the metal and under the lid of the container, and can detonate upon opening.[129]
Ingestion of large amounts of potassium compounds can lead to hyperkalemia, strongly influencing the cardiovascular system.[130][131] Potassium chloride is used in the U.S. for lethal injection executions.[130]
See also
References
- ^ «Standard Atomic Weights: Potassium». CIAAW. 1979.
- ^ a b Aitken, F.; Volino, F. (January 2022). «New equations of state describing both the dynamic viscosity and self-diffusion coefficient for potassium and thallium in their fluid phases». Physics of Fluids. 34 (1): 017112. doi:10.1063/5.0079944.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.122. ISBN 1-4398-5511-0.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Augustyn, Adam. «Potassium/ Chemical element». Encyclopedia Britannica. Retrieved 2019-04-17.
Potassium Physical properties
- ^ a b Webb, D. A. (April 1939). «The Sodium and Potassium Content of Sea Water» (PDF). The Journal of Experimental Biology (2): 183.
- ^ Anthoni, J. (2006). «Detailed composition of seawater at 3.5% salinity». seafriends.org.nz. Retrieved 2011-09-23.
- ^ Halperin, Mitchell L.; Kamel, Kamel S. (1998-07-11). «Potassium». The Lancet. 352 (9122): 135–140. doi:10.1016/S0140-6736(98)85044-7. ISSN 0140-6736. PMID 9672294. S2CID 208790031.
- ^ a b Marggraf, Andreas Siegmund (1761). Chymische Schriften. p. 167.
- ^ a b c d e Greenwood, p. 73
- ^ Davy, Humphry (1808). «On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies». Philosophical Transactions of the Royal Society. 98: 32. doi:10.1098/rstl.1808.0001.
- ^ Klaproth, M. (1797) «Nouvelles données relatives à l’histoire naturelle de l’alcali végétal» (New data regarding the natural history of the vegetable alkali), Mémoires de l’Académie royale des sciences et belles-lettres (Berlin), pp. 9–13 ; see p. 13. From p. 13: «Cet alcali ne pouvant donc plus être envisagé comme un produit de la végétation dans les plantes, occupe une place propre dans la série des substances primitivement simples du règne minéral, &I il devient nécessaire de lui assigner un nom, qui convienne mieux à sa nature.
La dénomination de Potasche (potasse) que la nouvelle nomenclature françoise a consacrée comme nom de tout le genre, ne sauroit faire fortune auprès des chimistes allemands, qui sentent à quel point la dérivation étymologique en est vicieuse. Elle est prise en effet de ce qu’anciennement on se servoit pour la calcination des lessives concentrées des cendres, de pots de fer (pott en dialecte de la Basse-Saxe) auxquels on a substitué depuis des fours à calciner.
Je propose donc ici, de substituer aux mots usités jusqu’ici d’alcali des plantes, alcali végétal, potasse, &c. celui de kali, & de revenir à l’ancienne dénomination de natron, au lieu de dire alcali minéral, soude &c.»
(This alkali [i.e., potash] — [which] therefore can no longer be viewed as a product of growth in plants — occupies a proper place in the originally simple series of the mineral realm, and it becomes necessary to assign it a name that is better suited to its nature.
The name of «potash» (potasse), which the new French nomenclature has bestowed as the name of the entire species [i.e., substance], would not find acceptance among German chemists, who feel to some extent [that] the etymological derivation of it is faulty. Indeed, it is taken from [the vessels] that one formerly used for the roasting of washing powder concentrated from cinders: iron pots (pott in the dialect of Lower Saxony), for which roasting ovens have been substituted since then.
Thus I now propose to substitute for the until now common words of «plant alkali», «vegetable alkali», «potash», etc., that of kali ; and to return to the old name of natron instead of saying «mineral alkali», «soda», etc.) - ^ Davy, Humphry (1809). «Ueber einige neue Erscheinungen chemischer Veränderungen, welche durch die Electricität bewirkt werden; insbesondere über die Zersetzung der feuerbeständigen Alkalien, die Darstellung der neuen Körper, welche ihre Basen ausmachen, und die Natur der Alkalien überhaupt» [On some new phenomena of chemical changes that are achieved by electricity; particularly the decomposition of flame-resistant alkalis [i.e., alkalies that cannot be reduced to their base metals by flames], the preparation of new substances that constitute their [metallic] bases, and the nature of alkalies generally]. Annalen der Physik. 31 (2): 113–175. Bibcode:1809AnP….31..113D. doi:10.1002/andp.18090310202.
p. 157: In unserer deutschen Nomenclatur würde ich die Namen Kalium und Natronium vorschlagen, wenn man nicht lieber bei den von Herrn Erman gebrauchten und von mehreren angenommenen Benennungen Kali-Metalloid and Natron-Metalloid, bis zur völligen Aufklärung der chemischen Natur dieser räthzelhaften Körper bleiben will. Oder vielleicht findet man es noch zweckmässiger fürs Erste zwei Klassen zu machen, Metalle und Metalloide, und in die letztere Kalium und Natronium zu setzen. — Gilbert. (In our German nomenclature, I would suggest the names Kalium and Natronium, if one would not rather continue with the appellations Kali-metalloid and Natron-metalloid which are used by Mr. Erman [i.e., German physics professor Paul Erman (1764–1851)] and accepted by several [people], until the complete clarification of the chemical nature of these puzzling substances. Or perhaps one finds it yet more advisable for the present to create two classes, metals and metalloids, and to place Kalium and Natronium in the latter — Gilbert.)
- ^ Berzelius, J. Jacob (1814) Försök, att, genom användandet af den electrokemiska theorien och de kemiska proportionerna, grundlägga ett rent vettenskapligt system för mineralogien [Attempt, by the use of electrochemical theory and chemical proportions, to found a pure scientific system for mineralogy]. Stockholm, Sweden: A. Gadelius., p. 87.
- ^ 19. Kalium (Potassium) – Elementymology & Elements Multidict. vanderkrogt.net
- ^ McNaught, A. D. and Wilkinson,A. eds. (1997). Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). IUPAC. Blackwell Scientific Publications, Oxford.
- ^ a b Greenwood, p. 76
- ^ Greenwood, p. 75
- ^ Dye, J. L. (1979). «Compounds of Alkali Metal Anions». Angewandte Chemie International Edition. 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ Williams, D. Bradley G.; Lawton, Michelle (2010). «Drying of Organic Solvents: Quantitative Evaluation of the Efficiency of Several Desiccants». The Journal of Organic Chemistry. 75 (24): 8351–8354. doi:10.1021/jo101589h. PMID 20945830. S2CID 17801540.
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (87th ed.). Boca Raton, Florida, United States: CRC Press. pp. 477, 520. ISBN 978-0-8493-0594-8.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 4–80. ISBN 0-8493-0486-5.
- ^ Schultz, p. 94
- ^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. «Metal Aqua Ions» in J. A. McCleverty and T. J. Meyer (eds.) Comprehensive Coordination Chemistry II, Vol. 1, pp. 515–555, ISBN 978-0-08-043748-4.
- ^ Anthony Agulyanski (2004). «Fluorine chemistry in the processing of tantalum and niobium». In Anatoly Agulyanski (ed.). Chemistry of Tantalum and Niobium Fluoride Compounds (1st ed.). Burlington: Elsevier. ISBN 9780080529028.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Bowen, Robert; Attendorn, H. G. (1988). «Theory and Assumptions in Potassium–Argon Dating». Isotopes in the Earth Sciences. Springer. pp. 203–8. ISBN 978-0-412-53710-3.
- ^ Anaç, D. & Martin-Prével, P. (1999). Improved crop quality by nutrient management. Springer. pp. 290–. ISBN 978-0-7923-5850-3.
- ^ «Radiation and Radioactive Decay. Radioactive Human Body». Harvard Natural Sciences Lecture Demonstrations. Retrieved July 2, 2016.
- ^ Winteringham, F. P. W; Effects, F.A.O. Standing Committee on Radiation, Land And Water Development Division, Food and Agriculture Organization of the United Nations (1989). Radioactive fallout in soils, crops and food: a background review. Food & Agriculture Org. p. 32. ISBN 978-92-5-102877-3.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Shimansky, V.; Bikmaev, I. F.; Galeev, A. I.; Shimanskaya, N. N.; et al. (September 2003). «Observational constraints on potassium synthesis during the formation of stars of the Galactic disk». Astronomy Reports. 47 (9): 750–762. Bibcode:2003ARep…47..750S. doi:10.1134/1.1611216. S2CID 120396773.
- ^ The, L.-S.; Eid, M. F. El; Meyer, B. S. (2000). «A New Study of s-Process Nucleosynthesis in Massive Stars». The Astrophysical Journal. 533 (2): 998. arXiv:astro-ph/9812238. Bibcode:2000ApJ…533..998T. doi:10.1086/308677. ISSN 0004-637X. S2CID 7698683.
- ^ Greenwood, p. 69
- ^ a b Micale, Giorgio; Cipollina, Andrea; Rizzuti, Lucio (2009). Seawater Desalination: Conventional and Renewable Energy Processes. Springer. p. 3. ISBN 978-3-642-01149-8.
- ^ a b c d Prud’homme, Michel; Krukowski, Stanley T. (2006). «Potash». Industrial minerals & rocks: commodities, markets, and uses. Society for Mining, Metallurgy, and Exploration. pp. 723–740. ISBN 978-0-87335-233-8.
- ^ du Monceau, H. L. D. (1702–1797). «Sur la Base de Sel Marin». Mémoires de l’Académie Royale des Sciences (in French): 65–68.
- ^ a b Weeks, Mary Elvira (1932). «The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium». Journal of Chemical Education. 9 (6): 1035. Bibcode:1932JChEd…9.1035W. doi:10.1021/ed009p1035.
- ^ a b c Siegfried, R. (1963). «The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements». Isis. 54 (2): 247–258. doi:10.1086/349704. JSTOR 228541. PMID 14147904. S2CID 38152048.
- ^ Browne, C. A. (1926). «Historical notes upon the domestic potash industry in early colonial and later times». Journal of Chemical Education. 3 (7): 749–756. Bibcode:1926JChEd…3..749B. doi:10.1021/ed003p749.
- ^ Liebig, Justus von (1840). Die organische Chemie in ihrer Anwendung auf Agricultur und Physiologie (in German). F. Vieweg und Sohn.
- ^ Cordel, Oskar (1868). Die Stassfurter Kalisalze in der Landwirthschalt: Eine Besprechung … (in German). L. Schnock.
- ^ Birnbaum, Karl (1869). Die Kalidüngung in ihren Vortheilen und Gefahren (in German).
- ^ United Nations Industrial Development Organization and Int’l Fertilizer Development Center (1998). Fertilizer Manual. pp. 46, 417. ISBN 978-0-7923-5032-3.
- ^ Miller, H. (1980). «Potash from Wood Ashes: Frontier Technology in Canada and the United States». Technology and Culture. 21 (2): 187–208. doi:10.2307/3103338. JSTOR 3103338.
- ^ Rittenhouse, P. A. (1979). «Potash and politics». Economic Geology. 74 (2): 353–7. doi:10.2113/gsecongeo.74.2.353.
- ^ Enghag, P. (2004). «11. Sodium and Potassium». Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 978-3-527-30666-4.
- ^ Davy, Humphry (1808). «On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies». Philosophical Transactions of the Royal Society. 98: 1–44. doi:10.1098/rstl.1808.0001.
- ^ Shaposhnik, V. A. (2007). «History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)». Journal of Analytical Chemistry. 62 (11): 1100–2. doi:10.1134/S1061934807110160. S2CID 96141217.
- ^ a b c Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). «Potassium». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. ISBN 978-3-11-007511-3.
- ^ Burkhardt, p. 32
- ^ Rieke, R. D. (1989). «Preparation of Organometallic Compounds from Highly Reactive Metal Powders». Science. 246 (4935): 1260–4. Bibcode:1989Sci…246.1260R. doi:10.1126/science.246.4935.1260. PMID 17832221. S2CID 92794.
- ^ Ross, William H. (1914). «The Origin of Nitrate Deposits». Popular Science. Bonnier Corporation. pp. 134–145.
- ^ Abdel-Wahab, M.; Youssef, S.; Aly, A.; el-Fiki, S.; et al. (1992). «A simple calibration of a whole-body counter for the measurement of total body potassium in humans». International Journal of Radiation Applications and Instrumentation A. 43 (10): 1285–9. doi:10.1016/0883-2889(92)90208-V. PMID 1330980.
- ^ Chang, Raymond (2007). Chemistry. McGraw-Hill Higher Education. p. 52. ISBN 978-0-07-110595-8.
- ^ Vašák, Milan; Schnabl, Joachim (2016). «Chapter 8. Sodium and Potassium Ions in Proteins and Enzyme Catalysis». In Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel (eds.). The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. Vol. 16. Springer. pp. 259–290. doi:10.1007/978-3-319-21756-7_8. PMID 26860304.
- ^ Weiner ID, Linus S, Wingo CS (2014). «Disorders of potassium metabolism». In Freehally J, Johnson RJ, Floege J (eds.). Comprehensive clinical nephrology (5th ed.). St. Louis: Saunders. p. 118. ISBN 9780323242875.
- ^ Malnic G, Giebisch G, Muto S, Wang W, Bailey MA, Satlin LM (2013). «Regulation of K+ excretion». In Alpern RJ, Caplan MJ, Moe OW (eds.). Seldin and Giebisch’s the kidney: physiology and pathophysiology (5th ed.). London: Academic Press. pp. 1659–1716. ISBN 9780123814630.
- ^ Mount DB, Zandi-Nejad K (2011). «Disorders of potassium balance». In Taal MW, Chertow GM, Marsden PA, Skorecki KL, Yu AS, Brenner BM (eds.). The kidney (9th ed.). Philadelphia: Elsevier. pp. 640–688. ISBN 9781455723041.
- ^ Lockless, S. W.; Zhou, M.; MacKinnon, R. (2007). «Structural and thermodynamic properties of selective ion binding in a K+ channel». PLOS Biol. 5 (5): e121. doi:10.1371/journal.pbio.0050121. PMC 1858713. PMID 17472437.
- ^ Wei, Kuang-Yu; Gritter, Martin; Vogt, Liffert; de Borst, Martin H; Rotmans, Joris I; Hoorn, Ewout J (2020-09-02). «Dietary potassium and the kidney: lifesaving physiology». Clinical Kidney Journal. Oxford University Press (OUP). 13 (6): 952–968. doi:10.1093/ckj/sfaa157. ISSN 2048-8513. PMC 7769543. PMID 33391739.
- ^ Goyal, Abhinav; Spertus, John A.; Gosch, Kensey; Venkitachalam, Lakshmi; Jones, Philip G.; Van den Berghe, Greet; Kosiborod, Mikhail (2012). «Serum Potassium Levels and Mortality in Acute Myocardial Infarction». JAMA. 307 (2): 157–164. doi:10.1001/jama.2011.1967. PMID 22235086.
- ^ Smyth, A.; Dunkler, D.; Gao, P.; et al. (2014). «The relationship between estimated sodium and potassium excretion and subsequent renal outcomes». Kidney Int. 86 (6): 1205–1212. doi:10.1038/ki.2014.214. PMID 24918156.
- ^ Moore-Ede, M. C. (1986). «Physiology of the circadian timing system: predictive versus reactive homeostasis». Am J Physiol. 250 (5 Pt 2): R737–R752. doi:10.1152/ajpregu.1986.250.5.R737. PMID 3706563.
- ^ Slonim, Anthony D.; Pollack, Murray M. (2006). «Potassium». Pediatric critical care medicine. Lippincott Williams & Wilkins. p. 812. ISBN 978-0-7817-9469-5.
- ^ Visveswaran, Kasi (2009). «hypokalemia». Essentials of Nephrology (2nd ed.). BI Publications. p. 257. ISBN 978-81-7225-323-3.
- ^ Gumz, Michelle L.; Rabinowitz, Lawrence; Wingo, Charles S. (2015-07-02). «An Integrated View of Potassium Homeostasis». The New England Journal of Medicine. 373 (1): 60–72. doi:10.1056/NEJMra1313341. ISSN 0028-4793. PMC 5675534. PMID 26132942.
- ^ Campbell, Neil (1987). Biology. Menlo Park, California: Benjamin/Cummings Pub. Co. p. 795. ISBN 978-0-8053-1840-1.
- ^ Hellgren, Mikko; Sandberg, Lars; Edholm, Olle (2006). «A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study». Biophysical Chemistry. 120 (1): 1–9. doi:10.1016/j.bpc.2005.10.002. PMID 16253415.
- ^ Potts, W. T. W.; Parry, G. (1964). Osmotic and ionic regulation in animals. Pergamon Press.
- ^ Lans, H. S.; Stein, I. F.; Meyer, K. A. (1952). «The relation of serum potassium to erythrocyte potassium in normal subjects and patients with potassium deficiency». American Journal of the Medical Sciences. 223 (1): 65–74. doi:10.1097/00000441-195201000-00011. PMID 14902792.
- ^ Bennett, C. M.; Brenner, B. M.; Berliner, R. W. (1968). «Micropuncture study of nephron function in the rhesus monkey». Journal of Clinical Investigation. 47 (1): 203–216. doi:10.1172/JCI105710. PMC 297160. PMID 16695942.
- ^ Solomon, A. K. (1962). «Pumps in the living cell». Scientific American. 207 (2): 100–8. Bibcode:1962SciAm.207b.100S. doi:10.1038/scientificamerican0862-100. PMID 13914986.
- ^ Kernan, Roderick P. (1980). Cell potassium (Transport in the life sciences). New York: Wiley. pp. 40, 48. ISBN 978-0-471-04806-0.
- ^ Wright, F. S. (1977). «Sites and mechanisms of potassium transport along the renal tubule». Kidney International. 11 (6): 415–432. doi:10.1038/ki.1977.60. PMID 875263.
- ^ Squires, R. D.; Huth, E. J. (1959). «Experimental potassium depletion in normal human subjects. I. Relation of ionic intakes to the renal conservation of potassium». Journal of Clinical Investigation. 38 (7): 1134–48. doi:10.1172/JCI103890. PMC 293261. PMID 13664789.
- ^ Fiebach, Nicholas H.; Barker, Lee Randol; Burton, John Russell & Zieve, Philip D. (2007). Principles of ambulatory medicine. Lippincott Williams & Wilkins. pp. 748–750. ISBN 978-0-7817-6227-4.
- ^ Gadsby, D. C. (2004). «Ion transport: spot the difference». Nature. 427 (6977): 795–7. Bibcode:2004Natur.427..795G. doi:10.1038/427795a. PMID 14985745. S2CID 5923529.; for a diagram of the potassium pores are viewed, see Miller, C (2001). «See potassium run». Nature. 414 (6859): 23–24. Bibcode:2001Natur.414…23M. doi:10.1038/35102126. PMID 11689922. S2CID 4423041.
- ^ Jiang, Y.; Lee, A.; Chen, J.; Cadene, M.; et al. (2002). «Crystal structure and mechanism of a calcium-gated potassium channel» (PDF). Nature. 417 (6888): 515–22. Bibcode:2002Natur.417..515J. doi:10.1038/417515a. PMID 12037559. S2CID 205029269. Archived from the original on 2009-04-24.
{{cite journal}}: CS1 maint: bot: original URL status unknown (link) - ^ Shi, N.; Ye, S.; Alam, A.; Chen, L.; et al. (2006). «Atomic structure of a Na+— and K+-conducting channel». Nature. 440 (7083): 570–4. Bibcode:2006Natur.440..570S. doi:10.1038/nature04508. PMID 16467789. S2CID 4355500.; includes a detailed picture of atoms in the pump.
- ^ Zhou, Y.; Morais-Cabral, J. H.; Kaufman, A.; MacKinnon, R. (2001). «Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution». Nature. 414 (6859): 43–48. Bibcode:2001Natur.414…43Z. doi:10.1038/35102009. PMID 11689936. S2CID 205022645.
- ^ Noskov, S. Y.; Bernèche, S.; Roux, B. (2004). «Control of ion selectivity in potassium channels by electrostatic and dynamic properties of carbonyl ligands». Nature. 431 (7010): 830–4. Bibcode:2004Natur.431..830N. doi:10.1038/nature02943. PMID 15483608. S2CID 4414885.
- ^ National Academies of Sciences, Engineering and Medicine (2019). «Potassium: Dietary Reference Intakes for Adequacy». In Stallings, Virginia A; Harrison, Meghan; Oria, Maria (eds.). Dietary Reference Intakes for Sodium and Potassium. Washington, DC: The National Academies Press. doi:10.17226/25353. ISBN 978-0-309-48834-1. PMID 30844154.
- ^ Stallings, Virginia A; Harrison, Meghan; Oria, Maria, eds. (March 5, 2019). Dietary Reference Intakes for Sodium and Potassium – Publication. Health and Medicine Division. National Academies of Sciences, Engineering and Medicine. doi:10.17226/25353. ISBN 978-0-309-48834-1. PMID 30844154. S2CID 104464967. Retrieved May 13, 2019.
- ^ Panel on Dietary Reference Intakes for Electrolytes and Water, Standing Committee on the Scientific Evaluation of Dietary Reference Intakes, Food and Nutrition (2004). DRI, dietary reference intakes for water, potassium, sodium, chloride, and sulfate. Washington, D.C.: National Academies Press. ISBN 978-0-309-53049-1. Archived from the original on 2011-10-06.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Karger, S. (2004). «Energy and nutrient intake in the European Union». Annals of Nutrition and Metabolism. 48 (2 (suppl)): 1–16. doi:10.1159/000083041.
- ^ «Vitamins and minerals». National Health Service (NHS). 18 November 2021. Retrieved 13 November 2022.
- ^ «Sodium and Potassium Dietary Reference Intake Values Updated in New Report; Introduces New Category for Sodium Based on Chronic Disease Risk Reduction» (Press release). National Academies of Sciences, Engineering, and Medicine. 5 March 2019. Retrieved 29 January 2022.
- ^ National Academies of Sciences, Engineering, and Medicine; Health and Medicine Division; Food and Nutrition Board; Committee to Review the Dietary Reference Intakes for Sodium and Potassium (March 2019). Oria M, Harrison M, Stallings VA (eds.). Dietary Reference Intakes for Sodium and Potassium. National Academies Press. doi:10.17226/25353. ISBN 978-0-309-48834-1. PMID 30844154. S2CID 104464967. Bookshelf ID: NBK538102. Retrieved 13 November 2022.
- ^ «Potassium Food Charts». Asia Pacific Journal of Clinical Nutrition. Archived from the original on 2021-04-29. Retrieved 2011-05-18.
- ^ «Potassium Content of Selected Foods per Common Measure, sorted by nutrient content» (PDF). USDA National Nutrient Database for Standard Reference, Release 20. Archived from the original (PDF) on December 17, 2008.
- ^ Whelton PK, He J, Cutler JA, Brancati FL, Appel LJ, Follmann D, Klag MJ (1997). «Effects of oral potassium on blood pressure. Meta-analysis of randomized controlled clinical trials». JAMA. 277 (20): 1624–32. doi:10.1001/jama.1997.03540440058033. PMID 9168293. S2CID 25937399.
- ^ a b Institute of Medicine (U.S.). Committee on Optimization of Nutrient Composition of Military Rations for Short-Term, High-Stress Situations; Institute of Medicine (U.S.). Committee on Military Nutrition Research (2006). Nutrient composition of rations for short-term, high-intensity combat operations. National Academies Press. pp. 287–. ISBN 978-0-309-09641-6.
- ^ D’Elia, L.; Barba, G.; Cappuccio, F.; Strazzullo (2011). «Potassium Intake, Stroke, and Cardiovascular Disease: A Meta-Analysis of Prospective Studies». J Am Coll Cardiol. 57 (10): 1210–9. doi:10.1016/j.jacc.2010.09.070. PMID 21371638.
- ^ He FJ, Marciniak M, Carney C, Markandu ND, Anand V, Fraser WD, Dalton RN, Kaski JC, MacGregor GA (2010). «Effects of potassium chloride and potassium bicarbonate on endothelial function, cardiovascular risk factors, and bone turnover in mild hypertensives». Hypertension. 55 (3): 681–8. doi:10.1161/HYPERTENSIONAHA.109.147488. PMID 20083724.
- ^ «The Top 300 of 2020». ClinCalc. Retrieved 7 October 2022.
- ^ «Potassium Chloride — Drug Usage Statistics». ClinCalc. Retrieved 7 October 2022.
- ^ Shallenberger, R. S. (1993). Taste chemistry. Springer. pp. 120–. ISBN 978-0-7514-0150-9.
- ^ Garrett, Donald E. (1995-12-31). Potash: deposits, processing, properties and uses. Springer. ISBN 978-0-412-99071-7.
- ^ a b Ober, Joyce A. «Mineral Commodity Summaries 2008:Potash» (PDF). United States Geological Survey. Retrieved 2008-11-20.
- ^ a b c Ober, Joyce A. «Mineral Yearbook 2006:Potash» (PDF). United States Geological Survey. Retrieved 2008-11-20.
- ^ Wishart, David J. (2004). Encyclopedia of the Great Plains. U of Nebraska Press. p. 433. ISBN 978-0-8032-4787-1.
- ^ Chiu, Kuen-Wai (2000). «Potassium». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.1615200103080921.a01.pub2. ISBN 9780471238966.
- ^ Burkhardt, p. 34
- ^ Delahunt, J.; Lindeman, T. (2007). «Review of the safety of potassium and potassium oxides, including deactivation by introduction into water». Journal of Chemical Health and Safety. 14 (2): 21–32. doi:10.1016/j.jchas.2006.09.010.
- ^ Roy, Amit H. (2007). Kent and Riegel’s handbook of industrial chemistry and biotechnology. Springer. pp. 1135–57. Bibcode:2007karh.book……. ISBN 978-0-387-27843-8.
- ^ Ochoa-Hueso, R; Delgado-Baquerizo, M; King, PTA; Benham, M; Arca, V; Power, SA (2019). «Ecosystem type and resource quality are more important than global change drivers in regulating early stages of litter decomposition». Soil Biology and Biochemistry. 129: 144–152. doi:10.1016/j.soilbio.2018.11.009. S2CID 92606851.
- ^ «Potassium Uses, Side Effects & Interactions». Drugs.com.
- ^ World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR (eds.). WHO Model Formulary 2008. World Health Organization. p. 491. hdl:10665/44053. ISBN 9789241547659.
- ^ «Potassium chloride medical facts from Drugs.com». www.drugs.com. Archived from the original on 18 January 2017. Retrieved 14 January 2017.
- ^ British national formulary : BNF 69 (69 ed.). British Medical Association. 2015. pp. 680, 684. ISBN 9780857111562.
- ^ Figoni, Paula I (2010). «Bleaching and Maturing Agents». How Baking Works: Exploring the Fundamentals of Baking Science. John Wiley and Sons. p. 86. ISBN 978-0-470-39267-6.
- ^ Chichester, C. O. (July 1986). «Uses and Exposure to Sulfites in Food». Advances in food research. Academic Press. pp. 4–6. ISBN 978-0-12-016430-1.
- ^ Schultz
- ^ Toedt, John; Koza, Darrell & Cleef-Toedt, Kathleen Van (2005). «Personal Cleansing Products: Bar Soap». Chemical composition of everyday products. Greenwood Publishing Group. ISBN 978-0-313-32579-3.
- ^ Schultz, p. 95
- ^ Schultz, p. 99
- ^ Siegel, Richard S. (1940). «Ignition of the safety match». Journal of Chemical Education. 17 (11): 515. Bibcode:1940JChEd..17..515S. doi:10.1021/ed017p515.
- ^ Anger, Gerd; Halstenberg, Jost; Hochgeschwender, Klaus; Scherhag, Christoph; Korallus, Ulrich; Knopf, Herbert; Schmidt, Peter; Ohlinger, Manfred. «Chromium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 9. Weinheim: Wiley-VCH. p. 178. doi:10.1002/14356007.a07_067.
- ^ Greenwood, p. 74
- ^ Marx, Robert F. (1990). The history of underwater exploration. Courier Dover Publications. p. 93. ISBN 978-0-486-26487-5.
- ^ Gettens, Rutherford John & Stout, George Leslie (1966). Painting materials: A short encyclopaedia. Courier Dover Publications. pp. 109–110. ISBN 978-0-486-21597-6.
- ^ Modugno, G.; Benkő, C.; Hannaford, P.; Roati, G.; Inguscio, M. (1999-11-01). «Sub-Doppler laser cooling of fermionic ${}^{40}mathrm{K}$ atoms». Physical Review A. 60 (5): R3373–R3376. arXiv:cond-mat/9908102. Bibcode:1999PhRvA..60.3373M. doi:10.1103/PhysRevA.60.R3373. S2CID 119001675.
- ^ Jackson, C. B.; Werner, R. C. (1957). «Ch. 18: The Manufacture of Potassium and NaK». Handling and uses of the alkali metals. Advances in Chemistry. Vol. 19. pp. 169–173. doi:10.1021/ba-1957-0019.ch018. ISBN 978-0-8412-0020-3.
- ^ Kearey, Philip; Brooks, M & Hill, Ian (2002). «Optical Pumped Magnetometer». An introduction to geophysical exploration. Wiley-Blackwell. p. 164. ISBN 978-0-632-04929-5.
- ^ «Potassium 244856». Sigma Aldrich.
- ^ Solomon, Robert E. (2002). Fire and Life Safety Inspection Manual. Jones & Bartlett Learning. p. 459. ISBN 978-0-87765-472-8.
- ^ «DOE Handbook-Alkali Metals Sodium, Potassium, NaK, and Lithium». Hss.doe.gov. Archived from the original on 2010-09-28. Retrieved 2010-10-16.
- ^ Wray, Thomas K. «Danger: peroxidazable chemicals» (PDF). Environmental Health & Public Safety, North Carolina State University. Archived from the original on 2016-07-29.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ a b Schonwald, Seth (2004). «Potassium Chloride and Potassium Permanganate». Medical toxicology. Lippincott Williams & Wilkins. pp. 903–5. ISBN 978-0-7817-2845-4.
- ^ Markovchick, Vincent J. & Pons, Peter T. (2003). Emergency medicine secrets. Elsevier Health Sciences. p. 223. ISBN 978-1-56053-503-4.
Bibliography
- Burkhardt, Elizabeth R. (2006). «Potassium and Potassium Alloys». Ullmann’s Encyclopedia of Industrial Chemistry. Vol. A22. pp. 31–38. doi:10.1002/14356007.a22_031.pub2. ISBN 978-3-527-30673-2.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (2007). «Potassium». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. ISBN 978-3110177701.
- Schultz, H.; et al. (2006). «Potassium compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Vol. A22. pp. 39–103. doi:10.1002/14356007.a22_031.pub2. ISBN 978-3-527-30673-2.
- National Nutrient Database Archived 2014-08-10 at the Wayback Machine at USDA Website
External links
- «Potassium». Drug Information Portal. U.S. National Library of Medicine.

Potassium pearls (in paraffin oil, ~5 mm each) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Potassium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (pə-TASS-ee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery white, faint bluish-purple hue when exposed to air | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Potassium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 1: hydrogen and alkali metals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 336.7 K (63.5 °C, 146.3 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1030.793 K (757.643 °C, 1395.757 °F)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 0.89 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 0.82948 g/cm3[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 2223 K, 16 MPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 2.33 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 76.9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 29.6 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −1, +1 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 0.82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 227 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 203±12 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 275 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of potassium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 2000 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 83.3 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 102.5 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 72 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +20.8×10−6 cm3/mol (298 K)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 3.53 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 1.3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 3.1 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 0.4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 0.363 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-09-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery and first isolation | Humphry Davy (1807) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symbol | «K»: from New Latin kalium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of potassium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Potassium is the chemical element with the symbol K (from Neo-Latin kalium) and atomic number 19. It is a silvery white metal that is soft enough to easily cut with a knife.[6] Potassium metal reacts rapidly with atmospheric oxygen to form flaky white potassium peroxide in only seconds of exposure. It was first isolated from potash, the ashes of plants, from which its name derives. In the periodic table, potassium is one of the alkali metals, all of which have a single valence electron in the outer electron shell, which is easily removed to create an ion with a positive charge (which combines with anions to form salts). In nature, potassium occurs only in ionic salts. Elemental potassium reacts vigorously with water, generating sufficient heat to ignite hydrogen emitted in the reaction, and burning with a lilac-colored flame. It is found dissolved in seawater (which is 0.04% potassium by weight),[7][8] and occurs in many minerals such as orthoclase, a common constituent of granites and other igneous rocks.[9]
Potassium is chemically very similar to sodium, the previous element in group 1 of the periodic table. They have a similar first ionization energy, which allows for each atom to give up its sole outer electron. It was suspected in 1702 that they were distinct elements that combine with the same anions to make similar salts,[10] and this was proven in 1807 through using electrolysis. Naturally occurring potassium is composed of three isotopes, of which 40
K is radioactive. Traces of 40
K are found in all potassium, and it is the most common radioisotope in the human body.
Potassium ions are vital for the functioning of all living cells. The transfer of potassium ions across nerve cell membranes is necessary for normal nerve transmission; potassium deficiency and excess can each result in numerous signs and symptoms, including an abnormal heart rhythm and various electrocardiographic abnormalities. Fresh fruits and vegetables are good dietary sources of potassium. The body responds to the influx of dietary potassium, which raises serum potassium levels, by shifting potassium from outside to inside cells and increasing potassium excretion by the kidneys.
Most industrial applications of potassium exploit the high solubility of its compounds in water, such as saltwater soap. Heavy crop production rapidly depletes the soil of potassium, and this can be remedied with agricultural fertilizers containing potassium, accounting for 95% of global potassium chemical production.[11]
Etymology
The English name for the element potassium comes from the word potash,[12] which refers to an early method of extracting various potassium salts: placing in a pot the ash of burnt wood or tree leaves, adding water, heating, and evaporating the solution. When Humphry Davy first isolated the pure element using electrolysis in 1807, he named it potassium, which he derived from the word potash.
The symbol K stems from kali, itself from the root word alkali, which in turn comes from Arabic: القَلْيَه al-qalyah ‘plant ashes’. In 1797, the German chemist Martin Klaproth discovered «potash» in the minerals leucite and lepidolite, and realized that «potash» was not a product of plant growth but actually contained a new element, which he proposed calling kali.[13] In 1807, Humphry Davy produced the element via electrolysis: in 1809, Ludwig Wilhelm Gilbert proposed the name Kalium for Davy’s «potassium».[14] In 1814, the Swedish chemist Berzelius advocated the name kalium for potassium, with the chemical symbol K.[15]
The English and French-speaking countries adopted Davy and Gay-Lussac/Thénard’s name Potassium, whereas the Germanic countries adopted Gilbert/Klaproth’s name Kalium.[16] The «Gold Book» of the International Union of Pure and Applied Chemistry has designated the official chemical symbol as K.[17]
Properties
Physical
Potassium is the second least dense metal after lithium. It is a soft solid with a low melting point, and can be easily cut with a knife. Freshly cut potassium is silvery in appearance, but it begins to tarnish toward gray immediately on exposure to air.[18] In a flame test, potassium and its compounds emit a lilac color with a peak emission wavelength of 766.5 nanometers.[19]
Neutral potassium atoms have 19 electrons, one more than the configuration of the noble gas argon. Because of its low first ionization energy of 418.8 kJ/mol, the potassium atom is much more likely to lose the last electron and acquire a positive charge, although negatively charged alkalide K− ions are not impossible.[20] In contrast, the second ionization energy is very high (3052 kJ/mol).
Chemical
Potassium reacts with oxygen, water, and carbon dioxide components in air. With oxygen it forms potassium peroxide. With water potassium forms potassium hydroxide (KOH). The reaction of potassium with water can be violently exothermic, especially since the coproduced hydrogen gas can ignite. Because of this, potassium and the liquid sodium-potassium (NaK) alloy are potent desiccants, although they are no longer used as such.[21]
Compounds
Structure of solid potassium superoxide (
KO2).
Four oxides of potassium are well studied: potassium oxide (K2O), potassium peroxide (K2O2), potassium superoxide (KO2)[22] and potassium ozonide (KO3). The binary potassium-oxygen compounds react with water forming KOH.
KOH is a strong base. Illustrating its hydrophilic character, as much as 1.21 kg of KOH can dissolve in a single liter of water.[23][24] Anhydrous KOH is rarely encountered. KOH reacts readily with carbon dioxide (CO2) to produce potassium carbonate (K2CO3), and in principle could be used to remove traces of the gas from air. Like the closely related sodium hydroxide, KOH reacts with fats to produce soaps.
In general, potassium compounds are ionic and, owing to the high hydration energy of the K+ ion, have excellent water solubility. The main species in water solution are the aquo complexes [K(H2O)n]+ where n = 6 and 7.[25]
Potassium heptafluorotantalate (K2[TaF7]) is an intermediate in the purification of tantalum from the otherwise persistent contaminant of niobium.[26]
Organopotassium compounds illustrate nonionic compounds of potassium. They feature highly polar covalent K–C bonds. Examples include benzyl potassium KCH2C6H5. Potassium intercalates into graphite to give a variety of graphite intercalation compounds, including KC8.
Isotopes
There are 25 known isotopes of potassium, three of which occur naturally: 39
K (93.3%), 40
K (0.0117%), and 41
K (6.7%) (by mole fraction). Naturally occurring 40
K has a half-life of 1.250×109 years. It decays to stable 40
Ar by electron capture or positron emission (11.2%) or to stable 40
Ca by beta decay (88.8%).[27] The decay of 40
K to 40
Ar is the basis of a common method for dating rocks. The conventional K-Ar dating method depends on the assumption that the rocks contained no argon at the time of formation and that all the subsequent radiogenic argon (40
Ar) was quantitatively retained. Minerals are dated by measurement of the concentration of potassium and the amount of radiogenic 40
Ar that has accumulated. The minerals best suited for dating include biotite, muscovite, metamorphic hornblende, and volcanic feldspar; whole rock samples from volcanic flows and shallow instrusives can also be dated if they are unaltered.[27][28] Apart from dating, potassium isotopes have been used as tracers in studies of weathering and for nutrient cycling studies because potassium is a macronutrient required for life[29] on Earth.
40
K occurs in natural potassium (and thus in some commercial salt substitutes) in sufficient quantity that large bags of those substitutes can be used as a radioactive source for classroom demonstrations. 40
K is the radioisotope with the largest abundance in the human body. In healthy animals and people, 40
K represents the largest source of radioactivity, greater even than 14
C. In a human body of 70 kg, about 4,400 nuclei of 40
K decay per second.[30] The activity of natural potassium is 31 Bq/g.[31]
Cosmic formation and distribution
Potassium is formed in supernovae by nucleosynthesis from lighter atoms. Potassium is principally created in Type II supernovae via an explosive oxygen-burning process.[32] (These are fusion reactions; do not confuse with chemical burning between potassium and oxygen.) 40
K is also formed in s-process nucleosynthesis and the neon burning process.[33]
Potassium is the 20th most abundant element in the solar system and the 17th most abundant element by weight in the Earth. It makes up about 2.6% of the weight of the Earth’s crust and is the seventh most abundant element in the crust.[34] The potassium concentration in seawater is 0.39 g/L[7] (0.039 wt/v%), about one twenty-seventh the concentration of sodium.[35][36]
Potash
Potash is primarily a mixture of potassium salts because plants have little or no sodium content, and the rest of a plant’s major mineral content consists of calcium salts of relatively low solubility in water. While potash has been used since ancient times, its composition was not understood. Georg Ernst Stahl obtained experimental evidence that led him to suggest the fundamental difference of sodium and potassium salts in 1702,[10] and Henri Louis Duhamel du Monceau was able to prove this difference in 1736.[37] The exact chemical composition of potassium and sodium compounds, and the status as chemical element of potassium and sodium, was not known then, and thus Antoine Lavoisier did not include the alkali in his list of chemical elements in 1789.[38][39] For a long time the only significant applications for potash were the production of glass, bleach, soap and gunpowder as potassium nitrate.[40] Potassium soaps from animal fats and vegetable oils were especially prized because they tend to be more water-soluble and of softer texture, and are therefore known as soft soaps.[11] The discovery by Justus Liebig in 1840 that potassium is a necessary element for plants and that most types of soil lack potassium[41] caused a steep rise in demand for potassium salts. Wood-ash from fir trees was initially used as a potassium salt source for fertilizer, but, with the discovery in 1868 of mineral deposits containing potassium chloride near Staßfurt, Germany, the production of potassium-containing fertilizers began at an industrial scale.[42][43][44] Other potash deposits were discovered, and by the 1960s Canada became the dominant producer.[45][46]
Metal
Pieces of potassium metal
Potassium metal was first isolated in 1807 by Humphry Davy, who derived it by electrolysis of molten KOH with the newly discovered voltaic pile. Potassium was the first metal that was isolated by electrolysis.[47] Later in the same year, Davy reported extraction of the metal sodium from a mineral derivative (caustic soda, NaOH, or lye) rather than a plant salt, by a similar technique, demonstrating that the elements, and thus the salts, are different.[38][39][48][49] Although the production of potassium and sodium metal should have shown that both are elements, it took some time before this view was universally accepted.[39]
Because of the sensitivity of potassium to water and air, air-free techniques are normally employed for handling the element. It is unreactive toward nitrogen and saturated hydrocarbons such as mineral oil or kerosene.[50] It readily dissolves in liquid ammonia, up to 480 g per 1000 g of ammonia at 0 °C. Depending on the concentration, the ammonia solutions are blue to yellow, and their electrical conductivity is similar to that of liquid metals. Potassium slowly reacts with ammonia to form KNH
2, but this reaction is accelerated by minute amounts of transition metal salts.[51] Because it can reduce the salts to the metal, potassium is often used as the reductant in the preparation of finely divided metals from their salts by the Rieke method.[52] Illustrative is the preparation of magnesium:
- MgCl2 + 2 K → Mg + 2 KCl
Geology
Elemental potassium does not occur in nature because of its high reactivity. It reacts violently with water (see section Precautions below)[50] and also reacts with oxygen. Orthoclase (potassium feldspar) is a common rock-forming mineral. Granite for example contains 5% potassium, which is well above the average in the Earth’s crust. Sylvite (KCl), carnallite (KCl·MgCl2·6H2O), kainite (MgSO4·KCl·3H2O) and langbeinite (MgSO4·K2SO4) are the minerals found in large evaporite deposits worldwide. The deposits often show layers starting with the least soluble at the bottom and the most soluble on top.[36] Deposits of niter (potassium nitrate) are formed by decomposition of organic material in contact with atmosphere, mostly in caves; because of the good water solubility of niter the formation of larger deposits requires special environmental conditions.[53]
Biological role
Potassium is the eighth or ninth most common element by mass (0.2%) in the human body, so that a 60 kg adult contains a total of about 120 g of potassium.[54] The body has about as much potassium as sulfur and chlorine, and only calcium and phosphorus are more abundant (with the exception of the ubiquitous CHON elements).[55] Potassium ions are present in a wide variety of proteins and enzymes.[56]
Biochemical function
Potassium levels influence multiple physiological processes, including[57][58][59]
- resting cellular-membrane potential and the propagation of action potentials in neuronal, muscular, and cardiac tissue. Due to the electrostatic and chemical properties, K+ ions are larger than Na+ ions, and ion channels and pumps in cell membranes can differentiate between the two ions, actively pumping or passively passing one of the two ions while blocking the other.[60]
- hormone secretion and action
- vascular tone
- systemic blood pressure control
- gastrointestinal motility
- acid–base homeostasis
- glucose and insulin metabolism
- mineralocorticoid action
- renal concentrating ability
- fluid and electrolyte balance
Homeostasis
Potassium homeostasis denotes the maintenance of the total body potassium content, plasma potassium level, and the ratio of the intracellular to extracellular potassium concentrations within narrow limits, in the face of pulsatile intake (meals), obligatory renal excretion, and shifts between intracellular and extracellular compartments.
Plasma levels
Plasma potassium is normally kept at 3.5 to 5.5 millimoles (mmol) [or milliequivalents (mEq)] per liter by multiple mechanisms.[61] Levels outside this range are associated with an increasing rate of death from multiple causes,[62] and some cardiac, kidney,[63] and lung diseases progress more rapidly if serum potassium levels are not maintained within the normal range.
An average meal of 40–50 mmol presents the body with more potassium than is present in all plasma (20–25 mmol). This surge causes the plasma potassium to rise up to 10% before clearance by renal and extrarenal mechanisms.[64]
Hypokalemia, a deficiency of potassium in the plasma, can be fatal if severe. Common causes are increased gastrointestinal loss (vomiting, diarrhea), and increased renal loss (diuresis).[65] Deficiency symptoms include muscle weakness, paralytic ileus, ECG abnormalities, decreased reflex response; and in severe cases, respiratory paralysis, alkalosis, and cardiac arrhythmia.[66]
Control mechanisms
Potassium content in the plasma is tightly controlled by four basic mechanisms, which have various names and classifications. The four are 1) a reactive negative-feedback system, 2) a reactive feed-forward system, 3) a predictive or circadian system, and 4) an internal or cell membrane transport system. Collectively, the first three are sometimes termed the «external potassium homeostasis system»;[67] and the first two, the «reactive potassium homeostasis system».
- The reactive negative-feedback system refers to the system that induces renal secretion of potassium in response to a rise in the plasma potassium (potassium ingestion, shift out of cells, or intravenous infusion.)
- The reactive feed-forward system refers to an incompletely understood system that induces renal potassium secretion in response to potassium ingestion prior to any rise in the plasma potassium. This is probably initiated by gut cell potassium receptors that detect ingested potassium and trigger vagal afferent signals to the pituitary gland.
- The predictive or circadian system increases renal secretion of potassium during mealtime hours (e.g. daytime for humans, nighttime for rodents) independent of the presence, amount, or absence of potassium ingestion. It is mediated by a circadian oscillator in the suprachiasmatic nucleus of the brain (central clock), which causes the kidney (peripheral clock) to secrete potassium in this rhythmic circadian fashion.
The action of the sodium-potassium pump is an example of primary active transport. The two carrier proteins embedded in the cell membrane on the left are using ATP to move sodium out of the cell against the concentration gradient; The two proteins on the right are using secondary active transport to move potassium into the cell. This process results in reconstitution of ATP.
- The ion transport system moves potassium across the cell membrane using two mechanisms. One is active and pumps sodium out of, and potassium into, the cell. The other is passive and allows potassium to leak out of the cell. Potassium and sodium cations influence fluid distribution between intracellular and extracellular compartments by osmotic forces. The movement of potassium and sodium through the cell membrane is mediated by the Na⁺/K⁺-ATPase pump.[68] This ion pump uses ATP to pump three sodium ions out of the cell and two potassium ions into the cell, creating an electrochemical gradient and electromotive force across the cell membrane. The highly selective potassium ion channels (which are tetramers) are crucial for hyperpolarization inside neurons after an action potential is triggered, to cite one example. The most recently discovered potassium ion channel is KirBac3.1, which makes a total of five potassium ion channels (KcsA, KirBac1.1, KirBac3.1, KvAP, and MthK) with a determined structure. All five are from prokaryotic species.[69]
Renal filtration, reabsorption, and excretion
Renal handling of potassium is closely connected to sodium handling. Potassium is the major cation (positive ion) inside animal cells [150 mmol/L, (4.8 g)], while sodium is the major cation of extracellular fluid [150 mmol/L, (3.345 g)]. In the kidneys, about 180 liters of plasma is filtered through the glomeruli and into the renal tubules per day.[70] This filtering involves about 600 g of sodium and 33 g of potassium. Since only 1–10 g of sodium and 1–4 g of potassium are likely to be replaced by diet, renal filtering must efficiently reabsorb the remainder from the plasma.
Sodium is reabsorbed to maintain extracellular volume, osmotic pressure, and serum sodium concentration within narrow limits. Potassium is reabsorbed to maintain serum potassium concentration within narrow limits.[71] Sodium pumps in the renal tubules operate to reabsorb sodium. Potassium must be conserved, but because the amount of potassium in the blood plasma is very small and the pool of potassium in the cells is about 30 times as large, the situation is not so critical for potassium. Since potassium is moved passively[72][73] in counter flow to sodium in response to an apparent (but not actual) Donnan equilibrium,[74] the urine can never sink below the concentration of potassium in serum except sometimes by actively excreting water at the end of the processing. Potassium is excreted twice and reabsorbed three times before the urine reaches the collecting tubules.[75] At that point, urine usually has about the same potassium concentration as plasma. At the end of the processing, potassium is secreted one more time if the serum levels are too high.[citation needed]
With no potassium intake, it is excreted at about 200 mg per day until, in about a week, potassium in the serum declines to a mildly deficient level of 3.0–3.5 mmol/L.[76] If potassium is still withheld, the concentration continues to fall until a severe deficiency causes eventual death.[77]
The potassium moves passively through pores in the cell membrane. When ions move through Ion transporters (pumps) there is a gate in the pumps on both sides of the cell membrane and only one gate can be open at once. As a result, approximately 100 ions are forced through per second. Ion channel have only one gate, and there only one kind of ion can stream through, at 10 million to 100 million ions per second.[78] Calcium is required to open the pores,[79] although calcium may work in reverse by blocking at least one of the pores.[80] Carbonyl groups inside the pore on the amino acids mimic the water hydration that takes place in water solution[81] by the nature of the electrostatic charges on four carbonyl groups inside the pore.[82]
Nutrition
Dietary recommendations
The U.S. National Academy of Medicine (NAM), on behalf of both the U.S. and Canada, sets Dietary Reference Intakes, including Estimated Average Requirements (EARs) and Recommended Dietary Allowances (RDAs), or Adequate Intakes (AIs) for when there is not sufficient information to set EARs and RDAs.
For both males and females under 9 years of age, the AIs for potassium are: 400 mg of potassium for 0-6-month-old infants, 860 mg of potassium for 7-12-month-old infants, 2,000 mg of potassium for 1-3-year-old children, and 2,300 mg of potassium for 4-8-year-old children.
For males 9 years of age and older, the AIs for potassium are: 2,500 mg of potassium for 9-13-year-old males, 3,000 mg of potassium for 14-18-year-old males, and 3,400 mg for males that are 19 years of age and older.
For females 9 years of age and older, the AIs for potassium are: 2,300 mg of potassium for 9-18-year-old females, and 2,600 mg of potassium for females that are 19 years of age and older.
For pregnant and lactating females, the AIs for potassium are: 2,600 mg of potassium for 14-18-year-old pregnant females, 2,900 mg for pregnant females that are 19 years of age and older; furthermore, 2,500 mg of potassium for 14-18-year-old lactating females, and 2,800 mg for lactating females that are 19 years of age and older. As for safety, the NAM also sets tolerable upper intake levels (ULs) for vitamins and minerals, but for potassium the evidence was insufficient, so no UL was established.[83][84]
As of 2004, most Americans adults consume less than 3,000 mg.[85]
Likewise, in the European Union, in particular in Germany, and Italy, insufficient potassium intake is somewhat common.[86] The British National Health Service recommends a similar intake, saying that adults need 3,500 mg per day and that excess amounts may cause health problems such as stomach pain and diarrhea.[87]
In 2019, the National Academies of Sciences, Engineering, and Medicine revised the Adequate Intake for potassium to 2,600 mg/day for females 19 years of age and older who are not pregnant or lactating, and 3,400 mg/day for males 19 years of age and older.[88][89]
Food sources
Potassium is present in all fruits, vegetables, meat and fish. Foods with high potassium concentrations include yam, parsley, dried apricots, milk, chocolate, all nuts (especially almonds and pistachios), potatoes, bamboo shoots, bananas, avocados, coconut water, soybeans, and bran.[90]
The United States Department of Agriculture lists tomato paste, orange juice, beet greens, white beans, potatoes, plantains, bananas, apricots, and many other dietary sources of potassium, ranked in descending order according to potassium content. A day’s worth of potassium is in 5 plantains or 11 bananas.[91]
Deficient intake
Diets low in potassium can lead to hypertension[92] and hypokalemia.
Supplementation
Supplements of potassium are most widely used in conjunction with diuretics that block reabsorption of sodium and water upstream from the distal tubule (thiazides and loop diuretics), because this promotes increased distal tubular potassium secretion, with resultant increased potassium excretion.[medical citation needed] A variety of prescription and over-the counter supplements are available.[citation needed] Potassium chloride may be dissolved in water, but the salty/bitter taste makes liquid supplements unpalatable.[93] Typical doses range from 10 mmol (400 mg), to 20 mmol (800 mg).[medical citation needed] Potassium is also available in tablets or capsules, which are formulated to allow potassium to leach slowly out of a matrix, since very high concentrations of potassium ion that occur adjacent to a solid tablet can injure the gastric or intestinal mucosa.[medical citation needed] For this reason, non-prescription potassium pills are limited by law in the US to a maximum of 99 mg of potassium.[citation needed]
A meta-analysis concluded that a 1640 mg increase in the daily intake of potassium was associated with a 21% lower risk of stroke.[94] Potassium chloride and potassium bicarbonate may be useful to control mild hypertension.[95] In 2020, potassium was the 33rd most commonly prescribed medication in the U.S., with more than 17 million prescriptions.[96][97]
Detection by taste buds
Potassium can be detected by taste because it triggers three of the five types of taste sensations, according to concentration. Dilute solutions of potassium ions taste sweet, allowing moderate concentrations in milk and juices, while higher concentrations become increasingly bitter/alkaline, and finally also salty to the taste. The combined bitterness and saltiness of high-potassium solutions makes high-dose potassium supplementation by liquid drinks a palatability challenge.[93][98]
Commercial production
Mining
Potassium salts such as carnallite, langbeinite, polyhalite, and sylvite form extensive evaporite deposits in ancient lake bottoms and seabeds,[35] making extraction of potassium salts in these environments commercially viable. The principal source of potassium – potash – is mined in Canada, Russia, Belarus, Kazakhstan, Germany, Israel, the U.S., Jordan, and other places around the world.[99][100][101] The first mined deposits were located near Staßfurt, Germany, but the deposits span from Great Britain over Germany into Poland. They are located in the Zechstein and were deposited in the Middle to Late Permian. The largest deposits ever found lie 1,000 meters (3,300 feet) below the surface of the Canadian province of Saskatchewan. The deposits are located in the Elk Point Group produced in the Middle Devonian. Saskatchewan, where several large mines have operated since the 1960s pioneered the technique of freezing of wet sands (the Blairmore formation) to drive mine shafts through them. The main potash mining company in Saskatchewan until its merge was the Potash Corporation of Saskatchewan, now Nutrien.[102] The water of the Dead Sea is used by Israel and Jordan as a source of potash, while the concentration in normal oceans is too low for commercial production at current prices.[100][101]
Several methods are used to separate potassium salts from sodium and magnesium compounds. The most-used method is fractional precipitation using the solubility differences of the salts. Electrostatic separation of the ground salt mixture is also used in some mines. The resulting sodium and magnesium waste is either stored underground or piled up in slag heaps. Most of the mined potassium mineral ends up as potassium chloride after processing. The mineral industry refers to potassium chloride either as potash, muriate of potash, or simply MOP.[36]
Pure potassium metal can be isolated by electrolysis of its hydroxide in a process that has changed little since it was first used by Humphry Davy in 1807. Although the electrolysis process was developed and used in industrial scale in the 1920s, the thermal method by reacting sodium with potassium chloride in a chemical equilibrium reaction became the dominant method in the 1950s.
- Na + KCl → NaCl + K
The production of sodium potassium alloys is accomplished by changing the reaction time and the amount of sodium used in the reaction. The Griesheimer process employing the reaction of potassium fluoride with calcium carbide was also used to produce potassium.[36][103]
- 2 KF + CaC2 → 2 K + CaF2 + 2 C
Reagent-grade potassium metal costs about $10.00/pound ($22/kg) in 2010 when purchased by the tonne. Lower purity metal is considerably cheaper. The market is volatile because long-term storage of the metal is difficult. It must be stored in a dry inert gas atmosphere or anhydrous mineral oil to prevent the formation of a surface layer of potassium superoxide, a pressure-sensitive explosive that detonates when scratched. The resulting explosion often starts a fire difficult to extinguish.[104][105]
Cation identification
Potassium is now quantified by ionization techniques, but at one time it was quantitated by gravimetric analysis.
Reagents used to precipitate potassium salts include sodium tetraphenylborate, hexachloroplatinic acid, and sodium cobaltinitrite into respectively potassium tetraphenylborate, potassium hexachloroplatinate, and potassium cobaltinitrite.[50]
The reaction with sodium cobaltinitrite is illustrative:
- 3 K+ + Na3[Co(NO2)6] → K3[Co(NO2)6] + 3 Na+
The potassium cobaltinitrite is obtained as a yellow solid.
Commercial uses
Fertilizer
Potassium sulfate/magnesium sulfate fertilizer
Potassium ions are an essential component of plant nutrition and are found in most soil types.[11] They are used as a fertilizer in agriculture, horticulture, and hydroponic culture in the form of chloride (KCl), sulfate (K2SO4), or nitrate (KNO3), representing the ‘K’ in ‘NPK’. Agricultural fertilizers consume 95% of global potassium chemical production, and about 90% of this potassium is supplied as KCl.[11] The potassium content of most plants ranges from 0.5% to 2% of the harvested weight of crops, conventionally expressed as amount of K2O. Modern high-yield agriculture depends upon fertilizers to replace the potassium lost at harvest. Most agricultural fertilizers contain potassium chloride, while potassium sulfate is used for chloride-sensitive crops or crops needing higher sulfur content. The sulfate is produced mostly by decomposition of the complex minerals kainite (MgSO4·KCl·3H2O) and langbeinite (MgSO4·K2SO4). Only a very few fertilizers contain potassium nitrate.[106] In 2005, about 93% of world potassium production was consumed by the fertilizer industry.[101] Furthermore, potassium can play a key role in nutrient cycling by controlling litter composition.[107]
Medical use
Potassium citrate
Potassium citrate is used to treat a kidney stone condition called renal tubular acidosis.[108]
Potassium chloride
Potassium, in the form of potassium chloride is used as a medication to treat and prevent low blood potassium.[109] Low blood potassium may occur due to vomiting, diarrhea, or certain medications.[110] It is given by slow injection into a vein or by mouth.[111]
Food additives
Potassium sodium tartrate (KNaC4H4O6, Rochelle salt) is a main constituent of some varieties of baking powder; it is also used in the silvering of mirrors. Potassium bromate (KBrO3) is a strong oxidizer (E924), used to improve dough strength and rise height. Potassium bisulfite (KHSO3) is used as a food preservative, for example in wine and beer-making (but not in meats). It is also used to bleach textiles and straw, and in the tanning of leathers.[112][113]
Industrial
Major potassium chemicals are potassium hydroxide, potassium carbonate, potassium sulfate, and potassium chloride. Megatons of these compounds are produced annually.[114]
KOH is a strong base, which is used in industry to neutralize strong and weak acids, to control pH and to manufacture potassium salts. It is also used to saponify fats and oils, in industrial cleaners, and in hydrolysis reactions, for example of esters.[115][116]
Potassium nitrate (KNO3) or saltpeter is obtained from natural sources such as guano and evaporites or manufactured via the Haber process; it is the oxidant in gunpowder (black powder) and an important agricultural fertilizer. Potassium cyanide (KCN) is used industrially to dissolve copper and precious metals, in particular silver and gold, by forming complexes. Its applications include gold mining, electroplating, and electroforming of these metals; it is also used in organic synthesis to make nitriles. Potassium carbonate (K2CO3 or potash) is used in the manufacture of glass, soap, color TV tubes, fluorescent lamps, textile dyes and pigments.[117] Potassium permanganate (KMnO4) is an oxidizing, bleaching and purification substance and is used for production of saccharin. Potassium chlorate (KClO3) is added to matches and explosives. Potassium bromide (KBr) was formerly used as a sedative and in photography.[11]
While potassium chromate (K2CrO4) is used in the manufacture of a host of different commercial products such as inks, dyes, wood stains (by reacting with the tannic acid in wood), explosives, fireworks, fly paper, and safety matches,[118] as well as in the tanning of leather, all of these uses are due to the chemistry of the chromate ion rather than to that of the potassium ion.[119]
Niche uses
There are thousands of uses of various potassium compounds. One example is potassium superoxide, KO2, an orange solid that acts as a portable source of oxygen and a carbon dioxide absorber. It is widely used in respiration systems in mines, submarines and spacecraft as it takes less volume than the gaseous oxygen.[120][121]
- 4 KO2 + 2 CO2 → 2 K2CO3 + 3 O2
Another example is potassium cobaltinitrite, K3[Co(NO2)6], which is used as artist’s pigment under the name of Aureolin or Cobalt Yellow.[122]
The stable isotopes of potassium can be laser cooled and used to probe fundamental and technological problems in quantum physics. The two bosonic isotopes possess convenient Feshbach resonances to enable studies requiring tunable interactions, while 40
K is one of only two stable fermions amongst the alkali metals.[123]
Laboratory uses
An alloy of sodium and potassium, NaK is a liquid used as a heat-transfer medium and a desiccant for producing dry and air-free solvents. It can also be used in reactive distillation.[124] The ternary alloy of 12% Na, 47% K and 41% Cs has the lowest melting point of −78 °C of any metallic compound.[18]
Metallic potassium is used in several types of magnetometers.[125]
Precautions
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H260, H314 |
|
Precautionary statements |
P223, P231+P232, P280, P305+P351+P338, P370+P378, P422[126] |
| NFPA 704 (fire diamond) |
3 3 2
|
Potassium metal can react violently with water producing KOH and hydrogen gas.
- 2 K(s) + 2 H2O(l) → 2 KOH(aq) + H2(g)↑
A reaction of potassium metal with water. Hydrogen is produced, and with potassium vapor, burns with a pink or lilac flame. Strongly alkaline potassium hydroxide is formed in solution.
This reaction is exothermic and releases sufficient heat to ignite the resulting hydrogen in the presence of oxygen. Finely powdered potassium ignites in air at room temperature. The bulk metal ignites in air if heated. Because its density is 0.89 g/cm3, burning potassium floats in water that exposes it to atmospheric oxygen. Many common fire extinguishing agents, including water, either are ineffective or make a potassium fire worse. Nitrogen, argon, sodium chloride (table salt), sodium carbonate (soda ash), and silicon dioxide (sand) are effective if they are dry. Some Class D dry powder extinguishers designed for metal fires are also effective. These agents deprive the fire of oxygen and cool the potassium metal.[127]
During storage, potassium forms peroxides and superoxides. These peroxides may react violently with organic compounds such as oils. Both peroxides and superoxides may react explosively with metallic potassium.[128]
Because potassium reacts with water vapor in the air, it is usually stored under anhydrous mineral oil or kerosene. Unlike lithium and sodium, potassium should not be stored under oil for longer than six months, unless in an inert (oxygen-free) atmosphere, or under vacuum. After prolonged storage in air dangerous shock-sensitive peroxides can form on the metal and under the lid of the container, and can detonate upon opening.[129]
Ingestion of large amounts of potassium compounds can lead to hyperkalemia, strongly influencing the cardiovascular system.[130][131] Potassium chloride is used in the U.S. for lethal injection executions.[130]
See also
References
- ^ «Standard Atomic Weights: Potassium». CIAAW. 1979.
- ^ a b Aitken, F.; Volino, F. (January 2022). «New equations of state describing both the dynamic viscosity and self-diffusion coefficient for potassium and thallium in their fluid phases». Physics of Fluids. 34 (1): 017112. doi:10.1063/5.0079944.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.122. ISBN 1-4398-5511-0.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Augustyn, Adam. «Potassium/ Chemical element». Encyclopedia Britannica. Retrieved 2019-04-17.
Potassium Physical properties
- ^ a b Webb, D. A. (April 1939). «The Sodium and Potassium Content of Sea Water» (PDF). The Journal of Experimental Biology (2): 183.
- ^ Anthoni, J. (2006). «Detailed composition of seawater at 3.5% salinity». seafriends.org.nz. Retrieved 2011-09-23.
- ^ Halperin, Mitchell L.; Kamel, Kamel S. (1998-07-11). «Potassium». The Lancet. 352 (9122): 135–140. doi:10.1016/S0140-6736(98)85044-7. ISSN 0140-6736. PMID 9672294. S2CID 208790031.
- ^ a b Marggraf, Andreas Siegmund (1761). Chymische Schriften. p. 167.
- ^ a b c d e Greenwood, p. 73
- ^ Davy, Humphry (1808). «On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies». Philosophical Transactions of the Royal Society. 98: 32. doi:10.1098/rstl.1808.0001.
- ^ Klaproth, M. (1797) «Nouvelles données relatives à l’histoire naturelle de l’alcali végétal» (New data regarding the natural history of the vegetable alkali), Mémoires de l’Académie royale des sciences et belles-lettres (Berlin), pp. 9–13 ; see p. 13. From p. 13: «Cet alcali ne pouvant donc plus être envisagé comme un produit de la végétation dans les plantes, occupe une place propre dans la série des substances primitivement simples du règne minéral, &I il devient nécessaire de lui assigner un nom, qui convienne mieux à sa nature.
La dénomination de Potasche (potasse) que la nouvelle nomenclature françoise a consacrée comme nom de tout le genre, ne sauroit faire fortune auprès des chimistes allemands, qui sentent à quel point la dérivation étymologique en est vicieuse. Elle est prise en effet de ce qu’anciennement on se servoit pour la calcination des lessives concentrées des cendres, de pots de fer (pott en dialecte de la Basse-Saxe) auxquels on a substitué depuis des fours à calciner.
Je propose donc ici, de substituer aux mots usités jusqu’ici d’alcali des plantes, alcali végétal, potasse, &c. celui de kali, & de revenir à l’ancienne dénomination de natron, au lieu de dire alcali minéral, soude &c.»
(This alkali [i.e., potash] — [which] therefore can no longer be viewed as a product of growth in plants — occupies a proper place in the originally simple series of the mineral realm, and it becomes necessary to assign it a name that is better suited to its nature.
The name of «potash» (potasse), which the new French nomenclature has bestowed as the name of the entire species [i.e., substance], would not find acceptance among German chemists, who feel to some extent [that] the etymological derivation of it is faulty. Indeed, it is taken from [the vessels] that one formerly used for the roasting of washing powder concentrated from cinders: iron pots (pott in the dialect of Lower Saxony), for which roasting ovens have been substituted since then.
Thus I now propose to substitute for the until now common words of «plant alkali», «vegetable alkali», «potash», etc., that of kali ; and to return to the old name of natron instead of saying «mineral alkali», «soda», etc.) - ^ Davy, Humphry (1809). «Ueber einige neue Erscheinungen chemischer Veränderungen, welche durch die Electricität bewirkt werden; insbesondere über die Zersetzung der feuerbeständigen Alkalien, die Darstellung der neuen Körper, welche ihre Basen ausmachen, und die Natur der Alkalien überhaupt» [On some new phenomena of chemical changes that are achieved by electricity; particularly the decomposition of flame-resistant alkalis [i.e., alkalies that cannot be reduced to their base metals by flames], the preparation of new substances that constitute their [metallic] bases, and the nature of alkalies generally]. Annalen der Physik. 31 (2): 113–175. Bibcode:1809AnP….31..113D. doi:10.1002/andp.18090310202.
p. 157: In unserer deutschen Nomenclatur würde ich die Namen Kalium und Natronium vorschlagen, wenn man nicht lieber bei den von Herrn Erman gebrauchten und von mehreren angenommenen Benennungen Kali-Metalloid and Natron-Metalloid, bis zur völligen Aufklärung der chemischen Natur dieser räthzelhaften Körper bleiben will. Oder vielleicht findet man es noch zweckmässiger fürs Erste zwei Klassen zu machen, Metalle und Metalloide, und in die letztere Kalium und Natronium zu setzen. — Gilbert. (In our German nomenclature, I would suggest the names Kalium and Natronium, if one would not rather continue with the appellations Kali-metalloid and Natron-metalloid which are used by Mr. Erman [i.e., German physics professor Paul Erman (1764–1851)] and accepted by several [people], until the complete clarification of the chemical nature of these puzzling substances. Or perhaps one finds it yet more advisable for the present to create two classes, metals and metalloids, and to place Kalium and Natronium in the latter — Gilbert.)
- ^ Berzelius, J. Jacob (1814) Försök, att, genom användandet af den electrokemiska theorien och de kemiska proportionerna, grundlägga ett rent vettenskapligt system för mineralogien [Attempt, by the use of electrochemical theory and chemical proportions, to found a pure scientific system for mineralogy]. Stockholm, Sweden: A. Gadelius., p. 87.
- ^ 19. Kalium (Potassium) – Elementymology & Elements Multidict. vanderkrogt.net
- ^ McNaught, A. D. and Wilkinson,A. eds. (1997). Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). IUPAC. Blackwell Scientific Publications, Oxford.
- ^ a b Greenwood, p. 76
- ^ Greenwood, p. 75
- ^ Dye, J. L. (1979). «Compounds of Alkali Metal Anions». Angewandte Chemie International Edition. 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ Williams, D. Bradley G.; Lawton, Michelle (2010). «Drying of Organic Solvents: Quantitative Evaluation of the Efficiency of Several Desiccants». The Journal of Organic Chemistry. 75 (24): 8351–8354. doi:10.1021/jo101589h. PMID 20945830. S2CID 17801540.
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (87th ed.). Boca Raton, Florida, United States: CRC Press. pp. 477, 520. ISBN 978-0-8493-0594-8.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 4–80. ISBN 0-8493-0486-5.
- ^ Schultz, p. 94
- ^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. «Metal Aqua Ions» in J. A. McCleverty and T. J. Meyer (eds.) Comprehensive Coordination Chemistry II, Vol. 1, pp. 515–555, ISBN 978-0-08-043748-4.
- ^ Anthony Agulyanski (2004). «Fluorine chemistry in the processing of tantalum and niobium». In Anatoly Agulyanski (ed.). Chemistry of Tantalum and Niobium Fluoride Compounds (1st ed.). Burlington: Elsevier. ISBN 9780080529028.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), «The NUBASE evaluation of nuclear and decay properties», Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729….3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Bowen, Robert; Attendorn, H. G. (1988). «Theory and Assumptions in Potassium–Argon Dating». Isotopes in the Earth Sciences. Springer. pp. 203–8. ISBN 978-0-412-53710-3.
- ^ Anaç, D. & Martin-Prével, P. (1999). Improved crop quality by nutrient management. Springer. pp. 290–. ISBN 978-0-7923-5850-3.
- ^ «Radiation and Radioactive Decay. Radioactive Human Body». Harvard Natural Sciences Lecture Demonstrations. Retrieved July 2, 2016.
- ^ Winteringham, F. P. W; Effects, F.A.O. Standing Committee on Radiation, Land And Water Development Division, Food and Agriculture Organization of the United Nations (1989). Radioactive fallout in soils, crops and food: a background review. Food & Agriculture Org. p. 32. ISBN 978-92-5-102877-3.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Shimansky, V.; Bikmaev, I. F.; Galeev, A. I.; Shimanskaya, N. N.; et al. (September 2003). «Observational constraints on potassium synthesis during the formation of stars of the Galactic disk». Astronomy Reports. 47 (9): 750–762. Bibcode:2003ARep…47..750S. doi:10.1134/1.1611216. S2CID 120396773.
- ^ The, L.-S.; Eid, M. F. El; Meyer, B. S. (2000). «A New Study of s-Process Nucleosynthesis in Massive Stars». The Astrophysical Journal. 533 (2): 998. arXiv:astro-ph/9812238. Bibcode:2000ApJ…533..998T. doi:10.1086/308677. ISSN 0004-637X. S2CID 7698683.
- ^ Greenwood, p. 69
- ^ a b Micale, Giorgio; Cipollina, Andrea; Rizzuti, Lucio (2009). Seawater Desalination: Conventional and Renewable Energy Processes. Springer. p. 3. ISBN 978-3-642-01149-8.
- ^ a b c d Prud’homme, Michel; Krukowski, Stanley T. (2006). «Potash». Industrial minerals & rocks: commodities, markets, and uses. Society for Mining, Metallurgy, and Exploration. pp. 723–740. ISBN 978-0-87335-233-8.
- ^ du Monceau, H. L. D. (1702–1797). «Sur la Base de Sel Marin». Mémoires de l’Académie Royale des Sciences (in French): 65–68.
- ^ a b Weeks, Mary Elvira (1932). «The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium». Journal of Chemical Education. 9 (6): 1035. Bibcode:1932JChEd…9.1035W. doi:10.1021/ed009p1035.
- ^ a b c Siegfried, R. (1963). «The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements». Isis. 54 (2): 247–258. doi:10.1086/349704. JSTOR 228541. PMID 14147904. S2CID 38152048.
- ^ Browne, C. A. (1926). «Historical notes upon the domestic potash industry in early colonial and later times». Journal of Chemical Education. 3 (7): 749–756. Bibcode:1926JChEd…3..749B. doi:10.1021/ed003p749.
- ^ Liebig, Justus von (1840). Die organische Chemie in ihrer Anwendung auf Agricultur und Physiologie (in German). F. Vieweg und Sohn.
- ^ Cordel, Oskar (1868). Die Stassfurter Kalisalze in der Landwirthschalt: Eine Besprechung … (in German). L. Schnock.
- ^ Birnbaum, Karl (1869). Die Kalidüngung in ihren Vortheilen und Gefahren (in German).
- ^ United Nations Industrial Development Organization and Int’l Fertilizer Development Center (1998). Fertilizer Manual. pp. 46, 417. ISBN 978-0-7923-5032-3.
- ^ Miller, H. (1980). «Potash from Wood Ashes: Frontier Technology in Canada and the United States». Technology and Culture. 21 (2): 187–208. doi:10.2307/3103338. JSTOR 3103338.
- ^ Rittenhouse, P. A. (1979). «Potash and politics». Economic Geology. 74 (2): 353–7. doi:10.2113/gsecongeo.74.2.353.
- ^ Enghag, P. (2004). «11. Sodium and Potassium». Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 978-3-527-30666-4.
- ^ Davy, Humphry (1808). «On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies». Philosophical Transactions of the Royal Society. 98: 1–44. doi:10.1098/rstl.1808.0001.
- ^ Shaposhnik, V. A. (2007). «History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)». Journal of Analytical Chemistry. 62 (11): 1100–2. doi:10.1134/S1061934807110160. S2CID 96141217.
- ^ a b c Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). «Potassium». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. ISBN 978-3-11-007511-3.
- ^ Burkhardt, p. 32
- ^ Rieke, R. D. (1989). «Preparation of Organometallic Compounds from Highly Reactive Metal Powders». Science. 246 (4935): 1260–4. Bibcode:1989Sci…246.1260R. doi:10.1126/science.246.4935.1260. PMID 17832221. S2CID 92794.
- ^ Ross, William H. (1914). «The Origin of Nitrate Deposits». Popular Science. Bonnier Corporation. pp. 134–145.
- ^ Abdel-Wahab, M.; Youssef, S.; Aly, A.; el-Fiki, S.; et al. (1992). «A simple calibration of a whole-body counter for the measurement of total body potassium in humans». International Journal of Radiation Applications and Instrumentation A. 43 (10): 1285–9. doi:10.1016/0883-2889(92)90208-V. PMID 1330980.
- ^ Chang, Raymond (2007). Chemistry. McGraw-Hill Higher Education. p. 52. ISBN 978-0-07-110595-8.
- ^ Vašák, Milan; Schnabl, Joachim (2016). «Chapter 8. Sodium and Potassium Ions in Proteins and Enzyme Catalysis». In Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel (eds.). The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. Vol. 16. Springer. pp. 259–290. doi:10.1007/978-3-319-21756-7_8. PMID 26860304.
- ^ Weiner ID, Linus S, Wingo CS (2014). «Disorders of potassium metabolism». In Freehally J, Johnson RJ, Floege J (eds.). Comprehensive clinical nephrology (5th ed.). St. Louis: Saunders. p. 118. ISBN 9780323242875.
- ^ Malnic G, Giebisch G, Muto S, Wang W, Bailey MA, Satlin LM (2013). «Regulation of K+ excretion». In Alpern RJ, Caplan MJ, Moe OW (eds.). Seldin and Giebisch’s the kidney: physiology and pathophysiology (5th ed.). London: Academic Press. pp. 1659–1716. ISBN 9780123814630.
- ^ Mount DB, Zandi-Nejad K (2011). «Disorders of potassium balance». In Taal MW, Chertow GM, Marsden PA, Skorecki KL, Yu AS, Brenner BM (eds.). The kidney (9th ed.). Philadelphia: Elsevier. pp. 640–688. ISBN 9781455723041.
- ^ Lockless, S. W.; Zhou, M.; MacKinnon, R. (2007). «Structural and thermodynamic properties of selective ion binding in a K+ channel». PLOS Biol. 5 (5): e121. doi:10.1371/journal.pbio.0050121. PMC 1858713. PMID 17472437.
- ^ Wei, Kuang-Yu; Gritter, Martin; Vogt, Liffert; de Borst, Martin H; Rotmans, Joris I; Hoorn, Ewout J (2020-09-02). «Dietary potassium and the kidney: lifesaving physiology». Clinical Kidney Journal. Oxford University Press (OUP). 13 (6): 952–968. doi:10.1093/ckj/sfaa157. ISSN 2048-8513. PMC 7769543. PMID 33391739.
- ^ Goyal, Abhinav; Spertus, John A.; Gosch, Kensey; Venkitachalam, Lakshmi; Jones, Philip G.; Van den Berghe, Greet; Kosiborod, Mikhail (2012). «Serum Potassium Levels and Mortality in Acute Myocardial Infarction». JAMA. 307 (2): 157–164. doi:10.1001/jama.2011.1967. PMID 22235086.
- ^ Smyth, A.; Dunkler, D.; Gao, P.; et al. (2014). «The relationship between estimated sodium and potassium excretion and subsequent renal outcomes». Kidney Int. 86 (6): 1205–1212. doi:10.1038/ki.2014.214. PMID 24918156.
- ^ Moore-Ede, M. C. (1986). «Physiology of the circadian timing system: predictive versus reactive homeostasis». Am J Physiol. 250 (5 Pt 2): R737–R752. doi:10.1152/ajpregu.1986.250.5.R737. PMID 3706563.
- ^ Slonim, Anthony D.; Pollack, Murray M. (2006). «Potassium». Pediatric critical care medicine. Lippincott Williams & Wilkins. p. 812. ISBN 978-0-7817-9469-5.
- ^ Visveswaran, Kasi (2009). «hypokalemia». Essentials of Nephrology (2nd ed.). BI Publications. p. 257. ISBN 978-81-7225-323-3.
- ^ Gumz, Michelle L.; Rabinowitz, Lawrence; Wingo, Charles S. (2015-07-02). «An Integrated View of Potassium Homeostasis». The New England Journal of Medicine. 373 (1): 60–72. doi:10.1056/NEJMra1313341. ISSN 0028-4793. PMC 5675534. PMID 26132942.
- ^ Campbell, Neil (1987). Biology. Menlo Park, California: Benjamin/Cummings Pub. Co. p. 795. ISBN 978-0-8053-1840-1.
- ^ Hellgren, Mikko; Sandberg, Lars; Edholm, Olle (2006). «A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study». Biophysical Chemistry. 120 (1): 1–9. doi:10.1016/j.bpc.2005.10.002. PMID 16253415.
- ^ Potts, W. T. W.; Parry, G. (1964). Osmotic and ionic regulation in animals. Pergamon Press.
- ^ Lans, H. S.; Stein, I. F.; Meyer, K. A. (1952). «The relation of serum potassium to erythrocyte potassium in normal subjects and patients with potassium deficiency». American Journal of the Medical Sciences. 223 (1): 65–74. doi:10.1097/00000441-195201000-00011. PMID 14902792.
- ^ Bennett, C. M.; Brenner, B. M.; Berliner, R. W. (1968). «Micropuncture study of nephron function in the rhesus monkey». Journal of Clinical Investigation. 47 (1): 203–216. doi:10.1172/JCI105710. PMC 297160. PMID 16695942.
- ^ Solomon, A. K. (1962). «Pumps in the living cell». Scientific American. 207 (2): 100–8. Bibcode:1962SciAm.207b.100S. doi:10.1038/scientificamerican0862-100. PMID 13914986.
- ^ Kernan, Roderick P. (1980). Cell potassium (Transport in the life sciences). New York: Wiley. pp. 40, 48. ISBN 978-0-471-04806-0.
- ^ Wright, F. S. (1977). «Sites and mechanisms of potassium transport along the renal tubule». Kidney International. 11 (6): 415–432. doi:10.1038/ki.1977.60. PMID 875263.
- ^ Squires, R. D.; Huth, E. J. (1959). «Experimental potassium depletion in normal human subjects. I. Relation of ionic intakes to the renal conservation of potassium». Journal of Clinical Investigation. 38 (7): 1134–48. doi:10.1172/JCI103890. PMC 293261. PMID 13664789.
- ^ Fiebach, Nicholas H.; Barker, Lee Randol; Burton, John Russell & Zieve, Philip D. (2007). Principles of ambulatory medicine. Lippincott Williams & Wilkins. pp. 748–750. ISBN 978-0-7817-6227-4.
- ^ Gadsby, D. C. (2004). «Ion transport: spot the difference». Nature. 427 (6977): 795–7. Bibcode:2004Natur.427..795G. doi:10.1038/427795a. PMID 14985745. S2CID 5923529.; for a diagram of the potassium pores are viewed, see Miller, C (2001). «See potassium run». Nature. 414 (6859): 23–24. Bibcode:2001Natur.414…23M. doi:10.1038/35102126. PMID 11689922. S2CID 4423041.
- ^ Jiang, Y.; Lee, A.; Chen, J.; Cadene, M.; et al. (2002). «Crystal structure and mechanism of a calcium-gated potassium channel» (PDF). Nature. 417 (6888): 515–22. Bibcode:2002Natur.417..515J. doi:10.1038/417515a. PMID 12037559. S2CID 205029269. Archived from the original on 2009-04-24.
{{cite journal}}: CS1 maint: bot: original URL status unknown (link) - ^ Shi, N.; Ye, S.; Alam, A.; Chen, L.; et al. (2006). «Atomic structure of a Na+— and K+-conducting channel». Nature. 440 (7083): 570–4. Bibcode:2006Natur.440..570S. doi:10.1038/nature04508. PMID 16467789. S2CID 4355500.; includes a detailed picture of atoms in the pump.
- ^ Zhou, Y.; Morais-Cabral, J. H.; Kaufman, A.; MacKinnon, R. (2001). «Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution». Nature. 414 (6859): 43–48. Bibcode:2001Natur.414…43Z. doi:10.1038/35102009. PMID 11689936. S2CID 205022645.
- ^ Noskov, S. Y.; Bernèche, S.; Roux, B. (2004). «Control of ion selectivity in potassium channels by electrostatic and dynamic properties of carbonyl ligands». Nature. 431 (7010): 830–4. Bibcode:2004Natur.431..830N. doi:10.1038/nature02943. PMID 15483608. S2CID 4414885.
- ^ National Academies of Sciences, Engineering and Medicine (2019). «Potassium: Dietary Reference Intakes for Adequacy». In Stallings, Virginia A; Harrison, Meghan; Oria, Maria (eds.). Dietary Reference Intakes for Sodium and Potassium. Washington, DC: The National Academies Press. doi:10.17226/25353. ISBN 978-0-309-48834-1. PMID 30844154.
- ^ Stallings, Virginia A; Harrison, Meghan; Oria, Maria, eds. (March 5, 2019). Dietary Reference Intakes for Sodium and Potassium – Publication. Health and Medicine Division. National Academies of Sciences, Engineering and Medicine. doi:10.17226/25353. ISBN 978-0-309-48834-1. PMID 30844154. S2CID 104464967. Retrieved May 13, 2019.
- ^ Panel on Dietary Reference Intakes for Electrolytes and Water, Standing Committee on the Scientific Evaluation of Dietary Reference Intakes, Food and Nutrition (2004). DRI, dietary reference intakes for water, potassium, sodium, chloride, and sulfate. Washington, D.C.: National Academies Press. ISBN 978-0-309-53049-1. Archived from the original on 2011-10-06.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Karger, S. (2004). «Energy and nutrient intake in the European Union». Annals of Nutrition and Metabolism. 48 (2 (suppl)): 1–16. doi:10.1159/000083041.
- ^ «Vitamins and minerals». National Health Service (NHS). 18 November 2021. Retrieved 13 November 2022.
- ^ «Sodium and Potassium Dietary Reference Intake Values Updated in New Report; Introduces New Category for Sodium Based on Chronic Disease Risk Reduction» (Press release). National Academies of Sciences, Engineering, and Medicine. 5 March 2019. Retrieved 29 January 2022.
- ^ National Academies of Sciences, Engineering, and Medicine; Health and Medicine Division; Food and Nutrition Board; Committee to Review the Dietary Reference Intakes for Sodium and Potassium (March 2019). Oria M, Harrison M, Stallings VA (eds.). Dietary Reference Intakes for Sodium and Potassium. National Academies Press. doi:10.17226/25353. ISBN 978-0-309-48834-1. PMID 30844154. S2CID 104464967. Bookshelf ID: NBK538102. Retrieved 13 November 2022.
- ^ «Potassium Food Charts». Asia Pacific Journal of Clinical Nutrition. Archived from the original on 2021-04-29. Retrieved 2011-05-18.
- ^ «Potassium Content of Selected Foods per Common Measure, sorted by nutrient content» (PDF). USDA National Nutrient Database for Standard Reference, Release 20. Archived from the original (PDF) on December 17, 2008.
- ^ Whelton PK, He J, Cutler JA, Brancati FL, Appel LJ, Follmann D, Klag MJ (1997). «Effects of oral potassium on blood pressure. Meta-analysis of randomized controlled clinical trials». JAMA. 277 (20): 1624–32. doi:10.1001/jama.1997.03540440058033. PMID 9168293. S2CID 25937399.
- ^ a b Institute of Medicine (U.S.). Committee on Optimization of Nutrient Composition of Military Rations for Short-Term, High-Stress Situations; Institute of Medicine (U.S.). Committee on Military Nutrition Research (2006). Nutrient composition of rations for short-term, high-intensity combat operations. National Academies Press. pp. 287–. ISBN 978-0-309-09641-6.
- ^ D’Elia, L.; Barba, G.; Cappuccio, F.; Strazzullo (2011). «Potassium Intake, Stroke, and Cardiovascular Disease: A Meta-Analysis of Prospective Studies». J Am Coll Cardiol. 57 (10): 1210–9. doi:10.1016/j.jacc.2010.09.070. PMID 21371638.
- ^ He FJ, Marciniak M, Carney C, Markandu ND, Anand V, Fraser WD, Dalton RN, Kaski JC, MacGregor GA (2010). «Effects of potassium chloride and potassium bicarbonate on endothelial function, cardiovascular risk factors, and bone turnover in mild hypertensives». Hypertension. 55 (3): 681–8. doi:10.1161/HYPERTENSIONAHA.109.147488. PMID 20083724.
- ^ «The Top 300 of 2020». ClinCalc. Retrieved 7 October 2022.
- ^ «Potassium Chloride — Drug Usage Statistics». ClinCalc. Retrieved 7 October 2022.
- ^ Shallenberger, R. S. (1993). Taste chemistry. Springer. pp. 120–. ISBN 978-0-7514-0150-9.
- ^ Garrett, Donald E. (1995-12-31). Potash: deposits, processing, properties and uses. Springer. ISBN 978-0-412-99071-7.
- ^ a b Ober, Joyce A. «Mineral Commodity Summaries 2008:Potash» (PDF). United States Geological Survey. Retrieved 2008-11-20.
- ^ a b c Ober, Joyce A. «Mineral Yearbook 2006:Potash» (PDF). United States Geological Survey. Retrieved 2008-11-20.
- ^ Wishart, David J. (2004). Encyclopedia of the Great Plains. U of Nebraska Press. p. 433. ISBN 978-0-8032-4787-1.
- ^ Chiu, Kuen-Wai (2000). «Potassium». Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. doi:10.1002/0471238961.1615200103080921.a01.pub2. ISBN 9780471238966.
- ^ Burkhardt, p. 34
- ^ Delahunt, J.; Lindeman, T. (2007). «Review of the safety of potassium and potassium oxides, including deactivation by introduction into water». Journal of Chemical Health and Safety. 14 (2): 21–32. doi:10.1016/j.jchas.2006.09.010.
- ^ Roy, Amit H. (2007). Kent and Riegel’s handbook of industrial chemistry and biotechnology. Springer. pp. 1135–57. Bibcode:2007karh.book……. ISBN 978-0-387-27843-8.
- ^ Ochoa-Hueso, R; Delgado-Baquerizo, M; King, PTA; Benham, M; Arca, V; Power, SA (2019). «Ecosystem type and resource quality are more important than global change drivers in regulating early stages of litter decomposition». Soil Biology and Biochemistry. 129: 144–152. doi:10.1016/j.soilbio.2018.11.009. S2CID 92606851.
- ^ «Potassium Uses, Side Effects & Interactions». Drugs.com.
- ^ World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR (eds.). WHO Model Formulary 2008. World Health Organization. p. 491. hdl:10665/44053. ISBN 9789241547659.
- ^ «Potassium chloride medical facts from Drugs.com». www.drugs.com. Archived from the original on 18 January 2017. Retrieved 14 January 2017.
- ^ British national formulary : BNF 69 (69 ed.). British Medical Association. 2015. pp. 680, 684. ISBN 9780857111562.
- ^ Figoni, Paula I (2010). «Bleaching and Maturing Agents». How Baking Works: Exploring the Fundamentals of Baking Science. John Wiley and Sons. p. 86. ISBN 978-0-470-39267-6.
- ^ Chichester, C. O. (July 1986). «Uses and Exposure to Sulfites in Food». Advances in food research. Academic Press. pp. 4–6. ISBN 978-0-12-016430-1.
- ^ Schultz
- ^ Toedt, John; Koza, Darrell & Cleef-Toedt, Kathleen Van (2005). «Personal Cleansing Products: Bar Soap». Chemical composition of everyday products. Greenwood Publishing Group. ISBN 978-0-313-32579-3.
- ^ Schultz, p. 95
- ^ Schultz, p. 99
- ^ Siegel, Richard S. (1940). «Ignition of the safety match». Journal of Chemical Education. 17 (11): 515. Bibcode:1940JChEd..17..515S. doi:10.1021/ed017p515.
- ^ Anger, Gerd; Halstenberg, Jost; Hochgeschwender, Klaus; Scherhag, Christoph; Korallus, Ulrich; Knopf, Herbert; Schmidt, Peter; Ohlinger, Manfred. «Chromium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Vol. 9. Weinheim: Wiley-VCH. p. 178. doi:10.1002/14356007.a07_067.
- ^ Greenwood, p. 74
- ^ Marx, Robert F. (1990). The history of underwater exploration. Courier Dover Publications. p. 93. ISBN 978-0-486-26487-5.
- ^ Gettens, Rutherford John & Stout, George Leslie (1966). Painting materials: A short encyclopaedia. Courier Dover Publications. pp. 109–110. ISBN 978-0-486-21597-6.
- ^ Modugno, G.; Benkő, C.; Hannaford, P.; Roati, G.; Inguscio, M. (1999-11-01). «Sub-Doppler laser cooling of fermionic ${}^{40}mathrm{K}$ atoms». Physical Review A. 60 (5): R3373–R3376. arXiv:cond-mat/9908102. Bibcode:1999PhRvA..60.3373M. doi:10.1103/PhysRevA.60.R3373. S2CID 119001675.
- ^ Jackson, C. B.; Werner, R. C. (1957). «Ch. 18: The Manufacture of Potassium and NaK». Handling and uses of the alkali metals. Advances in Chemistry. Vol. 19. pp. 169–173. doi:10.1021/ba-1957-0019.ch018. ISBN 978-0-8412-0020-3.
- ^ Kearey, Philip; Brooks, M & Hill, Ian (2002). «Optical Pumped Magnetometer». An introduction to geophysical exploration. Wiley-Blackwell. p. 164. ISBN 978-0-632-04929-5.
- ^ «Potassium 244856». Sigma Aldrich.
- ^ Solomon, Robert E. (2002). Fire and Life Safety Inspection Manual. Jones & Bartlett Learning. p. 459. ISBN 978-0-87765-472-8.
- ^ «DOE Handbook-Alkali Metals Sodium, Potassium, NaK, and Lithium». Hss.doe.gov. Archived from the original on 2010-09-28. Retrieved 2010-10-16.
- ^ Wray, Thomas K. «Danger: peroxidazable chemicals» (PDF). Environmental Health & Public Safety, North Carolina State University. Archived from the original on 2016-07-29.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ a b Schonwald, Seth (2004). «Potassium Chloride and Potassium Permanganate». Medical toxicology. Lippincott Williams & Wilkins. pp. 903–5. ISBN 978-0-7817-2845-4.
- ^ Markovchick, Vincent J. & Pons, Peter T. (2003). Emergency medicine secrets. Elsevier Health Sciences. p. 223. ISBN 978-1-56053-503-4.
Bibliography
- Burkhardt, Elizabeth R. (2006). «Potassium and Potassium Alloys». Ullmann’s Encyclopedia of Industrial Chemistry. Vol. A22. pp. 31–38. doi:10.1002/14356007.a22_031.pub2. ISBN 978-3-527-30673-2.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (2007). «Potassium». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. ISBN 978-3110177701.
- Schultz, H.; et al. (2006). «Potassium compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Vol. A22. pp. 39–103. doi:10.1002/14356007.a22_031.pub2. ISBN 978-3-527-30673-2.
- National Nutrient Database Archived 2014-08-10 at the Wayback Machine at USDA Website
External links
- «Potassium». Drug Information Portal. U.S. National Library of Medicine.
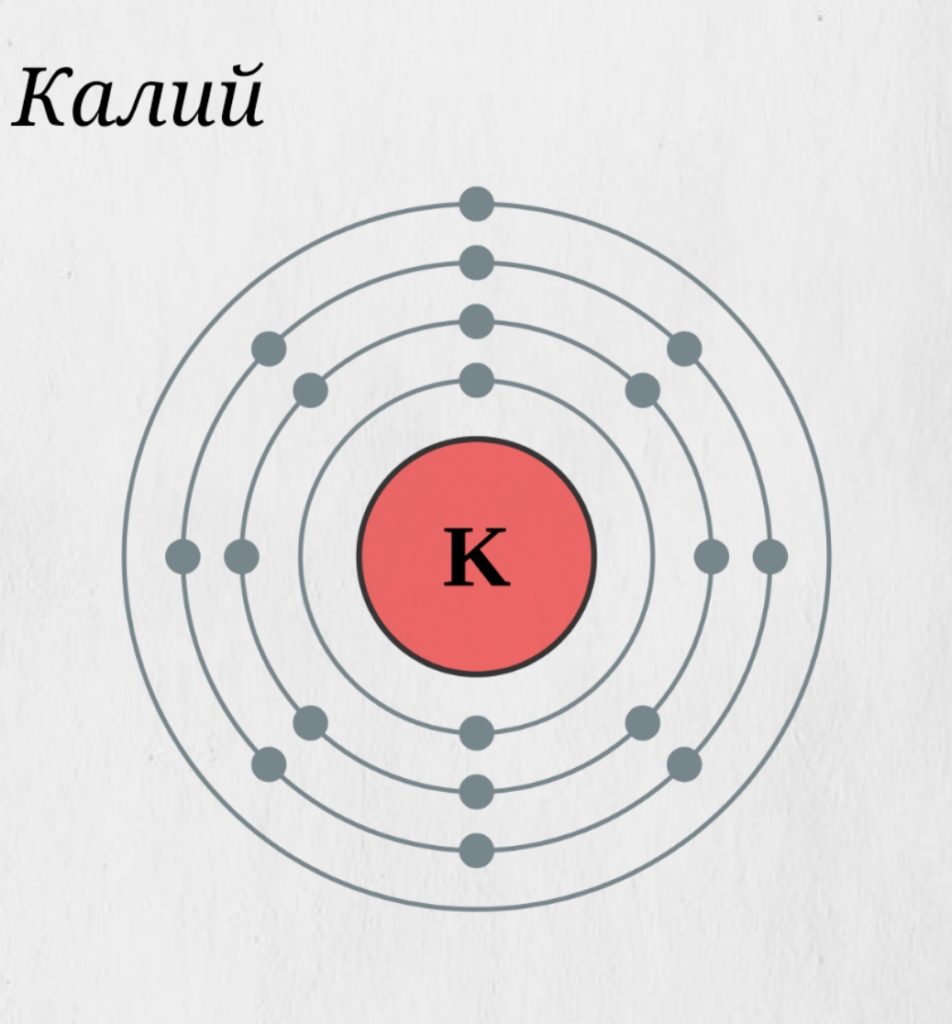
Содержание
- Как был открыт Калий;
- Где и как добывают Калий;
- Распространенность Калия;
- Применение Калия;
- Интересные факты.
Как был открыт Калий
Открытие такого химического элемента как калий принадлежит английскоиу химику Хэмфри Дэви. 19 ноября 1807 года ученый сообщил перед Королевским обществом в Лондоне, что обнаружил два новых химических элемента. Первым являлся Калий, а вторым, который был обнаружен чуть позже был Натрий. Калий Дэви получил методом электролиза из карбоната калия. Само название калий химический элемент получил из перевода слова щелочь с английского языка. На английском слово щелочь пишется как «alkali», которое в свою очередь переводится с арабского как «растения пепла». Другое название «Kalium» предложил в 1809 году немецкий химик Людвиг Вильгельм Гилберт. По итогу на сегодняшний день существует два латинских названия для этого химического элемента. В то же время «Золотая книга» из Международного союза теоретической и прикладной химии установила обозначение для калия буквой K.
Где и как добывают Калий
Такой химический элемент как калий добывается во многих местах по всему миру. Его ежегодная добыча составляет около 90 млн тонн. Лидерами по добыче калия являются Канада, Россия, США, Израиль, Германия, Казахстан и Белорусь. Этот металл добывают в большей своей части в виде минералов. К таким минералам относят карналлит, лангбейнит, полигалит и сильвин. Самые большие залежи калия предположительно находятся в канадской провинции Саскачеван. После успешной добычи калиевой руды необходимо отчистить калий от других химических элементов. От чистоты калия (в принципе как и любого элемента) будет зависеть его дальнейшая цена. Цена за 1 кг калия хорошей чистоты варьируется в районе 22 долларов США.
На сегодняшний день существует множество способов отделения калиевых солей от натрия и магния с последующим их применением. Наиболее часто используемый метод – это фракционное осаждение с использованием различий растворимости солей. Следующим по популярности идет электростатическое разделение солевой смеси из калиевых растворов. Это позволяет экономить и время и средства.
Чистый калий также добывается в больших количествах. Метод его очистки практически ничем не изменился со времен открытия Хэмфри Дэви. Метод электролиза являлся самым эффективным и распространенным в мире до 1950-х годов. Хотя некоторые предприятия используют этот метод и по сей день. С 1950-х годов популярность захватил метод термической реакции натрия с хлоридом калия. Сегодня этот метод является самым популярным.
Распространенность Калия
Калий является довольно распространенным химическим элементом. Он занимает 20 место по распространенности среди других элементов в нашей солнечной системе и 17 место по массе на Земле. В тоже время он замыкает топ-7 элементов по массе в земной коре. Его процентное отношение к общей массе земной коры составляет около 2,6% по оценкам ученых.
Известно, что калий образуется в сверхновых звездах в результате нуклеосинтеза из более легких атомов. Так же калий образуется в сверхновых типа II в результате взрывного процесса сжигания кислорода и в результате горения неона. Что же касается Земли, то калий встречается сдесь только в виде катиона в соединениях калия. Это связано с тем, что он имеет только один внешний электрон и очень легко его высвобождает. Калий входит в состав очень многих минеральных пород. Самыми важными из них являются сильвин, сильвинит, карналлит, каинит, счелит, полигалит, ортоклаз и мусковит. Так же не нужно забывать про морскую и океаничечкую воду как источник калия. Содержание в морской воде калия ориентировочно находится в соотношении 27 частей на тысячу. В подтверждение стоит отметить, что у одного из крупнейших добытчиков калия (Израиль) источником добычи является Мертвое море.
Применение Калия
Применение калия является очень неоднозначным. С одной стороны калий добывается относительно в очень больших количествах. С другой стороны 95% добытого калия отправляется для переработки в различного рода удобрения. Оставшиеся 5% добытого калия распределяется в разных частях на такие отрасли как медицина, пищевая промышленность, военная и химическая промышленность. Ионы калия являются важным компонентом питания растений и встречаются почти во всех видах почв.
Стоит заметить, что 90% от общего количества калия выделяемого для производства удобрений поступает в виде соединения KCl. В медицине это же соединение используется для лечения недостатка калия в организме человека. Оно применяется в виде внутривенной инъекции или орально в виде таблеток.
В пищевой промышленности калий применяется исключительно в виде разлличного рода пищевых добавок. В пример можно привести тартрат калий-натрия, который является основополагающим компонентом разрыхлителей. Бромат калия выступает в качестве сильного окислителя. Его пищевая нуменклатура — Е924, и используется в основном для увеличения прочности теста и регуляции величины его подъема. Калий используется также при добыче драгоценных металлов, таких как золото и серебро. Его химические соединения используются и военной промышленности. Так к примеру супероксид калия KO2 используется в качестве портативного источника кислорода и поглотителя диоксида углерода. В основном это системы вентиляции шахт, бункеры, а также системы жизнеоьеспечения подводных лодок и космических кораблей.
Интересные факты
Интересных фактов связанных с калием достаточно много. Стоит начать с того, что калий играет огромнейшую роль в организме человека. Его недостаток может вызывать огромное количество проблем со здоровьем у человека. Он оказывает влияние на тонус сосудов, артериальное давление, секрецию гормонов, желудочно-кишечную моторику, метаболизм глюкозы и инсулина, а также почечную концентрирующую способность. Калий в чистом виде является очень взрывоопасным веществом. Взрыв может произойти от малейшей царапины и его очень трудно потом потушить.
Еще одним интересным фактом является то, что цианистый калий используется спецслужбами(информация не подтвержденаа). Вероятно, на сегодняшний день, каждый видел фильм с иностранными разведчиками, которые в случае попадания в плен раскалывают зубами ампулу с цианистым калией и мгновенно умирают. В этом есть доля истины. Ведь цианистый калий является сильнейшим неорганическим ядом. И смертельная доза его составляет 1.7 мг/кг веса. Только принцип его действия основывается не на разъедании половины челюсти как в фильмах, а на неспособности усваивать клетками организма кислорода. И неизвестно конечно через какое время наступает смерть и возможно ли спасти человека после приема смертельной ампулы. То есть человек просто задыхается. Еще одним интересным фактом является то, что при определенном экстремальном давлении из твердого металлического калия начинает вытекать жидкая составляющая калия.
История калия
Калий был открыт осенью 1807 года английским химиком Дэви при электролизе твёрдого едкого кали. Увлажнив едкий кали, ученый выделил металл, которому дал название потассий, намекая на производство поташа (необходимого ингредиента для изготовления моющих средств) из золы. Своё привычное название металл получил через два года, в 1809г, инициатором переименования вещества стал Л.В. Гильберт, предложивший название калий (от арабского аль-кали – поташ).
Общая характеристика калия
Калий (лат. Kalium) является мягким щелочным металлом, элементом главной подгруппы I группы, IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 19 и обозначение – К.
Нахождение в природе
Калий в свободном состоянии в природе не встречается, он входит в состав всех клеток. Достаточно распространённый металл, занимает 7-е место по содержанию в земной коре (calorizator). Основными поставщиками калия являются Канада, Белоруссия и Россия, имеющие крупные месторождения данного вещества.
Физические и химические свойства
Калий – легкоплавкий металл серебристо-белого цвета. Имеет свойство окрашивать открытый огонь в яркий фиолетово-розовый цвет.
Калий имеет высокую химическую активность, это сильный восстановитель. При реакции с водой происходит взрыв, при длительном нахождении на воздухе полностью разрушается. Поэтому калий требует определённых условий для хранения – его заливают слоем керосина, силикона или бензина, для исключения вредных для металла контактов с водой и атмосферой.
Продукты питания богатые калием
Основными пищевыми источниками калия являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград, все зелёные овощи с листьями, листья мяты, семечки подсолнуха. Калия достаточно много в рыбе и молочных продуктах. Вообще, калий входит в состав почти всех растений. Яблочный уксус и мёд – чемпионы по содержанию калия.
Суточная потребность в калии
Суточная потребность организма человека в калии зависит от возраста, физического состояния и даже места проживания. Взрослым здоровым людям нужно 2,5г калия, беременным женщинам – 3,5г, спортсменам – до 5-ти грамм калия ежедневно. Количество необходимого калия для подростков рассчитывается по весу – 20 мг калия на 1 кг массы тела.
Полезные свойства калия и его влияние на организм
Калий вместе с натрием регулирует водный баланс в организме и нормализует ритм сердца, поддерживает концентрацию и физиологические функций магния.
Калий участвует в процессе проведения нервных импульсов и передачи их на иннервируемые органы. Способствует лучшей деятельности головного мозга, улучшая снабжение его кислородом. Оказывает положительное влияние при многих аллергических состояниях. Калий необходим для осуществления сокращений скелетных мышц. Калий регулирует содержание в организме солей, щелочей и кислот, чем способствует уменьшению отёков.
Калий содержится во всех внутриклеточных жидкостях, он необходим для нормальной жизнедеятельности мягких тканей (мышц, сосудов и капилляров, желез внутренней секреции и т.д.)
Усвояемость калия
Калий всасывается в организм из кишечника, куда поступает с пищей, выводится с мочой обычно в таком же количестве. Излишний калий выводится из организма тем же путём, не задерживается и не накапливается. Препятствиями для нормального всасывания калия могут послужить чрезмерное употребление кофе, сахара, алкоголя.
Взаимодействие с другими
Калий работает в тесном контакте с натрием и магнием, при росте концентрации калия из организма стремительно выводится натрий, а уменьшение количества магния может нарушить усвоение калия.
Признаки нехватки калия
Нехватка калия в организме характеризуется мышечной слабостью, быстрой утомляемостью, снижением иммунитета, сбоями в работе миокарда, нарушениями показателей артериального давления, учащённым и затруднённым дыханием. Кожные покровы могут шелушиться, повреждения плохо заживают, волосы становятся очень сухими и ломкими. Происходят сбои в работе желудочно-кишечного тракта – тошнота, рвота, расстройства желудка вплоть до гастрита и язвы.
Признаки избытка калия
Переизбыток калия наступает при передозировке препаратов, содержащих калий и характеризуется нервно-мышечными расстройствами, повышенной потливостью, возбудимостью, раздражительностью и плаксивостью. Человек постоянно испытывает чувство жажды, которое приводит к частым мочеиспусканиям. Желудочно-кишечный тракт реагирует кишечными коликами, чередованием запоров и поносов.
Применение калия в жизни
Калий в виде основных соединений находит широкое применение в медицине, сельском хозяйстве и промышленности. Калийные удобрения необходимы для нормального роста и вызревания растений, а всем известная марганцовка, это не что иное, как перманганат калия, испытанный временем антисептик.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
(от араб. аль-кали — поташ; лат. Kalium) К, хим. элемент I гр. периодич. системы; относится к щелочным металлам, ат. н. 19, ат. м. 39,0983. Состоит из двух стабильных изотопов 39 К (93,259%) и 41 К (6,729%), а также радиоактивного изотопа 40 К (Т 1/2 1,32.109 лет). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 1,97.10—28 м 2. Конфигурация внеш. электронной оболочки 4s1; степень окисления +1; энергия ионизации К 0 : К + : К 2+ соотв. 4,34070 эВ и 31,8196 эВ; сродство к электрону 0,47 эВ; электроотрицательность по Полингу 0,8; атомный радиус 0,2313 нм, ионный радиус (в скобках указано координац. число) К + 0,151 нм (4), 0,152 нм (6), 0,160 нм (7), 0,165 нм (8), 0,178 нм (12). Содержание в земной коре 2,41% по массе. Осн. минералы: сильвин КСl, карналлит KCl.MgCl2.6H2O, калиевый полевой шпат (ортоклаз) K[AlSi3O8], мусковит калиевая слюда) KAl2[AlSi3O10](OH, F)2, каинит КСl.MgSO4.3H2O, полигалит K2SO4.MgSO4.2CaSO4.2Н 2 О, алунит KAl3(SO4)2(OH)6.
Свойства. К. — мягкий серебристо-белый металл с кубич. решеткой, а =0,5344 нм, z =2, пространств. группа Im3m. Т. пл. 63,51 °С, т. кип. 761 °С; плотн. 0,8629 г/см 3; С 0p 29,60 Дж/(моль. К); DH0 пл 2,33 кДж/моль, DH0 возг 89,0 кДж/моль; S029864,68 Дж/(моль. К); ур-ние температурной зависимости давления пара (в мм рт. ст.): lgp =7,34 — 4507/T(373-474 К); r 6,23.10-8 Ом. м (0°С), 8,71.10—8 Ом. м (25°C) и 13,38.10-8 Ом. м (77°С); g 0,114 Н/м (334 К), h 5,096.10—4 Н. с/м 2 (350 К); теплопроводность 99,3 Вт/(м. К) при 273 К и 44,9 Вт/(м. К) при 473 К; при 273-323 К температурные коэф. линейного и объемного расширения составляют соотв. 8,33.10—5 К —1 и 2,498.10—4 К —1. К. может обрабатываться прессованием и прокаткой. К. химически очень активен. Легко взаимод. с О 2 воздуха, образуя калия оксид К 2 О, пероксид К 2 О 2 и надпероксид КО 2; при нагр. на воздухе загорается. С водой и разб. к-тами взаимод. со взрывом и воспламенением, причем H2SO4 восстанавливается до S2—, S0 и SO2, а НNО 3 — до NO, N2O и N2. При нагр. до 200-350 °С реагирует с Н 2 с образованием гидрида КН. Воспламеняется в атмосфере F2, слабо взаимод. с жидким Сl2, но взрывается при соприкосновении с Вr2 и растирании с I2; при контакте с межгалогенными соед. воспламеняется или взрывается. С S, Se и Те при слабом нагревании образует соотв. K2S, K2Se и К 2 Те, при нагр. с Р в атмосфере азота — К 3 Р и К 2 Р 5, с графитом при 250-500 °С — слоистые соед. состава С 8 К-С 60 К. С СО 2 не реагирует заметно при 10-30°С; стекло и платину разрушает выше 350-400 °С. К. раств. в жидком NH3 (35,9 г в 100 мл при — 70 °С), анилине, этилендиамине, ТГФ и диглиме с образованием р-ров с металлич. проводимостью. Р-р в NH3 имеет темно-синий цвет, в присут. Pt и следов воды разлагается, давая KNH2 и Н 2. С азотом К. не взаимод. даже под давлением при высоких т-рах. При взаимод. с NH4N3 в жидком NH3 образуется азид KN3. К. не раств. в жидких Li, Mg, Cd, Zn, Al и Ga и не реагирует с ними. С натрием образует интерметаллид KNa2 (плавится инконгруэнтно при 7°С), с рубидием и цезием -твердые р-ры, для к-рых миним. т-ры плавления составляют соотв. 32,8 °С (81,4% по массе Rb) и — 37,5 °С (77,3% Cs). С ртутью дает амальгаму, содержащую два меркурида -KHg2 и KHg (т. пл. соотв. 270 °С и 180°С). С таллием образует КТl (т. пл. 335 °С), с оловом — K2Sn, KSn, KSn2 и KSn4, со свинцом — КРb (т. пл. 568 °С) и фазы состава К 2 Рb3, КРb2 и КРb4, с сурьмой — К 3Sb и KSb (т. пл. соотв. 812 и 605 °С), с висмутом — K3Bi, K3Bi2 и KBi2 (т. пл. соотв. 671, 420 и 553 °C). К. энергично взаимод. с оксидами азота, а при высоких т-рах — с СО и СО 2. Восстанавливает В 2 О 3 и SiO2 соотв. до В и Si, оксиды Al, Hg, Ag, Ni и др. — до своб. металлов, сульфаты, сульфиты, нитраты, нитриты, карбонаты и фосфаты металлов — до оксидов или своб. металлов. Со спиртами К. образует алкоголяты, с галогеналкилами и галогенарилами — соотв. калийалкилы и калийарилы. Важнейшим соед. К. посвящены отд. статьи (см., напр., Калия гидроксид, Калия иодид, Калия карбонат, Калия хлорид). Ниже приводятся сведения о др. важных соединениях. Пероксид К 2 О 2 — бесцв. кристаллы с ромбич. решеткой ( а =0,6736 нм, b= 0,7001 нм, с =0,6479 нм, z = 4, пространств. группа Рппп); т. пл. 545 °С; плотн. 2,40 г/см 3; C0p 90,8 Дж/(моль. К); DH0 пл 20,5 кДж/моль, DH0 обр -443,0 кДж/моль; S0298 117 Дж/(моль. К). На воздухе К 2 О 2 мгновенно окисляется до КО 2; энергично взаимод. с водой с образованием КОН и О 2, с СО 2 дает К 2 СО 3 и О 2. Получают пероксид пропусканием дозированного кол-ва О 2 через р-р К. в жидком NH3, разложением КО 2 в вакууме при 340-350 °С. Надпероксид КО 2 — желтые кристаллы с тетрагон. решеткой ( а Ч0,5704 нм, с Ч0,6699 нм, z = 4, пространств. группа I4/mmm; плотн. 2,158 г/см 3); выше 149°С переходит в кубич. модификацию (а= 0,609 нм); т. пл. 535 °С; С 0p 77,5 Дж/(моль. К);
DH0 обр — 283,2 кДж/моль, DH0 пл 20,6 кДж/моль; S0298 125,4 Дж/(моль. К); парамагнетик. Сильный окислитель. Взаимод. с водой с образованием КОН и О 2. Диссоциирует, напр., в бензоле, давая анион-радикал О 2—. Сера при нагр. с КО 2 воспламеняется и дает K2SO4. С влажными СО 2 и СО надпероксид образует К 2 СО 3 и О 2, с NO2 — KNO3 и О 2, с SO2 — K2SO4 и О 2. При действии конц. H2SO4 выделяется О 3, при р-ции с NH3 образуются N2, H2O и КОН. Смесь КО 2 с графитом взрывает. Получают надпероксид сжиганием К. в воздухе, обогащенном влажным О 2 и нагретом до 75-80 °С. Озонид КО 3 — красные кристаллы с тетрагон. решеткой ( а =0,8597 нм, с= 0,7080 нм, пространств. группа I4/mcm); плотн. 1,99 г/см 3; устойчив только при хранении в герметически закрытых сосудах ниже 0°С, при более высокой т-ре распадается на КО 2 и О 2; С 0p >75 Дж/(моль. К); S0298 105 Дж/(моль. К); парамагнетик. Р-римость в жидком NH3 (г в 100 г); 14,82 (-35°С), 12,00 (-63,5°С), эвтектика NH3 — KO3 (5 г в 100 г NH3) имеет т. пл. — 80 °С; при длит. хранении аммиачные р-ры разлагаются на NH4O3 и KNH2. Раств. в фреонах. КО 3 — сильный окислитель; мгновенно реагирует с водой уже при 0 °С, давая КОН и О 2; с влажным СО 2 образует К 2 СО 3 и КНСО 3. Получают: взаимод. смеси О 3 и О 2 с КОН или КО 2 при т-ре ниже 0°С с послед. экстракцией жидким NH3; озонированием суспензии КО 2 или КОН во фреоне 12. Надпероксид, пероксид и озонид К. — компоненты составов для регенерации воздуха в замкнутых системах (шахты, подводные лодки, космич. корабли). Гидрид КН — бесцв. кристаллы с кубич. решеткой ( а =0,570 нм, z = 4, пространств. группа Fm3m); т. пл. 619 °С при давлении водорода 6,86 МПа; плотн. 1,52 г/см 3; С 0p38,1 Дж/(моль. К); DH0 обр -57,8 кДж/моль, DH0 пл 21,3 кДж/моль; S0298 50,2 Дж/(моль. К). Разлагается при нагр. на К. и Н 2. Сильный восстановитель. Воспламеняется во влажном воздухе, в среде F2 и Сl2. Энергично взаимод. с водой, давая КОН и Н 2. При нагр. с N2 или NH3 образует KNH2, с H2S — K2S и Н 2, с расплавл. серой — K2S и H2S, с влажным СO2 — НСООК, с СО — НСООК и С. Получают КН взаимод. К. с избытком Н 2 при 300-400 °С. Гидрид восстановитель в неорг. и орг. синтезах. Азид КN3 — бесцв. кристаллы с тетрагон. решеткой (а= 0,6094 нм, с= 0,7056 нм, z = 4, пространств. группа I4/mcm); С 0 р >76,9 Дж/(моль. К); DH0 обр -1,7 кДж/моль; S0298 104,0 Дж/(моль. К); т. пл. 354 °С, выше разлагается на К. и азот; плотн. 2,056 г/см 3. Р-римость (г в 100 г р-рителя): вода -41,4 (0°С), 105,7 (100°С), этанол — 0,137 (16°С). В эфире и бензоле раств. плохо. Водой гидролизуется; эвтектика Н 2 О -KN3 (35,5 г в 100 г) имеет т. пл. — 12°С. Получают: взаимод. N2O с расплавл. KNH2 при 280 °С; действием КОН на р-р HN3.
Получение. К. производят взаимод. Na с КОН при 380-450 °С или КСl при 760-890 °С. Р-ции проводят в атмосфере N2. Взаимод. КОН с жидким Na осуществляют противотоком в тарельчатой колонне из Ni. При р-ции с КСl пары Na пропускают через расплав КСl. Продукт р-ций -сплав К — Na. Его подвергают ректификации и получают К. с содержанием примесей (в % по массе): 1.10—3 Na и 1.10—4 С1. Кроме того, К. получают: вакуум-термич. восстановлением КСl карбидом СаС 2, сплавами Si-Fe или Si-Al при 850-950 °С и остаточном давлении 1,33 13,3 Па; нагреванием К 2 Сr2 О 7 с Zr при 400 °С; электролизом КОН с железным катодом; электролизом КСl (или его смеси К 2 СО 3) с жидким свинцовым катодом при 680-720 °С с послед. разделением К и Рb вакуумной дистилляцией; электролизом 50%-ного р-ра KNH2 в жидком NH3 при 25 °С и давлении 0,75 МПа с амальгамой К. в качестве анода и катодом из нержавеющей стали, при этом образуется 30%-ный р-р К. в жидком NH3, к-рый выводится из аппарата для отделения К.
Определение. Качественно К. обнаруживают по розово-фиолетовому окрашиванию пламени и по характерным лииниям спектра: 404,41, 404,72, 766,49, 769,90 нм. Наиб. распространенные количеств. методы, особенно в присут. др. щелочных металлов, — эмиссионная пламенная фотометрия (чувствительность 1.10—4 мкг/мл) и атомно-абсорбц. спектрометрия (чувствительность 0,01 мкг/мл). В меньшей степени используются химико-спектральный и спектрофотометрич. методы с применением дипикриламина (чувствительность 0,2-1,0 мкг/мл). При большом содержании К. в пробе применяют гравиметрич. метод с осаждением К. в виде тетрафенилбората, K2[PtCl6] или КСlO4 в среде бутанола.
Применение. К. — материал электродов в хим. источниках тока; компонент катодов-эмиттеров фотоэлементов и термоэмиссионных преобразователей, а также фотоэлектронных умножителей; геттер в вакуумных радиолампах; активатор катодов газоразрядных устройств. Сплав К. с Na -теплоноситель в ядерных реакторах. Радиоактивный изотоп 40 К служит для определения возраста горных пород (калийаргоновый метод). Искусств. изотоп 42 К (T1/2 12,52 года) -радиоактивный индикатор в медицине и биологии. К. — важнейший элемент (в виде соед.) для питания растений (см. Калийные удобрения). К. вызывает сильные ожоги кожи, при попадании мельчайших его крошек в глаза тяжело их поражает, возможна потеря зрения. Загоревшийся К. заливают минер. маслом или засыпают смесью талька и NaCl. Хранят К. в герметически закрытых железных коробках под слоем обезвоженного керосина или минер. масла. Отходы К. утилизируют обработкой их сухим этанолом или пропанолом с послед. разложением образовавшихся алкоголятов водой. К. открыл Г. Дэви в 1807. Лит.: Натрий и калий, Л., 1959; Коренман И. М., Аналитическая химия калия, М., 1964; Теплофизическиe свойства щелочных металлов, М., 1970, (Тр. МЭИ, в. 75); Вольнов И. И., Перекисные соединения щелочных металлов, М., 1980. Б. Д. Степин.
Химическая энциклопедия. — М.: Советская энциклопедия.
.
1988.
Глоссарий. Химия
Калий
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K+ + e— → K
2Cl— − 2e— → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH— − 4e— → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Источник: Википедия
Другие заметки по химии




















