From Wikipedia, the free encyclopedia
| Names | |
|---|---|
| IUPAC name
Dialuminium Tricarbonate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.034.930 |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Al2(CO3)3 |
| Appearance | white powder, unstable |
| Density | 1.5 g/cm3 |
| Melting point | 58 °C |
| Boiling point | decomposes |
|
Solubility in water |
reacts |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium carbonate (Al2(CO3)3), is a carbonate of aluminium. It is not well characterized; one authority says that simple carbonates of aluminium are not known.[1] However related compounds are known, such as the basic sodium aluminium carbonate mineral dawsonite (NaAlCO3(OH)2) and hydrated basic aluminium carbonate minerals scarbroite (Al5(CO3)(OH)13•5(H2O)) and hydroscarbroite (Al14(CO3)3(OH)36•nH2O).[2][3][4]
Preparation[edit]
There is no evidence that aluminium carbonate is formed in double displacement reactions; soluble carbonates are sufficiently alkaline to precipitate aluminium hydroxide and produce carbon dioxide.[5]
Although aluminium carbonate is highly unstable, carbonate species readily form on the surface of aluminium oxide when exposed to CO2.[6]
Uses[edit]
Aluminium carbonate, along with aluminium hydroxide and aluminium oxide, is a phosphate-binding drug that is sometimes administered to dogs and cats to bind intestinal phosphate and prevent the absorption of dietary phosphate as well as to decrease absorption of phosphate excreted by the pancreas. It is seldom used in humans because of concerns with toxicity, but cats and dogs do not appear to have a toxic response to its presence.[7]
The reaction of aluminium sulfate and sodium bicarbonate forms carbon dioxide and aluminium hydroxide which stabilises the formation of a foam.[5] This reaction was the basis of an early fire extinguisher invented by Aleksandr Loran in 1904.
References[edit]
- ^ Anthony John Downs, (1993), Chemistry of Aluminium, Gallium, Indium, and Thallium, Springer, ISBN 978-0-7514-0103-5
- ^ «Scarbroite». www.mindat.org.
- ^ «Hydroscarbroite». www.mindat.org.
- ^ «Dawsonite». www.mindat.org. Retrieved 2020-12-14.
- ^ a b Moody, Bernard (2013). Comparative Inorganic Chemistry. Elsevier. p. 311. ISBN 9781483280080.
- ^ Parkyns, N. D. (1969-01-01). «The surface properties of metal oxides. Part II. An infrared study of the adsorption of carbon dioxide on γ-alumina». Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 410–417. doi:10.1039/J19690000410. ISSN 0022-4944.
- ^ Deborah Silverstein; Kate Hopper (13 February 2008). Small Animal Critical Care Medicine — E-Book. Elsevier Health Sciences. p. 5. ISBN 978-1-4160-6926-3.
From Wikipedia, the free encyclopedia
| Names | |
|---|---|
| IUPAC name
Dialuminium Tricarbonate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.034.930 |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Al2(CO3)3 |
| Appearance | white powder, unstable |
| Density | 1.5 g/cm3 |
| Melting point | 58 °C |
| Boiling point | decomposes |
|
Solubility in water |
reacts |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium carbonate (Al2(CO3)3), is a carbonate of aluminium. It is not well characterized; one authority says that simple carbonates of aluminium are not known.[1] However related compounds are known, such as the basic sodium aluminium carbonate mineral dawsonite (NaAlCO3(OH)2) and hydrated basic aluminium carbonate minerals scarbroite (Al5(CO3)(OH)13•5(H2O)) and hydroscarbroite (Al14(CO3)3(OH)36•nH2O).[2][3][4]
Preparation[edit]
There is no evidence that aluminium carbonate is formed in double displacement reactions; soluble carbonates are sufficiently alkaline to precipitate aluminium hydroxide and produce carbon dioxide.[5]
Although aluminium carbonate is highly unstable, carbonate species readily form on the surface of aluminium oxide when exposed to CO2.[6]
Uses[edit]
Aluminium carbonate, along with aluminium hydroxide and aluminium oxide, is a phosphate-binding drug that is sometimes administered to dogs and cats to bind intestinal phosphate and prevent the absorption of dietary phosphate as well as to decrease absorption of phosphate excreted by the pancreas. It is seldom used in humans because of concerns with toxicity, but cats and dogs do not appear to have a toxic response to its presence.[7]
The reaction of aluminium sulfate and sodium bicarbonate forms carbon dioxide and aluminium hydroxide which stabilises the formation of a foam.[5] This reaction was the basis of an early fire extinguisher invented by Aleksandr Loran in 1904.
References[edit]
- ^ Anthony John Downs, (1993), Chemistry of Aluminium, Gallium, Indium, and Thallium, Springer, ISBN 978-0-7514-0103-5
- ^ «Scarbroite». www.mindat.org.
- ^ «Hydroscarbroite». www.mindat.org.
- ^ «Dawsonite». www.mindat.org. Retrieved 2020-12-14.
- ^ a b Moody, Bernard (2013). Comparative Inorganic Chemistry. Elsevier. p. 311. ISBN 9781483280080.
- ^ Parkyns, N. D. (1969-01-01). «The surface properties of metal oxides. Part II. An infrared study of the adsorption of carbon dioxide on γ-alumina». Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 410–417. doi:10.1039/J19690000410. ISSN 0022-4944.
- ^ Deborah Silverstein; Kate Hopper (13 February 2008). Small Animal Critical Care Medicine — E-Book. Elsevier Health Sciences. p. 5. ISBN 978-1-4160-6926-3.
Морфемный разбор слова:
Однокоренные слова к слову:
Карбонат алюминия: строение, свойства, применение
Содержание:
В карбонат алюминия представляет собой неорганическую соль, химическая формула которой Al2(CO3)3. Это карбонат металла практически не существует из-за его высокой нестабильности при нормальных условиях.
Соль не испытывает никаких неудобств на бумаге, когда записываются химические уравнения ее реакций; но на практике это работает против него.
Несмотря на сказанное, карбонат алюминия может встречаться вместе с другими ионами, такими как минерал даусонит. Точно так же есть производное, в котором он взаимодействует с водным раствором аммиака. В остальном это считается смесью Al (OH)3 и H2CO3; который представляет собой шипучий раствор с белым осадком.
Эта смесь имеет лечебное применение. Однако чистая, выделяемая и поддающаяся обработке соль Al2(CO3)3, не известно возможных приложений; по крайней мере, не в условиях огромного давления или экстремальных условий.
Структура карбоната алюминия
Кристаллическая структура этой соли неизвестна, поскольку она настолько нестабильна, что не может быть охарактеризована. Из его формулы Al2(CO3)3Однако известно, что доля ионов Al 3+ и CO3 2- 2: 3; то есть для каждых двух катионов Al 2+ должно быть три аниона CO3 2- электростатически взаимодействуя с ними.
Проблема в том, что оба иона очень неравны по размеру; Аль 3+ очень мало, а CO3 2- это громоздко. Это различие само по себе уже влияет на стабильность кристаллической решетки, ионы которой «неудобно» взаимодействовали бы, если бы эту соль можно было изолировать в твердом состоянии.
Следовательно, ионные взаимодействия между Al 3+ и CO3 2- они склонны к ковалентности; еще один фактор, усиливающий нестабильность Al2(CO3)3.
Карбонат гидроксида аммония алюминия
Хотя NH4Al (ОН)2CO3 (AACC, аббревиатура на английском языке), ни NaAlCO3(ОЙ)2 представляют собой карбонат алюминия, их можно рассматривать как его основные производные.
Свойства
Молярная масса
Нестабильность
В предыдущем разделе с молекулярной точки зрения было объяснено, почему Al2(CO3)3 это нестабильно. Но какую трансформацию он претерпевает? Следует учитывать две ситуации: сухую и «мокрую».
Сухой
В сухой ситуации анион CO3 2- возвращается в СО2 используя следующую декомпозицию:
Что имеет смысл, если он синтезируется под высоким давлением CO.2; то есть обратная реакция:
Следовательно, чтобы предотвратить Al2(CO3)3 соль следует подвергнуть воздействию высокого давления (используя N2, например). Таким образом, образование CO2 это не было бы термодинамически благоприятным.
Мокрый
В условиях повышенной влажности CO3 2- подвергается гидролизу, в результате чего образуется небольшое количество ОН – ; но достаточно, чтобы осадить гидроксид алюминия, Al (OH)3:
А с другой стороны, Аль 3+ также гидролизует:
Обратите внимание, что в итоге Al 3+ ведет себя как кислота (выделяет H + ) и база (выпускает OH – с балансом растворимости Al (OH)3); то есть проявляет амфотеризм.
Физический
Что касается его растворимости, он бесконечно растворим в воде. Кроме того, это будет гигроскопичное и расплывающееся твердое вещество. Однако это лишь догадки. Другие свойства должны быть оценены с помощью компьютерных моделей, подвергнутых воздействию высоких давлений.
Приложения
Он использовался для контроля увеличения содержания фосфатов в организме, а также для лечения симптомов изжоги, кислотного расстройства желудка и язвы желудка.
Источник
Тренажер задания 31 по химии алюминия
Тренажер задания 31 из ЕГЭ по химии алюминия, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии алюминия с текстовыми решениями и ответами.
1. В раствор, полученный при взаимодействии алюминия с разбавленной серной кислотой, по каплям добавили раствор гидроксида натрия до образования осадка. Выпавший осадок белого цвета отфильтровали и прокалили. Полученное вещество сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
2. К раствору сульфата алюминия добавили избыток гидроксида натрия. В полученный раствор небольшими порциями прибавили соляную кислоту, при этом наблюдали образование объемного осадка белого цвета, который растворился при дальнейшем прибавлении кислоты. В образовавшийся раствор прилили раствор карбоната натрия. Напишите уравнения описанных реакций.
3. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, пропустили через раствор тетрагидроксоалюмината натрия. Образовавшийся осадок отфильтровали, прокалили, и твердый остаток обработали соляной кислотой. Напишите уравнения описанных реакций.
4. Твердое вещество, образовавшееся при взаимодействии сернистого газа и сероводорода, при нагревании взаимодействует с алюминием. Продукт реакции растворили в разбавленной серной кислоте и в образовавшийся раствор добавили поташ. Напишите уравнения описанных реакций.
5. Продукт взаимодействия серы с алюминием (реакция протекает при нагревании) растворили в холодной разбавленной серной кислоте и в раствор добавили карбонат калия. Образовавшийся осадок отделили, смешали с едким натром и нагрели. Напишите уравнения описанных реакций.
6. К раствору кальцинированной соды добавили раствор хлорида алюминия, выделившееся вещество отделили и внесли в раствор едкого натра. В образовавшийся раствор по каплям прибавляли раствор хлороводородной кислоты до прекращения образования осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
7. Нитрат алюминия прокалили, продукт реакции смешали с кальцинированной содой и нагрели до плавления. Образовавшееся вещество растворили в азотной кислоте и полученный раствор нейтрализовали раствором аммиака, при этом наблюдали выделение объемного студенистого осадка. Напишите уравнения описанных реакций.
8. Осадок, полученный при добавлении в раствор сульфата алюминия каустической соды, отделили, прокалили, смешали с кальцинированной содой и нагрели до плавления. После обработки остатка серной кислотой была получена исходная соль алюминия. Напишите уравнения описанных реакций.
9. В раствор кристаллической соды добавили хлорид алюминия, выделившийся осадок отделили и обработали раствором едкого натра. Полученный раствор нейтрализовали азотной кислотой, выделившийся осадок отделили и прокалили. Напишите уравнения описанных реакций.
10. Осадок, полученный при взаимодействии раствора соли алюминия и щелочи, прокали-ли. Продукт реакции растворили в концентрированном горячем растворе щелочи. Через полученный раствор пропустили углекислый газ, в результате чего образовался осадок. Напишите уравнения описанных реакций.
11. Вещество, которое образуется при электролизе расплава боксита в криолите, растворяется как в растворе соляной кислоты, так и в растворе щелочи с выделением одного и того же газа. При смешивании полученных растворов образуется объемный осадок белого цвета. Напишите уравнения описанных реакций.
12. Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделилось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили. Фильтрат упарили, полученный твердый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь. Напишите уравнения описанных реакций
13. Оксид алюминия сплавили с карбонатом натрия, полученное твердое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия. Напишите уравнения описанных реакций.
HBr + NaOH = NaBr + H2O
14. Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода. Напишите уравнения описанных реакций.
15. Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твердому веществу добавили избыток раствора соляной кислоты. Напишите уравнения описанных реакций.
16. Газ, выделившийся при взаимодействии хлористого водорода с бертолетовой молью, внесли в реакцию с алюминием. Продукт реакции растворили в воде и добавили гидроксид натрия до прекращения выделения осадка, который отделили и прокалили. Напишите уравнения описанных реакций.
17. Газ, выделившийся при нагревании раствора хлористого водорода с оксидом марганца (IV), внесли во взаимодействие с алюминием. Продукт реакции растворили в воде и добавили сначала избыток раствора гидроксида натрия, а затем соляную кислоту. Напишите уравнения описанных реакций.
18. Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили, и полученный продукт сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
19) Оксид алюминия сплавили с содой. Полученный продукт растворили в соляной кислоте и обработали избытком аммиачной воды. Выпавший осадок растворили в избытке раствора гидроксида калия. Напишите уравнения описанных реакций.
20) Оксид алюминия сплавили с гидроксидом натрия. Продукт реакции внесли в раствор хлорида аммония. Выделившийся газ с резким запахом поглощен серной кислотой. Образовавшуюся среднюю соль прокалили. Напишите уравнения описанных реакций.
21) Порошок алюминия нагрели с порошком серы, полученное вещество обработали водой. выделившийся при этом осадок обработали избытком раствора гидроксида калия до его полного растворения. К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка. Напишите уравнения описанных реакций.
Al(OH)3 + KOH = K[Al(OH)4] допустимо образование K3[Al(OH)6]
22) Осадок, полученный при взаимодействии растворов сульфата алюминия и нитрата бария, отфильтровали. Фильтрат обработали едким натром в мольном соотношении 1 : 3. Выпавший осадок отделили и прокалили. Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
23) При взаимодействии раствора сульфата алюминия с раствором сульфида калия выделился газ, который пропустили через раствор гексагидроксоалюмината калия. Образовавшийся осадок отфильтровали, промыли, просушили и нагрели. Твердый остаток сплавили с едким натром. Напишите уравнения описанных реакций.
24) Алюминиевый порошок смешали с серой и нагрели. Полученное вещество поместили в воду. Образовавшийся осадок разделили на две части. К одной части прилили соляную кислоту, а к другой – раствор гидроксида натрия. Напишите уравнения описанных реакций.
25) Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили и полученный продукт растворили в разбавленной серной кислоте. Напишите уравнения описанных реакций.
26) При взаимодействии оксида алюминия и азотной кислоты образовалась соль. Соль высушили и прокалили. Образовавшийся при прокаливании остаток подвергли электролизу в расплавленном криолите. Полученный металл нагрели с концентрированными гидроксида калия и нитрата калия. При этом выделился газ с резким запахом. Напишите уравнения описанных реакций.
27) К раствору гидроксида натрия добавили порошок алюминия. Через раствор полученного вещества пропустили избыток углекислого газа. Выпавший осадок отделили и про-калили. Полученный продукт сплавили с карбонатом натрия. Напишите уравнения описанных реакций.
28) Порошок металлического алюминия смешали с твердым йодом, и добавили несколько капель воды. К полученной соли добавили раствор гидроксида натрия до выпадения осадка. Образовавшийся осадок растворили в соляной кислоте. При последующем добавлении раствора карбоната натрия вновь наблюдается выпадение осадка. Напишите уравнения описанных реакций.
29) Алюминий растворили в соляной кислоте. К полученному раствору добавили избыток раствора карбоната калия. Выпавший осадок растворили в избытке раствора едкого калия, а выделившийся газ пропустили над раскаленным углем. Напишите уравнения описанных реакций.
30) Алюминий растворили в водном растворе горячего гидроксида натрия. к полученному раствору добавили по каплям разбавленную соляную кислоту до прекращения выпадения осадка. Выделившийся в период реакции газ пропустили над раскаленным оксидом меди (II). Полученное простое вещество растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
31) Алюминий вступил в реакцию с железной окалиной. Полученную смесь веществ растворили в концентрированном растворе гидроксида натрия и отфильтровали. Твердое вещество сожгли в атмосфере хлора, а фильтрат обработали концентрированным раствором хлорида алюминия. Напишите уравнения описанных реакций.
Источник
Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется карбонат алюминия, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется карбонат алюминия», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Если не знаете, как правильно – «карбонат» или «карбонад», необходимо обратить внимание на значение слова и на контекст, в котором оно находится.
Как пишется правильно: «карбонат» или «карбонад»?
Безошибочно написаны оба слова – карбонат и карбонад.
Какое правило применяется?
Слово «карбонат» – неодушевленное имя существительное 2-го склонения м. р., имеющее значение – «химическое соединение, соль угольной кислоты». Слово иностранного происхождения, происходит от латинского слова «carbo» – «уголь».
«Карбонад» имеет те же морфологические характеристики, что и первое слово, но другое значение. Этим словом называют мясной деликатес, состоящий из спинной мышцы свиньи, который запекают в духовке или на углях, предварительно натерев смесью тёртого мускатного ореха, соли, молотого чёрного перца и давленого чеснока. Слово также имеет отношение к латинскому происхождению, в основе его содержится слово «carbo», но в русский язык существительное заимствовано из французского, это прочтение на русский манер слова «carbonnade».
Оба слова относятся к словарным. Чтобы не допускать ошибок в их написании, необходимо помнить, что химическое вещество пишется с буквой «т» в конце слова, а мясной деликатес – с «д».
Примеры предложений
Купил в магазине пачку питьевой соды, по-научному – карбоната натрия.
Карбонад, приготовленный в домашних условиях, гораздо вкуснее покупного.
Как неправильно писать
Нельзя писать существительное следующим образом – корбонат, корбонад, карбанат, карбанад.
Даша
Профи
(793),
закрыт
14 лет назад
Дмитрий Лысов
Профи
(793)
14 лет назад
Гидроксид меди(I) СuОН как индивидуальное соед. не получен. При взаимод. солей Сu(I) с щелочами в р-ре образуется гидратированный оксид Сu2О.xН2О
Гидроксид меди (II) Cu(OH)2 – вещество голубого цвета, существует в аморфной и кристаллической формах, кристаллическая решетка ромбическая, плотность 3,37
Хлористоводородная кислота, HCl, сильная одноосновная кислота, раствор хлористого водорода в воде. Соляная кислота — бесцветная жидкость с острым запахом
Сульфат железа (II) FeSO4. Токсичные, очень гигроскопичные парамагнитные …железа в разбавленной азотной кислоте, либо обработкой раствора сульфата железа
Гидроксид цинка Zn(OH)2. В кристаллическом состоянии существует в виде пяти модификаций, из которых при комнатной температуре только e-Zn(ОН)2 устойчива
Гидрокси́д алюми́ния Al(OH)3 (а также H3AlO3 и HAlO2) — соединение алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты.
сульфат натрия Na2SО4.
Карбонат калия (углекислый калий, поташ) K2CO3 – средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде
Комсомолка
Мастер
(1731)
14 лет назад
))) если бы ты у меня спросила это лет так 7 назад, я бы тебя по химии в МГУ подготовила …а сейчас мозги не те.
Всё, что помню : 1) Cu(OH)2, 2) H2SO3 или H2CO3 или HCl 3) Fe2(SO)4 — может быть.. 4) Zn OH — не помню степени, 5) Al(OH)3
6) NaCl 7) Na2 SO4 или как-то так K2CO3 — спасибо за повод потренировать память
КомсомолкаМастер (1731)
14 лет назад
Ух ты…пока писала — уже другие ответили.. не ожидала , что мало ошибок сделаю ..Мастерство , видать, не пропьешь. Яж ведь на инженера САПР отучилась5 лет..химия мне была вообще никаким боком ))))
mistika
Профи
(748)
14 лет назад
Гидроксид меди: Сu(ОН)2
Соляная кислота: HCL2
Раствор сульфата железа: Fe(OH)SO4
ГИДРОКСИД ЦИНКА: Zn(OH)2
Гидроксид алюминия: Аl(ОН)3
Хлорид натрия: NaCl
Раствор сульфата натрия: Na2SO4
Карбонат калия: К2СО3
Определение и формула карбоната алюминия

Формула –
Молярная масса равна г/моль.
Физические свойства – белая соль, нацело гидролизуется водой.
Карбонат алюминия относится к группе веществ, которые не могут существовать при нормальных условиях. Данная соль образована слабым основанием гидроксидом алюминия и слабой кислотой
. Его можно синтезировать под высоким давлением
и температуре, близкой к
. Для хранения карбоната алюминия, необходимо создавать очень сложную систему, которая защищала бы вещество от любого внешнего воздействия.
Тем не менее, нет никакой научной и практической необходимости в данном веществе, поэтрму нет смысла хранить его в таких сложных условиях, и тратить на это большие деньги. Таким образом, только некоторую незначительную информацию можно найти об этой соли алюминия.
Химические свойства карбоната алюминия
- Для карбоната алюминия характерна лишь одна реакция, а именно, полный гидролиз соли. Данный процесс необратим за счет того, что продукты реакции уходят из ее зоны. Гидроксид алюминия выпадает в осадок, а диоксид углерода в виде газа улетает:
Применение
Есть свидетельства, что карбонат алюминия используется в качестве медицинского препарата в случае избыточного количества кислоты в желудке. Таким образом, данное вещество действует как антацид. Тем не менее, он лечит только симптомы, а не саму болезнь. Этот препарат принимается в таблетках или в жидкой форме.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Определение и разбор слова
Данное слово является существительным, которое употребляется в значении “свиное филе, жаренное или запечённое с чесноком, мускатным орехом”. Несмотря на частое употребление этого слова, при написании возникают сложности. Давайте с этим разберёмся.
Существует два варианта написания анализируемого слова:
- “карбонад“, где на конце слова пишется согласная буква “д”,
- “карбонат“, где на конце слова пишется согласная буква “т”.
Как правильно пишется: “карбонад” или “карбонат”?
Согласно орфографической норме русского языка изучаемое слово пишется как в первом варианте:
карбонад
Отметим, что лексема “карбонад” заимствована из французского языка.
carbonade (франц.) – карбонад
Написание данного слова не подчиняется правилам русского языка, поэтому его правописание следует запомнить.
Важно знать, что в русском языке существует и слово “карбонат”, которое употребляется в значении “химическое соединение, соль угольной кислоты”.
Подытожим:
Карбонад – свиное филе, жаренное или запечённое с чесноком, мускатным орехом.
Карбонат – химическое соединение, соль угольной кислоты.
Примеры для закрепления
- В этом гастрономе продают лучший в городе карбонад.
- Карбонад – это любимый многими мясной деликатес.
- Для увеличения массы в карбонад закачивают воду.
Ответ:
Правильное написание слова — карбонат
Ударение и произношение — карбон`ат
Значение слова -м. 1) Соль угольной кислоты (сода, поташ и т.п.). 2) Общее название минералов, представляющих углекислые соединения различных металлов.
Выберите, на какой слог падает ударение в слове — БРЯЦАНИЕ?
или
Слово состоит из букв:
К,
А,
Р,
Б,
О,
Н,
А,
Т,
Похожие слова:
бикарбонат
гидрокарбонат
карбонатный
поликарбонат
Толкование слова. Правильное произношение слова. Значение слова.
КАРБОНАТ АЛЮМИНИЯ: СТРОЕНИЕ, СВОЙСТВА, ПРИМЕНЕНИЕ — ХИМИЯ — 2022
Карбонат алюминия , представляет собой неорганическую соль , имеющую по химической формуле А на рисунке 2 (СО 3 ) 3 . Это карбонат металла практически не существует, учитывая его высокую нестабильность при нормальных условиях.
Среди причин его нестабильности можно упомянуть слабые электростатические взаимодействия между ионами Al 3+ и CO 3 2- , которые в теории должны быть очень сильными из-за величины их зарядов.
Формула карбоната алюминия. Источник: Габриэль Боливар.
У соли нет недостатков на бумаге при написании химических уравнений ее реакций; но на практике это работает против него.
Несмотря на сказанное, карбонат алюминия может встречаться вместе с другими ионами, такими как минерал даусонит. Точно так же есть производное, в котором он взаимодействует с водным раствором аммиака. Остальное считается смесью Al (OH) 3 и H 2 CO 3 ; который представляет собой шипучий раствор с белым осадком.
Эта смесь имеет лечебное применение. Однако чистая, выделяемая и поддающаяся манипуляциям соль Al 2 (CO 3 ) 3 не имеет известных возможных применений; по крайней мере, не при огромном давлении или экстремальных условиях.
Структура карбоната алюминия
Кристаллическая структура этой соли неизвестна, поскольку она настолько нестабильна, что не может быть охарактеризована. Однако из его формулы Al 2 (CO 3 ) 3 известно, что соотношение ионов Al 3+ и CO 3 2- составляет 2: 3; Другими словами, на каждые два катиона Al 2+ должно приходиться три аниона CO 3 2-, электростатически взаимодействующих с ними.
Проблема в том, что оба иона очень неравны по размеру; Al 3+ очень мал, а CO 3 2- громоздок. Это различие само по себе уже влияет на стабильность кристаллической решетки, ионы которой «неудобно» взаимодействовали бы, если бы эту соль можно было изолировать в твердом состоянии.
В дополнение к этому аспекту, Al 3+ представляет собой сильно поляризованный катион, свойство, которое деформирует электронное облако CO 3 2- . Это как если бы вы хотели заставить его связываться ковалентно, хотя анион не может.
Следовательно, ионные взаимодействия между Al 3+ и CO 3 2- имеют тенденцию к ковалентности; еще один фактор, который увеличивает нестабильность Al 2 (CO 3 ) 3 .
Карбонат гидроксида аммония алюминия
Хаотическая взаимосвязь между Al 3+ и CO 3 2- смягчается по внешнему виду, когда в кристалле присутствуют другие ионы; такие как NH 4 + и OH — , поступающие из раствора аммиака. Этот квартет ионов, Al 3+ , CO 3 2- , NH 4 + и OH — , действительно может определять стабильные кристаллы, даже способные принимать различные морфологии.
Другой пример, похожий на этот, наблюдается в минерале даусоните и его ромбических кристаллах NaAlCO 3 (OH) 2 , где Na + заменяет NH 4 + . В этих солях их ионные связи достаточно сильны, поэтому вода не способствует высвобождению CO 2 ; или, по крайней мере, не резко.
Хотя NH 4 Al (OH) 2 CO 3 (AACC, аббревиатура на английском языке), ни NaAlCO 3 (OH) 2 не представляют собой карбонат алюминия, их можно рассматривать как основные его производные.
свойства
Молярная масса
нестабильность
В предыдущем разделе с молекулярной точки зрения было объяснено, почему Al 2 (CO 3 ) 3 нестабилен. Но какую трансформацию он претерпевает? Следует учитывать две ситуации: сухую и «мокрую».
сухой
В сухой ситуации анион CO 3 2- превращается в CO 2 в результате следующего разложения:
Что имеет смысл, если его синтезируют в присутствии оксида алюминия под высоким давлением CO 2 ; то есть обратная реакция:
Следовательно, чтобы предотвратить разложение Al 2 (CO 3 ) 3 , соль должна быть подвергнута воздействию высокого давления (например, с использованием N 2 ). Таким образом, образование CO 2 не будет термодинамически благоприятным.
Влажный
Находясь во влажном состоянии, CO 3 2- подвергается гидролизу, в результате чего образуются небольшие количества OH — ; но достаточно для осаждения гидроксида алюминия Al (OH) 3 :
Al 3+ + 3OH — Al (OH) 3
С другой стороны, Al 3+ также гидролизуется:
Хотя Al 3+ на самом деле сначала будет гидратироваться с образованием комплекса Al (H 2 O) 6 3+ , который гидролизуется с образованием 2+ и H 3 O + . Затем H 3 O (или H + ) протонирует CO 3 2- в H 2 CO 3 , который разлагается на CO 2 и H 2 O:
Обратите внимание, что в конечном итоге Al 3+ ведет себя как кислота (высвобождает H + ) и основание (высвобождает OH — при равновесии растворимости Al (OH) 3 ); то есть проявляет амфотеризм.
физический
Если ее удастся выделить, эта соль, вероятно, будет белого цвета, как и многие другие соли алюминия. Кроме того, из-за разницы между ионными радиусами Al 3+ и CO 3 2- , он наверняка будет иметь очень низкие температуры плавления или кипения по сравнению с другими ионными соединениями.
Что касается его растворимости, он бесконечно растворим в воде. Кроме того, это будет гигроскопичное и расплывающееся твердое вещество. Однако это всего лишь догадки. Другие свойства должны быть оценены с помощью компьютерных моделей, подвергнутых воздействию высоких давлений.
Приложения
Карбонат алюминия известен в медицине. Его использовали как мягкое вяжущее средство и как лекарство для лечения язвы желудка и воспалений. Он также использовался для предотвращения образования мочевых камней у людей.
Он использовался для контроля увеличения содержания фосфатов в организме, а также для лечения симптомов изжоги, кислотного расстройства желудка и язвы желудка.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. АлюминийАлюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью. Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью. Основное и возбужденное состояниеПри переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень. Природные соединенияПолучениеАлюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом — методом электролиза их оксидов и солей. Химические свойства
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой. Al + Br2 → AlBr3 (бромид алюминия) При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом. Al + F2 → (t) AlF3 (фторид алюминия) Al + S → (t) Al2S3 (сульфид алюминия) Al + N2 → (t) AlN (нитрид алюминия) Al + C → (t) Al4C3 (карбид алюминия) Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι — двойственный), вступает в реакции как с кислотами, так и с основаниями. Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде — выделяется водород) При прокаливании комплексные соли не образуются, так вода испаряется — вместо них образуются (в рамках ЕГЭ) средние соли — алюминаты (академически — сложные окиселы): Реакция с водой При комнатной температуре не идет из-за образования оксидной пленки — Al2O3 — на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) — реакция идет. Алюминотермия (лат. Aluminium + греч. therme — тепло) — способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C. С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W. Оксид алюминияОксид алюминия получают в ходе взаимодействия с кислородом — на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду. Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями. Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия) Гидроксид алюминияГидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок — гидроксид алюминия. Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями. Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание — Li3[Al(OH)6] — гексагидроксоалюминат лития) © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. источники: http://acetyl.ru/o/nal12c1o33.php http://studarium.ru/article/165 |
An alternate way to define salt is to describe it as a salt form of carbonic acid and an antacid with phosphate-binding action. Pure aluminium carbonate is extremely uncommon in nature; it is more commonly found as the sodium aluminium carbonate mineral dawsonite and the hydrated basic aluminium carbonate minerals scarbroite and hydroscarbroite.
What is Aluminium Carbonate?
Aluminium carbonate is a carbonate of an aluminium salt, which does not occur in nature. It is possible to produce it at high carbon dioxide pressure and at temperatures near to 0°C.
Aluminium carbonate storage would necessitate the development of a highly complicated mechanism that would safeguard the chemical from any external forces. Aluminium carbonate is a carbonate of aluminium. Furthermore, it is a water-insoluble Aluminium source that may readily be converted into other Aluminium compounds.
The chemical formula of Aluminium Carbonate is Al2(CO3)3.
Properties of Aluminium Carbonate
Physical Properties
The physical attributes of a chemical include its density, melting point, boiling temperature, and physical appearance. Some of the compound’s physical characteristics are also affected by the aluminium carbonate formula.
The following is a list of physical properties:
- Aluminium carbonate has a density of 1.5 g/cm3
- The compound’s molar mass is 96.09 g/mol.
- They are water-soluble.
- The melting point of aluminium carbonate is 58 °C.
- At the boiling point, it decomposes.
- The physical appearance of aluminium carbonate might be described as powdery and white. They seem like whitish powder.
Chemical Properties
The chemical properties of a compound provide information on the chemical formula of aluminium carbonate, molecular weight, reaction type, bond types involved, and other aspects of a compound.
The following are some of the compound’s chemical properties:
- Dialuminum Tricarbonate is the IUPAC term for aluminium carbonate.
- Aluminium carbonate has a molecular weight of 233.99.
- The compound’s hydrogen bond acceptor number is 9.
- The amount of hydrogen bond donors is zero. There are no bonds that can be rotated.
- The chemical compound has a complexity of 18.8.
- The characteristics of salt are basic in nature.
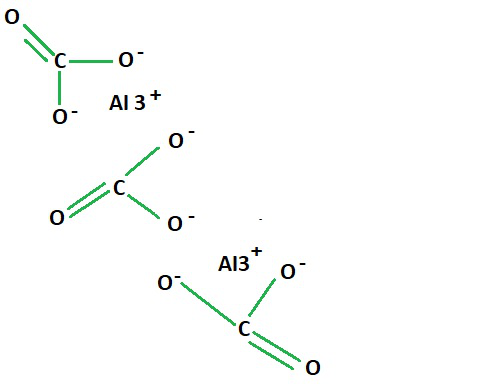
Structure of Aluminium Carbonate
Aluminium Carbonate
Preparation of Aluminium Carbonate
There is no indication that the production of aluminium carbonate may occur in double displacement processes. Furthermore, soluble carbonates can precipitate aluminium hydroxide, resulting in the production of carbon dioxide. This is due to the fact that soluble carbonate is considered alkaline. Above all, the reaction of aluminium sulphate with sodium bicarbonate produces carbon dioxide and aluminium hydroxide. Furthermore, aluminium hydroxide inhibits foam production. This reaction was also the inspiration for the development of an early fire extinguisher.
Uses of Aluminium Carbonate
- Aluminium carbonate, like aluminium oxide and aluminium hydroxide, is a phosphate-binding medication. This medication is occasionally given to dogs and cats by veterinarians in order to bind intestinal phosphate.
- This medicine inhibits the absorption of dietary phosphate and reduces the absorption of pancreatic phosphorus. Furthermore, it is rarely used in humans. This is because of worries about its toxicity. Dogs and cats do not have a harmful reaction to their presence.
- Aluminium carbonate is useful to prevent the formation of urinary stones in humans. It is also useful as a medicinal treatment in situations of excess stomach acid. Inflammations and ulcerations may occur in some of these situations. Aluminium carbonate merely treats the symptoms of the disease; it has no impact on the disease itself.
- Furthermore, this medication can be taken as a tablet or as a liquid. Above all, caution should be exercised when taking aluminium carbonate, and it should be discussed with a medical professional before to use. Those suffering from renal problems should absolutely avoid it. Furthermore, aluminium carbonate allows for the regulation of phosphate levels in the body.
Sample Questions
Question 1: Is aluminium carbonate water soluble?
Answer:
Basic Aluminum Carbonate is a water-insoluble Aluminum source that can be easily transformed to other Aluminum compounds like the oxide by heating (calcination).
Question 2: What is the formula and valency of aluminium oxide?
Answer:
The valency of aluminum is +3 and that of oxide is -2. Therefore, the chemical formula of aluminum oxide is Al2O3.
Question 3: What is the ion content of aluminium carbonate?
Answer:
As seen in the structural formula for aluminium carbonate, two aluminium ions are present in the bonding between the three carboxylic groups that constitute the aluminium and carbonate formula.
Question 4: What is the purpose of using aluminium in water treatment?
Answer:
Aluminum is used in water treatment to eliminate disease-causing germs and other contaminants from drinking water that might harm your health. When treated appropriately, the quantity of residual aluminium remaining in the water should be comparable to or lower than that of untreated water.
Question 5: Is aluminium toxic in water?
Answer:
The EPA initially issued aluminium guidelines in 1988 in order to safeguard aquatic life from the adverse effects of aluminium toxicity in freshwaters.
Aluminum can impair an aquatic organism’s capacity to control salt concentrations and clog fish gills, potentially leading to death or impairing development and reproduction.
An alternate way to define salt is to describe it as a salt form of carbonic acid and an antacid with phosphate-binding action. Pure aluminium carbonate is extremely uncommon in nature; it is more commonly found as the sodium aluminium carbonate mineral dawsonite and the hydrated basic aluminium carbonate minerals scarbroite and hydroscarbroite.
What is Aluminium Carbonate?
Aluminium carbonate is a carbonate of an aluminium salt, which does not occur in nature. It is possible to produce it at high carbon dioxide pressure and at temperatures near to 0°C.
Aluminium carbonate storage would necessitate the development of a highly complicated mechanism that would safeguard the chemical from any external forces. Aluminium carbonate is a carbonate of aluminium. Furthermore, it is a water-insoluble Aluminium source that may readily be converted into other Aluminium compounds.
The chemical formula of Aluminium Carbonate is Al2(CO3)3.
Properties of Aluminium Carbonate
Physical Properties
The physical attributes of a chemical include its density, melting point, boiling temperature, and physical appearance. Some of the compound’s physical characteristics are also affected by the aluminium carbonate formula.
The following is a list of physical properties:
- Aluminium carbonate has a density of 1.5 g/cm3
- The compound’s molar mass is 96.09 g/mol.
- They are water-soluble.
- The melting point of aluminium carbonate is 58 °C.
- At the boiling point, it decomposes.
- The physical appearance of aluminium carbonate might be described as powdery and white. They seem like whitish powder.
Chemical Properties
The chemical properties of a compound provide information on the chemical formula of aluminium carbonate, molecular weight, reaction type, bond types involved, and other aspects of a compound.
The following are some of the compound’s chemical properties:
- Dialuminum Tricarbonate is the IUPAC term for aluminium carbonate.
- Aluminium carbonate has a molecular weight of 233.99.
- The compound’s hydrogen bond acceptor number is 9.
- The amount of hydrogen bond donors is zero. There are no bonds that can be rotated.
- The chemical compound has a complexity of 18.8.
- The characteristics of salt are basic in nature.
Structure of Aluminium Carbonate
Aluminium Carbonate
Preparation of Aluminium Carbonate
There is no indication that the production of aluminium carbonate may occur in double displacement processes. Furthermore, soluble carbonates can precipitate aluminium hydroxide, resulting in the production of carbon dioxide. This is due to the fact that soluble carbonate is considered alkaline. Above all, the reaction of aluminium sulphate with sodium bicarbonate produces carbon dioxide and aluminium hydroxide. Furthermore, aluminium hydroxide inhibits foam production. This reaction was also the inspiration for the development of an early fire extinguisher.
Uses of Aluminium Carbonate
- Aluminium carbonate, like aluminium oxide and aluminium hydroxide, is a phosphate-binding medication. This medication is occasionally given to dogs and cats by veterinarians in order to bind intestinal phosphate.
- This medicine inhibits the absorption of dietary phosphate and reduces the absorption of pancreatic phosphorus. Furthermore, it is rarely used in humans. This is because of worries about its toxicity. Dogs and cats do not have a harmful reaction to their presence.
- Aluminium carbonate is useful to prevent the formation of urinary stones in humans. It is also useful as a medicinal treatment in situations of excess stomach acid. Inflammations and ulcerations may occur in some of these situations. Aluminium carbonate merely treats the symptoms of the disease; it has no impact on the disease itself.
- Furthermore, this medication can be taken as a tablet or as a liquid. Above all, caution should be exercised when taking aluminium carbonate, and it should be discussed with a medical professional before to use. Those suffering from renal problems should absolutely avoid it. Furthermore, aluminium carbonate allows for the regulation of phosphate levels in the body.
Sample Questions
Question 1: Is aluminium carbonate water soluble?
Answer:
Basic Aluminum Carbonate is a water-insoluble Aluminum source that can be easily transformed to other Aluminum compounds like the oxide by heating (calcination).
Question 2: What is the formula and valency of aluminium oxide?
Answer:
The valency of aluminum is +3 and that of oxide is -2. Therefore, the chemical formula of aluminum oxide is Al2O3.
Question 3: What is the ion content of aluminium carbonate?
Answer:
As seen in the structural formula for aluminium carbonate, two aluminium ions are present in the bonding between the three carboxylic groups that constitute the aluminium and carbonate formula.
Question 4: What is the purpose of using aluminium in water treatment?
Answer:
Aluminum is used in water treatment to eliminate disease-causing germs and other contaminants from drinking water that might harm your health. When treated appropriately, the quantity of residual aluminium remaining in the water should be comparable to or lower than that of untreated water.
Question 5: Is aluminium toxic in water?
Answer:
The EPA initially issued aluminium guidelines in 1988 in order to safeguard aquatic life from the adverse effects of aluminium toxicity in freshwaters.
Aluminum can impair an aquatic organism’s capacity to control salt concentrations and clog fish gills, potentially leading to death or impairing development and reproduction.