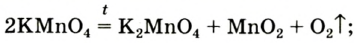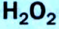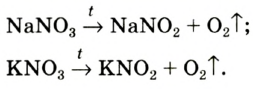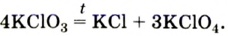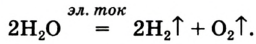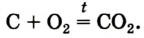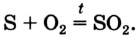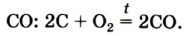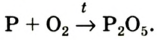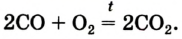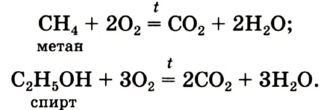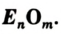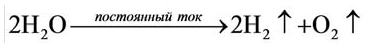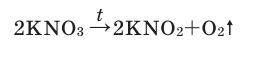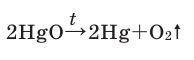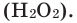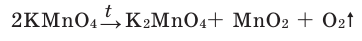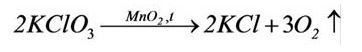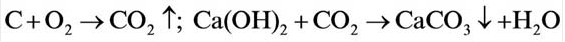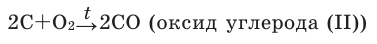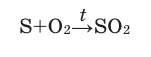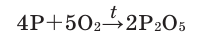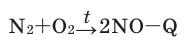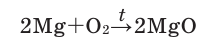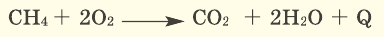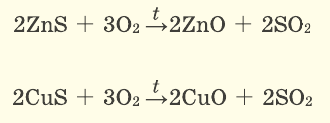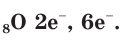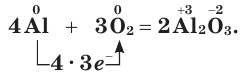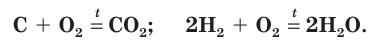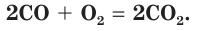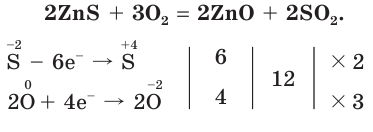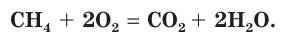Активные формы кислорода (АФК, реактивные формы кислорода, РФК, англ. Reactive oxygen species, ROS) — включают ионы кислорода, свободные радикалы и перекиси как неорганического, так и органического происхождения. Это, как правило, небольшие молекулы с исключительной реактивностью благодаря наличию неспаренного электрона на внешнем электронном уровне.
Все значения словосочетания «активные формы кислорода»
-
Однако известно, что лизосомальные ферменты не способны сами разрушать интактную клеточную стенку и являются потенцирующими веществами более мощных агентов альтерации, а именно активных форм кислорода.
-
Например, активные формы кислорода могут приносить пользу, сжигая отходы клеток, или вред, уничтожая сами клетки при слабо работающей питте(дисбалансе ваты).
-
Позже показано, что их определённая интенсивность необходима для нормального функционирования клетки (см. обзор: Voeikov, 2001), открыты ферментативное производство активных форм кислорода (Babior et al., 1973; Krieger-Brauer, Kather, 1995) и их влияние на важнейшие клеточные процессы (Downs et al., 1998; Chiarugi et al., 2003; Gordeeva et al., 2004).
- (все предложения)
- активный центр
- активный транспорт
- активный центр фермента
- циклический аденозинмонофосфат
- система комплемента
- (ещё синонимы…)
- человек
- активизация
- отдых
- спорт
- пассивный
- (ещё ассоциации…)
- кадет
- одежда
- формация
- формирование
- обмундирование
- (ещё ассоциации…)
- воздух
- чистый воздух
- окись
- вакуум
- дышать
- (ещё ассоциации…)
- активные действия
- активный участник событий
- становиться активным
- (полная таблица сочетаемости…)
- новая форма
- форма тела
- изменение формы
- форма соответствует
- иметь форму
- (полная таблица сочетаемости…)
- чистый кислород
- кислород воздуха
- недостаток кислорода
- кислород кончается
- перекрыть кислород
- (полная таблица сочетаемости…)
- Разбор по составу слова «активный»
- Разбор по составу слова «форма»
- Разбор по составу слова «кислород»
- Как правильно пишется слово «активный»
- Как правильно пишется слово «форма»
- Как правильно пишется слово «кислород»
активный кислород
- активный кислород
- active oxygen
Большой англо-русский и русско-английский словарь.
2001.
Смотреть что такое «активный кислород» в других словарях:
-
активный кислород — aktyvusis deguonis statusas T sritis chemija apibrėžtis Reakcijos metu išsiskiriantis atominis deguonis. atitikmenys: angl. active oxygen rus. активный кислород … Chemijos terminų aiškinamasis žodynas
-
Активный кислород — см. Перекись водорода … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
КИСЛОРОД — (лат. Oxygenium) О, химический элемент VI группы периодической системы, атомный номер 8, атомная масса 15,9994. В свободном виде встречается в виде двух модификаций О2 ( обычный кислород) и О3 (озон). О2 газ без цвета и запаха, плотность 1,42897… … Большой Энциклопедический словарь
-
кислород — а; м. Химический элемент (O), газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду. ◊ Перекрыть кислород кому л. Создать невыносимые условия жизни, работы. ◁ Кислородный,… … Энциклопедический словарь
-
Кислород — У этого термина существуют и другие значения, см. Кислород (значения). 8 Азот ← Кислород → Фтор … Википедия
-
Кислород — (латинское Oxygenium) О, химический элемент VI группы периодической системы Менделеева; атомный номер 8, атомная масса 15,9994. При нормальных условиях К. газ без цвета, запаха и вкуса. Трудно назвать другой элемент, который играл бы на… … Большая советская энциклопедия
-
КИСЛОРОД — (лат Oxygenium, от греч. oxys кислый и gennao рождаю) О, хим. элемент VI гр. периодич. системы, ат. н. 8, ат. м. 15,9994. Прир. К. состоит из трех стабильных изотопов: 16 О (99,759%), 17 О (0,037%) и 18 О (0,204%]. Конфигурация внеш. электронной… … Химическая энциклопедия
-
КИСЛОРОД — (латинское Oxygenrum) химический элемент; символ О; атомный номер 8, относительная атомная масса 15,999. При нормальных условиях кислород газ без цвета и запаха. В обычных условиях молекула кислорода двухатомная (О2); в тихом электрическом… … Металлургический словарь
-
КИСЛОРОД — (лат. Oxygenium), хим. элемент VI гр. периодич. системы. В свободном виде встречается в виде двух модификаций О2 ( обычный К.) и О3 (озон). О2 газ без цвета и запаха, плотн. 1,42897 г/л, tпл 218,8 °С, tкип 182,96 О С. Химически самый активный… … Естествознание. Энциклопедический словарь
-
Кислород — (лат. Oxygenium) химический элемент VI группы периодической таблицы. В свободном состоянии встречается в виде обычной молекулы (газа без запаха и цвета) и в виде озона (газа с резким кислым запахом). Химически, после фтора, самый активный… … Начала современного естествознания
-
КИСЛОРОД — хим. элемент, символ О (лат. Оху genium, от греч. oxys кислый и gennad рождаю), ат. н. 8, ат. м. 15,9994. При норм. условиях К. газ без цвета, запаха и вкуса. К. самый распространённый элемент на Земле, играющий огромную роль как в природе, так и … Большой энциклопедический политехнический словарь
Что такое активный кислород?
Опасность активного кислорода (радикалов) для организма человека
Как в организме формируется активный кислород?
Поддержание баланса свободных радикалов в организме человека
Методы восстановления баланса в организме человека
Что такое активный кислород?
Кислород (латинское Oxygenium), химический элемент VI группы периодической системы Менделеева. При нормальных условиях кислород — газ без цвета, запаха и вкуса. Трудно назвать другой элемент, который играл бы на нашей планете такую важную роль, как кислород. На земной поверхности, где протекает фотосинтез и господствует свободный кислород, формируются резко окислительные условия. Напротив, в клеточной системе организма человека формируется восстановительные условия и свободный кислород должен отсутствовать. Окислительно-восстановительные процессы в простой воде с участием кислорода подвергают организм человека окислительному разрушению. Так организм изнашивается, стареет, жизненно-важные органы теряют свою функцию. Но другой аспект проблемы связан с формированием свободного радикала кислорода. Свободные радикалы, кинетически независимые частицы, характеризующиеся наличием неспаренных электронов. К ним относиться молекула кислорода и производные соединения кислорода. Например: •ROО, H2O2, •OH, O3 , 1O2 и т.д.
В обычных условиях молекула кислорода двухатомна (О2). Диссоциация молекулярного кислорода в воде с образованием свободного радикала кислорода и перекиси водорода (рис «формирование») приводит, в дальнейшем, к реакции с аминокислотами, входящих в структуру ДНК организма человека и возникновению мутаций (рис «реакция»). 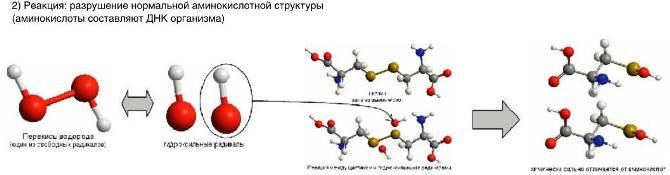
Опасность активного кислорода (радикалов) для организма человека
Свободные радикалы вызывают старение
Секреты старения находятся в самой глубине клеток, среди составляющих их молекул. Существует несколько теорий, объясняющих причины старения, но одна оказалась наиболее убедительной и лучше остальных подкрепленной современными доказательствами. Это теория свободных радикалов, и формулируется она так: старение происходит тогда, когда клетки постоянно повреждаются, подвергаясь вредному воздействию свободных радикалов. Клеточные повреждения со временем накапливаются, пока процесс не достигает критического момента, и в конце жизни нас ждет «букет» болезней и смерть.
Именно так приходит старение со всеми своими последствиями. Это откровение пришло к доктору Денхему Хармену, профессору медицины из университета Небраски в 1954 году. Однако, как и большая часть смелых идей, она оставалась практики без внимания, пока после многочисленных экспериментов доктора Хармена в конце шестидесятых годов другие исследования не начали подтверждать ее правоту. Сейчас эту теорию считают крупным шагом вперед в области изучения процесса старения.
По мнению доктора Хармена, такие заболевания, как рак, болезни сердца,атеросклероз, болезнь Паркинсона, артрит, болезнь Альцгеймера, — не отдельные проблемы со здоровьем. Это всего лишь различные формы процесса старения, вызванного свободными радикалами. То, какая форма выбирается, зависит от среды и наследственности. Некоторые специалисты утверждают, что от 80 до 90% всех дегенеративных болезней связаны с действием свободных радикалов. Избавьтесь от свободных радикалов и Вы замедлите процесс старения.
Разрыв поперечной связи в структуре ДНК
Свободный радикал — это атомы или фрагменты молекул, которые имеют отдельный непарный электрон. Этот электрон придаёт радикалу необычную химическую агрессивность, потому что для достижения стабильного состояния он должен отнять электрон у другого атома. Благодаря этому опять возникает радикал и заново повторяется вся цепочка реакции. Реакция «радикальной цепочки» продолжается до тех пор, пока 2 радикала не соединятся друг с другом или ее не прервет антиоксидант, не вступающий в эту реакцию. Свободные радикалы непрерывно образуются как побочные продукты клеточного метаболизма. Например, при дыхательной цепи митохондрий около 1-5% кислорода не восстанавливаются до состояния воды. При этом наряду с супероксидрадикалом (это ион молекулы кислорода с неспаренным электроном — 1O2 ) возникают пероксид водорода (H2O2) и особенно агрессивный гидроксилрадикал ( высокореакционный и короткоживущий радикал •OH, образованный соединением атомов кислорода и водорода). Свободные радикалы непосредственно воздействуют на геном человека, вызывая его многочисленные мутации. Например, у человека насчитывается примерно 10 тысяч оксидативных повреждений ДНК на одну клетку в день.
Свободнорадикальная патология
Перекисное окисление — сложный цепной процесс окисления кислородом липидных субстратов, главным образом полиненасыщенных жирных кислот, включающий стадии взаимодействия липидов со свободнорадильными соединениями и образования свободных радикалов липидной природы. В инициировании перекисного окисления решающую роль играют кислородные радикалы. В результате одноэлектронного восстановления молекулярного кислорода O2 в клетках образуется супероксидный анион-радикал. При реакции двух супероксидных радикалов образуется молекула перекиси водорода. Активация перекисного окисления является ключевым фактором, вызывающим повреждение мембранных структур органов и тканей при многих заболеваниях (за рубежом для таких заболеваний принят термин «свободнорадикальная патология»).
К свободнорадикальной патологии относятся заболевания печени, артриты, атеросклероз, заболевания легких, гипоксические, гипероксические и реперфузионные повреждения органов и тканей, злокачественные опухоли, катаракта и др.
Патология вырабатывания меланина
Под воздействием солнечных лучей в коже образуются свободные радикалы. Чтобы обезвредить свободные радикалы, специальные клетки-меланоциты начинают вырабатывать меланин. Именно он и является тем пигментом, от количества которого зависит интенсивность загара. Но защищаясь от солнца выработкой меланина, организм несколько запаздывает, давая возможность радикалам негативно воздействовать на клетки и ткани. В случаях ослабленной иммунной системы человека солнце может стать стимулятором нежелательных процессов, например, развития новообразований — миом, бородавок, родинок.
Как в организме формируется активный кислород?
Внутренние источники — неизбежная генерация активного кислорода.
- Естественный биологический метаболизм. Процесс вырабатывания энергии за счет синтеза АДФ из АТФ. АТФ — нуклеотидный кофермент аденозинтрифосфат является наиболее важной формой сохранения химической энергии в клетках. АДФ — нуклеотид аденозиндифосфат, образуется в результате переноса концевой фосфатной группы АТФ. Пример: усвоение пищи — углеводороды и жирные кислоты используются в процессе синтеза АТФ-АДФ.
- УФ-лучи. Во время образования и выведения меланина. Пример: Свободные радикалы препятствуют выведению меланина, поэтому происходит обесцвечивание кожи.
- Физиологический процесс. Стресс увеличивает выработку адреналина, что вызывает формирование свободных радикалов.
Внешние источники — представляют в наши дни большую опасность.
- Прямое потребление: сигареты, тяжелая жирная пища, глютамат натрия (Е 621, правда, некоторые производители стыдливо скрывают его наличие и в составе указывают «ароматизирующее вещество», «вкусовые добавки» или «усилители вкуса»), выхлопные газы и т. д.
- Косвенное потребление: сельскохозяйственные химикаты, пестициды, тригалогенометаны, ПХБ и т. д.
- Радиация: микроволновое излучение, рентген, электромагнитные волны средств коммуникации и т. д.

Поддержание баланса свободных радикалов в организме человека
У людей с нормальным состоянием здоровья баланс поддерживается за счет ферментов СОД.
СОД — фермент супероксиддисмутазы, ключевой фермент в ряду белковых антиоксидантов, защищающий организм от повреждающего действия свободных радикалов кислорода.
Французы называют СОД «Эликсиром молодости» за его способность предотвращать преждевременное старение. В наш век людей окружают многочисленные химикаты, участвующие в генерации свободных радикалов. Таким образом угроза нарушения баланса активных форм кислорода растет. Необходима дополнительная помощь организму в процессе выведения вредных элементов. 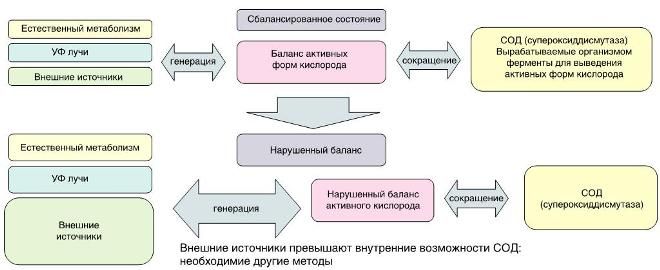
Методы восстановления баланса в организме человека
- Обычные методы
Медицинские препараты усиливающие функцию СОД. Ими являются витамины С, Е и др.
Здоровая пища, например, молоко, свежие фрукты и др.
Ионизированная щелочная вода с низким Окислительно Восстановительным Потенциалом и высоким рН. - Наш метод — пи-вода
Пи-вода известна как вода, повышающая жизненную энергию. Она широко известна в таких развитых странах как Япония.
Водоочиститель Неос ВЕ — идеальный источник пи-воды.
Далее читайте статью про » Что такое пи-вода?».
Содержание:
Кислород как химический элемент:
Кислород — самый распространенный элемент на Земле.
Дыхание, горение, многие процессы в живой и неживой природе, а также в технике протекают в присутствии кислорода как простого вещества.
Кислород, являясь самым распространенным элементом в земной коре, считается одним из самых необходимых элементов для жизнедеятельности на Земле.
Кислород был открыт в 1774 г. Дж. Пристли и независимо от него — К. Шееле, но как новое вещество его подробно охарактеризовал А. Лавуазье.
Название «кислород» предложено А. Лавуазье. По-латыни (oxygenium) оно означает «рождающий кислоты». Химическим знаком его была взята первая буква латинского названия. Порядковый номер кислорода в периодической системе — 8, а относительная атомная масса равна 15,9994
В свободном виде кислород встречается в атмосферном воздухе, а в связанном виде, т.е. в виде соединений, входит в состав воды, минералов и других веществ, составляющих горные породы, а также растительные и животные организмы. В земной коре масса кислорода составляет 47%. Объемная доля молекулярного кислорода в воздухе составляет 20,94%. В воде масса связанного кислорода составляет 89%.
Кислород как простое вещество
Получение:
В лаборатории кислород получают следующими способами.
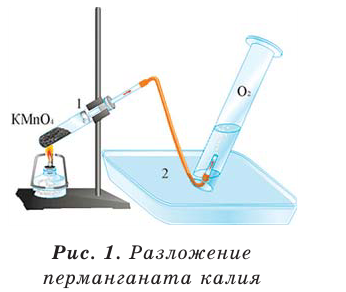
1. Термическим разложением перманганата калия:
2. Термическим разложением бертолетовой соли в присутствии катализатора:
3. Термическим разложением нитратов щелочных металлов:
4. Электролизом воды (рис. 19):
Рис. 19. При электролизе воды образуется один объем кислорода и два объема 4
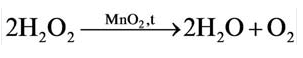
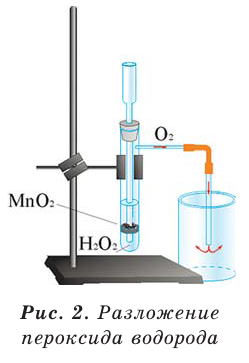
5. Пероксид водорода в присутствии катализатора оксида марганца (IV) разлагается на воду и кислород (рис. 20):
В промышленности кислород получают электролизом воды или из жидкого воздуха.
Рис. 20. Разложение 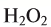
Понятие о катализаторах:
Если обратить внимание на реакцию получения кислорода посредством разложения пероксида водорода, то можно увидеть, что этот процесс осуществляется очень быстро в присутствии черного порошка — оксида марганца (IV) — 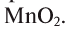
Если отделить фильтрованием порошок, находящийся на дне сосуда, и высушить его, то можно заметить, что его исходные масса и свойства не изменились. Им можно пользоваться при разложении других образцов пероксида водорода.
Вещества, участвующие в химической реакции и ускоряющие ее, но которые при этом не расходуются и не изменяются, называются катализаторами.
Процесс, протекающий в присутствии катализатора, называется катализом.
Рис. 21. Притяжение кислорода к магниту
Физические свойства:
Молекула кислорода состоит из двух атомов и как простое вещество выражается формулой 02. Относительная молекулярная масса равна 32. При обычных условиях кислород — газ без цвета, вкуса и запаха. Он немного тяжелее воздуха (1 л кислорода весит 1,43 г, а 1 л воздуха — 1,293 г). Кислород мало растворяется в воде: при 0°С в 1 л — 49 мл кислорода, при 20°С в 1л — 31 мл кислорода. Приблизительно при 1500°С кислород расщепляется на атомы. При —183°С кислород превращается в голубоватую жидкость. Жидкий кислород способен притягиваться к магниту (рис. 21).
Озон:
При пропускании через кислород или воздух электрической искры (или грозового разряда) образуется новое вещество с характерным запахом — озон. Возможность получения озона из чистого кислорода доказывает, что он является его аллотропическим видоизменением и состоит из атомов кислорода:
Озон постоянно образуется в стратосфере (слой атмосферы на высоте 23—25 км от Земли) под действием ультрафиолетовых лучей, а также в результате окисления смолистых веществ хвойных растений. Озоновый слой составляет в толщину 2—4,5 мм, он защищает Землю от губительной солнечной радиации (вредных лучей). Нарушение целостности озонового слоя чрезвычайно опасно для жизни на Земле. Поэтому ученые постоянно проводят исследования по изучению причин появления озоновых дыр и мер по их предупреждению.
Озон разъедает резину, обесцвечивает масло и бумагу, убивает бактерии. Он используется при усовершенствовании технологических процессов в промышленности, при очистке дымовых газов, промышленных и бытовых стоков, а также при дезинфекции питьевой воды.
Озон — газ голубого цвета с характерным запахом, в воде растворяется лучше, чем кислород (при 0°С в 1 л воды 490 мл).
Озон легко разлагается:
В лаборатории озон получают с помощью озонатора.
Озон отделяют от кислорода путем сильного вымораживания (озон кипит при температуре -111,9°С).
Озон ядовит. Его количество в воздухе не должно превышать 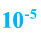
Серебро не взаимодействует с кислородом, но при взаимодействии с озоном дает оксид.
Химические свойства кислорода:
Кислород (после фтора) — самый активный неметалл.
Кислород поддерживает горение.
Кислород соединяется почти со всеми металлами (окисляет их), кроме золота, серебра, платины и металлов группы платины:
Кислород вступает в реакцию также со всеми неметаллами, кроме галогенов (элементов VII группы главной подгруппы), образуя оксиды:
Кислород также вступает в реакцию со сложными органическими и неорганическими веществами:
Оксиды — это вещества, образующиеся в результате взаимодействия кислорода и большинства простых или сложных веществ.
В оксидах кислород двухвалентен.
Биологическое значение кислорода
Кислород считается важным биогенным элементом. Он составляет 45% сухой биомассы растений. Процесс дыхания живых организмов на Земле непосредственно связан с кислородом. Кислород также является источником озонового слоя, задерживающего опасные солнечные лучи. Роль кислорода огромна при распаде и гниении умерших организмов. Процесс фотосинтеза также нельзя представить без кислорода. Он составляет 65% тела человека.
Применение кислорода
Кислород широко применяется в медицине, при обеспечении жизнедеятельности в подводных и космических аппаратах, при осуществлении процессов дыхания, горения и гниения, для создания высоких температур в производственных процессах, в производстве химических веществ, в качестве окислителя топлива в различных агрегатах. Кислород хранится в 40-литровых голубых баллонах (вес тары 80 кг) при давлении 150-160 атм и объеме 6-7 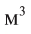
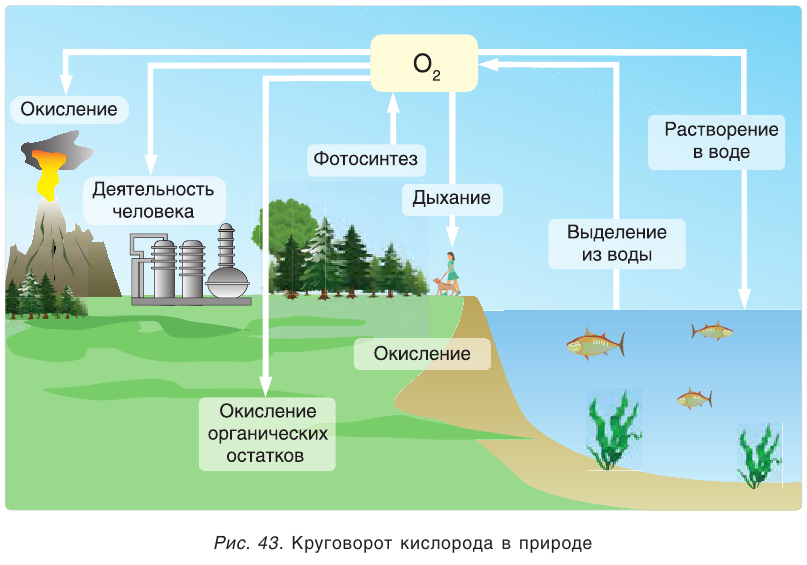
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).
Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде
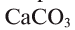
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Кислород и воздух
Атмосферный воздух — это природная смесь многих газов. Помимо азота и кислорода, являющихся основной составной частью воздуха, в его состав входят в небольшом количестве инертные газы, углекислый газ, пары воды и водород (табл. 6). Кроме них, в воздухе встречаются, в зависимости от внешних условий, пыль, некоторые случайные примеси. Кислород, азот и инертные газы являются постоянными составляющими воздуха, они встречаются в любом месте почти в одинаковом количестве. Содержание же углекислого газа, паров воды и пыли изменяется в зависимости от условий.
Один литр воздуха при 20°С и нормальном атмосферном давлении весит 1,293 г. При —192°С и давлении 101,33 кПа воздух превращается в бесцветную прозрачную жидкость. Из жидкого воздуха выделяются азот, кислород и инертные газы.
Углекислый газ и водяные пары воздуха выполняют функцию защитного экрана, препятствующего распространению во Вселенной тепла Земли, а озон не пропускает губительные для жизни на Земле коротковолновые ультрафиолетовые лучи, исходящие от Солнца и звезд. Твердые частицы воздуха (пыль) служат основой для образования дождевых капель (в состав пыли входят минеральные вещества, частицы угля, растительная пыль и различные бактерии).
К случайным примесям воздуха относятся сероводород и аммиак, образующиеся при гниении органических остатков, выбрасываемый промышленными предприятиями сернистый газ, образующиеся в результате электрических разрядов оксиды азота, которые периодически выводятся из состава воздуха дождем и снегом.
Воздух является необходимой составной частью жизни на Земле. Сохранение его чистоты имеет огромное значение для человечества. Для защиты воздуха от техногенных загрязнений необходимо использовать новые безотходные технологии, предупреждать уменьшение биомассы Земли, обеспечивать нормальную работу естественных механизмов очистки воздуха.
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота. Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
Оксиген
Это первый элемент, который вы будете подробно изучать. Из периодической системы Д. И. Менделеева можно получить такие сведения о нем:
- • символ Оксигена — О;
- • порядковый номер элемента — 8;
- • Оксиген находится во 2-м периоде, в VI группе;
- • относительная атомная масса элемента — 16 (точное значение — 15,999).
Значение порядкового номера элемента указывает на то, что атом Оксигена содержит 8 электронов, а заряд ядра атома равен +8.
Оксиген — неметаллический элемент, поскольку его простые вещества кислород 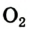
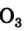
Вам известно, что Оксиген имеет постоянное значение валентности — 2. Атом этого элемента легко присоединяет 2 электрона и превращается в простой ион 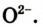
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 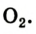
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 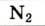 |
78,09 | 75,51 |
| Кислород | 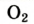 |
20,95 | 23,15 |
| Аргон | 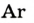 |
0,93 | 1,28 |
| углекислый газ | 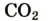 |
0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52). Когда горение фосфора прекратится, вода займет примерно 1/5 часть объема бутылки. Этот объем занимал в воздухе кислород, который вступил в реакцию с фосфором.
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 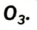
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Физические свойства кислорода
В обычных условиях кислород — бесцветный газ, который не имеет запаха и вкуса. При охлаждении до -183 °С превращается в голубую жидкость, которая при температуре -219 °С затвердевает, образуя синие кристаллы. Кислород в 1,1 раза тяжелее воздуха. Он плохо растворяется в воде, но этого достаточно для существования в природных водоемах рыб, других живых существ, которые дышат растворенным кислородом.
Жидкий кислород, как и железо, притягивается к магниту.
Вывод:
Оксиген — неметаллический элемент. В природе распространено его простое вещество кислород, а также вода и другие соединения. На кислород приходится немногим более 1/5 объема воздуха.Кислород — газ без запаха и вкуса, необходимый для дыхания; он поддерживает горение.
Открытие кислорода
Кислород был открыт во второй половине XVIII в. несколькими учеными разных стран. Первым этот газ получил шведский химик К.-В. Шееле в 1772 г., а через два года, не зная об опытах предшественника, — английский химик Дж. Пристли. В 1775 г. французский ученый A.-JI. Лавуазье исследовал кислород и дал ему название oxygen.
Кислород можно обнаружить с помощью тлеющей лучинки. Лучинка, помещенная в сосуд с этим газом, ярко вспыхивает (рис. 53).
Рис. 53.Обнаружение кислорода:
а — тлеющая лучинка на воздухе; б — возгорание лучинки в кислороде
Получение кислорода в промышленности
Неисчерпаемым источником кислорода является воздух. Чтобы получить из него кислород, следует отделить этот газ от азота и других газов. На такой идее основан промышленный метод получения кислорода. Его реализуют, используя специальную, достаточно громоздкую аппаратуру. Сначала воздух сильно охлаждают до превращения его в жидкость. Затем температуру сжиженного воздуха постепенно повышают. Первым из него начинает выделяться газ азот (температура кипения жидкого азота составляет -196 °С), а жидкость обогащается кислородом (температура кипения кислорода -183 °С).
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
В современном исполнении этот опыт изображен на рисунке 54. При нагревании меркурий
Рис. 54.Получение кислорода нагреванием меркурий
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
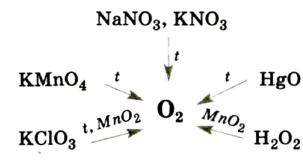
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
- калий перманганат
(бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)
Небольшое количество катализатора — манган
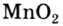
Получение кислорода разложением гидроген пероксида
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган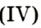
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 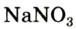

Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
Лабораторные методы получения кислорода
В природе кислород образуется вследствие фотосинтеза в зеленых листьях растений. Упрощенная схема этого процесса такова:
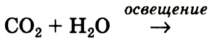
Выводы:
Кислород был открыт в конце XVIII в. несколькими учеными. Кислород получают в промышленности из воздуха, а в лаборатории — с помощью реакций разложения некоторых оксигенсодержащих соединений. Во время реакции разложения из одного вещества образуются два или более веществ.
Химические свойства кислорода
Химические свойства каждого вещества проявляются в химических реакциях при его участии.
Кислород — один из наиболее активных неметаллов. Но в обычных условиях он реагирует с немногими веществами. Его реакционная способность существенно возрастает с повышением температуры.
Реакции кислорода с простыми веществами
Кислород реагирует, как правило, при нагревании, с большинством неметаллов и почти со всеми металлами.
Реакция с углем (углеродом)
Известно, что уголь, нагретый на воздухе до высокой температуры, загорается. Это свидетельствует о протекании химической реакции вещества с кислородом. Теплоту, которая выделяется при этом, используют, например, для обогрева домов в сельской местности.
Основным продуктом сгорания угля является углекислый газ. Его химическая формула —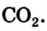
Карбон образует простые вещества — графит и алмаз. Они имеют общее название — углерод — и взаимодействуют с кислородом при нагревании согласно приведенному химическому уравнению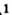
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Реакция с серой
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции — сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа — 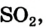
Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в)
Если ложку с горящей серой поместить в сосуд с кислородом, то сера будет гореть более ярким пламенем, чем на воздухе (рис. 56, в). Это можно объяснить тем, что молекул 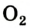
Рис. 57.Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Реакция с фосфором
Фосфор, как и сера, горит в кислороде интенсивнее, чем на воздухе (рис. 57). Продуктом реакции является белое твердое вещество — фосфор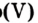
Реакция с магнием. Раньше эту реакцию использовали фотографы для создания яркого освещения («магниевая вспышка») при фотосъемке. В химической лаборатории соответствующий опыт проводят так. Металлическим пинцетом берут магниевую ленту и поджигают на воздухе. Магний сгорает ослепительно-белым пламенем (рис. 58, б); смотреть на него нельзя! В результате реакции образуется белое твердое вещество. Это соединение Магния с Оксигеном; его название — магний оксид.
Рис. 58. Магний (а) и его горение на воздухе (б)
Реакции кислорода со сложными веществами
Кислород может взаимодействовать с некоторыми оксигенсодержащими соединениями. Например, угарный газ СО горит на воздухе с образованием углекислого газа:
Немало реакций кислорода со сложными веществами мы осуществляем в повседневной жизни, сжигая природный газ (метан), спирт, древесину, бумагу, керосин и др. При их горении образуются углекислый газ и водяной пар:
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов —
Каждый оксид имеет химическое название, а некоторые — еще и традиционные, или тривиальные
Таблица 4
Формулы и названия некоторых оксидов
| Формула | Название | |
|---|---|---|
| традиционное (тривиальное) | химическое | |
| СаО | Негашеная известь | Кальций оксид |
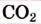 |
Углекислый газ | Карбон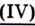 оксид оксид |
| СО | Угарный газ | Карбон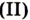 оксид оксид |
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Горение и кислород
Рассмотренные в предыдущем параграфе реакции с участием кислорода сопровождаются одинаковыми внешними эффектами.
Химическую реакцию, во время которой выделяется теплота и появляется пламя, называют горением.
Пламя возникает вследствие свечения раскаленных частиц веществ, которые сгорают или образуются во время реакции.
Для того чтобы горючее вещество воспламенилось, необходимы такие условия:
- наличие кислорода (воздуха);
- нагревание вещества до температуры самовозгорания (для бензина она составляет 220 °С, сухой древесины — 250—300 °С, бумаги — 440 °С, угля — свыше 600 °С).
Кислород поддерживает горение веществ, но сам не горит.
Если не выполняется хотя бы одно из этих условий, то горение не происходит. Это учитывают во время работы с огнеопасными веществами, а также при тушении пожаров.
Погасить огонь можно, залив горящее вещество или предмет водой, засыпав его песком или землей, накрыв одеялом или направив на него струю углекислого газа (он не поддерживает горения и тяжелее воздуха) (рис. 63).
Рис. 63. Гашение пламени:
а — водой; б — песком; в — углекислым газом
В лабораториях, на предприятиях с этой целью используют огнетушители (рис. 64).
Рис. 64. Огнетушитель (а)и его использование (б)
Окисление и кислород
Взаимодействие веществ с кислородом не всегда сопровождается их горением. Большинство таких реакций происходят медленно, иногда — незаметно. Вещество, которое взаимодействует с кислородом, подвергается окислению, т. е. изменяется при участии кислорода.
Медленным окислением веществ обусловлено появление ржавчины на железе, прокисание молока, прогорание масла, порча многих других продуктов питания.
Реакции веществ с кислородом, которые не сопровождаются горением, используют в цветной металлургии, химической промышленности.
Кислород, поступая через легкие в организм животного или человека, окисляет различные вещества, в том числе и те, которые постоянно поступают вместе с пищей.
Выводы:
При взаимодействии некоторых веществ с кислородом происходит их горение — химическое превращение с выделением теплоты и появлением пламени.
Условиями, необходимыми для горения, являются наличие кислорода и достижение веществом определенной температуры. Для того чтобы погасить пламя, необходимо устранить хотя бы одно из этих условий.
Любую реакцию вещества с кислородом называют окислением. Многие из таких реакций происходят медленно и не сопровождаются появлением пламени.
Круговорот оксигена в природе
Каждое мгновение на Земле происходит множество физических и химических превращений. Эти изменения в природе являются циклическими, т. е. периодически повторяющимися.
Часть изменений, которые происходят с веществами на планете, обусловлена химическими реакциями.
Совокупность процессов, происходящих в природе, при которых атомы или ионы элемента в результате реакций переходят от одних веществ к другим, называют круговоротом элемента.
Если главным веществом в круговороте Оксигена выбрать кислород, то можно выделить такие звенья круговорота (схема 8):
- расходование, или связывание, кислорода (процессы дыхания, сгорания топлива и горючего, окисление различных веществ в природе, в технологических процессах);
- взаимопревращение оксигенсодержащих соединений;
- образование кислорода (процесс фотосинтеза, разложение воды в верхних слоях атмосферы). Неизменность содержания кислорода в атмосфере свидетельствует о том, что процессы связывания и выделения кислорода компенсируют друг друга.
Схема 8. Круговорот Оксигена(основные звенья)
Оксиген способствует круговороту других элементов, поскольку образует с ними многочисленные соединения.
Применение кислорода в различных отраслях
Кислород используют в различных отраслях, причем в больших количествах (схема 9). В металлургии он ускоряет процесс выплавки стали и улучшает ее качество. Этот газ необходим в производстве многих химических соединений, используется в специальных устройствах для резки и сварки металлов (водородно-кислородные, ацетиленово-кислородные горелки). Баллоны, наполненные кислородом (рис. 66) или его смесью с инертным газом гелием, используют космонавты, военные летчики, пожарники, водолазы. Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания. С помощью сжиженного кислорода создают необходимые условия для сгорания горючего в космических ракетах.
Схема 9.Применение кислорода
Широко используется и кислород, входящий в состав воздуха. При его участии сгорает топливо на теплоэлектростанциях, горючее в двигателях автомобилей, обжигают металлические руды на заводах цветной металлургии.
Рис. 66. Баллон с кислородом
Во время сжигания топлива и горючего образуется и попадает в воздух значительное количество угарного (СО) и сернистого 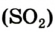
Биологическая роль кислорода
Кислород необходим живым существам для дыхания. Попадая через легкие в организм, этот газ соединяется с гемоглобином (компонент крови) и поступает во все органы и ткани. При участии кислорода происходят различные реакции. Некоторые из них сопровождаются выделением теплоты; благодаря этому поддерживается постоянная температура тела.
Выводы:
В природе атомы Оксигена в результате химических реакций постоянно переходят от одних веществ к другим; происходит круговорот этого элемента.
Кислород широко используется в промышленности, технике, медицине, а в составе воздуха — в теплоэнергетике, автотранспорте, других областях.
Кислород необходим живым существам. Попадая в организм во время дыхания, он принимает участие во многих химических реакциях. Кислород также является продуктом фотосинтеза.
Отравление угарным газом СО происходит потому, что он реагирует с гемоглобином, и поступление кислорода в организм прекращается.
Распространение кислорода в природе и его получение
Что происходит с вами, оставаясь в закрытом помещении, без воздуха? Какие газы и сколько процентов содержится в составе воздуха, которым мы дышим?
Общая характеристика:
Распространение кислорода в природе:
Кислород был открыт в 1772 году шведским ученым Карлом Шееле. Это самый распространенный в природе элемент. Примерно 49,4% массы земной коры приходится на долю кислорода. Кислород в атмосфере земного шара (по массе 23%, по объёму 21%) и в природных водах существует в растворённом виде.
Наличие кислорода в атмосферном воздухе впервые было установлено А.Лавуазье в 1774 году. Кроме кислорода в воздухе содержится 78% по объему и 75,5% по массе азота (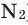
Кислород в виде соединений является основной составной частью почвы, воды, горных пород, руд, минералов. Он входит в состав всех живых организмов (растений, животных и т.д.). Приблизительно 65% человеческого тела составляет элемент кислород.
В природных соединениях встречается три изотопа 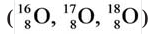
Французский химик. В 1774 году экспериментальным путем доказал состав воздуха.
Получение кислорода в лаборатории
Кислород получают в лаборатории в результате разложения воды под действием постоянного электрического тока:
В результате разложения нитрата калия. Впервые кислород был открыт К.Шееле в 1772 году в результате реакции разложения нитрата калия.
В результате разложения оксида ртути (II). В 1774 году кислород был получен английским ученым Джозефом Пристли путем нагревания оксида ртути (II) 
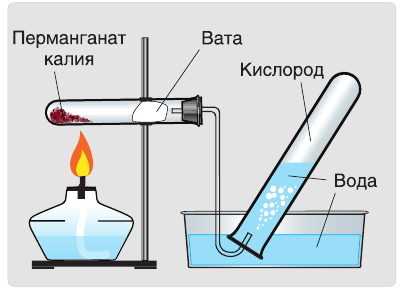
В настоящее время самыми удобными для получения кислорода в лабораторных условиях веществами являются известный в народе под названием «марганцовка» перманганат калия (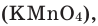
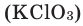
В результате разложения перманганата калия (рис. 1).
В результате разложения пероксида водорода 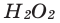
Вещества, которые ускоряют ход химических реакций, сохраняя при этом свое количество после реакции без изменения, называются катализаторами.
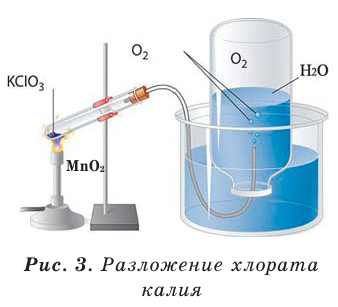
В результате разложения хлората калия (Бертолетова соль) при участии оксида марганца (IV) (рис. 3).
Без участия оксида марганца (IV) 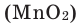
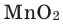
Получение кислорода в промышленности
В промышленности кислород в большом количестве получают при дистилляции сжиженного воздуха. Очистив воздух от пыли, влаги и углекислого газа, его сжижают путем сжатия под высоким давлением и охлаждения. Температуру сжиженного и охлажденного до — 200 


Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 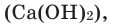
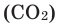
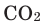
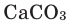
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (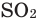
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (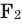
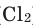
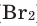
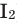
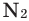
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (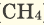
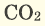
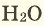
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода. Кроме того, в громадных количествах атмосферный кислород тратится при сжигании топлива, на процессы гниения, при вулканических извержениях (рис. 1).
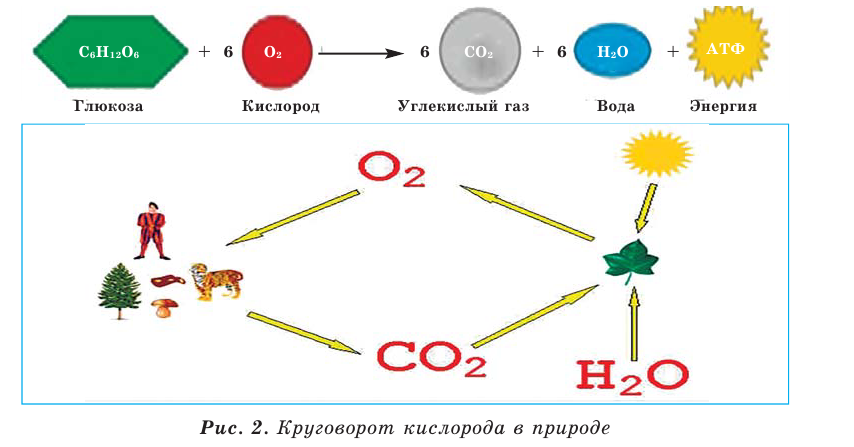
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Кислород — химический элемент и простое вещество
В периодической системе элементов кислород О расположен во втором периоде в VIА-группе. Кроме него в эту группу входят еще три неметалла — сера S, селен Se и теллур Te, а также один металл — полоний Po.
Кислород в природе
Кислород составляет почти половину массы земной коры (49 %). Он входит в состав самых разнообразных соединений: воды, оксидов, солей и т. д. Этот элемент является неотъемлемой частью живой материи — тканей растений и животных.
Основным источником кислорода на Земле является атмосферный воздух, в котором на долю кислорода приходится около 21 % по объему. Несмотря на колоссальные масштабы потребления кислорода (процессы горения, дыхания, промышленные потребности и т. д.), содержание 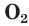
Процессы, происходящие в природе с участием кислорода, называются по-разному. Энергичное окисление с выделением тепла и света — горение, медленное окисление железа — ржавление, поглощение кислорода из воздуха живыми организмами — дыхание.
Строение атома кислорода
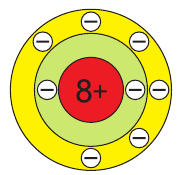
В атоме кислорода 8 электронов, которые располагаются на двух электронных слоях (рис. 44):
На внешнем электронном слое у атома кислорода находится 6 электронов, следовательно, до завершения этого слоя ему не хватает 2 электронов. Поэтому в своих
соединениях с металлами и водородом кислород обычно проявляет степень окисления, равную –2, как, например, в оксиде железа FeO. Кислород — второй по электроотрицательности химический элемент после фтора, поэтому только атомы фтора способны отнимать у него электроны. Положительную степень окисления +2 кислород проявляет только в соединении со фтором 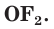
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 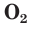
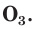
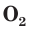
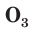
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности. Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов. Когда мы загораем на солнце, на нашу кожу падают «мягкие» ультрафиолетовые лучи, не способные принести вреда здоровью (если загорать в меру).
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 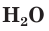
Химические свойства кислорода
Из-за высокой химической активности простое вещество кислород взаимодействует с большинством простых веществ и многими сложными веществами. Практически во всех своих реакциях кислород выступает в качестве окислителя.
Основными продуктами реакций кислорода с простыми веществами обычно являются оксиды. Окисление некоторых металлов происходит даже без нагревания, например:
Но для протекания большинства реакций кислорода с металлами требуется нагревание, иногда значительное.
При окислении кислородом неметаллов обычно выделяется большое количество теплоты, как, например, при горении углерода и водорода:
Кислород легко окисляет и многие сложные вещества. Например, известный вам из курса химии 7-го и 8-го классов оксид углерода(II) окисляется до углекислого газа:
При окислении сульфида цинка образуются два оксида — оксид цинка и оксид серы(IV):
Окисляются кислородом и органические вещества, например метан:
При этом, как правило, также образуются оксиды. Высокая окислительная способность кислорода является основой горения всех видов топлива.
С химическими свойствами озона вы познакомитесь в 11-м классе.
Применение кислорода и озона
Применение кислорода основано на его окислительных свойствах и свойстве поддерживать дыхание. Как окислитель он широко используется в металлургии, химической промышленности, других технологических процессах. Кислород применяют в качестве окислителя топлива в ракетных двигателях (рис. 47).
С участием кислорода совершается один из важнейших процессов жизнедеятельности живых организмов — дыхание. Окисление кислородом жиров, белков и углеводов служит источником энергии для живых организмов.
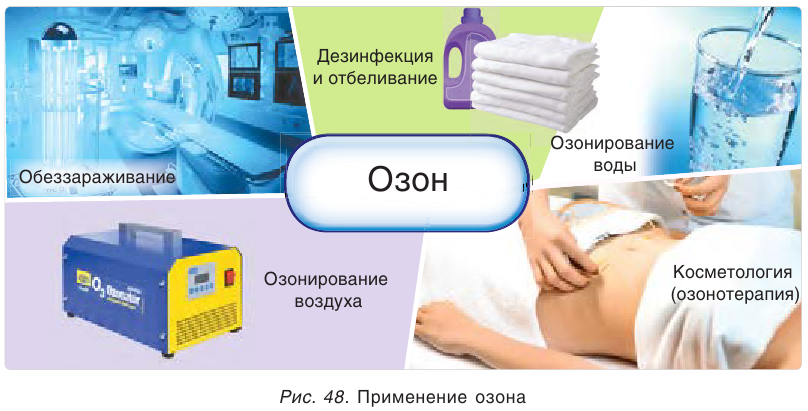
Озон используется для озонирования воздуха и питьевой воды, обезвреживания промышленных сточных вод, как дезинфицирующее средство в медицине, в качестве отбеливающего средства (рис. 48).
Атомы кислорода имеют на внешнем электронном слое по 6 электронов.
В соединениях с другими элементами кислород чаще всего проявляет степень окисления –2.
Известны две аллотропные модификации кислорода: кислород 
Кислород реагирует со многими простыми и сложными веществами.
Практически во всех реакциях кислород выступает в качестве окислителя.
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Озон как химический элемент
- Место химии в системе наук
- Перспективы химического производства
- Типы химических реакций в химии
- Атом в химии
Скачать материал

Скачать материал


- Сейчас обучается 410 человек из 62 регионов




- Сейчас обучается 266 человек из 63 регионов


Описание презентации по отдельным слайдам:
-
1 слайд
Активные формы кислорода. Антиоксидантная защитная система. Перекисное окисление липидов.
-
2 слайд
Свободные радикалы.
Химические соединения, имеющие высокую реакционную способность, благодаря наличию в составе одного или двух неспаренных электронов на внешней орбитали, называются свободными радикалами.
Радикал может образоваться в результате потери одного электрона или при получении одного электрона нерадикальной молекулой.Для биологических систем наиболее важны кислородные свободные радикалы (R.)
-
3 слайд
Кислородные свободные радикалы называют также активными формами кислорода (АФК)
Кислород, необходимый организму для функционирования (в ЦПЭ и многих других реакций), является одновременно и токсическим веществом, если из него образуются активные формы кислорода (АФК).
В норме в организме образуется около 2% АФК от всего кислорода, процесс образования идет спонтанно и подавить его трудно. -
4 слайд
Факторы, вызывающие образование АФК
-
5 слайд
Нейроденеративные процессы
СтарениеАФК
AO
система
ДЕФИЦИТ антиокси-дантов
Метаболические нарушения
ТоксикантыТяжелые металлы
ОКИСЛИТЕЛЬНЫЙ
С Т Р Е С С -
6 слайд
ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
Малоновый диальдегид
Перекисное окисление липидов (ПОЛ) является важной причиной накопления клеточных дефектов. Основным субстратом ПОЛ являются полиненасыщенные жирные кислоты, входящих в состав клеточных мембран, а также липопротеинов. Атака кислородными радикалами приводит к образованию гидрофобных радикалов. Образующиеся липидные радикалы, а также 4-гидроксиноненаль и малоновый диальдегид могут атаковать молекулы белков и нуклеиновых кислот. Альдегидные группы этих соединений образуют межмолекулярные сшивки, что сопровождается нарушением структуры макромолекул и их функций. -
7 слайд
ОКИСЛИТЕЛЬНЫЙ СТРЕСС И ДЕСТРУКЦИЯ КЛЕТКИ
-
8 слайд
К активным формам кислорода относят:
Основные АФК:
ОН – радикал, гидроксильный радикал;
О2- — супероксидный анион;
Н2О2 — пероксид водорода.
Важнейшими АФК также считаются :
— синглетный кислород (1О2),
— пергидроксил (НО2),
— гипохлорит анион (ClО-),
— пероксинитрат (ОNOО-). -
9 слайд
Как же образуются АФК?
АФК образуются в результате последовательного присоединения электронов к молекуле кислорода. Конечный продукт реакций – вода.
В ходе реакций образуются:
О2•- — супероксидный анион,
Н2О2 – пероксид водорода
НО• — гидроксильный радикал -
10 слайд
Источники электронов в клетках
Утечка электронов из ЦПЭ (убихинон) и непосредственное их взаимодействие с кислородом в митохондриях – основной путь образования АФК в клетках.
Утечка электронов из микросом за счет цитохрома Р- 450.
Превращение двухвалентного железа в трехвалентное в гемоглобине (реакция Фентона) и некоторые др. -
11 слайд
АФК наносят огромный вред организму т.к. очень легко вступают в химические реакции.
Для организма важно равновесие, образование не более 2% АФК.
Такая нестабильная частица, сталкиваясь с другими молекулами, «крадет» у них электрон, что существенно изменяет структуру этих молекул.
Пострадавшие молекулы стремятся отнять электрон у других «полноценных» молекул, вследствие чего развивается разрушительная цепная реакция, губительно действующая на живую клетку. -
-
13 слайд
Что происходит если нарушается равновесие между образование и тушением АФК. Высокий уровень АФК приводит к образования окислительного стресса (активируется ПОЛ), который может вызвать апоптоз клетки или некроз ткани.
Научно доказано что АФК повинны в развитии более 100 заболеваний, таких как: рак, атеросклероз, инфаркт, инсульт, ишемия, атеросклероз, заболевания нервной и иммунной систем и заболевания кожи. -
14 слайд
Повреждающие действие АФК
РАЗРУШЕНИЮ ПОДВЕРГАЮТСЯ:
1. Аминокислоты в белках (нарушается структура белков, между ними образуются ковалентные сшивки, эти белки гидролизуются)
2. Нуклеотиды в ДНК (окисление аденина и получение 8-гидроксиаденина, как следствие мутации)
3. Полиненасыщенные высшие жирные кислоты, входящие в состав липидов мембран клеток. -
15 слайд
АФК: повреждение белков
Свободнорадикальное окисление нарушает структуру белков.
В белках окисляются некоторые аминокислоты (лизин, аргинин и пролин) .
В результате разрушается структура белков, между ними образуются ковалентные «сшивки», всё это активирует протеолитические ферменты в клетке, гидролизующие повреждённые белки. -
-
17 слайд
АФК атакуют липиды мембраны клеток
В результате изменяются свойства мембраны:
Микровязкость
Выжигаются дыры в мембране
Изменяется проницаемость (набухание мембраны за счет утечки воды)
Изменяется ионный состав
Эти изменения нарушают жизнедеятельность клетки и приводят ее к гибели. -
18 слайд
Активные формы кислорода запускают процесс перекисного окисления липидов (ПОЛ)
Основным субстратом ПОЛ являются полиненасыщенные цепи жирных кислот (ВЖК), входящие в состав клеточных мембран, а также липопротеинов.
Их атака кислородными радикалами приводит к образованию гидрофобных радикалов, взаимодействующих друг с другом.
В результате атаки АФК жирных кислот изменяются свойства мембран (выжигаются дыры) и образуется конечный продукт малоновый диальдегид, который может вызывать денатурацию белков путем их сшивки. -
19 слайд
ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
Малоновый диальдегид
Перекисное окисление липидов (ПОЛ) является важной причиной накопления клеточных дефектов. Основным субстратом ПОЛ являются полиненасыщенные жирные кислоты, входящих в состав клеточных мембран, а также липопротеинов. Атака кислородными радикалами приводит к образованию гидрофобных радикалов. Образующиеся липидные радикалы, а также 4-гидроксиноненаль и малоновый диальдегид могут атаковать молекулы белков и нуклеиновых кислот. Альдегидные группы этих соединений образуют межмолекулярные сшивки, что сопровождается нарушением структуры макромолекул и их функций. -
20 слайд
ОКИСЛИТЕЛЬНЫЙ СТРЕСС И ДЕСТРУКЦИЯ КЛЕТКИ
-
21 слайд
Реакции ПОЛ являютсяя свободнорадикальными и постоянно протекают в клетки
-
22 слайд
Первая стадия – инициация образования свободного радикала
Вначале происходит атака сопряженных двойных связей ненасыщенных жирных кислот гидроксильным радикалом, что приводит к появлению липидных радикалов :
LH + НО* —- H2O + L*. -
23 слайд
Вторая стадия – развитие цепи
Липидный радикал может реагировать с О2 с образованием липоперокси радикала, который, в свою очередь, взаимодействует с новыми молекулами ненасыщенных жирных кислот и приводит к появлению липидных пероксидов, которые достаточно стабильны при температуре тела:
L* + O2—— LOО*
LOО* + LH ——- LOOH + L*. -
24 слайд
Третья стадия- разрушение структуры липидов
Образующиеся липидные радикалы , а также малоновый диальдегид (МДА), могут атаковать молекулы белков и нуклеиновые кислоты. Альдегидные группы этих соединений образуют межмолекулярные сшивки, что сопровождается нарушением структуры макромолекул и дезорганизует их функционирование. -
25 слайд
Образование МДА и сшивок между белками за счет МДА
-
26 слайд
Обрыв цепи — взаимодействие радикалов между собой:
LOO• + L• → LOOH + LH
L• + vit E → LH + vit E•
vit E• + L• → LH + vit Еокисл.
Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму. -
27 слайд
АФК выполняют полезные функции.
Активные формы кислорода необходимы организму, они участвуют во многих физиологических процессах, выполняя полезные функции:
1. Бактерицидную, лейкоциты с участием АФК разрушают фагоцитированные клетки бактерий, НАДФН-оксидаза нейтрофилов;
2. Иммунную — активирование иммунной реакции в лейкоцитах;
3. Регуляторную (сигнальные молекулы), до конца механизм не изучен. -
28 слайд
В организме существует система защиты клеток от АФК (система тушения АФК ) или Антиоксидантная система (АОС)
Антиоксиданты — это молекулы,
которые способны блокировать
реакции свободнорадикального
окисления, восстанавливая
разрушенные соединения.
Антиоксидантная система (АОС) включает:
1. Ферменты антиоксидантного действия;
2. Витамины, обладающие антиоксидантным действием.
3. Биофлавоноиды ( рутин, кверцетин, цитрин, гесперидин, аскорутин), серосодержащие аминокислоты (глютатион, цистеин, метионин), цитохром С, микроэлементы — селен, цинк и др. -
-
30 слайд
Ферменты антиоксидантного действия: супероксиддисмутаза (СОД), каталаза и глутатионпероксидаза.
СОД и каталаза образуют антиоксидантную пару, которая борется со свободными радикалами кислорода, не давая им возможности запустить процессы цепного окисления.
Глутатионпероксидаза обезвреживает липидные перекиси, обрывая тем самым цепное перекисное окисление липидов. Для работы глутатионпероксидазы необходим селен. -
31 слайд
Угроза для клеток со стороны активных радикалов устраняется действием ряда ферментов.
СОД катализирует дисмутацию супероксида в кислород и пероксид водорода. Таким образом, она играет важнейшую роль в антиоксидантной защите практически всех клеток, так или иначе находящихся в контакте с кислородом.
Каталаза предотвращает накопление в клетке перекиси водорода.
В печени, почках, нейтрофильных лейкоцитах обнаруживается пероксидазная активность. -
32 слайд
Витамины, обладающие антиоксидантным действием
1. Витамины группы Е (токоферолы)
2. Аскорбиновая кислота (витамин С)
3. Ретинол (витамин А) и β-каротин (провитамин А)
Антиоксиданты работают хорошо только тогда, когда они работают в группе, поддерживая друг друга.
Например: Витамин Е — главный прерыватель реакций окисления липидов, расходуется и видоизменяется в этих реакциях. Если рядом с ним находится витамин С, то он его восстанавливает и вводит в строй. -
33 слайд
Витамин Е ингибирует свободнорадикальное окисление путем отдачи электрона, что приводит к инактивации радикала липида. Витамин Е превращается в стабильное соединение.
-
-
35 слайд
Пероксидазы, каталазы, оксигеназы и оксидазы относятся к классу ферментов — оксидоредуктаз
Оксигеназы — это ферменты, катализирующие активирование О2 и последующее включение 1 (монооксигеназы) или 2 (диоксигеназы) его атомов в молекулы различных субстратов.
Если субстратом (акцептором О2) служит водород, фермент называют оксидазой.
В этом смысле оксидазы можно рассматривать как специализированный класс оксигеназ.
Оксигеназы участвуют во внемитохондриальном окислении. -
36 слайд
Понятие об оксидазном и оксигеназном типе окисления
80% кислорода используется на оксидазный тип – это первый тип окисления, т.е. когда атом кислорода восстанавливается 2 электронами, или молекула кислорода 4-мя электронами. Например: супероксиддисмутаза и оксидазы аминокислот.
20% О2 используется на оксигеназный тип окисления, идет по 2 путям – монооксигеназному и диоксигеназному. Монооксигеназный путь происходит в митохондриях и микросомах.
В митохондриях происходит гидроксилирование (при участии НАДФН2, ).
В микросомальном окислении участвует мультиферментная мембраносвязанная система, включающая НАДФН2, особые ФП и цхР450. -
37 слайд
Биологическое значение окисления по оксидазному типу:
Окисляются трудноокисляемые циклические вещества;
Быстрая инактивация БАВ — биологически активных веществ;
Образующаяся Н2О2 оказывает бактерицидное действие — разрушает клеточные мембраны фагоцитированных бактериальных клеток.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 147 269 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
- 21.11.2020
- 1172
- 6
- 20.11.2020
- 780
- 5
- 18.11.2020
- 111
- 0
- 04.11.2020
- 468
- 0
- 18.10.2020
- 178
- 4
- 10.08.2020
- 132
- 0
- 06.08.2020
- 260
- 0
- 26.07.2020
- 838
- 2
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Педагогическая риторика в условиях реализации ФГОС»
-
Курс повышения квалификации «Основы местного самоуправления и муниципальной службы»
-
Курс профессиональной переподготовки «Экскурсоведение: основы организации экскурсионной деятельности»
-
Курс профессиональной переподготовки «Клиническая психология: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Организация логистической деятельности на транспорте»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС юридических направлений подготовки»
-
Курс повышения квалификации «Этика делового общения»
-
Курс повышения квалификации «Использование активных методов обучения в вузе в условиях реализации ФГОС»
-
Курс повышения квалификации «Источники финансов»
-
Курс повышения квалификации «Финансовые инструменты»
-
Курс профессиональной переподготовки «Гостиничный менеджмент: организация управления текущей деятельностью»
-
Курс профессиональной переподготовки «Техническая диагностика и контроль технического состояния автотранспортных средств»
-
Курс профессиональной переподготовки «Информационная поддержка бизнес-процессов в организации»
-
Курс профессиональной переподготовки «Стандартизация и метрология»
Статья на конкурс «био/мол/текст»: Долгое время активные формы кислорода считались вредными побочными продуктами обмена веществ. За последнее десятилетие, однако, учёные показали, что живые организмы не только могут использовать активный кислород в своих целях, но и целенаправленно его вырабатывают. Возникает вопрос: нужно ли бороться с активными формами кислорода с помощью антиоксидантов?
Вот уже много лет производители продуктов питания и косметики твердят о пользе для нашего здоровья антиоксидантов. В связи с этим в головах людей прочно укрепляется точка зрения, что эти чудодейственные вещества являются своего рода панацеей от многих болезней и даже предотвращают процесс старения. Однако недавние исследования показывают, что всё не так однозначно, как считалось ранее.
Со времён изобретения сине-зелёными бактериями кислородного фотосинтеза [1] мы живём в чрезвычайно агрессивной окислительной среде. Правда, сам по себе кислород не очень страшен для нас, живых организмов, поскольку, чтобы пошла реакция окисления, необходимо преодолеть высокий энергетический барьер (или, говоря другими словами, нас нужно было бы поджечь). Однако иногда в процессах неполного окисления кислород превращается в так называемые активные формы (АФК), и тогда эти молекулы становится поистине страшным окислителем, взаимодействуя с любой органикой, встретившейся на пути: белками, жирами, углеводами, нуклеиновыми кислотами… И в наших клетках ежесекундно вырабатываются тысячи таких молекул — как побочные продукты дыхания, реакций синтеза и распада биомолекул.
К счастью, в нашем организме предусмотрены системы защиты от нежелательного окисления. Существуют специальные ферменты, занимающиеся нейтрализацией активных форм кислорода и их восстановлением до воды. Окислительные повреждения белков и ДНК, которые ещё можно обратить, восстанавливаются специальными ферментами репарации, а молекулы, подвергнувшиеся необратимым изменениям, уничтожаются. Таким образом, наш организм наделён природными антиоксидантами и способен сам постоять за себя.
Но иногда антиоксидантные системы организма дают сбой, и тогда активные формы кислорода могут причинить ощутимый урон. Опасность заключается ещё и в том, что процесс накопления окислительных повреждений обладает положительной обратной связью: повреждения молекул, отвечающих за регуляцию выработки и деградации АФК, порождают ещё большее увеличение содержания АФК в клетке. Так, известно, что при старении, травмах и некоторых заболеваниях (например, болезнях Альцгеймера и Паркинсона) повышается уровень окислительных повреждений в мозге [2], [3].
В свете сказанного понятно, почему врачи и фармацевты возлагают большие надежды на использование природных и синтетических антиоксидантов для лечения (или хотя бы облегчения протекания) болезней, сопровождающихся окислительными повреждениями тканей. И действительно, исследования на модельных животных показали, что использование антиоксидантов способствует смягчению симптомов некоторых заболеваний и даже может увеличивать среднюю продолжительность жизни. Так, в лаборатории академика В.П. Скулачёва были получены искусственные антиоксиданты, широко известные под названием «ионы Скулачёва» и способные встраиваться в мембраны митохондрий — одного из основных источников активных форм кислорода в клетке. С помощью этих антиоксидантов удалось обратить вспять некоторые вызванные старением нарушения у лабораторных животных [4].
И всё же, за последний десяток лет отношение учёных к активным формам кислорода кардинально изменилось. Всё началось с открытия в клетках иммунной системы фермента NADPH-оксидазы, единственная функция которого — осуществлять продукцию активных форм кислорода для борьбы с патогенными организмами. С его помощью макрофаги «поливают» нежелательных гостей токсичными молекулами супероксида, пероксида водорода, гипохлорита и др. в ходе так называемого «окислительного взрыва». Каково же было удивление учёных, когда этот фермент и ещё целых шесть его «родственников» (изоформ) были обнаружены практически во всех тканях организма!
Сейчас известно, что активные формы кислорода участвуют в регуляции многих процессов в клетке, влияя на скорость деления клеток и дифференцировку, а также на другие клеточные функции. Некоторая ирония заключается в том, что развитию «полезных» функций АФК способствовали свойства, следующие из его токсичности — высокая способность взаимодействовать с биомолекулами и наличие систем для его быстрого разрушения в клетке. Иными словами, активный кислород можно использовать как сигнальный маяк, быстро включая или выключая по необходимости. Таким образом, наш организм научился извлекать выгоду даже из такого, казалось бы, «вредного» побочного продукта, как активные формы кислорода.
Как же осуществляется такая регуляция? Для слаженной работы нашего организма клеткам необходимо обмениваться между собой информацией посредством гормонов, факторов роста и других специальных молекул. Эти вещества узнаются и связываются белками-рецепторами, о чём последние извещают клетку с помощью целого каскада ферментативных реакций. Особую роль в этих процессах играет осуществляемая специальными ферментами — киназами [5], [6] — реакция фосфорилирования белков. Она заключается в том, что к некоторым аминокислотным остаткам белка — тирозину и серину — присоединяется фосфатная группа, что приводит к его активации или, наоборот, подавлению активности. Этому процессу противостоит реакция дефосфорилирования, осуществляемая ферментами-фосфатазами и вызывающая в точности обратное действие. Баланс этих двух реакций и определяет уровень активности регулируемого белка в клетке. Например, инсулин — гормон, отвечающий за регуляцию потребления глюкозы клетками, — связывается с инсулиновыми рецепторами, находящимися на поверхности практически всех клеток организма, что приводит к появлению тирозинкиназной активности рецептора. Это запускает цепочку ферментативных процессов, в результате которых на мембране клеток увеличивается число белков-переносчиков глюкозы, и потребление клеткой глюкозы увеличивается [7].
Оказалось, что активные формы кислорода способны обратимо окислять остатки цистеина в каталитических участках некоторых фосфатаз и подавлять их активность. Это приводит к смещению уровня фосфорилированности регулируемых ими белков, что, конечно, влияет на передаваемый клетке сигнал. Так, выделение активных форм кислорода было зафиксировано при связывании клеточными рецепторами инсулина, и было показано, что подавление их продукции добавлением антиоксидантов ослабляет действие гормона на клетку [7].
В многочисленных исследованиях было показано, что активные формы кислорода участвуют в синтезе некоторых соединений (например, тиреоидных гормонов), регуляции подвижности клеток соединительных тканей, роста сосудов и нервных окончаний и т.д.
Ещё один совсем недавно открытый эффект — участие АФК в регуляции процессов в мозге, лежащих в основе обучения и памяти. Как известно, основная функция нервных клеток — получать и передавать электрические сигналы посредством межклеточных контактов — синапсов. Именно здесь определяется, будет ли входящий с другого нейрона электрический сигнал передан дальше следующим нейронам, или же он пропадёт бесследно. При этом мозг — динамичная структура, причём в нём не только постоянно образуются новые и рассасываются ненужные клеточные контакты, но и проводимость самих синапсов может меняться [8]. Без этих процессов мы не смогли бы обучиться никаким навыкам или, например, запомнить сведения, приведённые в данной статье.
Так вот, на клеточных культурах, а потом и в исследованиях на модельных животных было показано, что активные формы кислорода не только влияют, но и необходимы для регулирования проводимости синапсов. Так, чрезмерная продукция антиоксидантных белков в мыши приводила к развитию когнитивных нарушений у этих животных [9].
Рисунок 1. Механизм регуляции сигнальных каскадов пероксидом водорода. Активация различных клеточных рецепторов активирует NADPH-оксидазу, выделяющую пероксид водорода. Он, в свою очередь, инактивирует тирозин-фосфатазы и активирует тирозин-киназы, регулируя тем самым степень фосфорилирования многих клеточных ферментов и, следовательно, их активность.
* * *
Таким образом, за последние десятилетия активный кислород превратился в глазах учёных из опасного побочного продукта в важный компонент сигнальных путей клетки. В связи с этим и нам нужно пересмотреть свое отношение к антиоксидантам как к безусловно полезным веществам, которых чем больше — тем лучше. Антиоксидантов, получаемых с потреблением свежих фруктов и овощей, вполне достаточно для ежедневных нужд организма. А к активному использованию антиоксидантов в медицине надо относиться внимательно, имея в виду возможные побочные эффекты при чрезмерном подавлении продукции активных форм кислорода.
- Волонтер фотосинтеза;
- Marina S. Hernandes, Luiz R.G. Britto. (2012). NADPH Oxidase and Neurodegeneration. Current Neuropharmacology. 10, 321-327;
- Cynthia A. Massaad, Eric Klann. (2011). Reactive Oxygen Species in the Regulation of Synaptic Plasticity and Memory. Antioxidants & Redox Signaling. 14, 2013-2054;
- V. P. Skulachev. (2007). A biochemical approach to the problem of aging: “Megaproject” on membrane-penetrating ions. The first results and prospects. Biochemistry Moscow. 72, 1385-1396;
- Рецептор «нетрадиционной ориентации»;
- Mark A. Lemmon, Joseph Schlessinger. (2010). Cell Signaling by Receptor Tyrosine Kinases. Cell. 141, 1117-1134;
- Barry J. Goldstein, Kalyankar Mahadev, Xiangdong Wu, Li Zhu, Hiroyuki Motoshima. (2005). Role of Insulin-Induced Reactive Oxygen Species in the Insulin Signaling Pathway. Antioxidants & Redox Signaling. 7, 1021-1031;
- Элементы: «Какой же вклад протеинкиназа M-дзета вносит в формирование памяти?»;
- Dick Jaarsma, Elize D. Haasdijk, J.A.C. Grashorn, Richard Hawkins, Wim van Duijn, et. al.. (2000). Human Cu/Zn Superoxide Dismutase (SOD1) Overexpression in Mice Causes Mitochondrial Vacuolization, Axonal Degeneration, and Premature Motoneuron Death and Accelerates Motoneuron Disease in Mice Expressing a Familial Amyotrophic Lateral Sclerosis Mutant SOD1. Neurobiology of Disease. 7, 623-643;
- S. G. Rhee. (2006). CELL SIGNALING: H2O2, a Necessary Evil for Cell Signaling. Science. 312, 1882-1883.

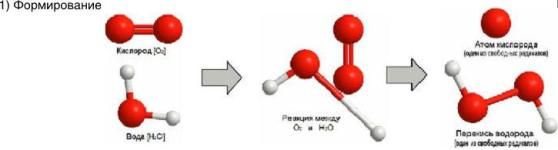
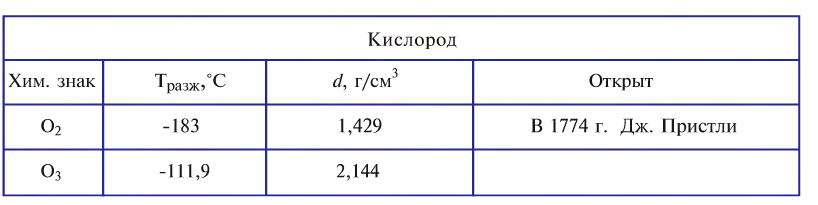
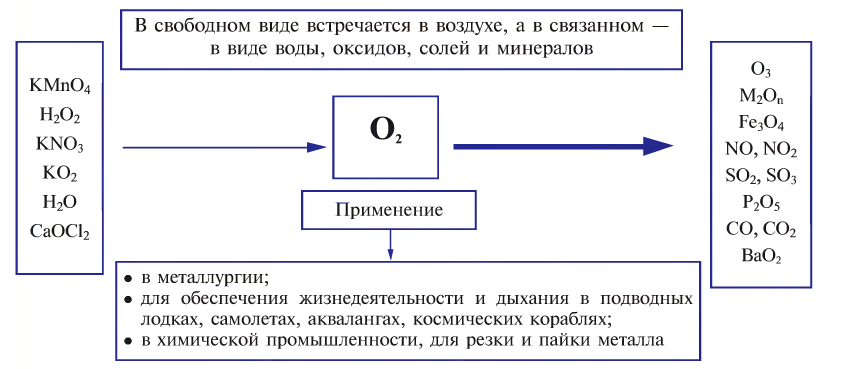
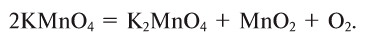
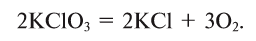
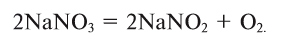
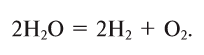

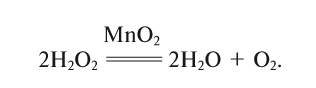
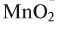

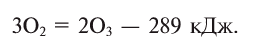
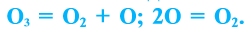
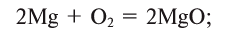
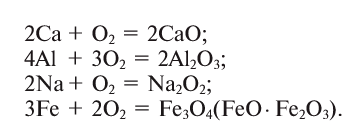
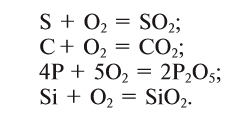
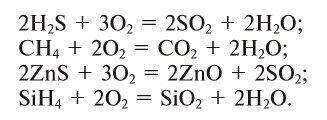

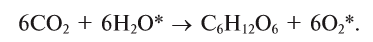
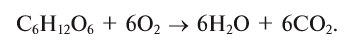
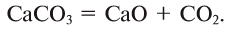
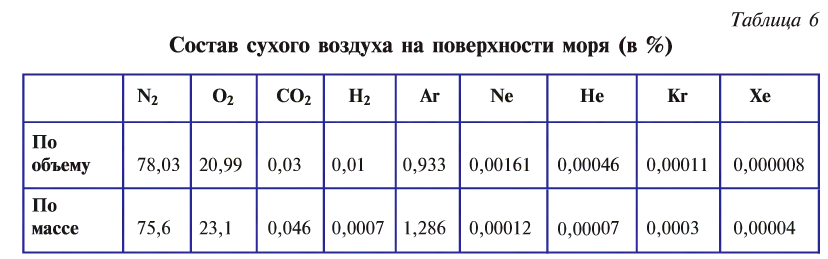


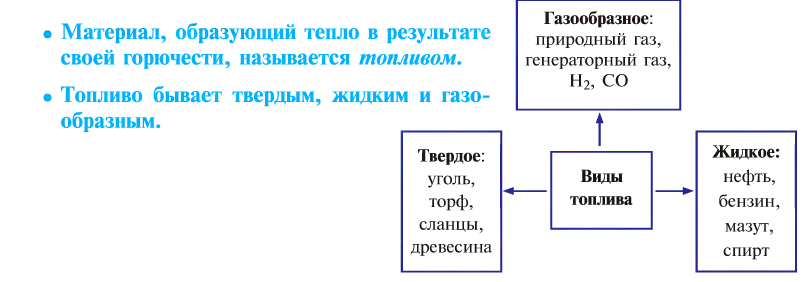
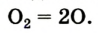
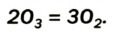
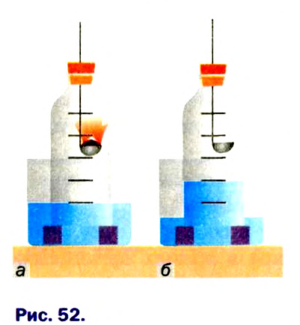

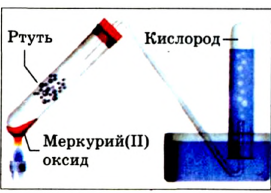
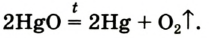
 (бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)
(бытовое название — марганцовка; вещество является распространенным дезинфицирующим средством)