|
Медь / Cuprum (Cu) |
|
|---|---|
| Атомный номер |
29 |
| Внешний вид простого вещества | пластичный металл золотисто-розового цвета
|
| Свойства атома | |
| Атомная масса (молярная масса) |
63,546 а. е. м. (г/моль) |
| Радиус атома |
128 пм |
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 3d10 4s1 |
| Химические свойства | |
| Ковалентный радиус |
117 пм |
| Радиус иона |
(+2e) 72 (+1e) 96 пм |
| Электроотрицательность (по Полингу) |
1,90 |
| Электродный потенциал |
+0,337 В/ +0,521 В |
| Степени окисления |
2, 1 |
| Термодинамические свойства простого вещества | |
| Плотность |
8,96 г/см³ |
| Удельная теплоёмкость |
24,465 Дж/(K·моль) |
| Теплопроводность |
401 Вт/(м·K) |
| Температура плавления |
1356,6 K |
| Теплота плавления |
13,01 кДж/моль |
| Температура кипения |
2840 K |
| Теплота испарения |
304,6 кДж/моль |
| Молярный объём |
7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Период решётки |
3,615 Å |
| Отношение c/a |
n/a |
| Температура Дебая |
315,00 K |
Медь — химический элемент с атомным номером 29 в периодической системе, обозначается символом Cu (лат. Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Физические свойства
- 4 Химические свойства
- 4.1 Соединения
- 4.2 Соединения меди(I)
- 4.3 Аналитическая химия меди
- 5 Применение
- 5.1 В электротехнике
- 5.2 Теплообмен
- 5.3 Для производства труб
- 5.4 Наиболее распространённые сплавы — бронза и латунь
- 5.5 Ювелирные сплавы
- 5.6 Соединения меди
- 5.7 Другие сферы применения
- 6 Биологическая роль
- 6.1 Токсичность
- 6.2 Бактерицидность
- 6.3 Органолептические свойства
- 7 Производство, добыча и запасы меди
- 8 Ссылки
- 9 Примечания
История и происхождение названия
Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, Меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два различных варианта распада с различными продуктами.
Плотность — 8,94*10³ кг/м³
Удельная теплоёмкость при 20 °С — 390 Дж/кг*К
Удельное электрическое сопротивление при 20-100 °С — 1,78·10-8 Ом·м
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
Хорошо проводит тепло. На воздухе покрывается оксидной плёнкой.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu20 имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl—(водн.) → [CuCl]— (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]—. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления. В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широкораспространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь самый широкоупотребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди применять для транспортировки ацетилена можно только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в кровельном деле. Кровли из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4]
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учереждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[1]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) [6] официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [7]. Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. [2][3]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [2], на долю России приходилось 3.2 % общих и 3.1 % подтверждённых мировых запасов [2]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 1,009 тыс. тонн, потребление — 714 тыс. тонн[4]. Основными производителями меди в России являются:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
Как добывают медь Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Нашли однажды самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н.э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Большая часть добываемой меди используется в электротехнике, потому что медь обладает высокой электропроводностью, уступая в этом только серебру, которое, конечно, намного дороже. Миллионы километров проводов опутали земной шар, и большинство из них медные. Медь нужна для производства двигателей, телевизоров, телефонных аппаратов, различных электроприборов, автомобилей, электровозов, холодильников и даже музыкальных инструментов. Ее используют в химической промышленности для борьбы с вредителями садов и огородов, для подкормки растений и животных. Всюду нужна медь. По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Медь в месторождениях
- Российский Центр Меди
- Некоммерческий ресурс о меди (eng)
- Химия в действии, М. Фримантл, том 2, изд. «Мир», М. 1991
Примечания
- ↑ [1]
- ↑ 1 2 3 http://www.ecsocman.edu.ru/db/msg/142462.html
- ↑ http://www.metalinfo.ru/ru/news/12150
- ↑ Минпромэнерго РФ, «Стратегия развития металлургической промышленности Российской Федерации на период до 2015 года» [2]
Wikimedia Foundation.
2010.
Медь
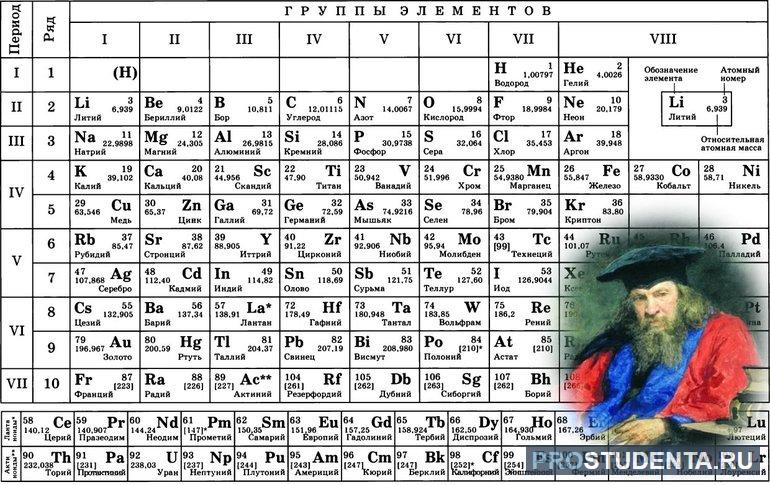
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
- Способы получения
- Химические свойства
Оксид меди (I)
- Химические свойства
Гидроксид меди (II)
- Химические свойства
Соли меди
Медь
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии:
+29Cu 1s22s22p63s23p63d104s1 1s 2s
2p
3s 3p
4s
3d
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
Видеоопыт взаимодействия сульфата меди (II) с железом можно посмотреть здесь.
- Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами. При этом образуется голубой осадок гидроксида меди(II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
Видеоопыт взаимодействия меди с серой можно посмотреть здесь.
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Но, обратите внимание:
2Cu + I2 = 2CuI
Видеоопыт взаимодействия меди с хлором можно посмотреть здесь.
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
Cu + H2 ≠
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2 + O2 = (CuOH)2CO3
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
Видеоопыт взаимодействия меди с соляной кислотой можно посмотреть здесь.
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением гидроксида меди (II) при 200°С:
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2 → CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например, соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl + 2NH3
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например, при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя:
Cu2O + CO = 2Cu + CO2
Cu2O + H2 = 2Cu + H2O
3Cu2O + 2Al = 6Cu + Al2O3
А под действием окислителей, например, кислорода — свойства восстановителя:
2Cu2O + O2 = 4CuO
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например, хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H2SO4(конц.гор.) = 4CuSO4 + 2I2 + H2S + 4H2O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.гор.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
Соли меди (II) также окисляют сульфиты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой. При нагревании возможно образование сульфата меди (II):
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2 + 4H2O
Еще одна форма этой реакции:
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Электролиз раствора нитрата меди (II):
2Cu(NO3)2 + 2Н2О → 2Cu + O2 + 4HNO3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH)2CO3 → 2CuO + CO2 + H2O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.

9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Ответы и решения
1.
CuCl2 Cu + Сl2
на катоде на аноде
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
2.
CuCl2 = Cu + Сl2
на катоде на аноде
Cu + S = CuS
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3.
NaNO3(тв.) + H2SO4(конц.) = HNO3 + NaHSO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
2NaNO3 = 2NaNO2 + O2↑
4.
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
Cu(OH)2 = CuO + H2O
CuO + C Cu + CO
6. Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7. Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
8. (CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
9.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
10.
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3CuO + 2NH3 = 3Cu + N2 + 3H2O
11.
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + H2 = Cu + H2O
12.
Cu + Cl2 = CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
13.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
CuO + H2 = Cu + H2O
14.
2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15.
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16.
2Cu + I2 = 2CuI
2CuI + 4H2SO4 = 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
17.
2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
18.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20.
Fe + 2HCl = FeCl2 + H2
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
21.
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
22.
Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
3CuO + 2NH3 = 3Cu + N2 + 3H2O
23.
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24.
CuO + CO = Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
.
25.
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
26.
H2C2O4 = CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
CuO + CO = Cu + CO2
27.
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
| Медь | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Никель | Цинк → | ||||||||||||||||||||
|
||||||||||||||||||||
| Внешний вид простого вещества | ||||||||||||||||||||

Самородная медь |
||||||||||||||||||||
| Свойства атома | ||||||||||||||||||||
| Название, символ, номер | Медь/Cuprum (Cu), 29 | |||||||||||||||||||
| Группа, период, блок |
11 (устар. 1), 4, d-элемент |
|||||||||||||||||||
| Атомная масса (молярная масса) |
63,546(3)[1] а. е. м. (г/моль) | |||||||||||||||||||
| Электронная конфигурация |
[Ar] 3d104s1 1s22s22p63s23p63d104s1 |
|||||||||||||||||||
| Радиус атома | 128 пм | |||||||||||||||||||
| Химические свойства | ||||||||||||||||||||
| Ковалентный радиус | 117 пм | |||||||||||||||||||
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм | |||||||||||||||||||
| Электроотрицательность | 1,90 (шкала Полинга) | |||||||||||||||||||
| Электродный потенциал | +0,337 В/ +0,521 В | |||||||||||||||||||
| Степени окисления | 0; +1; +2; +3; +4 | |||||||||||||||||||
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) | |||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||
| Плотность (при н. у.) | 8,92 г/см³ | |||||||||||||||||||
| Температура плавления | 1356,55 K (1083,4 °С) | |||||||||||||||||||
| Температура кипения | 2567 °С | |||||||||||||||||||
| Уд. теплота плавления | 13,01 кДж/моль | |||||||||||||||||||
| Уд. теплота испарения | 304,6 кДж/моль | |||||||||||||||||||
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) | |||||||||||||||||||
| Молярный объём | 7,1 см³/моль | |||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||
| Структура решётки | Кубическая гранецентрированая | |||||||||||||||||||
| Параметры решётки | 3,615 Å | |||||||||||||||||||
| Температура Дебая | 315 K | |||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||
| Теплопроводность | (300 K) 401 Вт/(м·К) | |||||||||||||||||||
| Наиболее долгоживущие изотопы | ||||||||||||||||||||
|
Основная статья: Изотопы меди
|
Медь (химический символ — Cu, от лат. Cuprum) — химический элемент 11-й группы (по устаревшей классификации — побочной подгруппы первой группы, IB) четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29.
В виде простого вещества медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки).
C давних пор широко используется человеком.
История
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк[3]. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий[4].
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопках. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
-
- [math]displaystyle{ mathsf{2CO + (CuOH)_2CO_3 rightarrow 2Cu + 3CO_2 + H_2O} }[/math]
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной. Монета имела хождение по всему западному побережью Южной Америки, в том числе и в государстве Инков[5].
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике[6].
Происхождение названия
Латинское название меди Cuprum (древнелат. aes cuprium, aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется χαλκός, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди aes (санскр. ayas, готск. aiz, нем. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках: ст.‑слав. *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово[7][8]. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа — через посредство греч. Μηδία[9]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл»[9].
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра[10], и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской[10][11]. С Гумёшевским рудником Полевского, — крупнейшим в XVIII−XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломлённым народным сознанием образом богини Венеры[10].
Нахождение в природе
Среднее содержание меди в земной коре (кларк) — (0,78-1,5)·10−4[12]% (по массе)[2]. В морской и речной воде содержание меди гораздо меньше: 3·10−7 % и 10−7 % (по массе) соответственно[2].
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[13].
Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[14].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[15] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5—58 МСм/м[16]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры.
Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = [math]displaystyle{ 8,52cdot10^{28} }[/math] (атом/м³).
Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа[17].
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
- Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырьё содержит 0,5—2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400 °C :
- [math]displaystyle{ mathsf{ 2CuFeS_2 + O_2 longrightarrow Cu_2S + 2FeS + SO_2uparrow } }[/math]
- [math]displaystyle{ mathsf{ 2FeS + 3O_2 longrightarrow 2FeO + 2SO_2uparrow } }[/math]
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
- [math]displaystyle{ mathsf{ FeO + SiO_2 longrightarrow FeSiO_3 } }[/math]
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
- [math]displaystyle{ mathsf{ 2Cu_2S + 3O_2 longrightarrow 2Cu_2O + 2SO_2 } }[/math]
- [math]displaystyle{ mathsf{ 2Cu_2O + Cu_2S longrightarrow 6Cu + SO_2 } }[/math]
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкислённого раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
- Также чистую медь можно получить и в процессе экзотермической реакции восстановления оксида меди водородом:
- [math]displaystyle{ mathsf{ CuO + H_2 uparrow longrightarrow Cu + H_2O + Quparrow} }[/math]
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
- [math]displaystyle{ mathsf{ CuSO_4 + Fe longrightarrow Cudownarrow + FeSO_4 } }[/math]
Электролизный метод
Электролиз раствора сульфата меди:
- [math]displaystyle{ mathsf{ CuSO_4 rightleftarrows Cu^{2+}+ SO_4^{2-} } }[/math]
- [math]displaystyle{ mathsf{ K^{-}: Cu^{2+}+ 2e longrightarrow Cu^{0} } }[/math]
- [math]displaystyle{ mathsf{ A^{+}: 2H_2O — 4e longrightarrow O_2 + 4H^{+} } }[/math]
- [math]displaystyle{ mathsf{ 2CuSO_4 + 2H_2O longrightarrow 2Cudownarrow + O_2uparrow +2H_2SO_4 } }[/math]
Химические свойства
Возможные степени окисления
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
- [math]displaystyle{ mathsf{ 2Cu + H_2O + CO_2 + O_2 longrightarrow (CuOH)_2CO_3downarrow } }[/math]
Реагирует с концентрированной холодной серной кислотой:
- [math]displaystyle{ mathsf{ Cu + H_2SO_4 longrightarrow CuO + SO_2uparrow + H_2O } }[/math]
С концентрированной горячей серной кислотой:
- [math]displaystyle{ mathsf{ Cu + 2H_2SO_4 longrightarrow CuSO_4 + SO_2uparrow + 2H_2O } }[/math]
С безводной горячей серной кислотой:
- [math]displaystyle{ mathsf{ 2Cu + 2H_2SO_4 xrightarrow{200^oC} Cu_2SO_4downarrow + SO_2uparrow + 2H_2O} }[/math]
C разбавленной серной кислотой при нагревании в присутствии кислорода в воздухе:
- [math]displaystyle{ mathsf{ 2Cu + 2H_2SO_4 + O_2 xrightarrow{t^circ } 2CuSO_4 + 2H_2O} }[/math]
С концентрированной азотной кислотой:
- [math]displaystyle{ mathsf{ Cu + 4HNO_3 longrightarrow Cu(NO_3)_2 + 2NO_2uparrow + 2H_2O} }[/math]
С разбавленной азотной кислотой:
- [math]displaystyle{ mathsf{ 3Cu + 8HNO_3 longrightarrow 3Cu(NO_3)_2 + 2NOuparrow + 4H_2O} }[/math]
С «царской водкой»:
- [math]displaystyle{ mathsf{ 3Cu + 2HNO_3 + 6HCl longrightarrow 3CuCl_2 + 2NOuparrow + 4H_2O} }[/math]
С концентрированной горячей соляной кислотой:
- [math]displaystyle{ mathsf{ 2Cu + 4HCl longrightarrow 2H[CuCl_2] + H_2uparrow} }[/math]
C разбавленной соляной кислотой в присутствии кислорода:
- [math]displaystyle{ mathsf{ 2Cu + 4HCl + O_2longrightarrow 2CuCl_2 + 2H_2O} }[/math]
C разбавленной соляной кислотой в присутствии перекиси водорода:
- [math]displaystyle{ mathsf{ Cu + 2HCl + H_2O_2{} longrightarrow CuCl_2 + 2H_2O} }[/math]
С газообразным хлороводородом при 500—600 °C:
- [math]displaystyle{ mathsf{ 2Cu + 4HCl + O_2 xrightarrow{500-600^oC} 2CuCl_2 + 2H_2O } }[/math]
С бромоводородом:
- [math]displaystyle{ mathsf{ 2Cu + 4HBr longrightarrow 2H[CuBr_2] + H_2uparrow} }[/math]
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
- [math]displaystyle{ mathsf{ 2Cu + 4CH_3COOH + O_2longrightarrow [Cu_2(H_2O)_2(CH_3COO)_4]} }[/math]
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
- [math]displaystyle{ mathsf{ Cu xrightarrow{NH_3cdot H_2O, O_2} [Cu(NH_3)_2]OHrightleftarrows [Cu(NH_3)_4](OH)_2} }[/math]
Окисляется до оксида меди(I) при недостатке кислорода при температуре 200 °C и до оксида меди(II) при избытке кислорода при температурах порядка 400—500 °C:
- [math]displaystyle{ mathsf{ 4Cu + O_2 xrightarrow{200^oC} 2Cu_2O} }[/math]
- [math]displaystyle{ mathsf{ 2Cu + O_2 xrightarrow{400-500^oC} 2CuO} }[/math]
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
- [math]displaystyle{ mathsf{ Cu + Cl_2longrightarrow CuCl_2} }[/math]
- [math]displaystyle{ mathsf{ Cu + Br_2longrightarrow CuBr_2} }[/math]
- [math]displaystyle{ mathsf{ Cu + S xrightarrow{CS_2} CuS} }[/math]
С йодом (йодида меди(II) не существует):
- [math]displaystyle{ mathsf{ 2Cu + I_2longrightarrow 2CuI} }[/math]
При 300—400 °C реагирует с серой и селеном:
- [math]displaystyle{ mathsf{ 2Cu + S xrightarrow{300-400^oC} Cu_2S} }[/math]
- [math]displaystyle{ mathsf{ 2Cu + Se xrightarrow{300-400^oC} Cu_2Se} }[/math]
C оксидами неметаллов:
- [math]displaystyle{ mathsf{ 4Cu + SO_2 xrightarrow{600-800^oC} Cu_2S + 2CuO} }[/math]
- [math]displaystyle{ mathsf{ 2Cu + 2NO xrightarrow{500-600^oC} 2CuO + N_2uparrow} }[/math]
- [math]displaystyle{ mathsf{ 4Cu + 2NO_2 xrightarrow{500-600^oC} 4CuO + N_2uparrow} }[/math]
- [math]displaystyle{ mathsf{ Cu + 2N_2O_4 xrightarrow{80^oC, CH_3-COO-CH_2-CH_3} Cu(NO_3)_2 + 2NOuparrow} }[/math]
С концентрированной соляной кислотой и хлоратом калия:
- [math]displaystyle{ mathsf{ 6Cu + 12HCl + KClO_3longrightarrow 6H[CuCl_2] + KCl + 3H_2O} }[/math]
С хлоридом железа(III):
- [math]displaystyle{ mathsf{ Cu + 2FeCl3{} longrightarrow CuCl_2 + 2FeCl2{}} }[/math]
Вытесняет менее активные металлы из их солей:
- [math]displaystyle{ mathsf{ Cu + 2AgNO3{} longrightarrow 2Ag + Cu(NO3{})2{}} }[/math]
Соединения меди(I)
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы.
Также присутствую не растворимые в воде комплексы(например, дихлорокупрат(I)-ион [CuCl2]− устойчив:
-
- [math]displaystyle{ mathsf{CuCl + Cl^- rightarrow [CuCl_2]^-} }[/math])
Следует обратить внимание на то, что сульфат меди(I) нестабилен Он мгновенно разлагается и переходит в устойчивый сульфат меди(II).
- Большинство соединений имеют белую окраску либо бесцветны.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
-
- [math]displaystyle{ mathsf{2Cu^+ rightarrow Cu^{2+} + Cudownarrow} }[/math]
Примером диспропорционирования может служить реакция оксида меди(I) с разбавленной серной кислотой:
-
- [math]displaystyle{ mathsf{Cu_2O + H_2SO_4 rightarrow CuSO_4 + Cudownarrow + H_2O} }[/math]
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета, который
разлагается при температуре 1800°С:
-
- [math]displaystyle{ mathsf{ 2Cu_2O xrightarrow{1800^oC} 4Cu +O_2 } }[/math]
Можно восстановить до элементарной меди:
-
- [math]displaystyle{ mathsf{ Cu_2O + H_2 xrightarrow {260^oC} 2Cu + H_2O } }[/math]
- [math]displaystyle{ mathsf{ Cu_2O + C xrightarrow {260^oC} 2Cu + CO } }[/math]
- [math]displaystyle{ mathsf{ Cu_2O + CO xrightarrow {250-300^oC} 2Cu + CO_2 } }[/math]
Также протекает процесс алюминотермии:
-
- [math]displaystyle{ mathsf{ 3Cu_2O + 2Al xrightarrow {1000^oC} 6Cu + Al_2O_3 } }[/math]
Реагирует с концентрированными растворами щелочей:
-
- [math]displaystyle{ mathsf{ Cu_2O + H_2O + 2OH^{-} rightarrow 2[Cu(OH)_2]^{-} } }[/math]
С концентрированной соляной кислотой:
-
- [math]displaystyle{ mathsf{ Cu_2O + 4HCl rightarrow 2H[CuCl_2] + H_2O} }[/math]
С разбавленными галоген кислотами(Hal = Cl, Br, I):
-
- [math]displaystyle{ mathsf{ Cu_2O + 2HHal rightarrow 2CuHal +H_2O } }[/math]
С разбавленной соляной кислотой в присутствии кислорода:
-
- [math]displaystyle{ mathsf{ 2Cu_2O + 8HCl + O_2 rightarrow 4CuCl_2 + 4H_2O } }[/math]
С концентрированной азотной кислотой:
-
- [math]displaystyle{ mathsf{ Cu_2O + 6HNO_3 rightarrow 2Cu(NO_3)_2 + 2NO_2 + 3H_2O } }[/math]
С концентрированной серной кислотой:
-
- [math]displaystyle{ mathsf{ Cu_2O + 3H_2SO_4 rightarrow 2CuSO_4 + SO_2 + 3H_2O } }[/math]
С разбавленной серной кислотой:
-
- [math]displaystyle{ mathsf{ Cu_2O + H_2SO_4 rightarrow CuSO_4 + Cu + H_2O } }[/math]
С гидросульфитом натрия:
-
- [math]displaystyle{ mathsf{ 2Cu_2O + 2NaHSO_3 rightarrow 4Cu + Na_2SO_4 + H_2SO_4 } }[/math]
С аммиаком:
-
- [math]displaystyle{ mathsf{ 3Cu_2O + 2NH_3 xrightarrow {250^oC} 2Cu_3N + 3H_2O } }[/math]
С раствором аммиака:
-
- [math]displaystyle{ mathsf{ Cu_2O + 4NH_3*H_2O rightarrow 2[Cu(NH_3)_2]OH + 3H_2O } }[/math]
С азотистоводородной кислотой в разных условиях при охлаждении:
-
- [math]displaystyle{ mathsf{ Cu_2O + 5HN_3 xrightarrow {10-15^oC} 2Cu(N_3)_2 + H_2O + NH_3 + N_2 } }[/math]
- [math]displaystyle{ mathsf{ Cu_2O + 2HN_3 xrightarrow {20-25^oC} 2CuN_3 + H_2O } }[/math]
С серой:
-
- [math]displaystyle{ mathsf{ 2Cu_2O + 3S xrightarrow {610^oC} 2Cu_2S + SO_2 } }[/math]
С Сульфидом меди(I):
-
- [math]displaystyle{ mathsf{ 2Cu_2O + Cu_2S xrightarrow {1200-1300^oC} 6Cu + SO_2 } }[/math]
С кислородом:
-
- [math]displaystyle{ mathsf{ 2Cu_2O + O_2 xrightarrow {500^oC} 4CuO } }[/math]
С хлором:
-
- [math]displaystyle{ mathsf{ Cu_2O + Cl_2 xrightarrow {250^oC} 2Cu_2OCl_2 } }[/math]
С оксидами щелочных металлов(Ме = Li, Na, K, Rb, Cs):
-
- [math]displaystyle{ mathsf{ Cu_2O + Me_2O xrightarrow {600-800^oC} 2MeCuO } }[/math]
С оксидом бария:
-
- [math]displaystyle{ mathsf{ Cu_2O + BaO xrightarrow {500-600^oC} Ba(CuO)2 } }[/math]
Соответствующий гидроксид CuOH (жёлтого цвета) разлагается при темперауре 100°С с образованием оксида меди(I).
-
- [math]displaystyle{ mathsf{ 2CuOH xrightarrow{100^oC} Cu_2O + H_2O} }[/math]
Гидроксид CuOH проявляет основные свойства.
-
- [math]displaystyle{ mathsf{ CuOH + 2HCl rightarrow H[CuCl_2] + H_2O } }[/math]
Также реагирует с раствором аммиака:
-
- [math]displaystyle{ mathsf{ CuOH + xNH_3*H_2O rightarrow Cu(NH_3)_x(OH) + xH_2O } }[/math]
Реагирует с гидроксидом калия:
-
- [math]displaystyle{ mathsf{ CuOH + KOH rightarrow K[Cu(OH)_2] } }[/math]
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует оксид CuO чёрного цвета, который разлагается при температуре 1100 °С:
-
- [math]displaystyle{ mathsf{ 4CuO xrightarrow{1100^oC} 2Cu_2O + O_2} }[/math]
Реагирует с раствором аммиака с образованием Реактива Швейцера:
-
- [math]displaystyle{ mathsf{ CuO + 4NH_3*H_2O rightarrow [Cu(NH_3)_4](OH)_2 + 3H_2O } }[/math]
- [math]displaystyle{ mathsf{ CuO + 4NH_3 + H_2O rightarrow [Cu(NH_3)_4](OH)_2 } }[/math]
Растворяется в концентрированных щелочах с образованием комплексов:
-
- [math]displaystyle{ mathsf{ CuO + 2OH^- +H_2O rightarrow [Cu(OH)_4]^{2+} } }[/math]
При сплавлении с щелочами образуются купраты металлов:
-
- [math]displaystyle{ mathsf{ CuO + 2KOH xrightarrow K_2CuO_2 + H_2O} }[/math]
С азотной кислотой:
-
- [math]displaystyle{ mathsf{ CuO + 2HNO_3 rightarrow Cu(NO_3)_2 + H_2O } }[/math]
Реагирует с йодоводородной кислотой с образованием йодида меди(I), так как йодида меди(II) не существует:
-
- [math]displaystyle{ mathsf{ 2CuO + 4HI rightarrow 2CuI + I_2 + 2H_2O } }[/math]
Протекают процессы магниетермии и алюминотермии:
-
- [math]displaystyle{ mathsf{ CuO + Mg rightarrow Cu + MgO } }[/math]
- [math]displaystyle{ mathsf{ 3CuO + 2Al rightarrow 3Cu + Al_2O_3 } }[/math]
Также можно восстановить до элементарной меди следующими способами:
-
- [math]displaystyle{ mathsf{ CuO + H_2 rightarrow Cu + H_2O } }[/math]
- [math]displaystyle{ mathsf{ CuO + C rightarrow Cu + CO } }[/math]
- [math]displaystyle{ mathsf{ CuO + CO rightarrow Cu + CO_2 } }[/math]
Оксид меди(II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соответствующий гидроксид Cu(OH)2 (голубого цвета), который при длительном стоянии разлагается, переходя в оксид меди(II) чёрного цвета:
-
- [math]displaystyle{ mathsf{ Cu(OH)_2 rightarrow CuO + H_2O} }[/math]
Также в избытке влаги возможно окисление меди, и переход в гидроксид куприла, в котором степень окисления меди +3:
-
- [math]displaystyle{ mathsf{ 4Cu(OH)_2 +O_2 rightarrow 4CuO(OH) + 2H_2O} }[/math]
При нагревании до 70 °С разлагается:
-
- [math]displaystyle{ mathsf{ Cu(OH)_2 xrightarrow{70^oC} CuO + H_2O} }[/math]
Реагирует с растворами концентрированных щелочей с образованием гидроксокомплексов синего цвета (это подтверждает преимущественно основный характер Cu(OH)_2):
-
- [math]displaystyle{ mathsf{ Cu(OH)_2 + OH^- rightarrow [Cu(OH)_4]^{2+}} }[/math]
С образованием солей меди(II) растворяется во всех кислотах(в том числе кислотах окислителях) кроме йодоводородной:
-
- [math]displaystyle{ mathsf{Cu(OH)_2 + H_2SO_4rightarrow CuSO_4 + 2H_2O} }[/math]
- [math]displaystyle{ mathsf{Cu(OH)_2 + HNO_3rightarrow Cu(NO_3)_2 + 2H_2O} }[/math]
- [math]displaystyle{ mathsf{Cu(OH)_2 + 2HClrightarrow CuCl_2 + 2H_2O} }[/math]
Реакция с йодоводородной кислотой отличается тем, что образуется йодид меди(I), так как йодида меди(II) не существует:
-
- [math]displaystyle{ mathsf{2Cu(OH)_2 + 4HIrightarrow 2CuI + I_2 + 4H_2O} }[/math]
Реакция с водным раствором аммиака является из важных в химии, так как образуется реактив Швейцера (растворитель целлюлозы):
-
- [math]displaystyle{ mathsf{Cu(OH)_2 + 4NH_3*H_2O rightarrow [Cu(NH_3)_4](OH)_2 + H_2O} }[/math]
- [math]displaystyle{ mathsf{Cu(OH)_2 + 4NH_3 rightarrow [Cu(NH_3)_4](OH)_2} }[/math]
Также суспензия гидроксида меди реагирует с углекислым газом с образованием дигидроксокарбонатом меди(II):
-
- [math]displaystyle{ mathsf{ 2Cu(OH)_2 + CO_2 rightarrow (CuOH)_2CO_3 + H_2O } }[/math]
Большинство солей двухвалентной меди имеют синюю или зелёную окраску.
При растворении солей меди(II) в воде образуются голубые аквакомплексы [Cu(H2O)6]2+.
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга).
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды
Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Оксид меди(III) не получен. Под этим названием описаны различные купраты(III).
Гексафторкупраты(III) и (IV) получают действием фтора на соли меди и щелочных металлов при нагревании под давлением. Они бурно реагируют с водой и являются сильными окислителями.
Комплексы меди(III) с ортопериодатами и теллуратами относительно стабильны и предложены как окислители в аналитической химии. Описано много комплексов меди(III) с аминокислотами и пептидами.
Аналитическая химия меди
Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цвет
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок.
- В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724—0,0180 мкОм·м/[16]), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[18].
Самое частое применение меди — электротехника
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[19], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы
Сплавы на основе меди
Латунная игральная кость, рядом цинк и слиток меди
Статуэтка, отлитая из бронзы
В разнообразных областях техники широко используются сплавы с использованием меди,
самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь.
Оба сплава являются общими названиями для целого семейства материалов,
в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы.
Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия.
Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди.
Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Медь и её сплавы с латунью и бронзой обладают высокой коррзионой стойкостью, электро- и теплопроводностью, антифрикционными показателями. При этом медь хорошо сваривается и обрабатывается резанием. [20]
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[21].
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Сплавы, в которых медь значима
Повреждённая пожаром дюралевая деталь дирижабля Гинденбург (LZ 129)
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия-бария-меди (купрата) YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников.
Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за того, что медь является катализатором полимеризации ацетилена (образует соединения меди с ацетиленом), трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[22].
Медь может быть использована для снижения переноса инфекции в лечебных учреждениях через поверхности, к которым прикасается рука человека. Из меди могут быть изготовлены ручки дверей, водозапорной арматуры, перила, поручни кроватей, столешницы.[23]
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм[24].
Также медь применяется в пиротехнике для окрашивания в синий цвет.[источник не указан 842 дня]
Стоимость
В январе 2008 года, впервые за всю историю, на Лондонской бирже металлов цены на медь превысили 8000 долларов США за тонну. В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на ЛБМ. Цена достигла пика в почти 10,2 тыс. долларов в феврале 2011 года[25].
На 2011 год стоимость меди составляла около 8900 долларов за тонну[26]. Вследствие кризиса мировой экономики цена на большинство видов сырья упала, и стоимость 1 тонны меди на 1 сентября 2016 не превышала 4700 долларов[27]. В мае 2021 цена меди взлетела до 10307$ за тонну на бирже.[28]
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[29].
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 1 мг/л (СанПиН 2.1.4.1074-01), однако недостаток меди в питьевой воде также нежелателен. Всемирная организация здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[30].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[30]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно.
В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[31] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[32]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/H1N1 (т. н. «свиной грипп»)[33].
Органолептические свойства
Излишняя концентрация ионов меди придаёт воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[34][35]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы[34], на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[34]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. т, потребление — 591,4 тыс. т[36].
Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[37].
Мировое производство меди в 2007 году составляло[38] 15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были:
Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
США (1,170/1,310),
Перу (1,190/1,220),
Китай (0,946/1,000),
Австралия (0,870/0,850),
Россия (0,740/0,750),
Индонезия (0,797/0,650),
Канада (0,589/0,590),
Замбия (0,520/0,560),
Казахстан (0,407/0,460),
Польша (0,452/0,430),
Мексика (0,347/0,270).
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Выплавка меди в 2019 ожидается 25,5 млн т[39]
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Современные способы добычи
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили). В зависимости от глубины залегания, руда добывается открытым или закрытым методом.[40]
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её растворения в слабом растворе серной кислоты и последующего выделения металлической (черновой) меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C.
С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит раствор серной кислоты с медным купоросом. В ходе электролиза происходит повышение концентрации серной кислоты. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[41].
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в карьере медного рудника.
См. также
- Бронза
- Купраты
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 2,0 2,1 2,2 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
- ↑ Спиридонов, 1989, с. 5—8.
- ↑ Спиридонов, 1989, с. 20—22.
- ↑ Waldemar Espinoza Soriano. Etnohistoria ecuatoriana: estudios y documentos (исп.). — Quito: Abya-Yala, 1988. — С. 135.
- ↑ Спиридонов, 1989, с. 172.
- ↑ Этимологический словарь славянских языков, том 18. — М.: Наука, 1993. — С. 144−146.
- ↑ Откупщиков Ю. В. Очерки по этимологии. — СПб.: Издательство Санкт-Петербургского университета. — 2001. — С. 127−130.
- ↑ 9,0 9,1 медь // Этимологический словарь русского языка = Russisches etymologisches Wörterbuch : в 4 т. / авт.-сост. М. Фасмер ; пер. с нем. и доп. чл.‑кор. АН СССР О. Н. Трубачёва, под ред. и с предисл. проф. Б. А. Ларина [т. I]. — Изд. 2-е, стер. — М. : Прогресс, 1986—1987.
- ↑ 10,0 10,1 10,2 Перфильев А. В. Герб и символы Полевского // Полевской край: Историко-краеведческий сборник. — Екатеринбург : Уралтрейд, 1998. — Вып. 1, № 3. — (Уральское краеведение).
- ↑ Официальные символы Архивная копия от 15 октября 2016 на Wayback Machine, на сайте Администрации Полевского городского округа
- ↑ Григорьев Н.А. Распределение химических элементов в верхней части континентальной коры / отв. ред. д.г.-м.н. Сазонов В.Н.. — Екатеринбург: УрО РАН, 2009. — С. 36. — 383 с. — ISBN isbn 978-5-7691-2038-1.
- ↑ Медь самородная — статья из Большой советской энциклопедии.
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны) (недоступная ссылка). Дата обращения: 29 ноября 2010. Архивировано 19 июня 2010 года.
- ↑ при 20 °С: 394,279 Вт/(м·К), то есть 0,941 кал/(см·сек·°С)
- ↑ 16,0 16,1 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- ↑ Применение меди Архивная копия от 14 сентября 2010 на Wayback Machine (недоступная ссылка с 21-05-2013 [3575 дней] — история, копия)
- ↑ ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа. Технические условия. Дата обращения: 24 июля 2008. Архивировано 14 сентября 2008 года.
- ↑ Грудев А. П., Машкин Л. Ф., Ханин М. И. Технология прокатного производства. — М.: Металлургия, 1994. — С. 441. — 656 с. — ISBN 5-229-00838-5.
- ↑ Смирягин А. П., Смирягина Н. А., Белова А. В. Промышленные цветные металлы и сплавы. — 3-е изд. — Металлургия, 1974. — С. 321—488.
- ↑ СП 31-116-2006 Проектирование и устройство кровель из листовой меди. Дата обращения: 25 декабря 2009. Архивировано 8 ноября 2009 года.
- ↑ Hannah Bloch. A Copper Bedrail Could Cut Back On Infections For Hospital Patients. Дата обращения: 11 ноября 2020. Архивировано 8 ноября 2020 года.
- ↑ Исаев А. А. Лазер на парах меди. Дата обращения: 6 января 2015. Архивировано 4 марта 2016 года.
- ↑ Цены на сырьё упали до самого низкого уровня со времен кризиса 2008 г. / Новости / Finance.UA. Дата обращения: 26 апреля 2015. Архивировано 6 октября 2014 года.
- ↑ Цена меди. Дата обращения: 28 мая 2011. Архивировано 1 апреля 2013 года.
- ↑ Графики цены меди за различные периоды. Дата обращения: 1 сентября 2016. Архивировано 29 августа 2016 года.
- ↑ Цена на медь достигла рекордно высокого значения в ходе торгов — Экономика и бизнес — ТАСС. Дата обращения: 13 сентября 2021. Архивировано 13 сентября 2021 года.
- ↑ Медь и рост человека // Наука и жизнь. — М.: «Правда», 1990. — № 1. — С. 17.
- ↑ 30,0 30,1 CHEMICAL FACT SHEETS (англ.). Дата обращения: 29 декабря 2009. Архивировано 22 августа 2011 года.
- ↑ US EPA. Дата обращения: 25 июля 2008. Архивировано 29 сентября 2015 года.
- ↑ В США наблюдается вспышка инфекции MRSA за пределами госпиталей. Дата обращения: 25 июля 2008. Архивировано 12 октября 2008 года.
- ↑ British Scientist Shares Expertise on Swine Flu Control in Beijing (недоступная ссылка). Дата обращения: 11 января 2010. Архивировано 23 сентября 2012 года.
- ↑ 34,0 34,1 34,2 Производство меди. Дата обращения: 17 ноября 2007. Архивировано 5 октября 2008 года.
- ↑ В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии
- ↑ Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года (недоступная ссылка). Минпромэнерго РФ (18 марта 2009). Дата обращения: 29 декабря 2009. Архивировано 18 октября 2010 года.
- ↑ Металлонвест оплатил лицензию за Удокан
- ↑ MINERAL COMMODITY SUMMARIES 2009. Дата обращения: 30 сентября 2009. Архивировано 6 августа 2011 года.
- ↑ Мировой рынок столкнется с дефицитом меди в 2019 году — Ведомости. Дата обращения: 10 марта 2020. Архивировано 24 июня 2020 года.
- ↑ Способы и места добычи меди. promzn.ru. Дата обращения: 25 августа 2018. Архивировано 26 августа 2018 года.
- ↑ Получение меди. Дата обращения: 29 января 2011. Архивировано 11 февраля 2011 года.
Литература
- Данные на начало XX века:. Медь // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Спиридонов А. А. В служеньи ремеслу и музам. — 2-е изд. — М.: Металлургия, 1989. — 176 с. — (Научно-популярная библиотека школьника). — 50 000 экз. — ISBN 5-229-00355-3.
- Фримантл М. Химия в действии. — М.: «Мир», 1991. — Т. 2.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. — «Химия», 2000. — С. 286.
- Максимов М. М., Горнунг М. Б. Очерк о первой меди. — М.: Недра, 1976. — 96 с. — 40 000 экз.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Российский Центр Меди, некоммерческий
- Медь в месторождениях
- Некоммерческий ресурс о меди (eng)
Медь
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
История и происхождение названия
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков производят русское слово медь (польск. miedz, чешск. med) от древненемецкого smida (металл) и Schmied (кузнец, англ. Smith). Конечно, родство корней в данном случае несомненно, однако, оба эти слова произведены от греч. рудник, копь независимо друг от друга. От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь венера (Venus). В более древние времена встречается название марс (Mars).
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра).
Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Химические свойства
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20-40 % железа, 22-25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4 — 99,4 % меди, 0,01 — 0,04 % железа, 0,02 — 0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0 — 99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5-12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Источник: Википедия
Другие заметки по химии
Медь и ее сплавы издавна применяются повсеместно. Этот элемент обладает удивительными свойствами, необходимыми для промышленности, производства, а работы печени, нервной системы человека. Легко поддается обработке, хорошо проводит электричество, не подвергается внешним агрессивным факторам.
Оглавление
- История открытия
- Медь в таблице Менделеева
- Строение атома меди
- Физические свойства
- Химические свойства
- Медь в природе
- Применение
История открытия
Металл был открыт в глубокой древности. Из него делали украшения, орудия труда, посуду, другие бытовые предметы. Найденные медные украшения произведены примерно в 8 веке до н. э. Название элемента происходит от места его добычи – острова Кипра. В древнегреческой мифологии есть легенда, что этот металл сама Афродита подарила людям.
Для повышения прочности меди, ее расплавляли, соединяли с другими веществами. Так в 3 веке до н. э. появилась бронза. Сам металл и его сплавы использовали для создания:
- оружия;
- доспехов;
- посуды;
- зеркал.
Постепенно добыча увеличивалась, медь стали применять в разных сферах промышленности. В 19 веке была начата промышленная выплавка. В этом же столетии открыли электричество, а медные провода и сопутствующие детали стали важными составляющими этого процесса.
Медь в таблице Менделеева
Располагается в 1 группе, 4 периода таблицы. Имеет 29 порядковый номер. Атомная масса – 63,54. На латыни элемент звучит как Cu («cuprum»).
Степени окисления +1 и +2. Атомы имеют валентность 4,3,2,1, что говорит о способности образовывать новые химические связи.
Строение атома меди
Атом состоит из положительного ядра, в котором:
- 29 протонов;
- 35 нейтронов.
По четырем орбитам вокруг располагаются 29 электронов.
Молекулярное уравнение меди имеет вид: 1s22s22p63s23p63d104s1. У элемента гранецентрированная решетка в форме куба.
Оксид меди
Физические свойства
Медь имеет золотистый цвет с легким розовым оттенком. Это мягкий, пластичный металл, который можно вытягивать и обрабатывать, формируя разные изделия. Обладает высокой теплопроводностью, электропроводностью.
Свойства:
- необходимая температура меди для кипения – 2567 градусов;
- плавление меди происходит при 1084 градусах.
Хорошо выдерживает:
- ультрафиолет;
- перепады температур;
- обладает коррозийной стойкостью.
Медь способна намагничиваться против направления магнитного поля. Благодаря уникальным свойствам, используется во всех сферах промышленности и производства. Сплавы прочные и качественные, имеют низкие коэффициенты трения, не подвергаются воздействиям внешней среды.
Химические свойства
При взаимодействии с водой и углекислым газом этот элемент окисляется, на нем образуется защитная пленка. Просто с водой не вступает в реакцию.
При нагревании образуются следующие соединения меди:
- с кислородом, образуя двухвалентное 2CuO;
- с серой – сульфид CuS;
- с галогенами – йодид CuCl2;
- растворяясь в азотной кислоте, получается нитрат меди, оксид азота;
- при смешивании с серной, азотной кислотами, медь проявляет восстановительные реакции, образует соли;
- при реакции соляной кислотой образуется трихлорокупрат водорода;
- окислительные реакции проходят при воздействии оксида азота, хлорида железа.
Водород, углерод, кремний, азот не вступают в реакции с медью.
Получают этот металл из минералов, руд при помощи:
- нагревания сульфидных руд – методом пирометаллургическим;
- вытеснения этого элемента из минералов, разбавленных в серной кислоте – методом гидрометаллургическим.
Взаимодействия меди с кислотами, щелочами и другими сложными веществами образуют новые химические соединения.
Медь в природе
Этот элемент присутствует в земной коре, пресной, морской воде, но в небольших количествах. Может быть самородком, но также встречается в соединениях. Месторождения самородной меди находятся в:
- США;
- России;
- Чили;
- Казахстане.
Содержится в животных организмах и растениях. Во взрослом человеке около 100 граммов. Металл поступает в тело с едой, так как находится в:
- морепродуктах;
- фруктах;
- овощах;
- злаках;
- кисломолочных изделиях и других продуктах питания.
Активно участвует в процессах обмена, нормализует работу нервной системы, способствует повышению гемоглобина, стимулирует выработку коллагена, укрепляет иммунитет, стенки сосудов, а также регулирует работу печени.
При недостатке элемента в организме могут возникнуть такие патологии:
- анемия;
- невриты;
- глаукома;
- псориаз;
- остеопороз;
- бронхиальная астма.
Избыток вызывает интоксикацию, негативно влияет на работу печени.
Применение
Благодаря своим уникальным свойствам, медь применяется в разных сферах промышленности:
- Чистую используют для создания проводов, кабелей, способных хорошо проводить ток. Проволока – самый пластичный материал из этого металла.
- В приборостроении применяют сплавы этого элемента, которые стойки к коррозии.
- В машиностроении, химическом производстве используют соединения с латунью, так как они имеют повышенную прочность.
- В металлургии – для получения сплавов бронзы, мельхиора.
- В ювелирном производстве соединяют этот элемент с золотом, повышая прочность ювелирных изделий.
- Делают радиаторы отопления, кондиционирования, так как элемент обладает хорошей теплопроводностью.
- В сельскохозяйственной сфере используется в качестве удобрения для почвы, так как металл способствует синтезу микроэлементов (крахмала, белков, витаминов).
- В металлургической промышленности – для хромирования, никелирования поверхностей.
- В строительстве – для создания громоотводов, листов кровли, конструкций, деталей, которые отличаются прочностью, устойчивостью к влаге.
- Оксид используется для пигмента стекол, керамики, глазури и эмали.
- В текстильной промышленности соединения применяют для окрашивания тканей, а также при производстве шелка.
- Монеты изготавливаются из этого металла.
- В кованном деле – для создания заборов, оград, кованых предметов, скульптур.
- В медицине – для лечения конъюнктивита, ожогов.
- В военной промышленности из металла делают гильзы.
- В судостроении элемент необходим для обшивки корпусов судов.
- Духовые музыкальные инструменты также выполнены из этого металла.
- Трубы из меди используют в водопроводах, газопроводах.
- Применяется в гальванопластике, когда необходимо создать копию предмета.
- В искусстве на медных пластинах делают гравюры, тиснения, узоры.
- В аэрокосмической промышленности многие детали производятся из сплавов этого элемента. Например, ранее в дирижаблях дюралевые детали были изготовлены из него.
- Некоторые соединения применяют в батареях, аккумуляторах.
На медных поверхностях не задерживаются бактерии, поэтому металл используют для покрытия поверхностей в общественных местах (ручки дверей, перила, столешницы и другие). Бактерицидные свойства элемента способны снизить заболеваемость населения. Более того, выяснено, что он дезактивирует передачу штамма свиного гриппа.
В народной медицине настаивают воду на меди. Она используется для лечений заболеваний желудка, печени и почек, воспалительных процессов, для замедления старения.
Цианид
Медь – красивый, мягкий металл с уникальными свойствами, известный еще до нашей эры, необходим для организма человека и для разных сфер промышленности. Раньше из него делали украшения, оружия, посуду. Он хорошо подвергается обработке, не поддается влиянию коррозии и ультрафиолета. Долго сохранят внешний вид и прочность, не портится. В чистом виде необходим при построении электрических приборов, а сплавы из него применяют в металлургической промышленности.
Медь содержится в продуктах питания и оказывает положительное влияние на организм человека. Ее недостаток вызывает болезни, а избыток негативно влияет на работу печени. Она необходима при борьбе с вредителями и для удобрения растений. А какие интересные факты о меди знаете вы? Напишите в комментариях. Поделитесь статьей в социальных сетях и сохраните ее в закладках.
О меди, как о первом металле полученным человеком и о ее свойствах можно посмотреть в видео.
Источники:
- https://ru.wikipedia.org/wiki/Медь
- https://cuprum-metall.ru/informatsiya/med/
- http://met-all.org/cvetmet-splavy/med/fizicheskie-i-himicheskie-svojstva-medi.html
Строение веществ и их переходы из одного состояния в другое изучает химия. В первую очередь для успешного понимания науки нужно выучить названия и произношение химических элементов. Существует общепринятая система классификации. Её первоначальный вариант разработал русский учёный Дмитрий Иванович Менделеев, назвав свой свод периодической таблицей. Всего же на начало 2019-го года известно 118 элементов.
Оглавление:
- Классификация химических веществ
- Правильное произношение
- Названия популярных элементов
- Чтение формул и символов
Классификация химических веществ
Вещество состоит из различных частиц. В его состав входят электроны, нейтроны и протоны. Взаимосвязи элементарных зарядов образуют атомы. В свою очередь, из них формируются молекулы и кристаллы. Из-за особенностей строения кристаллической решётки — основы вещества — тела могут находиться в твёрдом, жидком или газообразном состоянии. При этом они могут переходить из одной фазы в другую.
Каждому состоянию тела присущ набор свойств. Это характеристики, определяющие индивидуальность вещества, позволяя их отличать друг от друга.
Из наиболее интересных можно отметить: температуру плавления и кипения, строение кристаллической решётки, плотность, термодинамические и фазовые характеристики.
Вещества могут не только изменять свои агрегатные состояния, но и взаимодействовать между собой, образовывая новые соединения. Впервые классифицировать тела попробовал Д. И. Менделеев.
Его периодическая таблица, составленная им с 1869 года по 1871 год, строилась на отличии атомного веса (массы). В современном варианте его система видоизменилась. Так было выполнено сведение веществ в двумерную таблицу, в которой столбцы определяют главные физико-химические свойства, а строки являются периодами, в определённой мере подобными друг другу.
Каждый элемент, внесённый в таблицу, имеет свою историю открытия. Учёные, исследуя то или иное вещество, выделяли в нём индивидуальные особенности, что позволяло им давать названия, ассоциирующиеся с какими-то либо личными убеждениями и сравнениями.
Но перед этим в учёном мире были приняты важные термины:
- Элемент — слово произошло от латинского elementum, обозначающего какую-либо часть. Ученые античного времени говорили: «Как слова состоят из букв, так и тела — из элементов». Слово образовано из отрицательной приставки «а» и «томе» — рассечение.
- Атом — в переводе с греческого языка слово обозначает целое (неделимое).
- Молекула — термин происходит от латинского moles. На русский язык это слово можно перевести как «массив», «глыба».
Как видно из названия, химические совокупности ассоциируются с их свойствами. По этому же принципу давались названия и открытым веществам. Так как исследованиями занимались в основном Европейские учёные, то их названия записывались на латыни.
При этом у подавляющего числа элементов, звучащих на русском, они фонетически близки к латинским.
Правильное произношение
В таблице Менделеева все вещества написаны на латыни. Часто вместе с сокращённым названием указывается полное. Например, Ar — argon, Ba — barium, Au — aurum. Но для русскоязычного населения полное наименование пишут на русском. Так, Ar — аргон, Ba — барий, Au — аурум.
Произношение их что на латыни, что на русском языке одинаково. Единственное — присутствует акцент. Но существуют элементы, которые имеют двойное название. То есть, их можно произносить так же, как они и пишутся, или совсем по-другому. К таким веществам относятся:
- Золото — обозначается знаком Au и читается аурум. Слово в переводе с иностранного обозначает «жёлтое».
- Серебро — символизируется символом Ar, может произноситься как «аргентум». Слово имеет индоевропейское происхождение. Arg — обозначает светлый.
- Железо — подписывают знаком Fe, а читают как феррум. С латинского ferrum происходит от fars, что обозначает «крепкий».
- Сера — правильное название sulfur (сульфур). Обозначают её символом S. Интересно, что в древнерусском и старославянском под серой понимали любое горючее вещество, например, жир.
- Свинец — произносится как плюмбум (plumbum). Причина названия элемента доподлинно неизвестна. Сокращённое обозначение элемента — Pb.
- Олово — химический символ Sn. Элемент четырнадцатой группы пишется на латыни как stannum. Произносится также — «станниум». Происхождение записи связывают с санскритским словом, обозначающим прочность.
- Углерод — элемент, обозначающийся знаком C. Латинское название carboneum произносится как «карбон». Слово имеет в названии корень carbō обозначающий «уголь».
- Ртуть — с латинского звучит как «гидраргиум». Hydrargirum произошло от слияния слов «хюдор» — вода и «аргирос» — серебро.
- Медь — международное обозначение Сu. Пишется как cuprum, а произносится «купрум». Считается, что элемент получил название в честь острова Кипр, где находилось много рудников.
- Азот — пишется в зарубежной литературе как nitrogenium. За обозначение принят символ N. На русском языке произносится как «нитрогениум». Слово происходит от древнегреческого ἄζωτоς — «безжизненный».
Названия популярных элементов
В классической периодической таблице указано 118 элементов.
Расположены они по атомным номерам. Но вместе с этим существует и расширенный свод. Он является логическим продолжением труда русского химика и включает возможные, ещё не выявленные вещества. С учётом расширенной таблицы всего предполагается существование 218 веществ. Вот самые распространённые химические элементы таблицы Менделеева с произношением:
| Азо́т | эн | N | Nitrogenium |
| Алюми́ний | алюми́ний | Al | Aluminium |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бор | Borum | B | бор |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водород | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| Индий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Литий | Lithium | Li | ли́тий |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Мышьяк | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Ни́кель | Niccolum | Ni | ни́кель |
| Олово | Stannum | Sn | ста́ннум |
| Осмий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Платина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Танта́л | Tantalum | Ta | танта́л |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фо́сфор | Phosphorus | P | пэ |
| Фтор | Fluorum | F | фтор |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
Следует отметить, что знаковое обозначение элементов принято Международным союзом теоретической и прикладной химии. Его членами являются академии наук, химические общества, и научные организации 57 стран мира.
В качестве аббревиатуры комитета используется ИЮПАК. Именно его члены занимаются стандартизацией в области химии.
Чтение формул и символов
Цифра, стоящая перед веществом, обозначает количество молекул. Элемент же записывают буквенными символами. В устной речи придерживаются правила, при котором называют последовательно, начиная справа, все знаки.
Например, H2O — формула воды, её читают как «аш два о», NaCl (хлорид натрия) — «натрий хлор». Чтобы правильно произносить химические соединения, необходимо знать, как звучат символы элементов. Не стоит забывать и то, что индекс, относящийся к скобкам (группе атомов), произносят с суффиксом -жды. Например: дважды, трижды, четырежды.
Таким образом, несмотря на то, что существуют русские и латинские обозначения каждого химического элемента, в химических формулах используется только стандартное правило. При произношении соединения употребляют латинские названия. При этом часто они соответствуют русским, особенно если в имени элемента используется более одной буквы. Если же в названии стоит один символ, то латинскому имении соответствует название этой буквы.
То есть, например, гелий, так и произносится в формулах. Но если встречаются сокращённые буквы латиницы, то нужно произносить элемент полностью, как он и называется, например, Si — сицилициум и так далее. Вот некоторые названия редких элементов:
- Сm — кюрий.
- Сf — калифорний.
- Fm — фермий.
- No — нобелий.
- Lr — лоуренций.
- Hs — хассий.
- Po — полоний.
- Pa — проктаний.
- Gd — гадолиний.
- Er — эрбий.
Интересно и то, что последние элементы, которые добавляют в таблицу Менделеева являются синтезированными. Так, 115 был получен в Дубне. Назвали его moscovium (Mc), произносится на русском — «московий». Элемент 117 назвали tennessine (TS). Имя ему было дано в честь штата Теннесси.
В честь Юрия Цолаковича Оганесяна было решено назвать 118 элемент. Пишется он как oganesson (Og), читается — «оганесон». Это пока последний элемент, добавленный в таблицу.
Химические элементы: названия, символы и произношение символов
В таблице содержатся русские и латинские названия химических элементов, символы химических элементов и произношение символов. Для правильного произношения названий и символов в русских названиях и произношениях проставлены ударения.
| Русское название элемента | Латинское название элемента | Символ элемента | Произношение символа |
|---|---|---|---|
| Азо́т | Nitrogenium | N | эн |
| Акти́ний | Actinium | Ac | акти́ний |
| Алюми́ний | Aluminium | Al | алюми́ний |
| Амери́ций | Americium | Am | амери́ций |
| Арго́н | Argon | Ar | арго́н |
| Аста́т | Astatum | At | аста́т |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бе́рклий | Berkelium | Bk | бе́рклий |
| Бор | Borum | B | бор |
| Бо́рий | Bohrium | Bh | бо́рий |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водоро́д | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Гадоли́ний | Gadolinium | Gd | гадоли́ний |
| Га́ллий | Gallium | Ga | га́ллий |
| Га́фний | Hafnium | Hf | га́фний |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Го́льмий | Holmium | Ho | го́льмий |
| Дармшта́дтий | Darmstadtium | Ds | дармшта́дтий |
| Диспро́зий | Dysprosium | Dy | диспро́зий |
| Ду́бний | Dubnium | Db | ду́бний |
| Евро́пий | Europium | Eu | евро́пий |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| И́ндий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Итте́рбий | Ytterbium | Yb | итте́рбий |
| И́ттрий | Yttrium | Y | и́ттрий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Калифо́рний | Californium | Cf | калифо́рний |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Коперни́ций | Copernicium | Cn | коперни́ций |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Кю́рий | Curium | Cm | кю́рий |
| Ланта́н | Lanthanum | La | ланта́н |
| Ливермо́рий | Livermorium | Lv | ливермо́рий |
| Ли́тий | Lithium | Li | ли́тий |
| Лоуре́нсий | Lawrencium | Lr | лоуре́нсий |
| Люте́ций | Lutetium | Lu | люте́ций |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Мейтне́рий | Meitnerium | Mt | мейтне́рий |
| Менделе́вий | Mendelevium | Md | менделе́вий |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Моско́вий | Moscovium | Mc | моско́вий |
| Мышья́к | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Непту́ний | Neptunium | Np | непту́ний |
| Ни́кель | Niccolum | Ni | ни́кель |
| Нио́бий | Niobium | Nb | нио́бий |
| Нихо́ний | Nihonium | Nh | нихо́ний |
| Нобе́лий | Nobelium | No | нобе́лий |
| Оганесо́н | Oganesson | Og | оганесо́н |
| О́лово | Stannum | Sn | ста́ннум |
| О́смий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Пла́тина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Поло́ний | Polonium | Po | поло́ний |
| Празеоди́м | Praseodymium | Pr | празеоди́м |
| Проме́тий | Promethium | Pm | проме́тий |
| Протакти́ний | Protactinium | Pa | протакти́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Рентге́ний | Roentgenium | Rg | рентге́ний |
| Ро́дий | Rhodium | Rh | ро́дий |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Руте́ний | Ruthenium | Ru | руте́ний |
| Сама́рий | Samarium | Sm | сама́рий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Сибо́ргий | Seaborgium | Sg | сибо́ргий |
| Ска́ндий | Scandium | Sc | ска́ндий |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Та́ллий | Thallium | Tl | та́ллий |
| Танта́л | Tantalum | Ta | танта́л |
| Теллу́р | Tellurium | Te | теллу́р |
| Теннесси́н | Tennessium | Ts | теннесси́н |
| Те́рбий | Terbium | Tb | те́рбий |
| Техне́ций | Technetium | Tc | техне́ций |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Ту́лий | Thulium | Tm | ту́лий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фе́рмий | Fermium | Fm | фе́рмий |
| Флеро́вий | Flerovium | Fl | флеро́вий |
| Фо́сфор | Phosphorus | P | пэ |
| Фра́нций | Francium | Fr | фра́нций |
| Фтор | Fluorum | F | фтор |
| Ха́ссий | Hassium | Hs | га́ссий |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Це́рий | Cerium | Ce | це́рий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
| Эйнште́йний | Einsteinium | Es | эйнште́йний |
| Э́рбий | Erbium | Er | э́рбий |