Not to be confused with manganese (Mn).
«mg» redirects here. For the milligram (mg) or megagram (Mg), see kilogram § SI multiples. For other uses, see MG.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnesium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (mag-NEE-zee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | shiny grey solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Mg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnesium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 2 (alkaline earth metals) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ne] 3s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 923 K (650 °C, 1202 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1363 K (1091 °C, 1994 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 1.738 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 1.584 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 8.48 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 128 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.869[2] J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0,[3] +1,[4] +2 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 160 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 141±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 173 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of magnesium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4940 m/s (at r.t.) (annealed) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 24.8[5] µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 156[6] W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 43.9[7] nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +13.1×10−6 cm3/mol (298 K)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 45 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 17 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 35.4[9] GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.290 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1–2.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 44–260 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-95-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after Magnesia, Greece[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Joseph Black (1755[10]) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Humphry Davy (1808[10]) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of magnesium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Magnesium is a chemical element with the symbol Mg and atomic number 12. It is a shiny gray metal having a low density, low melting point and high chemical reactivity. Like the other alkaline earth metals (group 2 of the periodic table) it occurs naturally only in combination with other elements and it almost always has an oxidation state of +2. It reacts readily with air to form a thin passivation coating of magnesium oxide that inhibits further corrosion of the metal. The free metal burns with a brilliant-white light. The metal is obtained mainly by electrolysis of magnesium salts obtained from brine. It is less dense than aluminium and is used primarily as a component in strong and lightweight alloys that contain aluminium.
In the cosmos, magnesium is produced in large, aging stars by the sequential addition of three helium nuclei to a carbon nucleus. When such stars explode as supernovas, much of the magnesium is expelled into the interstellar medium where it may recycle into new star systems. Magnesium is the eighth most abundant element in the Earth’s crust[11] and the fourth most common element in the Earth (after iron, oxygen and silicon), making up 13% of the planet’s mass and a large fraction of the planet’s mantle. It is the third most abundant element dissolved in seawater, after sodium and chlorine.[12]
This element is the eleventh most abundant element by mass in the human body and is essential to all cells and some 300 enzymes.[13] Magnesium ions interact with polyphosphate compounds such as ATP, DNA, and RNA. Hundreds of enzymes require magnesium ions to function. Magnesium compounds are used medicinally as common laxatives and antacids (such as milk of magnesia), and to stabilize abnormal nerve excitation or blood vessel spasm in such conditions as eclampsia.[13]
Characteristics
Physical properties
Elemental magnesium is a gray-white lightweight metal, two-thirds the density of aluminium. Magnesium has the lowest melting (923 K (650 °C)) and the lowest boiling point 1,363 K (1,090 °C) of all the alkaline earth metals.[14]
Pure polycrystalline magnesium is brittle and easily fractures along shear bands. It becomes much more malleable when alloyed with small amount of other metals, such as 1% aluminium.[15] The malleability of polycrystalline magnesium can also be significantly improved by reducing its grain size to ca. 1 micron or less.[16]
When finely powdered, magnesium can react with water to produce hydrogen gas:
- Mg(s) + 2H2O(g) → Mg(OH)2(aq) + H2(g) + 1203.6 kJ
However, this reaction is much less dramatic than the reactions of the alkali metals with water, because the magnesium hydroxide tends to build up on the surface of the pure magnesium metal and prevent the reaction from occurring.[17]
Chemical properties
General chemistry
It tarnishes slightly when exposed to air, although, unlike the heavier alkaline earth metals, an oxygen-free environment is unnecessary for storage because magnesium is protected by a thin layer of oxide that is fairly impermeable and difficult to remove.
Direct reaction of magnesium with air or oxygen at ambient pressure forms only the «normal» oxide MgO. However, this oxide may be combined with hydrogen peroxide to form Magnesium peroxide, MgO2, and at low temperature the peroxide may be further reacted with ozone to form magnesium superoxide Mg(O2)2.[18]
Magnesium reacts with water at room temperature, though it reacts much more slowly than calcium, a similar group 2 metal. When submerged in water, hydrogen bubbles form slowly on the surface of the metal – though, if powdered, it reacts much more rapidly. The reaction occurs faster with higher temperatures (see safety precautions). Magnesium’s reversible reaction with water can be harnessed to store energy and run a magnesium-based engine. Magnesium also reacts exothermically with most acids such as hydrochloric acid (HCl), producing the metal chloride and hydrogen gas, similar to the HCl reaction with aluminium, zinc, and many other metals.
Flammability
Magnesium is highly flammable, especially when powdered or shaved into thin strips, though it is difficult to ignite in mass or bulk. Flame temperatures of magnesium and magnesium alloys can reach 3,100 °C (5,610 °F),[19] although flame height above the burning metal is usually less than 300 mm (12 in).[20] Once ignited, such fires are difficult to extinguish, because combustion continues in nitrogen (forming magnesium nitride), carbon dioxide (forming magnesium oxide and carbon), and water (forming magnesium oxide and hydrogen, which also combusts due to heat in the presence of additional oxygen). This property was used in incendiary weapons during the firebombing of cities in World War II, where the only practical civil defense was to smother a burning flare under dry sand to exclude atmosphere from the combustion.
Magnesium may also be used as an igniter for thermite, a mixture of aluminium and iron oxide powder that ignites only at a very high temperature.
Organic chemistry
Organomagnesium compounds are widespread in organic chemistry. They are commonly found as Grignard reagents. Magnesium can react with haloalkanes to give Grignard reagents. Examples of Grignard reagents are phenylmagnesium bromide and ethylmagnesium bromide. The Grignard reagents function as a common nucleophile, attacking the electrophilic group such as the carbon atom that is present within the polar bond of a carbonyl group.
A prominent organomagnesium reagent beyond Grignard reagents is magnesium anthracene with magnesium forming a 1,4-bridge over the central ring. It is used as a source of highly active magnesium. The related butadiene-magnesium adduct serves as a source for the butadiene dianion.
Magnesium in organic chemistry also appears as low valent magnesium compounds, primarily with the magnesium forming diatomic ions in the +1 oxidation state but more recently also with zero oxidation state or a mixture of +1 and zero states.[21] Such compounds find synthetic application as reducing agents and sources of nucleophilic metal atoms.
Source of light
When burning in air, magnesium produces a brilliant-white light that includes strong ultraviolet wavelengths. Magnesium powder (flash powder) was used for subject illumination in the early days of photography.[22][23] Later, magnesium filament was used in electrically ignited single-use photography flashbulbs. Magnesium powder is used in fireworks and marine flares where a brilliant white light is required. It was also used for various theatrical effects,[24] such as lightning,[25] pistol flashes,[26] and supernatural appearances.[27]
Detection in solution
The presence of magnesium ions can be detected by the addition of ammonium chloride, ammonium hydroxide and monosodium phosphate to an aqueous or dilute HCl solution of the salt. The formation of a white precipitate indicates the presence of magnesium ions.
Azo violet dye can also be used which turns deep blue in the presence of an alkaline solution of magnesium salt. The color is due to the adsorption of azo violet by Mg(OH)2.
Occurrence
Magnesium is the eighth-most-abundant element in the Earth’s crust by mass and tied in seventh place with iron in molarity.[11] It is found in large deposits of magnesite, dolomite, and other minerals, and in mineral waters, where magnesium ion is soluble.
Although magnesium is found in more than 60 minerals, only dolomite, magnesite, brucite, carnallite, talc, and olivine are of commercial importance.
The Mg2+
cation is the second-most-abundant cation in seawater (about 1⁄8 the mass of sodium ions in a given sample), which makes seawater and sea salt attractive commercial sources for Mg. To extract the magnesium, calcium hydroxide is added to seawater to form magnesium hydroxide precipitate.
- MgCl
2 + Ca(OH)
2 → Mg(OH)
2 + CaCl
2
Magnesium hydroxide (brucite) is insoluble in water and can be filtered out and reacted with hydrochloric acid to produced concentrated magnesium chloride.
- Mg(OH)
2 + 2 HCl → MgCl
2 + 2 H
2O
From magnesium chloride, electrolysis produces magnesium.
Forms
Alloys
Magnesium is brittle, and fractures along shear bands when its thickness is reduced by only 10% by cold rolling (top). However, after alloying Mg with 1% Al and 0.1% Ca, its thickness could be reduced by 54% using the same process (bottom).
As of 2013, magnesium alloys consumption was less than one million tonnes per year, compared with 50 million tonnes of aluminum alloys. Their use has been historically limited by the tendency of Mg alloys to corrode,[28] creep at high temperatures, and combust.[29]
Corrosion
The presence of iron, nickel, copper, and cobalt strongly activates corrosion. In more than trace amounts, these metals precipitate as intermetallic compounds, and the precipitate locales function as active cathodic sites that reduce water, causing the loss of magnesium.[29] Controlling the quantity of these metals improves corrosion resistance. Sufficient manganese overcomes the corrosive effects of iron. This requires precise control over composition, increasing costs.[29] Adding a cathodic poison captures atomic hydrogen within the structure of a metal. This prevents the formation of free hydrogen gas, an essential factor of corrosive chemical processes. The addition of about one in three hundred parts arsenic reduces its corrosion rate in a salt solution by a factor of nearly ten.[29][30]
High-temperature creep and flammability
Research showed that magnesium’s tendency to creep at high temperatures is eliminated by the addition of scandium and gadolinium. Flammability is greatly reduced by a small amount of calcium in the alloy.[29] By using rare-earth elements, it may be possible to manufacture magnesium alloys with an ignition temperature higher than magnesium’s liquidus and in some cases potentially pushing it close to magnesium’s boiling point.[31]
Compounds
Magnesium forms a variety of compounds important to industry and biology, including magnesium carbonate, magnesium chloride, magnesium citrate, magnesium hydroxide (milk of magnesia), magnesium oxide, magnesium sulfate, and magnesium sulfate heptahydrate (Epsom salts).
Isotopes
Magnesium has three stable isotopes: 24
Mg, 25
Mg and 26
Mg. All are present in significant amounts in nature (see table of isotopes above). About 79% of Mg is 24
Mg. The isotope 28
Mg is radioactive and in the 1950s to 1970s was produced by several nuclear power plants for use in scientific experiments. This isotope has a relatively short half-life (21 hours) and its use was limited by shipping times.
The nuclide 26
Mg has found application in isotopic geology, similar to that of aluminium. 26
Mg is a radiogenic daughter product of 26
Al, which has a half-life of 717,000 years. Excessive quantities of stable 26
Mg have been observed in the Ca-Al-rich inclusions of some carbonaceous chondrite meteorites. This anomalous abundance is attributed to the decay of its parent 26
Al in the inclusions, and researchers conclude that such meteorites were formed in the solar nebula before the 26
Al had decayed. These are among the oldest objects in the Solar System and contain preserved information about its early history.
It is conventional to plot 26
Mg/24
Mg against an Al/Mg ratio. In an isochron dating plot, the Al/Mg ratio plotted is27
Al/24
Mg. The slope of the isochron has no age significance, but indicates the initial 26
Al/27
Al ratio in the sample at the time when the systems were separated from a common reservoir.
Production
Magnesium sheets and ingots
World production was approximately 1,100 kt in 2017, with the bulk being produced in China (930 kt) and Russia (60 kt).[32] The United States was in the 20th century the major world supplier of this metal, supplying 45% of world production even as recently as 1995. Since the Chinese mastery of the Pidgeon process the US market share is at 7%, with a single US producer left: US Magnesium, a Renco Group company in Utah born from now-defunct Magcorp.[33]
In September 2021, China took steps to reduce production of magnesium as a result of a government initiative to reduce energy availability for manufacturing industries, leading to a significant price increase.[34]
- Pidgeon process
China is almost completely reliant on the silicothermic Pidgeon process (the reduction of the oxide at high temperatures with silicon, often provided by a ferrosilicon alloy in which the iron is but a spectator in the reactions) to obtain the metal.[35] The process can also be carried out with carbon at approx 2300 °C:
- 2MgO
(s) + Si
(s) + 2CaO
(s) → 2Mg
(g) + Ca
2SiO
4(s) - MgO
(s) + C
(s) → Mg
(g) + CO
(g)
- Dow process
In the United States, magnesium is obtained principally with the Dow process, by electrolysis of fused magnesium chloride from brine and sea water. A saline solution containing Mg2+
ions is first treated with lime (calcium oxide) and the precipitated magnesium hydroxide is collected:
- Mg2+
(aq) + CaO
(s) + H
2O → Ca2+
(aq) + Mg(OH)
2(s)
The hydroxide is then converted to a partial hydrate of magnesium chloride by treating the hydroxide with hydrochloric acid and heating of the product:
- Mg(OH)
2(s) + 2 HCl → MgCl
2(aq) + 2H
2O
(l)
The salt is then electrolyzed in the molten state. At the cathode, the Mg2+
ion is reduced by two electrons to magnesium metal:
- Mg2+
+ 2
e−
→ Mg
At the anode, each pair of Cl−
ions is oxidized to chlorine gas, releasing two electrons to complete the circuit:
- 2 Cl−
→ Cl
2 (g) + 2
e−
- YSZ process
A new process, solid oxide membrane technology, involves the electrolytic reduction of MgO. At the cathode, Mg2+
ion is reduced by two electrons to magnesium metal. The electrolyte is yttria-stabilized zirconia (YSZ). The anode is a liquid metal. At the YSZ/liquid metal anode O2−
is oxidized. A layer of graphite borders the liquid metal anode, and at this interface carbon and oxygen react to form carbon monoxide. When silver is used as the liquid metal anode, there is no reductant carbon or hydrogen needed, and only oxygen gas is evolved at the anode.[36] It has been reported that this method provides a 40% reduction in cost per pound over the electrolytic reduction method.[37]
History
The name magnesium originates from the Greek word for locations related to the tribe of the Magnetes, either a district in Thessaly called Magnesia[38] or Magnesia ad Sipylum, now in Turkey.[39] It is related to magnetite and manganese, which also originated from this area, and required differentiation as separate substances. See manganese for this history.
In 1618, a farmer at Epsom in England attempted to give his cows water from a well there. The cows refused to drink because of the water’s bitter taste, but the farmer noticed that the water seemed to heal scratches and rashes. The substance became known as Epsom salts and its fame spread.[40] It was eventually recognized as hydrated magnesium sulfate, MgSO
4·7 H
2O.
The metal itself was first isolated by Sir Humphry Davy in England in 1808. He used electrolysis on a mixture of magnesia and mercuric oxide.[41] Antoine Bussy prepared it in coherent form in 1831. Davy’s first suggestion for a name was magnium,[41] but the name magnesium is now used in English and all major European languages but Russian.
Uses as a metal
Magnesium is the third-most-commonly-used structural metal, following iron and aluminium.[42] The main applications of magnesium are, in order: aluminium alloys, die-casting (alloyed with zinc),[43] removing sulfur in the production of iron and steel, and the production of titanium in the Kroll process.[44]
Magnesium is used in lightweight materials and alloys. For example, when infused with silicon carbide nanoparticles, it has extremely high specific strength.[45]
Historically, magnesium was one of the main aerospace construction metals and was used for German military aircraft as early as World War I and extensively for German aircraft in World War II. The Germans coined the name «Elektron» for magnesium alloy, a term which is still used today. In the commercial aerospace industry, magnesium was generally restricted to engine-related components, due to fire and corrosion hazards. Magnesium alloy use in aerospace is increasing in the 21st century, driven by the importance of fuel economy.[46] Recent developments in metallurgy and manufacturing have allowed for the potential for magnesium alloys to act as replacements for aluminium and steel alloys in certain applications.[47][48]
In the form of thin ribbons, magnesium is used to purify solvents; for example, preparing super-dry ethanol.[citation needed]
Aircraft
- Wright Aeronautical used a magnesium crankcase in the WWII-era Wright R-3350 Duplex Cyclone aviation engine. This presented a serious problem for the earliest models of the Boeing B-29 Superfortress heavy bomber when an in-flight engine fire ignited the engine crankcase. The resulting combustion was as hot as 5,600 °F (3,100 °C) and could sever the wing spar from the fuselage.[49][50][51]
Automotive
Mg alloy motorcycle engine blocks
- Mercedes-Benz used the alloy Elektron in the bodywork of an early model Mercedes-Benz 300 SLR; these cars competed in the 1955 World Sportscar Championship including a win at the Mille Miglia, and at Le Mans where one was involved in the 1955 Le Mans disaster when spectators were showered with burning fragments of elektron.[citation needed]
- Porsche used magnesium alloy frames in the 917/053 that won Le Mans in 1971, and continues to use magnesium alloys for its engine blocks due to the weight advantage.[citation needed]
- Volkswagen Group has used magnesium in its engine components for many years.[52]
- Mitsubishi Motors uses magnesium for its paddle shifters.[citation needed]
- BMW used magnesium alloy blocks in their N52 engine, including an aluminium alloy insert for the cylinder walls and cooling jackets surrounded by a high-temperature magnesium alloy AJ62A. The engine was used worldwide between 2005 and 2011 in various 1, 3, 5, 6, and 7 series models; as well as the Z4, X1, X3, and X5.[citation needed]
- Chevrolet used the magnesium alloy AE44 in the 2006 Corvette Z06.[citation needed]
Both AJ62A and AE44 are recent developments in high-temperature low-creep magnesium alloys. The general strategy for such alloys is to form intermetallic precipitates at the grain boundaries, for example by adding mischmetal or calcium.[53] New alloy development and lower costs that make magnesium competitive with aluminium will increase the number of automotive applications.[citation needed]
Electronics
Because of low density and good mechanical and electrical properties, magnesium is used for manufacturing of mobile phones, laptop and tablet computers, cameras, and other electronic components.[citation needed] It was used as a premium feature because of its light weight in some 2020 laptops.[54]
Products made of magnesium: firestarter and shavings, sharpener, magnesium ribbon
Other
Magnesium, being readily available and relatively nontoxic, has a variety of uses:
- Magnesium is flammable, burning at a temperature of approximately 3,100 °C (3,370 K; 5,610 °F),[19] and the autoignition temperature of magnesium ribbon is approximately 473 °C (746 K; 883 °F).[55] It produces intense, bright, white light when it burns. Magnesium’s high combustion temperature makes it a useful tool for starting emergency fires. Other uses include flash photography, flares, pyrotechnics, fireworks sparklers, and trick birthday candles. Magnesium is also often used to ignite thermite or other materials that require a high ignition temperature. Magnesium continues to be used as an incendiary element in warfare.[56]
Magnesium firestarter (in left hand), used with a pocket knife and flint to create sparks that ignite the shavings
- In the form of turnings or ribbons, to prepare Grignard reagents, which are useful in organic synthesis.[citation needed]
- As an additive agent in conventional propellants and the production of nodular graphite in cast iron.[citation needed]
- As a reducing agent to separate uranium and other metals from their salts.[citation needed]
- As a sacrificial (galvanic) anode to protect boats, underground tanks, pipelines, buried structures, and water heaters.[citation needed]
- Alloyed with zinc to produce the zinc sheet used in photoengraving plates in the printing industry, dry-cell battery walls, and roofing.[43]
- As a metal, this element’s principal use is as an alloying additive to aluminium with these aluminium-magnesium alloys being used mainly for beverage cans, sports equipment such as golf clubs, fishing reels, and archery bows and arrows.[citation needed]
- Specialty, high-grade car wheels of magnesium alloy are called «mag wheels», although the term is often misapplied to aluminium wheels. Many car and aircraft manufacturers have made engine and body parts from magnesium.[citation needed]
- Magnesium batteries have been commercialized as primary batteries, and are an active topic of research for rechargeable batteries.[citation needed]
Safety precautions
Magnesium block heated with blowtorch to self-combustion, emitting intense white light
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H228, H251, H261 |
|
Precautionary statements |
P210, P231, P235, P410, P422[57] |
| NFPA 704 (fire diamond) |
https://cameochemicals.noaa.gov/chemical/6949 0 1 1 |
Magnesium metal and its alloys can be explosive hazards; they are highly flammable in their pure form when molten or in powder or ribbon form. Burning or molten magnesium reacts violently with water. When working with powdered magnesium, safety glasses with eye protection and UV filters (such as welders use) are employed because burning magnesium produces ultraviolet light that can permanently damage the retina of a human eye.[58]
Magnesium is capable of reducing water and releasing highly flammable hydrogen gas:[59]
- Mg (s) + 2 H
2O (l) → Mg(OH)
2 (s) + H
2 (g)
Therefore, water cannot extinguish magnesium fires. The hydrogen gas produced intensifies the fire. Dry sand is an effective smothering agent, but only on relatively level and flat surfaces.
Magnesium reacts with carbon dioxide exothermically to form magnesium oxide and carbon:[60]
- 2 Mg + CO
2 → 2 MgO + C (s)
Hence, carbon dioxide fuels rather than extinguishes magnesium fires.
Burning magnesium can be quenched by using a Class D dry chemical fire extinguisher, or by covering the fire with sand or magnesium foundry flux to remove its air source.[61]
Useful compounds
Magnesium compounds, primarily magnesium oxide (MgO), are used as a refractory material in furnace linings for producing iron, steel, nonferrous metals, glass, and cement. Magnesium oxide and other magnesium compounds are also used in the agricultural, chemical, and construction industries. Magnesium oxide from calcination is used as an electrical insulator in fire-resistant cables.[62]
Magnesium hydride is under investigation as a way to store hydrogen.
Magnesium reacted with an alkyl halide gives a Grignard reagent, which is a very useful tool for preparing alcohols.
Magnesium salts are included in various foods, fertilizers (magnesium is a component of chlorophyll), and microbe culture media.
Magnesium sulfite is used in the manufacture of paper (sulfite process).
Magnesium phosphate is used to fireproof wood used in construction.
Magnesium hexafluorosilicate is used for moth-proofing textiles.
Biological roles
Mechanism of action
The important interaction between phosphate and magnesium ions makes magnesium essential to the basic nucleic acid chemistry of all cells of all known living organisms. More than 300 enzymes require magnesium ions for their catalytic action, including all enzymes using or synthesizing ATP and those that use other nucleotides to synthesize DNA and RNA. The ATP molecule is normally found in a chelate with a magnesium ion.[63]
Nutrition
Diet
Examples of food sources of magnesium (clockwise from top left): bran muffins, pumpkin seeds, barley, buckwheat flour, low-fat vanilla yogurt, trail mix, halibut steaks, garbanzo beans, lima beans, soybeans, and spinach
Spices, nuts, cereals, cocoa and vegetables are rich sources of magnesium.[13] Green leafy vegetables such as spinach are also rich in magnesium.[64]
Beverages rich in magnesium are coffee, tea, and cocoa.[65]
Dietary recommendations
In the UK, the recommended daily values for magnesium are 300 mg for men and 270 mg for women.[66] In the U.S. the Recommended Dietary Allowances (RDAs) are 400 mg for men ages 19–30 and 420 mg for older; for women 310 mg for ages 19–30 and 320 mg for older.[67]
Supplementation
Numerous pharmaceutical preparations of magnesium and dietary supplements are available. In two human trials magnesium oxide, one of the most common forms in magnesium dietary supplements because of its high magnesium content per weight, was less bioavailable than magnesium citrate, chloride, lactate or aspartate.[68][69]
Metabolism
An adult body has 22–26 grams of magnesium,[13][70] with 60% in the skeleton, 39% intracellular (20% in skeletal muscle), and 1% extracellular.[13] Serum levels are typically 0.7–1.0 mmol/L or 1.8–2.4 mEq/L. Serum magnesium levels may be normal even when intracellular magnesium is deficient. The mechanisms for maintaining the magnesium level in the serum are varying gastrointestinal absorption and renal excretion. Intracellular magnesium is correlated with intracellular potassium. Increased magnesium lowers calcium[71] and can either prevent hypercalcemia or cause hypocalcemia depending on the initial level.[71] Both low and high protein intake conditions inhibit magnesium absorption, as does the amount of phosphate, phytate, and fat in the gut. Unabsorbed dietary magnesium is excreted in feces; absorbed magnesium is excreted in urine and sweat.[72]
Detection in serum and plasma
Magnesium status may be assessed by measuring serum and erythrocyte magnesium concentrations coupled with urinary and fecal magnesium content, but intravenous magnesium loading tests are more accurate and practical.[73] A retention of 20% or more of the injected amount indicates deficiency.[74] As of 2004, no biomarker has been established for magnesium.[75]
Magnesium concentrations in plasma or serum may be monitored for efficacy and safety in those receiving the drug therapeutically, to confirm the diagnosis in potential poisoning victims, or to assist in the forensic investigation in a case of fatal overdose. The newborn children of mothers who received parenteral magnesium sulfate during labor may exhibit toxicity with normal serum magnesium levels.[76]
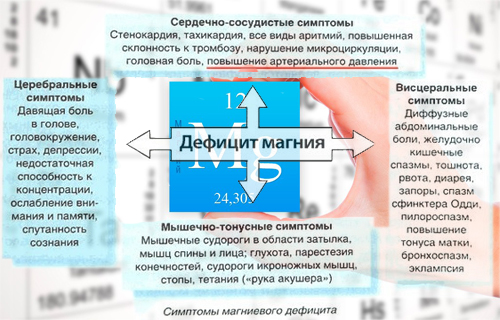
Deficiency
Low plasma magnesium (hypomagnesemia) is common: it is found in 2.5–15% of the general population.[77] From 2005 to 2006, 48 percent of the United States population consumed less magnesium than recommended in the Dietary Reference Intake.[78] Other causes are increased renal or gastrointestinal loss, an increased intracellular shift, and proton-pump inhibitor antacid therapy. Most are asymptomatic, but symptoms referable to neuromuscular, cardiovascular, and metabolic dysfunction may occur.[77] Alcoholism is often associated with magnesium deficiency. Chronically low serum magnesium levels are associated with metabolic syndrome, diabetes mellitus type 2, fasciculation, and hypertension.[79]
Therapy
- Intravenous magnesium is recommended by the ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death for patients with ventricular arrhythmia associated with torsades de pointes who present with long QT syndrome; and for the treatment of patients with digoxin induced arrhythmias.[80]
- Magnesium sulfate – intravenous – is used for the management of pre-eclampsia and eclampsia.[81][82]
- Hypomagnesemia, including that caused by alcoholism, is reversible by oral or parenteral magnesium administration depending on the degree of deficiency.[83]
- There is limited evidence that magnesium supplementation may play a role in the prevention and treatment of migraine.[84]
Sorted by type of magnesium salt, other therapeutic applications include:
- Magnesium sulfate, as the heptahydrate called Epsom salts, is used as bath salts, a laxative, and a highly soluble fertilizer.[85]
- Magnesium hydroxide, suspended in water, is used in milk of magnesia antacids and laxatives.
- Magnesium chloride, oxide, gluconate, malate, orotate, glycinate, ascorbate and citrate are all used as oral magnesium supplements.
- Magnesium borate, magnesium salicylate, and magnesium sulfate are used as antiseptics.
- Magnesium bromide is used as a mild sedative (this action is due to the bromide, not the magnesium).
- Magnesium stearate is a slightly flammable white powder with lubricating properties. In pharmaceutical technology, it is used in pharmacological manufacture to prevent tablets from sticking to the equipment while compressing the ingredients into tablet form.
- Magnesium carbonate powder is used by athletes such as gymnasts, weightlifters, and climbers to eliminate palm sweat, prevent sticking, and improve the grip on gymnastic apparatus, lifting bars, and climbing rocks.
Overdose
Overdose from dietary sources alone is unlikely because excess magnesium in the blood is promptly filtered by the kidneys,[77] and overdose is more likely in the presence of impaired renal function. In spite of this, megadose therapy has caused death in a young child,[86] and severe hypermagnesemia in a woman[87] and a young girl[88] who had healthy kidneys.
The most common symptoms of overdose are nausea, vomiting, and diarrhea; other symptoms include hypotension, confusion, slowed heart and respiratory rates, deficiencies of other minerals, coma, cardiac arrhythmia, and death from cardiac arrest.[71]
Function in plants
Plants require magnesium to synthesize chlorophyll, essential for photosynthesis. Magnesium in the center of the porphyrin ring in chlorophyll functions in a manner similar to the iron in the center of the porphyrin ring in heme. Magnesium deficiency in plants causes late-season yellowing between leaf veins, especially in older leaves, and can be corrected by either applying epsom salts (which is rapidly leached), or crushed dolomitic limestone, to the soil.
See also
- List of countries by magnesium production
- Magnesium oil
References
- ^ «Standard Atomic Weights: Magnesium». CIAAW. 2011.
- ^ Rumble, p. 4.61
- ^ Mg(0) has been synthesized in a compound containing a Na2Mg22+ cluster coordinated to a bulky organic ligand; see Rösch, B.; Gentner, T. X.; Eyselein, J.; Langer, J.; Elsen, H.; Li, W.; Harder, S. (2021). «Strongly reducing magnesium(0) complexes». Nature. 592 (7856): 717–721. Bibcode:2021Natur.592..717R. doi:10.1038/s41586-021-03401-w. PMID 33911274. S2CID 233447380
- ^ Bernath, P. F.; Black, J. H. & Brault, J. W. (1985). «The spectrum of magnesium hydride» (PDF). Astrophysical Journal. 298: 375. Bibcode:1985ApJ…298..375B. doi:10.1086/163620.. See also Low valent magnesium compounds.
- ^ Rumble, p. 12.135
- ^ Rumble, p. 12.137
- ^ Rumble, p. 12.28
- ^ Rumble, p. 4.70
- ^ Gschneider, K. A. (1964). Physical Properties and Interrelationships of Metallic and Semimetallic Elements. Solid State Physics. Vol. 16. p. 308. doi:10.1016/S0081-1947(08)60518-4. ISBN 9780126077162.
- ^ a b c Rumble, p. 4.19
- ^ a b Railsback, L. Bruce. «Abundance and form of the most abundant elements in Earth’s continental crust» (PDF). Some Fundamentals of Mineralogy and Geochemistry. Archived from the original (PDF) on 27 September 2011. Retrieved 15 February 2008.
- ^ Anthoni, J Floor (2006). «The chemical composition of seawater». seafriends.org.nz.
- ^ a b c d e «Dietary Supplement Fact Sheet: Magnesium». Office of Dietary Supplements, US National Institutes of Health. 11 February 2016. Retrieved 13 October 2016.
- ^ «alkaline-earth metal — Physical and chemical behaviour | Britannica». www.britannica.com. Retrieved 27 March 2022.
- ^ Sandlöbes, S.; Friák, M.; Korte-Kerzel, S.; Pei, Z.; Neugebauer, J.; Raabe, D. (2017). «A rare-earth free magnesium alloy with improved intrinsic ductility». Scientific Reports. 7 (1): 10458. Bibcode:2017NatSR…710458S. doi:10.1038/s41598-017-10384-0. PMC 5585333. PMID 28874798.
- ^ Zeng, Zhuoran; Nie, Jian-Feng; Xu, Shi-Wei; h. j. Davies, Chris; Birbilis, Nick (2017). «Super-formable pure magnesium at room temperature». Nature Communications. 8 (1): 972. Bibcode:2017NatCo…8..972Z. doi:10.1038/s41467-017-01330-9. PMC 5715137. PMID 29042555.
- ^ «Reactions of Group 2 Elements with Water». Chemistry LibreTexts. 3 October 2013. Retrieved 27 March 2022.
- ^ Vol’nov, I.I., Tokareva, S.A., Belevskii, V.N. et al. «The formation of magnesium perperoxide Mg(O2)2 in the reaction of magnesium peroxide with ozone» _Russ Chem Bull_ **19**, 468–471 (1970). https://doi.org/10.1007/BF00848959
- ^ a b Dreizin, Edward L.; Berman, Charles H. & Vicenzi, Edward P. (2000). «Condensed-phase modifications in magnesium particle combustion in air». Scripta Materialia. 122 (1–2): 30–42. CiteSeerX 10.1.1.488.2456. doi:10.1016/S0010-2180(00)00101-2.
- ^ DOE Handbook – Primer on Spontaneous Heating and Pyrophoricity. U.S. Department of Energy. December 1994. p. 20. DOE-HDBK-1081-94. Archived from the original on 15 April 2012. Retrieved 21 December 2011.
- ^ B. Rösch, T. X. Gentner, J. Eyselein, J. Langer, H. Elsen & S. Harder, «Strongly reducing magnesium(0) complexes», _Nature_ **592**, 717–721 (2021). [doi: 10.1038/s41586-021-03401-w](https://doi.org/10.1038/s41586-021-03401-w)
- ^ Hannavy, John (2013). Encyclopedia of Nineteenth-Century Photography. Routledge. p. 84. ISBN 978-1135873271.
- ^ Scientific American: Supplement. Vol. 48. Munn and Company. 1899. p. 20035.
- ^ Billboard. Nielsen Business Media, Inc. 1974. p. 20.
- ^ Altman, Rick (2007). Silent Film Sound. Columbia University Press. p. 41. ISBN 978-0231116633.
- ^ Lindsay, David (2005). Madness in the Making: The Triumphant Rise & Untimely Fall of America’s Show Inventors. iUniverse. p. 210. ISBN 978-0595347667.
- ^ McCormick, John; Pratasik, Bennie (2005). Popular Puppet Theatre in Europe, 1800–1914. Cambridge University Press. p. 106. ISBN 978-0521616157.
- ^ Makar, G. L.; Kruger, J. (1993). «Corrosion of magnesium». International Materials Reviews. 38 (3): 138–153. Bibcode:1993IMRv…38..138M. doi:10.1179/imr.1993.38.3.138.
- ^ a b c d e Dodson, Brian (29 August 2013). «Stainless magnesium breakthrough bodes well for manufacturing industries». Gizmag.com. Retrieved 29 August 2013.
- ^ Birbilis, N.; Williams, G.; Gusieva, K.; Samaniego, A.; Gibson, M. A.; McMurray, H. N. (2013). «Poisoning the corrosion of magnesium». Electrochemistry Communications. 34: 295–298. doi:10.1016/j.elecom.2013.07.021.
- ^ Czerwinski, Frank. «Controlling the ignition and flammability of magnesium for aerospace applications.» Corrosion Science 86 (2014): 1-16.
- ^ Bray, E. Lee (February 2019) Magnesium Metal. Mineral Commodity Summaries, U.S. Geological Survey
- ^ Vardi, Nathan. «Man With Many Enemies». Forbes. Retrieved 30 January 2021.
- ^ What to do about the magnesium shortage, Supply Management, published 17 February 2022, accessed 12 June 2022
- ^ «Magnesium Overview». China magnesium Corporation. Retrieved 8 May 2013.
- ^ Pal, Uday B.; Powell, Adam C. (2007). «The Use of Solid-Oxide-Membrane Technology for Electrometallurgy». JOM. 59 (5): 44–49. Bibcode:2007JOM….59e..44P. doi:10.1007/s11837-007-0064-x. S2CID 97971162.
- ^ Derezinski, Steve (12 May 2011). «Solid Oxide Membrane (SOM) Electrolysis of Magnesium: Scale-Up Research and Engineering for Light-Weight Vehicles» (PDF). MOxST. Archived from the original (PDF) on 13 November 2013. Retrieved 27 May 2013.
- ^ «Magnesium: historical information». webelements.com. Retrieved 9 October 2014.
- ^ languagehat (28 May 2005). «MAGNET». languagehat.com. Retrieved 18 June 2020.
- ^ Ainsworth, Steve (1 June 2013). «Epsom’s deep bath». Nurse Prescribing. 11 (6): 269. doi:10.12968/npre.2013.11.6.269.
- ^ a b Davy, H. (1808). «Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia». Philosophical Transactions of the Royal Society of London. 98: 333–370. Bibcode:1808RSPT…98..333D. doi:10.1098/rstl.1808.0023. JSTOR 107302.
- ^ Segal, David (2017). Materials for the 21st Century. Oxford University Press. ISBN 978-0192526090.
- ^ a b Baker, Hugh D. R.; Avedesian, Michael (1999). Magnesium and magnesium alloys. Materials Park, OH: Materials Information Society. p. 4. ISBN 978-0871706577.
- ^ Ketil Amundsen; Terje Kr. Aune; Per Bakke; Hans R. Eklund; Johanna Ö. Haagensen; Carlos Nicolas; et al. (2002). «Magnesium». Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a15_559. ISBN 978-3527306732.
- ^ Chin, Matthew (23 December 2015). «UCLA researchers create super-strong magnesium metal». ucla.edu.
- ^ Aghion, E.; Bronfin, B. (2000). «Magnesium Alloys Development towards the 21st Century». Materials Science Forum. 350–351: 19–30. doi:10.4028/www.scientific.net/MSF.350-351.19. S2CID 138429749.
- ^ Shu, Dong Wei, and Iram Raza Ahmad. «Magnesium Alloys: An Alternative for Aluminium in Structural Applications.» In Advanced Materials Research, vol. 168, pp. 1631-1635. Trans Tech Publications Ltd, 2011.
- ^ Magnesium alloy as a lighter alternative to aluminum alloy, Phys.org, November 29th 2017
- ^ Dreizin, Edward L.; Berman, Charles H.; Vicenzi, Edward P. (2000). «Condensed-phase modifications in magnesium particle combustion in air». Scripta Materialia. 122 (1–2): 30–42. CiteSeerX 10.1.1.488.2456. doi:10.1016/S0010-2180(00)00101-2.
- ^ Dorr, Robert F. (15 September 2012). Mission to Tokyo: The American Airmen Who Took the War to the Heart of Japan. pp. 40–41. ISBN 978-1610586634.
- ^ AAHS Journal. Vol. 44–45. American Aviation Historical Society. 1999.
- ^ «1950: The metal is magnesium, the car is the Beetle». www.hydro.com. 18 August 2020. Retrieved 5 April 2021.
- ^ Luo, Alan A. & Powell, Bob R. (2001). Tensile and Compressive Creep of Magnesium-Aluminum-Calcium Based Alloys (PDF) (Report). Materials & Processes Laboratory, General Motors Research & Development Center. Archived from the original (PDF) on 28 September 2007. Retrieved 21 August 2007.
- ^ Dignan, Larry (2 January 2020). «Blue magnesium alloy laptops: Premium price, plastic feel, but lightweight». ZDNet, A RED VENTURES COMPANY.
- ^ «Magnesium (Powder)». International Programme on Chemical Safety (IPCS). IPCS INCHEM. April 2000. Retrieved 21 December 2011.
- ^ «9N510 (ML-5) Submunition». Collective Awareness to UXO. Retrieved 22 November 2022.
- ^ Magnesium. Sigma Aldrich
- ^ «Science Safety: Chapter 8». Government of Manitoba. Retrieved 21 August 2007.
- ^ «Chemistry : Periodic Table : magnesium : chemical reaction data». webelements.com. Retrieved 26 June 2006.
- ^ «The Reaction Between Magnesium and CO2«. Purdue University. Retrieved 15 June 2016.
- ^ Cote, Arthur E. (2003). Operation of Fire Protection Systems. Jones & Bartlett Learning. p. 667. ISBN 978-0877655848.
- ^ Linsley, Trevor (2011). «Properties of conductors and insulators». Basic Electrical Installation Work. p. 362. ISBN 978-0080966281.
- ^
Romani, Andrea, M.P. (2013). «Chapter 3. Magnesium in Health and Disease». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 49–79. doi:10.1007/978-94-007-7500-8_3. ISBN 978-94-007-7499-5. PMID 24470089. - ^ «Magnesium in diet». MedlinePlus, U.S. National Library of Medicine, National Institutes of Health. 2 February 2016. Retrieved 13 October 2016.
- ^ Gropper, Sareen S.; Smith, Jack L.; Carr, Timothy P. (5 October 2016). Advanced Nutrition and Human Metabolism. Cengage Learning. ISBN 978-1-337-51421-7.
- ^ «Vitamins and minerals – Others – NHS Choices». Nhs.uk. 26 November 2012. Retrieved 19 September 2013.
- ^ «Magnesium», pp. 190–249 in «Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride». National Academy Press. 1997.
- ^ Firoz M; Graber M (2001). «Bioavailability of US commercial magnesium preparations». Magnes Res. 14 (4): 257–262. PMID 11794633.
- ^ Lindberg JS; Zobitz MM; Poindexter JR; Pak CY (1990). «Magnesium bioavailability from magnesium citrate and magnesium oxide». J Am Coll Nutr. 9 (1): 48–55. doi:10.1080/07315724.1990.10720349. PMID 2407766.
- ^ Saris NE, Mervaala E, Karppanen H, Khawaja JA, Lewenstam A (April 2000). «Magnesium. An update on physiological, clinical and analytical aspects». Clin Chim Acta. 294 (1–2): 1–26. doi:10.1016/S0009-8981(99)00258-2. PMID 10727669.
- ^ a b c «Magnesium». Umm.edu. University of Maryland Medical Center. 7 May 2013. Archived from the original on 16 February 2017. Retrieved 19 September 2013.
- ^ Wester PO (1987). «Magnesium». Am. J. Clin. Nutr. 45 (5 Suppl): 1305–1312. doi:10.1093/ajcn/45.5.1305. PMID 3578120.
- ^ Arnaud MJ (2008). «Update on the assessment of magnesium status». Br. J. Nutr. 99 Suppl 3: S24–S36. doi:10.1017/S000711450800682X. PMID 18598586.
- ^ Rob PM; Dick K; Bley N; Seyfert T; Brinckmann C; Höllriegel V; et al. (1999). «Can one really measure magnesium deficiency using the short-term magnesium loading test?». J. Intern. Med. 246 (4): 373–378. doi:10.1046/j.1365-2796.1999.00580.x. PMID 10583708. S2CID 6734801.
- ^ Franz KB (2004). «A functional biological marker is needed for diagnosing magnesium deficiency». J Am Coll Nutr. 23 (6): 738S–741S. doi:10.1080/07315724.2004.10719418. PMID 15637224. S2CID 37427458.
- ^ Baselt, R. (2008). Disposition of Toxic Drugs and Chemicals in Man (8th ed.). Biomedical Publications. pp. 875–877. ISBN 978-0962652370.
- ^ a b c Ayuk J.; Gittoes N.J. (March 2014). «Contemporary view of the clinical relevance of magnesium homeostasis». Annals of Clinical Biochemistry. 51 (2): 179–188. doi:10.1177/0004563213517628. PMID 24402002. S2CID 21441840.
- ^ Rosanoff, Andrea; Weaver, Connie M; Rude, Robert K (March 2012). «Suboptimal magnesium status in the United States: are the health consequences underestimated?» (PDF). Nutrition Reviews. 70 (3): 153–164. doi:10.1111/j.1753-4887.2011.00465.x. PMID 22364157.
- ^ Geiger H; Wanner C (2012). «Magnesium in disease». Clin Kidney J. 5 (Suppl 1): i25–i38. doi:10.1093/ndtplus/sfr165. PMC 4455821. PMID 26069818.
- ^ Zipes DP; Camm AJ; Borggrefe M; et al. (2012). «ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society». Circulation. 114 (10): e385–e484. doi:10.1161/CIRCULATIONAHA.106.178233. PMID 16935995.
- ^ James MF (2010). «Magnesium in obstetrics». Best Pract Res Clin Obstet Gynaecol. 24 (3): 327–337. doi:10.1016/j.bpobgyn.2009.11.004. PMID 20005782.
- ^ Euser, A. G.; Cipolla, M. J. (2009). «Magnesium Sulfate for the Treatment of Eclampsia: A Brief Review». Stroke. 40 (4): 1169–1175. doi:10.1161/STROKEAHA.108.527788. PMC 2663594. PMID 19211496.
- ^ Giannini, A. J. (1997). Drugs of Abuse (Second ed.). Los Angeles: Physicians Management Information Co. ISBN 978-0874894998.
- ^ Teigen L, Boes CJ (2014). «An evidence-based review of oral magnesium supplementation in the preventive treatment of migraine». Cephalalgia (Review). 35 (10): 912–922. doi:10.1177/0333102414564891. PMID 25533715. S2CID 25398410.
There is a strong body of evidence demonstrating a relationship between magnesium status and migraine. Magnesium likely plays a role in migraine development at a biochemical level, but the role of oral magnesium supplementation in migraine prophylaxis and treatment remains to be fully elucidated. The strength of evidence supporting oral magnesium supplementation is limited at this time.
- ^ Gowariker, Vasant; Krishnamurthy, V. P.; Gowariker, Sudha; Dhanorkar, Manik; Paranjape, Kalyani (8 April 2009). The Fertilizer Encyclopedia. p. 224. ISBN 978-0470431764.
- ^ McGuire, John; Kulkarni, Mona Shah; Baden, Harris (February 2000). «Fatal Hypermagnesemia in a Child Treated With Megavitamin/Megamineral Therapy». Pediatrics. 105 (2): E18. doi:10.1542/peds.105.2.e18. PMID 10654978. Retrieved 1 February 2017.
- ^ Kontani M; Hara A; Ohta S; Ikeda T (2005). «Hypermagnesemia induced by massive cathartic ingestion in an elderly woman without pre-existing renal dysfunction». Intern. Med. 44 (5): 448–452. doi:10.2169/internalmedicine.44.448. PMID 15942092.
- ^ Kutsal, Ebru; Aydemir, Cumhur; Eldes, Nilufer; Demirel, Fatma; Polat, Recep; Taspınar, Ozan; Kulah, Eyup (February 2000). «Severe Hypermagnesemia as a Result of Excessive Cathartic Ingestion in a Child Without Renal Failure». Pediatrics. 205 (2): 570–572. doi:10.1097/PEC.0b013e31812eef1c. PMID 17726419.
Cited sources
- Rumble, John R., ed. (2018). CRC Handbook of Chemistry and Physics (99th ed.). Boca Raton, FL: CRC Press. ISBN 978-1-1385-6163-2.
External links
- Magnesium at The Periodic Table of Videos (University of Nottingham)
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry’s Chemistry World: Magnesium
- «Magnesium – a versatile and often overlooked element: new perspectives with a focus on chronic kidney disease». Clin Kidney J. 5 (Suppl 1). February 2012. Archived from the original on 9 June 2013.
Not to be confused with manganese (Mn).
«mg» redirects here. For the milligram (mg) or megagram (Mg), see kilogram § SI multiples. For other uses, see MG.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnesium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (mag-NEE-zee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | shiny grey solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Mg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnesium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 2 (alkaline earth metals) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ne] 3s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 923 K (650 °C, 1202 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 1363 K (1091 °C, 1994 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 1.738 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 1.584 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 8.48 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 128 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 24.869[2] J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0,[3] +1,[4] +2 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 160 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 141±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 173 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of magnesium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal close-packed (hcp)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 4940 m/s (at r.t.) (annealed) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 24.8[5] µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 156[6] W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 43.9[7] nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +13.1×10−6 cm3/mol (298 K)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 45 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 17 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 35.4[9] GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poisson ratio | 0.290 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1–2.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 44–260 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-95-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Naming | after Magnesia, Greece[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Joseph Black (1755[10]) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Humphry Davy (1808[10]) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of magnesium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Magnesium is a chemical element with the symbol Mg and atomic number 12. It is a shiny gray metal having a low density, low melting point and high chemical reactivity. Like the other alkaline earth metals (group 2 of the periodic table) it occurs naturally only in combination with other elements and it almost always has an oxidation state of +2. It reacts readily with air to form a thin passivation coating of magnesium oxide that inhibits further corrosion of the metal. The free metal burns with a brilliant-white light. The metal is obtained mainly by electrolysis of magnesium salts obtained from brine. It is less dense than aluminium and is used primarily as a component in strong and lightweight alloys that contain aluminium.
In the cosmos, magnesium is produced in large, aging stars by the sequential addition of three helium nuclei to a carbon nucleus. When such stars explode as supernovas, much of the magnesium is expelled into the interstellar medium where it may recycle into new star systems. Magnesium is the eighth most abundant element in the Earth’s crust[11] and the fourth most common element in the Earth (after iron, oxygen and silicon), making up 13% of the planet’s mass and a large fraction of the planet’s mantle. It is the third most abundant element dissolved in seawater, after sodium and chlorine.[12]
This element is the eleventh most abundant element by mass in the human body and is essential to all cells and some 300 enzymes.[13] Magnesium ions interact with polyphosphate compounds such as ATP, DNA, and RNA. Hundreds of enzymes require magnesium ions to function. Magnesium compounds are used medicinally as common laxatives and antacids (such as milk of magnesia), and to stabilize abnormal nerve excitation or blood vessel spasm in such conditions as eclampsia.[13]
Characteristics
Physical properties
Elemental magnesium is a gray-white lightweight metal, two-thirds the density of aluminium. Magnesium has the lowest melting (923 K (650 °C)) and the lowest boiling point 1,363 K (1,090 °C) of all the alkaline earth metals.[14]
Pure polycrystalline magnesium is brittle and easily fractures along shear bands. It becomes much more malleable when alloyed with small amount of other metals, such as 1% aluminium.[15] The malleability of polycrystalline magnesium can also be significantly improved by reducing its grain size to ca. 1 micron or less.[16]
When finely powdered, magnesium can react with water to produce hydrogen gas:
- Mg(s) + 2H2O(g) → Mg(OH)2(aq) + H2(g) + 1203.6 kJ
However, this reaction is much less dramatic than the reactions of the alkali metals with water, because the magnesium hydroxide tends to build up on the surface of the pure magnesium metal and prevent the reaction from occurring.[17]
Chemical properties
General chemistry
It tarnishes slightly when exposed to air, although, unlike the heavier alkaline earth metals, an oxygen-free environment is unnecessary for storage because magnesium is protected by a thin layer of oxide that is fairly impermeable and difficult to remove.
Direct reaction of magnesium with air or oxygen at ambient pressure forms only the «normal» oxide MgO. However, this oxide may be combined with hydrogen peroxide to form Magnesium peroxide, MgO2, and at low temperature the peroxide may be further reacted with ozone to form magnesium superoxide Mg(O2)2.[18]
Magnesium reacts with water at room temperature, though it reacts much more slowly than calcium, a similar group 2 metal. When submerged in water, hydrogen bubbles form slowly on the surface of the metal – though, if powdered, it reacts much more rapidly. The reaction occurs faster with higher temperatures (see safety precautions). Magnesium’s reversible reaction with water can be harnessed to store energy and run a magnesium-based engine. Magnesium also reacts exothermically with most acids such as hydrochloric acid (HCl), producing the metal chloride and hydrogen gas, similar to the HCl reaction with aluminium, zinc, and many other metals.
Flammability
Magnesium is highly flammable, especially when powdered or shaved into thin strips, though it is difficult to ignite in mass or bulk. Flame temperatures of magnesium and magnesium alloys can reach 3,100 °C (5,610 °F),[19] although flame height above the burning metal is usually less than 300 mm (12 in).[20] Once ignited, such fires are difficult to extinguish, because combustion continues in nitrogen (forming magnesium nitride), carbon dioxide (forming magnesium oxide and carbon), and water (forming magnesium oxide and hydrogen, which also combusts due to heat in the presence of additional oxygen). This property was used in incendiary weapons during the firebombing of cities in World War II, where the only practical civil defense was to smother a burning flare under dry sand to exclude atmosphere from the combustion.
Magnesium may also be used as an igniter for thermite, a mixture of aluminium and iron oxide powder that ignites only at a very high temperature.
Organic chemistry
Organomagnesium compounds are widespread in organic chemistry. They are commonly found as Grignard reagents. Magnesium can react with haloalkanes to give Grignard reagents. Examples of Grignard reagents are phenylmagnesium bromide and ethylmagnesium bromide. The Grignard reagents function as a common nucleophile, attacking the electrophilic group such as the carbon atom that is present within the polar bond of a carbonyl group.
A prominent organomagnesium reagent beyond Grignard reagents is magnesium anthracene with magnesium forming a 1,4-bridge over the central ring. It is used as a source of highly active magnesium. The related butadiene-magnesium adduct serves as a source for the butadiene dianion.
Magnesium in organic chemistry also appears as low valent magnesium compounds, primarily with the magnesium forming diatomic ions in the +1 oxidation state but more recently also with zero oxidation state or a mixture of +1 and zero states.[21] Such compounds find synthetic application as reducing agents and sources of nucleophilic metal atoms.
Source of light
When burning in air, magnesium produces a brilliant-white light that includes strong ultraviolet wavelengths. Magnesium powder (flash powder) was used for subject illumination in the early days of photography.[22][23] Later, magnesium filament was used in electrically ignited single-use photography flashbulbs. Magnesium powder is used in fireworks and marine flares where a brilliant white light is required. It was also used for various theatrical effects,[24] such as lightning,[25] pistol flashes,[26] and supernatural appearances.[27]
Detection in solution
The presence of magnesium ions can be detected by the addition of ammonium chloride, ammonium hydroxide and monosodium phosphate to an aqueous or dilute HCl solution of the salt. The formation of a white precipitate indicates the presence of magnesium ions.
Azo violet dye can also be used which turns deep blue in the presence of an alkaline solution of magnesium salt. The color is due to the adsorption of azo violet by Mg(OH)2.
Occurrence
Magnesium is the eighth-most-abundant element in the Earth’s crust by mass and tied in seventh place with iron in molarity.[11] It is found in large deposits of magnesite, dolomite, and other minerals, and in mineral waters, where magnesium ion is soluble.
Although magnesium is found in more than 60 minerals, only dolomite, magnesite, brucite, carnallite, talc, and olivine are of commercial importance.
The Mg2+
cation is the second-most-abundant cation in seawater (about 1⁄8 the mass of sodium ions in a given sample), which makes seawater and sea salt attractive commercial sources for Mg. To extract the magnesium, calcium hydroxide is added to seawater to form magnesium hydroxide precipitate.
- MgCl
2 + Ca(OH)
2 → Mg(OH)
2 + CaCl
2
Magnesium hydroxide (brucite) is insoluble in water and can be filtered out and reacted with hydrochloric acid to produced concentrated magnesium chloride.
- Mg(OH)
2 + 2 HCl → MgCl
2 + 2 H
2O
From magnesium chloride, electrolysis produces magnesium.
Forms
Alloys
Magnesium is brittle, and fractures along shear bands when its thickness is reduced by only 10% by cold rolling (top). However, after alloying Mg with 1% Al and 0.1% Ca, its thickness could be reduced by 54% using the same process (bottom).
As of 2013, magnesium alloys consumption was less than one million tonnes per year, compared with 50 million tonnes of aluminum alloys. Their use has been historically limited by the tendency of Mg alloys to corrode,[28] creep at high temperatures, and combust.[29]
Corrosion
The presence of iron, nickel, copper, and cobalt strongly activates corrosion. In more than trace amounts, these metals precipitate as intermetallic compounds, and the precipitate locales function as active cathodic sites that reduce water, causing the loss of magnesium.[29] Controlling the quantity of these metals improves corrosion resistance. Sufficient manganese overcomes the corrosive effects of iron. This requires precise control over composition, increasing costs.[29] Adding a cathodic poison captures atomic hydrogen within the structure of a metal. This prevents the formation of free hydrogen gas, an essential factor of corrosive chemical processes. The addition of about one in three hundred parts arsenic reduces its corrosion rate in a salt solution by a factor of nearly ten.[29][30]
High-temperature creep and flammability
Research showed that magnesium’s tendency to creep at high temperatures is eliminated by the addition of scandium and gadolinium. Flammability is greatly reduced by a small amount of calcium in the alloy.[29] By using rare-earth elements, it may be possible to manufacture magnesium alloys with an ignition temperature higher than magnesium’s liquidus and in some cases potentially pushing it close to magnesium’s boiling point.[31]
Compounds
Magnesium forms a variety of compounds important to industry and biology, including magnesium carbonate, magnesium chloride, magnesium citrate, magnesium hydroxide (milk of magnesia), magnesium oxide, magnesium sulfate, and magnesium sulfate heptahydrate (Epsom salts).
Isotopes
Magnesium has three stable isotopes: 24
Mg, 25
Mg and 26
Mg. All are present in significant amounts in nature (see table of isotopes above). About 79% of Mg is 24
Mg. The isotope 28
Mg is radioactive and in the 1950s to 1970s was produced by several nuclear power plants for use in scientific experiments. This isotope has a relatively short half-life (21 hours) and its use was limited by shipping times.
The nuclide 26
Mg has found application in isotopic geology, similar to that of aluminium. 26
Mg is a radiogenic daughter product of 26
Al, which has a half-life of 717,000 years. Excessive quantities of stable 26
Mg have been observed in the Ca-Al-rich inclusions of some carbonaceous chondrite meteorites. This anomalous abundance is attributed to the decay of its parent 26
Al in the inclusions, and researchers conclude that such meteorites were formed in the solar nebula before the 26
Al had decayed. These are among the oldest objects in the Solar System and contain preserved information about its early history.
It is conventional to plot 26
Mg/24
Mg against an Al/Mg ratio. In an isochron dating plot, the Al/Mg ratio plotted is27
Al/24
Mg. The slope of the isochron has no age significance, but indicates the initial 26
Al/27
Al ratio in the sample at the time when the systems were separated from a common reservoir.
Production
Magnesium sheets and ingots
World production was approximately 1,100 kt in 2017, with the bulk being produced in China (930 kt) and Russia (60 kt).[32] The United States was in the 20th century the major world supplier of this metal, supplying 45% of world production even as recently as 1995. Since the Chinese mastery of the Pidgeon process the US market share is at 7%, with a single US producer left: US Magnesium, a Renco Group company in Utah born from now-defunct Magcorp.[33]
In September 2021, China took steps to reduce production of magnesium as a result of a government initiative to reduce energy availability for manufacturing industries, leading to a significant price increase.[34]
- Pidgeon process
China is almost completely reliant on the silicothermic Pidgeon process (the reduction of the oxide at high temperatures with silicon, often provided by a ferrosilicon alloy in which the iron is but a spectator in the reactions) to obtain the metal.[35] The process can also be carried out with carbon at approx 2300 °C:
- 2MgO
(s) + Si
(s) + 2CaO
(s) → 2Mg
(g) + Ca
2SiO
4(s) - MgO
(s) + C
(s) → Mg
(g) + CO
(g)
- Dow process
In the United States, magnesium is obtained principally with the Dow process, by electrolysis of fused magnesium chloride from brine and sea water. A saline solution containing Mg2+
ions is first treated with lime (calcium oxide) and the precipitated magnesium hydroxide is collected:
- Mg2+
(aq) + CaO
(s) + H
2O → Ca2+
(aq) + Mg(OH)
2(s)
The hydroxide is then converted to a partial hydrate of magnesium chloride by treating the hydroxide with hydrochloric acid and heating of the product:
- Mg(OH)
2(s) + 2 HCl → MgCl
2(aq) + 2H
2O
(l)
The salt is then electrolyzed in the molten state. At the cathode, the Mg2+
ion is reduced by two electrons to magnesium metal:
- Mg2+
+ 2
e−
→ Mg
At the anode, each pair of Cl−
ions is oxidized to chlorine gas, releasing two electrons to complete the circuit:
- 2 Cl−
→ Cl
2 (g) + 2
e−
- YSZ process
A new process, solid oxide membrane technology, involves the electrolytic reduction of MgO. At the cathode, Mg2+
ion is reduced by two electrons to magnesium metal. The electrolyte is yttria-stabilized zirconia (YSZ). The anode is a liquid metal. At the YSZ/liquid metal anode O2−
is oxidized. A layer of graphite borders the liquid metal anode, and at this interface carbon and oxygen react to form carbon monoxide. When silver is used as the liquid metal anode, there is no reductant carbon or hydrogen needed, and only oxygen gas is evolved at the anode.[36] It has been reported that this method provides a 40% reduction in cost per pound over the electrolytic reduction method.[37]
History
The name magnesium originates from the Greek word for locations related to the tribe of the Magnetes, either a district in Thessaly called Magnesia[38] or Magnesia ad Sipylum, now in Turkey.[39] It is related to magnetite and manganese, which also originated from this area, and required differentiation as separate substances. See manganese for this history.
In 1618, a farmer at Epsom in England attempted to give his cows water from a well there. The cows refused to drink because of the water’s bitter taste, but the farmer noticed that the water seemed to heal scratches and rashes. The substance became known as Epsom salts and its fame spread.[40] It was eventually recognized as hydrated magnesium sulfate, MgSO
4·7 H
2O.
The metal itself was first isolated by Sir Humphry Davy in England in 1808. He used electrolysis on a mixture of magnesia and mercuric oxide.[41] Antoine Bussy prepared it in coherent form in 1831. Davy’s first suggestion for a name was magnium,[41] but the name magnesium is now used in English and all major European languages but Russian.
Uses as a metal
Magnesium is the third-most-commonly-used structural metal, following iron and aluminium.[42] The main applications of magnesium are, in order: aluminium alloys, die-casting (alloyed with zinc),[43] removing sulfur in the production of iron and steel, and the production of titanium in the Kroll process.[44]
Magnesium is used in lightweight materials and alloys. For example, when infused with silicon carbide nanoparticles, it has extremely high specific strength.[45]
Historically, magnesium was one of the main aerospace construction metals and was used for German military aircraft as early as World War I and extensively for German aircraft in World War II. The Germans coined the name «Elektron» for magnesium alloy, a term which is still used today. In the commercial aerospace industry, magnesium was generally restricted to engine-related components, due to fire and corrosion hazards. Magnesium alloy use in aerospace is increasing in the 21st century, driven by the importance of fuel economy.[46] Recent developments in metallurgy and manufacturing have allowed for the potential for magnesium alloys to act as replacements for aluminium and steel alloys in certain applications.[47][48]
In the form of thin ribbons, magnesium is used to purify solvents; for example, preparing super-dry ethanol.[citation needed]
Aircraft
- Wright Aeronautical used a magnesium crankcase in the WWII-era Wright R-3350 Duplex Cyclone aviation engine. This presented a serious problem for the earliest models of the Boeing B-29 Superfortress heavy bomber when an in-flight engine fire ignited the engine crankcase. The resulting combustion was as hot as 5,600 °F (3,100 °C) and could sever the wing spar from the fuselage.[49][50][51]
Automotive
Mg alloy motorcycle engine blocks
- Mercedes-Benz used the alloy Elektron in the bodywork of an early model Mercedes-Benz 300 SLR; these cars competed in the 1955 World Sportscar Championship including a win at the Mille Miglia, and at Le Mans where one was involved in the 1955 Le Mans disaster when spectators were showered with burning fragments of elektron.[citation needed]
- Porsche used magnesium alloy frames in the 917/053 that won Le Mans in 1971, and continues to use magnesium alloys for its engine blocks due to the weight advantage.[citation needed]
- Volkswagen Group has used magnesium in its engine components for many years.[52]
- Mitsubishi Motors uses magnesium for its paddle shifters.[citation needed]
- BMW used magnesium alloy blocks in their N52 engine, including an aluminium alloy insert for the cylinder walls and cooling jackets surrounded by a high-temperature magnesium alloy AJ62A. The engine was used worldwide between 2005 and 2011 in various 1, 3, 5, 6, and 7 series models; as well as the Z4, X1, X3, and X5.[citation needed]
- Chevrolet used the magnesium alloy AE44 in the 2006 Corvette Z06.[citation needed]
Both AJ62A and AE44 are recent developments in high-temperature low-creep magnesium alloys. The general strategy for such alloys is to form intermetallic precipitates at the grain boundaries, for example by adding mischmetal or calcium.[53] New alloy development and lower costs that make magnesium competitive with aluminium will increase the number of automotive applications.[citation needed]
Electronics
Because of low density and good mechanical and electrical properties, magnesium is used for manufacturing of mobile phones, laptop and tablet computers, cameras, and other electronic components.[citation needed] It was used as a premium feature because of its light weight in some 2020 laptops.[54]
Products made of magnesium: firestarter and shavings, sharpener, magnesium ribbon
Other
Magnesium, being readily available and relatively nontoxic, has a variety of uses:
- Magnesium is flammable, burning at a temperature of approximately 3,100 °C (3,370 K; 5,610 °F),[19] and the autoignition temperature of magnesium ribbon is approximately 473 °C (746 K; 883 °F).[55] It produces intense, bright, white light when it burns. Magnesium’s high combustion temperature makes it a useful tool for starting emergency fires. Other uses include flash photography, flares, pyrotechnics, fireworks sparklers, and trick birthday candles. Magnesium is also often used to ignite thermite or other materials that require a high ignition temperature. Magnesium continues to be used as an incendiary element in warfare.[56]
Magnesium firestarter (in left hand), used with a pocket knife and flint to create sparks that ignite the shavings
- In the form of turnings or ribbons, to prepare Grignard reagents, which are useful in organic synthesis.[citation needed]
- As an additive agent in conventional propellants and the production of nodular graphite in cast iron.[citation needed]
- As a reducing agent to separate uranium and other metals from their salts.[citation needed]
- As a sacrificial (galvanic) anode to protect boats, underground tanks, pipelines, buried structures, and water heaters.[citation needed]
- Alloyed with zinc to produce the zinc sheet used in photoengraving plates in the printing industry, dry-cell battery walls, and roofing.[43]
- As a metal, this element’s principal use is as an alloying additive to aluminium with these aluminium-magnesium alloys being used mainly for beverage cans, sports equipment such as golf clubs, fishing reels, and archery bows and arrows.[citation needed]
- Specialty, high-grade car wheels of magnesium alloy are called «mag wheels», although the term is often misapplied to aluminium wheels. Many car and aircraft manufacturers have made engine and body parts from magnesium.[citation needed]
- Magnesium batteries have been commercialized as primary batteries, and are an active topic of research for rechargeable batteries.[citation needed]
Safety precautions
Magnesium block heated with blowtorch to self-combustion, emitting intense white light
| Hazards | |
|---|---|
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H228, H251, H261 |
|
Precautionary statements |
P210, P231, P235, P410, P422[57] |
| NFPA 704 (fire diamond) |
https://cameochemicals.noaa.gov/chemical/6949 0 1 1 |
Magnesium metal and its alloys can be explosive hazards; they are highly flammable in their pure form when molten or in powder or ribbon form. Burning or molten magnesium reacts violently with water. When working with powdered magnesium, safety glasses with eye protection and UV filters (such as welders use) are employed because burning magnesium produces ultraviolet light that can permanently damage the retina of a human eye.[58]
Magnesium is capable of reducing water and releasing highly flammable hydrogen gas:[59]
- Mg (s) + 2 H
2O (l) → Mg(OH)
2 (s) + H
2 (g)
Therefore, water cannot extinguish magnesium fires. The hydrogen gas produced intensifies the fire. Dry sand is an effective smothering agent, but only on relatively level and flat surfaces.
Magnesium reacts with carbon dioxide exothermically to form magnesium oxide and carbon:[60]
- 2 Mg + CO
2 → 2 MgO + C (s)
Hence, carbon dioxide fuels rather than extinguishes magnesium fires.
Burning magnesium can be quenched by using a Class D dry chemical fire extinguisher, or by covering the fire with sand or magnesium foundry flux to remove its air source.[61]
Useful compounds
Magnesium compounds, primarily magnesium oxide (MgO), are used as a refractory material in furnace linings for producing iron, steel, nonferrous metals, glass, and cement. Magnesium oxide and other magnesium compounds are also used in the agricultural, chemical, and construction industries. Magnesium oxide from calcination is used as an electrical insulator in fire-resistant cables.[62]
Magnesium hydride is under investigation as a way to store hydrogen.
Magnesium reacted with an alkyl halide gives a Grignard reagent, which is a very useful tool for preparing alcohols.
Magnesium salts are included in various foods, fertilizers (magnesium is a component of chlorophyll), and microbe culture media.
Magnesium sulfite is used in the manufacture of paper (sulfite process).
Magnesium phosphate is used to fireproof wood used in construction.
Magnesium hexafluorosilicate is used for moth-proofing textiles.
Biological roles
Mechanism of action
The important interaction between phosphate and magnesium ions makes magnesium essential to the basic nucleic acid chemistry of all cells of all known living organisms. More than 300 enzymes require magnesium ions for their catalytic action, including all enzymes using or synthesizing ATP and those that use other nucleotides to synthesize DNA and RNA. The ATP molecule is normally found in a chelate with a magnesium ion.[63]
Nutrition
Diet
Examples of food sources of magnesium (clockwise from top left): bran muffins, pumpkin seeds, barley, buckwheat flour, low-fat vanilla yogurt, trail mix, halibut steaks, garbanzo beans, lima beans, soybeans, and spinach
Spices, nuts, cereals, cocoa and vegetables are rich sources of magnesium.[13] Green leafy vegetables such as spinach are also rich in magnesium.[64]
Beverages rich in magnesium are coffee, tea, and cocoa.[65]
Dietary recommendations
In the UK, the recommended daily values for magnesium are 300 mg for men and 270 mg for women.[66] In the U.S. the Recommended Dietary Allowances (RDAs) are 400 mg for men ages 19–30 and 420 mg for older; for women 310 mg for ages 19–30 and 320 mg for older.[67]
Supplementation
Numerous pharmaceutical preparations of magnesium and dietary supplements are available. In two human trials magnesium oxide, one of the most common forms in magnesium dietary supplements because of its high magnesium content per weight, was less bioavailable than magnesium citrate, chloride, lactate or aspartate.[68][69]
Metabolism
An adult body has 22–26 grams of magnesium,[13][70] with 60% in the skeleton, 39% intracellular (20% in skeletal muscle), and 1% extracellular.[13] Serum levels are typically 0.7–1.0 mmol/L or 1.8–2.4 mEq/L. Serum magnesium levels may be normal even when intracellular magnesium is deficient. The mechanisms for maintaining the magnesium level in the serum are varying gastrointestinal absorption and renal excretion. Intracellular magnesium is correlated with intracellular potassium. Increased magnesium lowers calcium[71] and can either prevent hypercalcemia or cause hypocalcemia depending on the initial level.[71] Both low and high protein intake conditions inhibit magnesium absorption, as does the amount of phosphate, phytate, and fat in the gut. Unabsorbed dietary magnesium is excreted in feces; absorbed magnesium is excreted in urine and sweat.[72]
Detection in serum and plasma
Magnesium status may be assessed by measuring serum and erythrocyte magnesium concentrations coupled with urinary and fecal magnesium content, but intravenous magnesium loading tests are more accurate and practical.[73] A retention of 20% or more of the injected amount indicates deficiency.[74] As of 2004, no biomarker has been established for magnesium.[75]
Magnesium concentrations in plasma or serum may be monitored for efficacy and safety in those receiving the drug therapeutically, to confirm the diagnosis in potential poisoning victims, or to assist in the forensic investigation in a case of fatal overdose. The newborn children of mothers who received parenteral magnesium sulfate during labor may exhibit toxicity with normal serum magnesium levels.[76]
Deficiency
Low plasma magnesium (hypomagnesemia) is common: it is found in 2.5–15% of the general population.[77] From 2005 to 2006, 48 percent of the United States population consumed less magnesium than recommended in the Dietary Reference Intake.[78] Other causes are increased renal or gastrointestinal loss, an increased intracellular shift, and proton-pump inhibitor antacid therapy. Most are asymptomatic, but symptoms referable to neuromuscular, cardiovascular, and metabolic dysfunction may occur.[77] Alcoholism is often associated with magnesium deficiency. Chronically low serum magnesium levels are associated with metabolic syndrome, diabetes mellitus type 2, fasciculation, and hypertension.[79]
Therapy
- Intravenous magnesium is recommended by the ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death for patients with ventricular arrhythmia associated with torsades de pointes who present with long QT syndrome; and for the treatment of patients with digoxin induced arrhythmias.[80]
- Magnesium sulfate – intravenous – is used for the management of pre-eclampsia and eclampsia.[81][82]
- Hypomagnesemia, including that caused by alcoholism, is reversible by oral or parenteral magnesium administration depending on the degree of deficiency.[83]
- There is limited evidence that magnesium supplementation may play a role in the prevention and treatment of migraine.[84]
Sorted by type of magnesium salt, other therapeutic applications include:
- Magnesium sulfate, as the heptahydrate called Epsom salts, is used as bath salts, a laxative, and a highly soluble fertilizer.[85]
- Magnesium hydroxide, suspended in water, is used in milk of magnesia antacids and laxatives.
- Magnesium chloride, oxide, gluconate, malate, orotate, glycinate, ascorbate and citrate are all used as oral magnesium supplements.
- Magnesium borate, magnesium salicylate, and magnesium sulfate are used as antiseptics.
- Magnesium bromide is used as a mild sedative (this action is due to the bromide, not the magnesium).
- Magnesium stearate is a slightly flammable white powder with lubricating properties. In pharmaceutical technology, it is used in pharmacological manufacture to prevent tablets from sticking to the equipment while compressing the ingredients into tablet form.
- Magnesium carbonate powder is used by athletes such as gymnasts, weightlifters, and climbers to eliminate palm sweat, prevent sticking, and improve the grip on gymnastic apparatus, lifting bars, and climbing rocks.
Overdose
Overdose from dietary sources alone is unlikely because excess magnesium in the blood is promptly filtered by the kidneys,[77] and overdose is more likely in the presence of impaired renal function. In spite of this, megadose therapy has caused death in a young child,[86] and severe hypermagnesemia in a woman[87] and a young girl[88] who had healthy kidneys.
The most common symptoms of overdose are nausea, vomiting, and diarrhea; other symptoms include hypotension, confusion, slowed heart and respiratory rates, deficiencies of other minerals, coma, cardiac arrhythmia, and death from cardiac arrest.[71]
Function in plants
Plants require magnesium to synthesize chlorophyll, essential for photosynthesis. Magnesium in the center of the porphyrin ring in chlorophyll functions in a manner similar to the iron in the center of the porphyrin ring in heme. Magnesium deficiency in plants causes late-season yellowing between leaf veins, especially in older leaves, and can be corrected by either applying epsom salts (which is rapidly leached), or crushed dolomitic limestone, to the soil.
See also
- List of countries by magnesium production
- Magnesium oil
References
- ^ «Standard Atomic Weights: Magnesium». CIAAW. 2011.
- ^ Rumble, p. 4.61
- ^ Mg(0) has been synthesized in a compound containing a Na2Mg22+ cluster coordinated to a bulky organic ligand; see Rösch, B.; Gentner, T. X.; Eyselein, J.; Langer, J.; Elsen, H.; Li, W.; Harder, S. (2021). «Strongly reducing magnesium(0) complexes». Nature. 592 (7856): 717–721. Bibcode:2021Natur.592..717R. doi:10.1038/s41586-021-03401-w. PMID 33911274. S2CID 233447380
- ^ Bernath, P. F.; Black, J. H. & Brault, J. W. (1985). «The spectrum of magnesium hydride» (PDF). Astrophysical Journal. 298: 375. Bibcode:1985ApJ…298..375B. doi:10.1086/163620.. See also Low valent magnesium compounds.
- ^ Rumble, p. 12.135
- ^ Rumble, p. 12.137
- ^ Rumble, p. 12.28
- ^ Rumble, p. 4.70
- ^ Gschneider, K. A. (1964). Physical Properties and Interrelationships of Metallic and Semimetallic Elements. Solid State Physics. Vol. 16. p. 308. doi:10.1016/S0081-1947(08)60518-4. ISBN 9780126077162.
- ^ a b c Rumble, p. 4.19
- ^ a b Railsback, L. Bruce. «Abundance and form of the most abundant elements in Earth’s continental crust» (PDF). Some Fundamentals of Mineralogy and Geochemistry. Archived from the original (PDF) on 27 September 2011. Retrieved 15 February 2008.
- ^ Anthoni, J Floor (2006). «The chemical composition of seawater». seafriends.org.nz.
- ^ a b c d e «Dietary Supplement Fact Sheet: Magnesium». Office of Dietary Supplements, US National Institutes of Health. 11 February 2016. Retrieved 13 October 2016.
- ^ «alkaline-earth metal — Physical and chemical behaviour | Britannica». www.britannica.com. Retrieved 27 March 2022.
- ^ Sandlöbes, S.; Friák, M.; Korte-Kerzel, S.; Pei, Z.; Neugebauer, J.; Raabe, D. (2017). «A rare-earth free magnesium alloy with improved intrinsic ductility». Scientific Reports. 7 (1): 10458. Bibcode:2017NatSR…710458S. doi:10.1038/s41598-017-10384-0. PMC 5585333. PMID 28874798.
- ^ Zeng, Zhuoran; Nie, Jian-Feng; Xu, Shi-Wei; h. j. Davies, Chris; Birbilis, Nick (2017). «Super-formable pure magnesium at room temperature». Nature Communications. 8 (1): 972. Bibcode:2017NatCo…8..972Z. doi:10.1038/s41467-017-01330-9. PMC 5715137. PMID 29042555.
- ^ «Reactions of Group 2 Elements with Water». Chemistry LibreTexts. 3 October 2013. Retrieved 27 March 2022.
- ^ Vol’nov, I.I., Tokareva, S.A., Belevskii, V.N. et al. «The formation of magnesium perperoxide Mg(O2)2 in the reaction of magnesium peroxide with ozone» _Russ Chem Bull_ **19**, 468–471 (1970). https://doi.org/10.1007/BF00848959
- ^ a b Dreizin, Edward L.; Berman, Charles H. & Vicenzi, Edward P. (2000). «Condensed-phase modifications in magnesium particle combustion in air». Scripta Materialia. 122 (1–2): 30–42. CiteSeerX 10.1.1.488.2456. doi:10.1016/S0010-2180(00)00101-2.
- ^ DOE Handbook – Primer on Spontaneous Heating and Pyrophoricity. U.S. Department of Energy. December 1994. p. 20. DOE-HDBK-1081-94. Archived from the original on 15 April 2012. Retrieved 21 December 2011.
- ^ B. Rösch, T. X. Gentner, J. Eyselein, J. Langer, H. Elsen & S. Harder, «Strongly reducing magnesium(0) complexes», _Nature_ **592**, 717–721 (2021). [doi: 10.1038/s41586-021-03401-w](https://doi.org/10.1038/s41586-021-03401-w)
- ^ Hannavy, John (2013). Encyclopedia of Nineteenth-Century Photography. Routledge. p. 84. ISBN 978-1135873271.
- ^ Scientific American: Supplement. Vol. 48. Munn and Company. 1899. p. 20035.
- ^ Billboard. Nielsen Business Media, Inc. 1974. p. 20.
- ^ Altman, Rick (2007). Silent Film Sound. Columbia University Press. p. 41. ISBN 978-0231116633.
- ^ Lindsay, David (2005). Madness in the Making: The Triumphant Rise & Untimely Fall of America’s Show Inventors. iUniverse. p. 210. ISBN 978-0595347667.
- ^ McCormick, John; Pratasik, Bennie (2005). Popular Puppet Theatre in Europe, 1800–1914. Cambridge University Press. p. 106. ISBN 978-0521616157.
- ^ Makar, G. L.; Kruger, J. (1993). «Corrosion of magnesium». International Materials Reviews. 38 (3): 138–153. Bibcode:1993IMRv…38..138M. doi:10.1179/imr.1993.38.3.138.
- ^ a b c d e Dodson, Brian (29 August 2013). «Stainless magnesium breakthrough bodes well for manufacturing industries». Gizmag.com. Retrieved 29 August 2013.
- ^ Birbilis, N.; Williams, G.; Gusieva, K.; Samaniego, A.; Gibson, M. A.; McMurray, H. N. (2013). «Poisoning the corrosion of magnesium». Electrochemistry Communications. 34: 295–298. doi:10.1016/j.elecom.2013.07.021.
- ^ Czerwinski, Frank. «Controlling the ignition and flammability of magnesium for aerospace applications.» Corrosion Science 86 (2014): 1-16.
- ^ Bray, E. Lee (February 2019) Magnesium Metal. Mineral Commodity Summaries, U.S. Geological Survey
- ^ Vardi, Nathan. «Man With Many Enemies». Forbes. Retrieved 30 January 2021.
- ^ What to do about the magnesium shortage, Supply Management, published 17 February 2022, accessed 12 June 2022
- ^ «Magnesium Overview». China magnesium Corporation. Retrieved 8 May 2013.
- ^ Pal, Uday B.; Powell, Adam C. (2007). «The Use of Solid-Oxide-Membrane Technology for Electrometallurgy». JOM. 59 (5): 44–49. Bibcode:2007JOM….59e..44P. doi:10.1007/s11837-007-0064-x. S2CID 97971162.
- ^ Derezinski, Steve (12 May 2011). «Solid Oxide Membrane (SOM) Electrolysis of Magnesium: Scale-Up Research and Engineering for Light-Weight Vehicles» (PDF). MOxST. Archived from the original (PDF) on 13 November 2013. Retrieved 27 May 2013.
- ^ «Magnesium: historical information». webelements.com. Retrieved 9 October 2014.
- ^ languagehat (28 May 2005). «MAGNET». languagehat.com. Retrieved 18 June 2020.
- ^ Ainsworth, Steve (1 June 2013). «Epsom’s deep bath». Nurse Prescribing. 11 (6): 269. doi:10.12968/npre.2013.11.6.269.
- ^ a b Davy, H. (1808). «Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia». Philosophical Transactions of the Royal Society of London. 98: 333–370. Bibcode:1808RSPT…98..333D. doi:10.1098/rstl.1808.0023. JSTOR 107302.
- ^ Segal, David (2017). Materials for the 21st Century. Oxford University Press. ISBN 978-0192526090.
- ^ a b Baker, Hugh D. R.; Avedesian, Michael (1999). Magnesium and magnesium alloys. Materials Park, OH: Materials Information Society. p. 4. ISBN 978-0871706577.
- ^ Ketil Amundsen; Terje Kr. Aune; Per Bakke; Hans R. Eklund; Johanna Ö. Haagensen; Carlos Nicolas; et al. (2002). «Magnesium». Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a15_559. ISBN 978-3527306732.
- ^ Chin, Matthew (23 December 2015). «UCLA researchers create super-strong magnesium metal». ucla.edu.
- ^ Aghion, E.; Bronfin, B. (2000). «Magnesium Alloys Development towards the 21st Century». Materials Science Forum. 350–351: 19–30. doi:10.4028/www.scientific.net/MSF.350-351.19. S2CID 138429749.
- ^ Shu, Dong Wei, and Iram Raza Ahmad. «Magnesium Alloys: An Alternative for Aluminium in Structural Applications.» In Advanced Materials Research, vol. 168, pp. 1631-1635. Trans Tech Publications Ltd, 2011.
- ^ Magnesium alloy as a lighter alternative to aluminum alloy, Phys.org, November 29th 2017
- ^ Dreizin, Edward L.; Berman, Charles H.; Vicenzi, Edward P. (2000). «Condensed-phase modifications in magnesium particle combustion in air». Scripta Materialia. 122 (1–2): 30–42. CiteSeerX 10.1.1.488.2456. doi:10.1016/S0010-2180(00)00101-2.
- ^ Dorr, Robert F. (15 September 2012). Mission to Tokyo: The American Airmen Who Took the War to the Heart of Japan. pp. 40–41. ISBN 978-1610586634.
- ^ AAHS Journal. Vol. 44–45. American Aviation Historical Society. 1999.
- ^ «1950: The metal is magnesium, the car is the Beetle». www.hydro.com. 18 August 2020. Retrieved 5 April 2021.
- ^ Luo, Alan A. & Powell, Bob R. (2001). Tensile and Compressive Creep of Magnesium-Aluminum-Calcium Based Alloys (PDF) (Report). Materials & Processes Laboratory, General Motors Research & Development Center. Archived from the original (PDF) on 28 September 2007. Retrieved 21 August 2007.
- ^ Dignan, Larry (2 January 2020). «Blue magnesium alloy laptops: Premium price, plastic feel, but lightweight». ZDNet, A RED VENTURES COMPANY.
- ^ «Magnesium (Powder)». International Programme on Chemical Safety (IPCS). IPCS INCHEM. April 2000. Retrieved 21 December 2011.
- ^ «9N510 (ML-5) Submunition». Collective Awareness to UXO. Retrieved 22 November 2022.
- ^ Magnesium. Sigma Aldrich
- ^ «Science Safety: Chapter 8». Government of Manitoba. Retrieved 21 August 2007.
- ^ «Chemistry : Periodic Table : magnesium : chemical reaction data». webelements.com. Retrieved 26 June 2006.
- ^ «The Reaction Between Magnesium and CO2«. Purdue University. Retrieved 15 June 2016.
- ^ Cote, Arthur E. (2003). Operation of Fire Protection Systems. Jones & Bartlett Learning. p. 667. ISBN 978-0877655848.
- ^ Linsley, Trevor (2011). «Properties of conductors and insulators». Basic Electrical Installation Work. p. 362. ISBN 978-0080966281.
- ^
Romani, Andrea, M.P. (2013). «Chapter 3. Magnesium in Health and Disease». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 49–79. doi:10.1007/978-94-007-7500-8_3. ISBN 978-94-007-7499-5. PMID 24470089. - ^ «Magnesium in diet». MedlinePlus, U.S. National Library of Medicine, National Institutes of Health. 2 February 2016. Retrieved 13 October 2016.
- ^ Gropper, Sareen S.; Smith, Jack L.; Carr, Timothy P. (5 October 2016). Advanced Nutrition and Human Metabolism. Cengage Learning. ISBN 978-1-337-51421-7.
- ^ «Vitamins and minerals – Others – NHS Choices». Nhs.uk. 26 November 2012. Retrieved 19 September 2013.
- ^ «Magnesium», pp. 190–249 in «Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride». National Academy Press. 1997.
- ^ Firoz M; Graber M (2001). «Bioavailability of US commercial magnesium preparations». Magnes Res. 14 (4): 257–262. PMID 11794633.
- ^ Lindberg JS; Zobitz MM; Poindexter JR; Pak CY (1990). «Magnesium bioavailability from magnesium citrate and magnesium oxide». J Am Coll Nutr. 9 (1): 48–55. doi:10.1080/07315724.1990.10720349. PMID 2407766.
- ^ Saris NE, Mervaala E, Karppanen H, Khawaja JA, Lewenstam A (April 2000). «Magnesium. An update on physiological, clinical and analytical aspects». Clin Chim Acta. 294 (1–2): 1–26. doi:10.1016/S0009-8981(99)00258-2. PMID 10727669.
- ^ a b c «Magnesium». Umm.edu. University of Maryland Medical Center. 7 May 2013. Archived from the original on 16 February 2017. Retrieved 19 September 2013.
- ^ Wester PO (1987). «Magnesium». Am. J. Clin. Nutr. 45 (5 Suppl): 1305–1312. doi:10.1093/ajcn/45.5.1305. PMID 3578120.
- ^ Arnaud MJ (2008). «Update on the assessment of magnesium status». Br. J. Nutr. 99 Suppl 3: S24–S36. doi:10.1017/S000711450800682X. PMID 18598586.
- ^ Rob PM; Dick K; Bley N; Seyfert T; Brinckmann C; Höllriegel V; et al. (1999). «Can one really measure magnesium deficiency using the short-term magnesium loading test?». J. Intern. Med. 246 (4): 373–378. doi:10.1046/j.1365-2796.1999.00580.x. PMID 10583708. S2CID 6734801.
- ^ Franz KB (2004). «A functional biological marker is needed for diagnosing magnesium deficiency». J Am Coll Nutr. 23 (6): 738S–741S. doi:10.1080/07315724.2004.10719418. PMID 15637224. S2CID 37427458.
- ^ Baselt, R. (2008). Disposition of Toxic Drugs and Chemicals in Man (8th ed.). Biomedical Publications. pp. 875–877. ISBN 978-0962652370.
- ^ a b c Ayuk J.; Gittoes N.J. (March 2014). «Contemporary view of the clinical relevance of magnesium homeostasis». Annals of Clinical Biochemistry. 51 (2): 179–188. doi:10.1177/0004563213517628. PMID 24402002. S2CID 21441840.
- ^ Rosanoff, Andrea; Weaver, Connie M; Rude, Robert K (March 2012). «Suboptimal magnesium status in the United States: are the health consequences underestimated?» (PDF). Nutrition Reviews. 70 (3): 153–164. doi:10.1111/j.1753-4887.2011.00465.x. PMID 22364157.
- ^ Geiger H; Wanner C (2012). «Magnesium in disease». Clin Kidney J. 5 (Suppl 1): i25–i38. doi:10.1093/ndtplus/sfr165. PMC 4455821. PMID 26069818.
- ^ Zipes DP; Camm AJ; Borggrefe M; et al. (2012). «ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society». Circulation. 114 (10): e385–e484. doi:10.1161/CIRCULATIONAHA.106.178233. PMID 16935995.
- ^ James MF (2010). «Magnesium in obstetrics». Best Pract Res Clin Obstet Gynaecol. 24 (3): 327–337. doi:10.1016/j.bpobgyn.2009.11.004. PMID 20005782.
- ^ Euser, A. G.; Cipolla, M. J. (2009). «Magnesium Sulfate for the Treatment of Eclampsia: A Brief Review». Stroke. 40 (4): 1169–1175. doi:10.1161/STROKEAHA.108.527788. PMC 2663594. PMID 19211496.
- ^ Giannini, A. J. (1997). Drugs of Abuse (Second ed.). Los Angeles: Physicians Management Information Co. ISBN 978-0874894998.
- ^ Teigen L, Boes CJ (2014). «An evidence-based review of oral magnesium supplementation in the preventive treatment of migraine». Cephalalgia (Review). 35 (10): 912–922. doi:10.1177/0333102414564891. PMID 25533715. S2CID 25398410.
There is a strong body of evidence demonstrating a relationship between magnesium status and migraine. Magnesium likely plays a role in migraine development at a biochemical level, but the role of oral magnesium supplementation in migraine prophylaxis and treatment remains to be fully elucidated. The strength of evidence supporting oral magnesium supplementation is limited at this time.
- ^ Gowariker, Vasant; Krishnamurthy, V. P.; Gowariker, Sudha; Dhanorkar, Manik; Paranjape, Kalyani (8 April 2009). The Fertilizer Encyclopedia. p. 224. ISBN 978-0470431764.
- ^ McGuire, John; Kulkarni, Mona Shah; Baden, Harris (February 2000). «Fatal Hypermagnesemia in a Child Treated With Megavitamin/Megamineral Therapy». Pediatrics. 105 (2): E18. doi:10.1542/peds.105.2.e18. PMID 10654978. Retrieved 1 February 2017.
- ^ Kontani M; Hara A; Ohta S; Ikeda T (2005). «Hypermagnesemia induced by massive cathartic ingestion in an elderly woman without pre-existing renal dysfunction». Intern. Med. 44 (5): 448–452. doi:10.2169/internalmedicine.44.448. PMID 15942092.
- ^ Kutsal, Ebru; Aydemir, Cumhur; Eldes, Nilufer; Demirel, Fatma; Polat, Recep; Taspınar, Ozan; Kulah, Eyup (February 2000). «Severe Hypermagnesemia as a Result of Excessive Cathartic Ingestion in a Child Without Renal Failure». Pediatrics. 205 (2): 570–572. doi:10.1097/PEC.0b013e31812eef1c. PMID 17726419.
Cited sources
- Rumble, John R., ed. (2018). CRC Handbook of Chemistry and Physics (99th ed.). Boca Raton, FL: CRC Press. ISBN 978-1-1385-6163-2.
External links
- Magnesium at The Periodic Table of Videos (University of Nottingham)
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry’s Chemistry World: Magnesium
- «Magnesium – a versatile and often overlooked element: new perspectives with a focus on chronic kidney disease». Clin Kidney J. 5 (Suppl 1). February 2012. Archived from the original on 9 June 2013.
История магния
Магний в виде металла был впервые получен Гемфри Дэви в 1808 году. Английский химик проводил процесс электролиза между влажной смесью белой магнезии и оксидом ртути, в результате чего получил сплав ртути с неизвестным металлом (амальгаму). После выгонки ртути Дэви получил новое вещество – порошок металла, который был назван магнием (calorizator). Через два десятилетия, в 1828 году француз А.Бюсси получил чистый металлический магний.
Общая характеристика магния
Магний является элементом главной подгруппы II группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 12 и атомную массу 24,305. Принятое обозначение – Mg (от латинского Magnesium).
Нахождение в природе
По количеству содержания в земной коре магний занимает 8-е место среди минеральных веществ, он очень распространён. Природными источниками магния являются морская вода, ископаемые минеральные отложения и рассолы.
Физические и химические свойства
Магний является лёгким и ковким металлом, его цвет – серебристо-белый с явным металлическим блеском. В обычном состоянии покрыт плёнкой оксида магния, которую можно разрушить, нагрев металл до 600-650˚С. Магний сгорает, выделяя ослепительно белое пламя и образуя оксид и нитрид магния.
Суточная потребность в магнии
Суточная потребность в магнии зависит от возраста, пола и физического состояния человека. Для здорового взрослого человека составляет от 400 до 500 мг.
Продукты питания богатые магнием
В продуктах питания содержится различное количество магния, расположим их по мере убывания содержания полезного микроэлемента:
- крупы (пшено и гречка)
- горох, фасоль, лесные орехи, тахинная халва
- сухое молоко, арбуз, пшеничные отруби, шпинат, соевая мука
- ржаной хлеб, абрикосы, лимон, грейпфрут
- печень говяжья, мясо кролика, свинина
- пшеничный хлеб, кукуруза, морковь, салат
- молочные продукты, рыба, яйца
- картофель, репчатый лук, белокочанная капуста
- томаты, зелёный лук, свёкла
- яблоки, сливы.
Усвояемость магния
Всасывание органических соединений магния в основном происходит в двенадцатиперстной и толстой кишках, при чрезмерном употреблении кофеина, алкоголя и калия организм теряет значительную часть магния с мочой.
Взаимодействие с другими
Для организма важен баланс между кальцием и магнием, потому что именно эти минералы отвечают за нормальное состояние костной ткани и зубов. В аптечных витаминно-минеральных комплексах количество кальция и магния содержится в оптимальных количествах.
Натрий, магний и фосфор регулируют процессы в нервной системе и отвечают за мышечную активность. Обменные процессы магния в организме происходят с помощью витаминов В6, D, Е и калия.
Признаки нехватки магния
Нехватку магния в организме могут вызвать болезни почек, расстройство желудка, приём мочегонных средств и некоторых контрацептивов, чрезмерное увлечение алкоголем и кофеином. Признаками нехватки магния считают бессонницу, раздражительность, головокружения, нарушения сердцебиения и скачки кровяного давления, частые головные боли, чувство усталости, мерцающие точки перед глазами, судороги, мышечные спазмы, выпадение волос.
Признаки избытка магния
Признаками избытка магния считают:
- понос, тошноту, рвоту
- сонливость, замедление пульса
- нарушения координации, речи
- высыхание слизистых (во рту и носу).
Полезные свойства магния и его влияние на организм
Магний важен для эффективного функционирования нервов и мышц, важен для превращения сахара крови в энергию. Магний поддерживает здоровое состояние зубов, помогает предупредить отложения кальция, камни в почках и желчном пузыре, приносит облегчение при несварении. Организм человека содержит приблизительно 21 г магния.
Магний нормализует деятельность сердечно-сосудистой и эндокринной систем организма, функции головного мозга, оказывает помощь при выведении токсинов и тяжёлых металлов.
Применение магния в жизни
Соединения магния (сплавы) используются в самолётостроении и автомобильном производстве из-за прочности и лёгкости магниевых сплавов. Магний применяется как химический источник тока, в медицине, военном деле, в фотографии.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Глоссарий. Химия
Магний
Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов, с атомным номером 12. Обозначается символом Mg (лат. Magnesium). Простое вещество магний (CAS-номер: 7439-95-4) — лёгкий, ковкий металл серебристо-белого цвета. Средне распространён в природе. При горении выделяется большое количество света и тепла.
Происхождение названия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари называли её горькой солью, а также английской, или эпсомской солью. Минерал эпсомит имеет состав MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
Впервые был выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
MgCl2 (электролиз) = Mg + Cl2.
Расплавленный металл периодически отбирают из электролизной ванны, а в нее добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые «отнимают» примеси от магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
MgO + C = Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
CaCO3·MgCO3 = CaO + MgO + 2CO2,
2MgO + CaO + Si = CaSiO3 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, пространственная группа P 63/mmc. При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Плотность магния при 20 °C — 1,737 г/см³, температура плавления металла tпл = 651 °C, температура кипения — tкип = 1103 °C, теплопроводность при 20 °C — 156 Вт/(м·К). Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Химические свойства
Смесь порошкового магния с перманганатом калия KMnO4 — взрывчатое вещество.
Раскаленный магний реагирует с водой:
Mg (раск.) + Н2О = MgO + H2↑;
Щелочи на магний не действуют, в кислотах он растворяется легко с выделением водорода:
Mg + 2HCl = MgCl2 + H2;
При нагревании на воздухе магний сгорает, с образованием оксида, также с азотом может образовываться небольшое количество нитрида:
2Mg + О2 = 2MgO;
3Mg + N2 = Mg3N2
Источник: Википедия
Другие заметки по химии
TopasNew » Ответы Тривиадор » Биология и химия » Под каким номером расположен магний в таблице Д. И. Менделеева?
Магний в таблице Д. И. Менделеева расположен под номером:
Верный ответ: 12.
Кстати, а Вы знали, что деревья-великаны баобабы вырастают до 21 метра в высоту и достигают 9 метров в обхвате. Правда, со временем они не увеличиваются, а уменьшаются!
С ув., редакция ответов на вопросы из игры Triviador!
Поделиться с друзьями:
Выставить рейтинг новости:
- 0
- 1
- 2
- 3
- 4
- 5
Похожие новости:
Под каким номером расположен радий в таблице Д. И. Менделеева?..
Азот в таблице Д. И. Менделеева расположен под номером:..
Под каким номером расположен европий в таблице Менделеева?..
Платина в таблице Д. И. Менделеева расположена под номером:..
Как обозначается мышьяк в периодической таблице Менделеева?..
Что обозначает Cu в периодической системе химических элементов Д. И…
{poster_avatar} flint
2 831 19.11.14
Статья «Под каким номером расположен магний в таблице Д. И. Менделеева?», опубликованная 19.ноя.2014 18:34, находится в категории Биология и химия и имеет более 2 831 просмотров.
Регистрация
Авторизация VK
Разделы
-
Статьи об играх
- Новости игростроя
- Интервью с разработчиками
- Игровая аналитика
- Статьи на общеигровую тематику
-
Прохождение Fallout 4
- Прохождение квестов
- Журналы
- Спутники
- Голограммы
- Пупсы
-
Советы и подсказки
- ClickerHeroes
- 94% (процента)
- 2048
-
Russia.Triviador
- Искусство
- География
- Литература
- Биология и химия
- Развлечения
- Общие знания
- История
- Математика и физика
- Спорт
- Образ жизни
- Тривиадор с друзьями
Статья дня
Мировой игрострой: новости игр
Как работает VPN на iPhone?…
VPN, или виртуальная частная сеть, защищает и шифрует ваше интернет-соединение….

До сегодняшнего дня магнию по сравнению с другими металлами столько внимания, как сейчас, никогда не уделялось. Это связано со сложностью установления его концентрации в плазме крови. Магний достаточно сложно распределяется в организме, он находится и в органах, и в тканях, вне клеток и внутри них.
Магний (Mg в Таблице Менделеева) является четвертым по счету из важнейших химических элементов. Всего их 12. Первые места занимают калий, кальций и натрий.
Магний и его функции
Магний участвует в процессе усвоения витаминов группы B, C 4,5; участвует в фосфорном и углеводном обмене, а также в передаче нервно-мышечного импульса. Он оказывает влияние на количество кальция в крови.
Препараты магния действуют на снижение повышенного давления, рост и укрепление костей, используется при стрессах и мигренях. Действие препаратов магния достаточно разнообразно.
Роль магния в системе органов кровообращения
Магний влияет на пласт клеток, называемых эндотелием – они покрывают внутреннюю поверхность сердечных полостей кровеносных и лимфатических сосудов. Было проведено исследование, в котором участвовали две группы людей, в одной из них проводилось использование препарата магния, а в другой – плацебо. В ходе этого исследования выяснено, что через полгода приема препарата магния результаты анализов у пациентов улучшились. Можно сделать вывод, что пренебрегать этими препаратами не следует.
В связи с исследованиями, которые проводились на протяжении нескольких лет, были сделаны выводы о развитии ишемической болезни сердца вследствие недостаточного содержания в организме магния. Гипомагниемия наблюдается у пациентов с высоким давлением, с сахарным диабетом второго типа, его недостаток может сказываться на прогрессировании атеросклероза, появляются пролапс митрального клапана, аритмия и тахикардия. Показатель магния в крови может говорить о тяжести заболевания, о его прогрессировании.
Как проявляется недостаток магния в организме
Недостаточное содержание магния проявляется как в проблемах опорно-двигательной системы, сердечно-сосудистой и в проблемах различных органов. Пациенты жалуются: на судороги, нервозность, утомляемость, кошмары, бессонницу, головокружения, снижение внимания, выпадение волос, диарею, запоры, тошноту, повышение давления. Во время тщательного обследования могут выявиться такие заболевания, как иммунодефицитные состояния, сахарный диабет, мочекаменная и желчекаменная болезни.
Назначение препаратов магния
Препараты магния назначаются в качестве восстановления процессов, в которых принимает непосредственное участие сам магний. Препараты назначаются как внутривенно, так и перорально при сердечных патологиях.
«Магнерот» назначается в кардиологической практике, состоит он из оротовой кислоты и соли магния. Синтезируется кислота в печени человека, свойства ее были открыты в 60-х годах. Назначение магния в те годы снизило летальность от инфаркта миокарда, далее его применение расширилось и стало незаменимым в кардиологической практике. Также оротовая кислота активно используется спортсменами, так как повышает выносливость.
«Магнерот» применяется при ИБС, вследствие чего сокращается прием нитроглицерина, он также достаточно благоприятно влияет на количество сахара в крови. Препараты магния на самом деле очень эффективны и отлично переносятся пациентами.
В чем причина недостаточного содержания магния?
В организме человека находится 24 г магния, из которых 60% входит в состав костей, 20% – в состав мышечной ткани, 0.8% – в эритроциты и плазму крови, 39% находится внутри клеток. Суточная доза составляет: для мужчин – 350 мг, для женщин – 300 мг.
Дефицит магния может быть связан с жизненными условиями. Организм исчерпывает свои ресурсы при алкоголизме, неправильном питании, беременности, потливости, гормональной контрацепции, физических нагрузках.
Усвояемость магния из продуктов питания составляет 30-35%, уменьшению его всасывания могут способствовать заболевания органов пищеварения. Продукты, богатые магнием, которые необходимо по возможности употреблять каждому, это: шоколад, орехи, зелень, бобовые, каши.
Также дефицит магния может развиваться при определенных заболеваниях. Это инфаркт миокарда, нефротический синдром, ожирение, гипертиреоз, артериальная гипертензия, длительный прием антибиотиков.
Как выяснилось, магний– это непросто химическое соединение, а очень важный элемент, который играет одну из главных ролей в состоянии здоровья человека. От магния зависит количество кальция, он также участвует в синтезе белка, и еще в более 300-х процессах в организме человека.
МАГНИЙ
- МАГНИЙ
-
Mg (magnesium),
химический элемент IIA подгруппы периодической системы элементов — семейства щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra). Открыт английским химиком Х.Дэви в 1808. Магний — один из наиболее легких металлов; недостаток его прочности устраняется в сплавах небольшими добавками других металлов. Сплавы магния широко применяют в ракетной технике, самолетостроении, электронной технике, авто-, мото- и приборостроении, для изготовления ручного инструмента, спортивного снаряжения.
См. также СПЛАВЫ. Магний — один из самых распространенных металлов, составляющий 2,09% (масс.) земной коры. Он встречается во многих соединениях — в виде силикатов (тальк 3MgO*4SiO2*H2O, серпентин Mg6[[Si4O10]](OH)8, асбест CaOЧ3MgOЧ4SiO2, оливин (MgFe)2*SiO4, морская пенка, или сепиолит, H4Mg2Si3O10), карбонатов (магнезит MgCO3, доломит MgCO3. CaCO3), хлоридов (карналлит KCl*MgCl2*6H2O, бишофит MgCl2*6H2O), гидроксида (брусит MgO*H2O). Хлорид и сульфат магния присутствуют в минеральных водах, соляных озерах и морской воде. Обширные кристаллические отложения этих солей остаются после испарения воды на суше после отступившего моря; примером служат отложения хлоридов магния в Верхнекамском месторождении. Отложения карналлита в Штасфурте (Германия) являются всемирно известными источниками калия и магния. В малых концентрациях магний рассеян в природе. Почти всякая почва и все растительные и животные ткани, как известно, содержат магний, который, очевидно, играет существенную роль в образовании хлорофилла зеленых растений. СВОЙСТВА МАГНИЯ
Атомный номер 12 Атомная масса 24,305 Изотопыстабильные 24, 25, 26
нестабильные 20, 21, 23, 27, 28
Температура плавления, ° С 650 Температура кипения, ° С 1107 Плотность, г/см3 1,738 Твердость (по Моосу) 2,0 Содержание в земной коре, % (масс.) 2,09 Степени окисления +2
Свойства. В подгруппе щелочноземельных металлов магний расположен между бериллием и кальцием, имеет степень окисления +2 и по свойствам близок к бериллию. Это блестящий белый металл, очень легкий, достаточно мягкий, ковкий и пластичный. По теплопроводности и электрической проводимости он лишь немного уступает Al. Магний — активный металл, его порошок или тонкая лента при нагревании возгораются, образуя ослепительно белое пламя; продуктами взаимодействия являются оксид MgO в смеси с нитридом MgN2. В сухой атмосфере при обычных условиях стабилен, так как быстро покрывается тонкой защитной оксидной пленкой; компактный металл можно обрабатывать в кузнечном горне. При нагревании соединяется с серой, азотом, галогенами и другими неметаллами. Холодная вода слабо действует на металл, с горячей он медленно реагирует с образованием малорастворимого гидроксида магния, а из паров воды выделяет водород. Mg растворяется в большинстве разбавленных кислот с выделением водорода, но HF слабо действует на Mg (пассивирует его) благодаря образованию на поверхности металла плотной, прочной и нерастворимой пленки фторида. Щелочи на магний не действуют. В сплавах с небольшим количеством других металлов приобретает твердость, прочность, повышается его коррозионная стойкость (особенно в сплавах с марганцем) при малой плотности. Но все же во влажной атмосфере и воде, особенно морской, коррозийонная стойкость сплавов магния относительно невелика. Наиболее ценные мягкие сплавы магния — электроны: Mg — Al — Zn (Al 3-10%, Zn 0,2-3%), Mg — Mn и Mg — Zn — Zr. Mg получают в основном электролизом из расплава MgCl2 при 700° С, а также металлотермическим восстановлением обожженных магнезита, доломита.
См. также МАГНИЕВАЯ ПРОМЫШЛЕННОСТЬ. Чистый магний используется в металлургии для получения некоторых металлов (например, титана), для раскисления и обессеривания в процессе производства сталей и сплавов цветных металлов, в составе реактива Гриньяра в органическом синтезе, в пиротехнике для изготовления осветительных и зажигательных ракет на основе смесей порошка Mg с окислителями.
Соединения. Магний как активный металл образует различные соединения — карбонат, оксид, сульфат и хлорид и другие.
Карбонат. MgCO3 (средняя соль) является основой минерала магнезита. При добавлении его к раствору солей магния образуется основной карбонат магния Mg2(OH)2CO3Ч3H2O. В медицине это препарат белой магнезии — слабительное и антацид; в промышленности в смеси с 15% асбестового волокна служит теплоизолятором, применяется для огнезащиты, для очистки жидкостей; используется также в производстве зубного порошка, пудры, других солей магния, минеральной воды, пигментов, бумаги и резиновых изделий. Основной карбонат хорошо растворим в воде, насыщенной CO2; он образует гидрокарбонат магния Mg(HCO3)2, вызывающий жесткость воды. Оксид MgO (жженая магнезия) — белый рыхлый легкий порошок; его получают прокаливанием среднего или основного карбоната при 700° С. При смешении легкого оксида с раствором хлорида магния образуется прочный магнезиальный цемент, используемый как штукатурка, побелка и для отделки полов. Карбонат, прокаленный выше 1400° C, образует оксид в 3,5 раза плотнее предыдущего MgO, так называемый тяжелый, обожженный до спекания, оксид магния, не содержащий CO2 и не реагирующий с водой. Он имеет температуру плавления 2800° C и в виде магнезиального кирпича является наиболее тугоплавким огнеупорным материалом для металлургических печей, тиглей, труб. Сульфат MgSO4.H2O (минерал кизерит) и MgSO4.7H2O (английская соль) встречаются в водах минеральных источников, но получают их кристаллизацией из раствора магнезита в разбавленной серной кислоте. Кристаллы сульфата бесцветны, выветриваются, хорошо растворяются в воде, имеют горько-соленый вкус. Сульфат магния находит широкое применение в медицинской практике как слабительное и местное обезболивающее, при лечении уремии, столбняка, артритов, ожогов, рожистых воспалений и многих других заболеваний. Его применяют в производстве огнеупоров, удобрений, взрывчатых веществ, минеральных вод, для крашения, печатания, весового анализа. Хлорид кристаллизуется из водных растворов при комнатной температуре в виде кристаллогидрата MgCl2Ч6H2O. При нагревании гидрат выделяет хлороводородную (соляную) кислоту, поэтому морскую воду нельзя использовать в паровых котлах. В реакции с MgO хлорид образует устойчивую основную соль Mg2OCl2. Эта реакция лежит в основе получения магнезиального цемента (сорель-цемента), используемого в качестве заменителя кафеля. Хлорид магния часто присутствует в поваренной соли, и его гигроскопичность может вызывать «твердение» соли в сырую погоду. Хлорид применяют также в производстве огнеупоров, для дезинфекции, пропитки хлопчатобумажных тканей, при изготовлении пергамента и искусственной кожи.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Тихонов В.Н. Аналитическая химия магния. М., 1973 Иванов А.И. и др. Производство магния. М., 1979
Энциклопедия Кольера. — Открытое общество.
2000.
Синонимы:
Полезное
Смотреть что такое «МАГНИЙ» в других словарях:
-
МАГНИЙ — (ново лат. magnium, от лат. magnesia). Серебристый металл, составляющий основание магнезии. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. МАГНИЙ блестящий металл серебристо белого цвета, горит очень ярким белым… … Словарь иностранных слов русского языка
-
МАГНИЙ — (Magnesium), Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305; относится к щелочно земельным металлам; tпл 650шC. Входит в состав хлорофилла. Магний компонент сплавов, осветительных и зажигательных… … Современная энциклопедия
-
МАГНИЙ — (символ Mg), металлический элемент серебристо белого цвета, один из ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ. Восьмой по распространенности элемент земной коры. Впервые был выделен в 1808 г. Хэмфри ДЭВИ. Необходим в питании человека и животных. Магний всегда… … Научно-технический энциклопедический словарь
-
Магний — (Magnesium), Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305; относится к щелочно земельным металлам; tпл 650°C. Входит в состав хлорофилла. Магний компонент сплавов, осветительных и зажигательных… … Иллюстрированный энциклопедический словарь
-
МАГНИЙ — МАГНИЙ, см. магнезия. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
-
МАГНИЙ — (лат. Magnesium) Mg, химический элемент II группы периодической системы, атомный номер 12, атомная масса 24,305. Название от новолатинского magnesia магнезия. Серебристый металл, очень легкий и прочный; плотность 1,74 г/см³, tпл 650 .С. На… … Большой Энциклопедический словарь
-
Магний — Mg (лат. Magnesium * a. magnesium; н. Magnesium; ф. magnesium; и. magnesio), хим. элемент II группы периодич. системы Менделеева, ат. н. 12, ат. м. 24,312. Природный M. состоит из смеси стабильных изотопов 24Mg (78,6%), 25Mg (10,11%) и… … Геологическая энциклопедия
-
МАГНИЙ — МАГНИЙ, магния, мн. нет, муж. (ново лат. magnium) (хим.). Мягкий серебристо белый металл, горящий белым ослепительным пламенем. Группа снята вечером при вспышке магния. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
-
МАГНИЙ — МАГНИЙ, я, муж. Химический элемент, мягкий лёгкий серебристо белый металл, горящий ярким белым светом. | прил. магниевый, ая, ое. Магниевая вспышка. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
-
МАГНИЙ — (лат. Magnesium), Mg, хим. элемент II группы периодич. системы элементов; ат. номер 12, ат. масса 24,305. Природный М. содержит 3 стабильных изотопа: 24Mg (78,99%), 25Mg (10,00%) и 26Mg (11,01%). Электронная конфигурация внеш. оболочки 3s2.… … Физическая энциклопедия
-
МАГНИЙ — серебристо белого цвета легкий металл (уд. вес 1,74), близкий по свойствам к алюминию. Темп pa плавления 650°; сопротивление на разрыв 12 кг/мм2; горит ярким пламенем. В промышленности находит все более широкое распространение при изготовлении… … Технический железнодорожный словарь
Элемент: магний (Magnesium)
Химический символ: Mg
Порядковый номер: 12
Год открытия: 1755
Стандартная атомная масса: 24.305
Температура плавления: 923 К
Температура кипения: 1363 К
Плотность при стандартных условиях: 1.738 г/cм3
Скорость звука в магнии: 4940 м/с
Число стабильных изотопов: 3
Кристаллическая решётка: гексагональная
Горькая слава греческого города
История открытия магния началась в XVII веке, в графстве Суррей, в источнике у города Эпсом. В 1618 году местный фермер попытался напоить своих коров из колодца, на что те заявили своему хозяину: сам пей эту горечь. Однако, как выяснилось, «эта горечь» вроде бы лечит царапины и сыпь. В 1695 году из странной воды выделили вещество – «эпсомскую соль» (она же горькая соль или английская соль). Сейчас мы знаем, что это – кристаллогидрат сульфата магния, MgSO4·7 H2O. Как пишут, соль получил некий химик Н. Гро, имя которого мы так и не смогли установить.
Далее стало понятно, что при взаимодействии с поташем (гидроксидом калия) образуется вещество, точь-в-точь такое же, как при прокаливании минерала, который добывали в окрестностях греческого города Магнесия-на-Меандре (забегая вперед, скажем, что от того же города получили свое название и магнит с магнетизмом, и марганец). Именно так слово «магнезия прочно вошло в химический оборот, а эпсомскую соль стали называть белой магнезией (или просто магнезией). Впрочем, карбонат или оксид магния именовали также.
Пропилеи Магнесии-на-Меандре
К чистому металлу смогли подобраться заметно позже. Обнаруженный в 1754 году шотландским врачом и химиком Джозефом Блэком факт, что при нагревании белой магнезии (в данном случае – карбоната магния) выделяется связанный воздух (углекислый газ) и образуется жженая магнезия (оксид магния), привело годом позже к признанию магния самостоятельным химическим элементом, а Блэка – к статусу его первооткрывателя. Кстати, параллельно Блэк еще и доказал, что воздух – это смесь газов, а не один газ.
Интересный факт про Блэка и магний: еще того, как открыть магний как элемент, он написал докторскую диссертацию (он же врач!) о лечении камней в почках при помощи того самого карбоната магния.
Джозеф Блэк
В 1792 году Антон фон Рупрехт, восстанавливая углем белую магнезию (оксид магния MgO), смог выделить некий металл, который он патриотично назвал австрием. Увы, название этой страны так и не закрепилось в таблице Менделеева, поскольку оказалось, что исходный материал был очень загрязнен железом. Кстати, потом название «австрий» всплывало еще не раз, но тем не менее, вместо него заветные клетки занимал галлий и полоний.
Кое-как выделить сравнительно чистый магний удалось великому сэру Хемфри Дэви в 1808 году. Впрочем, получить пригодный к употреблению магний и ему не удалось: Дэви проводил электролиз смеси магнезии и оксида ртути, так что на выходе у него получилась амальгама магния. Кстати, еще забавный факт: сам Дэви предложил назвать новый металл «магнием» (magnium), но в итоге в романских языках устаканилось слово magnesium. А вот в России с 1831 года закрепилось слово «магний».
Металлический магний получил французский химик и фармацевт Антуан Александр Брутус Бюсси, восстанавливая расплав хлорида магния металлическим калием. Это случилось в 1829 году, а уже в 1830 году Майкл Фарадей провел прямой электролиз хлорида магния и получил металлический магний в «промышленных» масштабах.
Антуан Александр Брутус Бюсси
Фотографический металл – и другие применения магния
Вообще-то, магния на нашей планете много.Он один из самых распространенных элементов, его кларк (извините, что ввели новое слово — не надо путать его с кварком, в одном атоме магния более семидесяти кварков, а кларк – это процентное содержание элемента в земной коре в среднем, этот термин ввел американский геохимик Франк Уиглсуорт Кларк в 1889 году, когда впервые прикинул, сколько и каких элементов присутствует до глубины в 16 километров) – почти два процента. Каждая средняя тонна земной коры содержит в себе 19,5 килограммов чистого магния.
Франк Уиглсуорт Кларк
Магний – очень легкий металл. Он всего лишь в 1,7 раз тяжелее воды – и самый легкий из всех используемых человечеством металлов в чистом виде для конструкционных материалов. Натрий и литий использовать сложно из-за мягкости и реакционной активности, бериллий очень ядовит…
Металлический магний
Впрочем, магний тоже очень легко горит – и горит очень ярким белым светом. И именно это его свойство привело к первому массовому практическому применению магния. Догадались, какому?
Правильно, многие хотя бы по фильмам помнят магниевые вспышки. Дело в том, что первые фотографические эмульсии были не очень чувствительны. Экспозиции достигали минут, и о съемке в помещении не могло идти и речи. А все искусственные источники света – свечи, лучины, масляные и керосиновые лампы – имели жёлтый спектр, к которому эмульсия была почти нечувствительна.
Магниевая вспышка 1909 года в действии
Поэтому белый свет вспышки магниевого порошка пришелся как нельзя кстати. Впервые такое применение магнию предложил физик Уильям Крукс, известный работами по катодным трубкам (к нему мы еще вернемся, когда поговорим об открытии таллия). Первая фотовспышка заработала в 1859 году. Магний служил фотографам верой и правдой – и даже когда вспышка порошка на платформе ушла в прошлое, в 1929 году магний переместился в одноразовые колбы-вспышки, продержавшиеся до 1960-70 годов, когда магний победил ксенон (об этом – в соответствующей главе).
Одноразовые магниевые вакуумные вспышки фирмы OSRAM
Но, сойдя со сцены как составляющая вспышек, магний остался в фотографии. Шасси (металлическая рама) всех современных топовых зеркалок сделаны именно из магния, иначе бы прочные профессиональные камеры было бы очень тяжело носить.
Магниевое шасси камеры Nikon D800
Ну а магниевые сплавы используются много где именно как легкие конструкционные материалы и поныне. Другое дело, что если можно заменить магний более тяжёлым алюминием, это делают – всё же магний горит, и если горит, то потушить его непросто: он горит и в воде.
Магниевые «нобели»: реактив Гриньяра
Неорганические соединения магния хорошо известны. О некоторых (всевозможных магнезиях) мы уже рассказали. Среди самых важных минералов магния нужно назвать доломит (карбонаты кальция и магния), бишофит (водный хлорид магния), брусит (гидроксид магния). Иногда среди минералов магния называют… морскую воду. С другой стороны, его там достаточно много – около 0,12% Но, пожалуй, самые интересные (и самые важные) для нас – органические соединения магния.
Рассказывая об них, не нужно забывать, что органическая химия этого металла принесла исследователям четыре (можно сказать, что и пять с половиной) Нобелевские премии. Но, конечно, самый главный «магниевый нобель» был вручен в 1912 году Виктору Гриньяру.
Виктор Гриньяр
Гриньяр получил высшее физическое образование и собирался работать школьным учителем. Но завалил экзамены на лицензию, «сходил» в армию… А когда вернулся, ему встретился школьный приятель, Луи Руссе, уже ставший учителем химии. Он и убедил Гриньяра, что химия — это круто.
Руссе рассказал другу, что открылась вакансия ассистента химического факультета на кафедре профессора Филиппа Барбье. Виктор поспешил занять эту вакансию. Впрочем, поначалу Гриньяру казалось, что вся химия — это эмпирическая наука, бессистемная и требующая огромного количества памяти (благодаря учителям химии подавляющее большинство современных школьников именно так и считает), однако потом внутренняя структура науки начала проступать, и наш герой начал показывать выдающиеся успехи.
Барбье был очень хорошим ученым и сильной личностью и умел ценить таких же. Он быстро начал привлекать ассистента кафедры к исследованиям и в 1900 году попросил его попробовать еще раз сделать работы по металлоорганической химии, в которых у него уже несколько лет наблюдались трудности.
Чем занимался Барбье? Он пытался усовершенствовать реакцию Зайцева — присоединение к углероду при кетоновой группе цинкорганических соединений с образованием третичных спиртов и новой связи «углерод – углерод». В те годы вообще единственными металлоорганическими соединениями (органическими веществами, в которых присутствует связь «углерод-металл») была цинкорганика. За одним единственным исключением.
Учитель Гриньяра попытался заменить в этой реакции цинк магнием, потому что знал, что в 1898 году в Германии получили соединения R-Mg-R (R — это углеводородный радикал: метил, этил и так далее), но они получались с непредсказуемым выходом и были нестабильны. Впрочем, у Барбье особо ничего не получилось: он попытался проводить реакцию с двумя органическими веществами в присутствии магния. Реакция, конечно, получалась, но шла непредсказуемо.
Как потом вспоминал сам Гриньяр, Барбье был очень плодовитым на идеи, но если работа сразу же «не шла», то химик охладевал к ней и брал следующую идею. Поэтому Барбье «скинул» эту работу на Гриньяра.
Молодой ученый уперся в те же проблемы, что и учитель, но потом его осенило: а что, если получить магнийорганику не прямо в реакции, как при реакции Зайцева, а получить промежуточное вещество заранее. И внезапно оказалось, что реакция RX+Mg = R-Mg-X (X – это галоген: хлор, бром, йод) идет в растворе очень легко, а полученные вещества идеально реагируют с кетонами и вообще с очень многими органическими соединениями. Так у органиков появился очень мощный метод для направленного органического синтеза. Им пользуются до сих пор, а вещества R-Mg-X везде, кроме Франции, получили название «реактив Гриньяра».
Работа Гриньяра произвела эффект разорвавшейся бомбы. В 1900 году вышла его статья в журнале Comptes Rendus de l’Académie des sciences, и он был ее единственным автором. Этот факт стал, кстати, поводом для серьезной полемики во Франции: почему же Барбье, поставивший задачу, не стал соавтором. По воспоминаниям нашего героя, ему это было просто неинтересно.
Любопытно, что свою степень по химии Гриньяр получил только в 1901 году, когда он стал уже всемирно знаменит. Правда, он озаботился защитой своих интеллектуальных прав: в 1900 году, сразу после открытия своей реакции, Гриньяр попросил двух французских академиков, Анри Муассана (Нобелевская премия 1906 года) и Марелена Бертло о защите своего открытия. Оба написали ему: никак без публикаций защитить свой приоритет не получится. Гриньяр внял совету, заручился поддержкой в публикациях статей, и с 1900 по 1904 год опубликовал четырнадцать.
Надо сказать, влияние на развитие химии эти публикации оказали немалое: только за его «нобелевский» 1912 год было опубликовано 700 статей, посвященных применению реактива Гриньяра. Поэтому Нобелевская премия была абсолютно по делу.
Магниевые «нобели»: хлорофилл
Следующий наш рассказ о нобелевских премиях, связанных с магнием, будет посвящен Рихарду Вильштеттеру, ученику Адольфа фон Байера, изучавшего красители.
Рихард Вильштеттер
В год, когда его патрон удостоился Нобелевской премии по химии (1905), он перешел на полную профессорскую ставку в Цюрих, в знаменитый ETH, и начал работать на производстве красителя хлорофилла — вещества, которое делает листья зелеными и который обеспечивает превращение углекислого раза растениями в углеводы (процесс фотосинтеза).
Именно на поприще изучения хлорофилла (до Вильштеттера вообще никто не знал даже брутто-формулы этого важнейшего вещества) он добился наибольших успехов. Сначала он выявил эмпирическую формулу хлорофилла — относительное содержание в нем атомов углерода, азота, водорода, кислорода и магния.
Вильштеттеру удалось опровергнуть утверждение о том, что у каждого растения — свой хлорофилл. Химик вместе со своим учеником Артуром Штоллем показал, что во всем растительном царстве существуют всего две очень близкие формы хлорофилла: a и b (правда, потом нашлись и c1, и c2, и некоторые другие).
Хлорофилл C1 и C2
Постепенно Вильштеттер начал расшифровывать структуру пигмента и обнаружил в нем тетрапиррольное кольцо (порфирин) с центральным атомом магния. Нужно отметить, что сырьем «хлорофилловой фабрики» Вильштеттера стала крапива, ведь в ней содержится очень много хлорофилла.
«Цель моей работы состояла в том, чтобы установить структурные характеристики наиболее широко распространенных пигментов растений, в частности хлорофилла, и найти определенные критерии, касающиеся их химической функции», — так описал свой труд Рихард Вильштеттер в нобелевской лекции.Это была первая премия «за хлорофилл». Но далеко не последняя.
В 1930 году Нобелевскую премию по химии с формулировкой «За исследования по конструированию гемина и хлорофилла, особенно за синтез гемина» получил немец Ханс Фишер, который сделал первые шаги по синтезу хлорофилла.
На представлении лауреата Ханс Седербаум из Шведской королевской академии сказал: «Работы Фишера стали научным достижением, которое вряд ли могло бы быть получено предыдущими поколениями. […] Исследования Фишера показали, что природа, несмотря на ее непомерное многообразие, довольно экономно использует стандартный строительный материал для конструирования таких сильно различающихся как по внешнему виду, так и по распространению двух веществ, [таких как хлорофилл и красный пигмент крови]».
Ханс Фишер
Дальше – больше. Как вы думаете, кто сделал первый в истории направленный синтез хлорофилла? Можно даже не гадать, «второй по крутизне химик после природы» (цитируя представителя Нобелевского комитета) – Роберт Бернс Вудворд,который опубликовал очередной рутинный великий синтез в 1960 году. Так что и этот синтез стал кирпичиком в нобелевской премии великого Вудворда, получившего премию «потому, что он молодец».
Американский биохимик Мелвин Кальвин при помощи радиоактивного углерода сумел показать, как именно работает хлорофилл в растениях. Как итог – Нобелевская премия по химии 1961 году «За исследование усвоения двуокиси углерода растениями». И, наконец, отчасти с хлорофиллом связана Нобелевская премия по химии 1988 года, которую получили немцы Иоганн Дайзенхофер, Хармут Михель и Роберт Хубер, которые установили трёхмерную структуру фотосинтетического реакционного центра.
Но, конечно, магний важен для человека не только Нобелевскими премиями. Магний – одиннадцатый по распространенности в нашем организме элемент, при этом он входит в состав или участвует в работе почти 300 ферментов (это из известных!), так что этот элемент нам просто необходим.
А в завершение нашего длинного рассказа мы покажем вам видео из знаменитой серии популярных видеороликов о химических элементах серии «Периодическое видео химических элементов», которую ведет замечательный профессор Ноттингемского университета Мартин Полякофф
Текст: Алексей Паевский