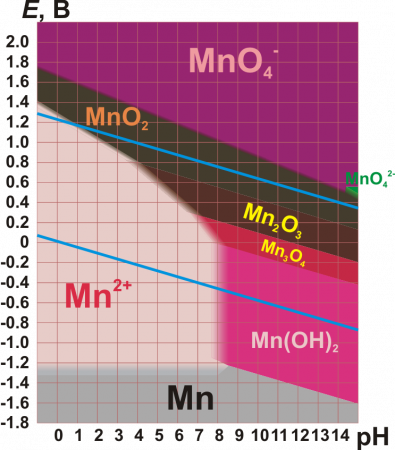
(Manganè se — франц. и англ.; Mangan — нем.; Mn = 55,09 [Среднее из 55,16 (Dewar и Scott, 1883) и 55,02 (Marimac, 1884)]. Уже древние знали о существовании главной руды М., пиролюзита, употребляли этот минерал при приготовлении стекла (Плиний Ст.) и уподобляли его магнитному железняку, хотя и знали, что он железа не притягивает. Шееле, в своей статье «De magnesia nigra» (1774), положил начало изучению M., а вместе с тем и хлора, кислорода и бария (в им исследованном материале присутствовала и ВаО). В том же году был получен и металлический М. Ганом. Кроме magnesia nigra существовало (XVI в.) название того же минерала — lapis manganensis; отсюда и ведет свое начало современное наименование металла. Соединения М. очень распространены в природе, но обыкновенно в малых количествах. Богатые металлом руды и минералы сдедующие: пиролюзит MnО 2, браунит Mn2O3, гаусманнит Mn3O4, псиломелан (Mn, Ва)О.MnО 2, манганит Mn2O2(OH)2, марганцевый шпат MnСО 3 обыкновенно в изоморфных смешениях (Mn,Fe)CO 3, (Mn,Ca,Mg)CO3, родонит MnSiO3. В малых количествах М. находится в большинстве силикатов, а потому присутствует в почвах, находится в золе растений и в костях животных. Встречается в виде сернистых соединений MnS и MnS 2, a также образует изоморфные смешения с другими сернистыми металлами. В самородном виде не встречается, потому что очень легко окисляется и труднее железа восстанавливается. Существует несколько путей для получения металлического М.: через восстановление углем окислов при сильном калении (John, Deville, Moissan), при сплавлении MnCl 2 с CaF 2 и металлич. Na (Brunner), путем электролиза крепкого раствора MnCl 2 (Bunsen). M. обыкновенно не получается чистым, содержит углерод, кремний. В чистом виде получают из амальгамы; амальгаму же можно получить, действуя амальгамой натрия на раствор MnCl 2, или электролизом того же раствора, употребляя катод из ртути; по полной отгонке ртути, что совершается при 440° (Moissan), остается порошкообразный металл. Водород и окись углерода более или менее легко действуют на многочисленные окислы М., за исключением закиси MnО; ее они не восстанавливают даже при 600° (Wright и Luff), а потому все они водородом превращаются в MnО; последняя при сплавлении с металлическим алюминием, под известью и плавиковым шпатом, дает довольно чистый металл (до 97% — Greene и Wahl, 1893); при действии магния на сплав MnCl 2 + КСl 2 (1 в. ч. + 2 в. ч.) получается королек очень чистого металла (Glatzel, 1889), удел. вес которого, d 20°/20° = 7,3921. По цвету М. приближается к железу, но обладает красноватым отливом, подобно висмуту; ломок и очень тверд — режет сталь, стекло; совершенно не притягивается магнитом, если не содержит железа; теплоемкость 0,1217 (с содерж. Si, при 14° — 97°, Regnault); плавится труднее железа, при 1900°; по-видимому, летуч при температурах немного высших точки плавления [Как показали опыты нагревания до белого каления в фарфоровой трубке в струе окиси углерода, водорода или азота (Lorenz и Heusler, 1892). Ни с H, ни с CO не получается при этом летучего соединения, подобного NiC 4O4, как показало спектроскопическое исследование пламени H или СО, зажженных при выходе из трубки]. М. легко выделяет водород с разведенными кислотами, при чем получаются соли закиси MnХ 2; даже на подогретую воду он действует и окисляется при обыкновенной температуры на воздухе. Порошкообразный М., из амальгамы, еще легче окисляется на воздухе и под водой; при взбалтывании его с водой и воздухом получается перекись водорода. Сплавы марганца с железом указаны ниже в ст. М. (металлургия), марганцевая сталь, ферроманган, белый чугун. Сплавы с медью очень похожи на сплавы олова с медью (см. Манганин). Сплав М. (80%) с цинком (5%) и медью (15%), так назыв. марганцевый нейзильбер, получается при восстановлении углем окислов, белого цвета, легко обрабатывается и хорошо полируется. О марганцовой бронзе см. Бронза. Из жидкой амальгамы отжиманием получена кристаллическая MnHg 5 [О. Prelingep (1893). Жидкая амальгама была получена, по Муассану, электролизом, по отгонке всей ртути в струе водорода при темно-красном калении остался серый пористый М., уд. в. 7,4212, такой М. реагирует с азотной кислотой с воспламенением, из нашатырного раствора выделяет аммиак и водород, а также следующие металлы из их соляных растворов — Sn, Рb, Sb, As, Bi, Сr, Fe, Со, Ni, Сu, Zu и Cd]. Спектр М. дают искры от вторичной спирали, полученные на поверхности раствора MnCl 2, или свет дуги между электродами из металлического М. Спектр содержит много линий: в оранжевой части (3 л.), в синей (5 л.), в фиолетовой (2 л.). Спектр от MnO — полосчатый; источником служит огонь при бессемеровском процессе.
Кислородные соединение
М. так многочисленны и разнообразны по свойствам, как ни для одного другого элемента; известны следующие — MnО, Mn 3O4, Mn2O3, MnО 2, MnО 3, Mn2O7. Состав высшего окисла определяет положение М. в 7-й группе периодической системы. Низший окисел есть основание; соли, отвечающие MnО, закиси, получаются при действии кислот и на металлический М., и на все его окислы, при чем из высших выделяется лишний кислород
Mnn О m + 2nHX = nМnХ 2 + nН 2O + (m — n)O;
при употреблении соляной кислоты выделяется хлор:
Mnn О m + 2mHCl = nMnCl2 + mH2O + (m — n)C12.
При обыкн. темп. могут существовать все окислы, при нагревании постоянен один — Mn 3O4; при нагревании на паяльной лампе в тигле при доступе воздуха МnО поглощает кислород, а МnО 2 теряет его, также и Мn 2 О 3 — в обоих случаях образуется Мn 3 О 4, а потому при количественном анализе применяется взвешивание в виде этого окисла; высшие окислы МnО 3 и Мn 2 О 7 в свободном виде очень непостоянны, даже при обыкн. темп. Основные свойства МnО очень значительны; по мере накопления кислорода основные свойства слабеют, но они могут быть подмечены даже для Мn 2 О 7; с другой стороны, МnО 2, будучи основанием крайне слабым, проявляет уже свойства слабого кислотного окисла; ангидридные свойства МnО 3 и особенно Мn 2 О 7 вполне резко выражены.
Закись М.
удобнее всего получается при нагревании в струе водорода высших окислов или углекислого М. в виде зеленоватого порошка; она превращается в прозрачные, зеленые, блестящие октаэдры, если водород, в котором ее нагревают, содержит некоторое количество хлористого водорода; эти кристаллы, не изменяя формы, превращаются в Мn 3 О 4 при нагревании на воздухе. Гидрат закиси Мn(ОН) 2 осаждается щелочами из растворов солей закиси в виде белого осадка, быстро буреющего на воздухе вследствие окисления. По химическим свойствам МnО очень походит на MgO; основные свойства МnО резче; соли МnХ 2 сходны то с солями MgX 2, то с солями FeX 2, NiX2, CuX2. Хлористый М. (безводный) MnCl 2 получается при прямом соединении М. и хлора, при нагревании в токе хлористого водорода МnО или МnСО 3; представляет светло-розовые кристаллические листочки, при красном калении плавится и при действии влажного воздуха дает НСl и высшие окислы М. В растворе MnCl 2 получают обыкновенно из остатков от добычи хлора; здесь всегда находится FeCl 3, которое с МnСО 3 дает MnCl 2, a Fe(OH)3 осаждается; иной раз в исходном растворе присутствуют еще соли меди, бария или кальция, тогда сероводородом удаляют медь, а сернистым аммонием осаждают весь М. в виде тельно-розового осадка MnS, растворимого легко в соляной кислоте. Если кристаллизация из крепкого раствора MnCl 2 совершается при 15-20°, то осаждаются кристаллы одноклин. сист. состава MnCl 2.4H2 O; чтобы обезводить эту соль нужно нагревать в токе HCl-газа. МnВr 2.4H2 O вполне похож на предыдущую соль; MnJ 2.4H2 O в отсутствии воздуха может быть обезвожен и даже расплавлен, в присутствии воздуха нагревание приводит к выделению паров йода, причем получаются окислы М. Сернокислый MnSO4 получается при сильном нагревании тестообразной смеси пиролюзита и крепкой серной кислоты, при чем происходит выделение кислорода. По охлаждении — извлечение водой и кристаллизация; из крепкого раствора ниже 6° выделяются кристаллы MnSO 4.7H2 O, изоморфные с железным купоросом, при 7° -20° — кристаллы MnSO 4.5H2 O, изоморфные с медным купоросом; известны также гидраты и другого состава. Ниже 200° все эти гидраты дают MnSO 4.H2 O (Грэм) — желтовато-розоватый порошок; этот гидрат теряет воду выше 200°, при чем теряет и окраску, разлагается только при красном калении, превращаясь в Mn 3O4. Двойные соли, как при других купоросах, имеют состав M 2Mn(SO4)2.6H2O. Азотнокислый М., Мn(NO 3)2.6H2O, при нагревании плавится, кипит при 129,5°, разлагаясь и выделяя черную окись Mn 2O3. Углекислый М., 5MnCO3.Mn(OH)2 (H. Rose), получается в виде белого осадка при действии соды на растворы МnХ 2; он очень трудно растворим в воде (1 ч. в 8000), а потому применяется при количественном анализе для отделения; уже при обыкн. темп. осадок окисляется, а при накаливании дает красную Mn 3O4. При действии на раствор солей MnХ 2 цианистым калием получается желтоватый осадок синеродистого М., MnСу 2, который очень непостоянен. Подобно желтой соли (см.), и здесь имеется двойная соль К 4 МnСу 6.3H2 O, кристаллизующаяся в виде темно-сине-фиолетовых квадратных пластинок; они легко теряют воду и дают раствор, к удивлению, почти не окрашенный или слабо-желтый. При стоянии на воздухе такого раствора совершается окисление
2K4MnCy6 + H2 O + О = 2К 3 MnСу 6 + 2КОН;
получается новая соль, аналогично превращению желтой соли в соль Гмелина (см.) но там для этой реакции требуется энергический окислитель, здесь же она совершается очень легко, при действии кислорода воздуха. Эта двойная соль К 3 МnСу 6, относящаяся к окисному типу — МnХ 3, кристаллизуется в виде темно-красных призм; при действии амальгамы калия с водой она восстанавливается в предыдущую.
Двуокись
М. МnО 2 [Ниже будут рассмотрены соединения окисного типа: но сначала должно сказать о МnО 2, неправильно именуемой «перекисью» Этот окисел не есть перекись свинца, это суть двуокиси, металл в них четырехэквивалентен; их структурные формулы такие
и
, с кислотами они не дают перекиси водорода, хотя последняя в присутствии аммиака и осаждает из раствора МnХ 2 двуокись; состав осадка Mn 6O11=5MnO2 MnO (A. Carnot)], подобно РbО 2, обладает слабыми кислотными свойствами, а потому образует с основаниями солеподобные соединения, манганиты. Важнейшая руда. М., пиролюзит, есть почти чистая двуокись, встречается в виде квадратных кристаллов и в виде масс, кристаллического характера; обладает стально-серым или черным цветом и металлическим блеском, уд. в. 4,82. Из солеподобных соединений в природе находятся псиломелан — (Мn, Ва)О.2МnО 2, манганит Мn 2O2 (ОН) 2, который можно представить чрез МnО. МnО 2.H2 O [В природе встречается обыкновенно вместе с известковым и тяжелым шпатом]. Искусственно МnО 2 можно получить, если промыть азотной кислотой, при кипячении, остаток после слабого каления Mn(NO 3)2 или MnСО 3 при доступе воздуха; в первом случае промывается черная окись Mn 2O3, во втором — красная закись-окись Mn 3O4 (см. ниже); так как в обоих случаях остается до промывании двуокись, то и Mn 2O3, и Mn 3O4 должно считать солеподоб. веществами, как Pb 2O3 и Pb 3O4 (сурик), которые точно так же при действии HNO 3 дают PbO 2. Двуокись М. можно получить и в виде гидрата, если действовать на раствор MnХ 2 раствором хлора или брома в едкой щелочи или если промыть гидрат Mn 2O3 азотной кислотой; такой гидрат MnО 2, промытый водой, растворим с бурым цветом (Gorgen); раствор обладает кислой реакцией, сохраняется в течение недель; малые количества щелочей или кислот осаждают гидрат (свертывают) [Получены след. калиевые соли этой кислоты: K 2O.5MnO2 — желтый осадок, образующийся при действии углекислоты на раствор K 2MnO4; K2O.MnO2 — темно-бурый порошок, получается при нагревании KMnО 4, второй манганит водой разлагается на КОН и первый манганит]. Но двуокись М. обладает и свойствами основными; если действовать при охлаждении на MnO 2, разболтанную в эфире, хлористым водородом, то получается зеленый раствор, по всей вероятности MnCl 4 (аналогично действуют и НВк и HJ); при -26° MnCl 4 почти не разлагается в водном растворе (Vernon, 1892); с крепкой плавиковой кислотой получается из MnО 2 несомненно MnF 4, потому что бурый раствор, получающийся при этом с KF, дает розовый осадок состава K 2MnF6. Если смешать 1 часть марганцево-кислого калия (см. ниже) с 5 ч. Н 2 SО 4 и 1 1/2 ч. H 2 O, то по мере выделения кислорода раствор делается желтым; из этого раствора вода осаждает гидрат Mn(OH) 4, a MnSO4 — двойную соль Mn(SO 4)2.MnSO4.9Н 2 O, в виде шестиугольных табличек, растворимых в слабой серной кислоте с красным цветом. С давних пор, как выше упомянуто, пиролюзит употребляется при выделке стекла, именно для уничтожения зеленого цвета, что, вероятно, происходит вследствие окисляющего действия MnО 2 на закись железа, а потому этот минерал получил название «мыла стеклоделов», действующего на огне (πυρ — огонь, λύω — мою). Очень важное значение пиролюзит имеет для добычи хлора, потому что уже при слабом нагревании с соляной кислотой или с поваренной солью и разведенной серной кислотой идет реакция
MnО 2 + 4НСl = MnСl 2 + 2Н 2 O + Сl 2.
Довольно давно возникла мысль превращать MnО, находящуюся в остатках после добывания хлора, опять в MnO 2. С 1867 г. часто применяется следующий путь (Walter Weldon): кислая жидкость нейтрализуется углекислой известью, при чем осаждается окись железа; прозрачный раствор смешивают с известковым молоком, нагревают паром и вдувают сильную струю воздуха; в этих условиях, вероятно, благодаря присутствии извести, MnО окисляется до MnО 2, которая и получается затем в осадке и может быть снова пущена в дело.
Окись
М., Mn2O3, и соли типа MnХ 3. Выше указано, что окисел этого типа с азотной кислотой дает MnO 2: последняя извлекает из него MnО. Но Mn 2O3 имеет и самостоятельное значение, подобно Аl 2O3, Fe2O3. В природе Mn 2O3 представляет минерал браунит (см.); искусственно получается при накаливании всякого другого окисла М. в струе кислорода или смеси его с азотом, но содержащей более 26% кислорода, в виде черного порошка, уд. веса 4,32. Соответственные соли MnCl 3 и Mn 2(SO4)3 известны только в растворах и легко разлагаются с выделением Cl или О, но двойные соли сравнительно прочны: например квасцы K 2Mn2(SO4)4.24Н 2 O, которые образуют фиолетовые октаэдры, фиолетово-красные кристаллы (NH 4)2MnCl5 и К 2 MnСl 5 (Neumann), а также вышеупомянутая двойная соль, аналогичная красной соли Гмелина, К 3 MnСу 6. Квасцы водой разлагаются с образованием гидрата окиси Mn 2O2 (ОН) 2. Этот гидрат встречается, как упомянуто, и в природе под именем манганита, в виде стально-серых или черных квадратных кристаллов, уд. веса 4,3; он очень похож на пиролюзит, но черта, проведенная на неглазурованном фарфоре от пиролюзита — черная, а от манганита — бурая.
Закись-окись
М. Mn3O4, или красная окись, встречается в бурых ромбических пирамидах под названием гаусманнита, уд. вес которого 4,85. Этот окисел получается при прокаливании на воздухе всех окислов М. в виде красно-бурого порошка, уд. веса 4,72; она превращается в кристаллы гаусманнита при нагревании в слабом токе НСl. В холодной крепкой серной кислоте Mn 3O4 растворяется с красным цветом, превращаясь в Mn 2(SO4)3 и MnSO 4, а при нагревании с разведенной серной кислотой дает 2MnSO 4 и MnО 2, так же и при действии кипящей азотной кислоты (см. выше).
Марганцовистый и марганцевый ангидриды,
MnО 3 и Mn 2O7. Глаубер (1659) уже сообщает, что при сплавлении пиролюзита с едкой щелочью получается масса, растворяющаяся в воде с пурпуровым цветом, который превращается затем в зеленый. В сочинении неизвестного автора «Ключ к тайному кабинету сокровищницы природы» (1705) говорится о подобном же сплаве, который растворяется, однако, с серо-зеленым цветом; цвет раствора делается затем небесно-голубым, фиолетовым и наконец красным. Шееле дал продукту сплавления название «минерального хамелеона». Сущность дела уяснена Э. Митчерлихом. Не только двуокись, но и низшие окислы при сплавлении со щелочью дают зеленый продукт, при чем совершается поглощение кислорода из воздуха; прибавление селитры способствует превращению; здесь образуется зеленая соль состава К 2 MnО 4; раствор ее при избытке щелочи постоянен и обладает тем же цветом. Если нейтрализовать часть щелочи кислотой, то цвет раствора меняется в фиолетовый и красный, вследствие превращения в др. соль
3К 2 MnО 4 + 2Н 2 O = 2КMnО 4 + 4КОН + MnО 2;
это превращение совершается и при содействии углекислоты, и при простом разбавлении водой, при чем раствор мутится, вследствие осаждения двуокиси. КMnО 4 есть марганцево-, а К 2 MnО 4 марганцовисто-кислый калий. Если кипятить КMnО 4 в крепком щелочном растворе, то идет обратное превращение при выделении кислорода
4КMnО 4 + 4КOH = 4K 2 MnО 4 + 2Н 2 O + О 2;
прибавление веществ, способных окисляться (напр. спирта), способствует превращению; так же действует и органического происхождения пыль, попадая из воздуха в щелочной раствор КMnО 4. Na2MnO4.10H2 О походит на глауберову соль, а ВаMnО 4 не растворим в воде (подобно BaSO 4) и кислотами разлагается. Соответственная кислота Н 2 MnО 4 неизвестна, а ангидрид MnО 3 представляет собой (Thorpe) аморфную расплывчатую красноватую массу, кажущуюся в отраженном свете почти черной. Если к хорошо охлажденной крепкой серной кислоте прибавлять постепенно KMnO 4, то получается зеленый раствор, а на дне собирается темно-красно-бурая жидкость, не застывающая при -20° и очень непостоянная; это марганцевый ангидрид MnO 7, при нагревании взрывающий [При чем появляется даже огонь; то же происходит при соприкосновении с бумагой и другими органическими веществами или если бросить одну каплю в сосуд, содержащий пары спирта, эфира, сероводорода и проч.] и растворяющийся в воде с разогреванием; получающийся при этом красный раствор содержит кислоту НMnО 4. Упомянутый зеленый сернокислый раствор, образующийся над слоем Mn 2O7, содержит, вероятно, вещество состава (Mn 2O6)SO4. Если к такому раствору прибавлять осторожно, при охлаждении, плавленой поваренной соли, то выделяется марганцевый хлорангидрид MnO 3 Cl (Ascboff), по уравн.:
(Mn2O6)SO4 + 2NaCl = Na2SO4 + 2MnO З Cl
в виде желтого газа, сгущающегося в охладительной смеси в зеленовато-бурую жидкость, обладающую свойствами хлорангидридов и взрывающую при нагревании. Из того же зеленого раствора был получен (Thorpe) марганцовистый ангидрид; при медленном прибавлении раствора к безводной соде по ур.:
(Mn2O6)SO4 + Na2CO3 = MnO3 + Na2SO4 + CO2 + O
ангидрид в виде порошка уносился током газов (СО 2 и О) и собирался в трубке, наполненной битым стеклом. Обыкновенный препарат из этой группы соединений есть KMnO 4, который часто называют «хамелеоном». В совершенно чистом виде он может быть получен (Грегори) так: возможно крепкий раствор 10 ч. КОН смешивают с 7 ч. КСlО 3 и 8 ч. MnО 2, выпаривают досуха и остаток нагревают при темно-красном калении до полного разложения КСlО 3; темно-зеленая масса извлекается водой; отстоявшийся раствор фильтруется через асбест и подвергается кристаллизации; выделяются длинные призмы КMnО 4, изоморфные с КСlО 4. Хамелеон растворим в 15 частях холодной воды; раствор обладает густым пурпуровым цветом. В химической практике хамелеон является окислителем; окисления совершаются особенно легко в присутствии избытка разведенной серной кислоты. Смесь хамелеона с серой взрывает при ударе, смесь с порошкообразным магнием горит очень быстро (см. Магний); раствор КMnО 4 употребляется при очищении водорода (для окисления AsH 3 и пр. примесей), как реактив для окисления органических соединений (Е. Е. Вагнер). В присутствии серной кислоты окислителем является, очевидно, свободная кислота НMnО 4. Относительно применения окислительной способности хамелеона в объемном анализе см. в ст. Железо (анализ), Окислы азота, Оксидиметрия. Хамелеон употребляется при определении азота в органических соединениях, по Кьельдалю, для того, чтобы закончить окисление органического вещества, начатое крепкой серной кислотой; азот здесь при избытке кислоты получается в виде серноаммиачной соли; свободный аммиак хамелеоном окисляется. Фабричное производство солей марганцевой и марганцовистой кислот развилось со времени применения их для дезинфекции (Hofmann, 1859), для чего готовят менее чистые натриевые препараты.
Из других соединений М. должно упомянуть о соединениях с серой и азотом. Сернистый M., MnS, находится в природе в виде марганцевого блеска, стально-серой массы или кристаллов (кубов), уд. в. 4,04; искусственно получают при накаливании в токе H 2 S закиси или ее солей; из растворов MnХ 2 сернистый аммоний осаждает тельно-розовый осадок, буреющий на воздухе, при нагревании под раствором превращающийся в зеленый гидрат 3MnS.Н 2 O. Минерал гауэрит, MnS2, большие буро-черные октаэдры; отвечает по составу двуокиси; при нагревании MnSO 4 с раствором многосернистого калия при 160-180° в запаянной трубке получается кирпично-красный порошок того же состава. Два соединения с азотом, Mn5N2 и Mn 3N2 получены недавно (О. Prelinger) и представляют твердые вещества уд. веса 6,58 и 6,21, обладающие металлическим блеском; первое получается при накаливании в струе азота, а второе в струе аммиака — металлического М. из электролизом полученной амальгамы; можно и не выделять предварительно металл из амальгамы, а прямо ею пользоваться. Если нагревать в струе азота амальгаму, то, когда отгонка ртути оканчивается, замечается значительное разогревание трубки, в которой производится операция. M n3N2 при прокаливании в струе азота превращается в Mn 5N2 , а это соединение в струе аммиака дает вновь Mn 3N2. Mn5N2 при нагревании в струе водорода дает аммиак, а также и при действии щелочей и даже воды; химические отношения Mn 3N2 таковы же.
При систематическом анализе соляных смесей, М., по осаждении углекислым барием гидратов окисей типа R 2O3, оказывается в растворе вместе с цинком; по осаждении сернистым аммонием его извлекают из осадка уксусной кислотой, которая не растворяет ZnS; из раствора, не содержащего других металлов, М. осаждают содой и взвешивают в виде Mn 3O4. При сокращенных способах отделения М. оказывается нередко с магнием, подобно которому он трудно осаждается в присутствии аммиачных солей; отделение в таких случаях основывается на переводе MnХ 2 в MnO 2, действием галоида в щелочном растворе. Техническое испытание марганцевых руд и препаратов нередко сводится к определению в них кислорода, способного выделять хлор с соляной кислотой; отвешенное количество испытуемого материала обрабатывают соляной кислотой, улавливают хлор раствором KJ и определяют йод, сделавшийся свободным (см. Йодометрия).
С. С. Колотов,
Δ .
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — С.-Пб.: Брокгауз-Ефрон.
1890—1907.
Соли марганца (II)
Химические свойства
Получение
Гидроксид марганца (II)
Химические свойства
Оксид марганца (II) принадлежит к основным оксидам, обладает всеми их свойствами. Ему соответствует нестойкий гидроксид Mn(OH) 2 .
Гидроксид марганца (II) — Mn(OH) 2 – нерастворимое в воде вещество светло-розового цвета.
Основной способ получения – щелочная обработка солей марганца (II):
MnSO 4 + 2NaOH → Mn(OH) 2 ↓ + Na 2 SO 4
На воздухе окисляется до гидроксида марганца (IV):
2Mn(OH) 2 ↓ + O 2 + 2H 2 O → 2Mn(OH) 4 ↓
Проявляет все свойства нерастворимых в воде оснований.
Все соли марганца (II) в окислительно-восстановительных реакциях, протекающих в растворах, являются восстановителями:
3Mn(NO 3) 2 + 2KMnO 4 + 2H 2 O → 5MnO 2 + 4HNO 3 + 2KNO 3
Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
Mn 2+ + 6H 2 O → 2+
MnCl 2 + 6H 2 O → Cl 2
Соли марганца (II) образуют комплексы.
Mn(CN) 2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN) 2 = K 4 гексоцианоманганат калия
Аналогично:
4KF + MnF 2 = K 4
2KCl + MnCl 2 = K 2
Соединения марганца (III)
Mn 2 O 3 – амфотерный оксид
, с преобладанием основных свойств.
Mn 2 O 3 + 6HF = 2MnF 3 + 3H 2 O
Mn +3 2 O 3 + NaOH = 2NaMnO 2 + H 2 O (t)
Mn(OH) 3 – гидроксид Mn 3+
— амфотерное соединение, с преобладанием основных свойств:
Mn(OH) 3 ↔ HMnO 2
Соединения марганца (IV)
К основным соединениям четырехвалентного марганца относятся оксид марганца (IV) MnO 2
, а также марганцеватистая кислота H 2 MnO 3
– очень неустойчивая, легко разлагающаяся на оксид марганца (IV) и воду.
Самым прочным соединением марганца (IV) является нерастворимый в воде оксид темно-бурого цвета. Это амфотерное соединение, но соответствующие свойства выражены крайне слабо.
MnO 2 + 4HF = MnF 4 + 2H 2 O
MnO 2 + 2NaOH = Na 2 MnO 3 + H 2 O
MnO 2 может проявлять в ОВ-реакциях в зависимости от природы партнера как окислительные, так и восстановительные свойства (окислительно-восстановительная двойственность).
Гораздо чаще используют оксид марганца (IV) в качестве окислителя, проводя реакции в кислой среде:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O
В щелочной среде оксид марганца (IV) может быть и восстановителем, превращаясь в соединения марганца (VI), например, соли марганцовистой кислоты – манганаты:
3MnO 2 + KClO 3 + 6KOH = 3K 2 MnO 4 + KCl + 3H 2 O
Влияние рН на ОВ-реакции MnO 2
Соединения марганца (VI)
MnO 3 – оксид
, обладает кислотными свойствами.
H 2 MnO 4 – марганцовистая кислота
– существует только в растворе.
Соли этой кислоты – манганаты
.
Манганаты могут быть получены прокаливанием сухих перманганатов:
Манганаты устойчивы в сильнощелочной среде, в нейтральной среде протекает реакция диспропорционирования:
3Na 2 MnO 4 + 2H 2 O → 2NaMnO 4 + MnO 2 + 4NaOH
Соединения марганца (VII)
Высшей степени окисления марганца +7 соответствует кислотный оксид Mn 2 O 7 , марганцевая кислота HMnO 4 и ее соли – перманганаты
.
Соединения марганца (VII) – сильные окислители. Mn 2 O 7 – зеленовато-бурая маслянистая жидкость, при соприкосновении с которой спирты и эфиры воспламеняются. Оксиду Mn (VII) соответствует марганцевая кислота HMnO 4 . Она существует только в растворах, но считается одной из самых сильных (α – 100%). Максимально возможная концентрация HMnO 4 в растворе – 20%. Соли HMnO 4 – перманганаты – сильнейшие окислители; в водных растворах, как и сама кислота, имеют малиновую окраску.
В окислительно-восстановительных реакциях перманганаты являются сильными окислителями. В зависимости от реакции среды они восстанавливаются либо до солей двухвалентного марганца (в кислой среде), оксида марганца (IV) (в нейтральной) или соединений марганца (VI) – манганатов – (в щелочной). Очевидно, что в кислой среде окислительные способности Mn +7 выражены наиболее ярко.
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
2KMnO 4 + 3Na 2 SO 3 + H 2 O → 2MnO 2 + 3Na 2 SO 4 + 2KOH
2KMnO 4 + Na 2 SO 3 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
2KMnO 4 + 3H 2 SO 4 + 5C 2 H 5 OH → 2MnSO 4 + K 2 SO 4 + 5CH 3 COH + 8H 2 O
спирт альдегид
4KMnO 4 + 2NaOH + C 2 H 5 OH → MnO 2 ↓ + 3CH 3 COH + 2K 2 MnO 4 +
Na 2 MnO 4 + 4H 2 O
При нагревании перманганат калия разлагается (эта реакция применяется для получения кислорода в лабораторных условиях):
2KMnO 4 K 2 MnO 4 + MnO 2 + O 2
Таким образом, для марганца характеры те же зависимости: при переходе от низшей степени окисления к высшей нарастают кислотные свойства кислородных соединений, а в ОВ-реакциях восстановительные свойства сменяются окислительными.
Для организма перманганаты ядовиты вследствие сильных окислительных свойств.
При отравлениях перманганатами в качестве антидота используют пероксид водорода в уксуснокислой среде:
2KMnO 4 + 5H 2 O 2 + 6CH 3 COOH → 2(CH 3 COO) 2 Mn + 2CH 3 COOK + 5O 2 + 8H 2 O
Раствор KMnO 4 является прижигающим и бактерицидным средством для обработки поверхности кожи и слизистых оболочек. Сильные окислительные свойства KMnO 4 в кислой среде лежат в основе аналитического метода перманганатометрии, используемого в клиническом анализе для определения окисляемости воды, мочевой кислоты в моче.
Организм человека содержит около 12 мг Mn в составе различных соединений, причем 43% сосредоточено в костной ткани. Он оказывает влияние на кроветворение, формирование костной ткани, рост, размножение и некоторые другие функции организма.
Тема: D-элементы VIII группы
Ключевые слова:
d-элементы, железо, кобальт, никель, триады – d-элементов, семейство железа, феромагнитные соединения, комплексооразующая способность, пассивация на холоду кислотами, карбонилы железа, кристаллогидраты, желтая и красная кравяные соли, ферраты, соль Мора, железная кислота.
Особенность VIII В-группы состоит в том, что она объединяет 3 триады d-элементов больших периодов, не имеющих электронных аналогов в малых периодах.
Элементы первой триады – Fe, Co, Ni
– называют семейством железа. Элементы второй и третьей триад, то есть Ru
(рутений), Rh
(родий), Pd
(палладий), Os
(осмий), Ir
(иридий), Pt
(платина), именуются платиновыми металлами.
Атомы элементов семейства железа в отличие от атомов платиновых металлов не имеют свободного f-подуровня.
Этот факт обуславливает химические особенности элементов семейства железа.
Платиновые металлы, очень сходные по свойствам и трудноотделимые друг от друга, резко отличаются от металлов семейства железа и никогда не встречаются вместе с ними в литосфере.
У элементов VIII В-группы почти полностью достраивается d-подуровень предвнешнего уровня. Однако не все электроны d-подуровня участвуют в образовании химических связей. Только около 10 лет назад было получено соединение железа со степенью окисления +8, чаще же в сложных соединениях для железа характерны степени окисления +3 и +2; у Со +3, а у Ni +2. Для металлов VIII В-группы характерны высокие плотности и температуры плавления. Fe, Co, Ni – ферромагниты; все элементы VIII В-группы хорошие комплексообразователи.
Элементы семейства железа – металлы со средней химической активностью. В ряду стандартных электродных потенциалов расположены левее водорода. Платиновые металлы расположены в конце ряда стандартных электродных потенциалов и отличаются низкой химической активностью.
Платиновые металлы используются в приборостроении, как катализаторы в оргсинтезе и для получения коррозионно-устойчивых сплавов.
Элементы семейства железа расположены в четвертом периоде периодической системы химических элементов. Fe, Co – серебристо-белые металлы, Ni имеет желтовато-белый цвет.
Для железа и кобальта в сложных веществах наиболее характерны степени окисления +2 и +3, а для никеля +2. Подобно элементам подгруппы марганца, способны образовывать соединения со степенью окисления 0 (карбонилы):
Выполнил
:
студент первого курса
инженерного факультета
15 б группы
Кошманов В.В.
Проверил: Харченко Н.Т.
Великие Луки 1998г.
Историческая справка. 3
Распространение в природе. 3
Физические и химические свойства. 3
Соединения двухвалентного марганца. 4
Соединения четырёхвалентного марганца. 4
Соединения шестивалентного марганца. 5
Соединения семивалентного марганца. 5
Получение. 6
Применение марганца и его соединений. 6
Литература. 7
Историческая справка.
Минералы Марганца известны издавна. Древнеримский натуралист Плиний упоминает о чёрном камне, который использовали для обесцвечивания жидкой стеклянной массы; речь шла о минерале пиролюзите
MnO 2
. В Грузии пиролюзит с древнейших времён служил присадочным материалом при получении железа. Долгое время пиролюзит называли чёрной магнезией и считали разновидностью магнитного железняка. В 1774 году К.Шелле доказал, что это соединение неизвестного металла, а другой шведский учёный Ю.Гаи, сильно нагревая смесь пиролюзита с углём, получил Марганец загрязнённый углеродом. Название Марганец традиционно происходит от немецкого
Marganerz-
марганцевая руда.
Распространение в природе.
Среднее Содержание Марганца в земной коре 0.1%, в большинстве изверженных пород 0.06-0.2% по массе, где он находится в рассеянном состоянии в форме
Mn2+
(аналог
Fe 2+).
На земной поверхности
Mn 2+
легко окисляется, здесь известны также минералы
Mn 3+
и
Mn 4+
.
В биосфере Марганец энергично мигрирует в восстановительных условиях и малоподвижен в окислительных условиях. Наиболее подвижен Марганец в кислых водах тундры и лесных ландшафтах, где он находится в форме
Mn 2+
. Содержание Марганца здесь часто повышенно и культурные растения местами страдают от избытка Марганца; в почвах, озёрах, болотах образуются железно марганцовые конкуренции, озёрные и болотные руды. В сухих степях и пустынях в условиях щелочной окислительной среды Марганец малоподвижен. Организмы бедны Марганцем, культурные растения часто нуждаются в марганцовых микро удобрениях. Речные воды бедны Марганцем (10 -6
-10 -5
г/л.), однако суммарный вынос этого элемента огромен, причём основная его масса осаждается в прибрежной зоне.
Физические и химические свойства.
В чистом виде марганец получают либо электролизом раствора сульфата марганца (
II)
, либо восстановлением из оксидов кремнием в электрических печках. Элементарный Марганец представляет собой серебристо-белый твердый, но хрупкий металл. Его хрупкость объясняется тем, что при нормальных температурах в элементарную ячейку
Mn
входит 58 атомов в сложной ажурной структуре, не относящейся к числу плотноупакованных. Плотность Марганца 7.44 г/см 3
, температура плавления 1244 о
С, температура кипения 2150 о
С. В реакциях проявляет валентность от 2 до 7, наиболее устойчивые степени окисления +2,+4,+7.
Соединения двухвалентного марганца.
Соли двухвалентного марганца можно получить при растворении в разбавленных кислотах:
Mn+2HCl MnCl 2
+H2
При растворении в воде образуется гидроксид
Mn(II):
Mn+2HOH Mn(OH) 2
+H 2
Гидроксид марганца можно получить в виде белого осадка при действии на растворы солей двухвалентного марганца щелочью:
MnSO 4
+2NaOH
Mn(OH) 2
+NaSO 4
Соединения Mn(II)
на воздухе неустойчивы, и
Mn(OH) 2
на воздухе быстро буреет, превращаясь в оксид-гидроксид четырёхвалентного марганца.
2
Mn(OH) 2
+O 2
MnO(OH) 2
Гидроксид марганца проявляет только основные свойства и не реагирует со щелочами, а при взаимодействии с кислотами даёт соответствующие соли.
Mn(OH) 2
+2HCl MnCl 2
+
2H 2
O
Оксид марганца может быть получен при разложении карбоната марганца:
MnCO 3
MnO+CO 2
Либо при восстановлении диоксида марганца водородом:
MnO 2
+H 2
MnO+H 2
O
Соединения четырёхвалентного марганца.
Из соединений четырёхвалентного марганца наиболее известен диоксид марганца
MnO 2
—
пиролюзит. Поскольку валентность
IV
является промежуточной, соединения
Mn
(VI)
образуются как при окислении двухвалентного марганца.
Mn(NO 3) 2
MnO 2
+2NO
2
Так и при восстановлении соединений марганца в щелочной среде:
3K 2
MnO 4
+2H 2
O 2KMnO 4
+MnO 2
+4KOH
Последняя реакция является примером реакции самоокисления — самовосстановления, для которых характерно то, что часть атомов одного и того же элемента окисляется, восстанавливая одновременно оставшиеся атомы того же элемента:
Mn 6+
+2e=Mn 4+
1
Mn 6+
—e=Mn 7+
2
В свою очередь
Mn
О
2
может окислять галогениды и галоген водороды, например
HCl
:
MnO 2
+4HCl MnCl 2
+Cl 2
+2H 2
O
Диоксид марганца — твёрдое порошкообразное вещество. Он проявляет как основные, так и кислотные свойства.
Соединения шестивалентного марганца.
При сплавлении
MnO
2
со щелочами в присутствии кислорода, воздуха или окислителей получают соли шестивалентного
Марганца
, называемые манганатами.
MnO
2
+2KOH+KNO
3
K
2
MnO
2
+KNO
2
+H
2
O
Соединений марганца шестивалентного известно немного, и из них наибольшее значение соли марганцевой кислоты — манганаты.
Сама марганцевая кислота, как и соответствующей ей триоксид марганца
MnO
3
, в свободном виде не существует вследствии неустойчивости к процессам окисления — восстановления. Замена протона в кислоте на катион металла приводит к устойчивости манганатов, но их способность к процессам окисления — восствновления сохраняется. Растворы манганатов окрашены в зелёный цвет. При их подкислении образуется марганцеватая кислота,разлагается до соединений
марганца четырёхвалентного и семивалентного.
Сильные окислители переводят марганец шестивалентный в семивалентный.
2K 2
MnO
4
+Cl2
2
2KMnO
4
+2KCl
Соединения семивалентного марганца.
В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия
KMnO
2
, в быту называемый марганцовкой. Перманганат калия представляет собой кристаллы чёрно-фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона
MnO 4
—
.
Перманганаты являются солями марганцевой кислоты, которая устойчива только в разбавленных растворах (до 20%). Эти растворы могут быть получены действием сильных окислителей на соединения марганца двухвалентного:
2Mn(NO
3
)
2
+PbO
2
+6HNO
3
2HMnO
4
+5Pb(NO
3
)
2
+
2H
2
O
Марганец — элемент побочной подгруппы седьмой группы
четвёртого периода периодической
системы химических элементов Д. И. Менделеева, с атомным номером 25. Обозначается символом
Mn (лат. Manganum).
История открытия марганца
Известный естествоиспытатель и писатель древнего Рима Плиний
Старший указывал на чудесную способность черного порошка осветлять стекло.
Давно это вещество, дающее при размалывании черный порошок, называется
пиролюзитом, или двуокисью марганца. О способности пиролюзита очищать стекло
писал в 1540 г. и Ваноччио Бирингуччио. Пиролюзит является важнейшей рудой для
получения марганца — металла, употребляемого главным образом в металлургии.
От слова «магнезия» получили свои названия
марганец и магний.
Происхождение наименования двух химических элементов от одного и того же слова
объясняется тем, что пиролюзит долгое время противопоставлялся белой магнезии и
назывался черной магнезией. После получения металла в чистом виде марганец был
переименован. В основу названия было положено греческое слово
«манганезе», что значило очищать (намек на его применение в древности
в качестве «очистителя» стекла). Некоторые исследователи считают, что
название элемента произошло от латинского слова «магнес» — магнит,
так как пиролюзит, из которого добывают марганец, считался в древности
разновидностью того вещества, которое теперь называется магнитным железняком.
Марганец был открыт в 1774 г. шведским химиком Карлом
Вильгельмом Шееле. Правда, ни марганец, ни молибден, ни вольфрам Шееле не
выделил в чистом виде; он только указал, что в исследованных им минералах
содержатся эти новые элементы. Элемент №25 был обнаружен в минерале пиролюзите
МnО 2 · Н 2 О, известном еще Плинию Старшему.
Плиний считал его разновидностью магнитного железняка, хотя пиролюзит не
притягивается магнитом. Этому противоречию Плиний дал объяснение.
В рукописях знаменитого алхимика Альберта Великого (XIII в.) этот
минерал называется «магнезия». В XVI в. встречается уже название
«манганезе», которое, возможно, дано стеклоделами и происходит от слова
«манганидзейн» – чистить.
Когда Шееле в 1774 г. занимался исследованием пиролюзита, он посылал
своему другу Юхану Готлибу Гану образцы этого минерала. Ган, впоследствии
профессор, выдающийся химик своего времени, скатывал из пиролюзита шарики,
добавляя к руде масло, и сильно нагревал пх в тигле, выложенном древесным
углем. Получались металлические шарики, весившие втрое меньше, чем шарики из
руды. Это и был марганец. Новый металл называли сначала «магнезия», но так как
в то время уже была известна белая магнезия – окись магния, металл
переименовали в «магнезиум»; это название и было принято Французской комиссией
по номенклатуре в 1787 г. Но в 1808 г. Хэмфри Дэви открыл магнии и
тоже назвал его «магнезиум»; тогда во избежание путаницы марганец стали
называть «манганум. »
В России марганцем долгое время называли пиролюзит, пока в 1807 г.
А.И. Шерер не предложил именовать марганцем металл, полученный из пиролюзита,
а сам минерал в те годы называли черным марганцем.
Распространённость в природе марганца
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной
коры). В биосфере Марганец энергично мигрирует в восстановительных условиях и
малоподвижен в окислительной среде. Наиболее подвижен Марганец в кислых водах
тундры и лесных ландшафтов, где он находится в форме Мn 2+ .
Содержание Марганца здесь часто повышено и культурные растения местами страдают
от избытка Марганца. Весовое количество марганца увеличивается от кислых (600
г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах,
однако встречаются и самостоятельные месторождения марганца. В чиатурском
месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец,
рассеянный в горных породах вымывается водой и уносится в Мировой океан. При
этом его содержание в морской воде незначительно (10 −7 -10 −6 %),
а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие
окисления растворённым в воде кислородом с образованием нерастворимого в воде
оксида марганца, который в гидратированной форме (MnO 2 ·x
H 2 O)
и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может
достигать 45 % (также в них имеются примеси меди,
никеля, кобальта). Такие конкреции могут стать в будущем источником
марганца для промышленности.
Этот металл распространен примерно так же, как сера или фосфор. Богатые
залежи марганцевых руд находятся в Индии, Бразилии, Западной и Южной
Африке.
В России является остродефицитным сырьём, известны месторождения:
«Усинское»
в Кемеровской области, «Полуночное» в Свердловской,
«Порожинское»
в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области,
«Рогачёво-Тайнинская»
площадь и «Северо-Тайнинское» поле на Новой Земле.
Получение марганца
Первый металлический марганец был получен при восстановлении пиролюзита
древесным углем: МnО 2 + C → Mn + 2CO.
Но это не был элементарный марганец. Подобно своим соседям по таблице
Менделеева – хрому и железу, марганец реагирует с углеродом и всегда содержит
примесь карбида. Значит, с помощью углерода чистый марганец не получить. Сейчас
для получения металлического марганца применяют три способа: силикотермический
(восстановление кремнием), алюминотермический (восстановление алюминием) и
электролитический.
Наиболее широкое распространение нашел алюминотермический способ,
разработанный в конце XIX в. В этом случае в качестве марганцевого сырья
лучше применять не пиролюзит, а закись-окись марганца Mn 3 O 4 .
Пиролюзит реагирует с алюминием с выделением такого большого количества тепла,
что реакция легко может стать неуправляемой. Поэтому, прежде чем
восстанавливать пиролюзит, его обжигают, а уже полученную закись-окись
смешивают с алюминиевым порошком и поджигают в специальном контейнере.
Начинается реакция 3Мn 3 O 4 + 8Аl → 9Мn + 4Аl 2 О 3
– достаточно быстрая и не требующая дополнительных затрат энергии. Полученный
расплав охлаждают, скалывают хрупкий шлак, а слиток марганца дробят и
отправляют на дальнейшую переработку.
Однако алюминотермический способ, как и силикотермический, не дает марганца
высокой чистоты. Очистить алюминотермический марганец можно возгонкой, но этот
способ малопроизводителен и дорог. Поэтому металлурги давно искали новые
способы получения чистого металлического марганца и, естественно, прежде всего
надеялись на электролитическое рафинирование. Но в отличие от меди, никеля и
других металлов, марганец, откладывавшийся на электродах, не был чистым: его
загрязняли примеси окислов. Более того, получался пористый, непрочный,
неудобный для переработки металл.
Многие известные ученые пытались подобрать оптимальный режим электролиза
марганцевых соединении, но безуспешно. Эту задачу разрешил и 1919 г.
советский ученый Р.И. Агладзе (ныне действительный член Академии наук
Грузинской ССР). По разработанной им технологии электролиза из хлористых и
сернокислых солей получается достаточно плотный металл, содержащий до 99,98%
элемента №25. Этот метод лег в основу промышленного получения металлического
марганца.
Внешне этот металл похож на железо, только тверже его. На воздухе
окисляется, но, как и у алюминия, пленка окисла быстро покрывает всю
поверхность металла и препятствует дальнейшему окислению. С кислотами марганец
реагирует быстро, с азотом образует нитриды, с углеродом – карбиды. В общем,
типичный металл.
Физические свойства марганца
Плотность Марганца 7,2-7,4 г/см 3 ; t пл 1245 °С; t кип
2150 °С. Марганец имеет 4 полиморфные модификации: α-Мn (кубическая
объемноцентрированная решетка с 58 атомами в элементарной ячейке), β-Мn
(кубическая объемноцентрированная с 20 атомами в ячейке), γ-Мn
(тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая
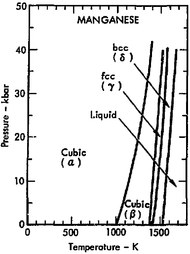
объемноцентрированная). Температура превращений: α=β 705 °С;
β=γ 1090 °С и γ=δ 1133 °С; α-модификация хрупка;
γ (и отчасти β) пластична, что имеет важное значение при создании
сплавов.
Атомный радиус Марганца 1,30 Å. ионные радиусы (в Å): Mn 2+
0,91, Mn 4+ 0,52; Mn 7+ 0,46. Прочие физические свойства
α-Mn: удельная теплоемкость (при 25°С) 0,478 кДж/(кг·К) [т. е. 0.114
ккал/(г·°С)]; температурный коэффициент линейного расширения (при 20°С) 22,3·10 -6
град -1 ; теплопроводность (при 25 °С) 66,57 Вт/(м·К) [т. е. 0,159
кал/(см·сек·°С)]; удельное объемное электрическое сопротивление 1,5-2,6 мком·м
(т. е. 150-260 мком·см): температурный коэффициент электрического сопротивления
(2-3)·10 -4 град -1 . Марганец парамагнитен.
Химические свойства марганца
Марганец достаточно активен, при нагревании энергично взаимодействует с
неметаллами — кислородом (образуется смесь оксидов Марганца разной
валентности), азотом, серой, углеродом, фосфором и другими. При комнатной
температуре Марганец на воздухе не изменяется: очень медленно реагирует с
водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя
соли двухвалентного Марганца. При нагревании в вакууме Марганец легко
испаряется даже из сплавов.
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в
кислороде (Mn + O 2 → MnO 2). Марганец при нагревании
разлагает воду, вытесняя водород (Mn + 2H 2 O →(t) Mn(OH) 2 +
H 2 ), образующийся гидроксид марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в
марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом,
образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем образуя карбиды Mn 3 C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
Mn + 2H + → Mn 2+ + H 2
С концентрированной серной кислотой реакция идёт по уравнению:
Mn + 2H 2 SO 4 (конц.) → MnSO 4 + SO 2 + 2H 2 O
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn 2 O 3 , MnO 2 ,
MnO 3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn 2 O 7 .
Mn 2 O 7 в обычных условиях жидкое маслянистое вещество
тёмно-зелёного, очень неустойчивое; в смеси с концентрированной серной кислотой
воспламеняет органические вещества. При 90 °C Mn 2 O 7
разлагается со взрывом. Наиболее устойчивы оксиды Mn 2 O 3 и
MnO 2 , а также комбинированный оксид Mn 3 O 4
(2MnO·MnO 2 , или соль Mn 2 MnO 4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2MnO 2 + 4KOH + O 2 → 2K 2 MnO 4 + 2H 2 O
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает
реакция:
3K 2 MnO 4 + 3H 2 SO 4 → 3K 2 SO 4 + 2HMnO 4 + MnO(OH) 2 ↓ +
H 2 O
Раствор окрашивается в малиновый цвет из-за появления аниона MnO 4 −
и из него выпадает коричневый осадок гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно
сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет
различные вещества, восстанавливаясь до соединений марганца разной степени
окисления. В кислой среде — до соединений марганца (II), в нейтральной — до
соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из
лабораторных способов получения чистого кислорода). Реакция идёт по уравнению
(на примере перманганата калия):
2KMnO 4 →(t) K 2 MnO 4
+ MnO 2 + O 2
Под действием сильных окислителей ион Mn 2+ переходит в ион MnO 4 − :
2MnSO 4 + 5PbO 2 + 6HNO 3
→ 2HMnO 4 + 2PbSO 4 + 3Pb(NO 3) 2
+ 2H 2 O
Эта реакция используется для качественного определения Mn 2+
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида
марганца (II), быстро буреющий на воздухе в результате окислления.
Применение марганца в промышленности
Марганец содержится во всех видах стали и чугуна. Способность марганца
давать сплавы с большинством известных металлов используется для получения не
только различных сортов марганцевой стали, но и большого числа нежелезных
сплавов (манганинов). Из них особенно замечательными являются сплавы марганца с
медью
(марганцевая бронза). Она, подобно стали, может закаляться и в то же время
намагничиваться, хотя ни марганец, ни медь не обнаруживают заметных магнитных
свойств.
Биологическая роль марганца и его содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его
содержание обычно очень мало, порядка тысячных долей процента, он оказывает
значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост,
образование крови
и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества
содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до
нескольких процентов марганца.
Марганец
активно влияет на обмен белков, углеводов
и жиров. Важной также считается способность марганца усиливать действие
инсулина и поддерживать определенный уровень холестерина в крови. В присутствии
марганца организм полнее использует жиры. Сравнительно богаты этим
микроэлементом крупы (в первую очередь овсяная и гречневая), фасоль, горох,
говяжья печень и многие хлебобулочные изделия, которыми практически
восполняется суточная потребность человека в марганце — 5,0-10,0 мг.
Не стоит забывать, что соединения марганца
могут оказывать токсичное действие на организм человека. Предельно допустимая
концентрация марганца в воздухе 0.3
мг/м 3 . При выраженном отравлении наблюдается поражение нервной
системы с характерным синдромом марганцевого паркинсонизма.
Объёмы производства марганцевой руды в России
Марганецкий ГОК – 29%
Месторождение марганцевых руд было открыто в 1883 году. В
1985 г. на базе этого месторождения начал добычу руды Покровский рудник. По
мере развития рудника и возникновения новых карьеров и шахт сформировался
Марганецкий ГОК.
В составе производственной структуры комбината: два карьера для открытой добычи
марганцевой руды, пять шахт для подземной добычи, три обогатительных фабрики, а
также необходимые вспомогательные цеха и службы, в т.ч. ремонтно-механический,
транспортный и пр.
Орджоникидзевский ГОК – 71%
Основным видом выпускаемой продукции является марганцевый
концентрат различных сортов с содержанием чистого марганца от 26% до 43% (в
зависимости от сортности). Попутные продукты — керамзитовая глина и шламы.
Добычу марганцевой руды предприятие ведется на закрепленных
за ним рудных полях. Запасов руд хватит на срок более 30 лет. Запасы
марганцевой руды в Украине суммарно по Орджоникидзевскому и Марганцевому
горно-обогатительным комбинатам составляет треть всех мировых запасов.
- Обозначение — Mn (Manganese);
- Период — IV;
- Группа — 7 (VIIb);
- Атомная масса — 54,938046;
- Атомный номер — 25;
- Радиус атома = 127 пм;
- Ковалентный радиус = 117 пм;
- Распределение электронов — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 ;
- t плавления = 1244°C;
- t кипения = 1962°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,55/1,60;
- Степень окисления: +7, +6, +5, +4, +3, +2, +1, 0;
- Плотность (н. у.) = 7,21 г/см 3 ;
- Молярный объем = 7,35 см 3 /моль.
Соединения марганца:
Пиролюзит(минерал марганца) был известен людям еще с древних времен, он использовался нашими предками для осветления стекла, получаемого варкой. До 1774 г. пиролюзит считали разновидностью магнитного железняка. И только в 1774 г. швед К. Шееле догадался, что в пиролюзите присутствует неизвестный тогдашней науке металл, после чего Ю. Ган получил металлический марганец, нагревая пиролюзит в печке с углем. Свое название «марганец» получил в начале 19 века (от немецкого Manganerz — марганцевая руда).
Марганец занимает 14-е место среди всех химических элементов по распространенности в земной коре. Больше всего марганца содержится в основных породах. Самостоятельные месторождения марганца крайне редки, чаще этот металл сопутствует железу во многих его рудах. Достаточно много марганца содержится в железо-марганцевых конкрециях, расположенных в донной части Мирового океана.
Минералы, богатые марганцем:
- пиролюзит — MnO 2 ·n
H 2 O - манганит — MnO(OH)
- марганцевый шпат — MnCO 3
- браунит — 3Mn 2 O 3 ·MnSiO 3
Рис. Строение атома марганца
.
Электронная конфигурация атома марганца — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 5 электронов 3d-подуровня (всего 7 электронов), поэтому в соединениях марганец может принимать степени окисления от +7 до +1 (наиболее часто встречаются +7, +2). Марганец является химически активным металлом. Аналогично алюминию при комнатной температуре реагирует с кислордом, содержащимся в атмосферном воздухе, с образованием прочной защитной оксидной пленки, которая предотвращает дальнейшее окисление металла.
Физические свойства марганца:
- металл серебристо-белого цвета;
- твердый;
- хрупкий при н. у.
Известны 4 модификации марганца: α-форма; β-форма; γ-форма; δ-форма.
До 710°C устойчивой является α-форма, которая при дальнейшем нагревании последовательно через все модификации переходит к δ-форме (1137°C).
Химические свойства марганца
- марганец (порошок) легко реагирует с кислородом, образуя оксиды, вид которого зависит от температуры реакции:
- 450°C — MnO 2 ;
- 600°C — Mn 2 O 3 ;
- 950°C — Mn 3 O 4 ;
- 1300°C — MnO.
- мелкораздробленный марганец при нагревании реагирует с водой с выделением водорода:
Mn + 2H 2 O = Mn(OH) 2 + H 2 ; - марганец (порошок) при нагревании вступает в реакцию с азотом, углеродом, серой, фосфором:
Mn + S = MnS; - активно реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Mn + 2HCl = MnCl 2 + H 2 ; - реагирует с разбавленной азотной кислотой:
3Mn + 8HNO 3 = 3Mn(NO 3) 2 + 2NO + 4H 2 O.
Применение и получение марганца
Получение марганца:
- чистый марганец получают электролизом водных растворов MnSO 4 с добавкой (NH 4) 2 SO 4 при pH=8-8,5: анод — свинец; катод — нержавеющая сталь (чешуйки марганца снимают с катодов);
- менее чистый марганец получают из его оксидов металлотермическими методами:
- алюмотермия:
4Al + 3MnO 2 = 3Mn + 2Al 2 O 3 ; - кремнийтермия:
Si + MnO 2 = Mn + SiO 2 .
- алюмотермия:
Применение марганца:
- в металлургии марганец используют для связывания серы и кислорода:
Mn + S = MnS; 2Mn + O 2 = 2MnO; - в качестве лигирующей добавки при выплавке различных сплавов (марганец дает коррозоустойчивость, вязкость, твердость):
- манганин
— сплав марганца с медью и никелем; - ферромарганец
— сплав марганца с железом; - марганцевая бронза
— сплав марганца с медью.
- манганин
- Калия перманганат издавная используют в качестве антисепитческого средства, которое действует только на поверхности кожи и слизистых оболочек.
Биологическая роль марганца:
Марганец входит в десятку «металлов жизни», необходимых для нормальной жизнедеятельности животных и растительных клеток.
В теле взрослого человека содержится порядка 12 мг марганца, который участвует в образовании белковых комплексов, а также входит в состав некоторых нуклеиновых кислот, аминокислот, ферментов (аргиназы и холинэстеразы).
Марганец наряду с магнием участвует в активации гидролиза АТФ, обеспечивая тем самым энергетическую жизнедеятельность живой клетки.
Ионы марганца участвуют в активации нуклеазы — данный фермент необходим для разложения нуклеиновых кислот до нуклеотидов.
Mn Марганец
МАРГАНЕЦ
(лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55 Mn. Конфигурация двух внешних электронных слоев атома марганца 3s 2 p 6 d 5 4s 2 . В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, к которой относятся также технеций и рений, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Радиус нейтрального атома марганца 0,130 нм, радиус иона Mn 2+ 0,080-0,104 нм, иона Mn 7+ 0,039-0,060 нм. Энергии последовательной ионизации атома марганца 7,435, 15,64, 33,7, 51,2, 72,4 эВ. По шкале Полинга электроотрицательность марганца 1,55; марганец принадлежит к числу переходных металлов.
Марганец в компактном виде твердый серебристо-белый металл.
Физические и химические свойства:
марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив a-Mn, параметр решетки а = 0,89125 нм, плотность 7,44 кг/дм 3 . В интервале температур 710-1090°C существует b-Mn, параметр решетки а = 0,6300 нм; при температурах 1090-1137°C g-Mn, параметр решетки а = 0,38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив d-Mn с параметром решетки а = 0,30750 нм. Модификации a, b, и d хрупкие, g-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn 3 O 4 и внутреннего слоя состава MnO.
Марганец образует несколько оксидов: MnO, Mn 3 O 4 , Mn 2 O 3 , MnO 2 и Mn 2 O 7 . Все они, кроме Mn 2 O 7 , представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества.
Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO 3 = MnO + CO 2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn 2 O 3 . Этот же оксид марганца образуется при нагревании MnO 2 на воздухе при температуре примерно 600°C:
4MnO 2 = 2Mn 2 O 3 + O 2
Оксид Mn 2 O 3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO 2 .
Если MnO 2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn 3 O 4:
3MnO 2 = Mn 3 O 4 + O 2
Этот оксид можно представить как MnO·Mn 2 О 3 , и по свойствам Mn 3 О 4 соответствует смеси этих оксидов.
Диоксид марганца MnO 2 наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая b-модификация MnO 2 это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, g-MnO 2 также встречается в природе. Это минерал рамсделит (другое название полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO 2 можно восстановить водородом до MnO.
Если к перманганату калия KMnO 4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn 2 O 7 , обладающий сильными окислительными свойствами:
2KMnO 4 + 2H 2 SO 4 = 2KHSO 4 + Mn 2 O 7 + H 2 O.
Mn 2 O 7 кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO 4 .
При взаимодействии марганца с галогенами образуются дигалогениды MnHal 2 . В случае фтора возможно также образование фторидов состава MnF 3 и MnF 4 , а в случае хлора также трихлорида MnCl 3 . Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS 2 . Известна целая группа нитридов марганца: MnN 6 , Mn 5 N 2 , Mn 4 N, MnN, Mn 6 N 5 , Mn 3 N 2 .
С фосфором марганец образует фосфиды составов MnР, MnP 3 , Mn 2 P, Mn 3 P, Mn 3 P 2 и Mn 4 P. Известно несколько карбидов и силицидов марганца.
С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH) 2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца (II):
Mn + 2HCl = MnCl 2 + H 2 .
Из растворов солей Mn 2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH) 2:
Mn(NO 3) 2 + 2NaOH = Mn(OH) 2 + 2NaNO 3
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H 2 MnO 4 и марганцовая кислота HMnO 4 , соли которых соответственно, манганаты (например, манганат натрия Na 2 MnO 4) и перманганаты (например, перманганат калия KMnO 4).
Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
2NaI + Na 2 MnO 4 + 2H 2 O = MnO 2 + I 2 + 4NaOH,
так и восстановителей
2K 2 MnO 4 + Cl 2 = 2KMnO 4 + 2KCl.
В водных растворах манганаты диспропорционируют на соединения марганца (+4) и марганца (+7):
3K 2 MnO 4 + 3Н 2 О = 2KMnO 4 + MnO 2 ·Н 2 О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном.
Перманганаты сильные окислители. Например, перманганат калия KMnO 4 в кислой среде окисляет сернистый газ SO 2 до сульфата:
2KMnO 4 + 5SO 2 +2H 2 O = K 2 SO 4 + 2MnSO 4 + 2H 2 SO 4 .
При давлении около 10 МПа безводный MnCl 2 в присутствии металлоорганических соединений реагирует с оксидом углерода (II) CO с образованием биядерного карбонила Mn 2 (CO) 10 .
История открытия:
один из основных материалов марганца пиролюзит был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале 19 в. для него было принято название «манганум» (от немецкого Manganerz марганцевая руда).
Нахождение в природе:
в земной коре содержание марганца составляет около 0,1 % по массе. В свободном виде марганец не встречается. Из руд наиболее распространены пиролюзит MnO 2 (содержит 63,2 % марганца), манганит MnO 2 ·Mn(OH) 2 (62,5 % марганца), браунит Mn 2 O 3 (69,5 % марганца), родохрозит MnCo 3 (47,8 % марганца), псиломелан mMnO·MnO 2 ·nH 2 O (45-60% марганца) и ряд других. Марганец содержат железо-марганцевые конкреции, которые в больших количествах (сотни миллиардов тонн) находятся на дне Тихого, Атлантического и Индийского океанов. В морской воде содержится около 1,0·10 8 % марганца. Промышленного значения эти запасы марганца пока не имеют из-за сложности подъема конкреций на поверхность.
Получение:
промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе при восстановлении руд железа и марганца коксом. В ферромарганце содержание углерода составляет 6-8 % по массе.
Чистый марганец получают электролизом водных растворов сульфата марганца MnSO 4 , который проводят в присутствии сульфата аммония (NH 4) 2 SO 4 .
Применение:
более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей кислорода, серы и других), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn 2 (CO) 10 .
Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических реакций, входят в состав микроудобрений.
Биологическая роль:
марганец микроэлемент , постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Содержание марганца в растениях составляет 10 4 -10 2 %, в животных 10 3 -10 5 %, некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, влияет на проветривание и минеральный обмен.
Этот элемент в виде пиролюзита (диоксид марганца, MnO 2) использовался доисторическими пещерными художниками пещеры Ласко, во Франции, ещё около 30 000 лет назад. В более поздние времена в древнем Египте производители стекла использовали минералы, содержащие этот металл для удаления бледно-зеленоватого оттенка натурального стекла.
Отличные руды
были найдены в регионе Магнезия, что в северной Греции, к югу от Македонии, и именно тогда началась путаница с названием. Различные руды из региона, которые включали как магний, так и марганец просто назывались магнезией. В XVII веке термин магнезия альба или белая магнезия была принята для магниевых минералов, в то время как название чёрная магнезия использовалась для более тёмных оксидов марганца.
Кстати, знаменитые магнитные минералы, обнаруженные в этом регионе, были названы камнем магнезии, который, в конце концов, стал сегодняшним магнитом. Путаница продолжалась ещё некоторое время пока в конце XVIII века группа шведских химиков пришла к выводу, что марганец является отдельным элементом. В 1774 году, член группы, представил эти выводы в Стокгольмскую академию, а в том же году Юхан Готлиб Ган, стал первым человеком, который получил чистый марганец и доказал, что это отдельный элемент
.
Марганец — химический элемент, характеристики марганца

читается как марганец, например, KMnO 4 — калий марганец о четыре. Это очень распространённый элемент в горных породах, его количество оценивается как 0,085% от массы земной коры.
Существует более 300 различных минералов
, содержащих этот элемент. Крупные земные месторождения находятся в Австралии, Габоне, Южной Африке, Бразилии и России. Но ещё больше находиться на океанском дне в основном на глубине от 4 до 6 километров, поэтому его добыча там не является коммерчески жизнеспособной.
Минералы окисленного железа (гематит, магнетит, лимонит и сидерит) содержат 30% этого элемента. Другим потенциальным источником являются глина и красные грязевые отложения, в которых есть узелки с содержанием до 25%. Наиболее чистый марганец
получают путём электролиза водных растворов.
Марганец и хлор находятся в VII группе периодической таблицы, но хлор — в главной подгруппе, а марганец — в побочной, к которой относятся ещё технеций Тс и рений Ке — полные электронные аналоги. Марганец Мп, технеций Тс и рений Ке — полные электронные аналоги с конфигурацией валентных электронов.
Этот элемент присутствует
в небольших количествах и в сельскохозяйственных почвах. Во многих сплавах меди, алюминия, магния, никеля различное его процентное содержание, даёт им конкретные физические и технологические свойства:
- устойчивость к износу;
- теплоустойчивость;
- устойчивость к коррозии;
- плавкость;
- электрическое сопротивление и т. д.
Валентности марганца
Степени окисления марганца от 0 до +7. В двухвалентной степени окисления марганец имеет отчётливо металлический характер и высокую склонность к образованию сложных связей. При четырехвалентном окислении преобладает промежуточный характер между металлическими и неметаллическими свойствами, в то время как шестивалентный и семивалентный обладают неметаллическими свойствами.
Оксиды:
Формула. Цвет
Биохимия и фармакология
Марганец является элементом, широко распространённым в природе, он присутствует в большинстве тканей растений и животных. Самые высокие концентрации находятся:
- в апельсиновой корке;
- в винограде;
- в ягодах;
- в спарже;
- в ракообразных;
- в брюхоногих;
- в двустворчатых.
Одни из наиболее важных реакций в биологии, фотосинтезе , полностью зависят от этого элемента. Это звёздный игрок в реакционном центре фотосистемы II, где молекулы воды превращаются в кислород. Без него невозможен фотосинтез
.
Он является важным элементом во всех известных живых организмах. Например, фермент, ответственный за превращение молекул воды в кислород во время фотосинтеза, содержит четыре атома марганца.
Средний человеческий организм содержит около 12 миллиграммов этого металла. Мы получаем около 4 миллиграммов каждый день из таких продуктов, как орехи, отруби, злаки, чай и петрушка. Этот элемент делает кости скелета более прочными. Он также важен для усвоения витамина B1.
Польза и вредные свойства

, имеет большое биологическое значение: он действует в качестве катализатора в биосинтезе порфиринов, а затем гемоглобина у животных и хлорофилла в зелёных растениях. Его присутствие также является необходимым условием для активности различных митохондриальных ферментных систем, некоторых ферментов метаболизма липидов и окислительных процессов фосфорилирования.
Пары или питьевая вода, загрязнённая солями этого металла, приводит к ирритативным изменениям дыхательных путей, хронической интоксикации с прогрессирующей и необратимой тенденцией, характеризующейся поражением базальных ганглиев центральной нервной системы, а затем нарушению экстрапирамидного типа аналогичного болезни Паркинсона.
Такое отравление часто имеет
профессиональный характер. Ему подвержены рабочих занятые на обработке этого металла и его производных, а также работники химической и металлургической промышленности. В медицине, его используют в форме перманганата калия как вяжущее, местное антисептическое средство, а также в качестве антидота ядов природы алкалоидов (морфин, кодеин, атропин и т. д.).
Некоторые почвы имеют низкий уровень этого элемента, поэтому его добавляют к удобрениям и дают в качестве пищевой добавки для пасущихся животных.
Марганец: применение

Когда Генри Бессемер
изобрёл процесс производства стали в 1856 году, его сталь разрушалась из-за горячей прокатки. Проблема была решена в том же году, когда было обнаружено, что добавление небольших количеств этого элемента к расплавленному железу решает эту проблему. Сегодня фактически около 90% всего марганца используется для производства стали.
Марганец – химический элемент с атомной массой 54,9380 и атомным номером 25, серебристо-белого оттенка, с большой массой, в природе существует в виде стабильного изотопа 35 Мn. Первые упоминания о металле записал древнеримский ученый Плиний, называл его «черным камнем». В те времена марганец использовался в качестве осветлителя стекла, во время процесса варки в расплав добавлялся пиролюзит марганца МnО 2 .
В Грузии издавна пиролюзит марганца использовался как присадка во время получения железа, назывался черной магнезией и считался одной из разновидностей магнетита (магнитного железняка). Лишь в 1774 году шведским ученым Шееле было доказано, что это соединение неизвестного науке металла, а через несколько лет Ю. Ган во время нагревания смеси угля и пиролюзита получил первый марганец, загрязненный атомами углерода.
Природное распространение марганца
В природе химический элемент марганец малораспространен, в земной коре его содержится всего 0,1%, в вулканической лаве 0,06–0,2%, металл на поверхности в рассеянном состоянии, имеет форму Мn 2+ . На поверхности земли под воздействием кислорода быстро образуются окислы марганца, имеют распространение минералы Мn 3+ и Мn 4+ , в биосфере металл малоподвижен в окислительной среде. Марганец – химический элемент, активно мигрирует при наличии восстановительных условий, металл очень подвижен в кислых природных водоемах тундры и лесных ландшафтах, где преобладает окислительная среда. По этой причине культурные растения имеют избыточное содержание металла, в почвах образуются железомарганцевые конкреции, болотные и озерные низкопроцентные руды.
В регионах с сухим климатом преобладает щелочная окислительная среда, что ограничивает подвижность металла. В культурных растениях ощущается недостаток марганца, сельхозпроизводство не может обходиться без использования специальных комплексных микродобавок. В реках химический элемент малораспространен, но суммарный вынос может достигать больших величин. Особенно много марганца имеется в прибрежных зонах в виде естественных осадков. На дне океанов встречаются большие залежи металла, которые образовались в давние геологические периоды, когда дно было сушей.
Химические свойства марганца
Марганец относится к категории активных металлов, при повышенных температурах активно вступает в реакции с неметаллами: азотом, кислородом, серой, фосфором и другими. В результате образуются разновалентные окислы марганца. При комнатной температуре марганец химический элемент малоактивен, при растворении в кислотах образует двухвалентные соли. При нагреве в вакууме до высоких температур химический элемент способен испаряться даже из устойчивых сплавов. Соединения марганца во многом схожи с соединениями железа, кобальта и никеля, находящихся в такой же степени окисления.
Наблюдается большое сходство марганца с хромом, подгруппа металла также имеет повышенную устойчивость при высших степенях окисления при увеличении порядкового номера элемента. Перенаты являются менее сильными окислителями, чем перманганаты.
Исходя из состава соединений марганца (II) допускается образование металла с более высокими степенями окисления, такие превращения могут происходить как в растворах, так и в расплавах солей.
Стабилизация степеней окисления марганца
Существование большого числа степеней окисления у марганца химического элемента объясняется тем, что в переходных элементах во время образования связей с d-орбиталями их энергетические уровни расщепляются при тетраэдрическом, октаэдрическом и квадратном размещении лигандов. Ниже приводится таблица известных в настоящее время степеней окисления некоторых металлов в первом переходном периоде.
Обращают на себя внимание низкие степени окисления, которые встречаются в большом ряде комплексов. В таблице есть перечень соединений, в которых лигандами являются химически нейтральные молекулы CO, NO и другие.
За счет комплексообразования стабилизируются высокие степени окисления марганца, самыми подходящими для этого лигандами является кислород и фтор. Если принимать во внимание, что стабилизирующее координационное число равняется шести, то максимальная стабилизация равняется пяти. Если марганец химический элемент образует оксокомплексы, то могут стабилизироваться более высокие степени окисления.
Стабилизация марганца в низших степенях окисления
Теория мягких и жестких кислот и оснований дает возможность объяснить стабилизацию разных степеней окисления металлов за счет комплексообразования при воздействии с лигандами. Элементы мягкого типа успешно стабилизируют невысокие степени окисления металла, а жесткие положительно стабилизируют высокие степени окисления.
Теория полностью объясняет связи металл-металл, формально эти связи рассматриваются как кислотно-основное взаимное воздействие.
Сплавы марганца
Активные химические свойства марганца позволяют ему образовывать сплавы со многими металлами, при этом большое количество металлов может растворяться в отдельных модификациях марганца и стабилизировать его. Медь, железо, кобальт, никель и некоторые другие металлы способны стабилизировать γ-модификацию, алюминий и серебро способны расширять β- и σ-области магния в двойных сплавах. Эти характеристики играют важную роль металлургии. Марганец химический элемент позволяет получать сплавы и высокими значениями пластичности, они поддаются штамповке, ковке и прокату.
В химических соединениях валентность марганца изменяется в пределах 2–7, увеличение степени окисления становится причиной возрастания окислительных и кислотных характеристик марганца. Все соединения Mn(+2) относятся к восстановителям. Оксид марганца имеет восстановительные свойства, серо-зеленого цвета, в воде и щелочах не растворяется, зато отлично растворяется в кислотах. Гидроксид марганца Mn(OH) 3 в воде не растворяется, по цвету белое вещество. Образование Mn(+4) может быть и окислителем (а), и восстановителем (б).
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O (а)
Эта реакция используется при необходимости получения в лабораторных условиях хлора.
MnO 2 + KClO 3 + 6KOH = KCl + 3K 2 MnO 4 + 3H 2 O (б)
Реакция протекает при сплавлении металлов. MnO 2 (оксид марганца) имеет бурый цвет, соответствующий гидроксид по цвету несколько темнее.
Физические свойства марганца
Марганец – химический элемент с плотностью 7,2–7,4 г/см 3 , t° плавления +1245°С, закипает при температуре +1250°С. Металлу присущи четыре полиморфные модификации:
- α-Мn. Имеет кубическую объемно-центрированную решетку, в одной элементарной ячейке располагается 58 атомов.
- β-Мn. Имеет кубическую объемно-центрированную решетку, в одной элементарной ячейке располагается 20 атомов.
- γ-Мn. Имеет тетрагональную решетку, в одной ячейке 4 атома.
- δ-Mn. Имеет кубическую объемно-центрированную решетку.
Температуры превращений марганца: α=β при t°+705°С; β=γ при t°+1090°С; γ=δ при t°+1133С. Наиболее хрупкая модификация α, в металлургии используется редко. Самыми значительными показателями пластичности отличается модификация γ, она чаще всего используется в металлургии. β-модификация частично пластична, промышленность ее применяет редко. Атомный радиус марганца химического элемента составляет 1,3 А, ионные радиусы в зависимости от валентности колеблются в пределах 0,46–0,91. Марганец парамагнитен, коэффициенты теплового расширения 22,3×10 -6 град -1 . Физические свойства могут немного корректироваться в зависимости от чистоты металла и его фактической валентности.
Способ получения марганца
Современная промышленность получает марганец по методу, разработанному электрохимиком В. И. Агладзе путем электрогидролиза водных растворов металла при добавлении (NH 4)2SO 4 , во время процесса кислотность раствора должна быть в пределах рН = 8,0–8,5. В раствор погружаются свинцовые аноды и катоды из сплава на основе титана АТ-3, допускается замена титановых катодов нержавеющими. Промышленность использует порошок марганца, который после окончания процесса снимается с катодов, металл оседает в виде чешуек. Способ получения считается энергетически затратным, это оказывает прямое влияние на увеличение себестоимости. При необходимости собранный марганец в дальнейшем переплавляется, что позволяет облегчить его применение в металлургии.
Марганец – химический элемент, который можно получать и галогенным процессом за счет хлорирования руды и дальнейшим восстановлением образовавшихся галогенидов. Такая технология обеспечивает промышленность марганцем с количеством посторонних технологических примесей не более 0,1%. Более загрязненный металл получают при протекании алюмотермической реакции:
3Mn 3 O 4 + 8Al = 9Mn + 4A l2 O 3
Или электротермией. Для удаления вредных выбросов в производственных цехах монтируется мощная принудительная вентиляция: воздуховоды из ПВХ, вентиляторы центробежного принципа действия. Кратность обмена воздуха регламентируется нормативными положениями и должна обеспечивать безопасное пребывание людей в рабочих зонах.
Использование марганца
Главный потребитель марганца – черная металлургия. Широкое использование металл имеет и в фармацевтической промышленности. На одну тонну выплавляемой стали необходимо 8–9 килограмм, перед введением в сплав марганца химического элемента его предварительно сплавляют с железом для получения ферромарганца. В сплаве доля марганца химического элемента составляет до 80%, углерода до 7%, остальное количество занимает железо и различные технологические примеси. За счет использования добавок значительно повышаются физико-механические характеристики сталей, выплавляемых в доменных печах. Технология пригодна и для использования добавок в современных электрических сталелитейных печах. За счет добавок высокоуглеродистого ферромарганца происходит раскисление и десульфарация стали. При добавке средне- и малоуглеродистых ферромарганцев металлургия получает легированные стали.
Низколегированная сталь имеет в составе 0,9–1,6% марганца, высоколегированная до 15%. Высокими показателями физической прочности и антикоррозионной устойчивости обладает сталь с содержанием 15% марганца и 14% хрома. Металл износоустойчив, может работать в жестких температурных условиях, не боится прямого контакта с агрессивными химическими соединениями. Такие высокие характеристики позволяют использовать сталь для изготовления наиболее ответственных конструкций и промышленных агрегатов, работающих в сложных условиях.
Марганец – химический элемент, применяемый и во время выплавки сплавов на безжелезной основе. Во время производства высокооборотных лопаток промышленных турбин используется сплав меди с марганцем, для пропеллеров применяются бронзы с содержанием марганца. Кроме этих сплавов, марганец как химический элемент присутствует в алюминиевых и магниевых. Он намного улучшает эксплуатационные характеристики цветных сплавов, делает их хорошо деформируемыми, не боящимися коррозионных процессов и износостойкими.
Легированные стали являются основным материалом для тяжелой промышленности, незаменимы во время производства различных типов вооружений. Широко применяются в кораблестроении и самолетостроении. Наличие стратегического запаса марганца – условие высокой обороноспособности любого государства. В связи с этим добыча металла ежегодно увеличивается. Кроме того, марганец – химический элемент, применяемый во время производства стекла, в сельском хозяйстве, полиграфии и т. д.
Марганец в флоре и фауне
В живой природе марганец – химический элемент, играющий важную роль в развитии. Он влияет на характеристики роста, состав крови, интенсивность процесса фотосинтеза. В растениях его количество составляет десятитысячные доли процента, а в животных стотысячные доли процента. Но даже такое незначительное содержание оказывает заметное влияние на большинство их функций. Он активирует воздействие ферментов, влияет на функцию инсулина, минеральный и кроветворный обмен. Недостаток марганца становится причиной появления различных болезней как острых, так и хронических.
Марганец – химический элемент, широко используемый в медицине. Недостаток марганца понижает физическую выносливость, становится причиной некоторых видов анемий, нарушает обменные процессы в костных тканях. Широко известны дезинфицирующие характеристики марганца, его растворы используются во время обработки некрозных тканей.
Недостаточное количество марганца в пище животных становится причиной снижения ежесуточного привеса. Для растений такая ситуация становится причиной пятнистости, ожогов, хлорозов и других заболеваний. При обнаружении признаков отравления назначается специальная медикаментозная терапия. Сильное отравление может становиться причиной появления синдрома марганцевого паркинсонизма – трудноизлечимой болезни, оказывающей негативное влияние на центральную нервную систему человека.
Суточная потребность марганца составляет до 8 мг, главное количество человек получает с пищей. При этом рацион должен быть сбалансированным по всем питательным веществам. При увеличенной нагрузке и недостаточном количестве солнечного света доза марганца корректируется на основании общего анализа крови. Значительное количество марганца содержится в грибах, водяных орехах, ряске, моллюсках и ракообразных. Содержание марганца в них может достигать нескольких десятых процента.
При попадании марганца в организм в чрезмерных дозах могут возникать болезни мышечных и костных тканей, поражаются дыхательные пути, страдает печень и селезенка. Для выведения марганца из организма требуется много времени, за этот период токсические характеристики увеличиваются с эффектом накапливания. Допустимая санитарными органами концентрация марганца в воздушной среде должна быть ≤ 0,3 мг/м 3 , контроль параметров выполняется в специальных лабораториях путем отбора воздуха. Алгоритм отбора регулируется государственными нормативными актами.
Истинная, эмпирическая, или брутто-формула: Mn
Молекулярная масса: 54,938
Марганец
— элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum, ма́нганум, в составе формул по-русски читается как марганец, например, KMnO 4 — калий марганец о четыре). Простое вещество марганец (CAS-номер: 7439-96-5) — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Распространённость в природе
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7-10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца
- пиролюзит MnO 2 ·xH 2 O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn 2 O 3 ·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O 4 ;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO 3 (47,8 % марганца);
- псиломелан mMnO MnO 2 nH 2 O (45-60 % марганца);
- пурпурит Mn 3 +, (36,65 % марганца).
Получение
- Алюминотермическим методом, восстанавливая оксид Mn 2 O 3 , образующийся при прокаливании пиролюзита.
- Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (~80 % Mn).
- Чистый металлический марганец получают электролизом.
Физические свойства
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент линейного температурного расширения: 0,000022 см/см/°C (при 0 °C)
- Электропроводность: 0,00695·106 Ом -1 ·см -1
- Теплопроводность: 0,0782 Вт/см·K
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость
- по шкале Бринелля: Мн/м²
- по шкале Мооса: 4
- Давление паров: 121 Па при 1244 °C
- Молярный объём: 7,35 см³/моль
Химические свойства
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны). При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде.
Марганец при нагревании разлагает воду , вытесняя водород. При этом слой образующегося гидроксида марганца замедляет реакцию. Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn 3 C и другие. Образует также силициды, бориды, фосфиды. В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn 2 O 3 , MnO 2 , MnO 3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn 2 O 7 .
Mn 2 O 7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn 2 O 3 и MnO 2 , а также комбинированный оксид Mn 3 O 4 (2MnO·MnO 2 , или соль Mn 2 MnO 4). При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты. Раствор манганата имеет тёмно-зелёный цвет. Раствор окрашивается в малиновый цвет из-за появления аниона MnO 4 − , и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Под действием сильных окислителей ион Mn 2+ переходит в ион MnO 4 — . Эта реакция используется для качественного определения Mn 2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа».
Соли MnCl 3 , Mn 2 (SO 4) 3 неустойчивы. Гидроксиды Mn(OH) 2 и Mn(OH) 3 имеют основный характер, MnO(OH) 2 — амфотерный. Хлорид марганца (IV) MnCl 4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора. Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn 2 (CO) 10 .
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF 3 , NO, N 2 , P(C 5 H 5) 3).
Применение в промышленности
Применение в металлургии
Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12-13 % Mn в сталь (так называемая Сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (эта сталь резко упрочняется и становится твёрже при ударах). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
В 1920-х-40х годах применение Марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале Сталь возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определенного содержания марганца в процессе мартеновской плавки, в которой вместе с В.И. Явойским и В. И. Баптизманским принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Применение в химии
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO 2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO 2 и KMnO 4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Теллурид марганца перспективный термоэлектрический материал (термо-э. д. с 500 мкВ/К).
Биологическая роль и содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект
Токсичность
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приёмом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве. Оно проявляется в виде тяжёлых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Чтобы развилась клиническая картина хронического отравления марганцем, обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемых повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом йода).
Месторождение
Усинское месторождение марганца
Содержание статьи
МАРГАНЕЦ
– химический элемент 7-й группы периодической системы, атомный номер 25, атомная масса 54,938. Марганец расположен в четвертом периоде между хромом и железом; постоянным спутником последнего он является и в природе. Есть только один устойчивый изотоп 55 Mn. Природный марганец целиком состоит из изотопа 55 Mn. Установлено, что неустойчивые ядра с массовыми числами 51, 52, 54 и 57 получаются при бомбардировке соседних (по периоду) элементов дейтронами, нейтронами, протонами, альфа-частицами или фотонами. Например, радиоактивный изотоп 57 Mn был выделен путем химического разделения из продуктов бомбардировки и его период полураспада составляет 1,7±0,1 мин.
Марганец, в соответствии с номером группы, проявляет максимальную степень окисления, равную +7, но может существовать также во всех более низких степенях окисления от 0 до +7. Наиболее важные из них – два, четыре и семь.
Некоторые соединения марганца известны еще с древних времен. Диоксид марганца (пиролюзит) считали разновидностью магнитного железняка (magnes) и применяли в качестве «мыла стекловаров», из-за его способности обесцвечивать железосодержащие стекла. Это свойство пиролюзита было открыто очень давно, и в древних рукописях минерал может быть опознан не столько по многочисленным и различным наименованиям его, сколько по этому индивидуальному характерному признаку. Древнеримский историк Плиний Старший , погибший при извержении Везувия, назвал черный немагнитный пиролюзит «женским магнитом» в отличие от коричневого магнитного железняка. В средневековье мастера стеклянных дел уже различали magnesius lapis – магнитный железняк и pseudomagnes (фальшивый магнит) – пиролюзит. Название пиролюзит было впервые дано этому минералу В. Хейденгером в 1826, который исходил из его использования в производстве стекла: от греческого pur– огонь и luen– мыть. Подобные же рассуждения есть в описании этого минерала Роже де Л»Илем, который называл его le savon des verriers или sapo vitriorum (мыло стекольщиков). В действительности, как упоминалось выше, минерал был описан значительно раньше Плинием под названием magnesius lapis и алхимиком Василием Валентином под названием Braunstein, который назвал его так потому, что этот минерал (в большинстве случаев черно-серого цвета) давал коричневую глазурь на глиняных изделиях. Интересна история происхождения названия минерала – magnesius lapis, от которого и происходит современное название элемента. Хотя пиролюзит и немагнитен, что признавал и Плиний, он соглашался рассматривать его как lapis magnesius из-за внешнего сходства, обьясняя его отличие от других минералов, притягивающихся к железу, разницей полов: железомарганцовистый magnesius lapis – женского рода и поэтому, по убеждению древних, более привлекателен. Плиний также обьяснял применение слова magnes, связывая его с именем пастуха Magnes, наблюдавшего, что гвозди его башмаков и железный наконечник палки притягивались к земле в том месте, где был найден магнитный железняк. Однако возможно, что это наименование связано с тем, что одна из разновидностей lapis magnes, имеющая белую окраску, была обнаружена в Азии на территории, называемой Магнезия. Согласно другой гипотезе, выдвинутой Л.Делатре, предполагается, что термин обязан своим происхождением греческому слову magganon – иллюзии; это связывается с хрупким и неустойчивым поведением металла, полученного из руды и внешне сходного с железной рудой. Делатре также предполагал, что термин связан с местностью Мангана в Восточной Индии. Термин manganesis чаще всего встречается в работах Альбертуса Магнуса (1193–1280). В более поздних материалах термин несколько видоизменился: вместо «магнезия» (magnesia) – «марганец» (manganese). Только в 1774 великий шведский химик Карл Вильгельм Шееле установил, что марганцевая руда и ее концентрат содержат неизвестный ранее металл. В его знаменитом исследовании свойств пиролюзита, представленном Стокгольмской академии наук, он, тем не менее, сообщал об открытии другого нового элемента – хлора. Хотя Шееле и открыл этот металл, ему не удалось выделить его в чистом виде. В этом же году Юхан Ган получил королек металла (braunsteinmetall) прокаливанием смеси пиролюзита с углем. Ган скатывал из оксида марганца шарики, нагревал их в тигле, выложенном древесным углем, и при этом получил большое количество маленьких металлических глобул, составляющих одну треть по весу от используемого минерала. Предполагают также, что именно Ган предложил для нового вещества название марганец, однако еще долгое время полученный металл продолжали называть так же, как и руду, – браунштайн. Термин марганец стал всеобщим лишь в начале 19 в. Его назвали manganesium. Позднее этот металл, чтобы не было путаницы с открытым в то же время магнием (magnasium), был переименован в manganium. В России, в первой половине 19 в. испеользовалось название марганцовик, а позже можно было встретить другое – манганес, связанное с изготовлением финифти пурпурного цвета.
Марганец встречается на всех континентах во многих кристаллических породах, в которых он, подобно железу, растворяется и вновь выделяется в виде оксидов, карбонатов, гидроксидов, вольфраматов, силикатов, сульфатов и других соединений. После железа марганец – самый распространенный из тяжелых металлов и пятнадцатый среди всех элементов периодической системы. Содержание его в земной коре составляет 0,1% по массе или 0,03% от общего числа атомов. Залежи марганцевых руд распространены практически повсеместно, но наиболее крупные из них расположены на территории бывшего СССР – единственной страны-производителя марганца в мире, удовлетворявшей свои огромные потребности в концентрате собственными внутренними ресурсами. Самые значительные месторождения залегают в двух основных районах: около Чиатури (Грузия) и близ Никополя, на Днепре. В 1913 царская Россия поставляла 52% мирового экспорта марганца, около 76% которого (миллион тонн), добывалось в Чиатури. Чиатурское месторождение служило источником получения иностранной валюты в 1920-х. После революции рудник восстановили в 1923, и с тех пор у причалов Поти собирались десятки иностранных кораблей, вывозивших руду. С распадом Советского Союза основные залежи остались за пределами России – на Украине, в Казахстане и Грузии. Количество импортируемой в Россию марганцевой руды сейчас составляет в пересчете на товарную марганцевую руду 1,6 млн. т. Потребность же промышленности России на сегодняшний день оценивается в 6,0 млн. т. марганцевой руды (или 1,7–1,8 млн. т. концентрата). Крупными месторождениями марганцевой руды владеют Китай, Индия, Гана, Бразилия, Южно-Африканская республика, Габон, Марокко, США, Австралия, Италия, Австрия. Общая мировая добыча марганца составляет 20–25 млн. тонн в год в пересчете на металл. На Земле есть множество минералов, содержащих марганец, наиболее важные – пиролюзит (гидратированный диоксид марганца, MnO 2), браунит (Mn 2 O 3), манганит (MnOOH), родохрозит (MnCO 3). Колонны, поддерживающие своды станции метро «Маяковская» в Москве, украшены тонким обрамлением из розового минерала – родонита (метасиликата марганца). Податливость и нежный цвет делают этот камень замечательным облицовочным материалом. Изделия из родонита хранятся в Государственном Эрмитаже и многих других музеях России. Большие залежи этого минерала встречаются на Урале, где когда-то была найдена глыба родонита массой в сорок семь тонн. Уральское месторождение родонита самое крупное в мире.
Огромное количество марганцевых минералов сосредоточено на дне Мирового океана. Только в Тихом океане ресурсы этого элемента достигают, по разным оценкам, от нескольких десятков до нескольких сотен миллиардов тонн. Железо-марганцевые конкреции (а именно так называют отложения этих двух элементов на дне океана) обусловлены постоянным окислением (за счет растворенного в воде кислорода) растворимых соединений двухвалентного марганца. Еще в 1876 британский трехмачтовый парусник «Челленджер», возвращаясь из научной экспедиции, привез образцы «марганцевых почек». Последующие экспедиции показали, что на дне Мирового океана сосредоточено огромное количество железо-марганцевых конкреций. До середины двадцатого столетия они не привлекали к себе особого внимания и лишь потом, когда некоторые «сухопутные» месторождения оказались под угрозой истощения, их стали рассматривать как реальные источники марганцевого концентрата. Содержание марганца в такой «подводной» руде иногда достигает 50%. По своей форме конкреции напоминают картофельные клубеньки и имеют цвет от коричневого до черного в зависимости от того, какой элемент в них преобладет – железо или марганец. Размеры большинства таких образований колеблются от миллиметра до нескольких десятков сантиметров, но встречаются и океанические образования более крупных размеров. В Скриппсовском океанографическом институте (США) находится конкреция массой 57 килограммов, найденная неподалеку от Гавайских островов в Тихом океане. Наиболее круные экспонаты имеют массу около тонны.
Металлический марганец.
В России марганец стали выплавлять в первой четверти 19 в. в виде сплава с железом – ферромарганца. Внешне чистый марганец похож на железо, однако отличается от него большей твердостью и хрупкостью. Это серебристо-белый металл, приобретающий серый цвет от примеси углерода. Плотность марганца – 7200 кг/м 3 – близка к плотности железа, однако температура плавления его существенно ниже, чем у железа, и составляет 1247° С. Марганец в слитках в сухом воздухе покрывается слоем оксида, предохраняющим от дальнейшего окисления; во влажном воздухе окисление идет в объеме. В мелкораздробленном состоянии марганец окисляется легко, а при некоторых условиях становится пирофорным (самовоспламеняющимся на воздухе). Вообще реакционная способность металлического марганца существенно зависит от его чистоты. Так 99,9%-ый марганец практически не взаимодействует с водой и медленно реагирует с водяным паром, тогда как металл, загрязненный примесями углерода, кислорода или азота, медленно взаимодействует с водой уже при комнатной температуре и быстро с горячей:
Mn + 2H 2 O = Mn(OH) 2 + H 2 .
Марганец легко растворяется в разбавленных кислотах, но пассивируется холодной концентрированной H 2 SO 4:
Mn + H 2 SO 4 (разб.) = MnSO 4 + H 2 .
С хлором, бромом и иодом марганец реагирует с образованием дигалогенидов:
Mn + Hal 2 = MnHal 2 , где Hal = Cl, Br, I.
При повышенных температурах марганец реагирует также с азотом, углеродом, бором, фосфором, кремнием. Например, при температуре 1200° С марганец сгорает в азоте:
3Mn + N 2 = Mn 3 N 2 (с примесью Mn 5 N 2).
Металлический марганец имеет четыре модификации: a-Mn (при Т
Т = 1100° C), d-Mn (при Т
> 1137° C). В элементарной ячейке кристаллической решетки альфа-марганца содержится 58 атомов, поэтому, по образному выражению замечательного кристаллохимика профессора Московского Университета Г.Б.Бокия, эта модификация «большое чудо природы».
Известно несколько промышленных способов получения металлического марганца.
Восстановление углем или алюминием в тиглях из MgO или CaO в электрических печах. Процесс служит, главным образом, для получения ферромарганца путем восстановления смеси оксидов железа и марганца при 1000–1100° C:
3Mn 3 O 4 + 8Al = 9Mn + 4Al 2 O 3 .
Этим же способом металлический марганец можно получить в лаборатории, поджигая смесь оксида марганца и порошка алюминия с помощью магниевой ленты
Восстановление безводных галогенидов марганца(II) натрием, магнием или водородом применяется для получения кристаллов марганца.
Наиболее чистый марганец (99,98%) получают электролизом растворов MnSO 4 в присутствии (NH 4) 2 SO 4 при pH 8-8,5, при этом в процессе электролиза выделяется гамма-форма металла. Для очистки марганца от газовых примесей применяют двойную перегонку в высоком вакууме с последующей переплавкой в аргоне и закаливанием. Первое место в мире по производству и экспорту металлического марганца (чистоты 99,9%) занимает ЮАР. К концу 20 в. объем выплавки в этой стране составил 35 тысяч тонн в год, то есть примерно 42% от всего мирового производства. На мировом рынке цена на металлический марганец колеблется от 1500 до 3000 американских долл. за тонну в зависимости от чистоты металла.
Соединения марганца.
Марганец образует огромное число различных соединений, в которых он содержится в различных степенях окисления от 0 до +7, однако практический интерес представляют вещества, где марганец двух-, четырех- и семивалентен.
Оксид марганца
(II
) – порошок от серо-зеленого до травянисто-зеленого цвета. Его получают либо прокаливанием карбоната марганца (II) в атмосфере инертного газа, либо частичным восстановлением MnO 2 водородом. В мелкоизмельченном состоянии легко окисляется. В природе изредка встречается в виде минерала манганозита.Является катализатором некоторых промышленно важных реакций дегидрирования органических соединений.
Хлорид марганца
(II
) – в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом:
MnCO 3 + 2HCl = MnCl 2 + CO 2 + H 2 O .
Тетрагидрат хлорида марганца(II) удобно получать растворением карбоната марганца(II) в соляной кислоте и упариванием образовавшегося раствора. Безводный MnCl 2 весьма гигроскопичен.
Сульфат марганца
(II
) – в безводном состоянии практически не имеющий цвета порошок, горький на вкус и получающийся при дегидратации соответствующих кристаллогидратов (MnSO 4 ·nH 2 O, где n = 1,4,5,7). Гептагидрат сульфата марганца иногда встречается в природе в виде минерала миллардита и устойчив при температуре ниже 9° C. При комнатной температуре устойчив MnSO 4 ·5H 2 O, называемый марганцевым купоросом. В промышленности сульфат марганца получают растворением пиролюзита в горячей концентрированной серной кислоте:
2MnO 2 + 2H 2 SO 4 = 2MnSO 4 + O 2 + 2H 2 O.
или прокаливанием MnO 2 с безводным FeSO 4:
4MnO 2 + 4FeSO 4 = 4MnSO 4 + 2Fe 2 O 3 + O 2 .
Cоли двухвалентного марганца каталитически действуют на протекание некоторых окислительных процессов, особенно происходящих под действием атмосферного кислорода, на этом основано их применение в качестве сиккативов – веществ, которые будучи растворенными в льняном масле, ускоряют его окисление кислородом воздуха и, тем самым, способствуют более быстрому высыханию. Льняное масло, содержащее сиккатив, называют олифой. В качестве сиккативов применяются некоторые органические соли марганца.
Из соединений марганца(IV) наибольшее значение имеет диоксид марганца, который является важнейшим минералом марганца. Различают несколько форм природного диоксида марганца: пиролюзит, рамсделит, псиломелан и криптомелан.
Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO 3) 2:
Mn(NO 3) 2 = MnO 2 + 2NO 2 ;
окислением соединений марганца(II) в щелочной среде хлором, гипохлоритом натрия:
Mn(OH) 2 + Cl 2 +2KOH = MnO 2 + 2KCl + 2H 2 O
Mn(OH) 2 + NaOCl = MnO 2 + NaCl + H 2 O.
Диоксид марганца представляет собой черный порошок амфотерного характера, проявляющий как окислительные, так и восстановительные свойства:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O
MnO 2 + Cl 2 + 4KOH = K 2 MnO 4 + 2KCl + 2H 2 O.
Диоксид марганца, введенный в состав стекла, уничтожает зеленую окраску, обусловленную силикатом железа и придает стеклу розовый цвет (или черный, если MnO 2 добавлено много). Тонкодисперсный порошок диоксида марганца обладает адсорбирующими свойствами: поглощает хлор, соли бария, радия и некоторых других металлов.
Несмотря на огромную значимость пиролюзита, в быту гораздо чаще приходится встречаться с веществом, в котором марганец семивалентен, – перманганатом калия («марганцовкой»), получившим распространение благодаря его ярко выраженным антисептическим свойствам. Сейчас перманганат калия получают электролитическим окислением растворов манганата (VI) калия. Это соединение представляет собой кристаллы пурпурно-красного цвета, устойчивые на воздухе и умеренно растворимые в воде. Однако его растворы в воде быстро разлагаются на свету и медленно в темноте с выделением кислорода. Перманганат калия – сильный окислитель. Вот некоторые примеры его окислительной активности:
2KMnO 4 + 10HCl + 3H 2 SO 4 = 2MnSO 4 + 5Cl 2 + K 2 SO 4 + 8H 2 O
2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 = 2MnSO 4 + 5O 2 + 8H 2 O
8KMnO 4 + 5PH 3 + 12 H 2 SO 4 = 8MnSO 4 + 5H 3 PO 4 + 4K 2 SO 4 + 12H 2 O.
Перманганат калия широко применяется в медицине, ветеринарии и лабораторной практике.
Перманганат калия – соль марганцевой кислоты HMnO 4 , существующей только в растворе с максимальной концентрацией около 20%. Цвет ее растворов подобен цвету раствора KMnO 4 . Марганцевая кислота принадлежит к числу наиболее сильных кислот. Реакция образования марганцевой кислоты при действии диоксида свинца или висмутата натрия на соли марганца(II) имеет значение в аналитической химии, так как благодаря возникающей интенсивной розовой окраске, можно открыть даже следы марганца.
Оксид марганца(VII) Mn 2 O 7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия:
2KMnO 4 + H 2 SO 4 = Mn 2 O 7 + K 2 SO 4 + H 2 O.
Это вещество – чрезвычайно сильный окислитель, взрывается при ударе или нагревании. Многие вещества, такие как сера, фосфор, древесная стружка, спирт, при малейшем соприкосновении с ним воспламеняются. При растворении в большом количестве воды образует марганцевую кислоту.
Применение марганца в металлургии. Марганец необходим в производстве стали, и сегодня ему нет эффективной его замены. С введением марганца в ванну с расплавом, он выполняет несколько функций. При раскислении и рафинировании стали марганец восстанавливает оксиды железа, превращаясь в оксид марганца, который устраняется в виде шлака. Марганец взаимодействует с серой, и образовавшиеся сульфиды также переходят в шлак. Алюминий и кремний, хотя и служат раскислителями наряду с марганцем, не способны выполнять функцию десульфуризации. Введение элемента № 25 вызывает замедление скорости роста зерна при нагреве, что приводит к получению мелкозернистой стали. Известно также, что алюминий и кремний, напротив, ускоряют рост зерен.
Вводить марганец в сталь в процессе плавки можно при использовании ферросплавов. Еще в 19 в. металлурги научились выплавлять зеркальный чугун, содержащий 5–20% марганца и 3,5–5,5% углерода. Пионером в этой области стал английский металлург Генри Бессемер . Зеркальный чугун, подобно чистому марганцу, обладает свойством удалять из расплавленной стали кислород и серу. В те времена зеркальный чугун получали в доменной печи путем восстановления содержащих марганец шпатовых железняков, ввозимых из Рейнской Пруссии – из Штальберга.
Бессемер приветствовал дальнейшее развитие производства марганцевых сплавов, и под его руководством Гендерсон организовал в 1863 на заводе Феникс в Глазго производство ферромарганца – сплава, содержащего 25–35% марганца. Ферромарганец обладал преимуществами перед зеркальным чугуном при производстве стали, так как придавал ей большую вязкость и пластичность. Наиболее экономически выгодный способ производства ферромарганца – выплавка в доменной печи.
Несмотря на то, что получение ферромарганца Гендерсоном было технически прогрессивным процессом, этот сплав долгое время не находил применения из-за трудностей, возникающих при выплавке. Промышленная выплавка ферромарганца в России началась в 1876 в доменных печах Нижне-Тагильского завода. Русский металлург А.П.Аносов еще в 1841 в своем труде О булатах
описал добавление ферромарганца в сталь. Кроме ферромарганца в металлургии широкое применение находит силикомарганец (15–20% Mn, около 10% Si и меньше 5% С).
В 1878 девятнадцатилетний шеффилдский металлург Роберт Гадфилд приступил к изучению сплавов железа с другими металлами и в 1882 выплавил сталь с 12%-ым содержанием марганца. В 1883 Гадфилду был выдан первый британский патент на марганцовистую сталь. Оказалось, что закалка стали Гадфилда в воде придает ей такие замечательные свойства, как износостойкость и увеличение твердости при длительном действии нагрузок. Эти свойства сразу нашли применение при изготовлении железнодорожных рельсов, гусениц тракторов, сейфов, замков и многих других изделий.
В технике широко применяются тройные сплавы марганец-медь-никель – манганины. Они обладают большим электрическим сопротивлением, не зависящим от температуры, но зависящим от давления. Поэтому манганины используются при изготовлении электрических манометров. Действительно, обычным манометром нельзя измерить давление в 10 тыс. атмосфер, это можно сделать электрическим манометром, заранее зная зависимость сопротивления манганина от давления.
Интересны сплавы марганца с медью (особенно 70% Mn и 30% Cu), они могут поглощать энергию колебаний, это находит применение там, где необходимо уменьшить вредные производственные шумы.
Как показал Гейслер в 1898, марганец образует сплавы с некоторыми металлами, например с алюминием, сурьмой, оловом, медью, отличающиеся способностью намагничиваться, хотя они и не содержат ферромагнитных компонентов. Это свойство связано с наличием в таких сплавах интерметаллических соединений. По имени первооткрывателя подобные материалы называются сплавами Гейслера.
Биологическая роль марганца.
Марганец относится к важнейшим из жизненно необходимых микроэлементов и участвует в регуляции важнейших биохимических процессов. Установлено, что небольшие количества элемента № 25 есть во всех живых организмах. Марганец участвует в основных нейрохимических процессах в центральной нервной системе, в образовании костной и соединительной тканей, регуляции жирового и углеводного обмена, обмене витаминов С, Е, холина и витаминов группы В.
В крови человека и большинства животных содержание марганца составляет около 0,02 мг/л. Суточная потребность взрослого организма составляет 3–5 мг Mn. Марганец оказывает влияние на процессы кроветворения и иммунную защиту организма. Укушенного каракуртом (ядовитым среднеазиатским пауком) человека можно спасти, если ввести ему внутривенно раствор сульфата марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти и наблюдается в основном у рабочих, связанных с производством марганца и его сплавов.
Дефицит марганца – одно из распространенных отклонений в элементном обмене современного человека. Это связано со значительным снижением потребления богатых марганцем продуктов (грубая растительная пища, зелень), увеличением количества фосфатов в организме (лимонады, консервы и др.), ухудшением экологической ситуации в крупных городах и психо-эмоциональной перенапряженностью. Коррекция дефицита марганца оказывает положительное влияние на состояние здоровья человека.
Юрий Крутяков
Соли марганца (II)
Химические свойства
Получение
Гидроксид марганца (II)
Химические свойства
Оксид марганца (II) принадлежит к основным оксидам, обладает всеми их свойствами. Ему соответствует нестойкий гидроксид Mn(OH) 2 .
Гидроксид марганца (II) — Mn(OH) 2 – нерастворимое в воде вещество светло-розового цвета.
Основной способ получения – щелочная обработка солей марганца (II):
MnSO 4 + 2NaOH → Mn(OH) 2 ↓ + Na 2 SO 4
На воздухе окисляется до гидроксида марганца (IV):
2Mn(OH) 2 ↓ + O 2 + 2H 2 O → 2Mn(OH) 4 ↓
Проявляет все свойства нерастворимых в воде оснований.
Все соли марганца (II) в окислительно-восстановительных реакциях, протекающих в растворах, являются восстановителями:
3Mn(NO 3) 2 + 2KMnO 4 + 2H 2 O → 5MnO 2 + 4HNO 3 + 2KNO 3
Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
Mn 2+ + 6H 2 O → 2+
MnCl 2 + 6H 2 O → Cl 2
Соли марганца (II) образуют комплексы.
Mn(CN) 2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN) 2 = K 4 гексоцианоманганат калия
Аналогично:
4KF + MnF 2 = K 4
2KCl + MnCl 2 = K 2
Соединения марганца (III)
Mn 2 O 3 – амфотерный оксид
, с преобладанием основных свойств.
Mn 2 O 3 + 6HF = 2MnF 3 + 3H 2 O
Mn +3 2 O 3 + NaOH = 2NaMnO 2 + H 2 O (t)
Mn(OH) 3 – гидроксид Mn 3+
— амфотерное соединение, с преобладанием основных свойств:
Mn(OH) 3 ↔ HMnO 2
Соединения марганца (IV)
К основным соединениям четырехвалентного марганца относятся оксид марганца (IV) MnO 2
, а также марганцеватистая кислота H 2 MnO 3
– очень неустойчивая, легко разлагающаяся на оксид марганца (IV) и воду.
Самым прочным соединением марганца (IV) является нерастворимый в воде оксид темно-бурого цвета. Это амфотерное соединение, но соответствующие свойства выражены крайне слабо.
MnO 2 + 4HF = MnF 4 + 2H 2 O
MnO 2 + 2NaOH = Na 2 MnO 3 + H 2 O
MnO 2 может проявлять в ОВ-реакциях в зависимости от природы партнера как окислительные, так и восстановительные свойства (окислительно-восстановительная двойственность).
Гораздо чаще используют оксид марганца (IV) в качестве окислителя, проводя реакции в кислой среде:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O
В щелочной среде оксид марганца (IV) может быть и восстановителем, превращаясь в соединения марганца (VI), например, соли марганцовистой кислоты – манганаты:
3MnO 2 + KClO 3 + 6KOH = 3K 2 MnO 4 + KCl + 3H 2 O
Влияние рН на ОВ-реакции MnO 2
Соединения марганца (VI)
MnO 3 – оксид
, обладает кислотными свойствами.
H 2 MnO 4 – марганцовистая кислота
– существует только в растворе.
Соли этой кислоты – манганаты
.
Манганаты могут быть получены прокаливанием сухих перманганатов:
Манганаты устойчивы в сильнощелочной среде, в нейтральной среде протекает реакция диспропорционирования:
3Na 2 MnO 4 + 2H 2 O → 2NaMnO 4 + MnO 2 + 4NaOH
Соединения марганца (VII)
Высшей степени окисления марганца +7 соответствует кислотный оксид Mn 2 O 7 , марганцевая кислота HMnO 4 и ее соли – перманганаты
.
Соединения марганца (VII) – сильные окислители. Mn 2 O 7 – зеленовато-бурая маслянистая жидкость, при соприкосновении с которой спирты и эфиры воспламеняются. Оксиду Mn (VII) соответствует марганцевая кислота HMnO 4 . Она существует только в растворах, но считается одной из самых сильных (α – 100%). Максимально возможная концентрация HMnO 4 в растворе – 20%. Соли HMnO 4 – перманганаты – сильнейшие окислители; в водных растворах, как и сама кислота, имеют малиновую окраску.
В окислительно-восстановительных реакциях перманганаты являются сильными окислителями. В зависимости от реакции среды они восстанавливаются либо до солей двухвалентного марганца (в кислой среде), оксида марганца (IV) (в нейтральной) или соединений марганца (VI) – манганатов – (в щелочной). Очевидно, что в кислой среде окислительные способности Mn +7 выражены наиболее ярко.
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
2KMnO 4 + 3Na 2 SO 3 + H 2 O → 2MnO 2 + 3Na 2 SO 4 + 2KOH
2KMnO 4 + Na 2 SO 3 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
2KMnO 4 + 3H 2 SO 4 + 5C 2 H 5 OH → 2MnSO 4 + K 2 SO 4 + 5CH 3 COH + 8H 2 O
спирт альдегид
4KMnO 4 + 2NaOH + C 2 H 5 OH → MnO 2 ↓ + 3CH 3 COH + 2K 2 MnO 4 +
Na 2 MnO 4 + 4H 2 O
При нагревании перманганат калия разлагается (эта реакция применяется для получения кислорода в лабораторных условиях):
2KMnO 4 K 2 MnO 4 + MnO 2 + O 2
Таким образом, для марганца характеры те же зависимости: при переходе от низшей степени окисления к высшей нарастают кислотные свойства кислородных соединений, а в ОВ-реакциях восстановительные свойства сменяются окислительными.
Для организма перманганаты ядовиты вследствие сильных окислительных свойств.
При отравлениях перманганатами в качестве антидота используют пероксид водорода в уксуснокислой среде:
2KMnO 4 + 5H 2 O 2 + 6CH 3 COOH → 2(CH 3 COO) 2 Mn + 2CH 3 COOK + 5O 2 + 8H 2 O
Раствор KMnO 4 является прижигающим и бактерицидным средством для обработки поверхности кожи и слизистых оболочек. Сильные окислительные свойства KMnO 4 в кислой среде лежат в основе аналитического метода перманганатометрии, используемого в клиническом анализе для определения окисляемости воды, мочевой кислоты в моче.
Организм человека содержит около 12 мг Mn в составе различных соединений, причем 43% сосредоточено в костной ткани. Он оказывает влияние на кроветворение, формирование костной ткани, рост, размножение и некоторые другие функции организма.
Тема: D-элементы VIII группы
Ключевые слова:
d-элементы, железо, кобальт, никель, триады – d-элементов, семейство железа, феромагнитные соединения, комплексооразующая способность, пассивация на холоду кислотами, карбонилы железа, кристаллогидраты, желтая и красная кравяные соли, ферраты, соль Мора, железная кислота.
Особенность VIII В-группы состоит в том, что она объединяет 3 триады d-элементов больших периодов, не имеющих электронных аналогов в малых периодах.
Элементы первой триады – Fe, Co, Ni
– называют семейством железа. Элементы второй и третьей триад, то есть Ru
(рутений), Rh
(родий), Pd
(палладий), Os
(осмий), Ir
(иридий), Pt
(платина), именуются платиновыми металлами.
Атомы элементов семейства железа в отличие от атомов платиновых металлов не имеют свободного f-подуровня.
Этот факт обуславливает химические особенности элементов семейства железа.
Платиновые металлы, очень сходные по свойствам и трудноотделимые друг от друга, резко отличаются от металлов семейства железа и никогда не встречаются вместе с ними в литосфере.
У элементов VIII В-группы почти полностью достраивается d-подуровень предвнешнего уровня. Однако не все электроны d-подуровня участвуют в образовании химических связей. Только около 10 лет назад было получено соединение железа со степенью окисления +8, чаще же в сложных соединениях для железа характерны степени окисления +3 и +2; у Со +3, а у Ni +2. Для металлов VIII В-группы характерны высокие плотности и температуры плавления. Fe, Co, Ni – ферромагниты; все элементы VIII В-группы хорошие комплексообразователи.
Элементы семейства железа – металлы со средней химической активностью. В ряду стандартных электродных потенциалов расположены левее водорода. Платиновые металлы расположены в конце ряда стандартных электродных потенциалов и отличаются низкой химической активностью.
Платиновые металлы используются в приборостроении, как катализаторы в оргсинтезе и для получения коррозионно-устойчивых сплавов.
Элементы семейства железа расположены в четвертом периоде периодической системы химических элементов. Fe, Co – серебристо-белые металлы, Ni имеет желтовато-белый цвет.
Для железа и кобальта в сложных веществах наиболее характерны степени окисления +2 и +3, а для никеля +2. Подобно элементам подгруппы марганца, способны образовывать соединения со степенью окисления 0 (карбонилы):
ОПРЕДЕЛЕНИЕ
Марганец
— двадцать пятый элемент Периодической таблицы. Обозначение — Mn от латинского «manganum». Расположен в четвертом периоде, VIIB группе. Относится к металлам. Заряд ядра равен 25.
Марганец принадлежит к довольно распространенным элементам, составляя 0,1% (масс.) земной коры. Из соединений, содержащих марганец, наиболее часто встречается минерал пиролюзит, представляющий собой диоксид марганца MnO 2 . Большое значение имеют также минералы гаусманит Mn 3 O 4 и браунитMn 2 O 3 .
В виде простого вещества марганец представляет собой серебристо-белый (рис. 1) твердый хрупкий металл. Его плотность 7,44 г/см 3 , температура плавления 1245 o С.
Рис. 1. Марганец. Внешний вид.
Атомная и молекулярная масса марганца
Относительной молекулярная масса вещества
(M r) — это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента
(A r) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии марганец существует в виде одноатомных молекул Mn, значения его атомной и молекулярной масс совпадают. Они равны 54,9380.
Аллотропия и аллотропные модификации марганца
Известны четыре кристаллические модификации марганца, каждая из которых термодинамически устойчива в определенном интервале температур. Ниже 707 o С устойчив α-марганец, имеющий сложную структуру — в его элементарную ячейку входят 58 атомов. Сложность структуры марганца при температурах ниже 707 o С обусловливают его хрупкость.
Изотопы марганца
Известно, что в природе марганец может находиться в виде единственного стабильного изотопа 55 Mn. Массовое число равно 55, ядро атома содержит двадцать пять протонов и тридцать нейтронов.
Существуют искусственные изотопы марганца с массовыми числами от 44-х до 69-ти, а также семь изомерных состояний ядер. Наиболее долгоживущим изотопом среди вышеперечисленных является 53 Mn с периодом полураспада равным 3,74 млн. лет.
Ионы марганца
На внешнем энергетическом уровне атома марганца имеется семь электронов, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 .
В результате химического взаимодействия марганец отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Mn 0 -2e → Mn 2+ ;
Mn 0 -3e → Mn 3+ ;
Mn 0 -4e → Mn 4+ ;
Mn 0 -6e → Mn 6+ ;
Mn 0 -7e → Mn 7+ .
Молекула и атом марганца
В свободном состоянии марганец существует в виде одноатомных молекул Mn. Приведем некоторые свойства, характеризующие атом и молекулу марганца:
Сплавы марганца
Марганец применяется главным образом в производстве легированных сталей. Марганцовистая сталь, содержащая до 15% Mn, обладает высокими твердостью и прочностью. Из неё изготовляют рабочие части дробильных машин, шаровых мельниц, железнодорожные рельсы. Кроме того, марганец входит в состав сплавов на основе магния; он повышает их стойкость против коррозии. Сплав меди с марганцем и никелем — манганин обладает низким температурным коэффициентом электрического сопротивления. В небольших количествах марганец входит во многие сплавы алюминия.
Примеры решения задач
ПРИМЕР 1
| Задание | Марганец получают восстановлением кремнием оксида марганца (III). Технический оксид массой 20 г (массовая доля примесей равна 5,2%) восстановили до металла. Рассчитайте массу полученного марганца. |
| Решение | Запишем уравнение реакции восстановления оксида марганца (III) кремнием до марганца:
2Mn 2 O 3 + 3Si = 3SiO 2 + 4Mn. Рассчитаем массу оксида марганца (III) без примесей: ω pure (Mn 2 O 3) = 100% — ω impurity ; ω pure (Mn 2 O 3) = 100% — 5,2 = 94,8% = 0,984. m pure (Mn 2 O 3) = m impurity (Mn 2 O 3) × ω pure (Mn 2 O 3) / 100%; m pure (Mn 2 O 3) = 20 × 0,984 = 19,68 г. Определим количество вещества оксида марганца (III) (молярная масса — 158 г/моль): n (Mn 2 O 3) = m (Mn 2 O 3) / M (Mn 2 O 3); n (Mn 2 O 3) = 19,68 / 158 = 0,12 моль. Согласно уравнению реакции n(Mn 2 O 3) :n(Si) = 2:3, значит, n(Si) = 3/2×n(Mn 2 O 3) = 3/2×0,12 = 0,2 моль. Тогда масса кремния будет равна (молярная масса — 28 г/моль): m (Si) = n (Si) × M (Si); m (Si) = 0,2 × 28 = 5,6 г. |
| Ответ | Масса кремния 5,6 г |
ПРИМЕР 2
| Задание | Вычислите массу перманганата калия, который необходим для окисления сульфита калия массой 7,9 г в нейтральной среде. |
| Решение | Запишем уравнение реакции окисления сульфита калия перманганатом калия в нейтральной среде:
2KMnO 4 + 3K 2 SO 3 + H 2 O = 2MnO 2 + 3K 2 SO 4 + 2KOH. Рассчитаем число моль сульфита калия (молярная масса — 158 г/моль): n (K 2 SO 3) = m (K 2 SO 3) / M (K 2 SO 3); n (K 2 SO 3) = 7,9 / 158 = 0,05 моль. Согласно уравнению реакции n(K 2 SO 3) :n(KMnO 4) = 3:2, значит, n(KMnO 4) = 2/3 × n(K 2 SO 3) = 2/3 × 0,05 = 0,03 моль. Масса перманганата калия необходимого для окисления сульфита калия в нейтральной среде равна (молярная масса — 158г/моль): m (KMnO 4) = n (KMnO 4) × M (KMnO 4); m (KMnO 4) = 0,03 × 158 = 4,74 г. |
| Ответ | Масса перманганата калия равна 4,74 г |
Выполнил
:
студент первого курса
инженерного факультета
15 б группы
Кошманов В.В.
Проверил: Харченко Н.Т.
Великие Луки 1998г.
Историческая справка. 3
Распространение в природе. 3
Физические и химические свойства. 3
Соединения двухвалентного марганца. 4
Соединения четырёхвалентного марганца. 4
Соединения шестивалентного марганца. 5
Соединения семивалентного марганца. 5
Получение. 6
Применение марганца и его соединений. 6
Литература. 7
Историческая справка.
Минералы Марганца известны издавна. Древнеримский натуралист Плиний упоминает о чёрном камне, который использовали для обесцвечивания жидкой стеклянной массы; речь шла о минерале пиролюзите
MnO 2
. В Грузии пиролюзит с древнейших времён служил присадочным материалом при получении железа. Долгое время пиролюзит называли чёрной магнезией и считали разновидностью магнитного железняка. В 1774 году К.Шелле доказал, что это соединение неизвестного металла, а другой шведский учёный Ю.Гаи, сильно нагревая смесь пиролюзита с углём, получил Марганец загрязнённый углеродом. Название Марганец традиционно происходит от немецкого
Marganerz-
марганцевая руда.
Распространение в природе.
Среднее Содержание Марганца в земной коре 0.1%, в большинстве изверженных пород 0.06-0.2% по массе, где он находится в рассеянном состоянии в форме
Mn2+
(аналог
Fe 2+).
На земной поверхности
Mn 2+
легко окисляется, здесь известны также минералы
Mn 3+
и
Mn 4+
.
В биосфере Марганец энергично мигрирует в восстановительных условиях и малоподвижен в окислительных условиях. Наиболее подвижен Марганец в кислых водах тундры и лесных ландшафтах, где он находится в форме
Mn 2+
. Содержание Марганца здесь часто повышенно и культурные растения местами страдают от избытка Марганца; в почвах, озёрах, болотах образуются железно марганцовые конкуренции, озёрные и болотные руды. В сухих степях и пустынях в условиях щелочной окислительной среды Марганец малоподвижен. Организмы бедны Марганцем, культурные растения часто нуждаются в марганцовых микро удобрениях. Речные воды бедны Марганцем (10 -6
-10 -5
г/л.), однако суммарный вынос этого элемента огромен, причём основная его масса осаждается в прибрежной зоне.
Физические и химические свойства.
В чистом виде марганец получают либо электролизом раствора сульфата марганца (
II)
, либо восстановлением из оксидов кремнием в электрических печках. Элементарный Марганец представляет собой серебристо-белый твердый, но хрупкий металл. Его хрупкость объясняется тем, что при нормальных температурах в элементарную ячейку
Mn
входит 58 атомов в сложной ажурной структуре, не относящейся к числу плотноупакованных. Плотность Марганца 7.44 г/см 3
, температура плавления 1244 о
С, температура кипения 2150 о
С. В реакциях проявляет валентность от 2 до 7, наиболее устойчивые степени окисления +2,+4,+7.
Соединения двухвалентного марганца.
Соли двухвалентного марганца можно получить при растворении в разбавленных кислотах:
Mn+2HCl MnCl 2
+H2
При растворении в воде образуется гидроксид
Mn(II):
Mn+2HOH Mn(OH) 2
+H 2
Гидроксид марганца можно получить в виде белого осадка при действии на растворы солей двухвалентного марганца щелочью:
MnSO 4
+2NaOH
Mn(OH) 2
+NaSO 4
Соединения Mn(II)
на воздухе неустойчивы, и
Mn(OH) 2
на воздухе быстро буреет, превращаясь в оксид-гидроксид четырёхвалентного марганца.
2
Mn(OH) 2
+O 2
MnO(OH) 2
Гидроксид марганца проявляет только основные свойства и не реагирует со щелочами, а при взаимодействии с кислотами даёт соответствующие соли.
Mn(OH) 2
+2HCl MnCl 2
+
2H 2
O
Оксид марганца может быть получен при разложении карбоната марганца:
MnCO 3
MnO+CO 2
Либо при восстановлении диоксида марганца водородом:
MnO 2
+H 2
MnO+H 2
O
Соединения четырёхвалентного марганца.
Из соединений четырёхвалентного марганца наиболее известен диоксид марганца
MnO 2
—
пиролюзит. Поскольку валентность
IV
является промежуточной, соединения
Mn
(VI)
образуются как при окислении двухвалентного марганца.
Mn(NO 3) 2
MnO 2
+2NO
2
Так и при восстановлении соединений марганца в щелочной среде:
3K 2
MnO 4
+2H 2
O 2KMnO 4
+MnO 2
+4KOH
Последняя реакция является примером реакции самоокисления — самовосстановления, для которых характерно то, что часть атомов одного и того же элемента окисляется, восстанавливая одновременно оставшиеся атомы того же элемента:
Mn 6+
+2e=Mn 4+
1
Mn 6+
—e=Mn 7+
2
В свою очередь
Mn
О
2
может окислять галогениды и галоген водороды, например
HCl
:
MnO 2
+4HCl MnCl 2
+Cl 2
+2H 2
O
Диоксид марганца — твёрдое порошкообразное вещество. Он проявляет как основные, так и кислотные свойства.
Соединения шестивалентного марганца.
При сплавлении
MnO
2
со щелочами в присутствии кислорода, воздуха или окислителей получают соли шестивалентного
Марганца
, называемые манганатами.
MnO
2
+2KOH+KNO
3
K
2
MnO
2
+KNO
2
+H
2
O
Соединений марганца шестивалентного известно немного, и из них наибольшее значение соли марганцевой кислоты — манганаты.
Сама марганцевая кислота, как и соответствующей ей триоксид марганца
MnO
3
, в свободном виде не существует вследствии неустойчивости к процессам окисления — восстановления. Замена протона в кислоте на катион металла приводит к устойчивости манганатов, но их способность к процессам окисления — восствновления сохраняется. Растворы манганатов окрашены в зелёный цвет. При их подкислении образуется марганцеватая кислота,разлагается до соединений
марганца четырёхвалентного и семивалентного.
Сильные окислители переводят марганец шестивалентный в семивалентный.
2K 2
MnO
4
+Cl2
2
2KMnO
4
+2KCl
Соединения семивалентного марганца.
В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия
KMnO
2
, в быту называемый марганцовкой. Перманганат калия представляет собой кристаллы чёрно-фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона
MnO 4
—
.
Перманганаты являются солями марганцевой кислоты, которая устойчива только в разбавленных растворах (до 20%). Эти растворы могут быть получены действием сильных окислителей на соединения марганца двухвалентного:
2Mn(NO
3
)
2
+PbO
2
+6HNO
3
2HMnO
4
+5Pb(NO
3
)
2
+
2H
2
O
Соли марганца (II)
Химические свойства
Получение
Гидроксид марганца (II)
Химические свойства
Оксид марганца (II) принадлежит к основным оксидам, обладает всеми их свойствами. Ему соответствует нестойкий гидроксид Mn(OH) 2 .
Гидроксид марганца (II) — Mn(OH) 2 – нерастворимое в воде вещество светло-розового цвета.
Основной способ получения – щелочная обработка солей марганца (II):
MnSO 4 + 2NaOH → Mn(OH) 2 ↓ + Na 2 SO 4
На воздухе окисляется до гидроксида марганца (IV):
2Mn(OH) 2 ↓ + O 2 + 2H 2 O → 2Mn(OH) 4 ↓
Проявляет все свойства нерастворимых в воде оснований.
Все соли марганца (II) в окислительно-восстановительных реакциях, протекающих в растворах, являются восстановителями:
3Mn(NO 3) 2 + 2KMnO 4 + 2H 2 O → 5MnO 2 + 4HNO 3 + 2KNO 3
Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
Mn 2+ + 6H 2 O → 2+
MnCl 2 + 6H 2 O → Cl 2
Соли марганца (II) образуют комплексы.
Mn(CN) 2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN) 2 = K 4 гексоцианоманганат калия
Аналогично:
4KF + MnF 2 = K 4
2KCl + MnCl 2 = K 2
Соединения марганца (III)
Mn 2 O 3 – амфотерный оксид
, с преобладанием основных свойств.
Mn 2 O 3 + 6HF = 2MnF 3 + 3H 2 O
Mn +3 2 O 3 + NaOH = 2NaMnO 2 + H 2 O (t)
Mn(OH) 3 – гидроксид Mn 3+
— амфотерное соединение, с преобладанием основных свойств:
Mn(OH) 3 ↔ HMnO 2
Соединения марганца (IV)
К основным соединениям четырехвалентного марганца относятся оксид марганца (IV) MnO 2
, а также марганцеватистая кислота H 2 MnO 3
– очень неустойчивая, легко разлагающаяся на оксид марганца (IV) и воду.
Самым прочным соединением марганца (IV) является нерастворимый в воде оксид темно-бурого цвета. Это амфотерное соединение, но соответствующие свойства выражены крайне слабо.
MnO 2 + 4HF = MnF 4 + 2H 2 O
MnO 2 + 2NaOH = Na 2 MnO 3 + H 2 O
MnO 2 может проявлять в ОВ-реакциях в зависимости от природы партнера как окислительные, так и восстановительные свойства (окислительно-восстановительная двойственность).
Гораздо чаще используют оксид марганца (IV) в качестве окислителя, проводя реакции в кислой среде:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O
В щелочной среде оксид марганца (IV) может быть и восстановителем, превращаясь в соединения марганца (VI), например, соли марганцовистой кислоты – манганаты:
3MnO 2 + KClO 3 + 6KOH = 3K 2 MnO 4 + KCl + 3H 2 O
Влияние рН на ОВ-реакции MnO 2
Соединения марганца (VI)
MnO 3 – оксид
, обладает кислотными свойствами.
H 2 MnO 4 – марганцовистая кислота
– существует только в растворе.
Соли этой кислоты – манганаты
.
Манганаты могут быть получены прокаливанием сухих перманганатов:
Манганаты устойчивы в сильнощелочной среде, в нейтральной среде протекает реакция диспропорционирования:
3Na 2 MnO 4 + 2H 2 O → 2NaMnO 4 + MnO 2 + 4NaOH
Соединения марганца (VII)
Высшей степени окисления марганца +7 соответствует кислотный оксид Mn 2 O 7 , марганцевая кислота HMnO 4 и ее соли – перманганаты
.
Соединения марганца (VII) – сильные окислители. Mn 2 O 7 – зеленовато-бурая маслянистая жидкость, при соприкосновении с которой спирты и эфиры воспламеняются. Оксиду Mn (VII) соответствует марганцевая кислота HMnO 4 . Она существует только в растворах, но считается одной из самых сильных (α – 100%). Максимально возможная концентрация HMnO 4 в растворе – 20%. Соли HMnO 4 – перманганаты – сильнейшие окислители; в водных растворах, как и сама кислота, имеют малиновую окраску.
В окислительно-восстановительных реакциях перманганаты являются сильными окислителями. В зависимости от реакции среды они восстанавливаются либо до солей двухвалентного марганца (в кислой среде), оксида марганца (IV) (в нейтральной) или соединений марганца (VI) – манганатов – (в щелочной). Очевидно, что в кислой среде окислительные способности Mn +7 выражены наиболее ярко.
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 → 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
2KMnO 4 + 3Na 2 SO 3 + H 2 O → 2MnO 2 + 3Na 2 SO 4 + 2KOH
2KMnO 4 + Na 2 SO 3 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
2KMnO 4 + 3H 2 SO 4 + 5C 2 H 5 OH → 2MnSO 4 + K 2 SO 4 + 5CH 3 COH + 8H 2 O
спирт альдегид
4KMnO 4 + 2NaOH + C 2 H 5 OH → MnO 2 ↓ + 3CH 3 COH + 2K 2 MnO 4 +
Na 2 MnO 4 + 4H 2 O
При нагревании перманганат калия разлагается (эта реакция применяется для получения кислорода в лабораторных условиях):
2KMnO 4 K 2 MnO 4 + MnO 2 + O 2
Таким образом, для марганца характеры те же зависимости: при переходе от низшей степени окисления к высшей нарастают кислотные свойства кислородных соединений, а в ОВ-реакциях восстановительные свойства сменяются окислительными.
Для организма перманганаты ядовиты вследствие сильных окислительных свойств.
При отравлениях перманганатами в качестве антидота используют пероксид водорода в уксуснокислой среде:
2KMnO 4 + 5H 2 O 2 + 6CH 3 COOH → 2(CH 3 COO) 2 Mn + 2CH 3 COOK + 5O 2 + 8H 2 O
Раствор KMnO 4 является прижигающим и бактерицидным средством для обработки поверхности кожи и слизистых оболочек. Сильные окислительные свойства KMnO 4 в кислой среде лежат в основе аналитического метода перманганатометрии, используемого в клиническом анализе для определения окисляемости воды, мочевой кислоты в моче.
Организм человека содержит около 12 мг Mn в составе различных соединений, причем 43% сосредоточено в костной ткани. Он оказывает влияние на кроветворение, формирование костной ткани, рост, размножение и некоторые другие функции организма.
Тема: D-элементы VIII группы
Ключевые слова:
d-элементы, железо, кобальт, никель, триады – d-элементов, семейство железа, феромагнитные соединения, комплексооразующая способность, пассивация на холоду кислотами, карбонилы железа, кристаллогидраты, желтая и красная кравяные соли, ферраты, соль Мора, железная кислота.
Особенность VIII В-группы состоит в том, что она объединяет 3 триады d-элементов больших периодов, не имеющих электронных аналогов в малых периодах.
Элементы первой триады – Fe, Co, Ni
– называют семейством железа. Элементы второй и третьей триад, то есть Ru
(рутений), Rh
(родий), Pd
(палладий), Os
(осмий), Ir
(иридий), Pt
(платина), именуются платиновыми металлами.
Атомы элементов семейства железа в отличие от атомов платиновых металлов не имеют свободного f-подуровня.
Этот факт обуславливает химические особенности элементов семейства железа.
Платиновые металлы, очень сходные по свойствам и трудноотделимые друг от друга, резко отличаются от металлов семейства железа и никогда не встречаются вместе с ними в литосфере.
У элементов VIII В-группы почти полностью достраивается d-подуровень предвнешнего уровня. Однако не все электроны d-подуровня участвуют в образовании химических связей. Только около 10 лет назад было получено соединение железа со степенью окисления +8, чаще же в сложных соединениях для железа характерны степени окисления +3 и +2; у Со +3, а у Ni +2. Для металлов VIII В-группы характерны высокие плотности и температуры плавления. Fe, Co, Ni – ферромагниты; все элементы VIII В-группы хорошие комплексообразователи.
Элементы семейства железа – металлы со средней химической активностью. В ряду стандартных электродных потенциалов расположены левее водорода. Платиновые металлы расположены в конце ряда стандартных электродных потенциалов и отличаются низкой химической активностью.
Платиновые металлы используются в приборостроении, как катализаторы в оргсинтезе и для получения коррозионно-устойчивых сплавов.
Элементы семейства железа расположены в четвертом периоде периодической системы химических элементов. Fe, Co – серебристо-белые металлы, Ni имеет желтовато-белый цвет.
Для железа и кобальта в сложных веществах наиболее характерны степени окисления +2 и +3, а для никеля +2. Подобно элементам подгруппы марганца, способны образовывать соединения со степенью окисления 0 (карбонилы):
Марганец — элемент побочной подгруппы седьмой группы
четвёртого периода периодической
системы химических элементов Д. И. Менделеева, с атомным номером 25. Обозначается символом
Mn (лат. Manganum).
История открытия марганца
Известный естествоиспытатель и писатель древнего Рима Плиний
Старший указывал на чудесную способность черного порошка осветлять стекло.
Давно это вещество, дающее при размалывании черный порошок, называется
пиролюзитом, или двуокисью марганца. О способности пиролюзита очищать стекло
писал в 1540 г. и Ваноччио Бирингуччио. Пиролюзит является важнейшей рудой для
получения марганца — металла, употребляемого главным образом в металлургии.
От слова «магнезия» получили свои названия
марганец и магний.
Происхождение наименования двух химических элементов от одного и того же слова
объясняется тем, что пиролюзит долгое время противопоставлялся белой магнезии и
назывался черной магнезией. После получения металла в чистом виде марганец был
переименован. В основу названия было положено греческое слово
«манганезе», что значило очищать (намек на его применение в древности
в качестве «очистителя» стекла). Некоторые исследователи считают, что
название элемента произошло от латинского слова «магнес» — магнит,
так как пиролюзит, из которого добывают марганец, считался в древности
разновидностью того вещества, которое теперь называется магнитным железняком.
Марганец был открыт в 1774 г. шведским химиком Карлом
Вильгельмом Шееле. Правда, ни марганец, ни молибден, ни вольфрам Шееле не
выделил в чистом виде; он только указал, что в исследованных им минералах
содержатся эти новые элементы. Элемент №25 был обнаружен в минерале пиролюзите
МnО 2 · Н 2 О, известном еще Плинию Старшему.
Плиний считал его разновидностью магнитного железняка, хотя пиролюзит не
притягивается магнитом. Этому противоречию Плиний дал объяснение.
В рукописях знаменитого алхимика Альберта Великого (XIII в.) этот
минерал называется «магнезия». В XVI в. встречается уже название
«манганезе», которое, возможно, дано стеклоделами и происходит от слова
«манганидзейн» – чистить.
Когда Шееле в 1774 г. занимался исследованием пиролюзита, он посылал
своему другу Юхану Готлибу Гану образцы этого минерала. Ган, впоследствии
профессор, выдающийся химик своего времени, скатывал из пиролюзита шарики,
добавляя к руде масло, и сильно нагревал пх в тигле, выложенном древесным
углем. Получались металлические шарики, весившие втрое меньше, чем шарики из
руды. Это и был марганец. Новый металл называли сначала «магнезия», но так как
в то время уже была известна белая магнезия – окись магния, металл
переименовали в «магнезиум»; это название и было принято Французской комиссией
по номенклатуре в 1787 г. Но в 1808 г. Хэмфри Дэви открыл магнии и
тоже назвал его «магнезиум»; тогда во избежание путаницы марганец стали
называть «манганум. »
В России марганцем долгое время называли пиролюзит, пока в 1807 г.
А.И. Шерер не предложил именовать марганцем металл, полученный из пиролюзита,
а сам минерал в те годы называли черным марганцем.
Распространённость в природе марганца
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной
коры). В биосфере Марганец энергично мигрирует в восстановительных условиях и
малоподвижен в окислительной среде. Наиболее подвижен Марганец в кислых водах
тундры и лесных ландшафтов, где он находится в форме Мn 2+ .
Содержание Марганца здесь часто повышено и культурные растения местами страдают
от избытка Марганца. Весовое количество марганца увеличивается от кислых (600
г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах,
однако встречаются и самостоятельные месторождения марганца. В чиатурском
месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец,
рассеянный в горных породах вымывается водой и уносится в Мировой океан. При
этом его содержание в морской воде незначительно (10 −7 -10 −6 %),
а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие
окисления растворённым в воде кислородом с образованием нерастворимого в воде
оксида марганца, который в гидратированной форме (MnO 2 ·x
H 2 O)
и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может
достигать 45 % (также в них имеются примеси меди,
никеля, кобальта). Такие конкреции могут стать в будущем источником
марганца для промышленности.
Этот металл распространен примерно так же, как сера или фосфор. Богатые
залежи марганцевых руд находятся в Индии, Бразилии, Западной и Южной
Африке.
В России является остродефицитным сырьём, известны месторождения:
«Усинское»
в Кемеровской области, «Полуночное» в Свердловской,
«Порожинское»
в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области,
«Рогачёво-Тайнинская»
площадь и «Северо-Тайнинское» поле на Новой Земле.
Получение марганца
Первый металлический марганец был получен при восстановлении пиролюзита
древесным углем: МnО 2 + C → Mn + 2CO.
Но это не был элементарный марганец. Подобно своим соседям по таблице
Менделеева – хрому и железу, марганец реагирует с углеродом и всегда содержит
примесь карбида. Значит, с помощью углерода чистый марганец не получить. Сейчас
для получения металлического марганца применяют три способа: силикотермический
(восстановление кремнием), алюминотермический (восстановление алюминием) и
электролитический.
Наиболее широкое распространение нашел алюминотермический способ,
разработанный в конце XIX в. В этом случае в качестве марганцевого сырья
лучше применять не пиролюзит, а закись-окись марганца Mn 3 O 4 .
Пиролюзит реагирует с алюминием с выделением такого большого количества тепла,
что реакция легко может стать неуправляемой. Поэтому, прежде чем
восстанавливать пиролюзит, его обжигают, а уже полученную закись-окись
смешивают с алюминиевым порошком и поджигают в специальном контейнере.
Начинается реакция 3Мn 3 O 4 + 8Аl → 9Мn + 4Аl 2 О 3
– достаточно быстрая и не требующая дополнительных затрат энергии. Полученный
расплав охлаждают, скалывают хрупкий шлак, а слиток марганца дробят и
отправляют на дальнейшую переработку.
Однако алюминотермический способ, как и силикотермический, не дает марганца
высокой чистоты. Очистить алюминотермический марганец можно возгонкой, но этот
способ малопроизводителен и дорог. Поэтому металлурги давно искали новые
способы получения чистого металлического марганца и, естественно, прежде всего
надеялись на электролитическое рафинирование. Но в отличие от меди, никеля и
других металлов, марганец, откладывавшийся на электродах, не был чистым: его
загрязняли примеси окислов. Более того, получался пористый, непрочный,
неудобный для переработки металл.
Многие известные ученые пытались подобрать оптимальный режим электролиза
марганцевых соединении, но безуспешно. Эту задачу разрешил и 1919 г.
советский ученый Р.И. Агладзе (ныне действительный член Академии наук
Грузинской ССР). По разработанной им технологии электролиза из хлористых и
сернокислых солей получается достаточно плотный металл, содержащий до 99,98%
элемента №25. Этот метод лег в основу промышленного получения металлического
марганца.
Внешне этот металл похож на железо, только тверже его. На воздухе
окисляется, но, как и у алюминия, пленка окисла быстро покрывает всю
поверхность металла и препятствует дальнейшему окислению. С кислотами марганец
реагирует быстро, с азотом образует нитриды, с углеродом – карбиды. В общем,
типичный металл.
Физические свойства марганца
Плотность Марганца 7,2-7,4 г/см 3 ; t пл 1245 °С; t кип
2150 °С. Марганец имеет 4 полиморфные модификации: α-Мn (кубическая
объемноцентрированная решетка с 58 атомами в элементарной ячейке), β-Мn
(кубическая объемноцентрированная с 20 атомами в ячейке), γ-Мn
(тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая
объемноцентрированная). Температура превращений: α=β 705 °С;
β=γ 1090 °С и γ=δ 1133 °С; α-модификация хрупка;
γ (и отчасти β) пластична, что имеет важное значение при создании
сплавов.
Атомный радиус Марганца 1,30 Å. ионные радиусы (в Å): Mn 2+
0,91, Mn 4+ 0,52; Mn 7+ 0,46. Прочие физические свойства
α-Mn: удельная теплоемкость (при 25°С) 0,478 кДж/(кг·К) [т. е. 0.114
ккал/(г·°С)]; температурный коэффициент линейного расширения (при 20°С) 22,3·10 -6
град -1 ; теплопроводность (при 25 °С) 66,57 Вт/(м·К) [т. е. 0,159
кал/(см·сек·°С)]; удельное объемное электрическое сопротивление 1,5-2,6 мком·м
(т. е. 150-260 мком·см): температурный коэффициент электрического сопротивления
(2-3)·10 -4 град -1 . Марганец парамагнитен.
Химические свойства марганца
Марганец достаточно активен, при нагревании энергично взаимодействует с
неметаллами — кислородом (образуется смесь оксидов Марганца разной
валентности), азотом, серой, углеродом, фосфором и другими. При комнатной
температуре Марганец на воздухе не изменяется: очень медленно реагирует с
водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя
соли двухвалентного Марганца. При нагревании в вакууме Марганец легко
испаряется даже из сплавов.
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в
кислороде (Mn + O 2 → MnO 2). Марганец при нагревании
разлагает воду, вытесняя водород (Mn + 2H 2 O →(t) Mn(OH) 2 +
H 2 ), образующийся гидроксид марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в
марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом,
образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем образуя карбиды Mn 3 C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
Mn + 2H + → Mn 2+ + H 2
С концентрированной серной кислотой реакция идёт по уравнению:
Mn + 2H 2 SO 4 (конц.) → MnSO 4 + SO 2 + 2H 2 O
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn 2 O 3 , MnO 2 ,
MnO 3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn 2 O 7 .
Mn 2 O 7 в обычных условиях жидкое маслянистое вещество
тёмно-зелёного, очень неустойчивое; в смеси с концентрированной серной кислотой
воспламеняет органические вещества. При 90 °C Mn 2 O 7
разлагается со взрывом. Наиболее устойчивы оксиды Mn 2 O 3 и
MnO 2 , а также комбинированный оксид Mn 3 O 4
(2MnO·MnO 2 , или соль Mn 2 MnO 4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2MnO 2 + 4KOH + O 2 → 2K 2 MnO 4 + 2H 2 O
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает
реакция:
3K 2 MnO 4 + 3H 2 SO 4 → 3K 2 SO 4 + 2HMnO 4 + MnO(OH) 2 ↓ +
H 2 O
Раствор окрашивается в малиновый цвет из-за появления аниона MnO 4 −
и из него выпадает коричневый осадок гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно
сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет
различные вещества, восстанавливаясь до соединений марганца разной степени
окисления. В кислой среде — до соединений марганца (II), в нейтральной — до
соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из
лабораторных способов получения чистого кислорода). Реакция идёт по уравнению
(на примере перманганата калия):
2KMnO 4 →(t) K 2 MnO 4
+ MnO 2 + O 2
Под действием сильных окислителей ион Mn 2+ переходит в ион MnO 4 − :
2MnSO 4 + 5PbO 2 + 6HNO 3
→ 2HMnO 4 + 2PbSO 4 + 3Pb(NO 3) 2
+ 2H 2 O
Эта реакция используется для качественного определения Mn 2+
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида
марганца (II), быстро буреющий на воздухе в результате окислления.
Применение марганца в промышленности
Марганец содержится во всех видах стали и чугуна. Способность марганца
давать сплавы с большинством известных металлов используется для получения не
только различных сортов марганцевой стали, но и большого числа нежелезных
сплавов (манганинов). Из них особенно замечательными являются сплавы марганца с
медью
(марганцевая бронза). Она, подобно стали, может закаляться и в то же время
намагничиваться, хотя ни марганец, ни медь не обнаруживают заметных магнитных
свойств.
Биологическая роль марганца и его содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его
содержание обычно очень мало, порядка тысячных долей процента, он оказывает
значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост,
образование крови
и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества
содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до
нескольких процентов марганца.
Марганец
активно влияет на обмен белков, углеводов
и жиров. Важной также считается способность марганца усиливать действие
инсулина и поддерживать определенный уровень холестерина в крови. В присутствии
марганца организм полнее использует жиры. Сравнительно богаты этим
микроэлементом крупы (в первую очередь овсяная и гречневая), фасоль, горох,
говяжья печень и многие хлебобулочные изделия, которыми практически
восполняется суточная потребность человека в марганце — 5,0-10,0 мг.
Не стоит забывать, что соединения марганца
могут оказывать токсичное действие на организм человека. Предельно допустимая
концентрация марганца в воздухе 0.3
мг/м 3 . При выраженном отравлении наблюдается поражение нервной
системы с характерным синдромом марганцевого паркинсонизма.
Объёмы производства марганцевой руды в России
Марганецкий ГОК – 29%
Месторождение марганцевых руд было открыто в 1883 году. В
1985 г. на базе этого месторождения начал добычу руды Покровский рудник. По
мере развития рудника и возникновения новых карьеров и шахт сформировался
Марганецкий ГОК.
В составе производственной структуры комбината: два карьера для открытой добычи
марганцевой руды, пять шахт для подземной добычи, три обогатительных фабрики, а
также необходимые вспомогательные цеха и службы, в т.ч. ремонтно-механический,
транспортный и пр.
Орджоникидзевский ГОК – 71%
Основным видом выпускаемой продукции является марганцевый
концентрат различных сортов с содержанием чистого марганца от 26% до 43% (в
зависимости от сортности). Попутные продукты — керамзитовая глина и шламы.
Добычу марганцевой руды предприятие ведется на закрепленных
за ним рудных полях. Запасов руд хватит на срок более 30 лет. Запасы
марганцевой руды в Украине суммарно по Орджоникидзевскому и Марганцевому
горно-обогатительным комбинатам составляет треть всех мировых запасов.
Mn Марганец
МАРГАНЕЦ
(лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55 Mn. Конфигурация двух внешних электронных слоев атома марганца 3s 2 p 6 d 5 4s 2 . В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, к которой относятся также технеций и рений, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Радиус нейтрального атома марганца 0,130 нм, радиус иона Mn 2+ 0,080-0,104 нм, иона Mn 7+ 0,039-0,060 нм. Энергии последовательной ионизации атома марганца 7,435, 15,64, 33,7, 51,2, 72,4 эВ. По шкале Полинга электроотрицательность марганца 1,55; марганец принадлежит к числу переходных металлов.
Марганец в компактном виде твердый серебристо-белый металл.
Физические и химические свойства:
марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив a-Mn, параметр решетки а = 0,89125 нм, плотность 7,44 кг/дм 3 . В интервале температур 710-1090°C существует b-Mn, параметр решетки а = 0,6300 нм; при температурах 1090-1137°C g-Mn, параметр решетки а = 0,38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив d-Mn с параметром решетки а = 0,30750 нм. Модификации a, b, и d хрупкие, g-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn 3 O 4 и внутреннего слоя состава MnO.
Марганец образует несколько оксидов: MnO, Mn 3 O 4 , Mn 2 O 3 , MnO 2 и Mn 2 O 7 . Все они, кроме Mn 2 O 7 , представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества.
Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO 3 = MnO + CO 2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn 2 O 3 . Этот же оксид марганца образуется при нагревании MnO 2 на воздухе при температуре примерно 600°C:
4MnO 2 = 2Mn 2 O 3 + O 2
Оксид Mn 2 O 3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO 2 .
Если MnO 2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn 3 O 4:
3MnO 2 = Mn 3 O 4 + O 2
Этот оксид можно представить как MnO·Mn 2 О 3 , и по свойствам Mn 3 О 4 соответствует смеси этих оксидов.
Диоксид марганца MnO 2 наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая b-модификация MnO 2 это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, g-MnO 2 также встречается в природе. Это минерал рамсделит (другое название полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO 2 можно восстановить водородом до MnO.
Если к перманганату калия KMnO 4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn 2 O 7 , обладающий сильными окислительными свойствами:
2KMnO 4 + 2H 2 SO 4 = 2KHSO 4 + Mn 2 O 7 + H 2 O.
Mn 2 O 7 кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO 4 .
При взаимодействии марганца с галогенами образуются дигалогениды MnHal 2 . В случае фтора возможно также образование фторидов состава MnF 3 и MnF 4 , а в случае хлора также трихлорида MnCl 3 . Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS 2 . Известна целая группа нитридов марганца: MnN 6 , Mn 5 N 2 , Mn 4 N, MnN, Mn 6 N 5 , Mn 3 N 2 .
С фосфором марганец образует фосфиды составов MnР, MnP 3 , Mn 2 P, Mn 3 P, Mn 3 P 2 и Mn 4 P. Известно несколько карбидов и силицидов марганца.
С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH) 2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца (II):
Mn + 2HCl = MnCl 2 + H 2 .
Из растворов солей Mn 2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH) 2:
Mn(NO 3) 2 + 2NaOH = Mn(OH) 2 + 2NaNO 3
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H 2 MnO 4 и марганцовая кислота HMnO 4 , соли которых соответственно, манганаты (например, манганат натрия Na 2 MnO 4) и перманганаты (например, перманганат калия KMnO 4).
Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
2NaI + Na 2 MnO 4 + 2H 2 O = MnO 2 + I 2 + 4NaOH,
так и восстановителей
2K 2 MnO 4 + Cl 2 = 2KMnO 4 + 2KCl.
В водных растворах манганаты диспропорционируют на соединения марганца (+4) и марганца (+7):
3K 2 MnO 4 + 3Н 2 О = 2KMnO 4 + MnO 2 ·Н 2 О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном.
Перманганаты сильные окислители. Например, перманганат калия KMnO 4 в кислой среде окисляет сернистый газ SO 2 до сульфата:
2KMnO 4 + 5SO 2 +2H 2 O = K 2 SO 4 + 2MnSO 4 + 2H 2 SO 4 .
При давлении около 10 МПа безводный MnCl 2 в присутствии металлоорганических соединений реагирует с оксидом углерода (II) CO с образованием биядерного карбонила Mn 2 (CO) 10 .
История открытия:
один из основных материалов марганца пиролюзит был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале 19 в. для него было принято название «манганум» (от немецкого Manganerz марганцевая руда).
Нахождение в природе:
в земной коре содержание марганца составляет около 0,1 % по массе. В свободном виде марганец не встречается. Из руд наиболее распространены пиролюзит MnO 2 (содержит 63,2 % марганца), манганит MnO 2 ·Mn(OH) 2 (62,5 % марганца), браунит Mn 2 O 3 (69,5 % марганца), родохрозит MnCo 3 (47,8 % марганца), псиломелан mMnO·MnO 2 ·nH 2 O (45-60% марганца) и ряд других. Марганец содержат железо-марганцевые конкреции, которые в больших количествах (сотни миллиардов тонн) находятся на дне Тихого, Атлантического и Индийского океанов. В морской воде содержится около 1,0·10 8 % марганца. Промышленного значения эти запасы марганца пока не имеют из-за сложности подъема конкреций на поверхность.
Получение:
промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе при восстановлении руд железа и марганца коксом. В ферромарганце содержание углерода составляет 6-8 % по массе.
Чистый марганец получают электролизом водных растворов сульфата марганца MnSO 4 , который проводят в присутствии сульфата аммония (NH 4) 2 SO 4 .
Применение:
более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей кислорода, серы и других), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn 2 (CO) 10 .
Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами многих химических реакций, входят в состав микроудобрений.
Биологическая роль:
марганец микроэлемент , постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Содержание марганца в растениях составляет 10 4 -10 2 %, в животных 10 3 -10 5 %, некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, влияет на проветривание и минеральный обмен.
Ответ:
Правильное написание слова — марганец
Ударение и произношение — м`арганец
Значение слова -химический элемент, металл серебристо-белого цвета
Выберите, на какой слог падает ударение в слове — ОБЛЕГЧИТЬ?
Слово состоит из букв:
М,
А,
Р,
Г,
А,
Н,
Е,
Ц,
Похожие слова:
ферромарганец
Рифма к слову марганец
танец, иностранец, республиканец, ополченец, гасконец, пехотинец, наконец, преображенец, якобинец, конец, кузнец, вконец, хлебец, мудрец, кормилец, ярославец, малоярославец, полководец, выходец, итальянец, пялец, образец, австриец, проходимец, продавец, молодец, лжец, владелец, доходец, выжлец, погребец, палец, пемец, вдовец, купец, мерзавец, ревнивец, немец, дворец, мертвец, храбрец, самодержец, швейцарец, ординарец, народец, дровец, румянец, счастливец, чепец, красавец
Толкование слова. Правильное произношение слова. Значение слова.
МА́РГАНЕЦ (лат. Manganum), Mn, химический элемент с атомным номером 25, атомная масса 54,9380. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида (см. НУКЛИД) 55Mn. Конфигурация двух внешних электронных слоев атома марганца 3s2p6d54s2. В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, к которой относятся также технеций (см. ТЕХНЕЦИЙ) и рений (см. РЕНИЙ), и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 (валентность II) до +7 (валентность VII), наиболее устойчивы соединения, в которых марганец проявляет степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Радиус нейтрального атома марганца 0,130 нм, радиус иона Mn2+ — 0,080—0,104 нм, иона Mn7+ — 0,039—0,060 нм. Энергии последовательной ионизации атома марганца 7,435, 15,64, 33,7, 51,2, 72,4 эВ. По шкале Полинга электроотрицательность марганца 1,55; марганец принадлежит к числу переходных металлов. Марганец в компактном виде — твердый серебристо-белый металл.
История открытия
Один из основных материалов марганца — пиролюзит (см. ПИРОЛЮЗИТ)— был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом черной магнезии, к которому магнит «равнодушен». В 1774 г. шведский химик К. Шееле (см. ШЕЕЛЕ Карл Вильгельм) показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану (см. ГАН Юхан Готлиб) , который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале 19 в. для него было принято название «манганум» (от немецкого Manganerz — марганцевая руда).
Нахождение в природе
В земной коре содержание марганца составляет около 0,1 % по массе. В свободном виде марганец не встречается. Из руд наиболее распространены пиролюзит MnO2(содержит 63,2 % марганца), манганит (см. МАНГАНИТ) MnO2·Mn(OH)2 (62,5 % марганца), браунит (см. БРАУНИТ) Mn2O3 (69,5 % марганца), родохрозит (см. РОДОХРОЗИТ) MnCo3 (47,8 % марганца), псиломелан (см. ПСИЛОМЕЛАН) mMnO·MnO2·nH2O (45—60% марганца). Марганец содержат жՐېՐאޭмарганцевые конкреции, которые в больших количествах (сотни миллиардов тонн) находятся на дне Тихого, Атлантического и Индийского океанов. В морской воде содержится около 1,0·10–8 % марганца. Промышленного значения эти запасы марганца пока не имеют из-за сложности подъема конкреций на поверхность.
Получение
Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду марганца, то ее предварительно подвергают обжигу. В некоторых случаях руду далее подвергают сернокислотному выщелачиванию. Затем обычно марганец в полученном концентрате восстанавливают с помощью кокса (карботермическое восстановление). Иногда в качестве восстановителя используют алюминий или кремний. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе (см. ст. Железо (см. ЖЕЛЕЗО)) при восстановлении руд железа и марганца коксом (см. КОКС). В ферромарганце содержание углерода составляет 6—8 % по массе. Чистый марганец получают электролизом водных растворов сульфата марганца MnSO4, который проводят в присутствии сульфата аммония (NH4)2SO4.
Физические и химические свойства
Марганец твердый хрупкий металл. Известны четыре кубические модификации металлического марганца. При температурах от комнатной и до 710°C устойчив альфа-Mn, параметр решетки а = 0,89125 нм, плотность 7,44 кг/дм3. В интервале температур 710—1090°C существует бета-Mn, параметр решетки а = 0,6300 нм; при температурах 1090—1137°C — гамма-Mn, параметр решетки а = 0,38550 нм. Наконец, при температуре от 1137°C и до температуры плавления (1244°C) устойчив дельта-Mn с параметром решетки а = 0,30750 нм. Модификаци альфа, бета и дельта хрупкие, гамма-Mn пластичен. Температура кипения марганца около 2080°C.
На воздухе марганец окисляется, в результате чего его поверхность покрывается плотной оксидной пленкой, которая предохраняет металл от дальнейшего окисления. При прокаливании на воздухе выше 800°C марганец покрывается окалиной, состоящей из внешнего слоя Mn3O4 и внутреннего слоя состава MnO. Марганец образует несколько оксидов: MnO, Mn3O4, Mn2O3, MnO2 и Mn2O7. Все они, кроме Mn2O7, представляющего собой при комнатной температуре маслянистую зеленую жидкость с температурой плавления 5,9°C, твердые кристаллические вещества. Монооксид марганца MnO образуется при разложении солей двухвалентного марганца (карбоната и других) при температуре около 300°C в инертной атмосфере:
MnCO3 = MnO + CO2
Этот оксид обладает полупроводниковыми свойствами. При разложении MnOОН можно получить Mn2O3. Этот же оксид марганца образуется при нагревании MnO2 на воздухе при температуре примерно 600°C:
4MnO2 = 2Mn2O3 + O2
Оксид Mn2O3 восстанавливается водородом до MnO, а под действием разбавленных серной и азотной кислот переходит в диоксид марганца MnO2. Если MnO2 прокаливать при температуре около 950°C, то наблюдается отщепление кислорода и образование оксида марганца состава Mn3O4:
3MnO2 = Mn3O4 + O2
Этот оксид можно представить как MnO·Mn2О3, и по свойствам Mn3О4 соответствует смеси этих оксидов. Диоксид марганца MnO2 — наиболее распространенное природное соединение марганца в природе, существующее в нескольких полиморфных формах. Так называемая бета-модификация MnO2 — это уже упоминавшийся минерал пиролюзит. Ромбическая модификация диоксида марганца, гамма-MnO2 также встречается в природе. Это — минерал рамсделит (другое название — полианит).
Диоксид марганца нестехиометричен, в его решетке всегда наблюдается дефицит кислорода. Если оксиды марганца, отвечающие его более низким степеням окисления, чем +4, — основные, то диоксид марганца обладает амфотерными свойствами. При 170°C MnO2 можно восстановить водородом до MnO. Если к перманганату калия KMnO4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn2O7, обладающий сильными окислительными свойствами:
2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
Mn2O7 — кислотный оксид, ему отвечает сильная, не существующая в свободном состоянии марганцовая кислота НMnO4. При взаимодействии марганца с галогенами образуются дигалогениды MnHal2. В случае фтора возможно также образование фторидов состава MnF3 и MnF4, а в случае хлора — также трихлорида MnCl3. Реакции марганца с серой приводят к образованию сульфидов составов MnS (существует в трех полиморфных формах) и MnS2. Известна целая группа нитридов марганца: MnN6, Mn5N2, Mn4N, MnN, Mn6N5, Mn3N2.
С фосфором марганец образует фосфиды составов MnР, MnP3, Mn2P, Mn3P, Mn3P2 и Mn4P. Известно несколько карбидов и силицидов марганца. С холодной водой марганец реагирует очень медленно, но при нагревании скорость реакции значительно возрастает, образуется Mn(OH)2 и выделяется водород. При взаимодействии марганца с кислотами образуются соли марганца(II):
Mn + 2HCl = MnCl2 + H2.
Из растворов солей Mn2+ можно осадить плохо растворимое в воде основание средней силы Mn(OH)2:
Mn(NO3)2 + 2NaOH = Mn(OH)2 + 2NaNO3
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H2MnO4 и марганцовая кислота HMnO4, соли которых — соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4). Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще)
2NaI + Na2MnO4 + 2H2O = MnO2 + I2 + 4NaOH,
так и восстановителей
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
В водных растворах манганаты диспропорционируют на соединения марганца(+4) и марганца(+7):
3K2MnO4 + 3Н2О = 2KMnO4 + MnO2·Н2О + 4КОН.
При этом окраска раствора из зеленой переходит в синюю, затем в фиолетовую и малиновую. За способность изменять окраску своих растворов К. Шееле назвал манганат калия минеральным хамелеоном. Перманганаты — сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата:
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4. При давлении около 10 МПа безводный MnCl2 в присутствии металлоорганических соединений реагирует с оксидом углерода(II) CO с образованием биядерного карбонила Mn2(CO)10.
Применение
Более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления (см. РАСКИСЛЕНИЕ), десульфурации (см. ДЕСУЛЬФУРАЦИЯ) (при этом происходит удаление из стали нежелательных примесей — кислорода, серы), а также для легирования (см. ЛЕГИРОВАНИЕ) сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn2(CO)10. Соединения марганца (карбонат, оксиды и другие) используют при производстве ферритных материалов, они служат катализаторами (см. КАТАЛИЗАТОРЫ) многих химических реакций, входят в состав микроудобрений.
Биологическая роль
Марганец — микроэлемент (см. МИКРОЭЛЕМЕНТЫ), постоянно присутствующий в живых организмах и необходимый для их нормальной жизнедеятельности. Содержание марганца в растениях составляет 10-4–10-2 %, в животных 10-3–10-5%, некоторые растения (водяной орех, ряска, диатомовые водоросли) и животные (муравьи, устрицы, ряд ракообразных) способны концентрировать марганец. В организме среднего человека (масса тела 70 кг) содержится 12 мг марганца. Марганец необходим животным и растениям для нормального роста и размножения. Он активирует ряд ферментов, участвует в процессах дыхания, фотосинтеза (см. ФОТОСИНТЕЗ), влияет на проветривание и минеральные обмен.
Человек с пищей получает ежедневно 0,4—10 мг марганца. Недостаток марганца в организме может привести к заболеванию человека. Для обеспечения нормального развития растений в почву вносят марганцевые микроудобрения (обычно в форме разбавленного раствора перманганата калия). Однако избыток марганца для человеческого организма вреден. При отравлении соединениями марганца происходит поражение нервной системы, развивается так называемый марганцевый паркинсонизм. (см. ПАРКИНСОНИЗМ)ПДК в расчете на марганец для воздуха 0,03 мг/м3. Токсическая доза (для крыс) — 10—20 мг.
Энциклопедический словарь.
2009.
Синонимы слова «МАРГАНЕЦ»:
МЕТАЛЛ, ПИРОЛЮЗИТ, ЭЛЕМЕНТ
Смотреть что такое МАРГАНЕЦ в других словарях:
МАРГАНЕЦ
МАРГАНЕЦ, -нца, м. Химический элемент, металл серебристо-белого цвета.II прил. марганцевый, -ая, -ое и марганцовый, -ая, -ое. Марганцевая руда.
МАРГАНЕЦ
марганец м. 1) Химический элемент, серебристо-белый хрупкий металл, встречающийся в природе в виде соединений (оксидов, карбонатов и т.п.). 2) устар. То же, что: марганцовка.<br><br><br>… смотреть
МАРГАНЕЦ
марганец м. хим.manganese хлористый марганец — manganous chloride
МАРГАНЕЦ
марганец
пиролюзит
Словарь русских синонимов.
марганец
сущ., кол-во синонимов: 3
• металл (86)
• пиролюзит (3)
• элемент (159)
Словарь синонимов ASIS.В.Н. Тришин.2013.
.
Синонимы:
металл, пиролюзит, элемент… смотреть
МАРГАНЕЦ
МАРГАНЕЦ (лат. Manganura), Mn, хим.
элемент VII группы периодич. системы Менделеева; ат. н. 25, ат. м. 54,9380;
тяжёлый серебристо-белый металл. В пр… смотреть
МАРГАНЕЦ
МАРГАНЕЦ, город в Днепропетровской
области УССР. Расположен на берегу Каховского водохранилища. Ж.-д. ст.
на линии Кривой Рог — Запорожье. 48,9 тыс. … смотреть
МАРГАНЕЦ
(от нем. Manganerz — марганцевая руда; лат. Manganum) Mn, хим. элемент VII гр. периодич. системы, ат. н. 25, ат. м. 54,9380. В природе один устойчивый изотоп <sup>55</sup> Мn. Конфигурация внеш. электронной оболочки атома 3d<sup>5</sup>4s<sup>2</sup>, степени окисления от +2 до +7, наиб. устойчивы соед. Мn(II) и Mn(VII); энергии ионизации при последоват. переходе от Мn<sup>0</sup> к Мn<sup>2+</sup> соотв. равны 7,435 и 15,6401 эВ; элсктроотрицатсльность по Полингу 2,5; ионные радиусы (в скобках указаны координац. числа) Мn<sup>2+</sup> 0,080 нм (4), 0,089 нм (5), 0,104 (7), Мn<sup>7+</sup> 0,039 (4), 0,060 нм (6). Содержание М. в земной коре 0,1% по массе, в океанич. воде 2.10<sup>-</sup><sup>7</sup>%. В своб. виде в природе не встречается. Входит в состав множества минералов, преим. типа оксидов. наиб. распространены пиролюзит b-МnО <sub>2</sub>, псиломелан mМО.nМnО <sub>2</sub>.хН <sub>2</sub> О [М = Ва, Са, К, Мn(II)], манганит b-MnOOH, браунит 3Мn<sub>2</sub> О <sub>3</sub>.MnSiO<sub>3</sub>, родохрозит МnСО <sub>3</sub>. Главные месторождения марганцевых руд (50-75% мировых запасов, 1981) находятся в СССР. За рубежом крупнейшие месторождения известны в ЮАР (более 3 млрд. т, в пересчете на металл), Австралии (490 млн. т), Габоне (450 млн. т), Бразилии (100 млн. т), Индии (80 млн. т), Гане (10 млн. т). Общая мировая добыча марганцевых руд 20-25 млн. т/год. Большое кол-во М. содержат железо-марганцевые конкреции, расположенные в Тихом, Атлантическом и Индийском океанах; их ресурсы в Тихом океане оцениваются в 90-1650 млрд. т. <br> <b> Свойства.</b> Компактный М. — серебристо-белый металл. Известно 4 кубич. кристаллич. модификации М.: ниже 710°С устойчива a-форма (а = 0,89125 нм, <i>z =</i>58, пространств. группа I43m, плотн. 7,44 г/см <sup>3</sup>), при 710-1090°С — b-форма (<i> а =</i>0,6300 нм, z= 20, пространств. группа P4<sub>1</sub>3, плотн. 7,29 г/см <sup>3</sup>), при 1090-1137°С — g-форма (а = 0,38550 нм при 1100°С, z<i> =</i>4, пространств.группа Fm3m,<i></i> плотн. 6,37 г/см <sup>3</sup>), выше 1137°С — d-форма (<i> а =</i>0,30750 нм при 1143°С, z= 2, пространств. группа Im3m, плотн. 6,28 г/см <sup>3</sup>); DH<sup>0</sup> полиморфных переходов (в кДж/моль) a : b 2,2, b : d 2,1, d : g 1,9. При охлаждении до комнатной т-ры g-форма переходит в тетрагон. кристаллич. модификацию (<i> а =</i>0,3774 нм, с= 0,3525 нм, плотн. 7,21 г/см <sup>3</sup>). Т. пл. 1244°С, т. кип. ок. 2080 °С; <i> С°<sub> р</sub></i>[в Дж/(моль. К)] a-формы 26,3, b 26,5, g 27,6; DH<sup>0</sup><sub> пл</sub> 12,0 кДж/моль, DH<sup>0</sup><sub> исп</sub> 227 кДж/моль; ур-ния температурной зависимости давления пара lgр (Пa)= 10,8828 Ч 13625/Т (1043 [ Т [ 1158 К) и lgp<i></i> (Па) = 20,005 — 14850/T — 2,52 lgT(1517 [ T [ 2353 К); температурный коэф. линейного расширения (в К <sup>-1</sup>) в интервале 0-20<sup>o</sup> С для a-Мn 2,23 Х 10<sup>-</sup><sup>5</sup>, b 2,49 Х 10<sup>-</sup><sup>5</sup>, g 1,475 Х 10<sup>-</sup><sup>5</sup>; r (в мкОм. см) для a-Mn ~ 140, b 91, g 35-40; температурный коэф. r (в К <sup>-</sup><sup>1</sup>) для a-Мn (2-3).10<sup>-</sup><sup>4</sup>, b 1,36.10<sup>-</sup><sup>3</sup>, g (5,5-6,5).10<sup>-</sup><sup>3</sup>; теплопроводность 66,5 Вт/(см. К). Ниже Ч 173°С М. антифeрромагнитен, при более высоких т-рах парамагнитен; магн. восприимчивость +9,6.10<sup>-</sup><sup>6</sup>. Модификации a, b и d хрупкие, g-Mn пластичен, но после деформации медленно разрушается; твердость по шкале Роквелла a-Мn 70, g-Мn 20. М. легко окисляется на воздухе, образуя выше 800°С окалину, состоящую из внутр. слоя МnО и внеш. слоя Мn<sub>3</sub> О <sub>4</sub>. Ниже 800 °С образуется Мn<sub>2</sub> О <sub>3</sub>, а при т-рах ниже 450°С — МnО <sub>2</sub> (см. <i>Марганца оксиды</i>).<i></i> Поглощает Н <sub>2</sub> (до 60 см <sup>3</sup> на 100 г М.) с образованием твердых р-ров. М. взаимод. с галогенами, давая дигалогениды МnХ <sub>2</sub> (с фтором также MnF<sub>3</sub> и MnF<sub>4</sub>) — кристаллы; хорошо раств. в воде (кроме MnF<sub>2</sub>); образуют кристаллогидраты (см. также табл.). Для MnBr<sub>2</sub> т. пл. 698 °С, MnI<sub>2</sub> 638°С. Дихлорид MnCl<sub>2</sub> получают взаимод. MnО <sub>2</sub> с конц. соляной к-той или Mn, MnО либо MnСО <sub>3</sub> с газообразным НCl; применяют для получения пигментов, как катализатор в орг. синтезе, реагент для обнаружения S<sub>2</sub>O<sub>8</sub><sup>2</sup><sup>-</sup> , IO<sub>4</sub><sup>-</sup>, для обработки семян с целью ускорения роста растений, в физ.-хим. анализе как репер. <br> <img src=»https://words-storage.s3.eu-central-1.amazonaws.com/production/article_images/5a3aa3a52685b21ade9b292f/9bc5f225-2d4f-4c84-8120-a75ebf4b7944″ alt=»МАРГАНЕЦ фото» align=»absmiddle» class=»responsive-img img-responsive» title=»МАРГАНЕЦ фото»> <br> * Т. кип. ок. 1640°С; DH<sup>0</sup><sub> пл</sub> 14 кДж/моль, DH<sup>0</sup><sub> исп</sub> 256 кДж/моль. * Т. кип. 1240°С; DH<sup>0</sup><sub> пл</sub> 37,6 кДж/моль, DH<sup>0</sup><sub> исп</sub> 148 кДж/моль. <p> Трихлорид MnCl<sub>3</sub> образуется при взаимод. MnО <sub>2 </sub> с р-ром НCl в этаноле при — 63 °С; при нагр. до 40 °С разлагается с выделением Cl<sub>2</sub>. Быстрым охлаждением паров, образующихся при взаимод. MnF<sub>3</sub> с F<sub>2</sub> при т-рах выше 550°С, получают тетрафторид MnF<sub>4 </sub>- голубые кристаллы; при нагр. до 70 °С разлагается с выделением F<sub>2</sub>; DH<sup>0</sup><sub> обр</sub> -1109 кДж/молъ. При нагр. М. взаимод. с S, N<sub>2</sub>, P, С, Si и др. неметаллами. Известны нитриды: MnN<sub>6</sub>, Mn<sub>5</sub>N<sub>2</sub>, Mn<sub>4</sub>N, MnN, Mn<sub>6</sub>N<sub>5</sub>, Mn<sub>3</sub>N<sub>2</sub> и Mn<sub>x</sub>N с <i> х =</i>9,2-25,3. Сульфид MnS существует в трех кристаллич. модификациях (b-форма — минерал алабандин); плохо раств. в воде и м. б. осажден из р-ров солей Mn<sup>2+</sup> сульфидами щелочных металлов. Фосфиды М.: MnР, MnР <sub>3</sub>, Mn<sub>2</sub> Р (т. пл. 1327°С), Mn<sub>3</sub> Р (т. пл. 1105°C), Mn<sub>3</sub>P<sub>2</sub> (разлагается при 1090 °С) и Mn<sub>4</sub> Р (т. пл. 1085°С с разл.). Карбиды М.: Mn<sub>3</sub> С [разлагается при 950°С, <i> С°<sub> р</sub></i>93,3 Дж/(моль. К), DH<sup>0</sup><sub> обр</sub> 5,6 кДж/моль, S<sup>0</sup><sub>298</sub> 98,7 Дж/(моль. К)], Mn<sub>5</sub> С <sub>2</sub> (разлагается при 1050 °С, DH<sup>0</sup><sub> обр</sub> -66,1 кДж/моль), Mn<sub>15</sub> С <sub>4</sub> (разлагается при 850 °С), Mn<sub>7</sub> С <sub>3</sub> [разлагается при 1100°С, DH<sup>0</sup><sub> обр</sub> -98,7 кДж/моль, S<sup>0</sup><sub>298</sub><i></i>217 Дж/(моль. К)], Mn<sub>23</sub> С <sub>6</sub> (разлагается при 1025 °С, DH<sup>0</sup><sub> обр</sub> -287 кДж/моль), Mn<sub>2</sub> С <sub>7</sub>. Макс. р-римость углерода в a-, b- и g-Mn соотв. равна 1,3, 0,4 и 2,0% по массе. Силициды М.: MnSi, MnSi<sub>1,7</sub> [т. пл. 1160°С с разл., C<sup>0</sup><sub>p</sub> 58,70 Дж/(моль. К), DH<sup>0</sup><sub> обр</sub> -83,7 кДж/моль, S<sup>0</sup><sub>298</sub> 55,5 Дж/(моль. К)], Mn<sub>3</sub>Si, Mn<sub>5</sub>Si<sub>3</sub>. М. взаимод. с водой при комнатной т-ре очень медленно, при нагр. — с умеренной скоростью. Реагирует с разб. соляной и азотной к-тами и с горячей H<sub>2</sub>SO<sub>4</sub> с образованием солей Mn<sup>2+</sup> . Из р-ров солей Mn<sup>2+</sup> (см. <i> Марганца карбонат. Марганца нитрат. Марганца сульфат</i>)<i></i> при рН 8,7 осаждается плохо растворимый в воде Mn(ОН)<sub>2 </sub>- слабое основание. Еще более слабые основные св-ва проявляет нерастворимый в воде гидроксид Mn(III). Известны неустойчивые соли ортомарганцоватистой Н <sub>4</sub>MnО <sub>4</sub> и марганцоватистой Н <sub>3</sub>MnО <sub>4</sub> к-т. наиб. важны соли марганцоватой к-ты Н <sub>2</sub>MnО <sub>4 </sub>- манганаты и марганцовой к-ты НMnО <sub>4 </sub>- перманганаты (см. <i>Манганаты</i>). <br> <b> Получение.</b> М. получают методами <i> металлотермии -</i> карбо-, силико- или алюминотермич. восстановлением рудных концентратов, а также выщелачиванием руд H<sub>2</sub>SO<sub>4</sub> с послед. электролитич. восстановлением MnSO<sub>4</sub>. Предварительно руды М. обогащают, иногда обжигают (для разложения карбонатов), восстанавливают (для перевода в соед. Mn<sup>2+</sup>) или сплавляют с кварцитом. Карботермич. восстановлением получают высокоуглеродистый ферромарганец (содержащий 6-8% С), силикотермическим — низкоуглеродистый ферромарганец ( ~ 0,1% С), алюминотермическим — чистый М. Металлич. М. с низким содержанием С и Fe получают также восстановлением концентратов силикомарганцем (содержит более 36% Si). Hаиб. чистый М. с концентрацией примесей металлов менее 0,1% получают электролизом р-ров MnSO<sub>4</sub> (с концентрацией 35-40 г/л) в присут. (NH<sub>4</sub>)<sub>2</sub>SO<sub>4</sub> (ок. 150 г/л) при рН 8,0-8,5. Для очистки от газовых примесей жидкий М. вакуумируют или перегоняют в вакууме. <br> <b> Определение.</b> Качественно Mn<sup>3+</sup> обнаруживают по красно-фиолетовому окрашиванию, возникающему при добавлении р-ров солей Mn<sup>3+</sup> к щелочному р-ру формальдоксима, или по коричневому пятну, появляющемуся на фильтровальной бумаге (смоченной предварительно р-ром 8-гидроксихинолина) после нанесения капли р-ра соли Mn<sup>3+</sup> . Количественно М. определяют спектрофотометрически в виде иона MnО <sub>4</sub> (предварительно Mn<sup>2+</sup> и Mn<sup>3+</sup> окисляют до MnО <sub>4</sub> избытком КIO<sub>4</sub> в среде HNO<sub>3</sub>-H<sub>3</sub>PO<sub>4</sub>). Из р-ров Mn<sup>2+</sup> м. б. осажден в виде MnS действием (NH<sub>4</sub>)<sub>2</sub>S; осадок имеет сначала светло-розовый цвет, к-рый при нагр. переходит в зеленый. <br> <b> Применение.</b> М. один из основных металлов, используемых для раскисления, десульфурации и легирования сталей (более 90% производимого М. применяют в металлургии). Для удаления из стали О и S М. вводят в виде высокоуглеродистого ферромарганца (8-9 кг на 1 т стали), для легирования стали-в виде средне- и малоуглеродистого ферромарганца. М. — компонент сплавов цветных металлов, сплавов с Аl и Mg. М. придает стали, Аl и Mg прочность, твердость, улучшает способность к закаливанию, устойчивость к коррозии. М. применяют также для получения сплавов на его основе и для создания защитных антикоррозионных покрытий на металлах. В капиталистич. странах в произ-ве соед. М. ежегодно используется ок. 800 тыс. т марганцевых руд (о применении соед. М. см. соответствующие статьи), в произ-ве марганцевоцинковых ферритов, применяемых для изготовления трансформаторов и др. радиотехн. устройств, для получения окрашенного стекла и цветных глазурей, для фосфатирования стальных изделий — ок. 10 тыс. т/год. Произ-во марганцевого концентрата (тыс. т, в пересчете на металл): в Австралии 1750, Бразилии 2000, Габоне 2200, Гане 290, Индии 1400, ЮАР 3200 (1985); в СССР 9876 (1983). М. необходим для жизнедеятельности организмов. Недостаток М. у растений вызывает хлороз (недостаток хлорофилла). Нек-рые почвы бедны М. и нуждаются в <i> марганцевых удобрениях.</i> Недостаток М. в организме человека (суточная доза составляет ок. 4 мг) также может вызывать заболевания. В то же время соед. М. токсичны, поражают центр. нервную систему, вдыхание пыли из соед. М. в течение 1-3 лет может привести к хронич. отравлениям; ПДК (в пересчете на М.) для М. как аэрозоля конденсации 0,03 мг/м , как аэрозоля дезинтеграции 0,2 мг/м <sup>3</sup>, при одновременном воздействии М. и фтора 0,15 мг/м <sup>3</sup>. М. открыл К. Шееле и выделил в чистом виде Ю. Ган в 1774. <i> Лит.:</i> Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л., 1974; Электрохимия марганца, т. 1-8, Тб., 1957-1979; Kemmitt R. D. W., Peacock R. D., The chemistry of manganese, technetium and rhenium, Oxf, 1975 (Pergamon texts in inorganic chemistry, v. 22). <i> Э.</i> <i> Г. Раков.</i> </p><p><br></p><b>Синонимы</b>: <div class=»tags_list»>
металл, пиролюзит, элемент
</div><br><br>… смотреть
МАРГАНЕЦ
(лат. Manganum), Mn,- хим. элемент побочной подгруппы VII группы периодич. системы элементов, ат. номер 25, ат. масса 54,9380. В природе представ… смотреть
МАРГАНЕЦ
Mn (от нем. Manganerz — марганцевая руда; лат. Manganum * a. manganese; н. Mangan; ф. manganese; и. manganeso), — хим. элемент VII группы перио… смотреть
МАРГАНЕЦ
МАРГАНЕЦ(ново-лат.), marganesium, испорченное слово, произведен. от magneg — магнит, по сходству с ним). Металл сероватого цвета, трудноплавкий, хрупки… смотреть
МАРГАНЕЦ
Mn (от нем. Manganerz — марганцевая руда; лат. Manganum * a. manganese; н. Mangan; ф. manganese; и. manganeso), — хим. элемент VII группы периодич. системы Менделеева, ат. н. 25, ат. м. 54,9380. Природный M. состоит из одного стабильного изотопа 55Mn. B 1774 швед. химик K. B. Шееле выделил M. в виде сплава c железом. B том же году швед. учёный Ю. Ган получил M., загрязнённый углеродом.
M. — серебристо-белый металл. Установлены 4 полиморфные модификации; до 700В°C устойчив — О±-Mn c кубич. объёмноцентрированной кристаллич. решёткой, a=0,8 9139 нм, 58 атомов в элементарной ячейке; при 700-1079В°C — ОІ-Mn c кубич. объёмноцентрированной решёткой, a=0,6 3130 нм, 20 атомов в элементарной ячейке; при 1079-1143В°C — Оі-Mn c кубич. гранецентрированной решёткой, a=0,3 8550 нм, 4 атома в элементарной ячейке; выше 1143В°C — Оґ-Mn c кубич. объёмноцентрированной решёткой, a=0,3 0750 нм, 2 атома в элементарной ячейке. B обычных условиях устойчив О±-Mn; ОІ-Mn легко зафиксировать закалкой c темп-рой выше О±в†’ОІ перехода, тогда как Оі-Mn не может быть полностью зафиксирован при охлаждении. О±-Mn хрупок, Оі- и отчасти ОІ-Mn пластичны. Плотности (кг/м3): 7470 (293 K) — О±-Mn; 7260 (293 K) — ОІ-Mn; 6370 (1383 K) или 7210 (293 K) — Оі-Mn; 6280 (1416 K) — Оґ-Mn. Свойства О±-Mn — модификации: уд. теплоёмкость 0,478 кДж/кгВ·K (298 K), теплопроводность 66,57 Bт/мВ·K (298 K), температурный коэфф. линейного расширения 22,3В·* 10-6 K-1 (293 K), уд. электрич. сопротивление (1,5-2,6)В·* 10-6 OмВ·м, температурный коэфф. электрич. сопротивления (2-3)В·* 10-4 K-1,tпл 1244В°C, tкип 2095В°C. M. парамагнитен, при низких темп-pax О±-Mn, Оі-Mn и Оґ-Mn переходят в антиферромагнитное состояние, темп-ры Нееля равны соответственно 95 K, 580 K, 625 K; ОІ-Mn остаётся парамагнетиком до очень низких темп-p (1,5 K).
Степени окисления от +2 до +7, наиболее характерны +2, +4, +7. B сухом воздухе M. окисляется c поверхности, при нагревании горит на воздухе. Взаимодействует c N2, C, Si, P, S, B. C водородом не взаимодействует, но поглощает его c образованием твёрдых растворов. При взаимодействии M. c редкоземельными элементами, Al, Sn, Au, Bi и др. образуются интерметаллиды. Cu, Fe, Co и Ni образуют непрерывные ряды твёрдых растворов c Оі-Mn. Легко растворяется в кислотах, энергично взаимодействует c галогенами, образуя соли МnГ2. Соединения Mn2+ — восстановители. Оксид MnO обладает основными свойствами. Соединения Mn4+ выступают и как окислители, и как восстановители; MnO2 имеет амфотерные свойства c нек-рым преобладанием кислотной функции. Из соединений Mn6+ характерна марганцовистая кислота, из соединений Mn7+ — марганцовая кислота. Mн. соединения M. ядовиты, поражают центр. нервную систему человека.
M. — довольно распространённый элемент. Кларк его в земной коре 0,1% (по массе), в ультраосновных породах — 0,15%, основных — 0,2%, средних — 0,12%, кислых — 0,06%, осадочных — 0,07%, кам. метеоритах — 0,2%. Содержание M. в океанич. воде 2В·* 10-7 %, в живом веществе Земли 1В·* 10-3 %, в почве 8,5В·* 10-2 %. Представлен в осн. оксидами, карбонатами и в меньшей мере силикатами M. Осн. минералы M.: Пиролюзит, Гаусманит, Псиломелан, Манганит, Браунит, Родохрозит, Родонит. Вследствие кристаллохим. близости M. к трём важнейшим петрогенным элементам — Fe, Mg, Ca — широко представлен как изоморфная примесь в породообразующих минералах (оливинах, гранатах, слюдах, карбонатах). Содержание M., как и Fe, варьирует в породах незначительно. Отношение Mn/Mg и Mn/Fe, как и Fe/Mg, может служить показателем степени дифференциации изверженных пород. Значит. кол-во M. содержат Железо-марганцевые конкреции. Осн. типы м-ний и схемы обогащения см. в ст. Марганцевые руды.
M. разной чистоты в пром-сти получают электролизом и восстановлением его оксидов кремнием или алюмино-термически (чистый металл до 99,7-99,98% Mn — при электролизе; c низким содержанием углерода и железа — восстановлением марганцевой руды в дуговой электрич. печи; очень высокой чистоты — дистилляцией в вакууме).
Используется в осн. в чёрной металлургии (почти 95% M. идёт на раскисление и десульфурацию стали и чугуна и на добавки в спец. стали), при выплавке разл. сплавов цветных металлов, для создания антикоррозионных покрытий. Соединения M. широко используют при произ-ве стекла, олиф и в гальванич. элементах (пиролюзит), в медицине (перманганат калия), в красильном деле (хлорид и сульфат M.).
И. Ф. Кравчук…. смотреть
МАРГАНЕЦ
Марганец
1) город, Днепропетровская обл., Украина. Первоначально село Городище; название от городище ‘место, где некогда был город, укрепленное се… смотреть
МАРГАНЕЦ
⊲ МАРГАНЕЦ 1763, нца, м.Нем. Manganerz.Хим., Минер.«Рыхлая, на сажу похожая горная порода, иногда нѣсколько красноватая, иногда желѣзнаго, сѣраго, по б… смотреть
МАРГАНЕЦ
твердый хрупкий металл серовато-белого цвета, мелкокристаллического строения; уд. вес 7,4; темп-pa плавления 1250—1280°. На воздухе легко покрывается п… смотреть
МАРГАНЕЦ
(лат. Мап-ganum), хим. элемент VII гр. периодич. системы. Назв. от нем. Manganerz — марганц. руда. Серебристо-белый металл; шготн. 7,44 г/см3, tnn = 12… смотреть
МАРГАНЕЦ
(Manganum) , Mn, хим. элемент VII гр. периодич. системы Менделеева. Металл. В земной коре содержится 0,1%. Минералы М. — пиролюзит, манганит, родонит и др. Ср. содержание М. в почвах 0,085%. В растениях накапливаются десятитысячные — сотые, в ж-ных — стотысячные — тысячные доли процента. М. активизирует ряд ферментов, участвует в процессах дыхания, фотосинтеза, влияет на кроветворение и минер. обмен. Недостаток М. в почве вызывает у р-ний некрозы, хлорозы, пятнистости. При недостатке этого элемента в кормах ж-ные отстают в росте и развитии, у них нарушается минер. обмен, развивается анемия. На почвах, бедных М. (карбонатных и переизвесткованных), применяют <i>марганцевые удобрения. </i> <br><b>Синонимы</b>: <div class=»tags_list»>
металл, пиролюзит, элемент
</div><br><br>… смотреть
МАРГАНЕЦ
МАРГАНЕЦ (символ Мn), серо-белый ПЕРЕХОДНЫЙ ЭЛЕМЕНТ, впервые был выделен в 1774 г. Его главные руды — это пиролюзит, манганит и гаусманнит. Также встре… смотреть
МАРГАНЕЦ
1) Орфографическая запись слова: марганец2) Ударение в слове: м`арганец3) Деление слова на слоги (перенос слова): марганец4) Фонетическая транскрипция … смотреть
МАРГАНЕЦ
Марганець, город на Ю. Днепропетровской обл. (Украина). 50 тыс. жителей (2001). Пос. Городищенский при медном руднике возник в 1883 г., в 1926 г. п… смотреть
МАРГАНЕЦ
• марганец m
english: manganèse
deutsch: Mangan n
français: manganèse Синонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
МАРГАНЕЦ (лат. Manganum) — Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54,9380. Название от немецкого Manganerz — марганцевая руда. Серебристо-белый металл; плотность 7,44 г/с<span>м&sup3</span>, tпл 1244 .С. Минералы — пиролюзит, псиломелан, манганит и др.; огромны запасы марганца на дне океанов (железомарганцевые конкреции). Марганец в виде сплавов с железом (ферромарганец) и кремнием (силикомарганец) идет на производство рельсовой и конструкционной стали; им легируют сплавы на основе алюминия, магния и меди.<br>… смотреть
МАРГАНЕЦ
МАРГАНЕЦ (лат . Manganum), Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54, 9380. Название от немецкого Manganerz — марганцевая руда. Серебристо-белый металл; плотность 7, 44 г/см3, tпл 1244 °С. Минералы — пиролюзит, псиломелан, манганит и др.; огромны запасы марганца на дне океанов (железомарганцевые конкреции). Марганец в виде сплавов с железом (ферромарганец) и кремнием (силикомарганец) идет на производство рельсовой и конструкционной стали; им легируют сплавы на основе алюминия, магния и меди.<br><br><br>… смотреть
МАРГАНЕЦ
МАРГАНЕЦ м. металл манган, марган; черно-бурый окисел его, употребляемый в разных производствах, особ. для добыванья кислорода. | Черный (железистый?) подзем известковой почвы. Марганцевый, к нему относящ., его содержащий; руды этого металла носят названия марганцевого блеска, бленды, пены и пр. Марганцеватая вениса, содержащая немного марганца. Марганцевистая кислота, низшая степень окисления, а марганцевая — высшая. <br><br><br>… смотреть
МАРГАНЕЦ
Заимств. в XVIII в. из нем. яз., где Marganerz — сложение Mangan «марганец» и Erz «руда». В рус. яз. в слове произошла метатеза н — р > р — н (ср. т… смотреть
МАРГАНЕЦ
химический элемент, розовато-белый металл, легко окисляющийся на воздухе. Внесение солей М. в почву (в вегетационных опытах) даже в небольших количеств… смотреть
МАРГАНЕЦ
корень — МАРГАНЕЦ; нулевое окончание;Основа слова: МАРГАНЕЦВычисленный способ образования слова: Бессуфиксальный или другой∩ — МАРГАНЕЦ; ⏰Слово Маргане… смотреть
МАРГАНЕЦ
(manganese) металлический элемент серого цвета. При вдыхании его окиси шахтерами, находящимися в плохо вентилируемых шахтах под землей, он может вызвать повреждение головного мозга и симптомы, сходные с паркинсонизмом. В небольших количествах марганец необходим организму человека для поддержания его нормальной жизнедеятельности (см. Микроэлемент). Обозначение: Мп…. смотреть
МАРГАНЕЦ
мед. марганец (manganese) Компонент (наряду с цинком и медью) ферментативной системы антиоксидантов.
— Необходим для здоровья костей и нервной систем… смотреть
МАРГАНЕЦ
марганец [нем. manganerz марганцевая руда] — хим. элемент, символ мп (лат. manganum), тяжелый серебристо-белый металл; примен. при производстве стали и чугуна, делает их коррозионно-стойкими, износостойкими, вязкими и твердыми; соединения марганца примен. в сельском хозяйстве, в медицине, в стекольной и керамической промышленности. <br><br><br>… смотреть
МАРГАНЕЦ
Ма́рганец. Заимств. в XVIII в. из нем. яз., где Marganerz — сложение Mangan «марганец» и Erz «руда». В рус. яз. в слове произошла метатеза н — р > р — … смотреть
МАРГАНЕЦ
МАРГАНЕЦ (Manganum), Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54,9380; металл, tпл 1244шC. Марганец используют для легирования сталей и получения сплавов на его основе, в производстве микроудобрений. Открыт шведским химиком К. Шееле и получен шведским минералогом Ю. Ганом в 1774. <br>… смотреть
МАРГАНЕЦ
(Manganum), Mn, химический элемент VII группы периодической системы, атомный номер 25, атомная масса 54,9380; металл, tпл 1244°C. Марганец используют д… смотреть
МАРГАНЕЦ
Марена Марганец Мара Манер Мангра Манг Мана Ман Маг Маар Ера Грена Грац Гран Герц Герман Герма Гера Ген Гем Марна Маца Гарнец Гарем Мга Ганец Гана Гамен Гам Мег Мена Гаер Арма Мера Мец Нагар Нега Негр Нер Аренга Рага Рам Арен Ангарец Ангар Амер Аман Агреман Агар Агам Ага Цена Агнец Царан Цанга Рем Ранец Ранг Рана Рамена Арам… смотреть
МАРГАНЕЦ
(элемент) Ма́нґан, -ну; (простое вещество) ма́нґан, -ну
— азотнокислый марганец
— бромистый марганец
— кремнекислый марганец
— молочнокислый марганец
— сернистый марганец
— сернокислый марганец
— углекислый марганец
— уксуснокислый марганец
— фосфористый марганец
Синонимы:
металл, пиролюзит, элемент… смотреть
МАРГАНЕЦ
mangan* * *
м, хим.
manganez; manganСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
(Manganum; Mn)химический элемент VII группы периодической системы Д.И. Менделеева, ат. номер 25, ат. масса 54,9380; входит как микроэлемент в состав ра… смотреть
МАРГАНЕЦ
Rzeczownik марганец m Chemiczny mangan m
МАРГАНЕЦ
МАРГАНЕЦ, город (с 1938) на Украине, Днепропетровская обл. Железнодорожная станция. 54, 7 тыс. жителей (1991). Добыча и обогащение марганцевых руд (Никопольский марганцоворудный бас.). Предприятия легкой, мебельной промышленности. Историко-краеведческий музей.<br><br><br>… смотреть
МАРГАНЕЦ
-нца, м.
Химический элемент, тяжелый металл серебристо-белого цвета.[От нем. Manganerz]Синонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
МАРГАНЕЦ — город (с 1938) на Украине, Днепропетровская обл. Железнодорожная станция. 54,7 тыс. жителей (1991). Добыча и обогащение марганцевых руд (Никопольский марганцоворудный бас.). Предприятия легкой, мебельной промышленности. Историко-краеведческий музей.<br>… смотреть
МАРГАНЕЦ
(2 м), Р. ма/рганца, Тв. ма/рганцемСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
МАРГАНЕЦ , город (с 1938) на Украине, Днепропетровская обл. Железнодорожная станция. 54,7 тыс. жителей (1991). Добыча и обогащение марганцевых руд (Никопольский марганцоворудный бас.). Предприятия легкой, мебельной промышленности. Историко-краеведческий музей…. смотреть
МАРГАНЕЦ
МАРГАНЕЦ, город (с 1938) на Украине, Днепропетровская обл. Железнодорожная станция. 54,7 тыс. жителей (1991). Добыча и обогащение марганцевых руд (Никопольский марганцоворудный бас.). Предприятия легкой, мебельной промышленности. Историко-краеведческий музей…. смотреть
МАРГАНЕЦ
ма́рганец,
ма́рганцы,
ма́рганца,
ма́рганцев,
ма́рганцу,
ма́рганцам,
ма́рганец,
ма́рганцы,
ма́рганцем,
ма́рганцами,
ма́рганце,
ма́рганцах
(Источник: «Полная акцентуированная парадигма по А. А. Зализняку»)
.
Синонимы:
металл, пиролюзит, элемент… смотреть
МАРГАНЕЦ
марганец (Manganum; Mn) — химический элемент VII группы периодической системы Д. И. Менделеева, ат. номер 25, ат. масса 54,9380; входит как микроэлемент в состав растительных и животных организмов: является кофактором некоторых ферментов. <br><br><br>… смотреть
МАРГАНЕЦ
— город (с 1938) на Украине, Днепропетровская обл.Железнодорожная станция. 54,7 тыс. жителей (1991). Добыча и обогащениемарганцевых руд (Никопольский марганцоворудный бас.). Предприятия легкой,мебельной промышленности. Историко-краеведческий музей…. смотреть
МАРГАНЕЦ
м. хим.manganeso mхлористый марганец — cloruro de manganeso
МАРГАНЕЦ
м хим
manganês mСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
(Manganum; Mn) химический элемент VII группы периодической системы Д. И. Менделеева, ат. номер 25, ат. масса 54,9380; входит как микроэлемент в состав растительных и животных организмов: является кофактором некоторых ферментов…. смотреть
МАРГАНЕЦ
manganese* * *ма́рганец м.manganese, Mn* * *manganeseСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
м. хим.manganèse mСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
м хим.Mangan nСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
м’арганец, -нца, твор. п. -нцемСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
хим. манган (-ну). Закись -ца — манганистий закис (-су), одноокис (недокис) мангану. Окись -ца — мангановий окис, півтораокис мангану. Перекись -ца — надокис (двоокис) мангану (мангановий)…. смотреть
МАРГАНЕЦ
• хим.
hipermangán• mangán
Синонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
марганецמַנגָן ז’Синонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
марганец ма́рганецИз нем. Мanganerz, сближенного со словами на суф. -ец, или непосредственно из ит. manganese – то же; см. Преобр. I, 510; Маценауэр 25… смотреть
МАРГАНЕЦ
марганец, м′арганец, -нца, м. Химический элемент, металл серебристо-белого цвета.прил. марганцевый, -ая, -ое и марганцовый, -ая, -ое. Марганцевая руда…. смотреть
МАРГАНЕЦ
м хим.锰 měngСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
см.:Ангидрит твою мать (или ангидрит твою перекись марганца)Синонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
МАРГАНЕЦ, -нца, м. Химический элемент, металл серебристо-белого цвета. || прилагательное марганцевый, -ая, -ое и марганцовый, -ая, -ое. Марганцевая руда…. смотреть
МАРГАНЕЦ
فقط مفرد : منگنز (Mn) ، عنصر شيميايي با عدد اتمي 25 و جرم اتمي 54.938049
МАРГАНЕЦ
ма́рганец, -нцаСинонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
ма’рганец, ма’рганцы, ма’рганца, ма’рганцев, ма’рганцу, ма’рганцам, ма’рганец, ма’рганцы, ма’рганцем, ма’рганцами, ма’рганце, ма’рганцах
МАРГАНЕЦ
Из нем. Мanganerz, сближенного со словами на суф. -ец, или непосредственно из ит. manganese – то же; см. Преобр. I, 510; Маценауэр 250.
МАРГАНЕЦ
МАРГАНЕЦ марганца, мн. нет, м. (ит. manganese — марганцевая руда) (хим.). Хрупкий металл розовато-белого цвета.
МАРГАНЕЦ
manganeseСинонимы: металл, пиролюзит, элемент
МАРГАНЕЦ
марганец м хим. Mangan n 1Синонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
Начальная форма — Марганец, винительный падеж, единственное число, мужской род, неодушевленное
МАРГАНЕЦ
м.
manganese
Итальяно-русский словарь.2003.
Синонимы:
металл, пиролюзит, элемент
МАРГАНЕЦ
марганец = м. хим. manganese; марганцевый manganesian; manganese attr.
МАРГАНЕЦ
марганец;
марганец кислотасы марганцевая кислота.
МАРГАНЕЦ
марганец м`арганец, -нца, тв. -нцем
МАРГАНЕЦ
марган||ецм τό μαγγάνιο{ν}, τό μαγ-γανήσιον.
МАРГАНЕЦ
М мн. нет kim. manqan (qırmızı boz metal).
МАРГАНЕЦ
хим. марганец. МАРГАРИН маргарин.
История марганца
Первооткрывателями марганца принято считать шведских химиков К. Шееле и Ю. Гана, первый из которых в 1774 году обнаружил неизвестный металл в широко используемой железной руде, называемой в древности чёрной магнезией, второй же путём нагревания смеси пиролюзита (основного минерала марганца) с углём получил металлический марганец (calorizator). Название новый металл получил от немецкого Manganerz, т.е. марганцевая руда.
Общая характеристика марганца
Марганец является элементом побочной подгруппы VII группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 25 и атомную массу 54,9380. Принятое обозначение – Mn (от латинского Manganum).
Нахождение в природе
Марганец достаточно распространён, входит во вторую десятку элементов по распространённости. В земной коре встречается чаще всего совместно с железными рудами, но имеются и месторождения именно марганца, например в Грузии и России.
Физические и химические свойства
Марганец является тяжёлым серебристо-белым металлом, так называемым чёрным металлом. При нагревании имеет свойство разлагать воду, вытесняя водород. В обычном состоянии поглощает водород.
Суточная потребность в марганце
Для взрослого здорового человека суточная потребность в марганце составляет 5-10 мг.
Продукты питания богатые марганцем
Марганец попадает в организм человека с пищей, поэтому в обязательном порядке необходимо ежедневно съедать один или несколько продуктов из следующего списка:
- орехи (арахис, грецкий орех, миндаль, фисташки, фундук)
- крупы и злаки (пшено, гречка, овсянка, рис, рожь, пшеница)
- бобовые (горох, фасоль, чечевица)
- овощи и зелень (салат, листья свёклы, укроп, шпинат, чеснок)
- ягоды и фрукты (абрикосы, брусника, малина, черника, чёрная смородина)
- грибы (белые, подосиновики, лисички)
- говяжья печень.
Полезные свойства марганца и его влияние на организм
Функции марганца в организме человека:
- регуляция уровня глюкозы в крови, стимуляция выработки аскорбиновой кислоты
- профилактика сахара диабета путём снижения уровня сахара в крови
- нормализация мозговой деятельности и процессов в нервной системе
- участие в работе поджелудочной железы и синтезе холестерина
- способствование росту соединительных тканей, хрящей и костей
- влияние на липидный обмен и предотвращение избыточного отложения жира в печени
- участие в делении клеток
- снижение активности «плохого» холестерина и замедление роста холестериновых бляшек.
Взаимодействие с другими
Марганец помогает активизировать ферменты, необходимые для правильного использования организмом биотина, витаминов B1 и С. Взаимодействие марганца с медью и цинком является признанным антиоксидантным средством. Большие дозы кальция и фосфора будут задерживать всасывание марганца.
Применение марганца в жизни
Наибольшее применение марганец нашёл в металлургии, также при производстве реостатов, гальванических элементов. Соединения марганца используют как термоэлектрический материал.
Признаки нехватки марганца
При режиме питания, утяжелённом большим количеством углеводов, в организме происходит перерасход марганца, что проявляется следующими симптомами: анемия, снижение прочности костей, задержка роста, а также атрофия яичников у женщин и яичек у мужчин.
Признаки избытка марганца
Излишек марганца также неполезен организму, его проявлениями могут служить сонливость, боли в мышцах, потеря аппетита и изменения в формировании костей – так называемый «марганцевый» рахит.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
| Марганец | |
|---|---|
| Твёрдый, хрупкий металл серебристо-белого цвета | |

Электролитический марганец |
|
| Название, символ, номер | Марганец / Manganum (Mn), 25 |
| Атомная масса (молярная масса) |
54,938045 (5) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s2 |
| Радиус атома | 127 пм |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+7e) 46 (+2e) 80 пм |
| Электроотрицательность | 1,55 (шкала Полинга) |
| Электродный потенциал | −1,180 В |
| Степени окисления | 7, 6, 5, 4, 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) |
716,8 (7,43) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,21 г/см³ |
| Температура плавления | 1 517 K |
| Температура кипения | 2 235 K |
| Уд. теплота плавления | 13,4 кДж/моль |
| Уд. теплота испарения | 221 кДж/моль |
| Молярная теплоёмкость | 26,3 Дж/(K·моль) |
| Молярный объём | 7,35 см³/моль |
| Структура решётки | кубическая |
| Параметры решётки | 8,890 Å |
| Температура Дебая | 400 K |
| Теплопроводность | (300 K) 6,87 Вт/(м·К) |
| Номер CAS | 7439-96-5 |
Марганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 25. Обозначается символом Mn (лат. Manganum, манганум, в составе формул по-русски читается как марганец, например, KMnO4 — калий марганец о четыре). Простое вещество марганец — металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам. Известны пять аллотропных модификаций марганца — четыре с кубической и одна с тетрагональной кристаллической решёткой.
Содержание
- 1 История открытия
- 2 Распространённость в природе
- 2.1 Минералы марганца
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Изотопы
- 7 Применение в промышленности
- 7.1 Применение в металлургии
- 7.2 Применение в химии
- 8 Определение методами химического анализа
- 9 Биологическая роль и содержание в живых организмах
- 10 Токсичность
- 11 Месторождение
История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 году шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от нем. Manganerz — марганцевая руда).
Распространённость в природе
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Массовая доля марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6 %), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железомарганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца
- пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (MnIIMn2III)O4;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан mMnO·MnO2·nH2O (45-60 % марганца);
- пурпурит Mn3+[PO4], (36,65 % марганца).
Получение
- Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
- 4MnO2 ⟶ 2Mn2O3 + O2
- Mn2O3 + 2Al ⟶ 2Mn + Al2O3
- Восстановлением железосодержащих оксидных руд марганца коксом. Этим способом в металлургии обычно получают ферромарганец (~80 % Mn).
- Чистый металлический марганец получают электролизом.
Физические свойства
Некоторые свойства приведены в таблице. Другие свойства марганца:
- Работа выхода электрона: 4,1 эВ
- Коэффициент теплового расширения: 0,000022 K−1 (при 0 °C)
- Электропроводность: 0,00695⋅106 Ом−1·см−1
- Теплопроводность: 0,0782 Вт/(см·K)
- Энтальпия атомизации: 280,3 кДж/моль при 25 °C
- Энтальпия плавления: 14,64 кДж/моль
- Энтальпия испарения: 219,7 кДж/моль
- Твёрдость:
- по шкале Бринелля: Мн/м²
- по шкале Мооса: 4
- Давление паров: 121 Па при 1244 °C
- Молярный объём: 7,35 см³/моль
Химические свойства
| Окисленная форма |
Восстановленная форма |
Среда | E0, В |
|---|---|---|---|
| Mn2+ | Mn | H+ | −1,186 |
| Mn3+ | Mn2+ | H+ | +1,51 |
| MnO2 | Mn3+ | H+ | +0,95 |
| MnO2 | Mn2+ | H+ | +1,23 |
| MnO2 | Mn(OH)2 | OH− | −0,05 |
| MnO42− | MnO2 | H+ | +2,26 |
| MnO42− | MnO2 | OH− | +0,62 |
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |
Диаграмма Пурбе для марганца
Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7 (степени окисления +1, +5 малохарактерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
- Mn + O2 ⟶ MnO2
Марганец при нагревании разлагает воду, вытесняя водород:
- Mn + 2H2O →∘t Mn(OH)2 + H2↑
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
С соляной и серной кислотами реагирует по уравнению
- Mn + 2H+ ⟶ Mn2+ + H2↑
С концентрированной серной кислотой реакция идёт по уравнению
- Mn + 2H2SO4 ⟶ MnSO4 + SO2↑ + 2H2O
С разбавленной азотной кислотой реакция идёт по уравнению
- 3Mn + 8HNO3 ⟶ 3Mn(NO3)2 + 2NO↑ + 4H2O
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.
Mn2O7 в обычных условиях — жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца IV (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
- 2MnO2 + 4KOH + O2 ⟶ 2K2MnO4 + 2H2O
Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция
- 3K2MnO4 + 3H2SO4 ⟶ 3K2SO4 + 2HMnO4 + MnO(OH)2↓ + H2O
Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) — сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия)
- 2KMnO4 →∘t K2MnO4 + MnO2 + O2
Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
- 2MnSO4 + 5PbO2 + 6HNO3 ⟶ 2HMnO4 + 2PbSO4 + 3Pb(NO3)2 + 2H2O
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления. Подробное описание реакции см. в разделе «Определение методами химического анализа». В нейтральных или кислых водных растворах ион Mn2+ образует окрашенный в бледно-розовый цвет аквакомплекс [Mn(H2O)6]2+.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основный характер, MnO(OH)2 — амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
- MnO2 + 4HCl ⟶ MnCl2 + Cl2↑ + 2H2O
Нулевая степень окисления у марганца проявляется в соединениях с σ-донорными и π-акцепторными лигандами. Так, для марганца и известен карбонил состава Mn2(CO)10.
Известны и другие соединения марганца с σ-донорными и π-акцепторными лигандами (PF3, NO, N2, P(C5H5)3).
Изотопы
Основная статья: Изотопы марганца
Марганец является моноизотопным элементом — в природе существует только один устойчивый изотоп 55Mn. Все другие изотопы марганца нестабильны и радиоактивны, они получены искусственно. Известны 25 радиоактивных изотопов марганца, имеющие массовое число А в диапазоне от 44 до 70. Наиболее стабильными из них являются 53Mn (период полураспада T1/2 = 3,7 млн лет), 54Mn (T1/2 = 312,3 суток) и 52Mn (T1/2 = 5,591 суток). Преобладающим каналом распада лёгких изотопов марганца (А < 55) является электронный захват (и иногда конкурирующий с ним позитронный распад) в соответствующие изотопы хрома. У тяжёлых изотопов (А > 55) основным каналом распада является β−-распад в соответствующие изотопы железа. Известны также 7 изомеров (метастабильных возбуждённых состояний) с периодами полураспада более 100 нс.
Применение в промышленности
Применение в металлургии
Марганец в виде ферромарганца применяется для раскисления стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12—13 % Mn в сталь (так называемая сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (т. н. «наклёп»). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
В 1920—1940-х годах применение марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале «Сталь» возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определённого содержания марганца в процессе мартеновской плавки, в которой вместе с В. И. Явойским и В. И. Баптизманским принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Применение в химии
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Теллурид марганца — перспективный термоэлектрический материал (термо-ЭДС 500 мкВ/К).
Определение методами химического анализа
Марганец принадлежит к пятой аналитической группе катионов.
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn2+, следующие:
1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
-
- MnSO4 + 2KOH → Mn(OH)2↓ + K2SO4
- Mn2+ + 2OH− → Mn(OH)2↓
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
-
- MnSO4 + H2O2 + 2NaOH → MnO(OH)2↓ + Na2SO4 + H2O
- Mn2+ + H2O2 + 2OH− → MnO(OH)2↓ + H2O
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn2+ до MnO4− с образованием марганцевой кислоты малинового цвета:
- 2MnSO4 + 5PbO2 + 6HNO3 → 2HMnO4 + 2PbSO4↓ + 3Pb(NO3)2 + 2H2O
- 2Mn2+ + 5PbO2 + 4H+ → 2MnO4− + 5Pb2+ + 2H2O
Эта реакция даёт отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой. При больших количествах марганца провести эту реакцию не удаётся, так как избыток ионов Mn2+ восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2, и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Mn2+ в MnO4− могут быть использованы другие окислители, например, персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag+ или висмутат натрия NaBiO3:
-
- 2MnSO4 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5Bi(NO3)3 + NaNO3 + 2Na2SO4 + 7H2O
Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца II MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца II, окрашенный в телесный цвет:
-
- MnSO4 + (NH4)2S → MnS↓ + (NH4)2SO4
- Mn2+ + S2− → MnS↓
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца (II) и добавляют 2 капли раствора сульфида аммония.
Биологическая роль и содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект.
Токсичность
Основная статья: Отравление марганцем
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приёмом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве. Оно проявляется в виде тяжёлых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Чтобы развилась клиническая картина хронического отравления марганцем, обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемых повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом йода).
Месторождение
- Усинское месторождение марганца
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
Характеристика марганца
Положение в ПСХЭ
Марганец (Mn) располагается в 4 периоде, в VII группе, побочной подгруппе, имеет порядковый номер 25.
Атомные числа
A (массовое число) = 55
P (число протонов) = 25
N (число нейтронов) = A — Z = 55 — 25 = 30
ē (число электронов) = 25
Электронное строение атома
Mn
+25
2
8
13
2
25Mn 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Валентные электроны
| 25Mn | ↑ | ↑ | ↑ | ↑ | ↑ | ↑↓ | ||||||
| 3d | 4s | 4p |
| 25Mn* | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |||||
| 3d | 4s | 4p |
Степени окисления
минимальная: 0
максимальная: +7
Свойства простого вещества
Марганец – d-элемент, металл.
Высший оксид
Mn2O7 – оксид марганца (VII).
Проявляет кислотные свойства:
Mn2O7 + 2NaOH ⟶ 2NaMnO4 + H2O
Высший гидроксид
HMnO4 – марганцовая кислота.
Проявляет кислотные свойства:
HMnO4 + NaOH ⟶ NaMnO4 + H2O
Not to be confused with Magnesium (Mg).

Pure manganese cube and oxidized manganese chips |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Manganese | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (MANG-gə-neez) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery metallic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Mn) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Manganese in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | d-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Ar] 3d5 4s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 13, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1519 K (1246 °C, 2275 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2334 K (2061 °C, 3742 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 7.21 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 5.95 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 12.91 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 221 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 26.32 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | −3, −2, −1, 0, +1, +2, +3, +4, +5, +6, +7 (depending on the oxidation state, an acidic, basic, or amphoteric oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 1.55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 127 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | Low spin: 139±5 pm High spin: 161±8 pm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of manganese |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 5150 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 21.7 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 7.81 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 1.44 µΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | (α) +529.0×10−6 cm3/mol (293 K)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 198 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 120 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 6.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brinell hardness | 196 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7439-96-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Carl Wilhelm Scheele (1774) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Johann Gottlieb Gahn (1774) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of manganese
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Manganese is a chemical element with the symbol Mn and atomic number 25. It is a hard, brittle, silvery metal, often found in minerals in combination with iron. Manganese is a transition metal with a multifaceted array of industrial alloy uses, particularly in stainless steels. It improves strength, workability, and resistance to wear. Manganese oxide is used as an oxidising agent; as a rubber additive; and in glass making, fertilisers, and ceramics. Manganese sulfate can be used as a fungicide.
Manganese is also an essential human dietary element, important in macronutrient metabolism, bone formation, and free radical defense systems. It is a critical component in dozens of proteins and enzymes.[3] It is found mostly in the bones, but also the liver, kidneys, and brain.[4] In the human brain, the manganese is bound to manganese metalloproteins, most notably glutamine synthetase in astrocytes.
Manganese was first isolated in 1774. It is familiar in the laboratory in the form of the deep violet salt potassium permanganate. It occurs at the active sites in some enzymes.[5] Of particular interest is the use of a Mn-O cluster, the oxygen-evolving complex, in the production of oxygen by plants.
Characteristics[edit]
Physical properties[edit]
Manganese is a silvery-gray metal that resembles iron. It is hard and very brittle, difficult to fuse, but easy to oxidize.[6] Manganese metal and its common ions are paramagnetic.[7] Manganese tarnishes slowly in air and oxidizes («rusts») like iron in water containing dissolved oxygen.[citation needed]
Isotopes[edit]
Naturally occurring manganese is composed of one stable isotope, 55Mn. Several radioisotopes have been isolated and described, ranging in atomic weight from 46 u (46Mn) to 72 u (72Mn). The most stable are 53Mn with a half-life of 3.7 million years, 54Mn with a half-life of 312.2 days, and 52Mn with a half-life of 5.591 days. All of the remaining radioactive isotopes have half-lives of less than three hours, and the majority of less than one minute. The primary decay mode in isotopes lighter than the most abundant stable isotope, 55Mn, is electron capture and the primary mode in heavier isotopes is beta decay.[8] Manganese also has three meta states.[8]
Manganese is part of the iron group of elements, which are thought to be synthesized in large stars shortly before the supernova explosion.[9] 53Mn decays to 53Cr with a half-life of 3.7 million years. Because of its relatively short half-life, 53Mn is relatively rare, produced by cosmic rays impact on iron.[10] Manganese isotopic contents are typically combined with chromium isotopic contents and have found application in isotope geology and radiometric dating. Mn–Cr isotopic ratios reinforce the evidence from 26Al and 107Pd for the early history of the Solar System. Variations in 53Cr/52Cr and Mn/Cr ratios from several meteorites suggest an initial 53Mn/55Mn ratio, which indicate that Mn–Cr isotopic composition must result from in situ decay of 53Mn in differentiated planetary bodies. Hence, 53Mn provides additional evidence for nucleosynthetic processes immediately before coalescence of the Solar System.[11][12][13][14]
Allotropes[edit]
|
Unit cell of a α-Mn crystal |
Unit cell of a β-Mn crystal |
Four allotropes (structural forms) of solid manganese are known, labeled α, β, γ and δ, and occurring at successively higher temperatures. All are metallic, stable at standard pressure, and have a cubic crystal lattice, but they vary widely in their atomic structures.[15][16][17]
Alpha manganese (α-Mn) is the equilibrium phase at room temperature. It has a body-centered cubic lattice and is unusual among elemental metals in having a very complex unit cell, with 58 atoms per cell (29 atoms per primitive unit cell) in four different types of site.[18][15] It is paramagnetic at room temperature and antiferromagnetic at temperatures below 95 K (−178 °C).[19]
Phase diagram of manganese[15]
Beta manganese (β-Mn) forms when heated above the transition temperature of 973 K (700 °C; 1,290 °F). It has a primitive cubic structure with 20 atoms per unit cell at two types of sites, which is as complex as that of any other elemental metal.[20] It is easily obtained as a metastable phase at room temperature by rapid quenching. It does not show magnetic ordering, remaining paramagnetic down to the lowest temperature measured (1.1 K).[20][21][22]
Gamma manganese (γ-Mn) forms when heated above 1,370 K (1,100 °C; 2,010 °F). It has a simple face-centered cubic structure (four atoms per unit cell). When quenched to room temperature it converts to β-Mn, but it can be stabilized at room temperature by alloying it with at least 5 percent of other elements (such as C, Fe, Ni, Cu, Pd or Au), and these solute-stabilized alloys distort into a face-centered tetragonal structure.[23][22]
Delta manganese (δ-Mn) forms when heated above 1,406 K (1,130 °C; 2,070 °F) and is stable up to the manganese melting point of 1,519 K (1,250 °C; 2,270 °F). It has a body-centered cubic structure (two atoms per cubic unit cell).[16][22]
Chemical compounds[edit]
Common oxidation states of manganese are +2, +3, +4, +6, and +7, although all oxidation states from −3 to +7 have been observed. Manganese in oxidation state +7 is represented by salts of the intensely purple permanganate anion MnO4−. Potassium permanganate is a commonly used laboratory reagent because of its oxidizing properties; it is used as a topical medicine (for example, in the treatment of fish diseases). Solutions of potassium permanganate were among the first stains and fixatives to be used in the preparation of biological cells and tissues for electron microscopy.[25]
Aside from various permanganate salts, Mn(VII) is represented by the unstable, volatile derivative Mn2O7. Oxyhalides (MnO3F and MnO3Cl) are powerful oxidizing agents.[6] The most prominent example of Mn in the +6 oxidation state is the green anion manganate, [MnO4]2-. Manganate salts are intermediates in the extraction of manganese from its ores. Compounds with oxidation states +5 are somewhat elusive, one example is the blue anion hypomanganate [MnO4]3-.
Compounds with Mn in oxidation state +5 are rarely encountered and often found associated with an oxide (O2-) or nitride (N3-) ligand.[26][27]
Mn(IV) is somewhat enigmatic because it is common in nature but far rarer in synthetic chemistry. The most common Mn ore, pyrolusite, is MnO2. It is the dark brown pigment of many cave drawings but is also a common ingredient in dry cell batteries. Complexes of Mn(IV) are well known, but they require elaborate ligands. Mn(IV)-OH complexes are an intermediate in some enzymes, including the oxygen evolving center (OEC) in plants.[28]
Simple derivatives Mn+3 are rarely encountered but can be stabilized by suitably basic ligands. Manganese(III) acetate is an oxidant useful in organic synthesis. Solid compounds of manganese(III) are characterized by its strong purple-red color and a preference for distorted octahedral coordination resulting from the Jahn-Teller effect.[citation needed]
Aqueous solution of KMnO4 illustrating the deep purple of Mn(VII) as it occurs in permanganate
A particularly common oxidation state for manganese in aqueous solution is +2, which has a pale pink color. Many manganese(II) compounds are known, such as the aquo complexes derived from manganese(II) sulfate (MnSO4) and manganese(II) chloride (MnCl2). This oxidation state is also seen in the mineral rhodochrosite (manganese(II) carbonate). Manganese(II) commonly exists with a high spin, S = 5/2 ground state because of the high pairing energy for manganese(II). There are no spin-allowed d–d transitions in manganese(II), which explain its faint color.[29]
| Oxidation states of manganese[30] | |
|---|---|
| 0 | Mn 2(CO) 10 |
| +1 | MnC 5H 4CH 3(CO) 3 |
| +2 | MnCl 2, MnCO 3, MnO |
| +3 | MnF 3, Mn(OAc) 3, Mn 2O 3 |
| +4 | MnO 2 |
| +5 | K 3MnO 4 |
| +6 | K 2MnO 4 |
| +7 | KMnO 4, Mn 2O 7 |
| Common oxidation states are in bold. |
Organomanganese compounds[edit]
Manganese forms a large variety of organometallic derivatives, i.e., compounds with Mn-C bonds. The organometallic derivatives include numerous examples of Mn in its lower oxidation states, i.e. Mn(-III) up through Mn(I). This area of organometallic chemistry is attractive because Mn is inexpensive and of relatively low toxicity.[citation needed]
Of greatest commercial interest is «MMT», methylcyclopentadienyl manganese tricarbonyl, which is used as an anti-knock compound added to gasoline (petrol) in some countries. It features Mn(I). Consistent with other aspects of Mn(II) chemistry, manganocene (Mn(C5H5)2) is high-spin. In contrast, its neighboring metal iron forms an air-stable, low-spin derivative in the form of ferrocene (Fe(C5H5)2). When conducted under an atmosphere of carbon monoxide, reduction of Mn(II) salts gives dimanganese decacarbonyl Mn2(CO)10, an orange and volatile solid. The air-stability of this Mn(0) compound (and its many derivatives) reflects the powerful electron-acceptor properties of carbon monoxide. Many alkene complexes and alkyne complexes are derived from Mn2(CO)10.[citation needed]
In Mn(CH3)2(dmpe)2, Mn(II) is low spin, which contrasts with the high spin character of its precursor, MnBr2(dmpe)2 (dmpe = (CH3)2PCH2CH2P(CH3)2).[31] Polyalkyl and polyaryl derivatives of manganese often exist in higher oxidation states, reflecting the electron-releasing properties of alkyl and aryl ligands. One example is [Mn(CH3)6]2-.[citation needed]
History[edit]
The origin of the name manganese is complex. In ancient times, two black minerals were identified from the regions of the Magnetes (either Magnesia, located within modern Greece, or Magnesia ad Sipylum, located within modern Turkey).[32]
They were both called magnes from their place of origin, but were considered to differ in sex. The male magnes attracted iron, and was the iron ore now known as lodestone or magnetite, and which probably gave us the term magnet. The female magnes ore did not attract iron, but was used to decolorize glass. This female magnes was later called magnesia, known now in modern times as pyrolusite or manganese dioxide.[citation needed] Neither this mineral nor elemental manganese is magnetic. In the 16th century, manganese dioxide was called manganesum (note the two Ns instead of one) by glassmakers, possibly as a corruption and concatenation of two words, since alchemists and glassmakers eventually had to differentiate a magnesia nigra (the black ore) from magnesia alba (a white ore, also from Magnesia, also useful in glassmaking). Michele Mercati called magnesia nigra manganesa, and finally the metal isolated from it became known as manganese (German: Mangan). The name magnesia eventually was then used to refer only to the white magnesia alba (magnesium oxide), which provided the name magnesium for the free element when it was isolated much later.[33]
Some of the cave paintings in Lascaux, France, use manganese-based pigments.[34]
Manganese dioxide, which is abundant in nature, has long been used as a pigment. The cave paintings in Gargas that are 30,000 to 24,000 years old are made from the mineral form of MnO2 pigments.[35]
Manganese compounds were used by Egyptian and Roman glassmakers, either to add to, or remove, color from glass.[36] Use as «glassmakers soap» continued through the Middle Ages until modern times and is evident in 14th-century glass from Venice.[37]
Because it was used in glassmaking, manganese dioxide was available for experiments by alchemists, the first chemists. Ignatius Gottfried Kaim (1770) and Johann Glauber (17th century) discovered that manganese dioxide could be converted to permanganate, a useful laboratory reagent.[38] By the mid-18th century, the Swedish chemist Carl Wilhelm Scheele used manganese dioxide to produce chlorine. First, hydrochloric acid, or a mixture of dilute sulfuric acid and sodium chloride was made to react with manganese dioxide, and later hydrochloric acid from the Leblanc process was used and the manganese dioxide was recycled by the Weldon process. The production of chlorine and hypochlorite bleaching agents was a large consumer of manganese ores.[citation needed]
Scheele and others were aware that pyrolusite (mineral form of manganese dioxide) contained a new element. Johan Gottlieb Gahn was the first to isolate an impure sample of manganese metal in 1774, which he did by reducing the dioxide with carbon.[citation needed]
The manganese content of some iron ores used in Greece led to speculations that steel produced from that ore contains additional manganese, making the Spartan steel exceptionally hard.[39] Around the beginning of the 19th century, manganese was used in steelmaking and several patents were granted. In 1816, it was documented that iron alloyed with manganese was harder but not more brittle. In 1837, British academic James Couper noted an association between miners’ heavy exposure to manganese and a form of Parkinson’s disease.[40] In 1912, United States patents were granted for protecting firearms against rust and corrosion with manganese phosphate electrochemical conversion coatings, and the process has seen widespread use ever since.[41]
The invention of the Leclanché cell in 1866 and the subsequent improvement of batteries containing manganese dioxide as cathodic depolarizer increased the demand for manganese dioxide. Until the development of batteries with nickel-cadmium and lithium, most batteries contained manganese. The zinc–carbon battery and the alkaline battery normally use industrially produced manganese dioxide because naturally occurring manganese dioxide contains impurities. In the 20th century, manganese dioxide was widely used as the cathodic for commercial disposable dry batteries of both the standard (zinc–carbon) and alkaline types.[42]
Occurrence[edit]
Manganese comprises about 1000 ppm (0.1%) of the Earth’s crust, the 12th most abundant of the crust’s elements.[4] Soil contains 7–9000 ppm of manganese with an average of 440 ppm.[4] The atmosphere contains 0.01 μg/m3.[4] Manganese occurs principally as pyrolusite (MnO2), braunite (Mn2+Mn3+6)SiO12),[43] psilomelane (Ba,H2O)2Mn5O10, and to a lesser extent as rhodochrosite (MnCO3).
|
|
|
|
|
|
| Manganese ore | Psilomelane (manganese ore) | Spiegeleisen is an iron alloy with a manganese content of approximately 15% | Manganese oxide dendrites on limestone from Solnhofen, Germany – a kind of pseudofossil. Scale is in mm | Mineral rhodochrosite (manganese(II) carbonate) |
Percentage of manganese output in 2006 by countries[44]
The most important manganese ore is pyrolusite (MnO2). Other economically important manganese ores usually show a close spatial relation to the iron ores, such as sphalerite.[6][45] Land-based resources are large but irregularly distributed. About 80% of the known world manganese resources are in South Africa; other important manganese deposits are in Ukraine, Australia, India, China, Gabon and Brazil.[44] According to 1978 estimate, the ocean floor has 500 billion tons of manganese nodules.[46] Attempts to find economically viable methods of harvesting manganese nodules were abandoned in the 1970s.[47]
In South Africa, most identified deposits are located near Hotazel in the Northern Cape Province, with a 2011 estimate of 15 billion tons. In 2011 South Africa produced 3.4 million tons, topping all other nations.[48]
Manganese is mainly mined in South Africa, Australia, China, Gabon, Brazil, India, Kazakhstan, Ghana, Ukraine and Malaysia.[49]
Production[edit]
For the production of ferromanganese, the manganese ore is mixed with iron ore and carbon, and then reduced either in a blast furnace or in an electric arc furnace.[50] The resulting ferromanganese has a manganese content of 30 to 80%.[6] Pure manganese used for the production of iron-free alloys is produced by leaching manganese ore with sulfuric acid and a subsequent electrowinning process.[51]
Process flow diagram for a manganese refining circuit.
A more progressive extraction process involves directly reducing (a low grade) manganese ore by heap leaching. This is done by percolating natural gas through the bottom of the heap; the natural gas provides the heat (needs to be at least 850 °C) and the reducing agent (carbon monoxide). This reduces all of the manganese ore to manganese oxide (MnO), which is a leachable form. The ore then travels through a grinding circuit to reduce the particle size of the ore to between 150 and 250 μm, increasing the surface area to aid leaching. The ore is then added to a leach tank of sulfuric acid and ferrous iron (Fe2+) in a 1.6:1 ratio. The iron reacts with the manganese dioxide (MnO2) to form iron hydroxide (FeO(OH)) and elemental manganese (Mn).[citation needed]
This process yields approximately 92% recovery of the manganese. For further purification, the manganese can then be sent to an electrowinning facility.[52]
In 1972 the CIA’s Project Azorian, through billionaire Howard Hughes, commissioned the ship Hughes Glomar Explorer with the cover story of harvesting manganese nodules from the sea floor.[53] That triggered a rush of activity to collect manganese nodules, which was not actually practical. The real mission of Hughes Glomar Explorer was to raise a sunken Soviet submarine, the K-129, with the goal of retrieving Soviet code books.[54]
An abundant resource of manganese in the form of Mn nodules found on the ocean floor.[55][56] These nodules, which are composed of 29% manganese,[57] are located along the ocean floor and the potential impact of mining these nodules is being researched. Physical, chemical, and biological environmental impacts can occur due to this nodule mining disturbing the seafloor and causing sediment plumes to form. This suspension includes metals and inorganic nutrients, which can lead to contamination of the near-bottom waters from dissolved toxic compounds. Mn nodules are also the grazing grounds, living space, and protection for endo- and epifaunal systems. When theses nodules are removed, these systems are directly affected. Overall, this can cause species to leave the area or completely die off.[58] Prior to the commencement of the mining itself, research is being conducted by United Nations affiliated bodies and state-sponsored companies in an attempt to fully understand environmental impacts in the hopes of mitigating these impacts.[59]
Oceanic environment[edit]
Many trace elements in the ocean come from metal-rich hydrothermal particles from hydrothermal vents.[60] Dissolved manganese (dMn) is found throughout the world’s oceans, 90% of which originates from hydrothermal vents.[61] Particulate Mn develops in buoyant plumes over an active vent source, while the dMn behaves conservatively.[60] Mn concentrations vary between the water columns of the ocean. At the surface, dMn is elevated due to input from external sources such as rivers, dust, and shelf sediments. Coastal sediments normally have lower Mn concentrations, but can increase due to anthropogenic discharges from industries such as mining and steel manufacturing, which enter the ocean from river inputs. Surface dMn concentrations can also be elevated biologically through photosynthesis and physically from coastal upwelling and wind-driven surface currents. Internal cycling such as photo-reduction from UV radiation can also elevate levels by speeding up the dissolution of Mn-oxides and oxidative scavenging, preventing Mn from sinking to deeper waters.[62] Elevated levels at mid-depths can occur near mid-ocean ridges and hydrothermal vents. The hydrothermal vents release dMn enriched fluid into the water. The dMn can then travel up to 4,000 km due to the microbial capsules present, preventing exchange with particles, lowing the sinking rates. Dissolved Mn concentrations are even higher when oxygen levels are low. Overall, dMn concentrations are normally higher in coastal regions and decrease when moving offshore.[62]
Soils[edit]
Manganese occurs in soils in three oxidation states: the divalent cation, Mn2+ and as brownish-black oxides and hydroxides containing Mn (III,IV), such as MnOOH and MnO2. Soil pH and oxidation-reduction conditions affect which of these three forms of Mn is dominant in a given soil. At pH values less than 6 or under anaerobic conditions, Mn(II) dominates, while under more alkaline and aerobic conditions, Mn(III,IV) oxides and hydroxides predominate. These effects of soil acidity and aeration state on the form of Mn can be modified or controlled by microbial activity. Microbial respiration can cause both the oxidation of Mn2+ to the oxides, and it can cause reduction of the oxides to the divalent cation.[63]
The Mn(III,IV) oxides exist as brownish-black stains and small nodules on sand, silt, and clay particles. These surface coatings on other soil particles have high surface area and carry negative charge. The charged sites can adsorb and retain various cations, especially heavy metals (e.g., Cr3+, Cu2+, Zn2+, and Pb2+). In addition, the oxides can adsorb organic acids and other compounds. The adsorption of the metals and organic compounds can then cause them to be oxidized while the Mn(III,IV) oxides are reduced to Mn2+ (e.g., Cr3+ to Cr(VI) and colorless hydroquinone to tea-colored quinone polymers).[64]
Applications[edit]
Manganese has no satisfactory substitute in its major applications in metallurgy.[44] In minor applications (e.g., manganese phosphating), zinc and sometimes vanadium are viable substitutes.
Steel[edit]
Manganese is essential to iron and steel production by virtue of its sulfur-fixing, deoxidizing, and alloying properties, as first recognized by the British metallurgist Robert Forester Mushet (1811–1891) who, in 1856, introduced the element, in the form of Spiegeleisen, into steel for the specific purpose of removing excess dissolved oxygen, sulfur, and phosphorus in order to improve its malleability. Steelmaking,[65] including its ironmaking component, has accounted for most manganese demand, presently in the range of 85% to 90% of the total demand.[51] Manganese is a key component of low-cost stainless steel.[66][67] Often ferromanganese (usually about 80% manganese) is the intermediate in modern processes.
Small amounts of manganese improve the workability of steel at high temperatures by forming a high-melting sulfide and preventing the formation of a liquid iron sulfide at the grain boundaries. If the manganese content reaches 4%, the embrittlement of the steel becomes a dominant feature. The embrittlement decreases at higher manganese concentrations and reaches an acceptable level at 8%. Steel containing 8 to 15% of manganese has a high tensile strength of up to 863 MPa.[68][69] Steel with 12% manganese was discovered in 1882 by Robert Hadfield and is still known as Hadfield steel (mangalloy). It was used for British military steel helmets and later by the U.S. military.[70]
Aluminium alloys[edit]
Manganese is used in production of alloys with aluminium. Aluminium with roughly 1.5% manganese has increased resistance to corrosion through grains that absorb impurities which would lead to galvanic corrosion.[71] The corrosion-resistant aluminium alloys 3004 and 3104 (0.8 to 1.5% manganese) are used for most beverage cans.[72] Before 2000, more than 1.6 million tonnes of those alloys were used; at 1% manganese, this consumed 16,000 tonnes of manganese.[failed verification][72]
Batteries[edit]
Manganese(IV) oxide was used in the original type of dry cell battery as an electron acceptor from zinc, and is the blackish material in carbon–zinc type flashlight cells. The manganese dioxide is reduced to the manganese oxide-hydroxide MnO(OH) during discharging, preventing the formation of hydrogen at the anode of the battery.[73]
- MnO2 + H2O + e− → MnO(OH) + OH−
The same material also functions in newer alkaline batteries (usually battery cells), which use the same basic reaction, but a different electrolyte mixture. In 2002, more than 230,000 tons of manganese dioxide was used for this purpose.[42][73]
World-War-II-era 5-cent coin (1942-5 identified by mint mark P, D or S above dome) made from a 56% copper-35% silver-9% manganese alloy
Resistors[edit]
Copper alloys of manganese, such as Manganin, are commonly found in metal element shunt resistors used for measuring relatively large amounts of current. These alloys have very low temperature coefficient of resistance and are resistant to sulfur. This makes the alloys particularly useful in harsh automotive and industrial environments.[74]
Niche[edit]
Methylcyclopentadienyl manganese tricarbonyl is an additive in some unleaded gasoline to boost octane rating and reduce engine knocking.[citation needed]
Manganese(IV) oxide (manganese dioxide, MnO2) is used as a reagent in organic chemistry for the oxidation of benzylic alcohols (where the hydroxyl group is adjacent to an aromatic ring). Manganese dioxide has been used since antiquity to oxidize and neutralize the greenish tinge in glass from trace amounts of iron contamination.[37] MnO2 is also used in the manufacture of oxygen and chlorine and in drying black paints. In some preparations, it is a brown pigment for paint and is a constituent of natural umber.[citation needed]
Tetravalent manganese is used as an activator in red-emitting phosphors. While many compounds are known which show luminescence,[75] the majority are not used in commercial application due to low efficiency or deep red emission.[76][77] However, several Mn4+ activated fluorides were reported as potential red-emitting phosphors for warm-white LEDs.[78][79] But to this day, only K2SiF6:Mn4+ is commercially available for use in warm-white LEDs.[80]
The metal is occasionally used in coins; until 2000, the only United States coin to use manganese was the «wartime» nickel from 1942 to 1945.[81] An alloy of 75% copper and 25% nickel was traditionally used for the production of nickel coins. However, because of shortage of nickel metal during the war, it was substituted by more available silver and manganese, thus resulting in an alloy of 56% copper, 35% silver and 9% manganese. Since 2000, dollar coins, for example the Sacagawea dollar and the Presidential $1 coins, are made from a brass containing 7% of manganese with a pure copper core.[82] In both cases of nickel and dollar, the use of manganese in the coin was to duplicate the electromagnetic properties of a previous identically sized and valued coin in the mechanisms of vending machines. In the case of the later U.S. dollar coins, the manganese alloy was intended to duplicate the properties of the copper/nickel alloy used in the previous Susan B. Anthony dollar.
Manganese compounds have been used as pigments and for the coloring of ceramics and glass. The brown color of ceramic is sometimes the result of manganese compounds.[83] In the glass industry, manganese compounds are used for two effects. Manganese(III) reacts with iron(II) to reduce strong green color in glass by forming less-colored iron(III) and slightly pink manganese(II), compensating for the residual color of the iron(III).[37] Larger quantities of manganese are used to produce pink colored glass. In 2009, Professor Mas Subramanian and associates at Oregon State University discovered that manganese can be combined with yttrium and indium to form an intensely blue, non-toxic, inert, fade-resistant pigment, YInMn blue, the first new blue pigment discovered in 200 years.[citation needed]
Biological role[edit]
Reactive center of arginase with boronic acid inhibitor – the manganese atoms are shown in yellow.
Biochemistry[edit]
The classes of enzymes that have manganese cofactors include oxidoreductases, transferases, hydrolases, lyases, isomerases and ligases. Other enzymes containing manganese are arginase and Mn-containing superoxide dismutase (Mn-SOD). Also the enzyme class of reverse transcriptases of many retroviruses (though not lentiviruses such as HIV) contains manganese. Manganese-containing polypeptides are the diphtheria toxin, lectins and integrins.[84]
Biological role in humans[edit]
Manganese is an essential human dietary element. It is present as a coenzyme in several biological processes, which include macronutrient metabolism, bone formation, and free radical defense systems. It is a critical component in dozens of proteins and enzymes.[3] The human body contains about 12 mg of manganese, mostly in the bones. The soft tissue remainder is concentrated in the liver and kidneys.[4] In the human brain, the manganese is bound to manganese metalloproteins, most notably glutamine synthetase in astrocytes.[85]
Nutrition[edit]
| Males | Females | ||
|---|---|---|---|
| Age | AI (mg/day) | Age | AI (mg/day) |
| 1–3 | 1.2 | 1–3 | 1.2 |
| 4–8 | 1.5 | 4–8 | 1.5 |
| 9–13 | 1.9 | 9–13 | 1.6 |
| 14–18 | 2.2 | 14–18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| pregnant: 2 | |||
| lactating: 2.6 |
The U.S. Institute of Medicine (IOM) updated Estimated Average Requirements (EARs) and Recommended Dietary Allowances (RDAs) for minerals in 2001. For manganese there was not sufficient information to set EARs and RDAs, so needs are described as estimates for Adequate Intakes (AIs). As for safety, the IOM sets Tolerable upper intake levels (ULs) for vitamins and minerals when evidence is sufficient. In the case of manganese the adult UL is set at 11 mg/day. Collectively the EARs, RDAs, AIs and ULs are referred to as Dietary Reference Intakes (DRIs).[86] Manganese deficiency is rare.[87]
The European Food Safety Authority (EFSA) refers to the collective set of information as Dietary Reference Values, with Population Reference Intake (PRI) instead of RDA, and Average Requirement instead of EAR. AI and UL defined the same as in United States. For people ages 15 and older the AI is set at 3.0 mg/day. AIs for pregnancy and lactation is 3.0 mg/day. For children ages 1–14 years the AIs increase with age from 0.5 to 2.0 mg/day. The adult AIs are higher than the U.S. RDAs.[88] The EFSA reviewed the same safety question and decided that there was insufficient information to set a UL.[89]
For U.S. food and dietary supplement labeling purposes the amount in a serving is expressed as a percent of Daily Value (%DV). For manganese labeling purposes 100% of the Daily Value was 2.0 mg, but as of 27 May 2016 it was revised to 2.3 mg to bring it into agreement with the RDA.[90][91] A table of the old and new adult daily values is provided at Reference Daily Intake.
Excessive exposure or intake may lead to a condition known as manganism, a neurodegenerative disorder that causes dopaminergic neuronal death and symptoms similar to Parkinson’s disease.[4][92]
Deficiency[edit]
Manganese deficiency in humans, which is rare, results in a number of medical problems. A deficiency of manganese causes skeletal deformation in animals and inhibits the production of collagen in wound healing.[citation needed]
Toxicity in marine life[edit]
Many enzymatic systems need Mn to function, but in high levels, Mn can become toxic. One environmental reason Mn levels can increase in seawater is when hypoxic periods occur.[93] Since 1990 there have been reports of Mn accumulation in marine organisms including fish, crustaceans, mollusks, and echinoderms. Specific tissues are targets in different species, including the gills, brain, blood, kidney, and liver/hepatopancreas. Physiological effects have been reported in these species. Mn can affect the renewal of immunocytes and their functionality, such as phagocytosis and activation of pro-phenoloxidase, suppressing the organisms’ immune systems. This causes the organisms to be more susceptible to infections. As climate change occurs, pathogen distributions increase, and in order for organisms to survive and defend themselves against these pathogens, they need a healthy, strong immune system. If their systems are compromised from high Mn levels, they will not be able to fight off these pathogens and die.[61]
Biological role in bacteria[edit]
Mn-SOD is the type of SOD present in eukaryotic mitochondria, and also in most bacteria (this fact is in keeping with the bacterial-origin theory of mitochondria). The Mn-SOD enzyme is probably one of the most ancient, for nearly all organisms living in the presence of oxygen use it to deal with the toxic effects of superoxide (O−
2), formed from the 1-electron reduction of dioxygen. The exceptions, which are all bacteria, include Lactobacillus plantarum and related lactobacilli, which use a different nonenzymatic mechanism with manganese (Mn2+) ions complexed with polyphosphate, suggesting a path of evolution for this function in aerobic life.[citation needed]
Biological role in plants[edit]
Manganese is also important in photosynthetic oxygen evolution in chloroplasts in plants. The oxygen-evolving complex (OEC) is a part of photosystem II contained in the thylakoid membranes of chloroplasts; it is responsible for the terminal photooxidation of water during the light reactions of photosynthesis, and has a metalloenzyme core containing four atoms of manganese.[94][95] To fulfill this requirement, most broad-spectrum plant fertilizers contain manganese.[citation needed]
Precautions[edit]
| Hazards | |
|---|---|
| GHS labelling: | |
|
Hazard statements |
H401 |
|
Precautionary statements |
P273, P501[96] |
| NFPA 704 (fire diamond) |
0 0 0 |
Manganese compounds are less toxic than those of other widespread metals, such as nickel and copper.[97] However, exposure to manganese dusts and fumes should not exceed the ceiling value of 5 mg/m3 even for short periods because of its toxicity level.[98] Manganese poisoning has been linked to impaired motor skills and cognitive disorders.[99]
Permanganate exhibits a higher toxicity than manganese(II) compounds. The fatal dose is about 10 g, and several fatal intoxications have occurred. The strong oxidative effect leads to necrosis of the mucous membrane. For example, the esophagus is affected if the permanganate is swallowed. Only a limited amount is absorbed by the intestines, but this small amount shows severe effects on the kidneys and on the liver.[100][101]
Manganese exposure in United States is regulated by the Occupational Safety and Health Administration (OSHA).[102] People can be exposed to manganese in the workplace by breathing it in or swallowing it. OSHA has set the legal limit (permissible exposure limit) for manganese exposure in the workplace as 5 mg/m3 over an 8-hour workday. The National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 1 mg/m3 over an 8-hour workday and a short term limit of 3 mg/m3. At levels of 500 mg/m3, manganese is immediately dangerous to life and health.[103]
Generally, exposure to ambient Mn air concentrations in excess of 5 μg Mn/m3 can lead to Mn-induced symptoms. Increased ferroportin protein expression in human embryonic kidney (HEK293) cells is associated with decreased intracellular Mn concentration and attenuated cytotoxicity, characterized by the reversal of Mn-reduced glutamate uptake and diminished lactate dehydrogenase leakage.[104]
Environmental health concerns[edit]
In drinking water[edit]
Waterborne manganese has a greater bioavailability than dietary manganese. According to results from a 2010 study,[105] higher levels of exposure to manganese in drinking water are associated with increased intellectual impairment and reduced intelligence quotients in school-age children. It is hypothesized that long-term exposure due to inhaling the naturally occurring manganese in shower water puts up to 8.7 million Americans at risk.[106] However, data indicates that the human body can recover from certain adverse effects of overexposure to manganese if the exposure is stopped and the body can clear the excess.[107]
In gasoline[edit]
Methylcyclopentadienyl manganese tricarbonyl (MMT) is a gasoline additive used to replace lead compounds for unleaded gasolines to improve the octane rating of low octane petroleum distillates. It reduces engine knock agent through the action of the carbonyl groups. Fuels containing manganese tend to form manganese carbides, which damage exhaust valves. Compared to 1953, levels of manganese in air have dropped.[108]
In tobacco smoke[edit]
The tobacco plant readily absorbs and accumulates heavy metals such as manganese from the surrounding soil into its leaves. These are subsequently inhaled during tobacco smoking.[109] While manganese is a constituent of tobacco smoke,[110] studies have largely concluded that concentrations are not hazardous for human health.[111]
Role in neurological disorders[edit]
Manganism[edit]
Manganese overexposure is most frequently associated with manganism, a rare neurological disorder associated with excessive manganese ingestion or inhalation. Historically, persons employed in the production or processing of manganese alloys[112][113] have been at risk for developing manganism; however, current health and safety regulations protect workers in developed nations.[102] The disorder was first described in 1837 by British academic John Couper, who studied two patients who were manganese grinders.[40]
Manganism is a biphasic disorder. In its early stages, an intoxicated person may experience depression, mood swings, compulsive behaviors, and psychosis. Early neurological symptoms give way to late-stage manganism, which resembles Parkinson’s disease. Symptoms include weakness, monotone and slowed speech, an expressionless face, tremor, forward-leaning gait, inability to walk backwards without falling, rigidity, and general problems with dexterity, gait and balance.[40][114] Unlike Parkinson’s disease, manganism is not associated with loss of the sense of smell and patients are typically unresponsive to treatment with L-DOPA.[115] Symptoms of late-stage manganism become more severe over time even if the source of exposure is removed and brain manganese levels return to normal.[114]
Chronic manganese exposure has been shown to produce a parkinsonism-like illness characterized by movement abnormalities.[116] This condition is not responsive to typical therapies used in the treatment of PD, suggesting an alternative pathway than the typical dopaminergic loss within the substantia nigra.[116] Manganese may accumulate in the basal ganglia, leading to the abnormal movements.[117] A mutation of the SLC30A10 gene, a manganese efflux transporter necessary for decreasing intracellular Mn, has been linked with the development of this Parkinsonism-like disease.[118] The Lewy bodies typical to PD are not seen in Mn-induced parkinsonism.[117]
Animal experiments have given the opportunity to examine the consequences of manganese overexposure under controlled conditions. In (non-aggressive) rats, manganese induces mouse-killing behavior.[119]
Childhood developmental disorders[edit]
Several recent studies attempt to examine the effects of chronic low-dose manganese overexposure on child development. The earliest study was conducted in the Chinese province of Shanxi. Drinking water there had been contaminated through improper sewage irrigation and contained 240–350 μg Mn/L. Although Mn concentrations at or below 300 μg Mn/L were considered safe at the time of the study by the US EPA and 400 μg Mn/L by the World Health Organization, the 92 children sampled (between 11 and 13 years of age) from this province displayed lower performance on tests of manual dexterity and rapidity, short-term memory, and visual identification, compared to children from an uncontaminated area. More recently, a study of 10-year-old children in Bangladesh showed a relationship between Mn concentration in well water and diminished IQ scores. A third study conducted in Quebec examined school children between the ages of 6 and 15 living in homes that received water from a well containing 610 μg Mn/L; controls lived in homes that received water from a 160 μg Mn/L well. Children in the experimental group showed increased hyperactive and oppositional behavior.[105]
The current maximum safe concentration under EPA rules is 50 μg Mn/L.[120]
Neurodegenerative diseases[edit]
A protein called DMT1 is the major transporter in manganese absorption from the intestine, and may be the major transporter of manganese across the blood–brain barrier. DMT1 also transports inhaled manganese across the nasal epithelium. The proposed mechanism for manganese toxicity is that dysregulation leads to oxidative stress, mitochondrial dysfunction, glutamate-mediated excitotoxicity, and aggregation of proteins.[121]
See also[edit]
- Manganese exporter, membrane transport protein
- List of countries by manganese production
- Parkerizing
References[edit]
- ^ «Standard Atomic Weights: Manganese». CIAAW. 2017.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b Erikson, Keith M.; Ascher, Michael (2019). «Chapter 10. Manganese: Its Role in Disease and Health». In Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O.; Carver, Peggy L. (eds.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Metal Ions in Life Sciences. Vol. 19. Berlin: de Gruyter GmbH. pp. 253–266. doi:10.1515/9783110527872-016. ISBN 978-3-11-052691-2. PMID 30855111. S2CID 73725546.
- ^ a b c d e f Emsley, John (2001). «Manganese». Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford, UK: Oxford University Press. pp. 249–253. ISBN 978-0-19-850340-8.
- ^ Roth, Jerome; Ponzoni, Silvia; Aschner, Michael (2013). «Chapter 6 Manganese Homeostasis and Transport». In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 169–201. doi:10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5560-4. PMC 6542352. PMID 23595673. Electronic-book ISBN 978-94-007-5561-1.
- ^ a b c d Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). «Mangan». Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 1110–1117. ISBN 978-3-11-007511-3.
- ^ Lide, David R. (2004). Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics. CRC press. ISBN 978-0-8493-0485-9. Archived from the original on 17 December 2019. Retrieved 7 September 2019.
- ^ a b Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ Clery, Daniel (4 June 2020). «The galaxy’s brightest explosions go nuclear with an unexpected trigger: pairs of dead stars». Science. Retrieved 26 July 2021.
- ^ Schaefer, Jeorg; Faestermann, Thomas; Herzog, Gregory F.; Knie, Klaus; Korschinek, Gunther; Masarik, Jozef; Meier, Astrid; Poutivtsev, Michail; Rugel, Georg; Schlüchter, Christian; Serifiddin, Feride; Winckler, Gisela (2006). «Terrestrial manganese-53 – A new monitor of Earth surface processes». Earth and Planetary Science Letters. 251 (3–4): 334–345. Bibcode:2006E&PSL.251..334S. doi:10.1016/j.epsl.2006.09.016.
- ^ Birck, J.; Rotaru, M.; Allègre, C. (1999). «53Mn-53Cr evolution of the early solar system». Geochimica et Cosmochimica Acta. 63 (23–24): 4111–4117. Bibcode:1999GeCoA..63.4111B. doi:10.1016/S0016-7037(99)00312-9.
- ^ Lugmair, G.; Shukolyukov, A. (1998). «Early solar system timescales according to 53Mn-53Cr systematics». Geochimica et Cosmochimica Acta. 62 (16): 2863–2886. Bibcode:1998GeCoA..62.2863L. doi:10.1016/S0016-7037(98)00189-6.
- ^ Shukolyukov, Alexander; Lugmair, Günter W. (2000). «On The 53Mn Heterogeneity In The Early Solar System». Space Science Reviews. 92: 225–236. Bibcode:2000SSRv…92..225S. doi:10.1023/A:1005243228503.
- ^ Trinquier, A.; Birck, J.; Allègre, C.; Göpel, C.; Ulfbeck, D. (2008). «53Mn–53Cr systematics of the early Solar System revisited». Geochimica et Cosmochimica Acta. 72 (20): 5146–5163. Bibcode:2008GeCoA..72.5146T. doi:10.1016/j.gca.2008.03.023.
- ^ a b c Young, D.A. (1975). «Phase diagrams of the elements». International Nuclear Information System. LNL: 15. Retrieved 30 January 2023.
- ^ a b Dhananjayan, N.; Banerjee, T. (1969). Crystallographic modifications of manganese and their transformation characteristics. Chapter 1 of: Structure of Electro-Deposited Manganese. CSIR-NML. pp. 3–28.
- ^ Kemmitt, R. D. W.; Peacock, R. D. (1973). The Chemistry of Manganese, Technetium and Rhenium. Pergamon Texts in Inorganic Chemistry. Saint Louis: Elsevier Science. p. 778. ISBN 978-1-4831-3806-0. OCLC 961064866.
- ^ Bradley, A.J.; Thewlis, J. (1927). «The crystal structure of α-manganese». Proceedings of the Royal Society of London, Series A. 115 (771): 456–471. Bibcode:1927RSPSA.115..456B. doi:10.1098/rspa.1927.0103. ISSN 0950-1207.
- ^ Lawson, A. C.; Larson, Allen C.; Aronson, M. C.; et al. (1994). «Magnetic and crystallographic order in α‐manganese». J. Appl. Phys. 76 (10): 7049–7051. Bibcode:1994JAP….76.7049L. doi:10.1063/1.358024. ISSN 0021-8979.
- ^ a b Prior, Timothy J; Nguyen-Manh, Duc; Couper, Victoria J; Battle, Peter D (2004). «Ferromagnetism in the beta-manganese structure: Fe1.5Pd0.5Mo3N». Journal of Physics: Condensed Matter. 16 (13): 2273–2281. Bibcode:2004JPCM…16.2273P. doi:10.1088/0953-8984/16/13/008. ISSN 0953-8984. S2CID 250784683.
- ^ Funahashi, S.; Kohara, T. (1984). «Neutron diffuse scattering in β‐manganese». J. Appl. Phys. 55 (6): 2048–2050. Bibcode:1984JAP….55.2048F. doi:10.1063/1.333561. ISSN 0021-8979.
- ^ a b c Duschanek, H.; Mohn, P.; Schwarz, K. (1989). «Antiferromagnetic and ferromagnetic gamma-manganese generalisation of the fixed-spin-moment method». Physica B: Condensed Matter. 161 (1–3): 139–142. doi:10.1016/0921-4526(89)90120-8. ISSN 0921-4526.
- ^ Bacon, G E; Cowlam, N (1970). «A study of some alloys of gamma -manganese by neutron diffraction». Journal of Physics C: Solid State Physics. 3 (3): 675–686. Bibcode:1970JPhC….3..675B. doi:10.1088/0022-3719/3/3/023. ISSN 0022-3719.
- ^ «Ch. 20». Shriver and Atkins’ Inorganic Chemistry. Oxford University Press. 2010. ISBN 978-0-19-923617-6.
- ^ Luft, J. H. (1956). «Permanganate – a new fixative for electron microscopy». Journal of Biophysical and Biochemical Cytology. 2 (6): 799–802. doi:10.1083/jcb.2.6.799. PMC 2224005. PMID 13398447.
- ^ Man, Wai-Lun; Lam, William W. Y.; Lau, Tai-Chu (2014). «Reactivity of Nitrido Complexes of Ruthenium(VI), Osmium(VI), and Manganese(V) Bearing Schiff Base and Simple Anionic Ligands». Accounts of Chemical Research. 47 (2): 427–439. doi:10.1021/ar400147y. PMID 24047467.
- ^ Goldberg, David P. (2007). «Corrolazines: New Frontiers in High-Valent Metalloporphyrinoid Stability and Reactivity». Accounts of Chemical Research. 40 (7): 626–634. doi:10.1021/ar700039y. PMID 17580977.
- ^ Yano, Junko; Yachandra, Vittal (2014). «Mn4Ca Cluster in Photosynthesis: Where and How Water is Oxidized to Dioxygen». Chemical Reviews. 114 (8): 4175–4205. doi:10.1021/cr4004874. PMC 4002066. PMID 24684576.
- ^ Rayner-Canham, Geoffrey and Overton, Tina (2003) Descriptive Inorganic Chemistry, Macmillan, p. 491, ISBN 0-7167-4620-4.
- ^ Schmidt, Max (1968). «VII. Nebengruppe». Anorganische Chemie II (in German). Wissenschaftsverlag. pp. 100–109.
- ^ Girolami, Gregory S.; Wilkinson, Geoffrey; Thornton-Pett, Mark; Hursthouse, Michael B. (1983). «Hydrido, alkyl, and ethylene 1,2-bis(dimethylphosphino)ethane complexes of manganese and the crystal structures of MnBr2(dmpe)2, [Mn(AlH4)(dmpe)2]2 and MnMe2(dmpe)2». Journal of the American Chemical Society. 105 (22): 6752–6753. doi:10.1021/ja00360a054.
- ^ languagehat (28 May 2005). «MAGNET». languagehat.com. Retrieved 18 June 2020.
- ^ Calvert, J. B. (24 January 2003). «Chromium and Manganese». Archived from the original on 31 December 2016. Retrieved 10 December 2022.
- ^
- ^ Chalmin, E.; Vignaud, C.; Salomon, H.; Farges, F.; Susini, J.; Menu, M. (2006). «Minerals discovered in paleolithic black pigments by transmission electron microscopy and micro-X-ray absorption near-edge structure» (PDF). Applied Physics A. 83 (12): 213–218. Bibcode:2006ApPhA..83..213C. doi:10.1007/s00339-006-3510-7. hdl:2268/67458. S2CID 9221234.
- ^ Sayre, E. V.; Smith, R. W. (1961). «Compositional Categories of Ancient Glass». Science. 133 (3467): 1824–1826. Bibcode:1961Sci…133.1824S. doi:10.1126/science.133.3467.1824. PMID 17818999. S2CID 25198686.
- ^ a b c Mccray, W. Patrick (1998). «Glassmaking in renaissance Italy: The innovation of venetian cristallo». JOM. 50 (5): 14–19. Bibcode:1998JOM….50e..14M. doi:10.1007/s11837-998-0024-0. S2CID 111314824.
- ^ Rancke-Madsen, E. (1975). «The Discovery of an Element». Centaurus. 19 (4): 299–313. Bibcode:1975Cent…19..299R. doi:10.1111/j.1600-0498.1975.tb00329.x.
- ^ Alessio, L.; Campagna, M.; Lucchini, R. (2007). «From lead to manganese through mercury: mythology, science, and lessons for prevention». American Journal of Industrial Medicine. 50 (11): 779–787. doi:10.1002/ajim.20524. PMID 17918211.
- ^ a b c Couper, John (1837). «On the effects of black oxide of manganese when inhaled into the lungs». Br. Ann. Med. Pharm. Vital. Stat. Gen. Sci. 1: 41–42.
- ^ Olsen, Sverre E.; Tangstad, Merete; Lindstad, Tor (2007). «History of omanganese». Production of Manganese Ferroalloys. Tapir Academic Press. pp. 11–12. ISBN 978-82-519-2191-6.
- ^ a b Preisler, Eberhard (1980). «Moderne Verfahren der Großchemie: Braunstein». Chemie in unserer Zeit (in German). 14 (5): 137–148. doi:10.1002/ciuz.19800140502.
- ^ Bhattacharyya, P. K.; Dasgupta, Somnath; Fukuoka, M.; Roy Supriya (1984). «Geochemistry of braunite and associated phases in metamorphosed non-calcareous manganese ores of India». Contributions to Mineralogy and Petrology. 87 (1): 65–71. Bibcode:1984CoMP…87…65B. doi:10.1007/BF00371403. S2CID 129495326.
- ^ a b c USGS Mineral Commodity Summaries 2009
- ^ Cook, Nigel J.; Ciobanu, Cristiana L.; Pring, Allan; Skinner, William; Shimizu, Masaaki; Danyushevsky, Leonid; Saini-Eidukat, Bernhardt; Melcher, Frank (2009). «Trace and minor elements in sphalerite: A LA-ICPMS study». Geochimica et Cosmochimica Acta. 73 (16): 4761–4791. Bibcode:2009GeCoA..73.4761C. doi:10.1016/j.gca.2009.05.045.
- ^ Wang, X; Schröder, HC; Wiens, M; Schlossmacher, U; Müller, WEG (2009). «Manganese/polymetallic nodules: micro-structural characterization of exolithobiontic- and endolithobiontic microbial biofilms by scanning electron microscopy». Micron. 40 (3): 350–358. doi:10.1016/j.micron.2008.10.005. PMID 19027306.
- ^ United Nations (1978). Manganese Nodules: Dimensions and Perspectives. Marine Geology. Natural Resources Forum Library. Vol. 41. Springer. p. 343. Bibcode:1981MGeol..41..343C. doi:10.1016/0025-3227(81)90092-X. ISBN 978-90-277-0500-6. OCLC 4515098.
- ^ «Manganese Mining in South Africa – Overview». MBendi Information Services. Archived from the original on 5 February 2016. Retrieved 10 December 2022.
- ^ Elliott, R; Coley, K; Mostaghel, S; Barati, M (2018). «Review of Manganese Processing for Production of TRIP/TWIP Steels, Part 1: Current Practice and Processing Fundamentals». JOM. 70 (5): 680–690. Bibcode:2018JOM….70e.680E. doi:10.1007/s11837-018-2769-4. S2CID 139950857.
- ^ Corathers, L. A.; Machamer, J. F. (2006). «Manganese». Industrial Minerals & Rocks: Commodities, Markets, and Uses (7th ed.). SME. pp. 631–636. ISBN 978-0-87335-233-8.
- ^ a b Zhang, Wensheng; Cheng, Chu Yong (2007). «Manganese metallurgy review. Part I: Leaching of ores/secondary materials and recovery of electrolytic/chemical manganese dioxide». Hydrometallurgy. 89 (3–4): 137–159. doi:10.1016/j.hydromet.2007.08.010.
- ^ Chow, Norman; Nacu, Anca; Warkentin, Doug; Aksenov, Igor & Teh, Hoe (2010). «The Recovery of Manganese from low grade resources: bench scale metallurgical test program completed» (PDF). Kemetco Research Inc. Archived from the original (PDF) on 2 February 2012.
- ^ «The CIA secret on the ocean floor». BBC News. 19 February 2018. Retrieved 3 May 2018.
- ^ «Project Azorian: The CIA’s Declassified History of the Glomar Explorer». National Security Archive at George Washington University. 12 February 2010. Retrieved 18 September 2013.
- ^ Hein, James R. (January 2016). Encyclopedia of Marine Geosciences — Manganese Nodules. Springer. pp. 408–412. Retrieved 2 February 2021.
- ^ Hoseinpour, Vahid; Ghaemi, Nasser (1 December 2018). «Green synthesis of manganese nanoparticles: Applications and future perspective–A review». Journal of Photochemistry and Photobiology B: Biology. 189: 234–243. doi:10.1016/j.jphotobiol.2018.10.022. PMID 30412855. S2CID 53248245. Retrieved 2 February 2021.
- ^ International Seabed Authority. «Polymetallic Nodules» (PDF). isa.org. International Seabed Authority. Retrieved 2 February 2021.
- ^ Oebius, Horst U; Becker, Hermann J; Rolinski, Susanne; Jankowski, Jacek A (January 2001). «Parametrization and evaluation of marine environmental impacts produced by deep-sea manganese nodule mining». Deep Sea Research Part II: Topical Studies in Oceanography. 48 (17–18): 3453–3467. Bibcode:2001DSRII..48.3453O. doi:10.1016/s0967-0645(01)00052-2. ISSN 0967-0645.
- ^ Thompson, Kirsten F.; Miller, Kathryn A.; Currie, Duncan; Johnston, Paul; Santillo, David (2018). «Seabed Mining and Approaches to Governance of the Deep Seabed». Frontiers in Marine Science. 5. doi:10.3389/fmars.2018.00480. S2CID 54465407.
- ^ a b Ray, Durbar; Babu, E. V. S. S. K.; Surya Prakash, L. (1 January 2017). «Nature of Suspended Particles in Hydrothermal Plume at 3°40’N Carlsberg Ridge:A Comparison with Deep Oceanic Suspended Matter». Current Science. 112 (1): 139. doi:10.18520/cs/v112/i01/139-146. ISSN 0011-3891.
- ^ a b Hernroth, Bodil; Tassidis, Helena; Baden, Susanne P. (March 2020). «Immunosuppression of aquatic organisms exposed to elevated levels of manganese: From global to molecular perspective». Developmental & Comparative Immunology. 104: 103536. doi:10.1016/j.dci.2019.103536. ISSN 0145-305X. PMID 31705914. S2CID 207935992.
- ^ a b Sim, Nari; Orians, Kristin J. (October 2019). «Annual variability of dissolved manganese in Northeast Pacific along Line-P: 2010–2013». Marine Chemistry. 216: 103702. doi:10.1016/j.marchem.2019.103702. ISSN 0304-4203. S2CID 203151735.
- ^ Bartlett, Richmond; Ross, Donald (2005). «Chemistry of Redox Processes in Soils». In Tabatabai, M.A.; Sparks, D.L. (eds.). Chemical Processes in Soils. SSSA Book Series, no. 8. Madison, Wisconsin: Soil Science Society of America. pp. 461–487. LCCN 2005924447.
- ^ Dixon, Joe B.; White, G. Norman (2002). «Manganese Oxides». In Dixon, J.B.; Schulze, D.G. (eds.). Soil Mineralogy with Environmental Applications. SSSA Book Series no. 7. Madison, Wisconsin: Soil Science Society of America. pp. 367–386. LCCN 2002100258.
- ^ Verhoeven, John D. (2007). Steel metallurgy for the non-metallurgist. Materials Park, Ohio: ASM International. pp. 56–57. ISBN 978-0-87170-858-8.
- ^ Manganese USGS 2006
- ^ Dastur, Y. N.; Leslie, W. C. (1981). «Mechanism of work hardening in Hadfield manganese steel». Metallurgical Transactions A. 12 (5): 749–759. Bibcode:1981MTA….12..749D. doi:10.1007/BF02648339. S2CID 136550117.
- ^ Stansbie, John Henry (2007). Iron and Steel. Read Books. pp. 351–352. ISBN 978-1-4086-2616-0.
- ^ Brady, George S.; Clauser, Henry R.; Vaccari. John A. (2002). Materials Handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors. New York, NY: McGraw-Hill. pp. 585–587. ISBN 978-0-07-136076-0.
- ^ Tweedale, Geoffrey (1985). «Sir Robert Abbott Hadfield F.R.S. (1858–1940), and the Discovery of Manganese Steel Geoffrey Tweedale». Notes and Records of the Royal Society of London. 40 (1): 63–74. doi:10.1098/rsnr.1985.0004. JSTOR 531536.
- ^ «Chemical properties of 2024 aluminum allow». Metal Suppliers Online, LLC. Retrieved 30 April 2009.
- ^ a b Kaufman, John Gilbert (2000). «Applications for Aluminium Alloys and Tempers». Introduction to aluminum alloys and tempers. ASM International. pp. 93–94. ISBN 978-0-87170-689-8.
- ^ a b Dell, R. M. (2000). «Batteries fifty years of materials development». Solid State Ionics. 134 (1–2): 139–158. doi:10.1016/S0167-2738(00)00722-0.
- ^ «WSK1216» (PDF). vishay. Vishay Intertechnology. Retrieved 30 April 2022.
- ^ Chen, Daquin; Zhou, Yang; Zhong, Jiasong (2016). «A review on Mn4+ activators in solids for warm white light-emitting diodes». RSC Advances. 6 (89): 86285–86296. Bibcode:2016RSCAd…686285C. doi:10.1039/C6RA19584A.
- ^ Baur, Florian; Jüstel, Thomas (2016). «Dependence of the optical properties of Mn4+ activated A2Ge4O9 (A=K,Rb) on temperature and chemical environment». Journal of Luminescence. 177: 354–360. Bibcode:2016JLum..177..354B. doi:10.1016/j.jlumin.2016.04.046.
- ^ Jansen, T.; Gorobez, J.; Kirm, M.; Brik, M. G.; Vielhauer, S.; Oja, M.; Khaidukov, N. M.; Makhov, V. N.; Jüstel, T. (1 January 2018). «Narrow Band Deep Red Photoluminescence of Y2Mg3Ge3O12:Mn4+,Li+ Inverse Garnet for High Power Phosphor Converted LEDs». ECS Journal of Solid State Science and Technology. 7 (1): R3086–R3092. doi:10.1149/2.0121801jss. S2CID 103724310.
- ^ Jansen, Thomas; Baur, Florian; Jüstel, Thomas (2017). «Red emitting K2NbF7:Mn4+ and K2TaF7:Mn4+ for warm-white LED applications». Journal of Luminescence. 192: 644–652. Bibcode:2017JLum..192..644J. doi:10.1016/j.jlumin.2017.07.061.
- ^ Zhou, Zhi; Zhou, Nan; Xia, Mao; Yokoyama, Meiso; Hintzen, H. T. (Bert) (6 October 2016). «Research progress and application prospects of transition metal Mn4+-activated luminescent materials». Journal of Materials Chemistry C. 4 (39): 9143–9161. doi:10.1039/c6tc02496c.
- ^ «TriGain LED phosphor system using red Mn4+-doped complex fluorides» (PDF). GE Global Research. Retrieved 10 December 2022.
- ^ Kuwahara, Raymond T.; Skinner III, Robert B.; Skinner Jr., Robert B. (2001). «Nickel coinage in the United States». Western Journal of Medicine. 175 (2): 112–114. doi:10.1136/ewjm.175.2.112. PMC 1071501. PMID 11483555.
- ^ «Design of the Sacagawea dollar». United States Mint. Retrieved 4 May 2009.
- ^ Shepard, Anna Osler (1956). «Manganese and Iron–Manganese Paints». Ceramics for the Archaeologist. Carnegie Institution of Washington. pp. 40–42. ISBN 978-0-87279-620-1.
- ^ Rice, Derek B.; Massie, Allyssa A.; Jackson, Timothy A. (2017). «Manganese–Oxygen Intermediates in O–O Bond Activation and Hydrogen-Atom Transfer Reactions». Accounts of Chemical Research. 50 (11): 2706–2717. doi:10.1021/acs.accounts.7b00343. PMID 29064667.
- ^ Takeda, A. (2003). «Manganese action in brain function». Brain Research Reviews. 41 (1): 79–87. doi:10.1016/S0165-0173(02)00234-5. PMID 12505649. S2CID 1922613.
- ^ a b Institute of Medicine (US) Panel on Micronutrients (2001). «Manganese». Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium. National Academy Press. pp. 394–419. ISBN 978-0-309-07279-3. PMID 25057538.
- ^ See «Manganese». Micronutrient Information Center. Oregon State University Linus Pauling Institute. 23 April 2014.
- ^ «Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies» (PDF). 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ «Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982» (PDF).
- ^ «Daily Value Reference of the Dietary Supplement Label Database (DSLD)». Dietary Supplement Label Database (DSLD). Archived from the original on 7 April 2020. Retrieved 16 May 2020.
- ^ Silva Avila, Daiana; Luiz Puntel, Robson; Aschner, Michael (2013). «Chapter 7. Manganese in Health and Disease». In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 199–227. doi:10.1007/978-94-007-7500-8_7. ISBN 978-94-007-7499-5. PMC 6589086. PMID 24470093.
- ^ Hernroth, Bodil; Krång, Anna-Sara; Baden, Susanne (February 2015). «Bacteriostatic suppression in Norway lobster (Nephrops norvegicus) exposed to manganese or hypoxia under pressure of ocean acidification». Aquatic Toxicology. 159: 217–224. doi:10.1016/j.aquatox.2014.11.025. ISSN 0166-445X. PMID 25553539.
- ^ Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (May 2011). «Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å» (PDF). Nature. 473 (7345): 55–60. Bibcode:2011Natur.473…55U. doi:10.1038/nature09913. PMID 21499260. S2CID 205224374.
- ^ Dismukes, G. Charles; Willigen, Rogier T. van (2006). «Manganese: The Oxygen-Evolving Complex & Models». Manganese: The Oxygen-Evolving Complex & Models Based in part on the article Manganese: Oxygen-Evolving Complex & Models by Lars-Erik Andréasson & Tore Vänngård which appeared in the Encyclopedia of Inorganic Chemistry, First Edition, First Edition. Encyclopedia of Inorganic Chemistry. doi:10.1002/0470862106.ia128. ISBN 978-0470860786.
- ^ «Safety Data Sheet». Sigma-Aldrich. Retrieved 26 July 2021.
- ^ Hasan, Heather (2008). Manganese. The Rosen Publishing Group. p. 31. ISBN 978-1-4042-1408-8.
- ^ «Manganese Chemical Background». Metcalf Institute for Marine and Environmental Reporting University of Rhode Island. April 2006. Archived from the original on 28 August 2006. Retrieved 30 April 2008.
- ^ «Risk Assessment Information System Toxicity Summary for Manganese». Oak Ridge National Laboratory. Retrieved 23 April 2008.
- ^ Ong, K. L.; Tan, T. H.; Cheung, W. L. (1997). «Potassium permanganate poisoning – a rare cause of fatal self poisoning». Emergency Medicine Journal. 14 (1): 43–45. doi:10.1136/emj.14.1.43. PMC 1342846. PMID 9023625.
- ^ Young, R.; Critchley, J. A.; Young, K. K.; Freebairn, R. C.; Reynolds, A. P.; Lolin, Y. I. (1996). «Fatal acute hepatorenal failure following potassium permanganate ingestion». Human & Experimental Toxicology. 15 (3): 259–61. doi:10.1177/096032719601500313. PMID 8839216. S2CID 8993404.
- ^ a b «Safety and Health Topics: Manganese Compounds (as Mn)». U.S. Occupational Safety and Health Administration.
- ^ «NIOSH Pocket Guide to Chemical Hazards – Manganese compounds and fume (as Mn)». Centers for Disease Control. Retrieved 19 November 2015.
- ^ Yin, Z.; Jiang, H.; Lee, E. S.; Ni, M.; Erikson, K. M.; Milatovic, D.; Bowman, A. B.; Aschner, M. (2010). «Ferroportin is a manganese-responsive protein that decreases manganese cytotoxicity and accumulation» (PDF). Journal of Neurochemistry. 112 (5): 1190–8. doi:10.1111/j.1471-4159.2009.06534.x. PMC 2819584. PMID 20002294.
- ^ a b Bouchard, M. F; Sauvé, S; Barbeau, B; Legrand, M; Bouffard, T; Limoges, E; Bellinger, D. C; Mergler, D (2011). «Intellectual impairment in school-age children exposed to manganese from drinking water». Environmental Health Perspectives. 119 (1): 138–143. doi:10.1289/ehp.1002321. PMC 3018493. PMID 20855239.
- ^ Barceloux, Donald; Barceloux, Donald (1999). «Manganese». Clinical Toxicology. 37 (2): 293–307. doi:10.1081/CLT-100102427. PMID 10382563.
- ^ Devenyi, A. G; Barron, T. F; Mamourian, A. C (1994). «Dystonia, hyperintense basal ganglia, and high whole blood manganese levels in Alagille’s syndrome». Gastroenterology. 106 (4): 1068–71. doi:10.1016/0016-5085(94)90769-2. PMID 8143974. S2CID 2711273.
- ^ Agency for Toxic Substances and Disease Registry (2012) 6. Potential for human exposure, in Toxicological Profile for Manganese, Atlanta, GA: U.S. Department of Health and Human Services.
- ^ Pourkhabbaz, A; Pourkhabbaz, H (2012). «Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues». Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). «Hazardous Compounds in Tobacco Smoke». International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. PMC 3084482. PMID 21556207.
- ^ Bernhard, David; Rossmann, Andrea; Wick, Georg (2005). «Metals in cigarette smoke». IUBMB Life. 57 (12): 805–9. doi:10.1080/15216540500459667. PMID 16393783. S2CID 35694266.
- ^ Baselt, R. (2008) Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, pp. 883–886, ISBN 0-9626523-7-7.
- ^ Normandin, Louise; Hazell, A. S. (2002). «Manganese neurotoxicity: an update of pathophysiologic mechanisms». Metabolic Brain Disease. 17 (4): 375–87. doi:10.1023/A:1021970120965. PMID 12602514. S2CID 23679769.
- ^ a b Cersosimo, M. G.; Koller, W.C. (2007). «The diagnosis of manganese-induced parkinsonism». NeuroToxicology. 27 (3): 340–346. doi:10.1016/j.neuro.2005.10.006. PMID 16325915.
- ^ Lu, C. S.; Huang, C.C; Chu, N.S.; Calne, D.B. (1994). «Levodopa failure in chronic manganism». Neurology. 44 (9): 1600–1602. doi:10.1212/WNL.44.9.1600. PMID 7936281. S2CID 38040913.
- ^ a b Guilarte TR, Gonzales KK (August 2015). «Manganese-Induced Parkinsonism Is Not Idiopathic Parkinson’s Disease: Environmental and Genetic Evidence». Toxicological Sciences (Review). 146 (2): 204–12. doi:10.1093/toxsci/kfv099. PMC 4607750. PMID 26220508.
- ^ a b Kwakye GF, Paoliello MM, Mukhopadhyay S, Bowman AB, Aschner M (July 2015). «Manganese-Induced Parkinsonism and Parkinson’s Disease: Shared and Distinguishable Features». Int J Environ Res Public Health (Review). 12 (7): 7519–40. doi:10.3390/ijerph120707519. PMC 4515672. PMID 26154659.
- ^ Peres TV, Schettinger MR, Chen P, Carvalho F, Avila DS, Bowman AB, Aschner M (November 2016). «Manganese-induced neurotoxicity: a review of its behavioral consequences and neuroprotective strategies». BMC Pharmacology & Toxicology (Review). 17 (1): 57. doi:10.1186/s40360-016-0099-0. PMC 5097420. PMID 27814772.
- ^ Lazrishvili, I.; et al. (2016). «Manganese loading induces mouse-killing behaviour in nonaggressive rats». Journal of Biological Physics and Chemistry. 16 (3): 137–141. doi:10.4024/31LA14L.jbpc.16.03.
- ^ «Drinking Water Contaminants». US EPA. Retrieved 2 February 2015.
- ^ Prabhakaran, K.; Ghosh, D.; Chapman, G.D.; Gunasekar, P.G. (2008). «Molecular mechanism of manganese exposure-induced dopaminergic toxicity». Brain Research Bulletin. 76 (4): 361–367. doi:10.1016/j.brainresbull.2008.03.004. ISSN 0361-9230. PMID 18502311. S2CID 206339744.
External links[edit]
- National Pollutant Inventory – Manganese and compounds Fact Sheet
- International Manganese Institute
- NIOSH Manganese Topic Page
- Manganese at The Periodic Table of Videos (University of Nottingham)
- All about Manganese Dendrites