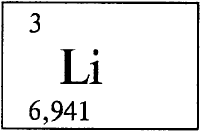Эфир в таблице Менделеева
Мировой эфир есть субстанция ВСЯКОГО химического элемента и значит — ВСЯКОГО вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.
Мировой эфир — это исток и венец всей подлинной Таблицы Менделеева, её начало и конец, — альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
В античной философии эфир (aithér-греч) наряду с землей, водой, воздухом и огнем — один из пяти элементов бытия (по Аристотелю) — пятая сущность (quinta essentia -лат.), понимаемая как тончайшая всепроникающая материя. В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство. Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
Предисловие.
У Менделеева было два фундаментальных научных открытия:
1 — Открытие Периодического закона в субстанции химии,
2 — Открытие взаимосвязи субстанции химии и субстанции Эфира, а именно: частицы Эфира формирует молекулы, ядра, электроны и т.д., но в химических реакциях не участвуют.
Эфир — частицы вещества размером ~ 10-100 метра (фактически — «первокирпичики» материи).
Факты. В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 — не видно, 2 — и не угадывается (из-за отсутствия нулевой группы).
Такой целенаправленный подлог сдерживает развитие прогресса цивилизации.
Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Результат. В школах и ВУЗах преподают обрезанную таблицу Менделеева.
Оценка ситуации. Таблица Менделеева без Эфира — то же самое, что человечество без детей — прожить можно, но развития и будущего не будет.
Резюме. Если враги человечества знания скрывают, то наша задача — эти знания раскрывать.
Вывод. В старой таблице Менделеева элементов меньше, а форсайта больше, чем в современной.
Заключение. Новый уровень возможен только при изменении информационного состояния общества.
Итог. Возврат к истинной таблице Менделеева — это уже вопрос не научный, а вопрос политический.
В чем же был основной политический смысл эйнштейновского учения?
Он состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира
. В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире — роль крови мировой экономики — их не вдохновляла.
Не вдохновляло это и прочих олигархов — угольных и стальных королей. Так финансовый магнат Морган моментально прекратил финансирование экспериментов Николы Теслы, когда тот вплотную подошел к беспроводной передаче энергии и извлечению энергии «из ниоткуда» — из мирового эфира. После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто — солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому
против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Один из первых ударов пришелся на таблицу Дмитрия Менделеева, в которой эфир стоял первым номером, именно размышления об эфире породили гениальное прозрение Менделеева — его периодическую таблицу элементов.
Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности»
(«Попытка химического понимания мирового эфира». 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
1 , , ,
Из комментариев:
Для химии современной периодической таблицы элементов достаточно.
Роль эфира может быть полезна в ядерных реакциях, но и это слишком не значительно.
Учёт влияния эфира наиболее близко в явлениях распада изотопов. Однако учёт этот чрезвычайно сложен и наличие закономерностей принимаются не всеми учёными.
Самое простое доказательство наличия эфира: Явление аннигиляции позитрон-электронной пары и возникновение этой пары из вакуума, а также невозможность поймать электрон в состоянии покоя. Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами — фононами в кристаллах.
Эфир — это дифференцированная материя, так сказать, атомы в разобранном состоянии или правильней сказать, элементарные частицы, из которых формируются будущие атомы. Поэтому ему нет места в таблице Менделеева, так как логика построения данной системы не предполагает включать в её состав не целостные структуры,которыми являются сами атомы. В противном случае, так можно и для кварков найти место, где-нибудь в минус первом периоде.
Сам эфир имеет более сложную многоуровневую структуру проявления в мировом бытии, нежели об этом знает современная наука. Как только она раскроет первые тайны этого неуловимого эфира, тогда и будут изобретены новые двигатели для всевозможных машин на абсолютно новых принципах.
Действительно,Тесла едва ли не единственный, кто был близок к разгадке тайны, так называемого эфира,но ему сознательно мешали осуществить свои замыслы. Вот так до сегодняшнего дня ещё не родился тот гений, который продолжит дело великого изобретателя и расскажет всем нам, что же на самом деле представляет из себя таинственный эфир и на какой пьедестал его можно будет поставить.
Эфир в таблице Менделеева
О
фициально преподаваемая в школах и ВУЗах таблица химических элементов Менделеева- фальсификат. Сам Менделеев в работе под названием «Попытка химического понимания мирового эфира» привёл несколько иную таблицу (Политехнический музей, Москва):
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание). Отличия видны: нулевая группа перенесена в 8-ю, а элемент легче водорода, с которой должна начинаться таблица и который условно назван Ньютонием (эфир),- вообще исключён.
Эта же таблица увековечена «кровавым тираном» тов. Сталиным в Санкт-Петербурге, Московский просп. 19. ВНИИМ им. Д. И. Менделеева (Всероссийский научно-исследовательский институт метрологии)
Памятник-таблица Периодическая система химических элементов Д.И. Менделеева выполнен мозаикой под руководством профессора Академии художеств В.А. Фролова (архитектурное оформление Кричевского). В основу памятника положена таблица из последнего прижизненного 8-го издания (1906 г.) Основ химии Д.И. Менделеева. Элементы, открытые при жизни Д.И. Менделеева обозначены красным цветом. Элементы, открытые с 1907 по 1934 гг. , обозначены синим цветом. Высота памятника-таблицы — 9 м. общая площадь 69 кв. м
Почему и как случилось, что нам столь открыто лгут?
Место и роль мирового эфира в истинной таблице Д.И. Менделеева
1. Suprema lex – salus populi
Многие слышали о Дмитрии Ивановиче Менделееве и об открытом им в 19-м веке (1869 г.) «Периодическом законе изменения свойств химических элементов по группам и рядам» (авторское название таблицы — «Периодическая система элементов по группам и рядам»).
Многие слышали также, что Д.И. Менделеев был организатором и бессменным руководителем (1869-1905 гг.) российского общественного научного объединения под названием «Русское Химическое Общество» (с 1872 года — «Русское Физико-Химическое Общество»), издававшее во всё время своего существования всемирно известный журнал ЖРФХО, вплоть до момента ликвидации Академией Наук СССР в 1930 году — и Общества, и его журнала.
Но мало тех, кто знает, что Д.И. Менделеев был одним из последних всемирно известных русских учёных конца 19-го века, кто отстаивал в мировой науке идею эфира как всемирной субстанциональной сущности, кто придавал ей фундаментальное научное и прикладное значение в раскрытии тайн Бытия и для улучшения народнохозяйственной жизни людей.
Ещё меньше тех, кто знает, что после скоропостижной (!!?) смерти Д.И. Менделеева (27.01.1907), признанного тогда выдающимся учёным всеми научными сообществами во всём мире кроме одной только Петербургской Академии Наук, его главное открытие — «Периодический закон» — было умышленно и повсеместно фальсифицировано мировой академической наукой.
И уж совсем мало тех, кто знает, что всё выше перечисленное связано воедино нитью жертвенного служения лучших представителей и носителей бессмертной Русской Физической Мысли благу народов, общественной пользе, вопреки нараставшей волне безответственности в высших слоях общества того времени.
В сущности, всестороннему развитию последнего тезиса и посвящена настоящая диссертация, ибо в подлинной науке любое пренебрежение существенными факторами всегда приводит к ложным результатам. Итак,- вопрос: почему учёные врут?
2. Psy-faktor: ni foi, ni loi
Это только сейчас, с конца 20-го века, общество начинает понимать (да и то робко) на практических примерах, что выдающийся и высококвалифицированный, но безответственный, циничный, безнравственный учёный с «мировым именем» не менее опасен для людей, чем выдающийся, но безнравственный политик, военный, юрист или в лучшем случае — «выдающийся» бандит с большой дороги.
Обществу внушили мысль, будто мировая академическая научная среда — это каста небожителей, монахов, святых отцов, которые дённо и нощно пекутся о благе народов. А простые смертные должны попросту смотреть в рот своим благодетелям, безропотно финансируя и реализуя все их “научные” прожекты, прогнозы и предписания по переустройству своей общественной и частной жизни.
На самом деле уголовно-преступного элемента в мировой научной среде ничуть не меньше, нежели в среде тех же политиков. Кроме того, — преступные, анти-общественные деяния политиков чаще всего видны сразу, а вот преступная и вредная, но «научно обоснованная» деятельность «видных» и «авторитетных» учёных распознаётся обществом далеко не сразу, а спустя годы, а то и десятилетия, на своей собственной «общественной шкуре».
Продолжим далее наше исследование этого чрезвычайно интересного (и засекреченного!) психофизиологического фактора научной деятельности (назовём его условно пси-фактором), в результате которого апостериори получается неожиданный (?!) отрицательный результат: «хотели как лучше для людей, а получилось как всегда, т.е. во вред». Ведь в науке отрицательный результат — это тоже результат, безусловно требующий всестороннего научного осмысления.
Рассматривая корреляцию между пси-фактором и основной целевой функцией (ОЦФ) государственного финансирующего органа, мы приходим к любопытному выводу: так называемая чистая, большая наука прошлых веков к настоящему моменту времени выродилась в касту неприкасаемых, т.е. в закрытую ложу придворных знахарей, блестяще освоивших науку обмана, блестяще владеющих наукой преследования инакомыслящих и наукой прислужничества перед своими власть имущими финансистами.
При этом необходимо иметь в виду, что, во-первых, во всех т.н. «цивилизованных странах» их т.н. «национальные академии наук» формально имеют статус государственных организаций с правами ведущего научного экспертного органа соответствующего правительства. Во-вторых, все эти национальные академии наук объединены между собой в единую жёсткую иерархическую структуру (подлинного названия которой мир не знает), вырабатывающую единую для всех национальных академий наук стратегию поведения в мире и единую т.н. научную парадигму, стержнем которой является отнюдь не раскрытие закономерностей бытия, а пси-фактор: осуществляя в качестве «придворных знахарей» так называемое «научное» прикрытие (для солидности) всех неблаговидных деяний власть имущих в глазах общества, стяжать себе славу жрецов и пророков, влияющих подобно демиургу на сам ход движения истории человечества.
Всё выше изложенное в этом разделе, включая и введённый нами термин «пси-фактор», было с большой точностью, обоснованно, предсказано Д.И. Менделеевым более 100 лет тому назад (см. например его аналитическую статью 1882 года «Какая же Академия нужна в России?», в которой Дмитрий Иванович фактически даёт развёрнутую характеристику пси-фактора и в которой им предлагалась программа радикальной реорганизации замкнутой учёной корпорации членов Российской Академии Наук, рассматривавших Академию исключительно лишь как кормушку для удовлетворения своих шкурных интересов.
В одном из своих писем 100-летней давности профессору Киевского университета П.П. Алексееву Д.И. Менделеев откровенно признался, что «готов хоть сам себя кадить, чтобы чёрта выкурить, иначе сказать, — чтобы основы академии преобразовать во что-нибудь новое, русское, своё, годное для всех вообще и, в частности, для научного движения в России».
Как мы видим, истинно великому учёному, гражданину и патриоту своей Родины по силам даже сложнейшие долгосрочные научные прогнозы. Рассмотрим теперь исторический аспект изменения этого пси-фактора, открытого Д.И. Менделеевым в конце 19 века.
3. Fin de siecle
Со второй половины 19-го века в Европе на волне «либерализма» произошёл бурный численный рост интеллигенции, научно-технических кадров и количественный рост теорий, идей и научно-технических проектов, предлагаемых этими кадрами обществу.
К концу 19 века в их среде резко обострилась конкуренция за «место под Солнцем», т.е. за звания, почести и награды, и как следствие этой конкуренции — усилилась поляризация научных кадров по нравственному критерию. Это способствовало взрывной активизации пси-фактора.
Революционный задор молодых, честолюбивых и беспринципных учёных и интеллигенции, опьянённых своей скорой учёностью и нетерпеливым желанием прославиться любой ценой в научном мире, парализовал не только представителей более ответственного и более честного круга учёных, но и всё научное сообщество в целом, с его инфраструктурой и устоявшимися традициями, которые противодействовали раньше безудержному росту пси-фактора.
Интеллигенты-революционеры 19-го века, ниспровергатели тронов и государственного уклада в странах Европы, распространили бандитские методы своей идеологической и политической борьбы со «старым порядком» при помощи бомб, револьверов, ядов и заговоров) также и в область научно-технической деятельности. В студенческих аудиториях, лабораториях и на научных симпозиумах они осмеивали отжившее якобы здравомыслие, устаревшие якобы понятия формальной логики — непротиворечивости суждений, их обоснованность. Таким образом, в начале 20-го века в моду научных диспутов вместо метода убеждения вошёл (точнее — ворвался, с визгом и грохотом) метод тотального подавления своих оппонентов, путём психического, физического и морального насилия над ними. При этом, естественно, значение пси-фактора достигло крайне высокого уровня, испытав в 30-ые годы свой экстремум.
В итоге — в начале 20 века «просвещённая» интеллигенция, фактически насильственным, т.е. революционным, путём сменила истинно научную парадигму гуманизма, просветительства и общественной пользы в естествознании на свою парадигму перманентного релятивизма, придав ей псевдонаучную форму теории всеобщей относительности (цинизма!).
Первая парадигма опиралась на опыт и его всестороннюю оценку ради поиска истины, поиска и осмысления объективных законов природы. Вторая парадигма делала упор на лицемерие и беспринципность; и не для поиска объективных законов природы, а ради своих эгоистических групповых интересов в ущерб обществу. Первая парадигма работала на общественную пользу, в то время как вторая — этого не предполагала.
Начиная с 30-х годов по настоящее время пси-фактор стабилизировался, оставаясь на порядок выше того его значения, которое было в начале и середине 19-го века.
Для более объективной и ясной оценки реального, а не мифического, вклада деятельности мирового научного сообщества (в лице всех национальных академий наук) в общественную и частную жизнь людей, введём понятие нормированного пси-фактора.
Нормированному значению пси-фактора, равному единице, соответствует стопроцентная вероятность получения такого отрицательного результата (т.е. такого общественного вреда) от внедрения в практику научных разработок, декларировавших априори положительный результат (т.е. определённую общественную пользу) за единичный исторический промежуток времени (смена одного поколения людей, порядка 25 лет), при котором всё человечество полностью погибает или вырождается не более чем за 25 лет с момента внедрения определённого блока научных программ.
4. Kill with kindness
Жестокая и грязная победа релятивизма и воинствующего атеизма в умонастроениях всемирного научного сообщества в начале 20-го века — главная причина всех бед человеческих в этом «атомном», «космическом» веке так называемого «научно-технического прогресса». Оглянемся назад,- какие нам нужны ещё доказательства сегодня, чтобы понять очевидное: в 20-ом веке не было ни одного общественно-полезного деяния всемирного братства учёных в области естествознания и общественных науках, которое бы укрепляло популяцию хомо сапиенс, филогенетически и нравственно. А есть как раз обратное: безжалостное калечение, разрушение и уничтожение психо-соматической природы человека, здорового образа его жизни и среды его обитания под разными благовидными предлогами.
В самом начале 20-го века все ключевые академические посты управления ходом исследований, тематикой, финансированием научно-технической деятельности и пр. были оккупированы «братством единомышленников», исповедующих двуединую религию цинизма и эгоизма. В этом — драматизм нашего времени.
Именно воинствующий атеизм и циничный релятивизм, стараниями своих адептов, опутал сознание всех без исключения высших государственных деятелей на нашей Планете. Именно этот двуглавый фетиш антропоцентризма породил и внедрил в сознание миллионов так называемую научную концепцию «всеобщего принципа деградации материи-энергии», т.е. вселенского распада ранее возникших — не весть как — объектов в природе. На место абсолютной фундаментальной сущности (всемирной субстанциональной среды) была поставлена псевдонаучная химера всеобщего принципа деградации энергии, с её мифическим атрибутом — «энтропией».
5. Littera contra littere
По представлениям таких корифеев прошлого как Лейбниц, Ньютон, Торричелли, Лавуазье, Ломоносов, Остроградский, Фарадей, Максвелл, Менделеев, Умов, Дж. Томсон, Кельвин, Г. Герц, Пирогов, Тимирязев, Павлов, Бехтерев и многих, многих других – Всемирная среда – это абсолютная фундаментальная сущность (= субстанция мира = мировой эфир = вся материя Вселенной = «квинтэссенция» Аристотеля), заполняющая изотропно и без остатка всё бесконечное мировое пространство и являющаяся Источником и Носителем всех видов энергии в природе,- неистребимых «сил движения», «сил действия».
В противовес этому, по ныне господствующему в мировой науке представлению,- абсолютной фундаментальной сущностью провозглашена математическая фикция «энтропия», да ещё некая «информация», которую на полном серьёзе мировые академические светилы провозгласили недавно т.н. «Вселенской фундаментальной сущностью», не удосужившись дать этому новому термину развёрнутого определения.
По научной парадигме первых — в мире царит гармония и порядок вечной жизни Вселенной, через постоянные локальные обновления (череду смертей–рождений) отдельных материальных образований разного масштаба.
По псевдонаучной парадигме вторых — мир, непостижимым образом однажды сотворённый, движется в пропасти всеобщей деградации, выравнивания температур ко всеобщей, вселенской смерти под неусыпным контролем некоего Всемирного суперкомпьютера, владеющего и распоряжающегося некоей «информацией».
Одни видят вокруг торжество вечной жизни, а другие видят вокруг распад и смерть, контролируемые неким Всемирным информационным банком.
Борьба этих двух диаметрально противоположных мировоззренческих концепций за господство в умах миллионов людей — центральный пункт биографии человечества. И ставка в этой борьбе — степени наивысшей.
И совершенно не случайно, что весь 20 век мировой научный истеблишмент занят внедрением (якобы как единственно возможных и перспективных) топливной энергетики, теории взрывчатых веществ, синтетических ядов и наркотиков, отравляющих веществ, генной инженерии с клонированием биороботов, с вырождением расы людей до уровня примитивных олигофренов, даунов и психопатов. И эти программы и планы сейчас даже не скрываются от общественности.
Правда жизни такова: наиболее процветающими и могущественными в глобальном масштабе сферами человеческой деятельности, созданными в 20 веке по последнему слову научной мысли, стали: порно- , нарко- , фарма-бизнес, торговля оружием, включая глобальные информационные и психотронные технологии. Их доля в мировом объёме всех финансовых потоков значительно превышает 50%.
Далее. Обезобразив за 1,5 века природу на Земле, мировое академическое братство торопится сейчас «колонизировать» и «покорить» околоземное пространство, имея намерения и научные проекты превращения этого пространства в свалку мусора своих «высоких» технологий. Этих господ-академиков буквально распирает от вожделенной сатанинской идеи похозяйничать и в околосолнечном пространстве, а не только на Земле.
Таким образом, в основании парадигмы всемирного академического братства вольных каменщиков положен камень крайне субъективного идеализма (антропоцентризма), а само здание их т.н. научной парадигмы держится на перманентном и циничном релятивизме и воинствующем атеизме.
Но поступь истинного прогресса неумалима. И, как всё живое на Земле тянется к Светилу, так и разум определённой части современных учёных и естествоиспытателей, не обременённых клановыми интересами всемирного братства,- тянется к солнцу вечной Жизни, вечного движения во Вселенной, через познание фундаментальных истин Бытия и поиска основной целевой функции существования и эволюции вида xomo sapiens. Теперь, рассмотрев природу пси-фактора, займёмся Таблицей Дмитрия Ивановича Менделеева.
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная фальшивка.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание).
И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации настоящей диссертации в журнале ЖРФМ Русского Физического Общества. Подлинная, нефальсифицированная Таблица Д.И. Менделеева «Периодическая система элементов по группам и рядам» (Д. И. Менделеев. Основы химии. VIII издание, СПб., 1906 г.)
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева – сын друга и соратника Д.И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, тот Борис Николаевич тоже действовал не в одиночку — он лишь выполнял заказ. Ведь новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д.И. Менделеева был фальсифицирован.
Главное искажение Таблицы – перенос «нулевой группы». Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент “Х” (по Менделееву — “Ньютоний”), — т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент “Х” есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«…Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую… Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими…
Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через “y”. Ему, очевидно, будут принадлежать коренные свойства аргоновых газов… “Короний”, плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром. Этот элемент “у”, однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу “х”, который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его “Ньютонием” — в честь бессмертного Ньютона… Задачу тяготения и задачи всей энергетики (!!!) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом” (“Попытка химического понимания мирового эфира”. 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше (!!!) элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!!) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года…» (“Основы химии”. VIII изд., 1906 г., стр. 613 и след.).
7. Punctum soliens
Из этих цитат совершенно определённо вытекает нижеследующее.
- Элементы нулевой группы начинают каждый ряд других элементов, располагаясь в левой части Таблицы, «…что составляет строго логическое следствие понимания периодического закона» — Менделеев.
- Особо важное и даже исключительное по смыслу периодического закона место принадлежит элементу “х”,- “Ньютонию”, — мировому эфиру. И располагаться этот особый элемент должен в самом начале всей Таблицы, в так называемой “нулевой группе нулевого ряда”. Более того, — являясь системообразующим элементом (точнее — системообразующей сущностью) всех элементов Таблицы Менделеева, мировой эфир — это субстанциональный аргумент всего многообразия элементов Таблицы Менделеева. Сама же Таблица, в этой связи, выступает в роли закрытого функционала этого самого аргумента.
Теперь обратимся к трудам первых фальсификаторов Таблицы Менделеева.
8. Corpus delicti
Чтобы вытравить из сознания всех последующих поколений учёных идею исключительной роли мирового эфира (а этого как раз и требовала новая парадигма релятивизма), специально были перенесены элементы нулевой группы из левой части Таблицы Менделеева в правую часть, сместив на ряд ниже соответствующие элементы и совместив нулевую группу с т.н. «восьмой». Разумеется, ни элементу “у”, ни элементу “х” в фальсифицированной таблице места не осталось.
Но и этого показалось мало братству релятивистов. С точностью до наоборот искажена основополагающая мысль Д.И. Менделеева об особо важной роли мирового эфира. В частности, в предисловии к первому фальсифицированному варианту Периодического закона Д.И. Менделеева, нисколько не смущаясь, Б.М. Меншуткин заявляет, что Менделеев якобы всегда выступал против особой роли мирового эфира в природных процессах. Вот выдержка из бесподобной по цинизму статьи Б.Н. Меншуткина:
«Таким образом (?!) мы снова возвращаемся к тому воззрению, против которого (?!) всегда (?!!!) выступал Д. И. Менделеев, которое с самых древних времён существовало среди философов, считавших все видимые и известные вещества и тела составленными из одного и того же первичного вещества греческих философов (“протэюлэ” греческих философов, prima materia – римских). Эта гипотеза всегда находила себе приверженцев в силу своей простоты и в учениях философов называлась гипотезой единства материи или гипотезой унитарной материи
». (Б.Н. Меншуткин. “Д. И. Менделеев. Периодический закон”. Под редакцией и со статьёй о современном положении периодического закона Б. Н. Меншуткина. Государственное Издательство, М-Л., 1926).
9. In rerum natura
Оценивая взгляды Д. И. Менделеева и его недобросовестных оппонентов, необходимо заметить следующее.
Скорее всего, Менделеев невольно ошибался в том, что «мировой эфир»- это «элементарное вещество» (т.е. «химический элемент» — в современном смысле этого термина). Скорее всего, «мировой эфир» — это истинная субстанция; и как таковая, в строгом смысле — не «вещество»; и она не обладает «элементарным химизмом» т.е. не обладает «предельно малым атомным весом» с «чрезвычайно быстрым собственным частичным движением».
Пусть Д.И. Менделеев ошибался в «вещественности», «химизме» эфира. В конце концов это терминологический просчёт великого учёного; и в его время это простительно, ибо тогда эти термины были ещё достаточно размыты, только входя в научный оборот. Но совершенно ясно другое: Дмитрий Иванович был совершенно прав в том, что «мировой эфир» это всё образующая сущность,- квинтэссенция, субстанция, из которой состоит весь мир вещей (вещественный мир) и в которой все вещественные образования пребывают. Прав Дмитрий Иванович и в том, что эта субстанция передаёт энергию на расстояния и не обладает никакой химической активностью. Последнее обстоятельство только подтверждает нашу мысль о том, что Д.И. Менделеев сознательно выделил элемент “х”, как исключительную сущность.
Итак, «мировой эфир», т.е. субстанция Вселенной, — изотропен, не имеет частичного строения, а является абсолютной (т.е. предельной, основополагающей, фундаментальной всеобщей) сущностью Мироздания, Вселенной. И именно потому, как правильно подметил Д.И. Менделеев,- мировой эфир «не способен к химическим взаимодействиям», а значит и не является “химическим элементом”, т.е. «элементарным веществом» — в современном смысле этих терминов.
Прав был Дмитрий Иванович и в том, что мировой эфир — переносчик энергии на расстояния. Скажем больше: мировой эфир, как субстанция Мира, не только переносчик, но и «хранитель», и «носитель» всех видов энергии (“сил действия”) в природе.
Из глубины веков Д.И. Менделееву вторит другой выдающийся учёный — Торричелли (1608 — 1647): «Энергия — есть квинтэссенция такой тонкой природы, что она не может содержаться ни в каком другом сосуде, как только в самой сокровенной субстанции материальных вещей».
Итак, по Менделееву и Торричелли мировой эфир это
самая сокровенная субстанция материальных вещей
. Именно поэтому менделеевский «Ньютоний» — не просто в нулевом ряду нулевой группы его периодической системы, а это — своеобразная «корона» всей его таблицы химических элементов. Корона, которая образует все химические элементы в мире, т.е. всё вещество. Эта Корона (“Матерь”, “Материя-субстанция” всякого вещества) есть Природная среда, приводимая в движение и побуждаемая к изменениям — по нашим расчётам — другой (второй) абсолютной сущностью, которую мы назвали «Субстанциональным потоком первичной фундаментальной информации о формах и способах движения Материи во Вселенной». Подробнее об этом — в журнале “Русская Мысль”, 1-8, 1997, стр. 28-31.
Математическим символом мирового эфира мы выбрали “О”, ноль, а семантическим – «лоно». В свою очередь математическим символом Субстанционального потока мы выбрали “1”, единицу, а семантическим — «один». Таким образом, исходя из вышеуказанной символики, появляется возможность лаконично выразить в одном математическом выражении совокупность всех возможных форм и способов движения материи в природе:
Это выражение математически определяет т.н. открытый интервал пересечения двух множеств, — множества “О” и множества “1”, в то время как семантическое определение этого выражения — «один в лоно» или иначе: Субстанциональный поток первичной фундаментальной информации о формах и способах движения Материи-субстанции полностью пронизывает эту Материю-субстанцию, т.е. мировой эфир.
В религиозных доктринах этот «открытый интервал» облечён в образную форму Вселенского акта творения Богом всего вещества в Мире из Материи-субстанции, с Которой Он непрерывно пребывает в состоянии плодоносного совокупления.
Автор данной статьи отдаёт себе отчёт в том, что эта математическая конструкция была в своё время навеяна ему опять же, как не покажется странным,- идеями незабвенного Д.И. Менделеева, высказанными им в его работах (см., например, статью «Попытка химического понимания мирового эфира»). Теперь настала пора подвести итог нашим исследованиям, изложенным в данной диссертации.
10. Errata: ferro et igni
Безапелляционное и циничное игнорирование мировой наукой места и роли мирового эфира в природных процессах (и в Таблице Менделеева!) как раз и породило всю гамму проблем человечества в нашем технократическом веке.
Главная из этих проблем — топливно-энергетическая.
Именно игнорирование роли мирового эфира позволяет учёным делать ложный (и лукавый – одновременно) вывод, будто добывать полезную энергию для своих повседневных нужд человек может лишь сжигая, т.е. безвозвратно разрушая вещество (топливо). Отсюда и ложный тезис об отсутствии у нынешней топливной энергетики реальной альтернативы. А раз так, то остаётся, якобы, только одно: плодить атомную (экологически самую грязную!) энергетику и газо-нефте-угле-добычу, засоряя и отравляя безмерно собственную среду обитания.
Именно игнорирование роли мирового эфира толкает всех современных учёных-ядерщиков на лукавый поиск «спасения» в расщеплении атомов и элементарных частиц на специальных дорогостоящих синхротронных ускорителях. В ходе этих чудовищных и чрезвычайно опасных по своим последствиям экспериментов хотят обнаружить и в дальнейшем использовать якобы «во благо» т.н. «кварк-глюонную плазму», по их ложным представлениям — как бы «пред-материю» (термин самих ядерщиков), согласно их ложной космологической теории т.н. «Большого взрыва Вселенной».
Достойно замечания, по нашим расчётам, что если эта т.н. «самая сокровенная мечта всех современных физиков-ядерщиков» ненароком будет достигнута, то это будет скорее всего рукотворным концом всякой жизни на земле и концом самой планеты земля,- воистину «Большим взрывом» в глобальном масштабе, но только не понарошку, а взаправду.
Поэтому нужно как можно быстрее остановить это безумное экспериментирование мировой академической науки, которая с головы до ног поражена ядом пси-фактора и которая, похоже, даже не представляет себе возможных катастрофических последствий этих своих безумных паранаучных затей.
Прав оказался Д. И. Менделеев, – «Задачу тяготения и задачи всей энергетики нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояниях».
Прав оказался Д. И. Менделеев и в том, что “когда-нибудь догадаются, что вручать дела данной промышленности лицам, ею живущим, не ведёт к наилучшим следствиям, хотя послушать таких лиц преполезно”.
«Основной смысл сказанного лежит в том, что интересы общие, вечные и прочные зачастую не совпадают с личными и временными, даже нередко одни другим противоречат, и, на мой взгляд, предпочитать надо — если помирить уже нельзя — первые, а не вторые. В этом и драматизм нашего времени
». Д. И. Менделеев. “Мысли к познанию России”. 1906 г.
Итак, мировой эфир есть субстанция всякого химического элемента и значит — всякого вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.
Мировой эфир – это исток и венец всей подлинной Таблицы Менделеева, её начало и конец,- альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
Вероятно, все вы видели периодическую таблицу элементов. Возможно, что она и по сей день преследует вас в ваших снах, а может быть, она пока для вас всего лишь визуальный фон, украшающий стенку школьного класса. Однако в этой, казалось бы, случайной коллекции клеток кроется значительно больше, чем это кажется на первый взгляд.
Периодическая таблица (или ПТ, как мы будем периодически называть её в этой статье), а также те элементы, которые входят в неё, обладают чертами, о которых вы, возможно, никогда не догадывались. Вот десять фактов, начиная от создания таблицы и до внесения в неё последних элементов, которые большинству людей не известны.
10. Менделееву помогали
Периодическая таблица стала использоваться, начиная с 1869 года, когда она была составлена заросшим густой бородой Димитрием Менделеевым. Большинство людей думает, что Менделеев был единственным, кто работал над этой таблицей, и благодаря этому он стал самым гениальным химиком столетия. Однако его усилиям помогали несколько европейских учёных, которые внесли важный вклад в завершение этого колоссального набора элементов.
Менделеев широко известен как отец периодической таблицы, но, когда он её составлял, ещё не все элементы таблицы были уже открыты. Как такое стало возможно? Учёные славятся своим безумием…
9. Последние добавленные элементы
Верьте или нет, периодическая таблица не сильно менялась с 1950-х годов. Однако 2 декабря 2016 года было добавлено сразу четыре новых элемента: нихоний (элемент №113), московий (элемент №115), тенессин (элемент №117) и оганесон (элемент №118). Эти новые элементы получили свои названия только в июне 2016 года, так как потребовалась пятимесячная экспертиза, прежде чем их официально добавили в ПТ.
Три элемента получили свои названия в честь городов или государств, в которых их удалось получить, а оганесон был назван в честь российского физика-ядерщика Юрия Оганесяна за его вклад в получение этого элемента.
8. Какой буквы нет в таблице?
В латинском алфавите есть 26 букв, и каждая из них важна. Однако Менделеев решил этого не замечать. Взгляните на таблицу и скажите, какой букве не повезло? Подсказка: ищите по порядку и загибайте при этом пальцы после каждой найденной буквы. В итоге вы найдёте «пропавшую» букву (если у вас на руках присутствуют все десять пальцев). Догадались? Это буква под номером 10, буква «J».
Говорят, что «единица» — это цифра одиноких. Так, может, стоило бы назвать букву «J» буквой одиноких? Но вот забавный факт: большинство мальчиков, родившихся в США в 2000 году, получили имена, начинавшиеся с этой буквы. Таким образом, эта буква не осталась без должного внимания.
7. Синтезированные элементы
Как вы, возможно, уже знаете, на сегодняшний день в периодической таблице присутствует 118 элементов. Можете ли вы догадаться, сколько элементов из этих 118 были получены лабораторным путём? Из всего общего списка в природных условиях можно найти лишь 90 элементов.
Вам кажется, что 28 искусственно созданных элементов — это много? Ну, просто поверьте на слово. Их синтезируют, начиная с 1937 года, и учёные продолжают это делать и сейчас. Все эти элементы вы можете найти в таблице. Посмотрите на элементы с 95 по 118, все эти элементы отсутствуют на нашей планете и были синтезированы в лабораториях. То же касается и элементов под номерами 43, 61, 85 и 87.
6. 137-й элемент
В середине 20-го века известный учёный по имени Ричард Фейнман сделал довольно громкое заявление, которое повергло в изумление весь научный мир нашей планеты. По его словам, если мы когда-нибудь обнаружим 137-й элемент, то мы не сможем определить количество в нём протонов и нейтронов. Число 1/137 примечательно тем, что это значение константы тонкой структуры, которая описывает вероятность поглощения или излучения электроном фотона. Теоретически элемент №137 должен иметь 137 электронов и 100-процентную вероятность поглощения фотона. Его электроны будут вращаться со скоростью света. Ещё более невероятно, что электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света.
Вы ещё не устали от физики? Возможно, вам будет интересно узнать, что число 137 объединяет три важнейших области физики: теорию о скорости света, квантовую механику и электромагнетизм. С начала 1900-х годов физики предполагают, что цифра 137 может быть основой Великой единой теории, в которую войдут все три вышеуказанных области. По общему признанию, это звучит так же невероятно, как легенды о НЛО и о Бермудском треугольнике.
5. Что можно сказать о названиях?
Почти все названия элементов имеют какой-то смысл, хотя он и не сразу понятен. Названия новым элементам даются не произвольно. Я бы назвал элемент просто первым пришедшим мне в голову словом. Например, «керфлумп». По-моему, неплохо.
Как правило, названия элементов относятся к одной из пяти основных категорий. Первая — это имена известных учёных, классический вариант — эйнштейний. Кроме того, элементы могут получить свои имена в зависимости от тех мест, где они были впервые зарегистрированы, например, германий, америций, галлий и т. д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
И, наконец, есть названия, описывающие свойства элементов. Аргон происходит от греческого слова «аргос», что означает «ленивый» или «медленный». Из названия следует предположение, что этот газ не отличается активностью. Бром — это ещё один элемент, название которого происходит от греческого слова. «Бромос» означает «зловоние», и это довольно точно описывает запах брома.
4. Было ли создание таблицы «озарением»
Если вы любите карточные игры, то этот факт для вас. Менделееву требовалось каким-то образом упорядочить все элементы и найти систему для этого. Естественно, что для создания таблицы по категориям он обратился к пасьянсу (ну, а к чему же ещё?) Менделеев записал атомный вес каждого элемента на отдельной карточке, а затем приступил к раскладке своего передового пасьянса. Он укладывал элементы в соответствии с их специфическими свойствами, а затем упорядочивал их в каждом столбце в соответствии с их атомным весом.
Многие не могут сложить и обычный пасьянс, так что этот пасьянс впечатляет. Что будет дальше? Наверное, кто-нибудь с помощью шахмат сделает переворот в астрофизике или создаст ракету, способную долететь до окраин галактики. Представляется, что в этом не будет ничего необычного, если учесть, что Менделеев сумел получить такой гениальный результат всего лишь с помощью колоды обычных игральных карт.
3. Невезучие инертные газы
Помните, как мы классифицировали аргон как самый «ленивый» и «медленный» элемент в истории нашей вселенной? Похоже, что Менделеевым овладели такие же чувства. Когда в 1894 году впервые удалось получить чистый аргон, он не вписывался ни в один из столбцов таблицы, поэтому, вместо того чтобы заняться поисками решения, учёный решил просто отрицать его существование.
Ещё более поразительно, что аргон был не единственным элементом, который изначально постигла эта судьба. Помимо аргона, без классификации остались ещё пять других элементов. Это коснулось радона, неона, криптона, гелия и ксенона — и все отрицали их существование просто потому, что Менделеев не смог найти для них места в таблице. После нескольких лет перегруппировки и переклассификации этим элементам (названных инертными газами) всё-таки посчастливилось присоединиться к достойному клубу признанных реально существующими.
2. Атомная любовь
Совет для всех тех, кто считает себя романтиком. Возьмите бумажную копию периодической таблицы и вырежьте из неё все сложные и относительно ненужные средние столбцы так, чтобы у вас осталось 8 колонок (вы получите «короткую» форму таблицы). Сложите её посредине IV группы — и вы узнаете, какие элементы могут образовывать соединения друг с другом.
Элементы, которые «целуются» при складывании, способны образовывать стабильные соединения. Эти элементы имеют комплементарные электронные структуры, и они будут сочетаться друг с другом. И, если это не настоящая любовь, как у Ромео с Джульеттой или у Шрека с Фионой — тогда я не знаю, что такое любовь.
1. Углерод рулит
Углерод пытается быть в центре игры. Вы думаете, что всё знаете об углероде, но это не так, он занимает намного более важное место, чем вы это себе представляете. Знаете ли вы, что он присутствует более чем в половине всех известных соединений? И как насчёт того факта, что 20 процентов веса всех живых организмов приходится на углерод? Это действительно странно, но приготовьтесь: каждый атом углерода в вашем теле был когда-то частью фракции углекислого газа в атмосфере. Углерод является не только суперэлементом нашей планеты, он четвёртый по численности элемент во всей Вселенной.
Если периодическую таблицу сравнить с вечеринкой, то углерод — её главный ведущий. И кажется, что он единственный знает, как нужно всё правильно организовать. Ну и, помимо прочего, это основной элемент всех бриллиантов, так что при всей своей назойливости он ещё и блестит!
Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление. В итоге, в феврале 1869 года Менделеев сформулировал первый периодический закон, а уже в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества историком химии Н. А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».
Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка
– этап формулирования основной задачи и первые попытки её решения; - Инкубация
– этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне; - Озарение
– этап, на котором находится интуитивное решение. Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации; - Проверка
– этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева
бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы
в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева
все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева
систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона
химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов
.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)
.
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами
называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом
называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера
химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами
называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R 2 O, RO, R 2 O 3 , RO 2 , R 2 O 5 , RO 3 , R 2 O 7 , RO 4 , где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R 2 O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO 2 , R 2 O 5 , RO 3 , R 2 O 7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH 4 , RH 3 , RH 2 , RH.
Соединения RH 4 имеют нейтральный характер; RH 3 — слабоосновный; RH 2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом
называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы
из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы
из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды
— это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды
занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены
представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газах
все электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
Переходные металлы
Переходные металлы
занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды
занимают группы 13-16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
Постпереходными металлами
Элементы, называемые постпереходными металлами
, относятся к группам 13-15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Флеровий Fl 114 Унунсептий Uus 117
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Как правильно пишется слово «литий»
ли́тий
ли́тий, -я
Источник: Орфографический
академический ресурс «Академос» Института русского языка им. В.В. Виноградова РАН (словарная база
2020)
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: баталёр — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «литий»
Синонимы к слову «литий»
Предложения со словом «литий»
- В настоящее время карбонат лития применяется для купирования приступов биполярного расстройства во всём мире, хотя и до сих пор непонятен механизм терапевтического эффекта.
- Для множества больных маниакально-депрессивным расстройством таким лекарством стали соли лития – легчайшего элемента из группы щелочных металлов.
- Небольшое количество металлического лития, которое добавляют в сплавы увеличивает их прочность и уменьшает плотность.
- (все предложения)
Цитаты из русской классики со словом «литий»
- Гроб был вынесен из собора, поставлен на роскошный катафалк, и мимо дома, где была отслужена лития, препровожден на вокзал железной дороги.
- Потом короткая лития на могиле, глухой стук земли о крышку гроба… небольшой свежий холмик…
- Духовенство с архиереем ехало впереди до первой стоящей на дороге церкви, где, не снимая гроба с колесницы, служили литию; на станции архиерей встречал шествие, и вносили гроб в церковь тем же порядком.
- (все
цитаты из русской классики)
Значение слова «литий»
-
ЛИ́ТИЙ, -я, м. Химический элемент, мягкий, очень легкий щелочной металл серебристо-белого цвета, не встречающийся в природе в чистом виде. (Малый академический словарь, МАС)
Все значения слова ЛИТИЙ
Отправить комментарий
Дополнительно
На чтение 1 мин.
Значение слова «Литий»
— химический элемент, серебристо-белый, мягкий, очень легкий щелочной металл
Содержание
- Транскрипция слова
- MFA Международная транскрипция
- Цветовая схема слова
Транскрипция слова
[л’ит’и́й’]
MFA Международная транскрипция
[ˈlʲitʲɪɪ̯]
| л | [л’] | согласный, звонкий непарный (сонорный), мягкий парный |
| и | [и] | гласный, безударный |
| т | [т’] | согласный, глухой парный, мягкий парный |
| и | [́и] | гласный, ударный |
| й | [й’] | согласный, звонкий непарный (сонорный), мягкий непарный |
Букв: 5 Звуков: 5
Цветовая схема слова
литий
Как произносится слово «Литий»
Тег audio не поддерживается вашим браузером.
Как правильно пишется «Литий»
ли́тий
ли́тий, -я
Как правильно перенести «Литий»
ли́—тий
Часть речи
Часть речи слова «литий» — Имя существительное
Морфологические признаки.
литий (именительный падеж, единственного числа)
Постоянные признаки:
- нарицательное
- неодушевлённое
- мужской
- 2-e склонение, на -ий
Непостоянные признаки:
- именительный падеж
- единственного числа
Может относится к разным членам предложения.
Склонение слова «Литий»
| Падеж | Единственное число | Множественное число |
|---|---|---|
| Именительный Кто? Что? |
ли́тий | ли́тии |
| Родительный Кого? Чего? |
ли́тия | ли́тиев |
| Дательный Кому? Чему? |
ли́тию | ли́тиям |
| Винительный (неод.) Кого? Что? |
ли́тий | ли́тии |
| Творительный Кем? Чем? |
ли́тием | ли́тиями |
| Предложный О ком? О чём? |
ли́тии | ли́тиях |
Разбор по составу слова «Литий»
Состав слова «литий»:
корень — [лит], суффикс — [ий], нулевое окончание — [ ]
Проверьте свои знания русского языка
Категория: Русский язык
Синонимы к слову «литий»
Ассоциации к слову «литий»
Предложения со словом «литий»
- В настоящее время карбонат лития применяется для купирования приступов биполярного расстройства во всём мире, хотя и до сих пор непонятен механизм терапевтического эффекта.
Аркадий Курамшин, Элементы: замечательный сон профессора Менделеева, 2019
- Раствор солей натрия с небольшой примесью солей лития – тоже жёлтый цвет.
Матвей Бронштейн, Солнечное вещество и другие повести, а также Жизнь и судьба Матвея Бронштейна и Лидии Чуковской (сборник), 2018
- Учёных заинтересовало, будет ли сохраняться привычка, если добавить в шоколад хлорид лития, вызывающий у животных лёгкую тошноту.
Вадим Юрьевич Майоров, Твои привычки. Они тебя или ты их?, 2019
Происхождение слова «Литий»
От лат. lithium, от др.-греч. λίθος «камень», далее из неустановленной формы. Латинский термин был сконструирован имиком Берцелиусом в начале XIX века.
Морфемный разбор слова:
Однокоренные слова к слову:
литий
Полезное
Смотреть что такое «литий» в других словарях:
ЛИТИЙ — (лат. lithium, от греч. lithos камень). Металл белого цвета, открытый в 1817 г. в петалите; все соли его растворимы в воде. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЛИТИЙ белый металл, самый легкий из всех,… … Словарь иностранных слов русского языка
ЛИТИЙ — (Lithium), Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941; относится к щелочным металлам, tпл 180,54шC. Литий используют для изготовления анодов для химических источников тока, в производстве меди,… … Современная энциклопедия
Литий — (Lithium), Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941; относится к щелочным металлам, tпл 180,54°C. Литий используют для изготовления анодов для химических источников тока, в производстве меди,… … Иллюстрированный энциклопедический словарь
ЛИТИЙ — (лат. Lithium) Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Название от греч. lithos камень (открыт в минерале петалите). Серибристо белый, самый легкий из металлов;… … Большой Энциклопедический словарь
Литий — Li (от греч. lithos камень * a. lithium; н. Lithium; ф. lithium; и. litio), хим. элемент I группы периодич. системы Менделеева, ат. н. 3, ат. м. 6,941, относится к щелочным металлам. B природе встречаются 2 стабильных изотопа: 6Li (7,42%) … Геологическая энциклопедия
ЛИТИЙ — ЛИТИЙ, хим. элемент, символ Li, порядков. номер 3, серебристо белый металл, ат. в. 6,940 (изотопы 6 и 7), t° пл. 186°; относится к группе щелочн. металлов, имеет наименьший по сравн. с др. металлами уд. в. (0,59). Открыт Арфедзоном… … Большая медицинская энциклопедия
ЛИТИЙ — хим. элемент, символ Li (лат. Lithium), ат. н. 3, ат. м. 6,941; серебристо белый, самый лёгкий металл, принадлежит к щелочным металлам, плотность 534 кг/м3, tпл = 180,5°С; легко режется ножом. Л. химически очень активен, взаимодействует с водой и … Большая политехническая энциклопедия
ЛИТИЙ — (символ Li), редкий серебряного цвета элемент, один из ЩЕЛОЧНЫХ МЕТАЛЛОВ, впервые был обнаружен в 1817 г. Содержится в таких рудах, как лепидолит и сподумен. По химическим свойствам близок к натрию. Самый легкий из всех металлов, используется в… … Научно-технический энциклопедический словарь
ЛИТИЙ — ЛИТИЙ, лития, мн. нет, муж. (от греч. lithios каменный) (минер., хим.). Химический элемент серебристобелый, мягкий, очень легкий щелочный металл, не встречающийся в природе в чистом виде, а только в виде солей. Толковый словарь Ушакова. Д.Н.… … Толковый словарь Ушакова
ЛИТИЙ — (Lithium), Li, хим. элемент I группы периодич. системы элементов, ат. номер 3, ат. масса 6,941, относится к щелочным металлам. Природный Л. состоит из смеси стабильных (7,5%) и (92,5%) с сильно различающимися сечениями захвата тепловых нейтронов… … Физическая энциклопедия
литий — сущ., кол во синонимов: 2 • металл (86) • элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Источник
Литий
Ли́тий / Lithium (Li), 3
Содержание
История и происхождение названия
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Нахождение в природе
Геохимия лития
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносоленых озёр.
Месторождения
Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра. Кристаллическая решетка относится к пространственной группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранится в керосине (к тому же плотность лития столь мала, что он будет в нём плавать) и может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом, находящимся в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °C до 300 °C литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с водородом (при 500—700 °C) с образованием гидрида лития, с аммиаком и с галогенами (с иодом — только при нагревании). При 130 °C реагирует с серой с образованием сульфида. В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид). При 600—700 °C литий реагирует с кремнием с образованием силицида. Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор.
Длительно литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6 Li (7,5 %) и 7 Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов. Это следует иметь в виду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов и два ядерных изомера ( 4 Li − 12 Li и 10m1 Li − 10m2 Li соответственно). Наиболее устойчивый из них, 8 Li, имеет период полураспада 0,8403 с. Экзотический изотоп 3 Li (трипротон), по-видимому, не существует как связанная система.
7 Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть вскоре после Большого Взрыва). Образование элемента лития в звездах возможно по ядерной реакции «скалывания» более тяжелых элементов.
Применение
Термоэлектрические материалы
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К).
Химические источники тока
Из лития изготовляют аноды химических источников тока (аккумуляторов, например литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).
Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.
Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидроксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).
Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом).
Ракетное топливо
Окислитель
| Окислитель | Удельная тяга (Р1, сек) | Температура сгорания °С | Плотность топлива г/см³ | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего % |
|---|---|---|---|---|---|
| Фтор | 378,3 сек | 5350 °C | 0,999 | 4642 м/сек | 28 % |
| Тетрафторгидразин | 348,9 сек | 5021 °C | 0,920 | 4082 м/сек | 21,07 % |
| ClF3 | 320,1 сек | 4792 °C | 1,163 | 4275 м/сек | 24 % |
| ClF5 | 334 сек | 4946 °C | 1,128 | 4388 м/сек | 24,2 % |
| Перхлорилфторид | 262,9 сек | 3594 °C | 0,895 | 3028 м/сек | 41 % |
| Окись фтора | 339,8 сек | 4595 °C | 1,097 | 4396 м/сек | 21 % |
| Кислород | 247,1 сек | 3029 °C | 0,688 | 2422 м/сек | 58 % |
| Перекись водорода | 270,5 сек | 2995 °C | 0,966 | 3257 м/сек | 28,98 % |
| N2O4 | 239,7 сек | 3006 °C | 0,795 | 2602 м/сек | 48 % |
| Азотная кислота | 240,2 сек | 3298 °C | 0,853 | 2688 м/сек | 42 % |
Лазерные материалы
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски, и для изготовления оптики с широкой спектральной полосой пропускания.
Окислители
Перхлорат лития используют в качестве окислителя.
Дефектоскопия
Сульфат лития используют в дефектоскопии.
Пиротехника
Нитрат лития используют в пиротехнике.
Сплавы
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике. На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии.
Электроника
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике. Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.
Металлургия
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Металлургия алюминия
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия, и его потребление растет с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5-3,5 кг на тонну выплавляемого алюминия [источник не указан 584 дня] ).
Легирование алюминия
Введение лития в систему легирования позволяет получить новые сплавы алюминия с высокой удельной прочностью.
Добавка лития снижает плотность сплава и повышает модуль упругости. При содержании лития до 1,8 % сплав имеет низкое сопротивление коррозии под напряжением, а при 1,9 % сплав не склонен к коррозионному растрескиванию. Увеличение содержания лития до 2,3 % способствует возрастанию вероятности образования рыхлот и трещин. Механические свойства при этом изменяются: пределы прочности и текучести возрастают, а пластические свойства снижаются.
Наиболее известны системы легирования Al-Mg-Li (пример — сплав 1420, применяемый для изготовления конструкций летательных аппаратов) и Al-Cu-Li (пример — сплав 1460, применяемый для изготовления емкостей для сжиженных газов).
Ядерная энергетика
Изотопы 6 Li и 7 Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний.
Литий-6 (термояд)
Применяется в термоядерной энергетике.
При облучении нуклида 6 Li тепловыми нейтронами получается радиоактивный тритий 3 H:
Благодаря этому литий-6 может применяться как замена радиоактивного, нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях. В термоядерном оружии обычно применяется дейтерид лития-6 6 LiD.
Перспективно также использование лития-6 для получения гелия-3 (через тритий) с целью дальнейшего использования в дейтерий-гелиевых термоядерных реакторах.
Литий-7 (теплоноситель)
Применяется в ядерных реакторах, использующих реакции с участием тяжёлых элементов, таких как уран, торий или плутоний.
Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов, жидкий литий-7 (часто в виде сплава с натрием или цезием) служит эффективным теплоносителем. Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах, и для производства трития.
Сушка газов
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Медицина
Соли лития обладают нормотимическими и другими лечебными свойствами. Поэтому они находят применение в медицине.
Смазочные материалы
Стеарат лития («литиевое мыло») используется в качестве высокотемпературной смазки. См.: литол.
Регенерация кислорода в автономных аппаратах
Гидроксид лития LiOH, пероксид Li2O2 и супероксид LiO2 применяются для очистки воздуха от углекислого газа; при этом последние два соединения реагируют с выделением кислорода (например, 4LiO2 + 2CO2 → 2Li2CO3 + 3O2), благодаря чему они используются в изолирующих противогазах, в патронах для очистки воздуха на подлодках, на пилотируемых космических аппаратах и т. д.
Силикатная промышленность
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
Прочие области применения
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Интересные факты
Источник
Литий
Ли́тий — химический элемент с атомным номером 3 в периодической системе, обозначается символом Li (лат. Lithium ), мягкий щелочной металл серебристо-белого цвета.
Содержание
История и происхождение названия
Получение
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, тверже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой. При комнатной температуре металлический литий имеет кубическую объемноцентрированную решетку ( координационное число 8), которая при холодной обработке переходит в кубическую плотноупакованную решетку, где каждый атом, имеющий двойную кубооктаэдрическую координацию, окружен 12 другими. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340° С, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см 3 ).
В 1818 немецкий химик Леопольд Гмелин (нем. Gmelin Leopold ) (1788—1853) установил, что соли лития окрашивают бесцветное пламя в карминово-красный цвет.
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только ниже 380° С и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие пары щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Во влажном воздухе медленно окисляется, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O.
Спокойно, без взрыва и загорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом, образуя алкоголят, с аммиаком и с галогенами (с иодом — только при нагревании).
Геохимия лития
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, выскоим содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносоленых озёр.
Применение
Литий по праву можно назвать важнейшим элементом современной цивилизации и развития технологий. В прошлом и позапрошлом веках критериями развития индустриальной и экономической мощи государств были показатели производства важнейших кислот и металлов, воды и энергоносителей. В 21-м веке Литий прочно и надолго вошел в список таких показателей. Сегодня литий имеет исключительно важное экономическое и стратегическое значение в развитых индустриальных странах, а говоря простым языком: Литий — это дополнительные десятки и сотни миллиардов долларов или рублей в бюджет любой страны, использующей литий.
Термоэлектрические материалы
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530мкВ/градус К).
Химические источники тока
Кобальтат лития, и молибдат лития показали лучшие эксплуатационные свойства и энергоемкость в качестве положительного электрода литиевых аккумуляторов. Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов.
Кроме того, добавление гидрооксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и емкость на 21 % (за счет образования никелатов лития). Алюминат лития — наиболее эффективный твердый электролит (наряду с цезий-бета-глиноземом).
Металлургия алюминия
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия и его потребление растет с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5-3,5 кг на тонну выплавляемого алюминия).
Легирование алюминия
Ракетное топливо
Окислитель
| Окислитель | Удельная тяга(Р1,сек) | Температура сгорания °С | Плотность топлива г/см 3 | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего % |
|---|---|---|---|---|---|
| Фтор | 378,3 сек | 5350 °C | 0,999 | 4642 м/сек | 28 % |
| Тетрафторгидразин | 348,9 сек | 5021 °C | 0,920 | 4082 м/сек | 21,07 % |
| ClF3 | 320,1 сек | 4792 °C | 1,163 | 4275 м/сек | 24 % |
| ClF5 | 334 сек | 4946 °C | 1,128 | 4388 м/сек | 24,2 % |
| Перхлорилфторид | 262,9 сек | 3594 °C | 0,895 | 3028 м/сек | 41 % |
| Окись фтора | 339,8 сек | 4595 °C | 1,097 | 4396 м/сек | 21 % |
| Кислород | 247,1 сек | 3029 °C | 0,688 | 2422 м/сек | 58 % |
| Перекись водорода | 270,5 сек | 2995 °C | 0,966 | 3257 м/сек | 28,98 % |
| N2O4 | 239,7 сек | 3006 °C | 0,795 | 2602 м/сек | 48 % |
| Азотная кислота | 240,2 сек | 3298 °C | 0,853 | 2688 м/сек | 42 % |
Лазерные материалы
Монокристаллы фторида лития используются для изготовления высокоэффективных ( КПД 80 %) лазеров на центрах свободной окраски, и для изготовления оптики с широкой спектральной полосой пропускания.
Сплавы
Сплавы лития с серебром и золотом, а так же медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике. На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии.
Электроника
Металлотермия
Литий иногда применяется для восстановления методами металлотермии редких металлов.
Ядерная энергетика
Изотопы 6 Li и 7 Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафнат лития входит в сосав специальной эмали предназначенной для захоронения высокоактивных ядерных отходов содержащих плутоний.
Литий-6 (термояд)
Применяется в термоядерной энергетике.
При облучении нуклида 6 Li тепловыми нейтронами получается радиоактивный тритий 3 1H (Т):
Литий-7 (теплоноситель)
Применяется в ядерных реакторах, использующих реакции с участием тяжёлых элементов, таких, как уран, торий или плутоний.
Сушка газов
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Медицина
Смазочные материалы
Стеарат лития (« литиевое мыло ») используется в качестве высокотемпературной смазки.
Регенерация кислорода в автономных аппаратах
Силикатная промышленность
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и цветной металлургии (для раскисления, повышения пластичности и прочности сплавов).
Прочие области применения
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики ).
В 2006 году цены на металлический литий 99 % составили в среднем 70 долл за 1 кг. [источник?]
Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6 Li (7,5 %) и 7 Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного фракционирования изотопов. Известны 7 искусственных радиоактивных изотопов лития (от 4 Li до 12 Li). Наиболее устойчивый из них, 8 Li, имеет период полураспада 0,8403 с. Экзотический изотоп 3 Li ( трипротон ), по-видимому, не существует как связанная система.
7 Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (т. е. вскоре после Большого Взрыва), а не в звёздах.
См. также
Ссылки
Литература
af:Litium ar:ليثيوم ast:Litiu be:Ліцій bg:Литий bn:লিথিয়াম bs:Litijum ca:Liti co:Litiu cs:Lithium cy:Lithiwm da:Lithium de:Lithium el:Λίθιο en:Lithium eo:Litio es:Litio et:Liitium eu:Litio fi:Litium fr:Lithium ga:Litiam gl:Litio (elemento) he:ליתיום hr:Litij hu:Lítium hy:Լիթիում id:Litium io:Litio is:Litín it:Litio ja:リチウム jbo:roksodna ka:ლითიუმი ko:리튬 ksh:Lithium ku:Lîtyûm la:Lithium lb:Lithium lt:Litis lv:Litijs mk:Литиум ml:ലിഥിയം nds:Lithium nl:Lithium nn:Litium no:Litium oc:Liti pl:Lit (pierwiastek) pt:Lítio ro:Litiu sh:Litij simple:Lithium sk:Lítium sl:Litij sq:Litiumi sr:Литијум sv:Litium th:ลิเทียม tr:Lityum ug:لىتىي uk:Літій uz:Litiy vi:Liti wa:Litiom zh:锂 zh-min-nan:Li (goân-sò͘) zh-yue:鋰
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Литий как пишется в химии, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Литий как пишется в химии», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Элемент: литий (Lithium)
Химический символ: Li
Порядковый номер: 3
Год открытия: 1817
Стандартная атомная масса: 6.938
Температура плавления: 453.65 К
Температура кипения: 1603 К
Плотность при стандартных условиях: 0.534 г/cм3
Скорость звука в литии: 6000 м/с
Число стабильных изотопов: 2
Кристаллическая решётка: объемно-центрированная кубическая
Как и в прошлых выпусках, начнем с начала. Если говорить о происхождении атомов лития, то наш герой – самый уникальный элемент. Потому что он образовывался сразу тремя (!) путями.
Во-первых, некоторое количество лития образовалось во время Большого взрыва. Примерно каждый миллиардный атом в молодой Вселенной был атомом 7Li, в 10 000 раз реже встречался 6Li. Во-вторых, атомы лития-7 появляются в молодых и больших звездах. Они – промежуточный продукт протон-протонного цикла, затем при высоких температурах через атом 8Be превращается в два атома гелия. Но если звезда живет недолго и гибнет – литий попадает в межзвездное пространство.
Есть и «в-третьих». Совершенно уникальный способ, которым образуется только три элемента – скалывание в космических лучах: частицы космических лучей «скалывают» кусочки от более тяжелых ядер.
Жозе Бонифасиу де Андрада и Силва
Человечество познакомилось с литием в 1800 году. Минерал петалит LiAlSi4O10 открыл бразильский ученый Жозе Бонифасиу де Андрада и Силва, который изучал геогнозию (как тогда называли геологию) в Португалии и которого занесло на шведский рудник Уто.
Впрочем, бразилец так и не догадался, что в новом минерале находится новый элемент – и пришлось ждать еще17 лет, пока петалит не попал в лабораторию знаменитого Йенса Якоба Берцелиуса, в руки молодого исследователя Иоганна Аугуста Арфведсона. Выполняя стандартную процедуру по установлению химического состава и определив петалит как алюмосиликат, Арфведсон определил, что алюминия, кремния и кислорода в нем 96 процентов по массе.
Петалит
Куда девались еще 4 процента? Оказалось, что в минерале присутствует некий металл, соли которого очень хорошо растворимы – еще лучше, чем соли калия и натрия. Арфведсон логично предположил, что неизвестный металл – «родственник» «потассиума» и «содиума», как иногда переводят названия калия и натрия горе-переводчики. Статью об открытии лития, впрочем, опубликовал сам Берцелиус – как руководитель лаборатории. Он же, поскольку никаких других ассоциаций «этот камень» (в смысле – петалит) не вызывал, предложил назвать литий литием (λίθος – «камень»). Впрочем, слава первооткрывателя нового элемента осталась за Арфведсоном: Берцелиусу хватило церия, селена и тория.
Иоганн Аугуст Арфведсон
С 1997 года Германское товарищество химиков (Gesellschaft Deutscher Chemiker) вручает иностранным исследователям лития премию Арфведсона-Шленка. Вторую часть названия премия получила в честь основателя литийорганической химии Вильгельма Шленка, который в 1917 году открыл первые литийорганические соединения. Кроме этого и сам Арфведсон дал имя иссиня-черному минералу арфведсониту. Правда, в его составе лития нет.
Что же дальше? Выделить чистый литий не получилось. Через год после открытия элемента немецкий химик Кристиан Готлиб Гмелин открыл первую качественную реакцию на литий – он выяснил, что соли лития окрашивают пламя в очень характерный карминово-красный цвет.
Окрашивание пламени литием
Чистый металл удалось получить британцу Уильяму Томасу Бранду, который в 1821 году добыл литий электролизом его оксида.
Уильям Томас Бранд
И, надо сказать, металл получился очень необычный. Очень мягкий – литий легко разрезать ножом: чуть тверже натрия, но помягче свинца. Очень легкий – почти в два раза легче воды. Правда в воде он не плавает, а активно с ней взаимодействует, выделяя водород. А вот в бензине – плавает. Очень быстро окисляется.
Поэтому такой металл не очень активно использовался в XIX – начале XX веков.
Металлический литий
Процитируем брошюрку «Применение редких элементов в промышленности». уральского химика Василия Сигизмундовича Сырокомского (автора многих брошюрок и методичек): «Главнейшее применение литий находит в данный момент в медицине, где углекислый и салицилово-кислый литий служат средством для растворения мочевой кислоты, выделяющейся в организме человека при подагре и некоторых других болезнях…». Это – ситуация на 1919 год, ровно через 60 лет первого использования солей лития для лечения подагры (в том числе и некоей «мозговой подагры»).
Ещё через 30 лет на краю Земли, а именно в Австралии попытка повторить «лечение подагры» привела к прорыву, который заметили не сразу.
Джон Кейд
Психиатр Джон Кейд, работавший в Мельбурне в Bundoora Repatriation Mental Hospital, проверял гипотезу о том, что маниакально-депрессивное психоз (ныне мы его называем БАР – биполярным аффективным расстройством) вызван отравлением каким-то продуктом метаболизма. И экспериментировал с животными. Чтобы вызвать у морских свинок расстройство, он впрыскивал несчастным животным мочу больных. Свинки, естественно, дохли. Кейд решил, что «побочка» от введения мочи в брюшную полость вызвана мочевой кислотой (а мы помним, что отложения кристаллов мочевой кислоты – это подагра). И тут Кейд вспомнил, как лечили подагру почти век назад. Для улучшения растворимости мочевой кислоты в крови, он добавил к моче урат лития. И внезапно, свинки стали спокойнее. Кейд что-то заподозрил. 3 сентября 1949 года в Medical Journal of Australia вышла статья Lithium salts in the treatment of psychotic excitement. Так были открыты нормотимические свойства солей лития. Увы, одно из величайших открытий в фармакологической психиатрии не сразу нашло путь в клиническую практику: в 1949 году FDA на 21 год запретило литиевые препараты из-за того, что погибло четыре пациента, получавших хлорид лития в качестве замены поваренной соли для гипертоников. А кроме того, карбонат лития – самая распространенная форма препаратов лития – не особенно интересовал фармгигантов: его же не запатентуешь, природное вещество…
Карбонат лития
Препараты лития спасают жизни и поныне. Так, например, 48 рандомизированных клинических исследований показали (на 6674 участниках, на секундочку), что литий достоверно снижает уровень суицидов при любых психических расстройствах.
Но не медициной единой знаменит литий. Звездный час его настал во второй половине XX века. Конечно же, речь идет о литий-ионных аккумуляторах. У них есть преимущества перед никель-кадмиевыми и никель-металлогидридными аккумуляторами, которык не обладают эффектом памяти (падении емкости при нарушении режима зарядки). А еще нет-нет, да взрываются. Кстати, развитие электромобилей может, наверное, сказаться на запасах лития: пока что его добывают около 600 тысяч тонн при разведанных мировых ресурсах в 65 миллионов тонн. Но рост добычи идет очень бурный. А все Маск с его «Теслой»! Больше всего лития добывают в Австралии, Чили и Аргентине, а участок Чили-Боливия-Аргентина получил название «литиевый треугольник».
Мировая добыча лития
Литий-6, как мы уже писали в главе про водород, служит источником трития в термоядерных процессах, поскольку сам тритий хранить особо негде. Именно поэтому дейтерид лития-6 – важнейший элемент водородной бомбы.
Алюмогидрид лития – прекрасная высокоэнергетичная добавка к топливу. А кое-где используется и металлический литий. Так, американская боевая торпеда Маrk 50 использует удивительный способ движения: гексафторид серы распыляется над блоком металлического лития, а выделившаяся в результате реакциии энергия превращает воду в пар, который вращает винт торпеды!
Пуск торпеды Маrk 50
Литийорганические соединения, начало которым положил век назад Вильгельм Шленк, активно используют в органическом синтезе: они по своим свойствам напоминают реактив Гриньяра, только более активны.
Вильгельм Шленк
Важным соединением лития стал его фторид. Кристаллы его прозрачны не только в оптике, но и в ультрафиолете. Поэтому именно из него делают ультрафиолетовую оптику: лучше материала не найти.
Фторид лития
Как мы уже писали в самом начале, лития в звездах очень мало. Однако астрометрический телескоп Global Astrometric Interferometer for Astrophysics (GAIA) принес загадку – около 20 звезд-гигантов содержали в своем составе аномально большое количество лития. Так появилась «проблема богатых литием гигантов, «Li-rich giant problem»
Однако в 2016 году в работе международной группы астрономов (arXiv:1603.03038) появилось объяснение. Оказалось, эту проблему можно очень изящно разрешить, предположив, что на поверхность звезд-гигантов падают слишком близкие экзопланеты. Они-то и насыщают на короткое время верхние слои звезды литием. Более того, предполагается, что в экзотических объектах Торна-Житков, красных сверхгигантах, «проглотивших» нейтронную звезду, тоже должен наблюдаться избыток лития. Осталось только наблюдать сам объект Торна-Житков.
Снимок Новой Центавра 2013. Фото Юрия Белецкого
Ну а напоследок расскажем, что совсем недавно, в 2015 году, удалось зафиксировать рождение лития во время гигантского взрыва звезды: спектральные линии лития заметили в Новой Центавра 2013 года. Здесь литий рождается во время термоядерных взрывов сжавшегося водорода, перетекшего на белый карлик со звезды-компаньона. Четвертый способ рождения лития – все-таки, это уникальный элемент!
Текст: Алексей Паевский
Литий
Ли́тий (лат. Lithium; обозначается символом Li) — элемент главной подгруппы первой группы, второго периода периодической системы химических элементов таблицы Менделеева, с атомным номером 3. Простое вещество литий (CAS-номер: 7439-93-2) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене LiAl[Si2O6] и в лепидолите KLi1.5Al1.5[Si3AlO10](F,OH)2. Металлический литий впервые получил Гемфри Дэви в 1825 году.
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Нахождение в природе
Геохимия лития
Литий по геохимическим свойствам относится к крупноионным литофильным элементам, в числе которых калий, рубидий и цезий. Содержание лития в верхней континентальной коре составляет 21 г/т, в морской воде 0,17 мг/л.
Основные минералы лития — слюда лепидолит — KLi1.5Al1.5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносоленых озёр.
Месторождения
Месторождения лития известны в России (более 50% запасов страны сосредоточено в редкометальных месторождениях Мурманской области), Боливии, Аргентине, Мексике, Афганистане, Чили, США, Канаде, Бразилии, Испании, Швеции, Китае, Австралии, Зимбабве, Конго.
Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси).
2LiCl = 2Li + Cl2
В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранится в керосине (к тому же плотность лития столь мала, что он будет в нём плавать) и может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом, находящимся в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °C до 300 °C литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с водородом (при 500—700 °C) с образованием гидрида лития, с аммиаком и с галогенами (с иодом — только при нагревании). При 130 °C реагирует с серой с образованием сульфида. В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид). При 600—700 °C литий реагирует с кремнием с образованием силицида. Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор.
Литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Источник: Википедия
Другие заметки по химии
Толковый словарь русского языка. Поиск по слову, типу, синониму, антониму и описанию. Словарь ударений.
литий
ТОЛКОВЫЙ СЛОВАРЬ
м.
Химический элемент, серебристо-белый, мягкий, очень лёгкий щелочной металл.
ТОЛКОВЫЙ СЛОВАРЬ УШАКОВА
ЛИ́ТИЙ, лития, мн. нет, муж. (от греч. lithios — каменный) (минер., хим.). Химический элемент — серебристобелый, мягкий, очень легкий щелочный металл, не встречающийся в природе в чистом виде, а только в виде солей.
СЛОВАРЬ СУЩЕСТВИТЕЛЬНЫХ
ЛИ́ТИЙ, -я, м
Химический элемент, мягкий (легко режется ножом), очень легкий щелочной металл серебристо-белого цвета (в природе в чистом виде не встречается); на воздухе легко окисляется.
Литий применяется в металлургии, как теплоноситель — в ядерных реакторах, используется в медицине, в химических источниках тока, при изготовлении термостойкой керамики, специальных стекол и др.
ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
ЛИ́ТИЙ -я; м. [от греч. lithos — камень, минерал] Химический элемент (Li), мягкий, очень лёгкий щелочной металл серебристо-белого цвета (в природе в чистом виде не встречается).
◁ Ли́тиевый, -ая, -ое.
* * *
ли́тий (лат. Lithium), химический элемент I группы периодической системы, относится к щелочным металлам. Название от греч. líthos — камень (открыт в минерале петалите). Серебристо-белый, самый лёгкий из металлов; плотность 0,533 г/см3, tпл 180,5°C. Химически очень активен, окисляется при обычной температуре; реагирует с азотом, образуя нитрид Li3N. Минералы — сподумен, лепидолит и др. Изотоп Li — единственный промышленный источник для производства трития. Литий используют для раскисления, легирования и модифицирования сплавов (например, аэрона, склерона), как теплоноситель в ядерных реакторах, компонент сплавов на основе Mg и Al, анод в химических источниках тока; некоторые соединения лития входят в состав пластичных смазок, специальных стёкол, термостойкой керамики, используются в медицине.
* * *
ЛИТИЙ — ЛИ́ТИЙ (лат. Lithium), Li, химический элемент с атомным номером 3, атомная масса 6,941. Химический символ Li читается так же, как и название самого элемента.
Литий встречается в природе в виде двух стабильных нуклидов (см. НУКЛИД)6Li (7,52% по массе) и 7Li (92,48%). В периодической системе Д. И. Менделеева литий расположен во втором периоде, группе IA и принадлежит к числу щелочных металлов (см. ЩЕЛОЧНЫЕ МЕТАЛЛЫ). Конфигурация электронной оболочки нейтрального атома лития 1s22s1. В соединениях литий всегда проявляет степень окисления +1.
Металлический радиус атома лития 0,152 нм, радиус иона Li+ 0,078 нм. Энергии последовательной ионизации атома лития 5,39 и 75,6 эВ. Электроотрицательность по Полингу 0,98, самая большая у щелочных металлов.
В виде простого вещества литий — мягкий, пластичный, легкий, серебристый металл.
История открытия и получение
Литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном (см. АРФВЕДСОН Юхан Август)сначала в минерале петалите (Li,Na)[Si4AlO10], а затем в сподумене (см. СПОДУМЕН)LiAl[Si2O6] и в лепидолите (см. ЛЕПИДОЛИТ)KLi1.5Al1.5[Si3AlO10](F,OH)2. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos — камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х.Г.Гмелин в 1818 году. В этом же году английский химик Г. Дэви (см. ДЭВИ Гемфри) электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида:
2LiCl = 2Li + Cl2
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Нахождение в природе
Литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10-3% по массе. Как уже упоминалось, основные минералы, содержащие литий, — это петалит (содержит 3,5-4,9 % Li2O), сподумен (6-7 % Li2O), лепидолит (4-6 % Li2,O) и амблигонит (см. АМБЛИГОНИТ)LiAl [PO4] — 8-10 % Li2,O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10-5 % лития.
Физические и химические свойства
Из металлов литий самый легкий, его плотность 0,534 г/см3 . Температура плавления 180,5°C, температура кипения 1326°C. При температурах от -193°C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а=0,350 нм.
Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний (см. МАГНИЙ). Литий химически очень активен. Он способен взаимодействовать с кислородом и азотом воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия:
4Li + O2 = 2Li2O,
6Li + N2 = 2Li3N
При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию, нагретый литий способен гореть в CO2:
4Li + CO2 = C + 2Li2O
Стандартный электродный потенциал Li/Li+ имеет наибольшее отрицательное значение (E°298 = -3,05 B) по сравнению со стандартными электродными потенциалами других металлов. Это обусловлено большой энергией гидратации маленького иона Li+, что значительно смещает равновесие в сторону ионизации металла:
Liтвердый Li+раствор + e
Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов.
Соединения лития — соли — как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния или кальция. Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 — это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313,5 г LiClO3).
Оксид лития Li2O — белое твердое вещество — представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH.
Этот гидроксид получают электролизом водных растворов LiCl:
2LiCl + 2H2O = 2LiOH + Cl2 + H2
LiOH — сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов. Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду:
2LiOH = Li2O + H2O
Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом:
2Li + H2 = 2LiH
LiH — ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2,8 м3 H2):
LiH + H2O = LiOH + H2
Он также находит применение при синтезе различных гидридов, например, борогидрида лития:
BCl3 + 4LiH = Li[BH4] + 3LiCl.
Литий образует соединения с частично ковалентной связью Li-C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция:
C6H5I + 2Li = C6H5Li + LiI.
Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов.
Применение
Из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6Li получают радиоактивный тритий 31H (Т):
63Li + 10n = 31H + 42He.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и цветной металлургии (для раскисления, повышения пластичности и прочности сплавов), для получения пластичных смазок. Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Биологическая роль
Литий в незначительных количествах присутствует в живых организмах, но по-видимому, не выполняет никаких биологических функций. Установлено его стимулирующее действие на некоторые процессы в растениях, способность повышать их устойчивость к заболеваниям.
В организме среднего человека (масса 70 кг) содержится около 0,7 мг лития. Токсическая доза 90-200 мг.
Особенности обращения с литием
Как и другие щелочные металлы, металлический литий способен вызывать ожоги кожи и слизистых, особенно в присутствии влаги. Поэтому работать с ним можно только в защитной одежде и очках. Хранят литий в герметичной таре под слоем минерального масла. Отходы лития нельзя выбрасывать в мусор, для уничтожения их следует обработать этиловым спиртом:
2С2Н5ОН + 2Li = 2С2Н5ОLi + Н2
Образовавшийся этилат лития затем разлагают водой до спирта и гидроксида лития LiOH.
БОЛЬШОЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
ЛИТИЙ (лат. Lithium) — Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Название от греч. lithos — камень (открыт в минерале петалите). Серибристо-белый, самый легкий из металлов; плотность 0,533 г/см³, tплощадь 180,5 .С. Химически очень активен, окисляется при обычной температуре; реагирует с азотом, образуя нитрид Li3N. Минералы — сподумен, лепидолит и др. Изотоп Li — единственный промышленный источник для производства трития. Литий используют для раскисления, легирования и модифицирования сплавов (напр., аэрона, склерона), как теплоноситель в ядерных реакторах, компонент сплавов на основе Mg и Al, анод в химических источниках тока; некоторые соединения лития входят в состав пластичных смазок, специальных стекол, термостойкой керамики, используются в медицине.
АКАДЕМИЧЕСКИЙ СЛОВАРЬ
-я, м.
Химический элемент, мягкий, очень легкий щелочной металл серебристо-белого цвета, не встречающийся в природе в чистом виде.
[От греч. λίθος — камень, минерал]
ИЛЛЮСТРИРОВАННЫЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
ЛИТИЙ (Lithium), Li, химический элемент I группы периодической системы, атомный номер 3, атомная масса 6,941; относится к щелочным металлам, tпл 180,54°C. Литий используют для изготовления анодов для химических источников тока, в производстве меди, сплавов с магнием, алюминием, кремнием, антифрикционных и других сплавов, как теплоноситель в ядерных реакторах; изотоп 6Li — для получения трития. Литий открыл в 1817 шведский химик Ю.А. Арфведсон, впервые получил английский ученый Г. Дэви в 1818.
ОРФОГРАФИЧЕСКИЙ СЛОВАРЬ
СЛОВАРЬ УДАРЕНИЙ
ли́тий, ли́тия (хим. элемент)
ФОРМЫ СЛОВ
ли́тий, ли́тии, ли́тия, ли́тиев, ли́тию, ли́тиям, ли́тием, ли́тиями, ли́тиях
СИНОНИМЫ
сущ., кол-во синонимов: 2
МОРФЕМНО-ОРФОГРАФИЧЕСКИЙ СЛОВАРЬ
ГРАММАТИЧЕСКИЙ СЛОВАРЬ
СЛОВАРЬ ИНОСТРАННЫХ СЛОВ
ЛИТИЙ (лат. lithium, от греч. lithos — камень). Металл белого цвета, открытый в 1817 г. в петалите; все соли его растворимы в воде.
СКАНВОРДЫ
— Щелочной металл.
— Первый металл в таблице Менделеева.
— Металл, который мягче воска и легче дерева.
— Самый легковесный металл.
— Какой металл плавится при температуре тела?
— Самый легкоокисляемый металл.
— Химический элемент, Li.
— «Литос» по-гречески «камень», а какой металл получил шведский химик Арфедсон самым первым из царства камней?
— Батискаф и атомная бомба, пиротехника и лечение психозов — вот области применения этого химического элемента.
— Своё название этот химический элемент получил из-за того, что был обнаружен в камнях.
— Этот щелочной металл был воспет большим любителем химии Куртом Кобэйном.
ПОЛЕЗНЫЕ СЕРВИСЫ
литийная кислота
СЛОВАРЬ ИНОСТРАННЫХ СЛОВ
ЛИТИЙНАЯ КИСЛОТА (от греч. lithos — камень). Мочевая кислота, находящаяся в моче и мочевых камнях.
ПОЛЕЗНЫЕ СЕРВИСЫ
литийный
ОРФОГРАФИЧЕСКИЙ СЛОВАРЬ
ПОЛЕЗНЫЕ СЕРВИСЫ
литийорганические соединения
ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
Литийоргани́ческие соедине́ния — содержат в молекуле атом лития, непосредственно связанный с атомом углерода. Применяются как катализаторы полимеризации (бутиллитий C4H9Li и др.) при получении бутадиеновых и изопреновых каучуков, в органической синтезе.
* * *
ЛИТИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — ЛИТИЙОРГАНИ́ЧЕСКИЕ СОЕДИНЕ́НИЯ, содержат в молекуле атом лития, непосредственно связанный с атомом углерода. Применяются как катализаторы полимеризации (бутиллитий C4H9Li и др.) при получении бутадиеновых и изопреновых каучуков, в органическом синтезе.
БОЛЬШОЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ
ЛИТИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат в молекуле атом лития, непосредственно связанный с атомом углерода. Применяются как катализаторы полимеризации (бутиллитий C4H9Li и др.) при получении бутадиеновых и изопреновых каучуков, в органическом синтезе.
ПОЛЕЗНЫЕ СЕРВИСЫ
литийорганический
СЛИТНО. РАЗДЕЛЬНО. ЧЕРЕЗ ДЕФИС
ОРФОГРАФИЧЕСКИЙ СЛОВАРЬ
МОРФЕМНО-ОРФОГРАФИЧЕСКИЙ СЛОВАРЬ
ПОЛЕЗНЫЕ СЕРВИСЫ








.jpg)