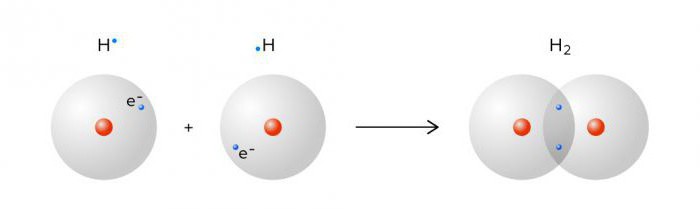
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме основной изотопной модификации H2, существуют разновидности, в которых один или оба атома протия заменены другими изотопами водорода — дейтерием или тритием: HD, HT, D2, DT, T2. Симметричность или несимметричность молекулы имеет значение при её вращении.
Содержание
- 1 Модели молекулы водорода
- 2 Гамильтониан
- 3 Волновые функции
- 4 Энергия электронных состояний
- 5 Зависимость энергии основного состояния от расстояния между ядрами
- 5.1 Ковалентная связь
- 5.2 Насыщение ковалентной связи
- 6 Движение ядер в молекуле водорода
- 6.1 Вращение
- 6.2 Колебания атомов
- 7 Пара- и ортоводород
- 8 Характеристики молекулы водорода
- 9 См. также
- 10 Примечания
- 11 Литература
Модели молекулы водорода
Рис.1.Модель водорода по Бору и осевая проекция электронного кольца
Н.Бор ещё в 1913 году дал описание модели молекулы водорода[1]. Согласно Бору, два внешних электрона, образующих молекулу, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга (рис.1). Боровская модель химической связи давала чёткую картину образования молекулярного водорода — динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга (d), притяжением кольца из двух электронов. При этом модель Н.Бора отражала кулоновскую электронную корреляцию — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
Также как и боровская модель атома, боровская модель молекулы водорода не отражала и не могла отражать волновую природу электрона и статистическую интерпретацию волновой функции. Здесь уместно дополнить боровскую модель молекулы водорода достижениями квантовой механики, аналогично боровской модели атома. В этом случае гипотетическое кольцо электронов в модели молекулы водорода трансформируется в геометрическое место расположения плотности вероятности нахождения связывающих электронов. Электронную пару следует представлять электронным облаком в форме кольца, баранки, тора. При этом предполагается, что электроны в торе удалены друг от друга на максимально возможное расстояние, а электронная плотность в молекуле водорода имеет минимум — «кулоновскую дырку» на линии, соединяющей ядра молекулы водорода. Наиболее вероятный радиус электронного тора (re) определяется боровским радиусом a0 и межъядерным расстоянием (d)
re2 = a02 — (d/2)2; re = 0,377 Å.
Рис.2.Контурная карта электронной плотности для молекулы водорода[2]
В теории молекулярных орбиталей, разработанной в 1927—1932 г.г. Ф.Хундом, Р.Малликеном и др., модель молекулы водорода описывали контурными картами электронной плотности (рис.2).
Карта строится как разность между электронной плотностью молекулы и несвязанных атомов. Сплошные линии контурной карты отражают области увеличения электронной плотности (в единицах заряда электрона). Пунктирные — области её уменьшения в молекуле по сравнению с электронной плотностью несвязанных атомов водорода, сближенных на равновесное расстояние.[2]
Поскольку в теории молекулярных орбиталей учитывается лишь фермиевская корреляция электронов, поэтому электронная плотность в молекуле водорода сконцентрирована на линии, соединяющей ядра молекулы (см. рис.2).
Рис.3.Модель молекулы водорода в теории валентных связей
Квантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлер и Фриц Лондон. Выполненный ими расчёт волновых функций явился основой теории валентных связей. В этой теории модель молекулы водорода описывали перекрыванием атомных орбиталей атомов водорода (1S типа). Схема перекрывания электронных облаков, образующих сигма-связь молекулы водорода, совпадает с линией соединения атомных центров молекулы (рис.3).
Расчёт молекулы водорода в основном сводится к определению интеграла перекрытия атомных орбиталей.
Гамильтониан
Гамильтониан молекулы водорода H2 записывается в виде
-
-
-
-
-
-
-
-
-
,
-
-
-
-
-
-
-
-
-
где M — масса протона, m — масса электрона, 

В адиабатическом приближении задача нахождения энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках 

Гамильтониан электронной подсистемы имеет вид
,
Гамильтониан молекулы водорода симметричен относительно переменных 

Волновые функции
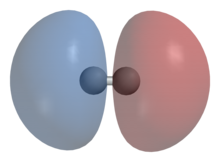
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение антисимметричной волновой функции молекулы водорода
Исходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водорода 
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Энергия электронных состояний
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
.
Для двух возможных волновых функций основного состояния она приобретает вид
,
где 


,

,

-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для 
Величина 

Зависимость энергии основного состояния от расстояния между ядрами
Ковалентная связь
Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состояний
Обменный интеграл для молеклы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Насыщение ковалентной связи
Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атому отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь.
Движение ядер в молекуле водорода
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
,
где 


Вращение
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные функции гамильтониана можно выбрать общими с собственными функциями оператора углового момента, то есть сферические гармоники:
.
Вклад вращения в энергию молекулы равен
.
Этот вклад мал, потому, что массы ядер намного больше, чем массы электронов. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательное движение, строго говоря, невозможно отделить от колебательного. Однако при малых l и при малых энергиях колебательного движения можно считать, что R равняется определённому среднему значению.
Вращательные уровни вырождены относительно магнитного квантового числа ml. Кратность вырождения 2l+1.
Колебания атомов
Вблизи минимума функцию 
,
где
Таким образом, задача об энергетических состояниях колебания ядер сводится к задаче квантового гармонического осциллятора. Следовательно, для низших колебательных и вращательных уровней энергия молекулы водорода равна
,
где 
Низшая энергия колебания 
При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорционально 

.
Следовательно, электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные. Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
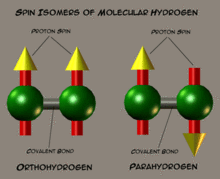
Пара- и ортоводород
Схематическое изображене спиновых изомеров водорода
Ядра атомов водорода, входящие в состав молекулы, являются протонами — фермионами со спином 1/2. По правилам сложения спинов ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводородом, а молекулы с суммарным ядерным спином 1 и тремя возможными проекциями (−1, 0, 1) называют ортоводородом. В состоянии термодинамического равновесия при комнатной температуре отношение между ортоводородом и параводородом составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Характеристики молекулы водорода
Межъядерные расстояния и энергии диссоциации молекул водорода, его изотопов и молекулярного иона водорода[3]
| Молекула | Межъядерное расстояние,Å | Энергия диссоциации, Эв |
|---|---|---|
| H2 | 0,7416 | 4,477 |
| HD | 0,7414 | 4,512 |
| D2 | 0,7416 | 4,555 |
| DT | 0,7416 | 4,570 |
| T2 | 0,7416 | 4,588 |
| HT | 0,7416 | 4,524 |
| H2+ | 1,06 | 2,648 |
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения (α) в зависимости от абсолютной температуры[4]:
| T, к | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10-6 | 2,47 · 10-2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10-4 | 7,83 · 10-2 | 0,621 | 0,954 | 0,992 | 0,999 |
См. также
- Молекулярный ион водорода
- Рекомбинация (химия)
- Боровская модель химической связи
- Кулоновская электронная корреляция
- Статистическая интерпретация волновой функции
- Теория молекулярных орбиталей
- Теория валентных связей
Примечания
- ↑ Бор Н. Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с.
- ↑ 1 2 Химический энциклопедический словарь / гл. редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 646. — 792 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.-Л.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 338. — 1072 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.-Л.: ГНТИ Химической литературы, 1964. — Т. 3. — С. 24. — 1008 с.
Литература
- Білий М. У. Атомна фізика. — Київ: Вища школа, 1973. (укр.)
- Федорченко А. М. Теоретична фізика. Квантова механіка, термодинаміка і статистична фізика. Т.2. — Київ: Вища школа, 1993.
- Юхновський І. Р. Основи квантової механіки. — Київ: Либідь, 2002.
- Ландау Л. Д., Лившиц Е. М. Теоретическая физика. т. ІІІ. Квантовая механика. Нерелятивистская теория. — М.: Наука, 1974.
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме основной изотопной модификации H2, существуют разновидности, в которых один или оба атома протия заменены другими изотопами водорода — дейтерием или тритием: HD, HT, D2, DT, T2. Симметричность или несимметричность молекулы имеет значение при её вращении.
Содержание
- 1 Модели молекулы водорода
- 2 Гамильтониан
- 3 Волновые функции
- 4 Энергия электронных состояний
- 5 Зависимость энергии основного состояния от расстояния между ядрами
- 5.1 Ковалентная связь
- 5.2 Насыщение ковалентной связи
- 6 Движение ядер в молекуле водорода
- 6.1 Вращение
- 6.2 Колебания атомов
- 7 Пара- и ортоводород
- 8 Характеристики молекулы водорода
- 9 См. также
- 10 Примечания
- 11 Литература
Модели молекулы водорода
Рис.1.Модель водорода по Бору и осевая проекция электронного кольца
Н.Бор ещё в 1913 году дал описание модели молекулы водорода[1]. Согласно Бору, два внешних электрона, образующих молекулу, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга (рис.1). Боровская модель химической связи давала чёткую картину образования молекулярного водорода — динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга (d), притяжением кольца из двух электронов. При этом модель Нильса Бора учитывала кулоновское отталкивание — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
Также как и боровская модель атома, боровская модель молекулы водорода не отражала и не могла отражать волновую природу электрона и статистическую интерпретацию волновой функции. Здесь уместно дополнить боровскую модель молекулы водорода достижениями квантовой механики, аналогично боровской модели атома. В этом случае гипотетическое кольцо электронов в модели молекулы водорода трансформируется в геометрическое место расположения плотности вероятности нахождения связывающих электронов. Электронную пару следует представлять электронным облаком в форме кольца, баранки, тора. При этом предполагается, что электроны в торе удалены друг от друга на максимально возможное расстояние, а электронная плотность в молекуле водорода имеет минимум — «кулоновскую дырку» на линии, соединяющей ядра молекулы водорода. Наиболее вероятный радиус электронного тора (re) определяется боровским радиусом a0 и межъядерным расстоянием (d)
- re2 = a02 — (d/2)2; re = 0,377 Å.
Рис.2.Контурная карта электронной плотности для молекулы водорода[2]
В теории молекулярных орбиталей, разработанной в 1927—1932 г.г. Ф.Хундом, Р.Малликеном и др., модель молекулы водорода описывали контурными картами электронной плотности (рис.2).
Карта строится как разность между электронной плотностью молекулы и несвязанных атомов. Сплошные линии контурной карты отражают области увеличения электронной плотности (в единицах заряда электрона). Пунктирные — области её уменьшения в молекуле по сравнению с электронной плотностью несвязанных атомов водорода, сближенных на равновесное расстояние.[2]
Поскольку в теории молекулярных орбиталей учитывается лишь фермиевская корреляция электронов, поэтому электронная плотность в молекуле водорода сконцентрирована на линии, соединяющей ядра молекулы (см. рис.2).
Рис.3.Модель молекулы водорода в теории валентных связей
Квантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлер и Фриц Лондон. Выполненный ими расчёт волновых функций явился основой теории валентных связей. В этой теории модель молекулы водорода описывали перекрыванием атомных орбиталей атомов водорода (1S типа). Схема перекрывания электронных облаков, образующих сигма-связь молекулы водорода, совпадает с линией соединения атомных центров молекулы (рис.3).
Расчёт молекулы водорода в основном сводится к определению интеграла перекрытия атомных орбиталей.
Гамильтониан
Гамильтониан молекулы водорода H2 записывается в виде
-
-
-
-
-
-
-
-
-
,
-
-
-
-
-
-
-
-
-
где M — масса протона, m — масса электрона, 

В адиабатическом приближении задача нахождения энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках 

Гамильтониан электронной подсистемы имеет вид
,
Гамильтониан молекулы водорода симметричен относительно переменных 

Волновые функции
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение антисимметричной волновой функции молекулы водорода
Исходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водорода 
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Энергия электронных состояний
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
.
Для двух возможных волновых функций основного состояния она приобретает вид
,
где 


,

,

-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для 
Величина 

Зависимость энергии основного состояния от расстояния между ядрами
Ковалентная связь
Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состояний
Обменный интеграл для молекулы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Насыщение ковалентной связи
Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атомы отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь.
Движение ядер в молекуле водорода
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
,
где 


Вращение
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные функции гамильтониана можно выбрать общими с собственными функциями оператора углового момента, то есть сферические гармоники:
.
Вклад вращения в энергию молекулы равен
.
Этот вклад мал, потому, что массы ядер намного больше, чем массы электронов. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательное движение, строго говоря, невозможно отделить от колебательного. Однако при малых l и при малых энергиях колебательного движения можно считать, что R равняется определённому среднему значению.
Вращательные уровни вырождены относительно магнитного квантового числа ml. Кратность вырождения 2l+1.
Колебания атомов
Вблизи минимума функцию 
,
где
Таким образом, задача об энергетических состояниях колебания ядер сводится к задаче квантового гармонического осциллятора. Следовательно, для низших колебательных и вращательных уровней энергия молекулы водорода равна
,
где 
Низшая энергия колебания 
При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорционально 

.
Следовательно, электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные. Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
Пара- и ортоводород
Схематическое изображение спиновых изомеров водорода
Ядра атомов водорода, входящие в состав молекулы, являются протонами — фермионами со спином 1/2. По правилам сложения спинов ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводородом, а молекулы с суммарным ядерным спином 1 и тремя возможными проекциями (−1, 0, 1) называют ортоводородом. В состоянии термодинамического равновесия при комнатной температуре отношение между ортоводородом и параводородом составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Характеристики молекулы водорода
Межъядерные расстояния и энергии диссоциации молекул водорода, его изотопов и молекулярного иона водорода[3]
| Молекула | Межъядерное расстояние,Å | Энергия диссоциации, Эв |
|---|---|---|
| H2 | 0,7416 | 4,477 |
| HD | 0,7414 | 4,512 |
| D2 | 0,7416 | 4,555 |
| DT | 0,7416 | 4,570 |
| T2 | 0,7416 | 4,588 |
| HT | 0,7416 | 4,524 |
| H2+ | 1,06 | 2,648 |
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения (α) в зависимости от абсолютной температуры[4]:
| T, к | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10-6 | 2,47 · 10-2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10-4 | 7,83 · 10-2 | 0,621 | 0,954 | 0,992 | 0,999 |
См. также
- Молекулярный ион водорода
- Рекомбинация (химия)
- Боровская модель химической связи
- Статистическая интерпретация волновой функции
- Теория молекулярных орбиталей
- Теория валентных связей
Примечания
- ↑ Бор Н. Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с.
- ↑ 1 2 Химический энциклопедический словарь / гл. редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 646. — 792 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.—Л.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 338. — 1072 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — М.—Л.: ГНТИ Химической литературы, 1964. — Т. 3. — С. 24. — 1008 с.
Литература
- Білий М. У. Атомна фізика. — Київ: Вища школа, 1973. (укр.)
- Федорченко А. М. Теоретична фізика. Квантова механіка, термодинаміка і статистична фізика. Т.2. — Київ: Вища школа, 1993.
- Юхновський І. Р. Основи квантової механіки. — Київ: Либідь, 2002.
- Ландау Л. Д., Лившиц Е. М. Теоретическая физика. т. ІІІ. Квантовая механика. Нерелятивистская теория. — М.: Наука, 1974.
-
Элоиза
21 октября, 20:01
0
Такие же формулы есть и в учебнике: Н; Н2; 2 О; О2; 2 Н2
- Комментировать
- Жалоба
- Ссылка
-
Найдите правильный ответ на вопрос ✅ «Как пишется атом водорода, молекула водорода, два атома кислорода, молекула кислорода, 2 молекулы водорода. …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » ⭐️ Химия » Как пишется атом водорода, молекула водорода, два атома кислорода, молекула кислорода, 2 молекулы водорода.
Химия
Вадиша
21 октября, 19:18
Найдите правильный ответ на вопрос ✅ «Как пишется атом водорода, молекула водорода, два атома кислорода, молекула кислорода, 2 молекулы водорода. …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Новые вопросы по химии
Химия: Какие частицы входят в состав ядра атома? а). электроны б). протоны в). нейтроны г). ионы
Ответы (3)
По положению элемента #40 в табл Менделеева запишите электрон конфигур. Выделите ваоентные электронв и распредилите их по квантовым состоянием в стабильном и возбуж состояниях. Для валент электрон запишите квант числа.
Ответы (1)
Кількість речовини атомів Оксигену у 49 г сульфатної кислоти?
Ответы (1)
CH3-CH2-CH2-Cl+KOH⇒?
Ответы (2)
Сожгли вещество, масса которого 13,8 грамм, при этом выделился оксид углерода (четырех валентный) объемом 23,52 литра, и вода массой 10,8 грамм. Плотность этого вещества по водороду 46. Установить молекулярную формулу
Ответы (2)
Главная » ⭐️ Химия » Как пишется атом водорода, молекула водорода, два атома кислорода, молекула кислорода, 2 молекулы водорода.
H,2O,H2,O,O2(вот смотри вроде так )
Такие же формулы есть и в учебнике: Н; Н2; 2О; О2; 2Н2
Сомневаешься в ответе?
Если сомневаешься в правильности ответа или его просто нет, то попробуй воспользоваться поиском
на сайте и найти похожие вопросы по предмету Химия либо задай свой вопрос и получи
ответ в течении нескольких минут.
Смотреть другие ответы
Химия
Как пишется атом водорода, молекула водорода, два атома кислорода, молекула кислорода, 2 молекулы водорода.
Попроси больше объяснений
Следить
Отметить нарушение
Автор: Гость
Обучайтесь и развивайтесь всесторонне вместе с нами, делитесь знаниями и накопленным опытом, расширяйте границы знаний и ваших умений.
поделиться знаниями или
запомнить страничку
- Все категории
- экономические
43,419 - гуманитарные
33,633 - юридические
17,906 - школьный раздел
608,162 - разное
16,857
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Как пишется атом водорода, молекула водорода, два атома кислорода, молекула кислорода, 2 молекулы водорода.
В периодической таблице Менделеева под номером 1 расположен самый часто встречающийся элемент во Вселенной — водород. Его распространение, в процентном соотношении, приближается к 75%. Самое низкое его содержание отмечено в слоях атмосферы – 0,0001%. В коре Земли содержится 1% газа по массе. Наибольшее его количество отмечается в воде: 12%. На нашей планете это третий по распространению химический элемент.
Описание элемента
Молекула водорода, формула которого Н-Н или Н2, наделена физическими и химическими свойствами.
Водород является газом, который не наделен ни цветом, ни запахом. Расположение водорода в таблице на 1 месте обусловлено тем, что в различных условиях этот элемент может проявлять себя как металл или как газ. На его внешней орбитали расположен 1 электрон, который водород может отдавать (металлические свойства) или же принимать еще один (качества газа).
Диаметр водородной молекулы равняется 27 нм.
Диаметр атома водорода равен 1А, радиус – 0, 41 А.
Свойства
К физическим относятся следующие:
- Температура кипения – 256оС.
- Температура плавления -259,2оС.
- Масса по воздуху (D) — 0,069.
- Водород плохо растворим в воде.
Химические свойства таковы:
- Неполярная связь между частицами молекулы обладает энергией в 436 кДж/моль.
- Температура тепловой диссоциации равна 2000оС.
- Реагирует с:
- галогенами;
- кислородом;
- серой;
- азотом;
- оксидом азота;
- активными металлами.
В условиях природы, водород встречается как в естественном виде, так и в форме изотопов: протий, дейтерий и тритий.
Строение молекулы
Молекула элемента имеет простое строение. Состав молекулы водорода представлен двумя атомами, которые, сближаясь, образуют ковалентную неполярную связь, а также одну электронную пару. Строение одного атома представляет: 1 положительно заряженное ядро, вокруг которого передвигается 1 отрицательно заряженный электрон. Этот электрон располагается на 1s орбитали.
Н — 1е = Н+ этот ион водорода является положительным.
Это выражение указывает на то, что водород обладает схожими параметрами с элементами 1 группы в периодической системе, которые являются щелочными металлами (литий, натрий, калий), отдающими свой единственный электрон на внешней орбитали.
Н + 1е = Н– ион водорода отрицательный.
Это уравнение показывает, что водород является родственным с аналогичными элементами из 7-й группы, которые являются газом и способны принимать недостающие электроны на свой внешний электронный уровень. К таким газам относятся: фтор, хлор, бром и т. д.
Состав молекулы водорода графически представлена далее.
Расстояние между водородными атомами r=0,74 А, в то время, как сумма орбитальных радиусов составляет 1,06 А. Это влияет на глубину перекрывания электронных облаков и на прочную, устойчивую водородную связь.
Атом водорода является самым элементарным атомом в природе. Размер атомного протона равен 10,5 А, а диаметр одного атома равен 0,1 нм.
Молекулы изотопов имеют особое строение. Атомное ядро протия состоит из одного лишь протона. Обозначается изотоп: 1Н.
Ядерное строение выглядит как комплекс из протона и нейтрона (2Н).
3Н — тритий — в своем атомном строении наделен ядром с 1 протоном и двумя нейтронами.
Масса
В науке существуют формулы, вычисляющие, чему равна масса молекулы водорода. По отношению к элементу, определяют молекулярную и атомную массы.
Молярная масса молекулы водорода вычисляется по общей формуле:
M = m / n, где m — это масса вещества, n — его количество.
Масса атома равна 1,008 а.е.м. Следовательно, относительная масса молекулы будет также равна 1,008. Поскольку молекула водорода состоит из двух атомов, то относительный атомный вес равен 2,016 а. е. м. Масса молекулы водорода выражается в граммах на моль (г/моль).
Значение в природе
Наиболее значимым в природе веществом, которое образует водород в комплексе с кислородом, является вода. Вода – источник жизни, поэтому водород – это жизненно необходимый элемент.
Из 100% всех химических элементов, которые составляют организменную среду, 1/10 часть, или 10%, приходится на водород. Помимо воды, он способен поддерживать четвертичную белковую структуру, что является возможным, благодаря водородной связи.
Принцип комплементарности нуклеиновых кислот также происходит с действием водородной молекулы. В растительной клетке Н принимает участие в процессе фотосинтеза, биосинтеза, в переносе энергии по мембранным каналам.
Применение
В химической промышленности водород достаточно широко применим. Его добавляют при изготовлении пластмассовых изделий, в мыловарении, а также при аммиачном и ментоловом производстве.
Пищевая промышленность: при выработке продуктов питания, водород добавляют в качестве пищевой добавки Е949. Такой компонент можно увидеть на упаковке маргарина, растительных масел. Добавка Е949 разрешена пищевой промышленностью РФ.
Водород некогда был задействован и в промышленности воздухоплавания, поскольку вещество легче воздуха. Так, в 30-е годы прошлого века этим вида газа наполняли воздушные шары и дирижабли. Несмотря на его дешевизну и удобство использования, водород вскоре прекратили использовать в качестве наполнителя, поскольку участились случаи взрывов летательных аппаратов.
В наши дни газ применяют, как топливо, используемое в космической промышленности. Однако рассматриваются методы применения его для работы двигателей легковых и грузовых автомобилей, поскольку элемент при сгорании не выделяет в атмосферу вредных примесей, а, значит, является экологически чистым.
Неотъемлемым компонентом изотопы водорода выступают в составе многих медикаментозных средств. Дейтерий применяют в фармакологических исследованиях, для определения поведения и воздействия лекарственного препарата в организме. Тритий используется в радиодиагностике, как элемент, определяющий биохимические реакции метаболизма ферментов. Водород входит в состав перекиси, которая является дезинфицирующим средством.
dsulor51
Вопрос по химии:
Как пишется атом водорода, молекула водорода, два атома кислорода, молекула кислорода, 2 молекулы водорода.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
sthowithen
H,2O,H2,O,O2(вот смотри вроде так )
eryeshaisi796
Такие же формулы есть и в учебнике: Н; Н2; 2О; О2; 2Н2
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.





 ,
, ,
,
 .
. ,
, ,
,![Q(R) = e^2 int psi^2_{1s}(|mathbf{r}_1 - mathbf{R}_1|) psi^2_{1s}(|mathbf{r}_2 - mathbf{R}_2|)
left[ frac{1}{|mathbf{r}_1 -mathbf{r}_2|} - frac{1}{|mathbf{r}_1 -mathbf{R}_2|} - frac{1}{|mathbf{r}_2 -mathbf{R}_1|} right] dV_1 dV_2](https://dic.academic.ru/dic.nsf/ruwiki/ce29ae941f494f67c708c8edbd1ba74e.png) ,
,
![left. - frac{1}{|mathbf{r}_1 -mathbf{R}_2|} - frac{1}{|mathbf{r}_2 -mathbf{R}_1|} right] dV_1 dV_2](https://dic.academic.ru/dic.nsf/ruwiki/69cccb624a5622f849040c7dc9ec31f7.png) .
.
 ,
, .
. .
. ,
,
 ,
,
 .
.













![{displaystyle Q(R)=e^{2}int psi _{1s}^{2}(|mathbf {r} _{1}-mathbf {R} _{1}|)psi _{1s}^{2}(|mathbf {r} _{2}-mathbf {R} _{2}|)left[{frac {1}{|mathbf {r} _{1}-mathbf {r} _{2}|}}-{frac {1}{|mathbf {r} _{1}-mathbf {R} _{2}|}}-{frac {1}{|mathbf {r} _{2}-mathbf {R} _{1}|}}right]dV_{1}dV_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf169c618ac3787e5435de547f616b47513946eb)

![{displaystyle left.-{frac {1}{|mathbf {r} _{1}-mathbf {R} _{2}|}}-{frac {1}{|mathbf {r} _{2}-mathbf {R} _{1}|}}right]dV_{1}dV_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6a35ce1f8f86821b22057c6cfda97ffaeef1604)