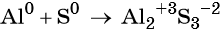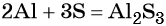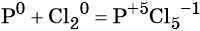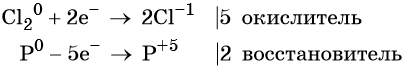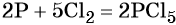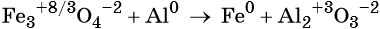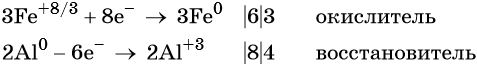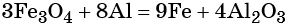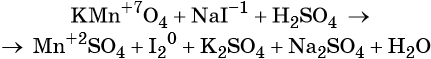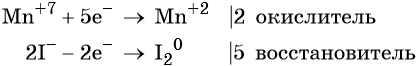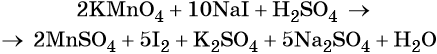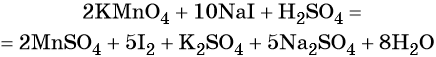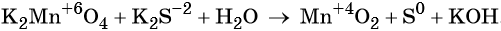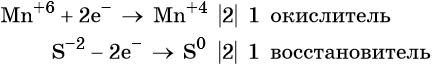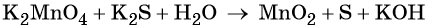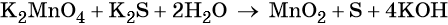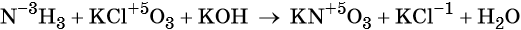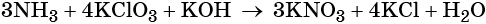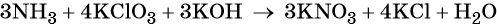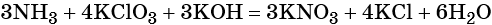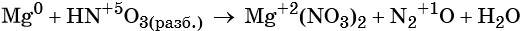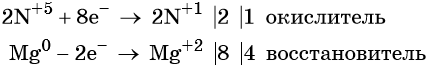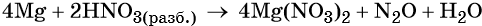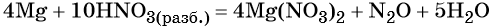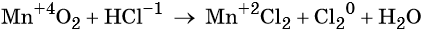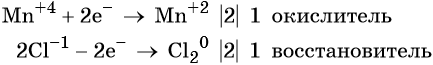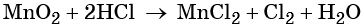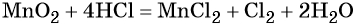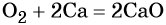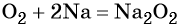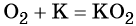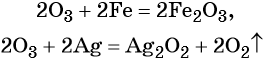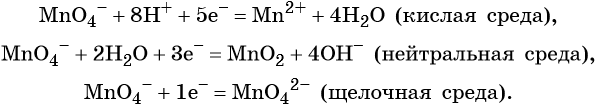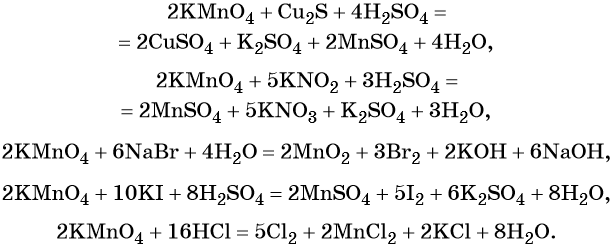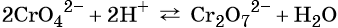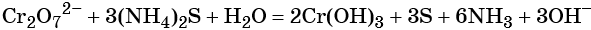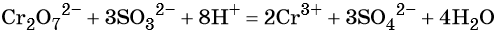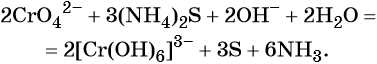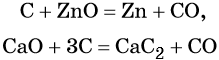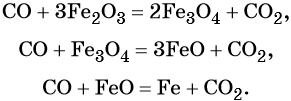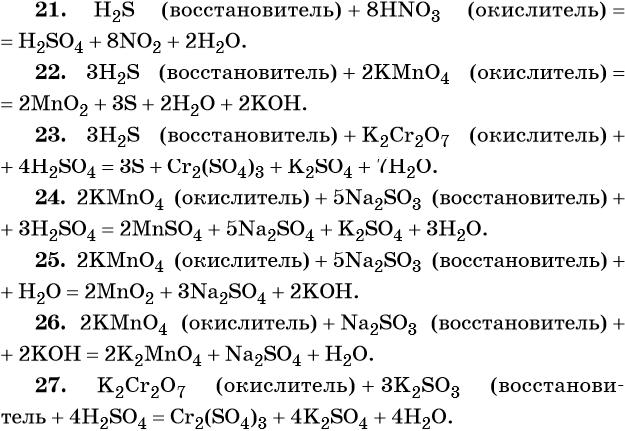Электронный учебник
Калькулятор ОВР
Калькулятор ОВР — это способ составить уравнение электронного и массового баланса в уравнении окислительно-восстановительной реакции
Статья об окислительно-восстановительных реакциях здесь.
Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
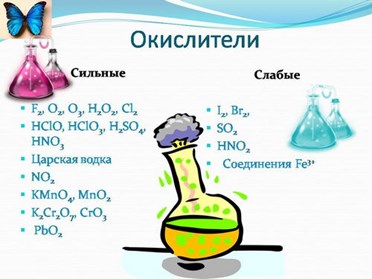
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы
Для
составления уравнений
окислительно-восстанови-тельных реакций
и определения коэффициентов применяют
два метода: метод электронного баланса
и ионно-электронный метод (метод
полуреакций).
Метод
электронного баланса является более
простым и учитывает изменение степени
окисления элементов в реакциях.
Ионно-электронный метод учитывает
характер химической связи в молекуле
и наличие тех ионов, которые в
действительности существуют в растворе,
например, MnO4—,
SO42-,
Cr2O72-.
При реакциях окисления-восстановления
электроны не берутся откуда-то со
стороны, а только переходят от одних
атомов или ионов к другим, поэтому число
электронов, принятых окислителем, равно
числу электронов, отданных восстановителем.
При составлении уравнений
окислительно-восстановительных реакций
для того, чтобы правильно написать
продукты реакции, необходимо знать
свойства реагирующих веществ.
8.3.1.
Метод электронного баланса. Подбор
коэф-фициентов в реакции методом
электронного баланса осуществляется
по следующей схеме:
1) Составить схему
реакции
P+HNO3→
разб.
Разбавленная
азотная кислота с а) неактивными металлами
(Cu),
б) неметаллами (P,
As,
S)
и в) производными этих неметаллов (AsH3,
PH3,
As2S3)
образует оксид азота (II),
понижая свою степень окисления:
P+HNO3→
NO
+
разб.
Атом
элемента в своей высшей положительной
степени окисления является окислителем,
следовательно, окислитель
N5+
+ 3ē
→ N2+
Атом
фосфора проявляет восстановительные
свойства в данной реакции, отдавая
электроны с последнего энергетического
уровня и повышая свою степень окисления
до +5.
P0
– 5ē
→ P+5
Следовательно,
молекулярное уравнение реакции имеет
следующий вид:
P
+ HNO3
→ NO + H3PO4
разб.
2)
Определить величину и знак степени
окисления элементов до реакции и после
реакции.
+5
0 +2 +5
HNO3
+ P
→ NO
+ H3PO4
3) Составить
электронный баланс
N5+
+ 3ē
→ N2+
5
P0
– 5ē
→ P5+
3
4) Подставить
найденные коэффициенты в уравнение
реакции.
5HNO3
+ 3P
+ 2H2O
→ 5NO
+ 3H3PO4
5)
Подсчитать количество атомов водорода
в правой и левой части равенства и
уравнять их за счет добавления молекул
воды в ту часть равенства, где их
недостаточно.
6) Подсчитать
количество атомов кислорода.
При
правильно написанном и решенном уравнении
количество атомов кислорода в правой
и левой части равенства совпадает.
Пример
1. Написать
уравнение окислительно-восстановительной
реакции, подобрав коэффициенты к нему:
FeSO4
+ KMnO4
+ H2SO4→
Fe2(SO4)3
+ + MnSO4
+ K2SO4
+ H2O.
Определяем степень окисления элементов
до реакции и после реакции.
+2
+7
+3
+2
FeSO4
+ KMnO4
+ H2SO4→
Fe2(SO4)3
+ MnSO4
+ K2SO4
+ H2O
Составляем
уравнения электронного баланса
2Fe2+
— 2ē
→ 2Fe3+
5
Mn+7
+ 5ē
→ Mn2+
2
Подставляем
найденные коэффициенты в уравнение
реакции. Подсчитываем количество групп
в правой части уравнения (15+2+1=18), добавляем
в левую часть равенства недостающие-группы
в виде коэффициента приH2SO4.
уравниваем число атомов водорода в
правой и левой части равенства.
Правильность
написанного уравнения проверяем по
числу атомов кислорода в правой и левой
части равенства.
10FeSO4+2KMnO4+8H2SO4→5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
8.3.2.
Ионно-электронный метод. При
составлении электронно-ионных уравнений
следует исходить не из изменения степени
окисления элементов в реагирующих
веществах, а нужно учитывать действительно
существующие ионы в водном растворе с
точки зрения теории электролитической
диссоциации. Например, если реакция
происходит с участием перманганата
калия, то в реакции окислителем будут
ионы MnO4—,
а не ионы Mn7+,
так как перманганат калия в водном
растворе диссоциирует KMnO4↔K++MnO4—.
При этом вещества неионного характера
и недиссоциирующие изображаются в
электронных уравнениях в виде молекул:
NH3,
CO,
NO2,
SiO2,
P.
В
окислительно-восстановительных реакциях
могут получаться различные продукты
реакции в зависимости от характера
среды – кислой, щелочной, нейтральной.
Для таких реакций в молекулярной схеме
необходимо указывать окислитель,
восстановитель и вещество, характеризующее
реакцию среды (кислоту, щелочь, воду). В
этом случае в ионном уравнении необходимо
руководствоваться правилами стяжения,
указывать ионы, характеризующие реакцию
среды: H+,
OH—,
H2O.
Правила стяжения сводятся к следующему:
1.
В кислой среде избыток ионов O+2
образует с ионами H+
молекулы воды:
Изб.
O2–+2H+=H2O
2.
В нейтральной или щелочной среде избыток
ионов O2-
образует с молекулами воды гидроксид
– ионы:
Изб.
O2–+
H2O=2OH–
3.
В щелочной среде недостаток ионов O2–
компенсируется двумя ионами OH—,
одновременно образуется одна молекула
воды:
2OH–H2O+O2–
|
Реакция среды |
Избыток |
Недостаток |
|
окислитель |
восстановитель |
|
|
Кислая |
Н+ |
Н2O |
|
изб. |
Н2О |
|
|
Нейтральная |
H2O |
Н2O |
|
изб.О2–+ |
Н2О |
|
|
Щелочная |
Н2O |
2OН– |
|
изб. |
2OН– |
Разберем
на конкретных примерах.
Пример
1.
Составить уравнение реакции, которая
протекает при пропускании сероводорода
Н2S
через подкисленный раствор перманганата
калия КМnO4
При
протекании реакции малиновая окраска
исчезает и раствор мутнеет. Опыт
показывает, что помутнение раствора
происходит в результате образования
элементарной серы из сероводорода:
H2S
S
+2H+
В
этой схеме число атомов одинаково в
левой и правой частях. Для уравнивания
зарядов надо от левой части схемы отнять
два электрона, после чего можно стрелку
заменить на знак равенства:
H2S
– 2=S+2H+
Эта
первая полуреакция — процесс окисления
восстановителя H2S.
Обесцвечивание
раствора связано с переходом иона МnО—4
(он имеет малиновую окраску) в ион Mn2+
(почти бесцветный и лишь при большой
концентрации имеет розоватую окраску),
что можно выразить схемой
MnO4–
Mn2+
Опыт
показывает, что в кислом растворе
кислород, входящий в состав ионов MnO—4,
вместе с ионами водорода в конечном
итоге образует воду. Поэтому процесс
перехода записываем так:
МnО—4
+ 8H+
Мn2+
+ 4Н2О
Чтобы
стрелку заменить на знак равенства,
надо уравнять и заряды. Поскольку
исходные вещества имеют семь положительных
зарядов (7+), а конечные — два положительных
(2+), то для выполнения условия сохранения
зарядов надо к левой части схемы прибавить
пять электронов:
MnO—4
+ 8H++5e—
= Mn2++4H2О
Это
вторая полуреакция – процесс восстановления
окислителя – иона MnO—4.
Для
составления общего (суммарного) уравнения
реакции надо уравнение полуреакций
почленно суммировать, предварительно
уравнять число отданных и полученных
электронов. В этом случае по правилам
нахождения наименьшего кратного
определяют соответствующие множители,
на которые умножаются равенства
полуреакций. Сокращенно запись проводится
так:
H2S
– 2ē = S
+ 2H+
5
MnO4–
+ 8H+
+ 5ē = Mn2+
+ 4H2O
2
5
+ 2MnO4–
+ 16H+
= 5S + 10H+
+ 2Mn2+
+ 8H2O
Сократив
на 10 Н+,
окончательно получим
5Н2S
+ 2МnО—4
+ 6Н+
=5S
+ 2Mn2+
+ 8Н2О
Проверяем
правильность составленного ионного
уравнения. В примере число атомов
кислорода в левой части 8, в правой 8;
число зарядов в левой части (2-) + (6+) == 4+,
в правой 2(2+) = 4+. Уравнение составлено
правильно.
Методом
полуреакций составляется ионное
уравнение реакции. Чтобы от ионного
уравнения перейти к молекулярному,
поступаем так: в левой части ионного
уравнения к каждому аниону подбираем
соответствующий катион, а к каждому
катиону — анион. Затем такие же ионы в
таком же количестве записываем и в
правую часть уравнения, после чего ионы
объединяем в молекулы:
5H2S
+ 2MnO4–
+ 6H+
= 5S + 2Mn2+
+ 8H2O
2K+
3SO42–
= 2K+
3SO42–
5H2S
+ 2KMnO4
+ 3H2SO4
= 5S + 2MnSO4
+ K2SO4
+ 8H2O
Пример
2. Реакция
среды кислая
1.
Составить схему реакции
K2SO3
+
KMnO4
+
H2SO4
K2SO4
+ MnSO4
+ H2O
SO32-
+
MnO4—
+
2H+
SO42-
+
Mn2+
Из
опытных данных знаем, что окислителем
является КМnO4.
Ион MnO4—
восстанавливается в кислой среде
до Мn2+
(фиолетово-малиновая окраска иона MnO4—
становится бесцветной, переходя в
Мn2+
— ион), следовательно, ион SO32
— будет являться восстановителем,
переходя в ион SO42-.
2.
Составить электронно-ионные уравнения
а) для
окислителя
MnO4—
+ 8H+
= Mn2+
+ 4H2O
Из
ионной схемы видно, что, ион MnO4—
– превращается в ион Мn2+,
при этом освобождаются ионы О2-,
которые по правилу стяжения в кислой
среде связываются ионами Н+,
образуя молекулы
Н2O.
б) для восстановителя
SO32-
+ H2O
= SO42-
+ 2H+
Из
ионной схемы видно, что ион SO32-
превращается в ион SO42-.
Для этого превращения необходимо
добавить ион О2-,
который берется из молекулы H2O
(реакция протекает в водной среде), при
этом освобождаются два иона Н+.
3.
Подсчитать число зарядов в правой и
левой части равенства, добавляя или
уменьшая необходимое число электронов.
Алгебраическая сумма зарядов в обеих
частях равенства должна быть одинакова.
MnO4—
+
8H+
+
5ē
= Mn2+
+ 4H2O
SO32-
+ H2O
— 2ē
= SO42-
+
2H+
4.
Найти основные коэффициенты, т. е.
коэффициенты при окислителе и
восстановителе:
M
+
8H+
+
5ē
= Mn2+
+ 4H2O
2
+
SO32-
+ H2O
— 2ē
= SO42-
+
2H+
5
5.
Написать суммарное электронно-ионное
уравнение, учитывая найденные
коэффициенты:
2MnO4—
+
16H
+ +
5SO32-
+
5H2O
=2Mn2+
+
8H2O
+ 5SO42-
+ 10H+
6.
Сократить в левой и правой части уравнения
10 Н+
и 5Н2O.
Получается ионное уравнение:
2MnO4—
+ 6H+
+ 5SO32-
= 2Mn2+
+ 5SO42-
+ 3H2O
7.
По ионному уравнению составить
молекулярное уравнение реакции:
2KMnO4
+
5K2SO3
+
3H2SO4
=
2MnSO4
+
6K2SO4
+
3H2O
8.
Число ионов и атомов каждого элемента
в правой и левой части равенства,
должно быть равно.
Пример
3. Реакция
среды щелочная.
1.
Составить схему реакции
KCrO2
+ Br2
+ KOH → K2CrO4
+ KBr +H2O
CrO2–
+ Br2
+ OH–
→
CrO42–
+ Br +H2O
Окислителем
в данной реакции является молекула
брома, следовательно, восстановителем
будет являться метахромит калия, а
именно ион СrO2
–.
2. Составить
электронно-ионное уравнение
а) для окислителя
Вr2
→ 2Вr
–
б) для
восстановителя
СrO2–
+ 4OН–
→ СrО42–
+ 2Н2О
Из
ионной схемы видно, что ион CrO2–
превращается в ион СгО42–.
Каждый недостающий ион О2–
берется по правилу стяжения из двух
гидроксильных ионов (среда щелочная
ОН—),
при этом одновременно образуется одна
молекула воды.
-
Подсчитать
число зарядов в правой и левой части
равенства. Найти коэффициенты при
окислителе и восстановителе.
C
–
+ 4OH–
—
3ē
→
CrO4
2–
+ 2H2O
2
Вr20
+ 2ē
→
2Br
–
3
4.
Написать суммарное уравнение, учитывая
найденные коэффициенты:
2CrO2
–
+ 8OH–
+ 3 Br20
→
2CrO4
2–
+ 6Br + 4H2O
5.
По ионному уравнению составить
молекулярное уравнение реакции.
2KcrO2
+ 8KOH + 3Br2
→ 2K2CrO4
+ 6KBr + 4H2O
6.
Число атомов и ионов каждого элемента
в правой и левой части уравнения
должно быть равно.
Пример
4. Реакция
среды нейтральная.
1. Составить
схему реакции
K2SO3
+ KMnO4
+ H2O
→ MnO2
↓ + K2SO4
SO32–
+ MnO4–
+ H2O
→ MnO2
+ SO42–
Окислителем
является КМnO4,
так как ион элемента в своей высшей
степени окисления не способен более
отдавать электроны (Мn+7).
Восстановителем является сульфит калия
K2SO3.
2.
Составить электронно-ионное уравнение
а)
для окислителя
МnO4—
+ 2Н2O→
MnO20
+ 4OН—
В
нейтральной среде избыток ионов кислорода
стягивается с молекулами воды, образуя
гидроксид-ионы.
б)
для восстановителя
SO32-
+ Н2O
→ SO42-
+ 2Н+
Из
ионной схемы видно, что ион SО32-
превращается в ион SO42-
, для этого необходимо добавить один
ион О2-
, который берется из молекулы Н2O
(реакция протекает в водной среде). При
этом освобождаются два иона Н+.
3.
Подсчитать число зарядов в правой и
левой части равенства. Найти
коэффициенты при окислителе и
восстановителе.
MnO4–
+ 2Н2O
+ 3ē → MnO20
+ 4OН–
2
SO32–
+ Н2O
– 2ē → SO42–
+ 2Н+
3
4.Написать
электронно-ионное уравнение, учитывая
найденные коэффициенты:
2MnO4–
+ 3SO32–
+ 7H2O
→ 2MnO2
+ 3SO42–
+ 8OH + 6H+
или
2MnO4–
+ 3SO32–
+ 7H2O
→ 2MnO2
+ 3SO42–
+ 6H2О
+ 2OH–
Сокращаем
левую и правую часть равенства на 6Н20.
Получаем окончательное ионное
уравнение.
2МnO4—
+ 3SO32-
+ Н2O
2МnО2
+ 3SO42-
+ 2OН—
5.
По ионному уравнению составить
молекулярное уравнение реакции.
2КМnO4
+ ЗК2SО3
+ H2O
2МnО2
+ 3K2SO4
+ 2КОН
6.
Число атомов и ионов каждого элемента
в правой и левей части уравнения должно
быть равно.
Пример
5. Исходя
из степени окисления (п)
азота, серы и марганца в соединениях
NН3,
HNO2,
HNO3,
H2S,
Н2SO3,
Н2SО4,
MnO2
и КМnO4,
определите, какие из них могут быть
только восстановителями, только
окислителями и какие проявляют как
окислительные, так и восстановительные
свойства.
Решение.
Степень окисления азота в указанных
соединениях соответственно равна: -3
(низшая), +3 (промежуточная), +5 (высшая);
n(S),
соответственно, равна: -2 (низшая), +4
(промежуточная), +6 (высшая); n(Мn),
соответственно, равна: + 4 (промежуточная),
+7 (высшая). Отсюда: NН3,
H2S
— только восстановители; HNO3,
H2SO4,
КMnО4
— только окислители; НNО2,
Н2SО3,
MnO2
— окислители и восстановители.
Пример
6.
Могут ли происходить
окислительно-восстановительные
реакции между следующими веществами:
a)
H2S
и HI;
б) H2S
и Н2SО3;
в) Н2SО3
и НС1O4?
Решение:
а)
Степень окисления в Н2S
n(S)
= -2; в HI
n(I)
= -1. Так как и сера и иод находятся в своей
низшей степени окисления, то оба
вещества проявляют только восстановительные
свойства и взаимодействовать друг с
другом не могут;
б)
в H2S
n(S)
= -2 (низшая), в H2SO3
n(S)
= +4 (промежуточная).
Следовательно,
взаимодействие этих веществ возможно,
причем, Н2SО3
является окислителем;
в)
в Н2SO3
n(s)
= +4
(промежуточная); в НС1O4
n(Сl)
= +7 (высшая). Взятые вещества могут
взаимодействовать, Н2SО3
в этом случае будет проявлять
восстановительные свойства.
Пример
7.
Составьте уравнения окислительно-восстановительной
реакции, идущей по схеме:
+7
+3 +2
+5
KMnO4
+ H3PO3
+ H2SO4
→ MnSO4
+ H3PO4
+ K2SO4
+ H2O
Решение.
Если в условии задачи даны как исходные
вещества, так и продукты их взаимодействия,
то написание уравнения реакции сводится,
как правило, к нахождению и расстановке
коэффициентов. Коэффициенты определяют
методом электронного баланса с
помощью электронных уравнений. Вычисляем,
как изменяют степень окисления
восстановитель и окислитель, и отражаем
это в электронных уравнениях:
восстановитель
5Р3+
— 2ē = Р5+
процесс
окисления
окислитель
2Mn7+
+ 5ē = Mn2+
процесс
восстановления
Общее
число электронов, отданных восстановителем,
должно быть равно числу электронов,
которые присоединяет окислитель. Общее
наименьшее кратное для отданных и
принятых электронов 10. Разделив это
число на 5, получаем коэффициент 2 для
окислителя и продукта его восстановления,
а при делении 10 на 2 получаем коэффициент
5 для восстановителя и продукта его
окисления. Коэффициент перед веществами,
атомы которых не меняют свою степень
окисления, находят подбором. Уравнение
реакции будет иметь вид:
2KMnO4+5H3PO3+2H2SO4
= 2MnSO4+5H3PO4+K2SO4+3H2O
Пример
8. Составьте
уравнение реакции взаимодействия цинка
с концентрированной серной кислотой,
учитывая максимальное восстановление
последней.
Решение.
Цинк, как любой металл, проявляет только
восстановительные свойства. В
концентрированной серной кислоте
окислительная функция принадлежит сере
(+6). Максимальное восстановление серы
означает, что она приобретает минимальную
степень окисления. Минимальная степень
окисления серы как p-элемента
VIA-группы равна -2. Цинк как металл
IIВ-группы
имеет постоянную степень окисления +2.
Отражаем сказанное в электронных
уравнениях:
восстановитель
4Zn0
— 2ē = Zn2+
процесс
окисления
окислитель
1S6+
+ 8ē = S2–
процесс
восстановления
Составляем
уравнение реакции:
4Zn
+ 5H2SO4
= 4ZnSO4
+ H2S
+ 4H2O
Перед
H2SO4
стоит коэффициент 5, а не 1, ибо четыре
молекулы H2SO4
идут на связывание четырех ионов Zn2+.
1. Как определить окислительно-восстановительную реакцию?
Существуют различные классификации химических реакций. К одной из них относится такие, при которых вещества, вступающие во взаимодействие друг с другом (или само вещество) меняют степени окисления элементов.
В качестве примера рассмотрим две реакции:
Zn0 + 2Н+1С1-1 = Zn+2Cl2-1 + Н20 (1)
Н+1Cl-1 + К+1О-2Н+1 = К+1Cl-1 + H2+1O-2 (2)
В реакции (1) участвуют цинк и соляная кислота. Цинк и водород меняют свои степени окисления, хлор оставляет свою степень окисления неизменной:
Zn0 — 2е = Zn2+
2Н+1 + 2е = H20
2Сl-1 = 2 Сl-1
А в реакции (2), (реакция нейтрализации), хлор, водород, калий, и кислород не меняют свои степени окисления: Сl-1 = Cl-1, H+1 = H+1, К+1 = К+1, O-2 = O-2; Реакция (1) относится к окислительно-восстановительной, а реакция (2) принадлежит к другому типу.
Химические реакции, которые осуществляются с изменением степени окисления элементов, называются окислительно-восстановительными.
Для того чтобы определить окислительно-восстановительную реакцию необходимо установить степени окисления элементов в левой и в правой части уравнения. Для этого требуется знать, как определить степень окисления того или иного элемента.
В случае реакции (1) элементы Zn и Н меняют свои состояния, теряя или приобретая электроны. Цинк, отдавая 2 электрона, переходит в ионное состояние – становится катионом Zn2+. В данном случае происходит процесс восстановления и цинк окисляется. Водород приобретает 2 электрона, проявляет окислительные свойства, сам в процессе реакции восстанавливается.
2. Определение степени окисления элементов.
Степень окисления элементов в его соединениях определяется, исходя из положения, что общий суммарный заряд степеней окисления всех элементов данного соединения равен нулю. Например, в соединении Н3РО4 степени окисления у водорода +1, у фосфора +5, у кислорода -2; Составив математическое уравнение определим, что в сумме число частиц (атомов или ионов) составят заряд равный нулю: (+1)x3+(+5)+(-2)х4 = 0
Но в данном примере уже заданы степени окисления элементов. Каким же образом можно определить степень окисления cеры, например, в соединении тиосульфат натрия Na2S2O3, или марганца в соединении перманганат калия — КMnO4? Для этого необходимо знать постоянные степени окисления ряда элементов. Они имеют следующие значения:
1) Элементы I группы периодической системы (в том числе водород в соединении с неметаллами) +1;
2) Элементы II группы периодической системы +2;
3) Элементы III группы периодической системы +3;
4) Кислород (кроме в соединении со фтором или в перекисных соединениях) -2;
Исходя из этих постоянных значений степеней окисления (для натрия и кислорода) определим степень окисления серы в соединении Na2S2O3. Поскольку суммарный заряд всех степеней окисления элементов, состав которых отражает данная формула соединения, равен нулю, то обозначив неизвестный заряд у серы «2Х» (поскольку в формуле два атома серы), составим следующее математическое равенство:
(+1) х 2 + 2Х + (-2) х 3 = 0
Решая это уравнение относительно 2 х, получим
2Х= (-1) х 2 + (+2) х 3
или
Х = [(-2) + (+6)] : 2 = +2;
Следовательно, степень окисления серы в соединении Na2S2O3 равна (+2). Но неужели всегда будет необходимо пользоваться таким неудобным методом для определения степеней окисления тех или иных элементов в соединениях? Конечно же не всегда. К примеру, для бинарных соединений: оксидов, сульфидов, нитридов и т.д., можно пользоваться для определения степеней окисления так называемым методом «крест-на-крест». Допустим, дана формула соединения: оксид титана – Ti2O3. Используя простой математический анализ, исходя из того, что степень окисления кислорода нам известна и равна (-2): Ti2O3, нетрудно установить, что степень окисления у титана будет равна (+3). Или, к примеру, в соединении метан СН4 известно, что степень окисления водорода равна (+1), тогда не составляет труда определить степень окисления углерода. Она будет соответствовать в формуле этого соединения (-4). Так же, пользуясь методом «крест-на-крест», не сложно установить, что если дана следующая формула соединения Cr4Si3, то степень окисления хрома в неё равна (+3), а кремния (-4).
Для солей так же это не предоставляется затруднительным. Причём не имеет значения, дана или средняя соль или кислая соль. В данных случаях необходимо исходить из солеобразующей кислоты. К примеру, дана соль нитрат натрия (NaNO3). Известно, что она является производной азотной кислоты (НNO3), а в этом соединении степень окисления азота равна (+5), следовательно, и в её соли – нитрате натрия, степень окисления азота так же равна (+5). Гидрокарбонат натрия (NaHCO3) является кислой солью угольной кислоты (H2CO3). Так же, как и в кислоте, степень окисления углерода в этой соли будет равна (+4).
Следует отметить то обстоятельство, что степени окисления в соединениях: металлах и неметаллах (при составлении уравнения электронного баланса) равны нулю: К0, Са0, Аl0 , Н20, Cl20,N20В качестве примера приведём степени окисления наиболее типичных элементов:
Только окислителями являются вещества, имеющие максимальную, как правило положительную, степень окисления, например: КCl+7O4, H2S+6O4, K2Cr+6O4, HN+5O3, KMn+7O4. Это легко доказать. Если бы данные соединения могли быть восстановителями, то в данных состояниях они должны были бы отдавать электроны:
Cl+7– е = Cl+8
S+6 – е = S+7
Но элементы хлор и сера не могут существовать с такими степенями окисления. Аналогичным образом, только восстановителями являются вещества, имеющие минимальную, как правило, отрицательную степень окисления, например: H2S-2, HJ—, N-3H3. В процессе окислительно-восстановительных реакций такие соединения не могут быть окислителями, поскольку им пришлось бы присоединять электроны:
S-2 + е = S-3
J— + е = J-2
Но для серы и йода ионы с такими степенями окисления не характерны. Элементы с промежуточными степенями окисления, например N+1, N+4, S+4, Сl+3, С+2 могут проявлять как окислительные, так и восстановительные свойства.
3. Типы окислительно-восстановительных реакций.
Существует четыре типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции.
Наиболее часто встречающийся тип реакций. При данных реакциях изменяются степени окисления элементов в разных молекулах, например:
2Bi+3Сl3 + 3Sn+2Cl2 = 2Bi0 + 3Sn+4Cl4
Bi+3 — 3е = Bi0
Sn+2 + 2е = Sn+4
2) Разновидностью межмолекулярных окислительно-восстановительных реакций является реакция конпропорционирования, в которой окислителем и восстановителем являются атомы одного и того же элемента: в данной реакции два атома одного элемента различными степенями окисления образуют один атом с иной степенью окисления:
SO2+4 + 2H2S-2 = 3S0 + 2Н2O
S-2 — 2е = S0
S+4 + 4е = S0
3) Реакции диспропорционирования осуществляются в случае, если окислителем и восстановителем являются атомы одного и того же элемента, или один атом элемента с одной степенью окисления образует соединение с двумя степенями окисления:
N+4O2 + NaOH = NaN+5O3+ NaN+3O2 + H2O
N+4 — е = N+5
N+4 + е = N+3
4) Внутримолекулярные окислительно-восстановительные реакции происходят в случаях, когда атом-окислитель и атом — восстановитель находятся в составе одного вещества, например:
N-3H4N+5O3 = N+12O + 2H2O
2N-3 — 8е =2N+1
2N+5 + 8е = 2N+1
4. Механизм окислительно-восстановительных реакций.
Окислительно-восстановительные реакции осуществляются за счет перехода электронов от атомов одного элемента к другому. Если атом или молекула теряет электроны, то такой процесс называется окислением, а данный атом является восстановителем, например:
Al0 — 3e = Al 3+
2Cl— — 2e = Cl20
Fe2+ — e = Fe3+
В данных примерах Al0, Cl—, Fe2+ являются восстановителями, а процессы их превращения в соединения Аl3+, Сl20, Fe3+ называются окислительными. Если атом или молекула приобретают электроны, то такой процесс называется восстановлением, а данный атом является окислителем, например:
Ca2++ 2e = Ca0
Cl20 + 2e = 2Cl—
Fe3+ + e = Fe2+
Окислителями, как правило, являются неметаллы (S, Cl2 ,F2, О2) или соединения металлов, имеющих максимальную степень окисления (Mn+7, Cr+6, Fe+3). Восстановителями являются металлы (К, Са, Аl) или соединения неметаллов, имеющих минимальную степень окисления (S-2, Сl-1 , N-3, P-3);
H2SO4 (конц.) + HJ → H2S + J2 + H2O
Прежде всего, установим, что степень окисления йода в йодистом водороде равна (-1), а серы в серной кислоте: (+6). В процессе реакции йод (-1) будет окисляться до молекулярного состояния, а сера (+6) восстанавливаться до степени окисления (-2) – сероводорода:
J—→ J02
S+6→ S-2
Чтобы составить уравнение электронного баланса необходимо учесть, что количество частиц атомов в левой и в правой частях полуреакций должно быть одинаковой
2J—→ J20
S+6 → S-2
Далее необходимо определить количество электронов, принявших участие в реакции:
2J— — 2e → J02
S+6 + 8e → S-2
Установив вертикальную черту, справа данной схемы полуреакции, определим коэффициенты реакции:
2J— — 2e → J02 |8
S+6 + 8e → S-2 |2
Сократив на «2», получим окончательные значения коэффициентов:
2J— — 2e → J02 |4
S+6 + 8e → S-2 |1
Подведем под данной схемой полуреакции горизонтальную черту и суммируем участвующее в реакции количество частиц атомов:
2J— — 2e → J02 |4
S+6 + 8e → S-2 |1
____________________
8J— + S+6 → 4 J02 + S-2
После этого необходимо расставить коэффициенты в уравнении реакции. Подставив полученные значения коэффициентов в молекулярное уравнение, приведем его к данному виду:
8HJ + H2SO4 = 4J2 + H2S + Н2O
Подсчитав количество атомов водорода в левой и правой частях уравнения, убедимся в необходимости коррекции коэффициента « 4 » перед водой, получим полное уравнение:
8HJ + H2SO4 = 4J2 + H2S + 4Н2O
Данное уравнение можно составить, используя метод электронно-ионного баланса. В этом случае отпадает необходимость в коррекции коэффициента перед молекулами воды. Уравнение составляется на основе диссоциации ионов соединений, участвующих в реакции: Например, диссоциация серной кислоты приводит к тому, что образуются два протона водорода и сульфат-анион:
H2SO4 ↔ 2H+ + SO42-
Аналогичным образом можно записать диссоциацию иодистого водорода и сероводорода:
HJ ↔ Н+ + J—
H2S ↔ 2Н+ + S2-
J2 не диссоциирует. Так же практически не диссоциирует Н2О. Составление уравнения методом полуреакции по йоду остается такой же:
2J— — 2e → J02
Полуреакция по атомам серы приобретет следующую форму:
SO4-2 → S-2
Поскольку в правой части полуреакции недостает четыре атома кислорода, то это количество необходимо сбалансировать за счет воды:
SO4-2 → S-2 + 4H2О
Тогда в левой части полуреакции необходимо компенсировать атомы водорода за счет протонов (т.к. реакция среды кислая):
SO42- + 8Н+ → S-2 + 4H2О
Подсчитав количество переходящих электронов, получим полную запись уравнения по методу полуреакций:
SO42- + 8Н+ + 8е → S-2 + 4H2О
Суммируя обе полуреакции, получим уравнение электронного баланса:
2J— — 2e → J02 |8 4
SO42- + 8Н+ + 8е → S-2 + 4H2О |2 1
_____________________________________
8J— + SO42- +8Н+ → 4J20 + S0 + 4H2O
Из данной записи следует, что метод электронно-ионного уравнения дает более полную картину окислительно-восстановительной реакции, чем метод электронного баланса.Количество электронов, участвующих в процессе, совпадает при обоих методах баланса, но в последнем случае как бы «автоматически» устанавливается количество протонов и молекул воды, участвующих в окислительно-восстановительном процессе.
Разберем несколько конкретных случаев окислительно-восстанови-тельных реакций, которые можно составить методом электронно-ионного баланса. Некоторые окислительно-восстановительные процессы осу-ществляются при участии щелочной среды, например:
KCrO2 + Br2 + KOH → KBr + K2CrO4 +H2O
В данной реакции восстановителем является хромит-ион (CrО2—), который окисляется до хромат-иона (CrO-24). Окислитель — бром (Br02) восстанавливается до бромид-иона (Br—):
СrO2— → CrO42-
Br02 → 2 Br—
Поскольку реакция происходит в щелочной среде, то первую полуреакцию необходимо составить с учетом гидроксид-ионов (OH—):
CrO2— + 4OH— — 3e = CrO2-4 + 2H2O
Вторую полуреакцию составляем уже известным способом:
CrO2— + 4OH— -3е = CrO42—+ 2H2O |2
Br02 + 2e = Br— |3
__________________________________________
2CrO2— + 3Br20 + 8OH— = 2CrO2-4 + 6Br— + 4H2O
После этого необходимо окончательно расставить коэффициенты в уравнении реакции и полностью молекулярное уравнение данного окислительно-восстановительного процесса примет вид:
2KCrO2 + 3Br2 + 8KOH = 2K2CrO4 + 6KBr + 4H2O.
В ряде случаев в окислительно-восстановительной реакции участвуют одновременно и недиссоциируемые вещества. Например:
AsH3 + HNO3 = H3AsO4 + NO2 + 4H2O
Тогда метод полуреакций составляется с учетом данного процесса:
AsH3 + 4H2O – 8e = AsO43- + 11H+ |1
NО3 + 2H+ + e = NO2 + H2O |8
________________________________________________
AsH3 + 8NО3 + 4H2O + 2H+ = AsO43- + 8NO2 + 11H+O
Молекулярное уравнение примет вид:
AsH3 + 8HNO3 = H3AsO4 + 8NO2 + 4H2O.
Окислительно-восстановительные реакции иногда сопровождаются одновременным процессом окисления-восстановления нескольких веществ. Например, в реакции с сульфидом меди взаимодействует концентрированная азотная кислота:
Cu2S + HNO3 = Cu(NO3)2 + H2SO4 + NO + H2O
D окислительно-восстановительном процессе участвуют атомы меди, серы и азота. При составлении уравнения методом полуреакций необходимо учитывать стадии данного процесса:
Cu+ → Cu2+
S2- → S+6
N5+ → N+2
В данной ситуации необходимо объединить в одну стадию окислительные и восстановительные процессы:
2Cu+ — 2e → 2Cu2+ |10e
S2- — 8e → S6+
_______________________
N5+ + 3e → N2+ |3e
При котором окислительно-восстановительная полуреакция примет вид:
2Cu+ — 2e → 2Cu2+
S2- — 8e → S6+ 3 (процессы восстановления)
_______________________
N5+ + 3e → N2+ 10 (процесс окисления)
_____________________________________
6Cu+ + 3S2- + 10N5+ → 6Cu2+ + 3S6+ + 10N2+
В итоге молекулярное уравнение реакции примет вид:
3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O.
Особое внимание следует уделить окислительно-восстановительным реакциям с участием органических веществ. Например, при окислении глюкозы перманганатом калия в кислой среде происходит следующая реакция:
C6H12O6 +KMnO4 + H2SO4 > CO2 + MnSO4 + K2SO4 + H2O
При составлении баланса методом полуреакции превращения глюкозы учитывается отсутствие её диссоциации, но коррекцию количества атомов водорода осуществляется за счет протонов и молекул воды:
C6H12O6 + 6H2O — 24e = 6CO2 + 24H+
Полуреакция с участием перманганата калия примет вид:
MnO4—+ 8H+ + 5e = Mn2+ +4H2O
В итоге получим следующую схему окислительно-восствновительного процесса:
C6H12O6 + 6H2O — 24e = 6CO2 + 24H+ |5
MnО4— +8H+ + 5e = Mn+2 + 4H2O |24
___________________________________________________
5C6H12O6 + 30H2O + 24MnО4— + 192H+ = 30CO2 + 120H+ + 24Mn2+ + 96H2O
Сократив количества протонов и молекул воды в левой и правой части полуреакции, получим итоговое молекулярное уравнение:
5C6H12O6 + 24KMnO4 + 36H2SO4 = 30CO2 + 24MnSO4 + 12K2SO4 + 66H2O
5. Влияние среды на характер протекания окислительно-восстановительных реакций.
В зависимости от среды (избыток H+, нейтральной, избыток OH—) может изменяться характер протекания реакции между одними и теми же веществами. Для создания кислой среды обычно используется серная кислота (H2SO4), азотная кислота (HNO3), соляная кислота (HCl), в качестве среды OH— применяют гидроксид натрия (NaOH) или гидроксид калия (KOH). Например покажем, как среда влияет на переманганат калия (КMnO4). и продукты его реакции:
Для примера возьмём в качестве восстановителя Na2SO3, в качестве окислителя KMnO4
В кислой среде:
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
SO32- + H2O — 2e → SO42- + 2H+ |5
MnO4—+ 8H+ + 5e → Mn2+ + 4H2O |2
________________________________________________
5SO32- + 2MnO4— + 6H+ → 5SO42- + 2Mn2+ + 3H2O
В нейтральной (или слабощелочной):
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
SO32- + H2O — 2e→ SO42- + 2H+ |3
MnO4— + 2H2O + 3e→ MnO2 + 4OН |2
_____________________________________
3SO32- + 2 MnO4— + H2O → 3SO42- + 2MnO2 + 2OН
В сильно щелочной среде:
Na2SO3 + 2KMnO4 + 2NaOH → Na2SO4 + K2MnO4 + Na2MnO + H2O
SO32- + 2 OН— — 2e → SO42- + H2O |1
MnO4— + e → MnO42 |2
____________________________________
SO32- + 2 MnO4— + 2OH → SO42- + 2MnO42- + H2O
Пероксид водорода (Н2О2) в зависимости от среды восстанавливается согласно схеме:
1) Кислая среда (H+) H2O2 + 2H+ + 2е → 2H2O
2) Нейтральная среда (Н2О) H2O2 + 2е → 2ОН
3) Щелочная среда (ОН—) H2O2 + 2е→ 2ОН
Пероксид водорода (Н2О2) выступает как окислитель:
2FeSO4 + H2O2 + H2SO4 → Fe2(SO4)3 + 2H2O
Fe2+ — е = Fe3+ |2
H2O2 + 2H+ + 2е = 2Н2О |1
________________________________
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2 Н2О
Однако, встречаясь с очень сильными окислителями (KMnO4) Пероксид водорода (Н2О2) выступает как восстановитель:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
H2O2 – 2e → O2 + 2H+ |5
MnO4—+ 8H+ + 5e → Mn2+ + 4H2O |2
_________________________________
5H2O + 2 MnO4— + 6H+→ 5O2 + 2Mn2+ + 8H2O
6. Определение продуктов окислительно-восстановительных реакций.
В практической части данной темы рассматриваются окислительно-восстановительные процессы с указанием только исходных реагентов. Продукты реакций, как правило, необходимо определить. Например, в реакции участвуют хлорид железа (FeCl3) и иодид калия (KJ):
FeCl3 + KJ = A + B + C
требуется установить формулы соединений A, B, C, образующиеся в результате окислительно-восстановительного процесса.
Исходные степени окисления реагентов следующие: Fe3+, Cl—, K+, J—. Нетрудно предположить, что Fe3+, являясь окислителем (имеет максимальную степень окисления), может только снизить свою степень окисления до Fe2+:
Fe3+ + e = Fe2+
Хлорид-ион и ион калия в реакции не изменяют свою степень окисления, а иодид-ион может только повысить свою степень окисления, т.е. перейти в состояние J20:
2J— — 2e= J20
В результате реакции, помимо окислительно-восстановительного процесса, произойдет реакция обмена между FeCl3 и KJ, но с учетом изменения степеней окисления реакция определяется не по данной схеме:
FeCl3 + KJ = FeJ3 + KCl,
а примет вид
FeCl3 + KJ = FeJ2 + KCl,
где в качестве продукта C обозначается соединение J20:
FeCl3 + 6KJ = 2FeJ2 + 6KJ + J2
Fe3+ + e ═> Fe2+ |2
2J— — 2e ═> J20 |1
________________________________
2Fe+3 + 2J— = 2Fe2+ + J20
В дальнейшем, при определении продуктов окислительно-восстановительного процесса, можно применять так называемую «систему лифта». Принцип её заключается в том, что любую окислительно-восстановительную реакцию можно представить, как движение лифтов в многоэтажном строении в двух взаимно противоположных направлениях. Причём, «этажами» будут являться степени окисления соответствующих элементов. Поскольку любая из двух полуреакций в окислительно-восстановительном процессе сопровождается либо понижением, либо повышением степени окисления того или иного элемента, то простым рассуждением можно предположить о возможных их степенях окисления в образующихся продуктах реакции.
В качестве примера приведём реакцию, в которой сера реагирует с концентрированным раствором гидроксида натрия (NaOH):
S + NaOH(конц) = (А) + (В) + H2O
Поскольку в данной реакции изменения будут происходить только со степенями окисления серы, то для наглядности составим диаграмму её возможных состояний:
Соединениями (А) и (В) не могут быть одновременно состояния серы S+4 и S+6, поскольку в данном случае процесс происходил бы только с отдачей электронов, т.е. являлся бы восстановительным:
S0 — 4е=S+4
S0— 6е =S+6
Но это противоречило бы принципу окислительно-восстановительных процессов. Тогда следует полагать, что в одном случае процесс должен проходить с отдачей электронов, а в другом двигаться в противоположном направлении, т.е. быть окислительным:
S0 — 4е =S+4
S0+ 2е =S-2
С другой стороны, насколько вероятно, что процесс восстановления будет осуществляться до состояния S+4 или до S+6? Поскольку реакция протекает в щелочной, а не в кислой среде, то окислительная возможность её значительно ниже, поэтому образование соединения S+4 в этой реакции предпочтительнее, чем S+6. Следовательно, реакция в окончательном варианте примет вид:
4S + 6NaOH(конц) = Na2SO3 + 2Na2S + 3H2O
S0 +2e = S—2 | 4 | 2
S0 + 6OH— — 4e = SO32— + 3H2O | 2 | 1
3S0 + 6OH— = 2S—2 + SO32— + 3H2O
В качестве другого примера разберём следующую реакцию между фосфином и концентрированной азотной кислотой(HNO3):
PH3 + HNO3 = (А) + (В) + H2O
В данном случае имеем изменяющиеся степени окисления у фосфора и азота. Для наглядности приведём диаграммы состояния их степеней окисления.
Фосфор в состоянии степени окисления (-3) будет проявлять только восстановительные свойства, поэтому в реакции он будет повышать свою степень окисления. Азотная кислота сама по себе является сильным окислителем и создаёт кислую среду, поэтому фосфор от состояния (-3) достигнет своей максимальной степени окисления (+5).
В противоположность этому азот будет понижать свою степень окисления. В реакциях данного типа обычно до состояния (+4).
Далее нетрудно предположить, что фосфор в состоянии (+5), являясь продуктом (А), может быть только ортофосфорной кислотой H3PO4, поскольку среда реакции сильнокислая. Азот в таких случаях, обычно принимает степень окисления (+2) или (+4), чаще (+4). Поэтом продуктом (В) будет оксид азота NO2. Остаётся только решить это уравнение методом баланса:
P—3 – 8e = P+5 | 1
N+5 + e = N+4 | 8
P—3 + 8N+5 = P+5 + 8N+4
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,618 -
гуманитарные
33,648 -
юридические
17,917 -
школьный раздел
611,537 -
разное
16,896
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Будьте в симбиозе со Studarium