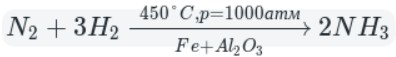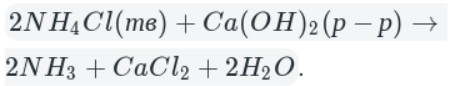YanaPetrova
+10
Решено
9 лет назад
Химия
5 — 9 классы
Напишите уравнения реакций,характеризующие азот как :а)окислитель;б)восстановитель. Составте схемы элнктронного баланса или обозначьте переход электронов стрелкой.
Смотреть ответ
1
Ответ
4
(5 оценок)
18
trubitcina
9 лет назад
Светило науки — 1 ответ — 0 раз оказано помощи
1) N2 + 3H2-> 2NH3 ( в этой реакции Азот проявляет себя как ок-тель)
2) N2 + O2->2NO ( в этой реакции Азот проявляет себя как во-тель)
(5 оценок)
https://vashotvet.com/task/4103034
ovingaugane
Вопрос по химии:
Напишите уравнения реакций,характеризующие азот как :а)окислитель;б)восстановитель. Составте схемы элнктронного баланса или обозначьте переход электронов стрелкой.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
feauldeo401
1) N2 + 3H2-> 2NH3 ( в этой реакции Азот проявляет себя как ок-тель) 2) N2 + O2->2NO ( в этой реакции Азот проявляет себя как во-тель)
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Химия,
вопрос задал YanaPetrova,
7 лет назад
Напишите уравнения реакций,характеризующие азот как :а)окислитель;б)восстановитель. Составте схемы элнктронного баланса или обозначьте переход электронов стрелкой.
Ответы на вопрос
Ответил trubitcina
0
1) N2 + 3H2-> 2NH3 ( в этой реакции Азот проявляет себя как ок-тель)
2) N2 + O2->2NO ( в этой реакции Азот проявляет себя как во-тель)
Предыдущий вопрос
Следующий вопрос
Новые вопросы
Литература,
5 лет назад
Что такое любовь? Сочинение…
Математика,
5 лет назад
Используй распределительное свойство 7*(60-2). 85*137-75*137. 78*214-78*204…
Математика,
7 лет назад
периметр квадрата 44см. чому дорівнює площа цього квадрата…
Химия,
7 лет назад
определите объем воздуха(н.у) необходимого для сжигания 58,1 г. фосфора до оксида фосфора(v)…
Обществознание,
7 лет назад
какое понятие является лишним территория президент, территория, законы и налоги…
Алгебра,
7 лет назад
7by+4b-14y-8,если y=5/28 b=2/7 Вычислите наиболее рациональным способом…
Азот окислитель восстановитель
Азот в химических реакциях может проявлять как окислительные так и восстановительные свойства, примером реакции где азот проявляет восстановительные свойства:
Пример где азот проявляет окислительные свойства:
Свойства окисления и восстановления азота применяют в производстве веществ в состав которого входит азот.
Почему азот окислитель восстановитель
При общей характеристике элементов пятой группы, главным образом азота и фосфора, внимание обращается на окислительные и восстановительные свойства атомов этих элементов.
Как окислители атомы азота и фосфора принимают по три электрона, а как восстановители — отдают по пять электронов.
Из важных в промышленном отношении где азот окислитель восстановитель заслуживает внимание получение азотной кислоты окислением аммиака, а именно: фаза окисления аммиака кислородом воздуха; если раньше в VIII классе при изучении этой реакции учащиеся старались выучить «наизусть» коэффициенты в ней, то теперь при подсчёте приёма и отдачи электронов такая потребность отпадает:
То, что нами написано, при направляющих вопросах преподавателя учащиеся могут легко понять. Уравнивая прием и отдачу электронов, они легко находят основные коэффициенты и в окончательном виде пишут равенство:
Центральным местом при изучении окислительно-восстановительных реакций в средней школе являются реакции между металлами и азотной кислотой.
Учащиеся должны ясно осознать, что азотная кислота в этих реакциях расходуется, с одной стороны, на окисление металла и при этом ее ион азота восстанавливается, а с другой стороны, — на образование соли, и валентность азота в ней в этом случае не изменяется.
Поэтому вследствие двойной функции азотной кислоты и писать ее в уравнении, особенно на первых порах, следует два раза. Даётся, например, задание написать уравнение реакции между разбавленной азотной кислотой и медью.
Окислительно восстановительные реакции
1-й шаг. На доске пишется:
2-й шаг. По продуктам реакции видно, что азотная кислота играет двойную роль, поэтому и в уравнении реакции она пишется два раза и уравнивается приём и отдача электронов между атомами меди и азотной кислотой, идущей на их окисление:
3-й шаг. При перенесении коэффициентов в правую часть равенства необходимо держаться направления больших стрелок:
4-й шаг. Обращается внимание учащихся на количество необходимых кислотных остатков азотной кислоты на три молекулы нитрата меди и найденное число 6 ставится коэффициентом перед азотной кислотой в левой части равенства:
5-й шаг. Далее подчитывается количество ионов водорода в левой части равенства, идущих на образование воды, и в окончательном виде пишется равенство:
Аналогичным путём пишутся уравнения реакций с концентрированной азотной кислотой, продуктом восстановления которой чаще является двуокись азота.
Круговорот азота в природе денитрификация

Отмечается, что эти процессы, ведущие к образованию селитры, являются полезными процессами с точки зрения интересов сельского хозяйства.
Но в почве происходит и обратный процесс — денитрификация, — в результате которого азот селитры восстанавливается до газообразного азота, уходящего в воздух.
Рис. Схема круговорота азота в природе
Процесс денитрификации является вредным процессом с точки зрения интересов сельского хозяйства, недостаток воздуха в почве благоприятствует этому процессу, отсюда вытекает необходимость рыхления почвы, её аэрация.
Фосфор как окислитель и восстановитель
При повторении темы «Фосфор» следует обратить внимание на довольно сложную реакцию — получение фосфора в свободном виде: указываются исходные продукты этой реакции и условие её протекания:
Реакция получения фосфора
Уравнение реакции целесообразно писать по фазам с выяснением роли участвующих в ней веществ:
1. Кремневый ангидрид, как мало летучее соединение, вытесняет более летучее соединение — фосфорный ангидрид:
2. Восстановление углем фосфора из фосфорного ангидрида:
Исключая промежуточные продукты — окись кальция и фосфорный ангидрид, пишем уравнение реакции в суммарном виде:
Свойства фосфора
При повторении химических свойств фосфора отмечается лёгкая окисляемость белого фосфора. Следует продемонстрировать опыты: самовоспламенение бумаги, смоченной раствором белого фосфора в сероуглероде.
Самовоспламенение свечей, распушённые иглой или булавкой фитили которых смочены тем же раствором. В связи с этими опытами следует сделать замечание, что так раньше в церкви получали «чудесные» огни.
Далее отмечается лёгкая воспламеняемость водородистых соединений фосфора, которые в природе образуются при гниении трупов, например на кладбищах, отмечаются суеверия, связанные с «чудесными» огнями на кладбищах и т. п.
Статья на тему Азот окислитель восстановитель
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Азот: решение уравнений ОВР методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры уравнений окислительно-восстановительных реакций азота (См. Азот и его соединения).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций азота
1. Уравнение термической реакции окисления азота:
2. Уравнение реакции азота с водородом:
3. Уравнение реакции азота с магнием:
4. Уравнение реакции азота с углеродом в нейтральной среде:
5. Уравнение реакции азота карбидом кальция с образованием цианамида кальция:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Напишите уравнения реакций, характеризующие азот как А) окислитель Б)Восстановитель?
Химия | 5 — 9 классы
Напишите уравнения реакций, характеризующие азот как А) окислитель Б)Восстановитель.
Составьте схемы электронного баланса или обозначьте переход электронов стрелкой.
А) взаимодействие с водородом с образованием аммиака.
Б) окисление кислородом с образованием любого оксида азота.
Уравнения писать не буду, это элементарно.
Напишите уравнения реакций окисления концентрированной серной кислотой Ba?
Напишите уравнения реакций окисления концентрированной серной кислотой Ba.
Составьте схемы электронного баланса.
Напишите уравнения реакций азота с натрием и водородом?
Напишите уравнения реакций азота с натрием и водородом.
Приведите электронный баланс.
Запишите уравнение и составьте схему электронного баланса реакции диоксида азота с водой?
Запишите уравнение и составьте схему электронного баланса реакции диоксида азота с водой.
По данным схемам составьте схемы электронного баланса и уравнения окислительно — востановительных реакций?
По данным схемам составьте схемы электронного баланса и уравнения окислительно — востановительных реакций.
Приведите примеры реакций, характеризующие как восстановитель : а) серу ; б) сероводород?
Приведите примеры реакций, характеризующие как восстановитель : а) серу ; б) сероводород.
Напишите уравнения реакций, покажите переход электронов стрелкой.
Как отличить реакции, протекающие в растворе с участием ионов и уравнениям окислительно — восстановительных реакций?
Как отличить реакции, протекающие в растворе с участием ионов и уравнениям окислительно — восстановительных реакций?
В задачнике написано : Для реакций, протекающих в растворе с участием ионов, составьте ионные уравнения.
К уравнениям всех окислительно — восстановительных реакций составьте схему электронного баланса или покажите переход электронов стрелкой.
Приведите примеры уравнений реакций, в которых сера является окислителем, востановителем?
Приведите примеры уравнений реакций, в которых сера является окислителем, востановителем.
Составьте схемы электронного баланса.
В уравнении химической реакции стрелкой покажи переход электронов от восстановителя к окислителю?
В уравнении химической реакции стрелкой покажи переход электронов от восстановителя к окислителю.
Над стрелкой укажи количество перешедших электронов.
ZnO + CO = Zn + CO2.
Закончите уравнения реакций, составьте схемы электронного баланса?
Закончите уравнения реакций, составьте схемы электронного баланса.
Приведите примеры уравнений реакций, в которых сера является окислителем , восстановителем?
Приведите примеры уравнений реакций, в которых сера является окислителем , восстановителем.
Составьте схемы электронного баланса.
Если вам необходимо получить ответ на вопрос Напишите уравнения реакций, характеризующие азот как А) окислитель Б)Восстановитель?, относящийся к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
Cu = 63, 5 Cl = 35 CuCl2 = 63, 5 + 35 * 2 = 133, 5.
источники:
http://prosto-o-slognom.ru/chimia_ovr/zadachi_03_N_meb.html
http://himia.my-dict.ru/q/2169524_napisite-uravnenia-reakcij-harakterizuusie-azot-kak/
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e11b2280c727169 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Напишите уравнения реакций, характеризующие азот как А) окислитель Б)Восстановитель?
Химия | 5 — 9 классы
Напишите уравнения реакций, характеризующие азот как А) окислитель Б)Восстановитель.
Составьте схемы электронного баланса или обозначьте переход электронов стрелкой.
А) взаимодействие с водородом с образованием аммиака.
Б) окисление кислородом с образованием любого оксида азота.
Уравнения писать не буду, это элементарно.
Напишите уравнения реакций окисления концентрированной серной кислотой Ba?
Напишите уравнения реакций окисления концентрированной серной кислотой Ba.
Составьте схемы электронного баланса.
Напишите уравнения реакций азота с натрием и водородом?
Напишите уравнения реакций азота с натрием и водородом.
Приведите электронный баланс.
Запишите уравнение и составьте схему электронного баланса реакции диоксида азота с водой?
Запишите уравнение и составьте схему электронного баланса реакции диоксида азота с водой.
По данным схемам составьте схемы электронного баланса и уравнения окислительно — востановительных реакций?
По данным схемам составьте схемы электронного баланса и уравнения окислительно — востановительных реакций.
Приведите примеры реакций, характеризующие как восстановитель : а) серу ; б) сероводород?
Приведите примеры реакций, характеризующие как восстановитель : а) серу ; б) сероводород.
Напишите уравнения реакций, покажите переход электронов стрелкой.
Как отличить реакции, протекающие в растворе с участием ионов и уравнениям окислительно — восстановительных реакций?
Как отличить реакции, протекающие в растворе с участием ионов и уравнениям окислительно — восстановительных реакций?
В задачнике написано : Для реакций, протекающих в растворе с участием ионов, составьте ионные уравнения.
К уравнениям всех окислительно — восстановительных реакций составьте схему электронного баланса или покажите переход электронов стрелкой.
Приведите примеры уравнений реакций, в которых сера является окислителем, востановителем?
Приведите примеры уравнений реакций, в которых сера является окислителем, востановителем.
Составьте схемы электронного баланса.
В уравнении химической реакции стрелкой покажи переход электронов от восстановителя к окислителю?
В уравнении химической реакции стрелкой покажи переход электронов от восстановителя к окислителю.
Над стрелкой укажи количество перешедших электронов.
ZnO + CO = Zn + CO2.
Закончите уравнения реакций, составьте схемы электронного баланса?
Закончите уравнения реакций, составьте схемы электронного баланса.
Приведите примеры уравнений реакций, в которых сера является окислителем , восстановителем?
Приведите примеры уравнений реакций, в которых сера является окислителем , восстановителем.
Составьте схемы электронного баланса.
Если вам необходимо получить ответ на вопрос Напишите уравнения реакций, характеризующие азот как А) окислитель Б)Восстановитель?, относящийся к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
Напишите уравнение реакции характеризующие азот как окислитель
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
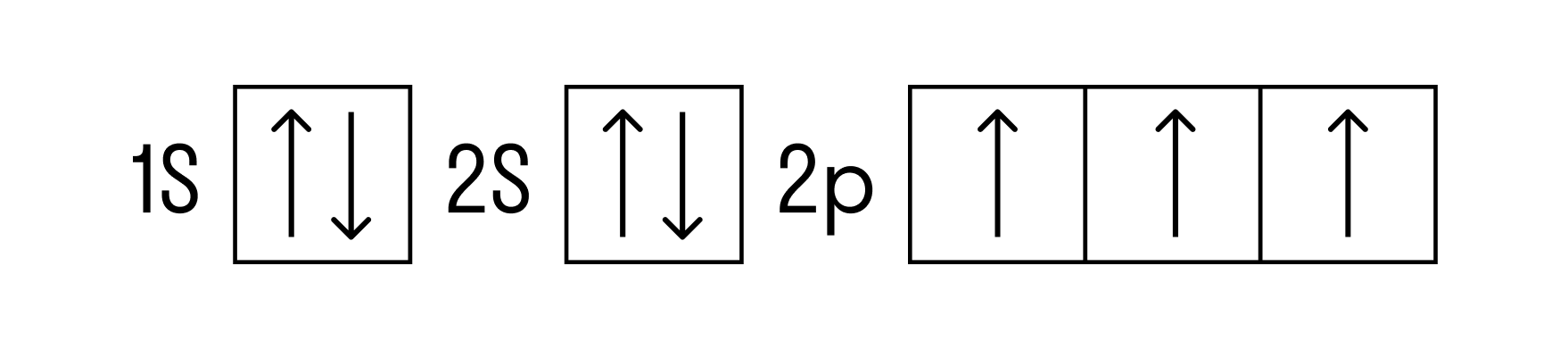
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s 2 2s 2 2p 3 , в сокращенном виде — [He]2s 2 2p 3 . На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
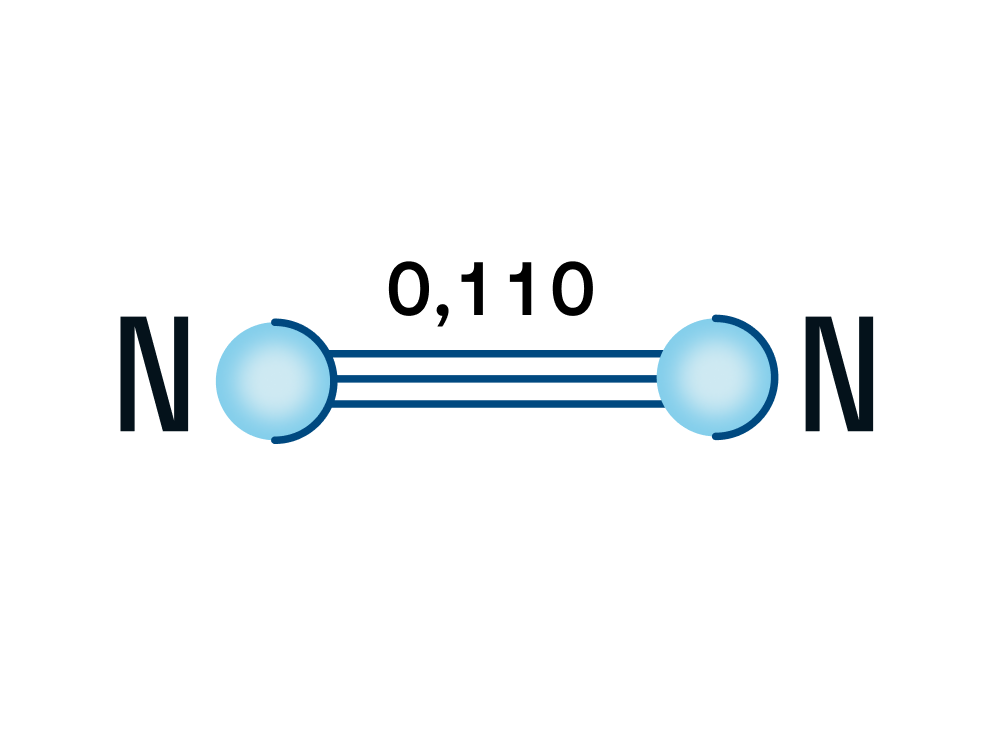
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
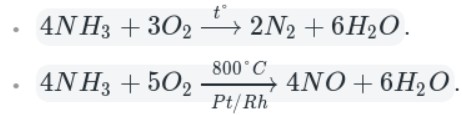
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
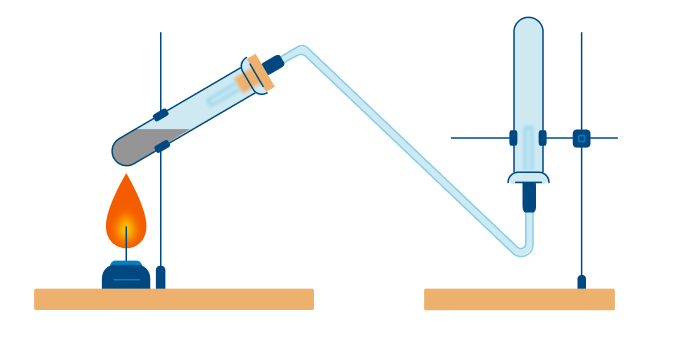
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O
Окисление оксида азота (II)
2NO + O2 = 2NO2
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
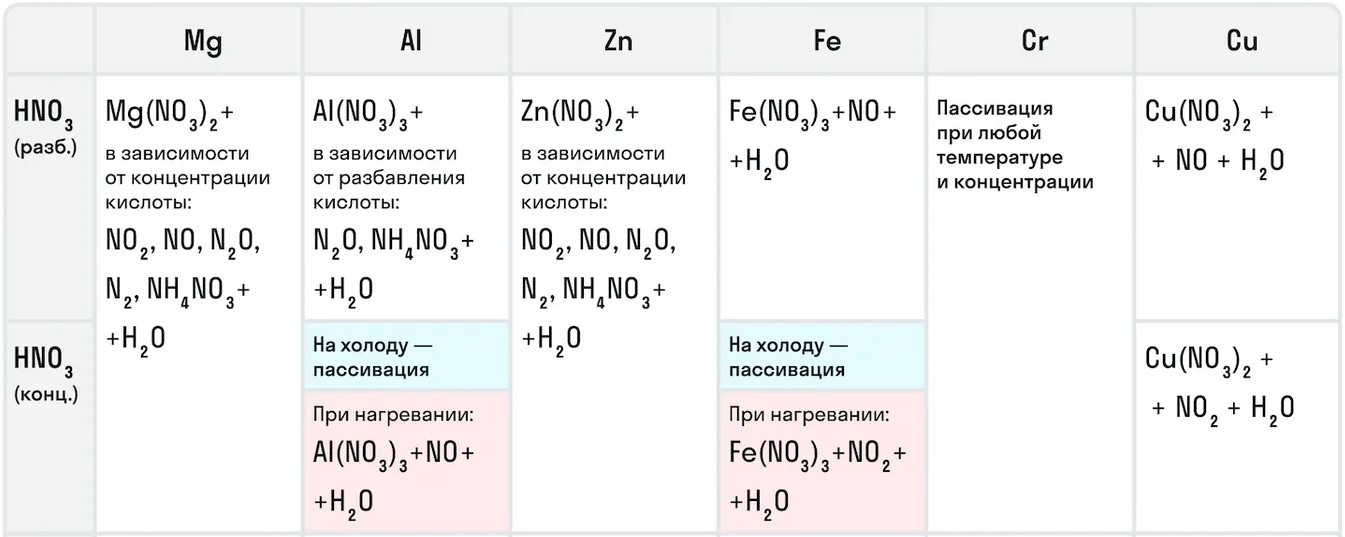
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
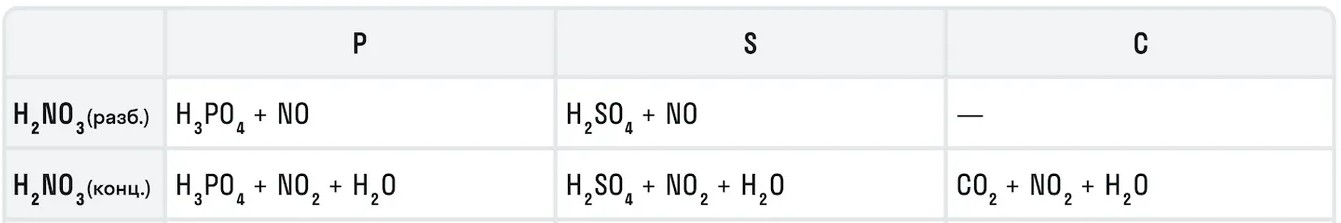
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
источники:
http://himia.my-dict.ru/q/2169524_napisite-uravnenia-reakcij-harakterizuusie-azot-kak/
http://skysmart.ru/articles/chemistry/azot