Основные оксиды

4.6
Средняя оценка: 4.6
Всего получено оценок: 2341.
4.6
Средняя оценка: 4.6
Всего получено оценок: 2341.
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
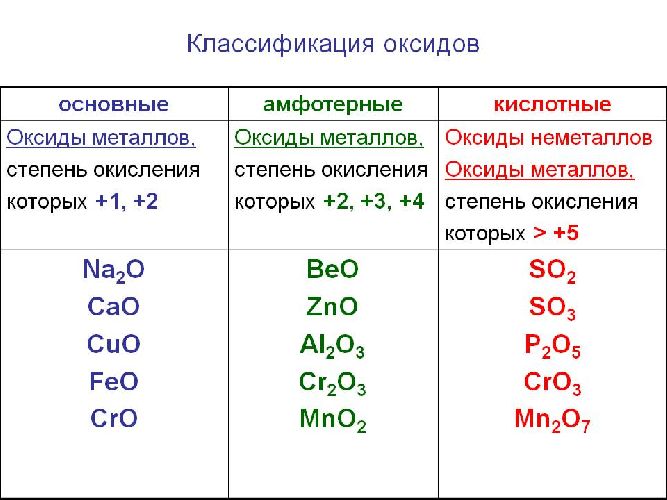
Классификация оксидов
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
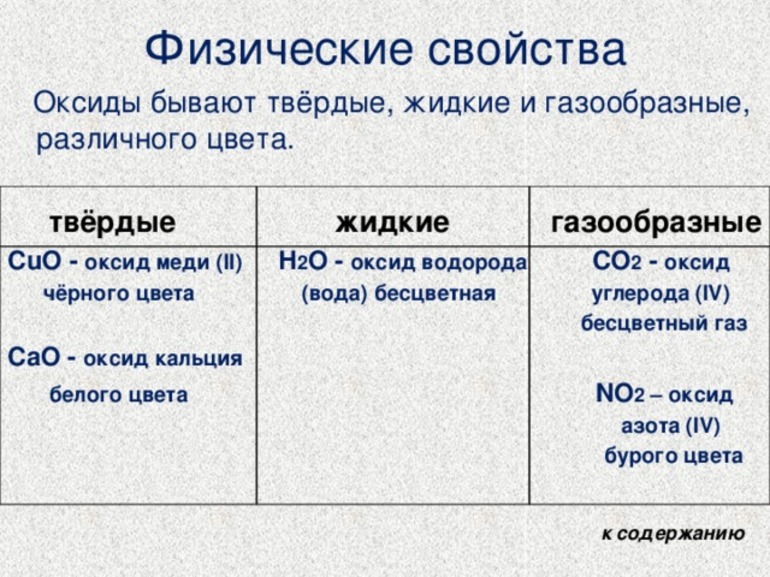
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO2 (кислотный оксид)=СaCO3 (соль)
FeO (основной оксид)+H2 SO4 (кислота)=FeSO4 (соль)+2H2O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
CaO+ZnO=CaZnO2
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H2O (вода)=Ba(OH)2 (основание щелочнозем. металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH3 =3Cu+3H2 O+N2
При нагревании разлагаются только оксиды ртути и благородных металлов:
2AU2O=4Au+O2
2HgO=2Hg+O2
Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
Что мы узнали?
При образовании основных оксидов одним из обязательных элементов является кислород.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
10/10
-
Ярослав Галкин
10/10
-
Николай Булахов
9/10
-
Инал Абдуллаев
10/10
-
Дворникова Кристина
8/10
-
Ахмад Махаров
7/10
-
Сергей Ефремов
8/10
-
Анастасия Вострикова
10/10
-
Данила Волков
10/10
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 2341.
А какая ваша оценка?
Основной оксид
Полезное
Смотреть что такое «Основной оксид» в других словарях:
-
основной оксид — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN basic oxide … Справочник технического переводчика
-
Оксид кальция(II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
-
Оксид кальция (II) — Оксид кальция Общие Систематическое наименование Оксид кальция Химическая формула CaO Молярная масса 56.077 г/моль … Википедия
-
Оксид магния(II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
-
Оксид магния (II) — Оксид магния Оксид магния (жжёная магнезия, периклаз), MgO бесцветные кристаллы, нерастворимые в воде, пожаро и взрывобезопасен. Основная форма минерал периклаз. Содержание 1 Свойства 2 … Википедия
-
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
-
Оксид углерода(II) — Оксид углерода(II) … Википедия
-
Оксид свинца(II) — Общие … Википедия
-
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
-
Оксид хрома(III) — Оксид хрома(III) … Википедия
Общие сведения
В 1775 году французский химик А. Лавуазье правильно истолковал результаты опытов Д. Пристли. Он понял, что газ, поддерживающий горение в герметичном сосуде, — это не часть воздуха, а новый химический элемент. Лавуазье назвал его оксигеном, что в переводе с греческого означает «образующий кислоты», так как думал, что новый элемент входит во все кислоты. Однако такая теория не была верной. Название кислород — это своего рода калька с французского, введенная М. В. Ломоносовым.
Кислород — газ без цвета, запаха и вкуса. При сильном охлаждении превращается сначала в голубую жидкость, затем — в кристаллы синего цвета. Имеет валентность 2 и семь степеней окисления в зависимости от вещества, с которым взаимодействует.
Степени окисления для разных соединений:
- оксиды — [-2];
- пероксиды — [-1];
- суперокислы или надперокислы — [-½];
- озониды (озон) — [-1/3];
- соли [O+] — [+½];
- монофторид кислорода — [+1];
- дифторид кислорода — [+2].
Образование оксидов
Бинарное соединение кислорода в степени окисления -2 с другим химическим элементом называется оксидом, иногда окисью или окислом. Оксиды существуют или были получены от всех химических элементов, кроме аргона, неона и гелия. Только фтор не может образовать окись, так как его электроотрицательность выше, чем у кислорода. Его соединения называются фторидами.
Получаются оксиды как при непосредственном вступлении кислорода в реакцию с другим химическим элементом, так и при косвенном взаимодействии — в результате разложения кислот, солей и оснований. Самый простой способ получения окисла — это сжигание вещества в кислороде. Формулы оксидов можно определить исходя из значений валентности кислорода и второго химического вещества, а номенклатура названий образуется по схеме:
- Слово оксид.
- К нему добавляется название второго элемента в родительном падеже.
- Если элемент имеет несколько степеней окисления, то рядом в скобках римскими цифрами ставится нужная.
Например, Mn2O7 — оксид марганца (VII). Допускается название по количеству атомов кислорода — монооксид, диоксид и т. п. Широко распространены и названия, сложившиеся исторически.
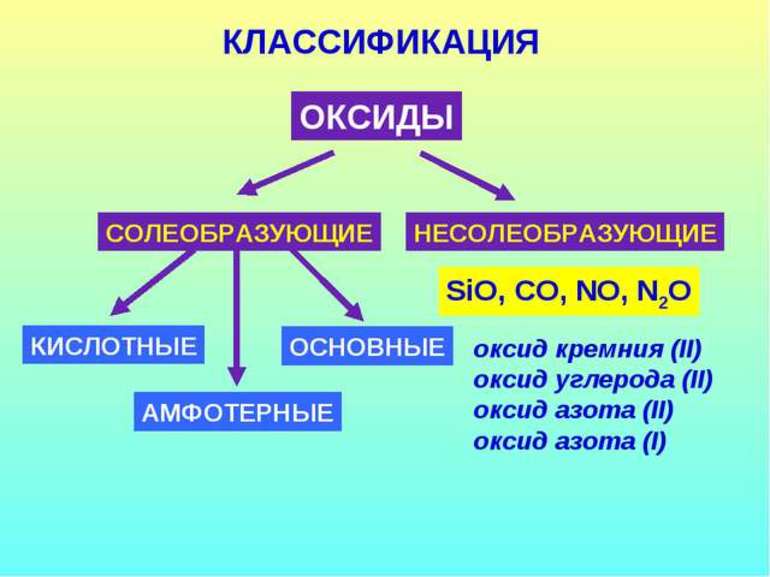
Все существующие оксиды разделяются на солеобразующие и несолеобразующие. Последние являются оксидами неметаллов, не имеющих соответственных гидроксидов. Таких соединений немного, к ним относятся оксиды одно- и двухвалентных неметаллов — вода H2O, токсичные газы монооксид углерода CO и оксид азота (II) NO, «веселящий газ» N2O, соединения с кислородом серы и кремния. Они довольно инертны, если и взаимодействуют с другими веществами, то солей не образовывают. Например, при растворении в воде N2O и SO2 образуется серная кислота, и выделяется азот.
Классификация солеобразующих соединений
В химии соединения с кислородом разделяют по характеру их соответствия основаниям, кислотам и амфотерным образованиям. Если металл, составляющий формулу с кислородом, имеет несколько степеней окисления, то промежуточное значение будет у амфотерного, самое большое — у кислотного, а самое низкое — у основного соединения.
К основным оксидам относятся соединения металлов, степень окисления которых равна +1 или +2. Им соответствуют гидроксиды, относящиеся к классу оснований. Реагируют с кислотами, в результате чего получаются соль и вода. В периодической системе усиление основных характеристик наблюдается в главных подгруппах сверху вниз. Список основных оксидов:
- Na2O — окись натрия, бесцветное кристаллическое вещество, применяется в виде реактива и как сырье для получения гидроксида натрия.
- K2O — твердый, реже мягкий, материал светло-желтого цвета, входящий в состав некоторых видов удобрений и цементов. Химически очень активное вещество, на воздухе сразу поглощает углекислый газ, переходя в карбонат калия, реагирует со спиртом, эфиром, серой, галогенами.
- CuO — нерастворимый в воде черный порошок, который можно получить разными способами, например, нагревая малахит. Применяется в производстве стекол и эмалей, вступая в реакцию, окрашивает их в зеленый или синий цвет.
- CaO — негашеная известь, получается из известняка. Представляет собой белое кристаллическое вещество, широко используется в строительстве.
- FeO — твердые кристаллы черного цвета, в природе встречаются в виде минерала вюстита. Используются как пищевой краситель Е172, при производстве чугуна и в качестве красящего компонента в керамике и минеральных красках.
- BaO — бесцветный ядовитый порошок, при сильном нагревании с кислородом переходит в пероксид.
- HgO — красное или оранжевое вещество, очень ядовитое и неустойчивое. В природе встречается только в редком минерале монтроидите. При опытах с оксидом ртути и был открыт кислород.
- MgO — жженая магнезия, из которой состоит минерал периклаз. Имеет коэффициент отражения света единицу, т. е. является абсолютным отражателем и может быть эталоном белого цвета.
К кислотным или ангидридам относятся оксиды неметаллов и металлов со степенью окисления больше +5.
Поскольку в них химические элементы находятся в высшей степени активности, их еще называют высшими. Кислотные свойства таких соединений повышаются по мере продвижения по таблице Менделеева слева направо, так как увеличивается положительный заряд ионов элемента с возрастанием номера периода.
Ангидриды соответствуют гидроксидам, относящимся к кислотам, они могут растворяться в щелочах, образуя при этом соль и воду. Некоторые вступают в реакцию с водой. Типичные представители кислотных оксидов: SO2, SO3, CrO3, P2O5, Cl2O7, Mn2O7. Металлы, которые могут иметь степень окисления +2, +3, +4, образуют с кислородом амфотерные соединения, проявляющие то кислотные, то основные свойства в зависимости от условий химической реакции. К ним относятся Fe2O3, Cr2O3, Al2O3, ZnO, BeO и MnO2.
Физические и химические свойства
Свойства оксидов физического характера определяются структурой их строения. Окислам металлов присуще ионное строение, что определяет и их свойства. Чаще всего это твердые вещества самых разных окрасок. Не растворяются в воде, за исключением соединений щелочных и щелочноземельных металлов. Имеют высокие температуры кипения и плавления. Другие свойства определяются их составом.
Вещества, образованные неметаллическими элементами, чаще всего имеют молекулярный вид строения и более разнообразны по агрегатному состоянию — встречаются жидкие, газообразные и твердые оксиды. К жидкостям относятся:
- вода;
- азотистый ангидрид N203 синего цвета;
- бесцветный и токсичный триоксид серы S03;
- зеленовато-бурый или красный Mn207;
- дихлорогептаоксид Cl207.
Окиси серы, углерода и азота при нормальных условиях находятся в газообразном состоянии. Главные химические свойства основных оксидов:
- Способность реагировать с водой до образования щелочи. Известная реакция гашения извести — CaO быстро и с теплоотдачей реагирует с водой, превращаясь в гидроксид кальция или гашеную известь.
- Химическое взаимодействие между окислами и кислотами приводят к образованию соли и воды. Если известь смешать с серной кислотой, то получится CaSO4, проще говоря — гипс.
- Вступление в реакцию с кислотными оксидами до получения соли. При взаимодействии извести с углекислым газом получается CaCO3, т. е. обычный мел.
Разные соединения имеют и уникальные свойства. CuO при сплавлении с основаниями, т. е. когда смесь веществ дополнительно нагревают, образует купраты (двойные соли меди и другого металла). Это говорит о слабовыраженных амфотерных свойствах окиси меди.
Также она довольно хорошо восстанавливается до металлического состояния аммиаком, углем и водородом.
FeO распадается при среднем нагревании, но если продолжать поднимать температуру, то получатся оксид Fe3O4 и железо. Может вступать в реакцию с сероводородом и восстанавливаться водородом и коксом. BaO при нагревании до 600 градусов переходит в пероксид бария и может восстановиться до металла при повышении температуры с цинком, магнием и кремнием.
Кислотные оксиды также хорошо реагируют с водой, взаимодействуют с основаниями и основными оксидами. Углекислый газ, растворяясь в воде, образует слабую угольную кислоту, ее применяют для газирования воды, при этом происходит обратная реакция. Диоксид углерода, вступая в реакцию с едким натром NaOH, образует соль угольной кислоты, известную в обиходе как кальцинированная сода. Из углекислого газа получается и так называемая горькая соль MgCO3, для этого нужно соединить CO2 и MgO.
Амфотерные оксиды вступают в химические реакции и с кислотами, и с основаниями. При взаимодействии со щелочами часто получаются соли двойных металлов.
Области применения
Оксиды очень широко применяются в быту, промышленности, медицине и других областях. Вода H2O — источник жизни на земле. Гематит или красный железняк Fe2O3 используют для пигментации красных красок, а магнетит или магнитный железняк Fe3O4 — в металлургии и для изготовления электродов, так как он хорошо проводит электрический ток.
Негашеная известь применяется в строительстве и быту для борьбы с вредителями древесины. Мелкие кристаллы корунда Al2O3 наносят на наждачную бумагу для создания хорошего шлифовального эффекта. Крупные используют в изготовлении искусственных рубинов и сапфиров для ювелирных изделий и часов.
Нанесение оксида железа (II) на сталь называется воронением или чернением. Соединение образовывает прочный тонкий слой на поверхности. Регулируя его толщину, можно получить так называемые цвета побежалости — пленки, изменяющей свой цвет в радужном спектре. Это свойство используют в технологии нанесения цветных рисунков на сталь.
Углекислый газ CO2 используют и в твердом, и в жидком виде. В пищевой промышленности его применяют при изготовлении разнообразных газированных напитков, соды, сахара. В виде сухого льда он используется для сильного охлаждения продуктов и материалов. Жидкой углекислотой наполняют огнетушители.
Широкое применение получил сернистый газ SO2. Его используют в химической промышленности для производства серной кислоты. Способность сернистого газа убивать микроорганизмы и плесень позволила использовать его для дезинфекции подвалов, погребов, складских помещений, а также для хранения и перевозки фруктов и ягод.
Оксид кремния (IV) SiO2 — тугоплавкое и твердое вещество. Встречается в природе в кристаллическом и аморфном состоянии. Кристаллический кремнезем — это минералы кварца в виде халцедона, агата, яшмы, горного хрусталя. Кварцевый песок используют для изготовления стекла, бетона и кирпича. Полудрагоценные камни обрабатывают ювелиры, особенно красиво кристаллы выглядят при использовании одновременно с SiO2 оксида свинца PbO.
Аморфный кремнезем называется опалом и выражается формулой SiO2 ∙ nH2O. Из него делают украшения, химическую посуду, кварцевые лампы. Соединения, имеющие устойчивый цвет, используют для пигментации стекол и красок. CO2O3 придает материалам синий, Cr2O3 — зеленый, ZnO — белый, MnO2 — розовый цвет.
Окись цинка нашла и медицинское применение, ее добавляют в маски и кремы, подсушивают раны при кожных заболевания. Жженую магнезию MgO из-за ее способности хорошо реагировать с соляной кислотой желудочного сока назначают как средство при повышенной кислотности, она помогает убрать изжогу и выступает сорбентом. Оксид хрома (VI) CrO3 используется в восстановительной хирургии. Это вещество безвредно для человеческого организма.
Свойства основных оксидов
Материал по химии
- Основные оксиды с водой
- Основные оксиды с кислотными оксидами.
- Основные оксиды с кислотами.
- Основные оксиды с амфотерными оксидами
- Основные оксиды с CO, C, H2
- Основные оксиды с металлами
- Тренировка по свойствам основных оксидов
Основными оксидами называют оксиды металлов, в которых металл проявляет I или II валентность, например, CaO, MgO, FeO, Na2O, K2O (есть исключения: ZnO и BeO являются амфотерными – эти исключения нужно знать обязательно, они часто встречаются на ЕГЭ по химии. Есть и другие исключения, о которых мы не будем говорить, так как они не встречаются на ЕГЭ по химии).
Дальнейшие химические свойства основного оксида зависят от его состава, то есть от металла, который в этот оксид входит. Так, оксиды, образованные активными металлами (находятся в IА-группе ПС, к этой группе еще относят кальций, стронций и барий) растворяются в воде, но не взаимодействуют с типичными восстановителями – H2, C и CO, а оксиды переходных металлов (металлов B-подгрупп) – ровно наоборот.
Химические свойства основных оксидов можно записать в виде таблицы:
Таблица – химические свойства основных оксидов
|
Основные оксиды очень активных металлов (Li, Na, K, Rb, Cs, Fr, Ca, Sr, Ba) |
Основные оксиды остальных металлов (Mg, Cr, Fe) |
|
Растворимы в воде, при взаимодействии с ней образуют едкие основные гидроксиды — щелочи |
Не растворимы в воде и не реагируют с ней |
|
Реагируют с кислотными оксидами, образуя соль |
Реагируют с кислотными оксидами, образуя соль |
|
Реагируют с кислотами, образуя соль и воду |
Реагируют с кислотами, образуя соль и воду |
|
Реагируют с амфотерными оксидами |
Не реагируют с амфотерными оксидами |
|
Не восстанавливаются с помощью H2, C, CO |
Если образованны переходными металлами (металлами побочных подгрупп), то восстанавливаются с помощью H2, C, CO |
|
Реагируют с более активными металлами (если свободный металл стоит левее, чем металл в оксиде) |
Реагируют с более активными металлами (если свободный металл стоит левее, чем металл в оксиде) |
Основные оксиды с водой
Как было сказано выше, основные оксиды очень активных металлов реагируют с водой с образованием растворов щелочей (в скобках даны некоторые тривиальные названия, так как они встречаются на ЕГЭ и в сборниках Добротина и Доронькина):
K2O + H2O → 2KOH (тривиальное названия гидроксида калия – едкое кали)
Na2O + H2O → 2NaOH (тривиальное название гидроксида натрия – едкий натр)
Cs2O + H2O → 2CsOH
CaO + H2O → Ca(OH)2 (негашеная известь CaO превращается в гашеную известь – Ca(OH)2)
BaO + H2O → Ba(OH)2 (концентрированный раствор гидроксида бария называют баритовой водой)
Реакции растворения основного оксида экзотермические, то есть выделяют много теплоты, поэтому следует обращаться с такими основными оксидами очень аккуратно.
Основные оксиды с кислотными оксидами.
Общее уравнение взаимодействия основных и кислотных оксидов можно описать следующим выражением:
Основный оксид + кислотный оксид → соль
Это реакции соединения.
Например:
K2O + N2O5 → 2KNO3
CaO + SO3 → CaSO4
3Na2O + P2O5 → 2Na3PO4
Как понять, какую соль писать в продуктах? Самый простой способ – сложение, при котором на первом месте всегда будет металл, на втором – неметалл, в конце молекулы кислород, например:
Na2O + SiO2 → Na2SiO3 – силикат натрия получен сложением всех исходных элементов с учётом их индексов. Это самый простой метод, но он не всегда хорошо работает, в материале о кислотных оксидах мы подробно рассказали о самых удобных методах образования соли из оксидов: https://onlineclass.space/материал/химия/28/
Основные оксиды с кислотами.
При взаимодействии основного оксида с кислотой образуется соль и вода. Это реакции обмена. Понять, что за соль образуется в таких реакциях гораздо легче: она состоит из катиона металла (из основного оксида) и остатка кислоты (остаток кислоты – это то, что остается, если от неё отщепить все имеющиеся протоны водорода, например, остатком азотной кислоты — HNO3 будет нитрат-ион NO3‒, а остатком серной кислоты — H2SO4 является сульфат-ион SO42‒).
K2O + 2HNO3 → 2KNO3 + H2O
CuO + H2SO4 → CuSO4 + H2O
FeO + 2HCl → FeCl2 + H2O
Основные оксиды с амфотерными оксидами
При взаимодействии основного оксида, образованного активными металлами, с амфотерными оксидами образуется соль:
Na2O + Al2O3 → NaAlO2
K2O + ZnO → K2ZnO3
BaO + BeO → BaBeO2
Подробнее об этой теме Вы можете прочитать в материале:
https://onlineclass.space/материал/химия/30/
Основные оксиды с CO, C, H2
Оксиды переходных металлов реагируют с восстановителями до образования металла:
FeO + H2 → Fe + H2O
MnO + C → Mn + CO
CuO + CO → Cu + CO2
Основные оксиды с металлами
Более активные металлы вытесняют менее активные металлы из их оксидов. Чтобы определить, какой металл активнее, пользуются рядом активности металлов (электрохимический ряд напряжений): чем правее в нем стоит металл, тем он слабее.
Тренировка по свойствам основных оксидов
Для тренировки решите несколько заданий в формате ОГЭ и ЕГЭ по химии.
Задание 1
Задание в формате ЕГЭ с ответом:
Какие из перечисленных оксидов реагируют с водой?
- NiO
- Cs2O
- CuO
- SrO
- MgO
- K2O
Задание 2
Пример задания из КИМ ЕГЭ:
Какие из перечисленных оксидов реагируют с амфотерными оксидами?
- FeO
- Na2O
- CaO
- BaO
- MgO
- MnO
Задание 3
Задание по образцу ФИПИ:
Какие из перечисленных оксидов реагируют с H<sub>2</sub>?
- CuO
- BaO
- Na2O
- FeO
- CaO
- CrO
Задание 4
Попробуйте решить задание ЕГЭ:
C какими из перечисленных оксидов может взаимодействовать железо?
- K2O
- ZnO
- CuO
- MgO
- NiO
- Ag2O
Задание 5
C какими из перечисленных веществ реагирует Na2O?
- Ba(OH) 2
- Al2O3
- Fe
- H2O
- NH4NO3
- HClO4
Задание 6
С какими из перечисленных веществ реагирует FeO?
- C
- NaBr
- H2O
- ZnO
- Zn
- H2
Осно́вные окси́ды — солеобразующие оксиды металлов, которым соответствуют основания[1]. Как правило, металлы в них проявляют степень окисления +1 или +2[2]. К ним относятся оксиды щелочных и щёлочноземельных металлов, а также оксиды переходных металлов в низших степенях окисления.
Таким образом, основными называются оксиды, гидроксиды которых являются основаниями.
Химические свойства
- Могут взаимодействовать с водой с образованием соответствующих гидроксидов. В реакцию с водой вступают не все основные оксиды, а только оксиды наиболее активных металлов, которые расположены в главных подгруппах первой и второй групп Периодической таблицы (натрий, калий, кальций, барий и др.)[3]:
- Взаимодействуют с кислотами с образованием соли и воды[3]:
- Взаимодействуют с кислотными оксидами с образованием соли[4]:
- Взаимодействуют с амфотерными оксидами с образованием соли[4]:
- Многие основные оксиды могут восстанавливаться до простых веществ[1]:
- Оксиды благородных металлов и ртути разлагаются при нагревании[1]:
Получение
- Окисление металлов (кроме благородных) кислородом[3]:
- Разложение гидроксидов[1]:
Примеры
Примеры основных оксидов[1][5][6]:
См. также
- Оксиды
- Солеобразующие оксиды
- Несолеобразующие оксиды
- Основные гидроксиды
Примечания
- ↑ 1 2 3 4 5 В.И. Федорченко и др. Общая химия. Часть 1.. — Оренбург: ГОУ ОГУ, 2011.
- ↑ Э.Г. Злотников. Краткий справочник по химии. — 3-е изд. — СПб.: Питер, 2012. — С. 18. — 192 с. — ISBN 978-5-459-00897-5.
- ↑ 1 2 3 Г.М. Чернобельская, И.Н. Чертков. Химия. — Москва: Дрофа, 2007. — С. 41. — 733 с. — ISBN 978-5-358-03176-0.
- ↑ 1 2 В.Ю. Джамеев. Химия. Биология. — Москва: Эксмо, 2015. — С. 31. — 96 с. — ISBN 978-5-699-76828-8.
- ↑ О.В. Мешкова. Химия. — Москва: Эксмо, 2017. — С. 189. — 368 с. — ISBN 978-5-699-95854-2.
- ↑ Константы неорганических веществ / под ред. Р.А. Лидина. — Москва: Дрофа, 2008. — С. 6. — 685 с. — ISBN 978-5-358-04347-3.
Ссылки
- [www.xumuk.ru/encyklopedia/2/3047.html Оксиды в Химической энциклопедии]
Эта страница в последний раз была отредактирована 5 сентября 2022 в 18:46.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.




















![{displaystyle {mathsf {Ca(OH)_{2}{xrightarrow[{}]{t}}CaO+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4619a68630114e18dc70e12f305d76778ea86f17)