ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ
- ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ
-
- ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ
-
(от позднелат. partialis — частичный), давление, к-рое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же темп-ре. Общее давление смеси газов равно сумме П. д. отд. составляющих смеси (см. ДАЛЬТОНА ЗАКОНЫ). Пространств. неоднородность П. д. определяет течение процессов диффузии данного газа, абсорбции, растворения и распределения его между двумя частями системы, разделёнными проницаемой для данного газа перегородкой (см. ОСМОС).
Физический энциклопедический словарь. — М.: Советская энциклопедия.
.
1983.- ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ
-
— часть общего давления, относящаяся к одному из компонентов газовой смеси. Равно давлению, к-рое он оказывал бы в отсутствие всех др. компонентов смеси, т. е. в том случае, когда масса данного компонента, содержащаяся в газовой смеси, одна занимала бы весь объём. Понятие П. д. применимо только к идеальным газам. Молярное П. д. i-ro компонента газовой смеси с общим давлением р равно: pi = Nip, где Ni — отношение числа молей данного компонента к сумме молей всех компонентов смеси (см. Дальтона законы).
П. д. непосредственно измерить нельзя, <его вычисляют исходя из общего давления и состава смеси. П. д. необходимыдля расчёта фазовых равновесий разл. физ.-хим. процессов.Ю. Н. Любитов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия.
Главный редактор А. М. Прохоров.
1988.
.
Полезное
Смотреть что такое «ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ» в других словарях:
-
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ — давление каждого (см.) или (см.) в смеси нескольких газов, которое данный газ или пар имел бы, если бы он один занимал весь объём смеси, находясь при ее температуре. Общее давление смеси равно сумме П. д. всех ее составляющих. П. д. используют в… … Большая политехническая энциклопедия
-
ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ — (от позднелат. partialis частичный) давление компонента идеальной газовой смеси, которое он оказывал бы, если бы один занимал объем всей смеси (см. Дальтона законы) … Большой Энциклопедический словарь
-
парциальное давление — Давление газа, входящего в состав газовой смеси, к рое он оказывал бы, занимая один весь объем смеси при той же темп ре. [http://metaltrade.ru/abc/a.htm] Тематики металлургия в целом EN partial pressure … Справочник технического переводчика
-
Парциальное давление — см. Давление … Российская энциклопедия по охране труда
-
парциальное давление — 3.7 парциальное давление (partial pressure): Давление, создаваемое одним компонентом газовой смеси при той же температуре и в том же объеме, который занимает смесь. Примечание В смеси идеальных газов парциальное давление каждого компонента равно… … Словарь-справочник терминов нормативно-технической документации
-
Парциальное давление — (лат. partialis частичный, от лат. pars часть) давление отдельно взятого компонента газовой смеси[1][2]. Общее давление газовой смеси является суммой парциальных давлений её компонентов. В химии парциальное давление газа в смеси газов… … Википедия
-
парциальное давление — (от позднелат. partialis частичный), давление компонента идеальной газовой смеси, которое он оказывал бы, если бы один занимал объём всей смеси (см. Дальтона законы). * * * ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ (от позднелат. partialis… … Энциклопедический словарь
-
парциальное давление — dalinis slėgis statusas T sritis Standartizacija ir metrologija apibrėžtis Dujų mišinio vieno sando slėgis, kurį turėtų tas sandas, jei vienas užimtų visą mišinio tūrį. Idealiųjų dujų dalinis slėgis p₁ = N₁ · p; čia N₁ – sando molinė dalis, p –… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
-
парциальное давление — dalinis slėgis statusas T sritis Standartizacija ir metrologija apibrėžtis Dujų mišinio vieno sando slėgis. atitikmenys: angl. partial pressure vok. Partialdruck, m; Teildruck, m rus. парциальное давление, n pranc. pression partielle, f … Penkiakalbis aiškinamasis metrologijos terminų žodynas
-
парциальное давление — dalinis slėgis statusas T sritis chemija apibrėžtis Dujų mišinio vieno komponento slėgis. atitikmenys: angl. partial pressure rus. парциальное давление … Chemijos terminų aiškinamasis žodynas
Трактовка закона
Учёный Дальтон в 1801 году сформировал закон парциальных давлений: Па смеси из идеальных газов равняется сумме рi её компонентов. Уравнение имеет следующий вид: Рсм=n (сумма pi), где n — число долей смеси.
Для определения парциального давления в химии используется отдельный компонент из атмосферного воздуха. При расчете учитывается значение каждого отдельного вещества, их число, температуры с объёмами. При необходимости можно найти общий показатель, сложив давление каждого компонента в отдельности.
Каждый газ в сосуде должен обозначаться как «идеальный». При нормальных условиях они взаимодействуют с углекислым газом, водородом, водой, азотом, водяным паром, кислородом, компонентами крови и прочими компонентами из таблицы Менделеева. При этом не образуются соединения. Отдельные молекулы способны сталкиваться между собой, отталкиваясь, но не деформируясь.
Физические и химические задачи решаются с помощью формулы парциального давления (закон открыли учёные Бойль и Мариотт): (k = P x V). Кроме полного варианта, уравнение записывается сокращённо k = PV, где:
- k равно постоянной величине;
- Р — давление;
- V — объем.
Второстепенные значения
Давление может измеряться в разных величинах: процент, паскаль (Па). Смысл последнего: сила в 1 ньютон приложена к площади в 1 кв. м. Если результат такой зависимости записывается в атмосферах, тогда для его нахождения потребуется учесть, что одна атмосфера равняется 101,325 Па.
Температура идеального газа повышается, если увеличивается объём, а снижается, если уменьшается последний показатель. Такое соотношение может называться законом Чарльза, который имеет следующий математический вид: k = V / T. Значение температуры в уравнении измеряется в градусах Кельвина. Оно зависит от градусов Цельсия. Чтобы его найти, прибавляется 273.
Уравнение используется в химии для определения мольной доли (концентрация, которая выражается через отношение количества молей 1 компонента к суммарному числу молей пары веществ, входящих в смесь). Кроме объёма, для газа характерна молярная масса (вес одной доли компонента) и объём. Существуют легкие способы её подсчёта:
- Стандартная. Измеряется в граммах и килограммах.
- Молекулярная. Так как газы весят мало, их вес вычисляется в специальной единице измерения — молярная масса. Для её определения суммируется вес составных атомов. Каждый компонент сравнивается с массой карбона, равной 12.
Уравнения Дальтона и Бойля
Физик и химик Дальтон считается первым учёным, предположившим структуру атомных элементов, их свойства. Общее давление вычисляется следующим образом: Р= P1 + P2 + P3. Пример: в колбе содержится по 10 г оксигена и нитрогена. Их общее Р будет равно 20 (10+10). Для вычисления pi используется температура, равная 37 градусам Цельсия.
Чтобы перевести её в градусы Кельвина, значение по Цельсию, равное 37, добавляется к 273. Результат — 310. Для вычисления количества молей газов используется масса, поделённая на молярную. Если уравнение касается нитрогена, вес каждого компонента соответствует цифре 14.
Так как вещество содержит в себе 2 атома, то 14х2, что равно 28. Масса в граммах делится на полученный результат. Таким способом вычисляется количество молей, приблизительно равное 0,4 моль. Чтобы найти аналогичное значение у оксигена, применяется масса 16. Вещество относится к двухатомным газам, поэтому 16х2 равняется 32. По результатам получается, что 0,3 моль оксигена содержится в составе газовой смеси.
Если в задаче указывается общее давление и pi в атмосферах, тогда используется в качестве константы R (0.0821 л атм/K моль). При подстановке данных в уравнение можно узнать Pобщее. Чтобы вычислить ПД нитрогена, 0,4 моль умножается на константу и температуру. Результат делится на 2 литра, что приблизительно равно 5.09 атм. Аналогичные шаги выполняются для вычисления ПД оксигена. Конечный результат равен 3.82 атм.
Свойства веществ
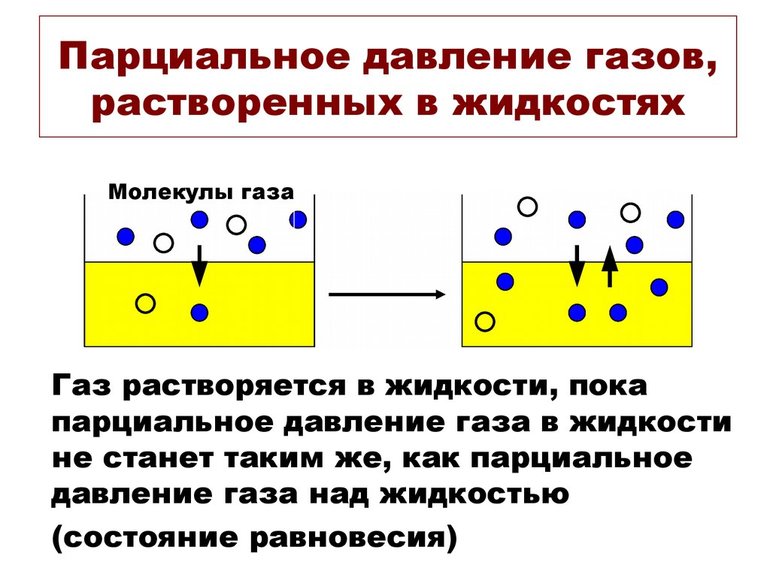
Значение pi газа, растворённого в жидкости, равняется pi того вещества, который образовался бы в фазе газообразования в случае равновесия с жидкостью при аналогичной температуре. Парциальное давление (ПД) измеряется в качестве термодинамической активности молекул вещества.
Газы постоянно вытекают из сферы с высоким ПД в область с низким давлением. Чем больше такая разница, тем быстрее поток. Газам свойственно растворяться, диффундировать, реагировать на ПД. В некоторых случаях показатель не зависит от концентрации газовой смеси.
При решении задач в области химии и физики учитываются свойства газов: сжимаемость и способность расширяться. Они не имеют своей формы, поэтому расширяются до заполнения сосуда, принимая его форму. По аналогичной причине они не имеют объёма. Газ давит на стенки ёмкости по всем направлениям одинаково. Характерное свойство компонентов — способность смешиваться между собой в разных соотношениях.
Так как объём зависит от температуры и давления, поэтому в норме должно быть 0 °C и 760 мм рт. ст. При этом нет места влаги. Если объём считается нормальным, его обозначают стоящей впереди буквой. Подобная зависимость отображается в термодинамике с помощью графика. Если доказана зависимость объема от давления, при этом температура постоянная, используются изотермы (линии, которые изображают на диаграмме процесс с неизменной температурой).
Точки и функции
В законе Бойля чётко указана зависимость объёма от давления при одинаковой температуре. Если данные нанести на график в функцию давления, через точки можно будет провести кривую. Точный эксперимент и незначительный разброс точек позволяют описать объёмное поведение системы с небольшой погрешностью.
Несколько подобных кривых для разных температур во всём диапазоне изученных условий позволяет описать объёмное поведение газа. Одновременно отображаются кривые постоянного давления, которые описывают изменения основных показателей. Чтобы получить окончательные результаты, кривые требуют незначительного сглаживания. Подобные графики сделать самостоятельно менее сложно.
Объём газа при неизменной температуре сильно изменяется с колебаниями давления. Но графически представить такую зависимость в широком диапазоне изменения давлений трудно. Если охвачена широкая область изменения, используются крупные масштабы.
Для упрощения процесса построения на график наносится зависимость произведения Р от давления при одной температуре, что существенно уменьшает область выявления функции. Наибольший эффект получается от применения 1−2 специальных функций объёма, которые называются коэффициентом сжимаемости и остаточным объёмом.
Каждое понятие характеризуется объёмным поведением газа с учётом его отклонений от нормального состояния вещества и созданных идеальных условий. Чтобы упростить поставленную задачу, график отображается на специальной бумаге либо при помощи компьютерных программ. Во втором случае достаточно ввести данные. Сервис самостоятельно строит прямые, кривые и прочие элементы графика.
Простые зависимости лучше отображать в стандартных программах Word. Графические сложные задачи в химии и физике решаются с помощью «Agrafer» — известная компьютерная программа, которая используется не только студентами, но и школьниками.
From Wikipedia, the free encyclopedia
In a mixture of gases, each constituent gas has a partial pressure which is the notional pressure of that constituent gas as if it alone occupied the entire volume of the original mixture at the same temperature.[1] The total pressure of an ideal gas mixture is the sum of the partial pressures of the gases in the mixture (Dalton’s Law).
The partial pressure of a gas is a measure of thermodynamic activity of the gas’s molecules. Gases dissolve, diffuse, and react according to their partial pressures but not according to their concentrations in gas mixtures or liquids. This general property of gases is also true in chemical reactions of gases in biology. For example, the necessary amount of oxygen for human respiration, and the amount that is toxic, is set by the partial pressure of oxygen alone. This is true across a very wide range of different concentrations of oxygen present in various inhaled breathing gases or dissolved in blood;[2] consequently, mixture ratios, like that of breathable 20% oxygen and 80% Nitrogen, are determined by volume instead of by weight or mass.[3] Furthermore, the partial pressures of oxygen and carbon dioxide are important parameters in tests of arterial blood gases. That said, these pressures can also be measured in, for example, cerebrospinal fluid.
Symbol[edit]
The symbol for pressure is usually P or p which may use a subscript to identify the pressure, and gas species are also referred to by subscript. When combined, these subscripts are applied recursively.[4][5]
Examples:
Dalton’s law of partial pressures[edit]
Schematic showing the concept of Dalton’s Law.
Dalton’s law expresses the fact that the total pressure of a mixture of ideal gases is equal to the sum of the partial pressures of the individual gases in the mixture.[6] This equality arises from the fact that in an ideal gas, the molecules are so far apart that they do not interact with each other. Most actual real-world gases come very close to this ideal. For example, given an ideal gas mixture of nitrogen (N2), hydrogen (H2) and ammonia (NH3):
where:
Ideal gas mixtures[edit]
Ideally the ratio of partial pressures equals the ratio of the number of molecules. That is, the mole fraction 
and the partial pressure of an individual gas component in an ideal gas can be obtained using this expression:
| where: | |

|
= mole fraction of any individual gas component in a gas mixture |
|---|---|

|
= partial pressure of any individual gas component in a gas mixture |

|
= moles of any individual gas component in a gas mixture |

|
= total moles of the gas mixture |

|
= total pressure of the gas mixture |
The mole fraction of a gas component in a gas mixture is equal to the volumetric fraction of that component in a gas mixture.[7]
The ratio of partial pressures relies on the following isotherm relation:
- VX is the partial volume of any individual gas component (X)
- Vtot is the total volume of the gas mixture
- pX is the partial pressure of gas X
- ptot is the total pressure of the gas mixture
- nX is the amount of substance of gas (X)
- ntot is the total amount of substance in gas mixture
Partial volume (Amagat’s law of additive volume)[edit]
The partial volume of a particular gas in a mixture is the volume of one component of the gas mixture. It is useful in gas mixtures, e.g. air, to focus on one particular gas component, e.g. oxygen.
It can be approximated both from partial pressure and molar fraction:[8]
- VX is the partial volume of an individual gas component X in the mixture
- Vtot is the total volume of the gas mixture
- pX is the partial pressure of gas X
- ptot is the total pressure of the gas mixture
- nX is the amount of substance of gas X
- ntot is the total amount of substance in the gas mixture
Vapor pressure[edit]
A log-lin vapor pressure chart for various liquids
Vapor pressure is the pressure of a vapor in equilibrium with its non-vapor phases (i.e., liquid or solid). Most often the term is used to describe a liquid’s tendency to evaporate. It is a measure of the tendency of molecules and atoms to escape from a liquid or a solid. A liquid’s atmospheric pressure boiling point corresponds to the temperature at which its vapor pressure is equal to the surrounding atmospheric pressure and it is often called the normal boiling point.
The higher the vapor pressure of a liquid at a given temperature, the lower the normal boiling point of the liquid.
The vapor pressure chart displayed has graphs of the vapor pressures versus temperatures for a variety of liquids.[9] As can be seen in the chart, the liquids with the highest vapor pressures have the lowest normal boiling points.
For example, at any given temperature, methyl chloride has the highest vapor pressure of any of the liquids in the chart. It also has the lowest normal boiling point (−24.2 °C), which is where the vapor pressure curve of methyl chloride (the blue line) intersects the horizontal pressure line of one atmosphere (atm) of absolute vapor pressure. Note that at higher altitudes, the atmospheric pressure is less than that at sea level, so boiling points of liquids are reduced. At the top of Mount Everest, the atmospheric pressure is approximately 0.333 atm, so by using the graph, the boiling point of diethyl ether would be approximately 7.5 °C versus 34.6 °C at sea level (1 atm).
Equilibrium constants of reactions involving gas mixtures[edit]
It is possible to work out the equilibrium constant for a chemical reaction involving a mixture of gases given the partial pressure of each gas and the overall reaction formula. For a reversible reaction involving gas reactants and gas products, such as:
the equilibrium constant of the reaction would be:
| where: | |

|
= the equilibrium constant of the reaction |
|---|---|

|
= coefficient of reactant 
|

|
= coefficient of reactant 
|

|
= coefficient of product 
|

|
= coefficient of product 
|

|
= the partial pressure of  raised to the power of raised to the power of 
|

|
= the partial pressure of  raised to the power of raised to the power of 
|

|
= the partial pressure of  raised to the power of raised to the power of 
|

|
= the partial pressure of  raised to the power of raised to the power of 
|
For reversible reactions, changes in the total pressure, temperature or reactant concentrations will shift the equilibrium so as to favor either the right or left side of the reaction in accordance with Le Chatelier’s Principle. However, the reaction kinetics may either oppose or enhance the equilibrium shift. In some cases, the reaction kinetics may be the overriding factor to consider.
Henry’s law and the solubility of gases[edit]
Gases will dissolve in liquids to an extent that is determined by the equilibrium between the undissolved gas and the gas that has dissolved in the liquid (called the solvent).[10] The equilibrium constant for that equilibrium is:
|
|
(1) |
where:
The form of the equilibrium constant shows that the concentration of a solute gas in a solution is directly proportional to the partial pressure of that gas above the solution. This statement is known as Henry’s law and the equilibrium constant 
Henry’s law is sometimes written as:[13]
|
|
(2) |
where 


Henry’s law is an approximation that only applies for dilute, ideal solutions and for solutions where the liquid solvent does not react chemically with the gas being dissolved.
In diving breathing gases[edit]
In underwater diving the physiological effects of individual component gases of breathing gases are a function of partial pressure.[14]
Using diving terms, partial pressure is calculated as:
- partial pressure = (total absolute pressure) × (volume fraction of gas component)[14]
For the component gas «i»:
- pi = P × Fi[14]
For example, at 50 metres (164 ft) underwater, the total absolute pressure is 6 bar (600 kPa) (i.e., 1 bar of atmospheric pressure + 5 bar of water pressure) and the partial pressures of the main components of air, oxygen 21% by volume and nitrogen approximately 79% by volume are:
- pN2 = 6 bar × 0.79 = 4.7 bar absolute
- pO2 = 6 bar × 0.21 = 1.3 bar absolute
| where: | |
| pi | = partial pressure of gas component i =  in the terms used in this article in the terms used in this article
|
|---|---|
| P | = total pressure =  in the terms used in this article in the terms used in this article
|
| Fi | = volume fraction of gas component i = mole fraction,  , in the terms used in this article , in the terms used in this article
|
| pN2 | = partial pressure of nitrogen =  in the terms used in this article in the terms used in this article
|
| pO2 | = partial pressure of oxygen =  in the terms used in this article in the terms used in this article
|
The minimum safe lower limit for the partial pressures of oxygen in a breathing gas mixture for diving is 0.16 bars (16 kPa) absolute. Hypoxia and sudden unconsciousness can become a problem with an oxygen partial pressure of less than 0.16 bar absolute.[15] Oxygen toxicity, involving convulsions, becomes a problem when oxygen partial pressure is too high. The NOAA Diving Manual recommends a maximum single exposure of 45 minutes at 1.6 bar absolute, of 120 minutes at 1.5 bar absolute, of 150 minutes at 1.4 bar absolute, of 180 minutes at 1.3 bar absolute and of 210 minutes at 1.2 bar absolute. Oxygen toxicity becomes a risk when these oxygen partial pressures and exposures are exceeded. The partial pressure of oxygen also determines the maximum operating depth of a gas mixture.[14]
Narcosis is a problem when breathing gases at high pressure. Typically, the maximum total partial pressure of narcotic gases used when planning for technical diving may be around 4.5 bar absolute, based on an equivalent narcotic depth of 35 metres (115 ft).
The effect of a toxic contaminant such as carbon monoxide in breathing gas is also related to the partial pressure when breathed. A mixture which may be relatively safe at the surface could be dangerously toxic at the maximum depth of a dive, or a tolerable level of carbon dioxide in the breathing loop of a diving rebreather may become intolerable within seconds during descent when the partial pressure rapidly increases, and could lead to panic or incapacitation of the diver.[14]
In medicine[edit]
The partial pressures of particularly oxygen (

| Unit | Arterial blood gas | Venous blood gas | Cerebrospinal fluid | Alveolar pulmonary gas pressures |
|
|---|---|---|---|---|---|
 |
kPa | 11–13[16] | 4.0–5.3[16] | 5.3–5.9[16] | 14.2 |
| mmHg | 75–100[17] | 30–40[18] | 40–44[19] | 107 | |
 |
kPa | 4.7–6.0[16] | 5.5–6.8[16] | 5.9–6.7[16] | 4.8 |
| mmHg | 35–45[17] | 41–51[18] | 44–50[19] | 36 |
See also[edit]
- Breathing gas – Gas used for human respiration
- Henry’s law – Gas law regarding proportionality of dissolved gas
- Ideal gas – Mathematical model which approximates the behavior of real gases
- Ideal gas law – Equation of the state of a hypothetical ideal gas
- Mole fraction – Proportion of a constituent in a mixture
- Mole (unit) – SI unit of amount of substance
- Vapor – Substances in the gas phase at a temperature lower than its critical point
References[edit]
- ^ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ «Gas Pressure and Respiration». Lumen Learning.
- ^ Gas blending
- ^ Staff. «Symbols and Units» (PDF). Respiratory Physiology & Neurobiology : Guide for Authors. Elsevier. p. 1. Archived (PDF) from the original on 2015-07-23. Retrieved 3 June 2017.
All symbols referring to gas species are in subscript,
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «pressure, p«. doi:10.1351/goldbook.P04819
- ^ Dalton’s Law of Partial Pressures
- ^ Frostberg State University’s «General Chemistry Online»
- ^ Page 200 in: Medical biophysics. Flemming Cornelius. 6th Edition, 2008.
- ^ Perry, R.H.; Green, D.W., eds. (1997). Perry’s Chemical Engineers’ Handbook (7th ed.). McGraw-Hill. ISBN 978-0-07-049841-9.
- ^ a b An extensive list of Henry’s law constants, and a conversion tool
- ^ Francis L. Smith & Allan H. Harvey (September 2007). «Avoid Common Pitfalls When Using Henry’s Law». CEP (Chemical Engineering Progress). ISSN 0360-7275.
- ^ Introductory University Chemistry, Henry’s Law and the Solubility of Gases Archived 2012-05-04 at the Wayback Machine
- ^ a b «University of Arizona chemistry class notes». Archived from the original on 2012-03-07. Retrieved 2006-05-26.
- ^ a b c d e NOAA Diving Program (U.S.) (December 1979). Miller, James W. (ed.). NOAA Diving Manual, Diving for Science and Technology (2nd ed.). Silver Spring, Maryland: US Department of Commerce: National Oceanic and Atmospheric Administration, Office of Ocean Engineering.
- ^ Sawatzky, David (August 2008). «3: Oxygen and its affect on the diver». In Mount, Tom; Dituri, Joseph (eds.). Exploration and Mixed Gas Diving Encyclopedia (1st ed.). Miami Shores, Florida: International Association of Nitrox Divers. pp. 41–50. ISBN 978-0-915539-10-9.
- ^ a b c d e f Derived from mmHg values using 0.133322 kPa/mmHg
- ^ a b Normal Reference Range Table Archived 2011-12-25 at the Wayback Machine from The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease.
- ^ a b The Medical Education Division of the Brookside Associates—> ABG (Arterial Blood Gas) Retrieved on Dec 6, 2009
- ^ a b Pathology 425 Cerebrospinal Fluid [CSF] Archived 2012-02-22 at the Wayback Machine at the Department of Pathology and Laboratory Medicine at the University of British Columbia. By Dr. G.P. Bondy. Retrieved November 2011
From Wikipedia, the free encyclopedia
In a mixture of gases, each constituent gas has a partial pressure which is the notional pressure of that constituent gas as if it alone occupied the entire volume of the original mixture at the same temperature.[1] The total pressure of an ideal gas mixture is the sum of the partial pressures of the gases in the mixture (Dalton’s Law).
The partial pressure of a gas is a measure of thermodynamic activity of the gas’s molecules. Gases dissolve, diffuse, and react according to their partial pressures but not according to their concentrations in gas mixtures or liquids. This general property of gases is also true in chemical reactions of gases in biology. For example, the necessary amount of oxygen for human respiration, and the amount that is toxic, is set by the partial pressure of oxygen alone. This is true across a very wide range of different concentrations of oxygen present in various inhaled breathing gases or dissolved in blood;[2] consequently, mixture ratios, like that of breathable 20% oxygen and 80% Nitrogen, are determined by volume instead of by weight or mass.[3] Furthermore, the partial pressures of oxygen and carbon dioxide are important parameters in tests of arterial blood gases. That said, these pressures can also be measured in, for example, cerebrospinal fluid.
Symbol[edit]
The symbol for pressure is usually P or p which may use a subscript to identify the pressure, and gas species are also referred to by subscript. When combined, these subscripts are applied recursively.[4][5]
Examples:
Dalton’s law of partial pressures[edit]
Schematic showing the concept of Dalton’s Law.
Dalton’s law expresses the fact that the total pressure of a mixture of ideal gases is equal to the sum of the partial pressures of the individual gases in the mixture.[6] This equality arises from the fact that in an ideal gas, the molecules are so far apart that they do not interact with each other. Most actual real-world gases come very close to this ideal. For example, given an ideal gas mixture of nitrogen (N2), hydrogen (H2) and ammonia (NH3):
where:
Ideal gas mixtures[edit]
Ideally the ratio of partial pressures equals the ratio of the number of molecules. That is, the mole fraction 
and the partial pressure of an individual gas component in an ideal gas can be obtained using this expression:
| where: | |

|
= mole fraction of any individual gas component in a gas mixture |
|---|---|

|
= partial pressure of any individual gas component in a gas mixture |

|
= moles of any individual gas component in a gas mixture |

|
= total moles of the gas mixture |

|
= total pressure of the gas mixture |
The mole fraction of a gas component in a gas mixture is equal to the volumetric fraction of that component in a gas mixture.[7]
The ratio of partial pressures relies on the following isotherm relation:
- VX is the partial volume of any individual gas component (X)
- Vtot is the total volume of the gas mixture
- pX is the partial pressure of gas X
- ptot is the total pressure of the gas mixture
- nX is the amount of substance of gas (X)
- ntot is the total amount of substance in gas mixture
Partial volume (Amagat’s law of additive volume)[edit]
The partial volume of a particular gas in a mixture is the volume of one component of the gas mixture. It is useful in gas mixtures, e.g. air, to focus on one particular gas component, e.g. oxygen.
It can be approximated both from partial pressure and molar fraction:[8]
- VX is the partial volume of an individual gas component X in the mixture
- Vtot is the total volume of the gas mixture
- pX is the partial pressure of gas X
- ptot is the total pressure of the gas mixture
- nX is the amount of substance of gas X
- ntot is the total amount of substance in the gas mixture
Vapor pressure[edit]
A log-lin vapor pressure chart for various liquids
Vapor pressure is the pressure of a vapor in equilibrium with its non-vapor phases (i.e., liquid or solid). Most often the term is used to describe a liquid’s tendency to evaporate. It is a measure of the tendency of molecules and atoms to escape from a liquid or a solid. A liquid’s atmospheric pressure boiling point corresponds to the temperature at which its vapor pressure is equal to the surrounding atmospheric pressure and it is often called the normal boiling point.
The higher the vapor pressure of a liquid at a given temperature, the lower the normal boiling point of the liquid.
The vapor pressure chart displayed has graphs of the vapor pressures versus temperatures for a variety of liquids.[9] As can be seen in the chart, the liquids with the highest vapor pressures have the lowest normal boiling points.
For example, at any given temperature, methyl chloride has the highest vapor pressure of any of the liquids in the chart. It also has the lowest normal boiling point (−24.2 °C), which is where the vapor pressure curve of methyl chloride (the blue line) intersects the horizontal pressure line of one atmosphere (atm) of absolute vapor pressure. Note that at higher altitudes, the atmospheric pressure is less than that at sea level, so boiling points of liquids are reduced. At the top of Mount Everest, the atmospheric pressure is approximately 0.333 atm, so by using the graph, the boiling point of diethyl ether would be approximately 7.5 °C versus 34.6 °C at sea level (1 atm).
Equilibrium constants of reactions involving gas mixtures[edit]
It is possible to work out the equilibrium constant for a chemical reaction involving a mixture of gases given the partial pressure of each gas and the overall reaction formula. For a reversible reaction involving gas reactants and gas products, such as:
the equilibrium constant of the reaction would be:
| where: | |

|
= the equilibrium constant of the reaction |
|---|---|

|
= coefficient of reactant 
|

|
= coefficient of reactant 
|

|
= coefficient of product 
|

|
= coefficient of product 
|

|
= the partial pressure of  raised to the power of raised to the power of 
|

|
= the partial pressure of  raised to the power of raised to the power of 
|

|
= the partial pressure of  raised to the power of raised to the power of 
|

|
= the partial pressure of  raised to the power of raised to the power of 
|
For reversible reactions, changes in the total pressure, temperature or reactant concentrations will shift the equilibrium so as to favor either the right or left side of the reaction in accordance with Le Chatelier’s Principle. However, the reaction kinetics may either oppose or enhance the equilibrium shift. In some cases, the reaction kinetics may be the overriding factor to consider.
Henry’s law and the solubility of gases[edit]
Gases will dissolve in liquids to an extent that is determined by the equilibrium between the undissolved gas and the gas that has dissolved in the liquid (called the solvent).[10] The equilibrium constant for that equilibrium is:
|
|
(1) |
where:
The form of the equilibrium constant shows that the concentration of a solute gas in a solution is directly proportional to the partial pressure of that gas above the solution. This statement is known as Henry’s law and the equilibrium constant 
Henry’s law is sometimes written as:[13]
|
|
(2) |
where 


Henry’s law is an approximation that only applies for dilute, ideal solutions and for solutions where the liquid solvent does not react chemically with the gas being dissolved.
In diving breathing gases[edit]
In underwater diving the physiological effects of individual component gases of breathing gases are a function of partial pressure.[14]
Using diving terms, partial pressure is calculated as:
- partial pressure = (total absolute pressure) × (volume fraction of gas component)[14]
For the component gas «i»:
- pi = P × Fi[14]
For example, at 50 metres (164 ft) underwater, the total absolute pressure is 6 bar (600 kPa) (i.e., 1 bar of atmospheric pressure + 5 bar of water pressure) and the partial pressures of the main components of air, oxygen 21% by volume and nitrogen approximately 79% by volume are:
- pN2 = 6 bar × 0.79 = 4.7 bar absolute
- pO2 = 6 bar × 0.21 = 1.3 bar absolute
| where: | |
| pi | = partial pressure of gas component i =  in the terms used in this article in the terms used in this article
|
|---|---|
| P | = total pressure =  in the terms used in this article in the terms used in this article
|
| Fi | = volume fraction of gas component i = mole fraction,  , in the terms used in this article , in the terms used in this article
|
| pN2 | = partial pressure of nitrogen =  in the terms used in this article in the terms used in this article
|
| pO2 | = partial pressure of oxygen =  in the terms used in this article in the terms used in this article
|
The minimum safe lower limit for the partial pressures of oxygen in a breathing gas mixture for diving is 0.16 bars (16 kPa) absolute. Hypoxia and sudden unconsciousness can become a problem with an oxygen partial pressure of less than 0.16 bar absolute.[15] Oxygen toxicity, involving convulsions, becomes a problem when oxygen partial pressure is too high. The NOAA Diving Manual recommends a maximum single exposure of 45 minutes at 1.6 bar absolute, of 120 minutes at 1.5 bar absolute, of 150 minutes at 1.4 bar absolute, of 180 minutes at 1.3 bar absolute and of 210 minutes at 1.2 bar absolute. Oxygen toxicity becomes a risk when these oxygen partial pressures and exposures are exceeded. The partial pressure of oxygen also determines the maximum operating depth of a gas mixture.[14]
Narcosis is a problem when breathing gases at high pressure. Typically, the maximum total partial pressure of narcotic gases used when planning for technical diving may be around 4.5 bar absolute, based on an equivalent narcotic depth of 35 metres (115 ft).
The effect of a toxic contaminant such as carbon monoxide in breathing gas is also related to the partial pressure when breathed. A mixture which may be relatively safe at the surface could be dangerously toxic at the maximum depth of a dive, or a tolerable level of carbon dioxide in the breathing loop of a diving rebreather may become intolerable within seconds during descent when the partial pressure rapidly increases, and could lead to panic or incapacitation of the diver.[14]
In medicine[edit]
The partial pressures of particularly oxygen (

| Unit | Arterial blood gas | Venous blood gas | Cerebrospinal fluid | Alveolar pulmonary gas pressures |
|
|---|---|---|---|---|---|
 |
kPa | 11–13[16] | 4.0–5.3[16] | 5.3–5.9[16] | 14.2 |
| mmHg | 75–100[17] | 30–40[18] | 40–44[19] | 107 | |
 |
kPa | 4.7–6.0[16] | 5.5–6.8[16] | 5.9–6.7[16] | 4.8 |
| mmHg | 35–45[17] | 41–51[18] | 44–50[19] | 36 |
See also[edit]
- Breathing gas – Gas used for human respiration
- Henry’s law – Gas law regarding proportionality of dissolved gas
- Ideal gas – Mathematical model which approximates the behavior of real gases
- Ideal gas law – Equation of the state of a hypothetical ideal gas
- Mole fraction – Proportion of a constituent in a mixture
- Mole (unit) – SI unit of amount of substance
- Vapor – Substances in the gas phase at a temperature lower than its critical point
References[edit]
- ^ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ «Gas Pressure and Respiration». Lumen Learning.
- ^ Gas blending
- ^ Staff. «Symbols and Units» (PDF). Respiratory Physiology & Neurobiology : Guide for Authors. Elsevier. p. 1. Archived (PDF) from the original on 2015-07-23. Retrieved 3 June 2017.
All symbols referring to gas species are in subscript,
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the «Gold Book») (1997). Online corrected version: (2006–) «pressure, p«. doi:10.1351/goldbook.P04819
- ^ Dalton’s Law of Partial Pressures
- ^ Frostberg State University’s «General Chemistry Online»
- ^ Page 200 in: Medical biophysics. Flemming Cornelius. 6th Edition, 2008.
- ^ Perry, R.H.; Green, D.W., eds. (1997). Perry’s Chemical Engineers’ Handbook (7th ed.). McGraw-Hill. ISBN 978-0-07-049841-9.
- ^ a b An extensive list of Henry’s law constants, and a conversion tool
- ^ Francis L. Smith & Allan H. Harvey (September 2007). «Avoid Common Pitfalls When Using Henry’s Law». CEP (Chemical Engineering Progress). ISSN 0360-7275.
- ^ Introductory University Chemistry, Henry’s Law and the Solubility of Gases Archived 2012-05-04 at the Wayback Machine
- ^ a b «University of Arizona chemistry class notes». Archived from the original on 2012-03-07. Retrieved 2006-05-26.
- ^ a b c d e NOAA Diving Program (U.S.) (December 1979). Miller, James W. (ed.). NOAA Diving Manual, Diving for Science and Technology (2nd ed.). Silver Spring, Maryland: US Department of Commerce: National Oceanic and Atmospheric Administration, Office of Ocean Engineering.
- ^ Sawatzky, David (August 2008). «3: Oxygen and its affect on the diver». In Mount, Tom; Dituri, Joseph (eds.). Exploration and Mixed Gas Diving Encyclopedia (1st ed.). Miami Shores, Florida: International Association of Nitrox Divers. pp. 41–50. ISBN 978-0-915539-10-9.
- ^ a b c d e f Derived from mmHg values using 0.133322 kPa/mmHg
- ^ a b Normal Reference Range Table Archived 2011-12-25 at the Wayback Machine from The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease.
- ^ a b The Medical Education Division of the Brookside Associates—> ABG (Arterial Blood Gas) Retrieved on Dec 6, 2009
- ^ a b Pathology 425 Cerebrospinal Fluid [CSF] Archived 2012-02-22 at the Wayback Machine at the Department of Pathology and Laboratory Medicine at the University of British Columbia. By Dr. G.P. Bondy. Retrieved November 2011
Когда мы имеем дело со смесями газов, важно знать, что они имеют такие характеристики, как парциальный объем и парциальное давление. Для начала определим, что такое смесь идеальных газов.
Смесь идеальных газов – это смесь нескольких газообразных веществ, которые при заданных условиях не будут вступать в определенные химические реакции.
При смене условий (например, повышении температуры, понижении давления) газовая смесь все же может вступать во взаимодействие. Важный параметр любой такой смеси – так называемая весовая концентрация gi i-ного газа-компонента.
Здесь:
- N – количество газов, из которых состоит смесь;
- xi i-го газа – молярная концентрация указанного газа в составе смеси;
- νi – количество молей i-го газа, присутствующего в смеси.
Понятие парциального давления
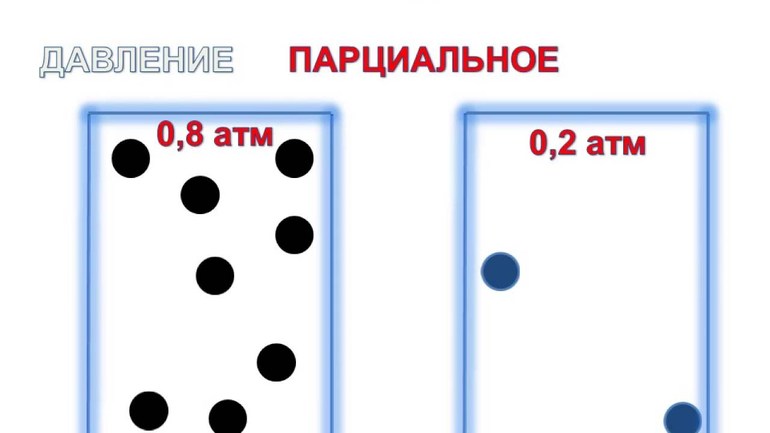
Парциальное давление – это особая характеристика, описывающая состояние компонентов смеси идеальных газов. Сформулируем основное определение:
Парциальным называется давление pi, которое могло бы создаваться i-ым газом в смеси при условии отсутствия остальных газов и сохранения исходного объема и температуры.
Формула парциального давления будет выглядеть так:
pi=miμiRTV=μiRTV
Объем смеси здесь обозначен буквой V, ее температура – T.
Следует подчеркнуть, что поскольку средние кинетические энергии молекул смеси равны, то существует и равенство температур всех компонентов газовой смеси, находящейся в состоянии термодинамического равновесия.
Для нахождения давления смеси идеальных газов нужно воспользоваться законом Дальтона в следующей формулировке:
p=∑i=1Npi=RTV∑i=1Nνi
Исходя из него, мы можем выразить парциальное давление так:
pi=xip.
Понятие парциального объема
У газовой смеси также есть такая характеристика, как парциальный объем.
Парциальный объем Vi i-газа в газовой смеси – это такой объем, который мог бы иметь газ при условии отсутствия всех остальных газов и сохранении исходной температуры и объема.
Если речь идет о смеси идеальных газов, то к ней применим закон Амага:
V=∑i=1NVi
В самом деле, при выражении νi из формулы выше у нас получится следующее:
νi=pViRT; p=RTVpRT∑i=1NVi→V=∑i=1NVi
Для расчета парциального объема газа используется следующая формула:
Vi=xiV.
Нам известно, что параметры, определяющие состояние смеси идеальных газов, будут подчиняться уравнению Менделеева-Клайперона. Формула будет выглядеть так:
pV=mμsmRT.
Все параметры данного уравнения будут относиться ко всей смеси. Это же уравнение удобнее записать так:
pV=mRsmT.
Здесь параметры Rsm=Rμsm=R∑i=1Nqiμi означают удельную газовую постоянную смеси.
Условие: имеется сосуд объемом 1 м3, в котором находится 0,10·10-3 кг гелия и 0,5·10-3 кг водорода. Постоянная температура равна 290 К. Вычислите давление смеси и парциальное давление гелия в нем.
Решение
Начнем с вычисления количества молей каждого компонента смеси. Для этого можно использовать формулу:
νi=miμi
Зная, что молярная масса водорода, согласно таблице Менделеева, составляет μH2=2·10-3 кгмоль, мы можем найти количество его молей в смеси по формуле:
νH2=mH2μH2
Считаем, что получится:
νH2=0,5·10-32·10-3=0,25 (моль).
Точно такие же расчеты проводим и для гелия, зная, что μHe=4·10-3 кгмоль:
Теперь с помощью уравнения Менделеева-Клайперона можно найти парциальное давление каждого компонента:
piV=νiRT.
Сначала рассчитаем давление водорода:
pH2V=νH2RT→pH2=νH2RTV
Парциальное давление будет равно:
pH2=0,25·8,31·2901=602,5 (Па).
Теперь то же самое подсчитываем для гелия:
pHe=0,025·8,31·2901=60,25 (Па).
Чтобы найти общее давление смеси газов, сложим сумму давлений ее составляющих:
p=pH2+pHe
Подставляем полученные ранее значения и находим нужный результат:
p=602,5+60,25=662,75 (Па).
Ответ: общее давление смеси составляет 662,75 Па, а парциальное давление гелия в смеси равно 60,25 Па.
Условие: дана смесь газов, состоящая из 1 кг углекислого газа и 0,5 кг O2. Если считать их идеальными, какой объем они будут занимать при давлении в 1 атм? Температура смеси равна 300К.
Решение
Начнем с вычисления общей массы газовой смеси.
m=mO2+mCO2
Значит, m=1+0,5=1,5.
Переходим к вычислению массовых компонентов смеси:
gO2=0,51,5=0,33;gCO2=11,5=0,67.
Тогда газовая постоянная смеси будет равна:
Rsm=R∑i=1Ngiμi
Rsm=8,310,3332·10-3+0,6746·10-3=200 ДжкгК.
Объем смеси вычисляем с помощью уравнения Менделеева-Клайперона:
Vsm=msmRsmTsmpsm
Вспомнив, что по условию давление равно 1 атм, что равно105 Па, вычислим объем:
Vsm=1,5·200·300105=0,9 м3.
Ответ: при указанных условиях смесь займет объем, равный 0,9 м3.
Смесям идеальных газов характерно свойство аддитивности двух показателей: парциального давления и объёма. Другими словами, любому включённому в смесь инертному газу характерно такое поведение, какое было бы, если б он в единственном числе заполнял предлагаемый объём. Для лучшего понимания разумно разобраться, что выражают указанные величины.
Определения
Давление – действующая на единицу поверхности сила, прямопропорциональная числу и скоростью сталкивающихся с этой поверхностью молекул, зависящей от температуры.
Парциальное давление – давление, оказываемое компонентом газовой смеси, при условии удаления других компонентов из занимаемого объёма, сохраняя этот объём и текущую температуру.
Объём – ограниченное чертой трёхмерное пространство, вмещающее вещество и отображающее его форму.
Парциальный объём – объём, занимаемый компонентом газовой смеси, при условии удаления других компонентов из занимаемого объёма, сохраняя первоначальное давление и температуру.
Идеальный газ – научная модель для познания газов, не учитывающая силу молекулярного взаимодействия.
Смесь идеальных газов – это совокупность газов, каждый из которого, находясь в смеси, при сохранении заданных условий, не вступает в химическую реакцию с остальными компонентами.
Говоря об идеальных газах и их смеси, следует понимать, что изменение условий, например температуры или давления, всё же может спровоцировать химическую реакцию. Важным параметром такой смеси является молярная (весовая) концентрация газового компонента. Данная величина измеряется в мг/м3 и показывает количество конкретного компонента в единице объёма газовой смеси.
Парциальное давление
Описывая характеристику состояния компонентов идеальной смеси газообразных веществ, парциальное давление, создаваемое i-ым газом в случае удаления других компонентов из сохраняемых условий, является показателем pi.
Формула
Формула парционального давления:
[p i=frac{m_{i}}{mu_{i}} frac{R T}{V}=mu_{i} frac{R T}{V}]
Где V– объём смеси, R = 8,31
Дж/моль*K– универсальная газовая постоянная, а T –
температура.
Следует отметить, что равность средней кинетической энергии находящихся в смеси молекул определяет равенство температур всех компонентов термодинамически уравновешенной газовой смеси. Найти общее давление смеси идеальных газов представляется возможным через закон Дальтона, отражаемый аддитивность парциальных давлений, а именно [p=sum p_{i}].
Пользуясь данным законом, найдём давление смеси идеальных газов через следующую формулировку: [p=sum_{i}^{N}=1 rightarrow p_{i}=frac{R T}{V} sum_{i}^{N}=1^{v_{i}}], где N – количество вошедших в смесь газов, vi– количественный показатель молей i-го газа. Отсюда парциальное давление можно выразить формулой [p_{i}=x_{i} p], где xi – молярная концентрация i-го газа.
Понятие парциального объёма
Описывая характеристику состояния компонентов идеальной смеси газообразных веществ, парциальный объём, занимаемый i-ым газом в случае удаления других компонентов из сохраняемых условий, является показателем Vi. Аддитивность парциального объёма определяет закон Амага, выраженный формулой [V=sum_{i}^{N}=1 V_{i}].
Формула
Пользуясь данным законом, можно вывести формулу нахождения парциального объёма через следующую формулировку:
[v_{i}=frac{p^{V_{i}}}{R T}]; [p=frac{R T}{V} frac{p}{R T} sum_{i}^{N}=mathbf{1}^{V}_{i}] , отсюда
следует, что — [boldsymbol{V=sum_{i}^{N}=1^{V_{i}}}, text{ а } boldsymbol{V_{i}=x_{i} V}].
Зная, что характеризующие состояние смеси инертных газов показатели подчиняются уравнению Менделеева-Клапейрона, выведем формулу:
[p V=frac{m}{mu_{s m}} R T] данное уравнение свои параметры относит ко всей газовой смеси.
[pV=mR_{s m} T] такой вариант уравнения содержит показатель Rsm, обозначающий удельную газовую составляющую смеси.
Уравнение Менделеева-Клапейрона показывает возможность изменения трёх характеризующих состояние идеального газа параметров.
Нет времени решать самому?
Наши эксперты помогут!
Примеры вычисления парциального давления и объёма
Задача №1
Условие: в сосуде объёмом 2 м3, при постоянной температуре 290 К находится 0,20*10-3 кг гелия и 1*10-3 кг водорода. Необходимо вычислить давление смеси и парциальное давление гелия.
Решение.
Сначала вычислим количество молей каждого компонента, используя следующую формулу:
[mathrm{v}{mathrm{i}}=frac{mathrm{m}{mathrm{i}}}{mu_{mathrm{i}}}]
Для расчёта количество молей водорода в смеси нам понадобится его молярная масса, которую возьмём из таблицы Менделеева:
[mu_{mathrm{H}_{2}}=2 * 10^{-3} frac{mathrm{кг}}{text { моль }}]
Теперь можно найти количество молей водорода в смеси:
[mathrm{v}_{mathrm{H}_{2}}=frac{mathrm{m}_{mathrm{H}_{2}}}{mu_{mathrm{H}_{2}}}=frac{1 * 10^{-3}}{2 * 10^{-3}}=0,5 text { (моль) }]
Зная молярную массу гелия из таблицы Менделеева, рассчитаем количество молей гелия в смеси:
[mathrm{v}_{mathrm{He}}=frac{mathrm{m}_{mathrm{He}}}{mu_{mathrm{He}}}=frac{4 * 10^{-3}}{20 * 10^{-3}}=0,2 text { (моль) }]
Теперь можно найти парциальное давление каждого из компонентов с помощью уравнения Менделеева-Клапейрона:
[mathrm{p}_{mathrm{i}} mathrm{V}=mathrm{v}_{mathrm{i}} mathrm{RT}]
Сначала нужно рассчитать давление водорода:
[mathrm{p}_{mathrm{H}_{2}} mathrm{~V}=mathrm{v}_{mathrm{H}_{2}} mathrm{RT} rightarrow mathrm{p}_{mathrm{H}_{2}}=frac{mathrm{v}_{mathrm{H}_{2}} mathrm{RT}}{mathrm{V}}=frac{0,5 * 8,31 * 290}{1}=1205 text { (Па) }]
Рассчитаем парциальное давление гелия:
[mathrm{p}_{mathrm{He}}=frac{mathrm{v}_{mathrm{He}} mathrm{RT}}{mathrm{V}}=frac{0,2 * 8,31 * 290}{1}=482 text { (Па) }]
Теперь найдём полное давление газовой смеси, сложив значения компонентов:
[mathrm{p}=mathrm{p}_{mathrm{H}_{2+}} mathrm{p}_{mathrm{H}}=1205+482=1687 text { Па }]
Ответ: парциальное давление гелия равно 482 Па, а общее давление 1205 Па.
Задача №2
Условие: идеальная газовая смесь состоит из 0,5 кг углекислого газа и 0,25 кг кислорода, какой объём они займут, если давление равно 1 атм, а температура смеси равна 300 К?
Решение.
Найдём суммарную массу газовой смеси:
[mathrm{m}=mathrm{m}_{mathrm{O}_{2}}+mathrm{m}_{mathrm{CO}_{2}}=0,5+0,25=0,75 text { (кг) }]
Вычислим массовые компоненты смеси:
[g_{mathrm{O}_{2}}=frac{0,25}{0,75}=0,33] [mathrm{g}_{mathrm{CO}_{2}}=frac{0,5}{0,75}=0,67]
Тогда газовая постоянная смеси равняется:
[mathrm{R}_{mathrm{sm}}=mathrm{R} sum_{mathrm{i}=1}^{mathrm{N}} frac{mathrm{g}_{mathrm{i}}}{mu_{mathrm{i}}}=8,31left(frac{0,33}{32 * 10^{-3}}+frac{0,67}{46 * 10^{-3}}right)=200left(frac{text { Дж }}{text { кгК }}right)]
Пользуясь уравнением Менделеева-Клапейрона, и, зная, что 1 атм равна 105 Па,вычислим объём смеси:
[mathrm{V}_{mathrm{sm}}=frac{mathrm{m}_{mathrm{sm}} mathrm{R}_{mathrm{sm}} mathrm{T}_{mathrm{sm}}}{mathrm{P}_{mathrm{sm}}}=frac{0,75 * 200 * 300}{10^{5}}=0,45left(mathrm{м}^{3}right)]
Ответ: при заданных условиях смесь займёт 0,45 м3.
Навык определения парциальных давлений и объёма актуален в машиностроении, энергетике и других промышленностях, связанных с использованием тепловых двигателей, приводимых в действие парами высокой температуры.
Парциа́льное давление (лат. partialis — частичный, от лат. pars — часть) — давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.[1] Общее давление газовой смеси является суммой парциальных давлений каждого газа в смеси.
В химии парциальное давление газа в смеси газов определяется как указано выше. Парциальное давление газа, растворённого в жидкости, является парциальным давлением того газа, который образовался бы в фазе газообразования в состоянии равновесия с жидкостью при той же температуре. Парциальное давление газа измеряется как термодинамическая активность молекул газа. Газы всегда будут вытекать из области с высоким парциальным давлением в область с более низким давлением; и чем больше разница, тем быстрее будет поток. Газы растворяются, диффузируют и реагируют соответственно их парциальному давлению и не обязательно зависимы от концентрации в газовой смеси.
Законы Дальтона парциального давления
-
Основная статья: Законы Дальтона
Парциальное давление идеального газа в смеси равно давлению, которое будет оказываться, если он занимает тот же объём при той же температуре. Причина этого в том, что молекулы идеального газа настолько далеки одна от другой, что они не мешают друг другу. Реально существующие газы очень близко подходят к этому идеалу. Следствием этого является то, что общее давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси, как это формулирует закон Дальтона.[2] Например, дана смесь идеального газа из азота (N2), водорода (H2) и аммиака (NH3):
, где:
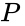



Смеси идеальных газов
Мольная доля отдельных компонентов газа в идеальной газовой смеси может быть выражена в пределах парциальных давлений компонентов или молей компонентов:
и парциальное давление отдельных компонентов газов в идеальном газе может быть получено используя следующее выражение:
, где:



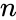
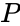
Мольная доля компонентов газа в газовой смеси равна объёмной доле этого компонента в газовой смеси.[3]
См. также
- Пар
- Газ, Идеальный газ и Уравнение состояния идеального газа
- Мольная доля и Моль
- Законы Дальтона
- Закон Генри
Примечания
- ↑ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN 0-764-57419-1.
- ↑ Dalton’s Law of Partial Pressures
- ↑ Pittsburgh University chemical engineering class notes
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Парциальное давление. Список первоначальных авторов статьи можно посмотреть в истории правок. Так же, как и в этом проекте, тексты, размещённые в Википедии, доступны на условиях GNU FDL.


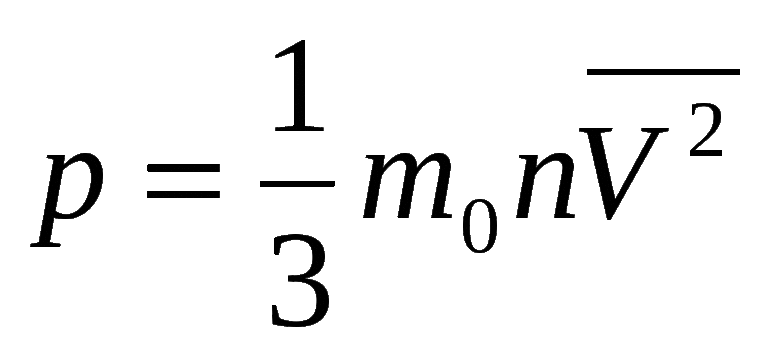














 , где:
, где:
 , где:
, где: