Фтороводородная кислота — неорганическое вещество, одноосновная кислота, раствор 
Свойства
Соединение — прозрачная жидкость, без цвета, с резким запахом. Не горит, но очень токсично для человека и окружающей среды. С химической точки зрения это кислота средней силы. Она вступает в реакции с большинством металлов, образуя соли — фториды. Соли щелочных металлов водорастворимы, а щелочно-земельных — плохо растворимы или вообще нерастворимы. Реактив любой концентрации не растворяет свинец, платину, палладий, золото, не реагирует с парафином, полиэтиленом, фторопластом и другими пластмассами, каучуковыми материалами. Кислота, содержащая более 60% HF, не взаимодействует с железом.
Важная особенность фтористоводородной кислоты — она единственная реагирует с оксидом кремния, который составляет основу всех силикатных материалов, в том числе, стекла. Поэтому ее нельзя наливать в стеклянные сосуды.
У фтороводородной кислоты есть еще одно интересное свойство — вода с добавлением даже небольшого количества этого реактива замерзает при более низких температурах.
Меры безопасности

Фтористоводородная кислота раздражающе действует на органы дыхания, глаза, оказывает легкое наркотическое действие, обладает способностью повреждать ДНК и усиливать воздействие других неблагоприятных факторов. Она относится ко 2-му классу опасности (газообразный фтороводород — к первому). Работать с плавиковой кислотой необходимо только в респираторе, в очках, плотно прилегающих к коже, в защитной одежде и резиновых перчатках, в вытяжном шкафу. При ликвидации проливов рекомендуется использовать противогазы с автономным источником воздуха. Пострадавших от отравления следует срочно доставить в больницу, предварительно промыв место попадания реактива большим количеством воды и обработав гелем 2,5-процентного глюконата кальция. В больнице в качестве антидота обычно используют внутриартериальные вливания хлорида кальция.
Хранение и перевозка
Хранят и перевозят плавиковую кислоту в пластиковых (полиэтиленовых, 
Применение
Фтористоводородная кислота выпускается различной концентрации, высокой чистоты и техническая с примесями. Основные сферы ее использования:
— В нефтехимии и горнодобывающей отрасли — для увеличения нефтедобычи и разрушения кремнийсодержащих пород.
— Для выделения некоторых металлов, например, тантала, циркония, ниобия.
— В химической индустрии — как катализатор в некоторых процессах; для производства фторопластов, хладагентов, фторосодержащих кислот, боратов и фторидов, органических соединений на основе фтора, синтетических смазочных масел.
— В стекольном деле с помощью этого хим. реактива выполняют прозрачное травление кремниевого стекла.
— Плавиковая кислота высокой чистоты необходима для очистки и травления кремния для полупроводников.
— В аналитической химии — для растворения силикатов.
— При производстве алюминия и работе с ним.
— Является составной частью жидкостей, использующихся для травления и полировки, для электрохимической обработки сплавов и нержавеющей стали. Применяется также для очистки металлических заготовок от песка.
В нашем магазине по выгодным ценам продается 40% и 70% фтористоводородная кислота, можно купить пластиковые емкости для ее хранения и перевозки.
From Wikipedia, the free encyclopedia

|
||
|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Fluorane[1] |
||
| Other names
Fluorhydric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChemSpider |
|
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
HF (aq) | |
| Appearance | Colorless liquid | |
| Density | 1.15 g/mL (for 48% soln.) | |
| Acidity (pKa) | 3.17[2] | |
| Hazards[3] | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H280, H300, H310, H314, H330 | |
|
Precautionary statements |
P260, P262, P264, P270, P271, P280, P284, P301+P310, P301+P330+P331, P302+P350, P303+P361+P353, P304+P340, P305+P351+P338, P310, P320, P321, P322, P330, P361, P363, P403+P233, P405, P410+P403, P501 | |
| NFPA 704 (fire diamond) |
4 0 0 ACID |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Hydrofluoric acid is a solution of hydrogen fluoride (HF) in water. Solutions of HF are colourless, acidic and highly corrosive. It is used to make most fluorine-containing compounds; examples include the commonly used pharmaceutical antidepressant medication fluoxetine (Prozac) and the material PTFE (Teflon). Elemental fluorine is produced from it. It is commonly used to etch glass and silicon wafers.
Uses[edit]
Production of organofluorine compounds[edit]
The principal use of hydrofluoric acid is in organofluorine chemistry. Many organofluorine compounds are prepared using HF as the fluorine source, including Teflon, fluoropolymers, fluorocarbons, and refrigerants such as freon. Many pharmaceuticals contain fluorine.[4]
Production of inorganic fluorides[edit]
Most high-volume inorganic fluoride compounds are prepared from hydrofluoric acid. Foremost are Na3AlF6, cryolite, and AlF3, aluminium trifluoride. A molten mixture of these solids serves as a high-temperature solvent for the production of metallic aluminium. Other inorganic fluorides prepared from hydrofluoric acid include sodium fluoride and uranium hexafluoride.[4]
Etchant, cleaner[edit]
It is used in the semiconductor industry as a major component of Wright etch and buffered oxide etch, which are used to clean silicon wafers. In a similar manner it is also used to etch glass by treatment with silicon dioxide to form gaseous or water-soluble silicon fluorides. It can also be used to polish and frost glass.[5]
- SiO2 + 4 HF → SiF4(g) + 2 H2O
- SiO2 + 6 HF → H2SiF6 + 2 H2O
A 5% to 9% hydrofluoric acid gel is also commonly used to etch all ceramic dental restorations to improve bonding.[6] For similar reasons, dilute hydrofluoric acid is a component of household rust stain remover, in car washes in «wheel cleaner» compounds, in ceramic and fabric rust inhibitors, and in water spot removers.[5][7] Because of its ability to dissolve iron oxides as well as silica-based contaminants, hydrofluoric acid is used in pre-commissioning boilers that produce high-pressure steam. Hydrofluoric acid is also useful for dissolving rock samples (usually powdered) prior to analysis. In similar manner, this acid is used in acid macerations to extract organic fossils from silicate rocks. Fossiliferous rock may be immersed directly into the acid, or a cellulose nitrate film may be applied (dissolved in amyl acetate), which adheres to the organic component and allows the rock to be dissolved around it.[8]
Oil refining[edit]
In a standard oil refinery process known as alkylation, isobutane is alkylated with low-molecular-weight alkenes (primarily a mixture of propylene and butylene) in the presence of an acid catalyst derived from hydrofluoric acid. The catalyst protonates the alkenes (propylene, butylene) to produce reactive carbocations, which alkylate isobutane. The reaction is carried out at mild temperatures (0 and 30 °C) in a two-phase reaction.
Production[edit]
Hydrofluoric acid was first prepared in 1771, by Carl Wilhelm Scheele.[9] It is now mainly produced by treatment of the mineral fluorite, CaF2, with concentrated sulfuric acid at approximately 265 °C.
- CaF2 + H2SO4 → 2 HF + CaSO4
The acid is also a by-product of the production of phosphoric acid from apatite and fluoroapatite. Digestion of the mineral with sulfuric acid at elevated temperatures releases a mixture of gases, including hydrogen fluoride, which may be recovered.[4]
Because of its high reactivity toward glass, hydrofluoric acid is stored in fluorinated plastic (often PTFE) containers.[4][5]
Properties[edit]
In dilute aqueous solution hydrogen fluoride behaves as a weak acid,[10]
Infrared spectroscopy has been used to show that, in solution, dissociation is accompanied by formation of the ion pair H3O+·F−.[11]
[12]
- H2O + HF ⇌ H3O+⋅F− pKa = 3.17
This ion pair has been characterized in the crystalline state at very low temperature.[13]
Further association has been characterized both in solution and in the solid state.[citation needed]
- HF + F− ⇌ HF−
2 log K = 0.6
It is assumed that polymerization occurs as the concentration increases. This assumption is supported by the isolation of a salt of a tetrameric anion H
3F−
4[14] and by low-temperature X-ray crystallography.[13] The species that are present in concentrated aqueous solutions of hydrogen fluoride have not all been characterized; in addition to HF−
2 which is known[11] the formation of other polymeric species, H
n−1F−
n, is highly likely.
The Hammett acidity function, H0, for 100% HF is estimated to be between −10.2 and −11,[15] which is comparable to the value −12 for sulfuric acid.[16][17]
Acidity[edit]
Unlike other hydrohalic acids, such as hydrochloric acid, hydrogen fluoride is only a weak acid in dilute aqueous solution.[18] This is in part a result of the strength of the hydrogen–fluorine bond, but also of other factors such as the tendency of HF, H
2O, and F−
anions to form clusters.[19] At high concentrations, HF molecules undergo homoassociation to form polyatomic ions (such as bifluoride, HF−
2) and protons, thus greatly increasing the acidity.[20] This leads to protonation of very strong acids like hydrochloric, sulfuric, or nitric when using concentrated hydrofluoric acid solutions.[21] Although hydrofluoric acid is regarded as a weak acid, it is very corrosive, even attacking glass when hydrated.[20]
The acidity of hydrofluoric acid solutions varies with concentration owing to hydrogen-bond interactions of the fluoride ion. Dilute solutions are weakly acidic with an acid ionization constant Ka = 6.6×10−4 (or pKa = 3.18),[10] in contrast to corresponding solutions of the other hydrogen halides, which are strong acids (pKa < 0). Concentrated solutions of hydrogen fluoride are much more strongly acidic than implied by this value, as shown by measurements of the Hammett acidity function H0[15](or «effective pH»). The H0 for 100% HF is estimated to be between −10.2 and −11, comparable to the value −12 for sulfuric acid.[16][17]
In thermodynamic terms, HF solutions are highly non-ideal, with the activity of HF increasing much more rapidly than its concentration.
The weak acidity in dilute solution is sometimes attributed to the high H—F bond strength, which combines with the high dissolution enthalpy of HF to outweigh the more negative enthalpy of hydration of the fluoride ion.[22] Paul Giguère and Sylvia Turrell[11][12] have shown by infrared spectroscopy that the predominant solute species in dilute solution is the hydrogen-bonded ion pair H3O+·F−.[23]
- H2O + HF ⇌ H3O+⋅F−
With increasing concentration of HF the concentration of the hydrogen difluoride ion also increases.[11] The reaction
- 3 HF ⇌ HF−
2 + H2F+
is an example of homoconjugation.
Health and safety[edit]
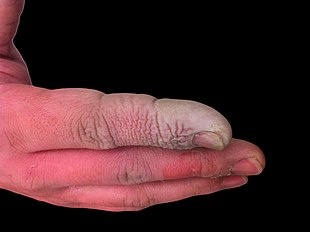
A hydrofluoric acid burn of the hand
In addition to being a highly corrosive liquid, hydrofluoric acid is also a powerful contact poison. Because of the ability of hydrofluoric acid to penetrate tissue, poisoning can occur readily through exposure of skin or eyes, or when inhaled or swallowed. Symptoms of exposure to hydrofluoric acid may not be immediately evident, and this can provide false reassurance to victims, causing them to delay medical treatment.[24] Despite having an irritating odor, HF may reach dangerous levels without an obvious odor.[5] HF interferes with nerve function, meaning that burns may not initially be painful. Accidental exposures can go unnoticed, delaying treatment and increasing the extent and seriousness of the injury.[24] Symptoms of HF exposure include irritation of the eyes, skin, nose, and throat, eye and skin burns, rhinitis, bronchitis, pulmonary edema (fluid buildup in the lungs), and bone damage.[25]
In the event of a hydrofluoric burn, it is recommended to wash with excess water and treat as a first measure with a calcium gluconate gel (which must be available in all places where this substance is stored or handled). Failing that, use a solution of calcium lactate or calcium citrate or, failing that also, with milk. It also must be considered a medical emergency in case of aspiration of vapors. In this case, it must be treated by applying oxygen through a mask. If necessary, resuscitation of the affected person should be applied. In case of splashes in the eyes, only treat with a very abundant sterile physiological solution; like in the breathing case, substances based on calcium compounds are discouraged due to their irritating properties.
In absolutely all cases, it should be treated in an advanced medical manner after first aid has been rendered.
The proprietary decontamination solution Hexafluorine has demonstrated greater effectiveness in treating hydrofluoric burns of the eye than water irrigation or calcium gluconate.[26][27]
See also[edit]
- Vapour phase decomposition
- 2019 Philadelphia Energy Solutions refinery explosion
References[edit]
- ^ Favre, Henri A.; Powell, Warren H., eds. (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Cambridge: The Royal Society of Chemistry. p. 131. ISBN 9781849733069.
- ^ Harris, Daniel C. (2010). Quantitative Chemical Analysis (8th international ed.). New York: W. H. Freeman. pp. AP14. ISBN 978-1429263092.
- ^ «Hydrofluoric Acid». PubChem. National Institute of Health. Retrieved October 12, 2017.
- ^ a b c d Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, René; Cuer, Jean Pierre (2000). «Fluorine Compounds, Inorganic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_307.
- ^ a b c d «CDC – The Emergency Response Safety and Health Database: Systemic Agent: HYDROGEN FLUORIDE/ HYDROFLUORIC ACID – NIOSH». www.cdc.gov. Retrieved 2015-12-04.
- ^ Craig, Robert (2006). Craig’s restorative dental materials. St. Louis, Mo: Mosby Elsevier. ISBN 0-323-03606-6. OCLC 68207297.
- ^ Strachan, John (January 1999). «A deadly rinse: The dangers of hydrofluoric acid». Professional Carwashing & Detailing. 23 (1). Archived from the original on April 25, 2012.
- ^ Edwards, D. (1982). «Fragmentary non-vascular plant microfossils from the late Silurian of Wales». Botanical Journal of the Linnean Society. 84 (3): 223–256. doi:10.1111/j.1095-8339.1982.tb00536.x.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 921. ISBN 978-0-08-022057-4.
- ^ a b Ralph H. Petrucci; William S. Harwood; Jeffry D. Madura (2007). General chemistry: principles and modern applications. Pearson/Prentice Hall. p. 691. ISBN 978-0-13-149330-8. Retrieved 22 August 2011.
- ^ a b c d Giguère, Paul A.; Turrell, Sylvia (1980). «The nature of hydrofluoric acid. A spectroscopic study of the proton-transfer complex H3O+…F−«. J. Am. Chem. Soc. 102 (17): 5473. doi:10.1021/ja00537a008.
- ^ a b Radu Iftimie; Vibin Thomas; Sylvain Plessis; Patrick Marchand; Patrick Ayotte (2008). «Spectral Signatures and Molecular Origin of Acid Dissociation Intermediates». J. Am. Chem. Soc. 130 (18): 5901–7. doi:10.1021/ja077846o. PMID 18386892.
- ^ a b
Mootz, D. (1981). «Crystallochemical Correlate to the Anomaly of Hydrofluoric Acid». Angew. Chem. Int. Ed. Engl. 20 (123): 791. doi:10.1002/anie.198107911. - ^ Bunič, Tina; Tramšek, Melita; Goreshnik, Evgeny; Žemva, Boris (2006). «Barium trihydrogen tetrafluoride of the composition Ba(H3F4)2: The first example of homoleptic HF metal environment». Solid State Sciences. 8 (8): 927–931. Bibcode:2006SSSci…8..927B. doi:10.1016/j.solidstatesciences.2006.02.045.
- ^ a b Hyman, Herbert H.; Kilpatrick, Martin; Katz, Joseph J. (1957). «The Hammett Acidity Function H0 for Hydrofluoric Acid Solutions». Journal of the American Chemical Society. American Chemical Society (ACS). 79 (14): 3668–3671. doi:10.1021/ja01571a016. ISSN 0002-7863.
- ^ a b Jolly, William L. (1991). Modern Inorganic Chemistry. McGraw-Hill. p. 203. ISBN 0-07-032768-8. OCLC 22861992.
- ^ a b Cotton, F. A.; Wilkinson, G. (1988). Advanced Inorganic Chemistry (5th ed.). New York: Wiley. p. 109. ISBN 0-471-84997-9. OCLC 16580057.
- ^ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. p. 425. ISBN 978-0-12-352651-9.
- ^ Clark, Jim (2002). «The acidity of the hydrogen halides». Retrieved 4 September 2011.
- ^ a b Chambers, C.; Holliday, A. K. (1975). Modern inorganic chemistry (An intermediate text) (PDF). The Butterworth Group. pp. 328–329. Archived from the original (PDF) on 2013-03-23.
- ^ Hannan, Henry J. (2010). Course in chemistry for IIT-JEE 2011. Tata McGraw Hill Education Private Limited. pp. 15–22. ISBN 9780070703360.
- ^ C. E. Housecroft and A. G. Sharpe «Inorganic Chemistry» (Pearson Prentice Hall, 2nd ed. 2005), p. 170.
- ^ Cotton & Wilkinson (1988), p. 104
- ^ a b Yamashita M, Yamashita M, Suzuki M, Hirai H, Kajigaya H (2001). «Ionophoretic delivery of calcium for experimental hydrofluoric acid burns». Crit. Care Med. 29 (8): 1575–8. doi:10.1097/00003246-200108000-00013. PMID 11505130. S2CID 45595073.
- ^ «CDC – NIOSH Pocket Guide to Chemical Hazards – Hydrogen fluoride». www.cdc.gov. Retrieved 2015-11-28.
- ^ Atley K, Ridyard E (2015). «Treatment of hydrofluoric acid exposure to the eye». Int J Ophthalmol. 8 (1): 157–61. doi:10.3980/j.issn.2222-3959.2015.01.28. PMC 4325260. PMID 25709926.
- ^ «The HEXAFLUORINE® solution — PREVOR». Prevor EN. Retrieved 2022-08-18.
External links[edit]
- International Chemical Safety Card 0283
- NIOSH Pocket Guide to Chemical Hazards
- CID 14917 from PubChem (HF)
- CID 144681 from PubChem (5HF)
- CID 141165 from PubChem (6HF)
- CID 144682 from PubChem (7HF)
- «Hydrofluoric Acid Burn», The New England Journal of Medicine—Acid burn case study
From Wikipedia, the free encyclopedia

|
||
|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Fluorane[1] |
||
| Other names
Fluorhydric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChemSpider |
|
|
| EC Number |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
HF (aq) | |
| Appearance | Colorless liquid | |
| Density | 1.15 g/mL (for 48% soln.) | |
| Acidity (pKa) | 3.17[2] | |
| Hazards[3] | ||
| GHS labelling: | ||
|
Pictograms |
 
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H280, H300, H310, H314, H330 | |
|
Precautionary statements |
P260, P262, P264, P270, P271, P280, P284, P301+P310, P301+P330+P331, P302+P350, P303+P361+P353, P304+P340, P305+P351+P338, P310, P320, P321, P322, P330, P361, P363, P403+P233, P405, P410+P403, P501 | |
| NFPA 704 (fire diamond) |
4 0 0 ACID |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Hydrofluoric acid is a solution of hydrogen fluoride (HF) in water. Solutions of HF are colourless, acidic and highly corrosive. It is used to make most fluorine-containing compounds; examples include the commonly used pharmaceutical antidepressant medication fluoxetine (Prozac) and the material PTFE (Teflon). Elemental fluorine is produced from it. It is commonly used to etch glass and silicon wafers.
Uses[edit]
Production of organofluorine compounds[edit]
The principal use of hydrofluoric acid is in organofluorine chemistry. Many organofluorine compounds are prepared using HF as the fluorine source, including Teflon, fluoropolymers, fluorocarbons, and refrigerants such as freon. Many pharmaceuticals contain fluorine.[4]
Production of inorganic fluorides[edit]
Most high-volume inorganic fluoride compounds are prepared from hydrofluoric acid. Foremost are Na3AlF6, cryolite, and AlF3, aluminium trifluoride. A molten mixture of these solids serves as a high-temperature solvent for the production of metallic aluminium. Other inorganic fluorides prepared from hydrofluoric acid include sodium fluoride and uranium hexafluoride.[4]
Etchant, cleaner[edit]
It is used in the semiconductor industry as a major component of Wright etch and buffered oxide etch, which are used to clean silicon wafers. In a similar manner it is also used to etch glass by treatment with silicon dioxide to form gaseous or water-soluble silicon fluorides. It can also be used to polish and frost glass.[5]
- SiO2 + 4 HF → SiF4(g) + 2 H2O
- SiO2 + 6 HF → H2SiF6 + 2 H2O
A 5% to 9% hydrofluoric acid gel is also commonly used to etch all ceramic dental restorations to improve bonding.[6] For similar reasons, dilute hydrofluoric acid is a component of household rust stain remover, in car washes in «wheel cleaner» compounds, in ceramic and fabric rust inhibitors, and in water spot removers.[5][7] Because of its ability to dissolve iron oxides as well as silica-based contaminants, hydrofluoric acid is used in pre-commissioning boilers that produce high-pressure steam. Hydrofluoric acid is also useful for dissolving rock samples (usually powdered) prior to analysis. In similar manner, this acid is used in acid macerations to extract organic fossils from silicate rocks. Fossiliferous rock may be immersed directly into the acid, or a cellulose nitrate film may be applied (dissolved in amyl acetate), which adheres to the organic component and allows the rock to be dissolved around it.[8]
Oil refining[edit]
In a standard oil refinery process known as alkylation, isobutane is alkylated with low-molecular-weight alkenes (primarily a mixture of propylene and butylene) in the presence of an acid catalyst derived from hydrofluoric acid. The catalyst protonates the alkenes (propylene, butylene) to produce reactive carbocations, which alkylate isobutane. The reaction is carried out at mild temperatures (0 and 30 °C) in a two-phase reaction.
Production[edit]
Hydrofluoric acid was first prepared in 1771, by Carl Wilhelm Scheele.[9] It is now mainly produced by treatment of the mineral fluorite, CaF2, with concentrated sulfuric acid at approximately 265 °C.
- CaF2 + H2SO4 → 2 HF + CaSO4
The acid is also a by-product of the production of phosphoric acid from apatite and fluoroapatite. Digestion of the mineral with sulfuric acid at elevated temperatures releases a mixture of gases, including hydrogen fluoride, which may be recovered.[4]
Because of its high reactivity toward glass, hydrofluoric acid is stored in fluorinated plastic (often PTFE) containers.[4][5]
Properties[edit]
In dilute aqueous solution hydrogen fluoride behaves as a weak acid,[10]
Infrared spectroscopy has been used to show that, in solution, dissociation is accompanied by formation of the ion pair H3O+·F−.[11]
[12]
- H2O + HF ⇌ H3O+⋅F− pKa = 3.17
This ion pair has been characterized in the crystalline state at very low temperature.[13]
Further association has been characterized both in solution and in the solid state.[citation needed]
- HF + F− ⇌ HF−
2 log K = 0.6
It is assumed that polymerization occurs as the concentration increases. This assumption is supported by the isolation of a salt of a tetrameric anion H
3F−
4[14] and by low-temperature X-ray crystallography.[13] The species that are present in concentrated aqueous solutions of hydrogen fluoride have not all been characterized; in addition to HF−
2 which is known[11] the formation of other polymeric species, H
n−1F−
n, is highly likely.
The Hammett acidity function, H0, for 100% HF is estimated to be between −10.2 and −11,[15] which is comparable to the value −12 for sulfuric acid.[16][17]
Acidity[edit]
Unlike other hydrohalic acids, such as hydrochloric acid, hydrogen fluoride is only a weak acid in dilute aqueous solution.[18] This is in part a result of the strength of the hydrogen–fluorine bond, but also of other factors such as the tendency of HF, H
2O, and F−
anions to form clusters.[19] At high concentrations, HF molecules undergo homoassociation to form polyatomic ions (such as bifluoride, HF−
2) and protons, thus greatly increasing the acidity.[20] This leads to protonation of very strong acids like hydrochloric, sulfuric, or nitric when using concentrated hydrofluoric acid solutions.[21] Although hydrofluoric acid is regarded as a weak acid, it is very corrosive, even attacking glass when hydrated.[20]
The acidity of hydrofluoric acid solutions varies with concentration owing to hydrogen-bond interactions of the fluoride ion. Dilute solutions are weakly acidic with an acid ionization constant Ka = 6.6×10−4 (or pKa = 3.18),[10] in contrast to corresponding solutions of the other hydrogen halides, which are strong acids (pKa < 0). Concentrated solutions of hydrogen fluoride are much more strongly acidic than implied by this value, as shown by measurements of the Hammett acidity function H0[15](or «effective pH»). The H0 for 100% HF is estimated to be between −10.2 and −11, comparable to the value −12 for sulfuric acid.[16][17]
In thermodynamic terms, HF solutions are highly non-ideal, with the activity of HF increasing much more rapidly than its concentration.
The weak acidity in dilute solution is sometimes attributed to the high H—F bond strength, which combines with the high dissolution enthalpy of HF to outweigh the more negative enthalpy of hydration of the fluoride ion.[22] Paul Giguère and Sylvia Turrell[11][12] have shown by infrared spectroscopy that the predominant solute species in dilute solution is the hydrogen-bonded ion pair H3O+·F−.[23]
- H2O + HF ⇌ H3O+⋅F−
With increasing concentration of HF the concentration of the hydrogen difluoride ion also increases.[11] The reaction
- 3 HF ⇌ HF−
2 + H2F+
is an example of homoconjugation.
Health and safety[edit]
A hydrofluoric acid burn of the hand
In addition to being a highly corrosive liquid, hydrofluoric acid is also a powerful contact poison. Because of the ability of hydrofluoric acid to penetrate tissue, poisoning can occur readily through exposure of skin or eyes, or when inhaled or swallowed. Symptoms of exposure to hydrofluoric acid may not be immediately evident, and this can provide false reassurance to victims, causing them to delay medical treatment.[24] Despite having an irritating odor, HF may reach dangerous levels without an obvious odor.[5] HF interferes with nerve function, meaning that burns may not initially be painful. Accidental exposures can go unnoticed, delaying treatment and increasing the extent and seriousness of the injury.[24] Symptoms of HF exposure include irritation of the eyes, skin, nose, and throat, eye and skin burns, rhinitis, bronchitis, pulmonary edema (fluid buildup in the lungs), and bone damage.[25]
In the event of a hydrofluoric burn, it is recommended to wash with excess water and treat as a first measure with a calcium gluconate gel (which must be available in all places where this substance is stored or handled). Failing that, use a solution of calcium lactate or calcium citrate or, failing that also, with milk. It also must be considered a medical emergency in case of aspiration of vapors. In this case, it must be treated by applying oxygen through a mask. If necessary, resuscitation of the affected person should be applied. In case of splashes in the eyes, only treat with a very abundant sterile physiological solution; like in the breathing case, substances based on calcium compounds are discouraged due to their irritating properties.
In absolutely all cases, it should be treated in an advanced medical manner after first aid has been rendered.
The proprietary decontamination solution Hexafluorine has demonstrated greater effectiveness in treating hydrofluoric burns of the eye than water irrigation or calcium gluconate.[26][27]
See also[edit]
- Vapour phase decomposition
- 2019 Philadelphia Energy Solutions refinery explosion
References[edit]
- ^ Favre, Henri A.; Powell, Warren H., eds. (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Cambridge: The Royal Society of Chemistry. p. 131. ISBN 9781849733069.
- ^ Harris, Daniel C. (2010). Quantitative Chemical Analysis (8th international ed.). New York: W. H. Freeman. pp. AP14. ISBN 978-1429263092.
- ^ «Hydrofluoric Acid». PubChem. National Institute of Health. Retrieved October 12, 2017.
- ^ a b c d Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, René; Cuer, Jean Pierre (2000). «Fluorine Compounds, Inorganic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_307.
- ^ a b c d «CDC – The Emergency Response Safety and Health Database: Systemic Agent: HYDROGEN FLUORIDE/ HYDROFLUORIC ACID – NIOSH». www.cdc.gov. Retrieved 2015-12-04.
- ^ Craig, Robert (2006). Craig’s restorative dental materials. St. Louis, Mo: Mosby Elsevier. ISBN 0-323-03606-6. OCLC 68207297.
- ^ Strachan, John (January 1999). «A deadly rinse: The dangers of hydrofluoric acid». Professional Carwashing & Detailing. 23 (1). Archived from the original on April 25, 2012.
- ^ Edwards, D. (1982). «Fragmentary non-vascular plant microfossils from the late Silurian of Wales». Botanical Journal of the Linnean Society. 84 (3): 223–256. doi:10.1111/j.1095-8339.1982.tb00536.x.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 921. ISBN 978-0-08-022057-4.
- ^ a b Ralph H. Petrucci; William S. Harwood; Jeffry D. Madura (2007). General chemistry: principles and modern applications. Pearson/Prentice Hall. p. 691. ISBN 978-0-13-149330-8. Retrieved 22 August 2011.
- ^ a b c d Giguère, Paul A.; Turrell, Sylvia (1980). «The nature of hydrofluoric acid. A spectroscopic study of the proton-transfer complex H3O+…F−«. J. Am. Chem. Soc. 102 (17): 5473. doi:10.1021/ja00537a008.
- ^ a b Radu Iftimie; Vibin Thomas; Sylvain Plessis; Patrick Marchand; Patrick Ayotte (2008). «Spectral Signatures and Molecular Origin of Acid Dissociation Intermediates». J. Am. Chem. Soc. 130 (18): 5901–7. doi:10.1021/ja077846o. PMID 18386892.
- ^ a b
Mootz, D. (1981). «Crystallochemical Correlate to the Anomaly of Hydrofluoric Acid». Angew. Chem. Int. Ed. Engl. 20 (123): 791. doi:10.1002/anie.198107911. - ^ Bunič, Tina; Tramšek, Melita; Goreshnik, Evgeny; Žemva, Boris (2006). «Barium trihydrogen tetrafluoride of the composition Ba(H3F4)2: The first example of homoleptic HF metal environment». Solid State Sciences. 8 (8): 927–931. Bibcode:2006SSSci…8..927B. doi:10.1016/j.solidstatesciences.2006.02.045.
- ^ a b Hyman, Herbert H.; Kilpatrick, Martin; Katz, Joseph J. (1957). «The Hammett Acidity Function H0 for Hydrofluoric Acid Solutions». Journal of the American Chemical Society. American Chemical Society (ACS). 79 (14): 3668–3671. doi:10.1021/ja01571a016. ISSN 0002-7863.
- ^ a b Jolly, William L. (1991). Modern Inorganic Chemistry. McGraw-Hill. p. 203. ISBN 0-07-032768-8. OCLC 22861992.
- ^ a b Cotton, F. A.; Wilkinson, G. (1988). Advanced Inorganic Chemistry (5th ed.). New York: Wiley. p. 109. ISBN 0-471-84997-9. OCLC 16580057.
- ^ Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. p. 425. ISBN 978-0-12-352651-9.
- ^ Clark, Jim (2002). «The acidity of the hydrogen halides». Retrieved 4 September 2011.
- ^ a b Chambers, C.; Holliday, A. K. (1975). Modern inorganic chemistry (An intermediate text) (PDF). The Butterworth Group. pp. 328–329. Archived from the original (PDF) on 2013-03-23.
- ^ Hannan, Henry J. (2010). Course in chemistry for IIT-JEE 2011. Tata McGraw Hill Education Private Limited. pp. 15–22. ISBN 9780070703360.
- ^ C. E. Housecroft and A. G. Sharpe «Inorganic Chemistry» (Pearson Prentice Hall, 2nd ed. 2005), p. 170.
- ^ Cotton & Wilkinson (1988), p. 104
- ^ a b Yamashita M, Yamashita M, Suzuki M, Hirai H, Kajigaya H (2001). «Ionophoretic delivery of calcium for experimental hydrofluoric acid burns». Crit. Care Med. 29 (8): 1575–8. doi:10.1097/00003246-200108000-00013. PMID 11505130. S2CID 45595073.
- ^ «CDC – NIOSH Pocket Guide to Chemical Hazards – Hydrogen fluoride». www.cdc.gov. Retrieved 2015-11-28.
- ^ Atley K, Ridyard E (2015). «Treatment of hydrofluoric acid exposure to the eye». Int J Ophthalmol. 8 (1): 157–61. doi:10.3980/j.issn.2222-3959.2015.01.28. PMC 4325260. PMID 25709926.
- ^ «The HEXAFLUORINE® solution — PREVOR». Prevor EN. Retrieved 2022-08-18.
External links[edit]
- International Chemical Safety Card 0283
- NIOSH Pocket Guide to Chemical Hazards
- CID 14917 from PubChem (HF)
- CID 144681 from PubChem (5HF)
- CID 141165 from PubChem (6HF)
- CID 144682 from PubChem (7HF)
- «Hydrofluoric Acid Burn», The New England Journal of Medicine—Acid burn case study
Пла́виковая кислота́ (фтороводоро́дная кислота́) — водный раствор фтороводорода (HF). Промышленностью выпускается в виде 40 % (чаще), а также 50 % и 72 % растворов. Название «плавиковая кислота» происходит от плавикового шпата, из которого получают фтороводород.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Техническая плавиковая кислота
- 4 Применение
- 5 Токсические свойства
Физические свойства
Растворение фтористого водорода в воде сопровождается довольно значительным выделением тепла (59 кДж/моль). Характерно для него образование содержащей 38,3 % HF и кипящей при 112 °C азеотропной смеси (по другим данным 37,5 % и tкип 109 °C). Такая азеотропная смесь получается в конечном счёте при перегонке как крепкой, так и разбавленной кислоты.
При низких температурах фтористый водород образует нестойкие соединения с водой состава Н2О·HF, Н2О·2НF и Н2О·4НF. Наиболее устойчиво из них первое (tпл −35 °C), которое следует рассматривать как фторид оксония — [Н3O]F. Второе является гидрофторидом оксония [Н3O][HF2].
Химические свойства
Это кислота средней силы (константа диссоциации составляет 6,8·10−4, степень диссоциации 0,1 н. раствора 9 %). Как и фтороводород, она разъедает стекло и другие силикатные материалы, поэтому плавиковую кислоту хранят и транспортируют в полиэтиленовой таре.
Реакция идёт по уравнению:
Na2O·CaO·6SiO2 + 28HF → Na2SiF6 + CaSiF6 + 4SiF4↑ + 14H2O
с выделением газообразного фторида кремния (SiF4).
Реагирует со многими металлами с образованием фторидов (свинец не растворяется в плавиковой кислоте, так как на поверхности его образуется нерастворимый фторид PbF2; платина и золото также не растворяются), не действует на парафин, который используют при хранении этой кислоты.
Техническая плавиковая кислота
Техническая плавиковая кислота обычно содержит ряд примесей — Fe, Rb, As, кременфтористоводородную кислоту Н2SiF6, SO2) и др.
Для грубой очистки ее перегоняют в аппаратах из платины или свинца, отбрасывая первые порции дистиллята.
Для получения более чистой кислоты техническую кислоту переводят в гидродифторид калия, затем разлагают его нагреванием, растворяя фтористый водород в дистиллированной воде.
Крепкая плавиковая кислота (более 60 % HF) может сохраняться и транспортироваться в стальных емкостях. Для хранения плавиковой кислоты и работы с ней в лабораторных условиях наиболее удобны сосуды из тефлона, полиэтилена и других пластмасс.
Применение
Крупный потребитель фтороводородной кислоты — алюминиевая промышленность.
- Раствор фтороводорода применяется для прозрачного травления силикатного стекла (например, нанесение надписей, для этого стекло покрывают парафином, прорезая отверстия для травления). Матовое травление получают в парах фтороводорода.
- Для травления кремния в полупроводниковой промышленности.
- В составе травильных, травильно-полировальных смесей, растворов для электрохимической обработки нержавеющей стали и специальных сплавов.
- Получение фторидов, кремнефторидов и борфторидов, фторорганических соединений, а также соответствующих кислот (кремнефтороводородная кислота и борфтороводородная кислота), синтетических смазочных масел и пластических масс.
- Для растворения силикатов при различного рода анализах.
Токсические свойства
Плавиковая кислота сильно ядовита. Обладает слабым наркотическим действием. Возможны острые и хронические отравления с изменением крови и кроветворных органов, органов пищеварительной системы, отёк легких.
Обладает выраженным ингаляционным действием, раздражающим действием на кожу и слизистые оболочки глаз (вызывает болезненные ожоги и изъязвления); кожно-резорбтивным, эмбриотропным, мутагенным и кумулятивным действием. Ей присвоен второй класс опасности для окружающей среды.
При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие. Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу.
Специфические антидоты практически отсутствуют, поэтому при сорбции кожей смертельной дозы фтороводорода человек может жить несколько суток (на наркотиках), но без надежды на спасение.
Предельно допустимая концентрация (ПДК) плавиковой кислоты:
| Вид | ПДК максимально разовая (ПДКм.р.) | ПДК среднесуточная (ПДКс.с.) |
|---|---|---|
| ПДК в воздухе рабочей зоны, мг/м3 (в пересчёте на фтор) | 0,5 | 0,1 |
| ПДК в атмосферном воздухе, мг/м3 (в пересчёте на фтор) | 0,02 | 0,005 |
Wikimedia Foundation.
2010.
В таком слове ударение должно быть поставлено на слог с буквой О — плавикОвая.

«Удивительно. Это же плавико́вая кислота. Та самая, что растворяет даже стекло. А для жителей Флоа это влага жизни», – Егор задумчиво смотрел вдаль. Озеро было немаленьким. Противоположного берега видно не было.

Плавико́вая кислота тормозит регенерацию, а сочетание серной кислоты с фтором тормозит омоложение и ускоряет старение. – Как будто мы все очень страдаем от омоложения, – с сарказмом заметил Леветатор. – Вы, возможно, не страдаете,…
— Владимир Власов, Земля Обетованная, 2021 год

… вода Известковое молоко Йодная вода Купоросное масло Лаббаракова вода Магнезиальный цемент Натронная известь Нашатырный спирт Олеум Пергидроль Плавико́вая кислота Реактив Несслера Сероводородная вода Синильная кислота Соляная кислота…
— Николай Стась, Справочник по общей и неорганической химии 4-е изд. Учебное пособие для СПО, 2021 год

Есть ли хоть доля правды в этих преданиях – сказать сложно. Дело в том, что, согласно современным знаниям, оказывать размягчающее воздействие на гранит может только одно вещество – плавико́вая кислота. Хуже то, плавико́вая кислота…
— Александр Матанцев, Технологии древних цивилизаций: пирамиды с вогнутым профилем, линейным фокусом и каменным отражателем, 2021 год

Что до черных, самых толстых и внушительных, там хранилась плавико́вая кислота, одна из самых мощных. Не та разбавленная, которая поступала в торговые сети. Здесь речь шла о тысячах литров крайне высокопроцентного состава.
— Франк Тилье, Жил-был раз, жил-был два, 2021 год

Кроме того, ряд химических реактивов действует на поверхность предметаследоносителя, изменяя ее рельеф (например, плавико́вая кислота — на поверхность стекла, глазурованного фарфора и фаянса) или цвет (медный купорос — на железо,…
— Александр Филиппов, Владимир Агафонов, Криминалистика 8-е изд., пер. и доп. Учебное пособие для СПО, 2021 год

Галогеноводородные кислоты и их соли носят следующие названия: фтороводородная ( плавико́вая ) кислота HF ( фториды ) ; хлороводородная ( соляная ) кислота HCl ( хлориды ) ; бромоводородная кислота HBr ( бромиды ) ; иодисто — водородная…
— Анатолий Брель, Эдуард Оганесян, Лариса Щербакова, Владимир Попков, Химия элементов. Учебник для вузов, 2021 год

Внутри прямоугольного гроба, грани которого выполнены из стекла, а ребра из металла, находится смесь множества Азотная, серная, хлорная, хлорноватистая, плавико́вая, йодороводная, бромовородная, ортофосфорная кислота – они создают…
— Сергей Долганин, Ячейка No30, 2021 год

Традиционно выделяют: кислоты — серная, соляная, азотная, плавико́вая, уксусная, щавелевая; • щелочи — едкий натр (каустическая сода), едкое кали (поташ), известь, влажный цемент; • многие соли тяжелых металлов (ртути, хрома, серебра,…
— Виктор Кадыков, Артем Морозов, Хирургия повреждений. Учебное пособие для вузов, 2021 год

Помимо этих названий, названия для некоторых бескислородных кислот, например HСl — соляная кислота, HF — плавико́вая кислота. Основания. Названия оснований складываются из слова «гидроксид» и названия металла, ксид лития.
— Александр Голубев, Валентин Шаповал, Юрий Лебедев, Герман Фадеев, Химия 2-е изд., пер. и доп. Учебник для академического бакалавриата, 2021 год

Если этот фторид растворить в воде, то получится плавико́вая кислота – самая агрессивная кислота из известных нам. Обычную кислоту (серную, соляную и пр.) можно хранить в стеклянных сосудах. А плавико́вая разъедает даже стекло,…
— Александр Никонов, Физика на пальцах. Для детей и родителей, которые хотят объяснять детям, 2021 год

Плавико́вая. кислота. «Стекло,. берегись!» Каким образом мастера на производстве делают надписи на стекле или наносят на него рисунки? В этом им помогает плавико́вая кислота – «гроза» всех стекол. Как у нее это получается? Плавико́вая или…
— Алина Шоричева, От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп Таблицы Менделеева, 2021 год

Фториды щелочных металлов растворимы в воде, щелочно-земельных – малорастворимы. в Плавико́вая кислота разъедает стекло и другие силикатные материалы (кварц, фарфор). Мастера предварительно покрывают стекло парафином, а потом прорезают…
— Алина Шоричева, От водорода до мейтнерия: неорганика на ладони. Книга первая: металлы и неметаллы главных подгрупп Таблицы Менделеева, 2021 год

на потоком полилась бы всё и вся превращающая в оплавленное желе концентрированная плавико́вая кислота. Самым большим в цеху аппаратом была газовая печь. КПавлу подошел один из военных, представился, им оказался подполковник Зуев. – Мы…
— Денис Игумнов, Ночная смена, 2021 год

Да ну! Серную кислоту купить или в кабинете химии спереть – не проблема, так же, как азотную, соляную и многие прочие. Даже плавико́вая вполне доступна, хотя именно ее на твоих шмотках нет, повезло. Хотя смесь ядреная. В целом скажу: ты,…
— Олег Рой, Имитатор. Книга пятая. Наследники, 2021 год

Облигатные раздражители: концентрированные минеральные кислоты (серная, азотная, соляная, плавико́вая) и щелочи (каустическая сода, едкий натрий и калий), органические кислоты (карболовая, муравьиная, уксусная), соли минеральных кислот…
— Коллектив авторов, Справочник семейного доктора, 2021 год

Фтороводородная (плавико́вая) кислота HF при Галогенид-ионы (кроме F–) обладают восстановительными свойствами. Восстановительная способность усиливается в ряду: Cl– Br– I–, так как растут радиус атома и склонность к отдаче электронов.
— Елена Крышилович, Валентина Мостовых, Химия, 2021 год

Плавико́вая кислота — одна из самых слабых кислот, что объясняется небольшой длиной и высокой полярностью связи. Фтороводородная кислота в водных растворах — слабый Ещё в середине XVII в. художники электролит.
— Елена Крышилович, Таисия Жуляева, Наглядная химия, 2021 год

Фтороводородная (плавико́вая) кислота способна реагировать со стеклом (реакция травления стекла), поэтому фтороводородную кислоту запрещено хранить в стеклянных ёмкостях. При попадании на кожу концентрированных или разбавленных растворов…
— Андрей Антошин, ОГЭ 2020. Химия. Тематические тренировочные задания, 2020 год

В указанном ряду кислотные свойства возрастают, фтороводородная (плавико́вая) кислота HF относится к слабым кислотам, в то время как иодоводородная HI — одна из сильнейших кислот. В промышленности галогеноводороды получают по реакциям:…
— Юрий Медведев, ОГЭ. Химия. Новый полный справочник для подготовки к ОГЭ, 2020 год
Вместо воды у них жидкий фтористый водород – та самая плавико́вая кислота, которая у нас разъедает стекло и разрушает почти все минералы, в состав которых входит кремний, легкорастворимый во фтористом водороде.
— Иван Ефремов, Туманность Андромеды
На данном портале вы узнаете где именно ставится ударение в слове «плавиковая». Наш портал подскажет куда падает ударение в слове плавиковая и как оно правильно произносится. В слове «плавиковая» ударение следует ставить на слог с буквой О — плавико́вая.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Плавиковая кислота
Брутто-формула:
HF
CAS# 7664-39-3
Категории:
Неорганические кислоты
PubChem CID: 14917
| ChemSpider ID: 14214
| CB8380315
| CHEBI:29228
| CHEMBL1232767
Названия
Русский:
- Плавиковая кислота [Wiki]
- Фтороводород(IUPAC) [Wiki]
- гидрофторид
- гидрофторидная кислота
- фторид водорода
- фтористоводородная кислота
- фтористый водород
- фтороводородная кислота
English:
- Antisal 2B
- EINECS:231-634-8
- Fluorwasserstoff
- Hydrofluoric acid(CAS) [Wiki]
- Hydrofluoride
- Hydrogen fluoride(IUPAC) [Wiki]
- Rubigine
- fluorane
- fluorhydric acid
- fluoric acid
Варианты формулы:
HF
H(+1)F(-1)
H-F
HF
Вещества, имеющие отношение…
Анион:
Фторид анион
Химический состав
Реакции, в которых участвует Плавиковая кислота
-
H2 + {Hal}2 -> 2H{Hal}
, где Hal =
F Cl Br I -
H{R} <=> H^+ + {R}^-
, где R =
F Cl Br I NO3 NO2 -
H2 + F2 = 2HF
-
2KHSO4 + F2 -> K2S2O6(O2) + 2HF
-
{M}O + 2H{X} -> {M}{X}2 + H2O
, где M =
Cu Ca Mg Sr Ba Hg Mn Cr Ni Fe Cd Zn Pb; X =
Cl F Br I
И ещё 255 реакций…

|
||
|
||
|
||
| Имена |
||
|---|---|---|
| Название ИЮПАК
Флуоран [1] |
||
| Другие имена Фтористоводородная кислота |
||
| Идентификаторы |
||
|
Количество CAS |
|
|
|
3D модель ( JSmol ) |
|
|
| ЧЭБИ |
|
|
| ChemSpider |
|
|
| Номер ЕС |
|
|
|
PubChem CID |
|
|
| Номер RTECS |
|
|
| UNII |
|
|
|
Панель управления CompTox ( EPA ) |
|
|
|
ИнЧИ
|
||
|
Улыбки
|
||
| Характеристики |
||
|
Химическая формула |
ВЧ (водн.) |
|
| Появление |
Бесцветная жидкость |
|
| Плотность | 1,15 г / мл (для 48% раствора) |
|
| Кислотность (p K a ) |
3,17 [2] | |
| Опасности [3] | ||
| Пиктограммы GHS |  
|
|
| Сигнальное слово GHS | Опасность | |
|
Положения об опасности GHS |
H280 , H300 , H310 , H314 , H318 , H330 | |
|
Меры предосторожности GHS |
P260 , P262 , P264 , P270 , P271 , P280 , P284 , P301 + 310 , P301 + 330 + 331 , P302 + 350 , P303 + 361 + 353 , Р304 + 340 , P305 + 351 + 338 , P310 , P320 , P321 , P322 , P330 , P361 , P363 , P403 + 233 , Р405 , Р410 + 403 , Р501 | |
| NFPA 704 (огненный алмаз) |
4 0 0 КИСЛОТА |
|
|
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). |
||
| Ссылки на инфобоксы | ||
Плавиковая кислота представляет собой раствор из фтористого водорода (HF) в воде . Растворы HF бесцветны, кислые и очень едкие . Он используется для изготовления большинства фторсодержащих соединений; Примеры включают обычно используемый фармацевтический антидепрессант флуоксетин (прозак) и материал ПТФЭ (тефлон). Из него получают элементарный фтор . Он обычно используется для травления стеклянных и кремниевых пластин.
Попадание фтористоводородной кислоты на кожу человека вызывает глубокие ожоги.
Использует
Производство фторорганических соединений
Основное применение фтористоводородной кислоты — это химия фторорганических соединений . Многие фторорганические соединения получают с использованием HF в качестве источника фтора, включая тефлон , фторполимеры , фторуглероды и хладагенты, такие как фреон . Многие фармацевтические препараты содержат фтор. [4]
Производство неорганических фторидов
Большинство неорганических фторидных соединений в больших объемах получают из плавиковой кислоты. Прежде всего, это Na 3 AlF 6 , криолит , и AlF 3 , трифторид алюминия . Расплавленная смесь этих твердых веществ служит высокотемпературным растворителем для производства металлического алюминия . Другие неорганические фториды, полученные из плавиковой кислоты, включают фторид натрия и гексафторид урана . [4]
Etchant, cleaner
Емкости для влажного травления
Он используется в полупроводниковой промышленности в качестве основного компонента травления Wright Etch и буферного оксидного травления , которые используются для очистки кремниевых пластин . Подобным образом он также используется для травления стекла путем обработки диоксидом кремния с образованием газообразных или водорастворимых фторидов кремния. Его также можно использовать для полировки и заморозки стекла. [5]
- SiO 2 + 4 HF → SiF 4 (г) + 2 H 2 O
- SiO 2 + 6 HF → H 2 SiF 6 + 2 H 2 O
Гель с фтористоводородной кислотой от 5% до 9% также обычно используется для протравливания всех керамических зубных реставраций с целью улучшения адгезии. [6] По тем же причинам разбавленная фтористоводородная кислота входит в состав бытовых пятновыводителей, в составах для мойки колес , в составах «для чистки колес», в ингибиторах ржавчины для керамики и тканей, а также в пятновыводителях. [5] [7] Благодаря своей способности растворять оксиды железа, а также загрязнения на основе диоксида кремния, фтористоводородная кислота используется в пуско-наладочных котлах, вырабатывающих пар высокого давления. Плавиковая кислота также полезна для растворения образцов горных пород (обычно порошкообразных) перед анализом. Подобным образом эта кислота используется при кислотной мацерации.для извлечения органических окаменелостей из силикатных пород. Ископаемые породы можно погрузить непосредственно в кислоту, или можно нанести пленку нитрата целлюлозы (растворенную в амилацетате ), которая прилипает к органическому компоненту и позволяет породе растворяться вокруг него. [8]
Нефтепереработка
В стандартном процессе нефтепереработки, известном как алкилирование , изобутан алкилируется низкомолекулярными алкенами (в основном смесью пропилена и бутилена ) в присутствии кислотного катализатора, полученного из плавиковой кислоты. Катализатор протонирует алкены (пропилен, бутилен) с образованием реактивных карбокатионов , которые алкилируют изобутан. Реакцию проводят при умеренных температурах (0 и 30 ° C) в двухфазной реакции.
Производство
Плавиковая кислота была впервые получена в 1771 году Карлом Вильгельмом Шееле . [9] В настоящее время он в основном производится путем обработки минерального флюорита CaF 2 концентрированной серной кислотой при температуре около 265 ° C.
- CaF 2 + H 2 SO 4 → 2 HF + CaSO 4
Кислота также является побочным продуктом производства фосфорной кислоты из апатита и фторапатита . При переваривании минерала серной кислотой при повышенных температурах выделяется смесь газов, в том числе фтористый водород, который можно восстановить. [4]
Из-за своей высокой реакционной способности по отношению к стеклу фтористоводородная кислота хранится в контейнерах из фторированного пластика (часто PTFE ). [4] [5]
Плавиковая кислота встречается в природе; он высвобождается при извержении вулканов.
Свойства
В разбавленном водном растворе фтороводород ведет себя как слабая кислота [10]. С помощью
инфракрасной спектроскопии было показано, что в растворе диссоциация сопровождается образованием ионной пары H
3О+
· F — . [11]
[12]
- ЧАС
2O + 2 HF ⇌ H + + F — + H
3О+
⋅F — p K a = 3,17
Эта ионная пара была охарактеризована в кристаллическом состоянии при очень низкой температуре. [13]
Дальнейшая ассоциация была охарактеризована как в растворе, так и в твердом состоянии. [ необходима цитата ]
- ВЧ + Ф — ⇌ ВЧ—
2 журнал K = 0,6
Предполагается, что полимеризация происходит при увеличении концентрации. Это предположение подтверждается выделением соли тетрамерного аниона H
3F—
4[14] и низкотемпературной рентгеновской кристаллографией. [13] Не все виды, присутствующие в концентрированных водных растворах фтороводорода, охарактеризованы; в дополнение к ВЧ—
2известное [11] образование других полимерных частиц, H
п −1F—
п, весьма вероятно.
Функция кислотности Гаммета , H 0 , для 100% HF оценивается в диапазоне от -10,2 до -11. [15], что сопоставимо со значением –12 для серной кислоты . [16] [17]
Кислотность
В отличие от других галогеноводородных кислот, таких как соляная кислота , фтористый водород является только слабой кислотой в разбавленном водном растворе. [18] Это частично является результатом прочности связи водород-фтор, но также и других факторов, таких как склонность HF, H
2O и F—
анионы с образованием кластеров. [19] При высоких концентрациях молекулы HF подвергаются гомоассоциации с образованием многоатомных ионов (таких как бифторид , HF—
2) и протоны , что значительно увеличивает кислотность. [20] Это приводит к протонированию очень сильных кислот, таких как соляная, серная или азотная, при использовании концентрированных растворов плавиковой кислоты. [21] Хотя фтористоводородная кислота считается слабой кислотой, она очень агрессивна и даже разрушает стекло при гидратации. [20]
Кислотность растворов плавиковой кислоты зависит от концентрации из -за взаимодействий с водородными связями фторид-иона. Разбавленные растворы слабокислые с константой кислотной ионизации K a =6,6 × 10 −4 (или p K a = 3,18 ) [10] в отличие от соответствующих растворов других галогенидов водорода, которые являются сильными кислотами ( p K a <0 ). Концентрированные растворы фтористого водорода намного более кислые, чем подразумевается этим значением, как показывают измерения функции кислотности Гаммета H 0 [15] (или «эффективного pH»). Значение H 0 для 100% HF оценивается в диапазоне от -10,2 до -11, что сравнимо со значением -12 для серной кислоты . [16] [17]
С термодинамической точки зрения растворы HF в высшей степени неидеальны , поскольку активность HF возрастает намного быстрее, чем его концентрация. Слабая кислотность разбавленного раствора иногда объясняется высокой прочностью связи H-F , которая в сочетании с высокой энтальпией растворения HF перевешивает более отрицательную энтальпию гидратации фторид-иона. [22] Поль Жигер и Сильвия Туррелл [11] [12] показали с помощью инфракрасной спектроскопии, что преобладающими веществами в разбавленном растворе являются пары ионов с водородными связями H
3О+
· F — . [23]
- ЧАС
2O + HF ⇌ H
3О+
⋅F —
С увеличением концентрации HF увеличивается и концентрация иона дифторида водорода . [11] Реакция
- 3 ВЧ ⇌ ВЧ—
2+ H 2 F +
является примером гомоконъюгации .
Здоровье и безопасность
Ожог руки плавиковой кислотой
Плавиковая кислота является не только очень коррозионной жидкостью, но и мощным контактным ядом . Из-за способности фтористоводородной кислоты проникать в ткани отравление может легко произойти при контакте с кожей или глазами, а также при вдыхании или проглатывании. Симптомы воздействия фтористоводородной кислоты могут быть не сразу очевидны, и это может дать ложную уверенность жертвам, заставляя их откладывать лечение. [24] Несмотря на раздражающий запах, HF может достигать опасного уровня без явного запаха. [5] ВЧ нарушает функцию нервов, а это означает, что первоначально ожоги могут быть безболезненными. Случайные воздействия могут остаться незамеченными, что приведет к отсрочке лечения и увеличению степени и серьезности травмы. [24]Симптомы воздействия HF включают раздражение глаз, кожи, носа и горла, ожоги глаз и кожи, ринит , бронхит , отек легких (скопление жидкости в легких) и повреждение костей. [25]
Популярная культура
В эпизоде 4-го сериала «Цепная реакция» британской медицинской драмы « Несчастный случай» в результате дорожно-транспортного происшествия происходит утечка фтористоводородной кислоты, которая проверяет ресурсы департамента и приводит к смерти полицейского и тяжелым ожогам других автомобилистов. В этом эпизоде реалистично изображены действия пожарной службы в случае утечки химического вещества.
В 15-м сезоне 2-го эпизода « Станции 19» начальник пожарной охраны подвергается воздействию фтористоводородной кислоты во время пожара на кофейном заводе в предыдущем эпизоде. После отсроченной реакции на симптомы это приводит к его смерти.
В фильме « Пила VI» фтористоводородная кислота используется для убийства Уильяма Истона. Двумя фильмами позже, в « Головоломке» , Карли убита плавиковой кислотой, введенной ей в кровоток.
В эпизоде сериала « Титаны» под названием «Джейсон Тодд» молодой Дик Грейсон утверждает, что убийца его родителей использовал плавиковую кислоту, чтобы сжечь веревки трапеции.
Растворяющиеся тела
Использование HF для растворения человеческих тел довольно распространено, но нереально. Хотя это возможно (при достаточном нагревании и времени), большие органические массы лучше растворять с помощью раствора пираньи .
- В эпизоде сериала « Во все тяжкие» под названием « Кошка в мешке … » Джесси Пинкман использует плавиковую кислоту, чтобы растворить тело Эмилио Коямы. В другом эпизоде « Резак для коробок » Уолтер Уайт и Джесси Пинкман используют плавиковую кислоту, чтобы растворить тело Виктора.
- В трех сегментах видеоигры Zero Time Dilemma под названием «Первым пришел, первым был спасен», каждой из трех команд участников предоставляется возможность нажать кнопку, которая активирует душ плавиковой кислоты, который льется на две другие команды. Процесс коррозии кислоты описан и изображен как достаточно быстрый, чтобы расплавить все, от металла и стекла до всего тела крупного взрослого мужчины за считанные секунды, оставив после себя лишь небольшое количество ткани.
- В сезоне 4, эпизоде 20 ER , персонаж подвергается воздействию большого количества плавиковой кислоты. Это обжигает его кожу и в конечном итоге убивает его.
См. Также
- Разложение паровой фазы
Ссылки
- ^ Фавр, Анри А .; Пауэлл, Уоррен Х., ред. (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные наименования 2013 . Кембридж: Королевское химическое общество . п. 131. ISBN. 9781849733069.
- ^ Харрис, Дэниел С. (2010). Количественный химический анализ (8-е международное издание). Нью-Йорк: WH Freeman. С. AP14. ISBN 978-1429263092.
- ^ «Плавиковая кислота» . PubChem . Национальный институт здоровья . Проверено 12 октября 2017 года .
- ^ a b c d Aigueperse, Жан; Моллард, Пол; Девилье, Дидье; Chemla, Marius; Фарон, Роберт; Романо, Рене; Куэр, Жан-Пьер (2000). «Соединения фтора неорганические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a11_307 .
- ^ a b c d «CDC — База данных по безопасности и охране здоровья при чрезвычайных ситуациях: Системный агент: ФТОРИД ВОДОРОДА / ФТОРОВОДОРОДНАЯ КИСЛОТА — NIOSH» . www.cdc.gov . Проверено 4 декабря 2015 .
- ^ Крейг, Роберт (2006). Реставрационные стоматологические материалы Крейга . Сент-Луис, Миссури: Мосби Эльзевьер. ISBN 0-323-03606-6. OCLC 68207297 .
- ↑ Страчан, Джон (январь 1999 г.). «Смертельное полоскание: опасность плавиковой кислоты» . Профессиональная мойка и уход за автомобилями . 23 (1). Архивировано из оригинального 25 апреля 2012 года.
- ^ Эдвардс, Д. (1982). «Фрагментарные микрофоссилии несосудистых растений из позднего силурия Уэльса». Ботанический журнал Линнеевского общества . 84 (3): 223–256. DOI : 10.1111 / j.1095-8339.1982.tb00536.x .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов . Оксфорд: Pergamon Press . п. 921. ISBN 978-0-08-022057-4.
- ^ a b Ральф Х. Петруччи; Уильям С. Харвуд; Джеффри Д. Мадура (2007). Общая химия: принципы и современные приложения . Пирсон / Прентис Холл. п. 691. ISBN. 978-0-13-149330-8. Проверено 22 августа 2011 года .
- ^ a b c d Giguère, Поль А .; Террелл, Сильвия (1980). «Природа плавиковой кислоты. Спектроскопическое исследование комплекса переноса протона H.
3О+
… F — .» . , J. Am Chem Soc. , . 102 (17): 5473. DOI : 10.1021 / ja00537a008 . - ^ a b Раду Ифтимие; Вибин Томас; Сильвен Плесси; Патрик Маршан; Патрик Айотте (2008). «Спектральные сигнатуры и молекулярное происхождение промежуточных продуктов диссоциации кислоты». Варенье. Chem. Soc. 130 (18): 5901–7. DOI : 10.1021 / ja077846o . PMID 18386892 .
- ^ а б Mootz, D. (1981). «Кристаллохимическая корреляция с аномалией плавиковой кислоты». Энгью. Chem. Int. Эд. Англ . 20 (123): 791. DOI : 10.1002 / anie.198107911 .
- ^ Бунич, Тина; Трамшек, Мелита; Горешник Евгений; Жемва, Борис (2006). «Трехводородный тетрафторид бария состава Ba (H 3 F 4 ) 2 : первый пример гомолептической металлической среды HF». Науки о твердом теле . 8 (8): 927–931. Bibcode : 2006SSSci … 8..927B . DOI : 10.1016 / j.solidstatesciences.2006.02.045 .
- ^ а б Хайман, Герберт Н .; Килпатрик, Мартин; Кац, Джозеф Дж. (1957). «Функция кислотности H 0 по Хаммету для растворов плавиковой кислоты». Журнал Американского химического общества . Американское химическое общество (ACS). 79 (14): 3668–3671. DOI : 10.1021 / ja01571a016 . ISSN 0002-7863 .
- ^ a b Веселый, Уильям Л. (1991). Современная неорганическая химия . Макгроу-Хилл. п. 203. ISBN. 0-07-032768-8. OCLC 22861992 .
- ^ a b Хлопок, FA ; Уилкинсон, Г. (1988). Высшая неорганическая химия (5-е изд.). Нью-Йорк: Вили. п. 109. ISBN 0-471-84997-9. OCLC 16580057 .
- ^ Виберг, Эгон; Виберг, Нильс; Холлеман, Арнольд Фредерик (2001). Неорганическая химия . Сан-Диего: Academic Press. п. 425. ISBN 978-0-12-352651-9.
- ^ Кларк, Джим (2002). «Кислотность галогеноводорода» . Проверено 4 сентября 2011 года .
- ^ a b Chambers, C .; Холлидей, АК (1975). Современная неорганическая химия (Промежуточный текст) (PDF) . Группа Баттерворта. С. 328–329. Архивировано из оригинального (PDF) 23 марта 2013 года.
- ^ Ханнан, Генри Дж. (2010). Курс химии для IIT-JEE 2011 . Tata McGraw Hill Education Private Limited. С. 15–22. ISBN 9780070703360.
- ^ С. Е. Housecroft и А. Г. Шарп «неорганическая химия» (Pearson Prentice Hall, 2е изд. 2005), стр. 170.
- ^ Коттон и Уилкинсон (1988) , стр. 104
- ^ а б Ямасита М, Ямасита М, Судзуки М, Хираи Х, Кадзигая Х (2001). «Ионофоретическая доставка кальция при экспериментальных ожогах плавиковой кислотой». Крит. Care Med . 29 (8): 1575–8. DOI : 10.1097 / 00003246-200108000-00013 . PMID 11505130 . S2CID 45595073 .
- ^ «CDC — Карманный справочник NIOSH по химическим опасностям — фтористый водород» . www.cdc.gov . Проверено 28 ноября 2015 .
Внешние ссылки
- Международная карта химической безопасности 0283
- Карманный справочник NIOSH по химической опасности
- CID 14917 от PubChem (HF)
- CID 144681 от PubChem (5HF)
- CID 141165 от PubChem (6HF)
- CID 144682 от PubChem (7HF)
- «Ожог плавиковой кислотой» , Медицинский журнал Новой Англии — тематическое исследование кислотного ожога