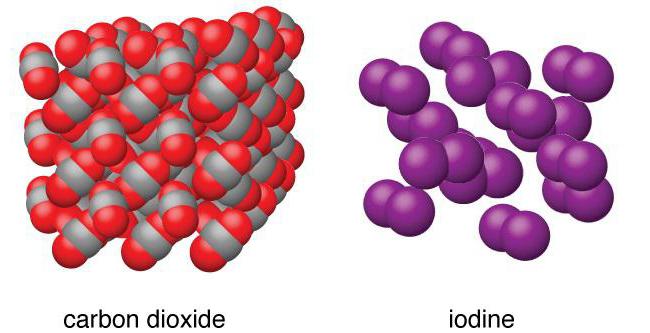
Спиртовой раствор йода … С детства хорошо знакомый всем детям и их родителям помощник при царапинах, ссадинах и порезах. Он является быстрым и эффективным средством, прижигающим и дезинфицирующим раневую поверхность. Однако сфера применения вещества не ограничивается только медициной, т. к. химические свойства йода очень разнообразны. Цель нашей статьи – ознакомиться с ними подробнее.
Физическая характеристика
Простое вещество имеет вид темно-фиолетовых кристаллов. При нагревании, вследствие особенностей внутреннего строения кристаллической решетки, а именно наличия в ее узлах молекул, соединение не расплавляется, а сразу образует пары. Это возгонка или сублимация. Она объясняется слабой связью между молекулами внутри кристалла, которые легко отрываются друг от друга – образуется газообразная фаза вещества. Номер йода в таблице Менделеева – 53. А его положение среди других химических элементов указывает на принадлежность к неметаллам. Остановимся на этом вопросе далее.
Место элемента в периодической системе
Йод находится в пятом периоде, VII группе и, наряду со фтором, хлором, бромом и астатом образует подгруппу галогенов. В связи с увеличением заряда ядра и атомного радиуса у представителей галогенов происходит ослабление неметаллических свойств, поэтому йод менее активен, чем хлор или бром, и его электроотрицательность также ниже. Атомная масса йода 126,9045. Простое вещество представлено двухатомными молекулами, как и у других галогенов. Ниже мы ознакомимся со строением атома элемента.
Особенности электронной формулы
Пять энергетических уровней и почти полностью заполненный электронами последний из них подтверждают наличие у элемента ярко выраженных признаков неметаллов. Как и другие галогены, йод является сильным окислителем, забирая у металлов и более слабых неметаллических элементов — серы, углерода, азота — недостающий до завершения пятого уровня электрон.
Йод – неметалл, в молекулах которого присутствует общая пара p-электронов, связывающая атомы между собой. Их плотность в месте перекрывания наибольшая, общее электронное облако не смещается ни к одному из атомов и располагается в центре молекулы. Формируется неполярная ковалентная связь, а сама молекула имеет линейную форму. В ряду галогенов, от фтора до астата, прочность ковалентной связи уменьшается. Наблюдается уменьшение величины энтальпии, от которой зависит распад молекул элемента на атомы. Какие же последствия для химических свойств йода это имеет?
Почему активность йода меньше, чем у других галогенов
Реакционная способность неметаллов определяется силой притягивания к ядру собственного атома чужих электронов. Чем меньше радиус атома, тем силы электростатического притяжения его отрицательно заряженных частиц других атомов выше. Чем выше номер периода, в котором расположен элемент, тем больше энергетических уровней он будет иметь. Йод находится в пятом периоде, и количество энергетических слоев у него больше, чем у брома, хлора и фтора. Именно поэтому молекула йода содержит атомы, имеющие радиус намного больше, чем у ранее перечисленных галогенов. Вот почему частицы I2 слабее притягивают электроны, что приводит к ослаблению их неметаллических свойств. Внутреннее строение вещества неизбежно влияет и на его физические характеристики. Приведем конкретные примеры.
Сублимация и растворимость
Уменьшение взаимного притягивания атомов йода в его молекуле приводит, как мы говорили ранее, к ослаблению прочности ковалентной неполярной связи. Происходит снижение устойчивости соединения к высокой температуре и повышение показателя термической диссоциации его молекул. Отличительная черта галогена: переход вещества при нагревании из твердого состояния сразу в газообразное, т. е. сублимация — это главная физическая характеристика йода. Его растворимость в органических растворителях, например сероуглероде, бензоле, этаноле, выше, чем в воде. Так, в 100 г воды при 20 °С может раствориться всего 0,02 г вещества. Эту особенность в лаборатории применяют для извлечения йода из водного раствора. Взболтав его с небольшим количеством H2S, можно наблюдать фиолетовое окрашивание сероводорода вследствие перехода в него молекул галогена.
Химические свойства йода
Взаимодействуя с металлами, элемент ведет себя всегда одинаково. Он притягивает валентные электроны атома металла, которые располагаются либо на последнем энергетическом слое (s-элементы, такие как натрий, кальций, литий и т. д.), либо на предпоследнем слое, содержащем, например, d-электроны. К ним относятся железо, марганец, медь и другие. В этих реакциях металл будет восстановителем, а йод, химическая формула которого I2, — окислителем. Поэтому именно эта высокая активность простого вещества является причиной его взаимодействия со многими металлами.
Заслуживает внимания взаимодействие йода с водой при нагревании. В щелочной среде реакция проходит с образованием смеси йодидной и иодноватой кислот. Последнее вещество проявляет свойства сильной кислоты и при дегидратации превращается в пятиокись йода. Если же раствор подкислить, то вышеназванные продукты реакции взаимодействуют между собой с образованием исходных веществ – свободных молекул I2 и воды. Данная реакция относится к окислительно-восстановительному типу, в ней проявляются химические свойства йода как сильного окислителя.
Качественная реакция на крахмал
Как в неорганической, так и в органической химии существует группа реакций, с помощью которых можно выявить в продуктах взаимодействия определенные виды простых или сложных ионов. Для обнаружения макромолекул сложного углевода – крахмала — часто применяют 5%-й спиртовой раствор I2. Например, на срез сырой картофелины капают несколько его капель, и окраска раствора становится синей. Такой же эффект мы наблюдаем при попадании вещества на любой крахмалосодержащий продукт. Эта реакция, в результате которой получается синий йод, широко применяется в органической химии для подтверждения присутствия полимера в исследуемой смеси.
О полезных свойствах продукта взаимодействия йода и крахмала известно давно. Его применяли в условиях отсутствия противомикробных медикаментозных препаратов для лечения диареи, язвы желудка в состоянии ремиссии, заболеваний дыхательной системы. Широкое распространение крахмальный клейстер, содержащий примерно 1 чайную ложку спиртового раствора йода на 200 мл воды, получил из-за дешевизны ингредиентов и простоты приготовления.
Однако нужно помнить, что синий йод противопоказан в терапии маленьких детей, людей, страдающих повышенной чувствительностью к йодосодержащим препаратам, а также больным базедовой болезнью.
Как неметаллы реагируют между собой
Среди элементов главной подгруппы VII группы с йодом вступает в реакцию фтор – самый активный неметалл, обладающий наивысшей степенью окисления. Процесс проходит на холоде и сопровождается взрывом. С водородом I2 взаимодействует при сильном нагревании, причем не до конца, продукт реакции – HI — начинает разлагаться на исходные вещества. Йодоводородная кислота достаточно сильная и хоть по своим характеристикам похожа на хлоридную кислоту, все же проявляет более выраженные признаки восстановителя. Как видно, химические свойства йода обусловлены его принадлежностью к активным неметаллам, однако элемент уступает по окислительной способности брому, хлору и, конечно же, фтору.
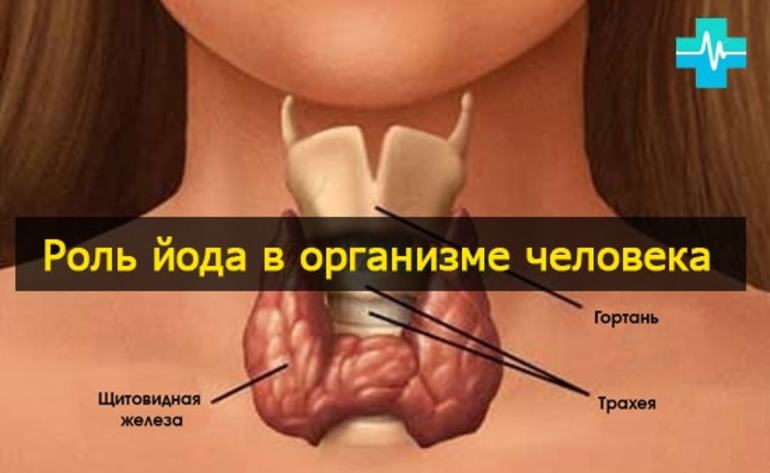
Роль элемента в живых организмах
Наибольшее содержание ионов I— находится в тканях щитовидной железы, где они входят в состав тиреотропных гормонов: тироксина и трийодтиронина. Они регулируют рост и развитие костной ткани, проведение нервных импульсов, скорость обмена веществ. Особенно опасен недостаток йодсодержащих гормонов в детском возрасте, так как возможна задержка психического развития и появление симптомов такого заболевания, как кретинизм.
Недостаточная секреция тироксина у взрослых связана с дефицитом йода в воде и продуктах питания. Она сопровождается выпадением волос, образованием отеков, снижением физической активности. Избыток элемента в организме также крайне опасен, так как развивается базедова болезнь, симптомы которой – возбудимость нервной системы, тремор конечностей, резкое исхудание.
Высокое содержание соединений йода обнаруживается у некоторых представителей мира флоры. Низшие растения – бурые и красные водоросли — накапливают их в своем талломе. Среди высших растений рекордсменами по накоплению йода являются вишня, хурма, финики и свекла. Большое количество элемента содержат морепродукты и морская рыба.
Распространение йодидов в природе и способы получения чистого вещества
Основная масса элемента присутствует в живых организмах и оболочках Земли – гидросфере и литосфере — в связанном состоянии. Соли элемента есть в морской воде, но их концентрация незначительна, поэтому извлекать чистый йод из нее нерентабельно. Гораздо эффективнее получение вещества из золы бурых водорослей: фукуса, ламинарии, саргассума.
В промышленных масштабах I2 выделяют из подземных вод в процессах добычи нефти. При переработке некоторых руд, например чилийской селитры, в ней встречаются иодаты и гипоиодаты калия, из которых в дальнейшем добывают чистый йод. Достаточно рентабельно получать I2 из раствора йодоводорода, окисляя его хлором. Полученное соединение является важным сырьем для фармацевтической промышленности.
Кроме уже названного 5% спиртового раствора йода, содержащего не только простое вещество, но и соль – иодид калия, а также спирт и воду, в эндокринологии по медицинским показаниям применяют такие препараты, как «Йод-актив» и «Йодомарин».
В районах с низким содержанием природных соединений, кроме йодированной пищевой соли, можно использовать такое лечебное средство, как «Антиструмин». Он содержит действующее вещество – йодид калия — и рекомендуется в качестве профилактического препарата, применяемого для предотвращения симптомов эндемического зоба.
Запишем уравнение реакции взаимодействия хлора с иодидом калия:
Йод (Jodum), I (в литературе встречается также символ J) — химический элемент VII группы периодической системы Д. И. Менделеева, относящийся к галогенам (от греч. halos — соль и genes — образующий), к которым также относятся фтор, хлор, бром и астат.
Порядковый (атомный) номер йода — 53, атомный вес (масса) — 126,9.
Из всех существующих в природе элементов йод является самым загадочным и противоречивым по своим свойствам.
Плотность (удельный вес) йода — 4,94 г/см3, tnl — 113,5 °С, tKn — 184,35 °С.
Из имеющихся в природе галогенов йод — самый тяжелый, если, конечно, не считать радиоактивный короткоживущий астат. Практически весь природный йод состоит из атомов одного стабильного изотопа с массовым числом 127. Радиоактивный 1-125 образуется в результате спонтанного деления урана. Из искусственных изотопов йода важнейшие — 1-131 и 1-123: их используют в медицине.
Молекула элементарного йода (J2), как и у прочих галогенов, состоит из двух атомов. Фиолетовые растворы йода являются электролитами (проводят электрический ток при наложении разности потенциалов) так как в растворе молекулы J2 частично диссоциируют (распадаются) на подвижные ионы J и J. Заметная диссоциация J2 наблюдается при t выше 700 °С, а также при действии света. Йод — единственный галоген, находящийся в твердом состоянии при нормальных условиях, и представляет собой серовато-черные с металлическим блеском пластинки или сростки кристаллов со своеобразным (характерным) запахом.
Отчетливо выраженное кристаллическое строение, способность проводить электрический ток — все эти «металлические» свойства характерны для чистого йода.
Однако йод выделяется среди прочих элементов, в том числе отличаясь от металлов, легкостью перехода в газообразное состояние. Превратить йод в пар даже легче, чем в жидкость. Он обладает повышенной летучестью и уже при обычной комнатной температуре испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании йода происходит его так называемая возгонка, то есть переход в газообразное состояние минуя жидкое, затем оседание в виде блестящих тонких пластинок; этот процесс служит для очистки йода в лабораториях и в промышленности.
Йод плохо растворим в воде (0,34 г/л при 25 °С, приблизительно 1:5000), зато хорошо растворяется во многих органических растворителях — сероуглероде, бензоле, спирте, керосине, эфире, хлороформе, а также в водных растворах йодидов (калия и натрия), причем в последних концентрация йода будет гораздо выше, чем та, которую можно получить прямым растворением элементарного йода в воде.
Окраска растворов йода в органике не отличается постоянством. Например, йодный раствор в сероуглероде — фиолетовый, а в спирте — бурый.
Конфигурация внешних электронов атома йода — ns2 np5. В соответствии с этим йод проявляет в соединениях переменную валентность (степень окисления): -1; +1; +3; +5 и +7.
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром, а тем более фтор.
С металлами йод при легком нагревании энергично взаимодействует, образуя бесцветные соли йодиды.
С водородом йод реагирует только при нагревании и не полностью, образуя йодистый водород. С некоторыми элементами — углеродом, азотом, кислородом, серой и селеном — йод непосредственно не соединяется. Несовместим он и с эфирными маслами, растворами аммиака, белой осадочной ртутью (образуется взрывчатая смесь).
ОПРЕДЕЛЕНИЕ
Йод
расположен в пятом периоде VII группе главной (A) подгруппе Периодической таблицы.
Относится к элементам p
-семейства. Неметалл. Обозначение — I. Порядковый номер — 53. Относительная атомная масса — 126,905 а.е.м.
Электронное строение атома йода
Атом йода состоит из положительно заряженного ядра (+53), внутри которого есть 53 протона и 74 нейтрона, а вокруг, по пяти орбитам движутся 53 электрона.
Рис.1. Схематическое строение атома йода.
Распределение электронов по орбиталям выглядит следующим образом:
53Te) 2) 18) 18) 7 ;
1s
2 2s
2 2p
6 3s
2 3p
6 3d
10 4s
2 4p
6 4d
10 5s
2 5p
5 .
Внешний энергетический уровень атома йода содержит 7 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома йода можно охарактеризовать набором из четырех квантовых чисел: n
(главное квантовое), l
(орбитальное), m l
(магнитное) и s
(спиновое):
Примеры решения задач
ПРИМЕР 1
С детства хорошо знакомый всем детям и их родителям помощник при царапинах, ссадинах и порезах. Он является быстрым и эффективным средством, прижигающим и дезинфицирующим раневую поверхность. Однако сфера применения вещества не ограничивается только медициной, т. к. химические свойства йода очень разнообразны. Цель нашей статьи — ознакомиться с ними подробнее.
Физическая характеристика
Простое вещество имеет вид темно-фиолетовых кристаллов. При нагревании, вследствие особенностей внутреннего строения кристаллической решетки, а именно наличия в ее узлах молекул, соединение не расплавляется, а сразу образует пары. Это возгонка или сублимация. Она объясняется слабой связью между молекулами внутри кристалла, которые легко отрываются друг от друга — образуется газообразная фаза вещества. Номер йода в таблице Менделеева — 53. А его положение среди других химических элементов указывает на принадлежность к неметаллам. Остановимся на этом вопросе далее.
Место элемента в периодической системе
Йод находится в пятом периоде, VII группе и, наряду со фтором, хлором, бромом и астатом образует подгруппу галогенов. В связи с увеличением заряда ядра и атомного радиуса у представителей галогенов происходит ослабление неметаллических свойств, поэтому йод менее активен, чем хлор или бром, и его электроотрицательность также ниже. Атомная масса йода 126,9045. Простое вещество представлено двухатомными молекулами, как и у других галогенов. Ниже мы ознакомимся со строением атома элемента.
Особенности электронной формулы
Пять энергетических уровней и почти полностью заполненный электронами последний из них подтверждают наличие у элемента ярко выраженных признаков неметаллов. Как и другие галогены, йод является сильным окислителем, забирая у металлов и более слабых неметаллических элементов — серы, углерода, азота — недостающий до завершения пятого уровня электрон.
Йод — неметалл, в молекулах которого присутствует общая пара p-электронов, связывающая атомы между собой. Их плотность в месте перекрывания наибольшая, общее электронное облако не смещается ни к одному из атомов и располагается в центре молекулы. Формируется неполярная ковалентная связь, а сама молекула имеет линейную форму. В ряду галогенов, от фтора до астата, прочность ковалентной связи уменьшается. Наблюдается уменьшение величины энтальпии, от которой зависит распад молекул элемента на атомы. Какие же последствия для химических свойств йода это имеет?
Почему активность йода меньше, чем у других галогенов
Реакционная способность неметаллов определяется силой притягивания к ядру собственного атома чужих электронов. Чем меньше радиус атома, тем силы электростатического притяжения его отрицательно заряженных частиц других атомов выше. Чем выше номер периода, в котором расположен элемент, тем больше энергетических уровней он будет иметь. Йод находится в пятом периоде, и количество энергетических слоев у него больше, чем у брома, хлора и фтора. Именно поэтому молекула йода содержит атомы, имеющие радиус намного больше, чем у ранее перечисленных галогенов. Вот почему частицы I 2 слабее притягивают электроны, что приводит к ослаблению их неметаллических свойств. Внутреннее строение вещества неизбежно влияет и на его физические характеристики. Приведем конкретные примеры.
Сублимация и растворимость
Уменьшение взаимного притягивания атомов йода в его молекуле приводит, как мы говорили ранее, к ослаблению прочности ковалентной неполярной связи. Происходит снижение устойчивости соединения к высокой температуре и повышение показателя термической диссоциации его молекул. Отличительная черта галогена: переход вещества при нагревании из твердого состояния сразу в газообразное, т. е. сублимация — это главная физическая характеристика йода. Его растворимость в органических растворителях, например сероуглероде, бензоле, этаноле, выше, чем в воде. Так, в 100 г воды при 20 °С может раствориться всего 0,02 г вещества. Эту особенность в лаборатории применяют для извлечения йода из водного раствора. Взболтав его с небольшим количеством H 2 S, можно наблюдать фиолетовое окрашивание сероводорода вследствие перехода в него молекул галогена.
Химические свойства йода
Взаимодействуя с металлами, элемент ведет себя всегда одинаково. Он притягивает валентные электроны атома металла, которые располагаются либо на последнем энергетическом слое (s-элементы, такие как натрий, кальций, литий и т. д.), либо на предпоследнем слое, содержащем, например, d-электроны. К ним относятся железо, марганец, медь и другие. В этих реакциях металл будет восстановителем, а йод, химическая формула которого I 2 , — окислителем. Поэтому именно эта высокая активность простого вещества является причиной его взаимодействия со многими металлами.
Заслуживает внимания взаимодействие йода с водой при нагревании. В щелочной среде реакция проходит с образованием смеси йодидной и иодноватой кислот. Последнее вещество проявляет свойства сильной кислоты и при дегидратации превращается в пятиокись йода. Если же раствор подкислить, то вышеназванные продукты реакции взаимодействуют между собой с образованием исходных веществ — свободных молекул I 2 и воды. Данная реакция относится к окислительно-восстановительному типу, в ней проявляются химические свойства йода как сильного окислителя.
Качественная реакция на крахмал
Как в неорганической, так и в органической химии существует группа реакций, с помощью которых можно выявить в продуктах взаимодействия определенные виды простых или сложных ионов. Для обнаружения макромолекул сложного углевода — крахмала — часто применяют 5%-й спиртовой раствор I 2 . Например, на срез сырой картофелины капают несколько его капель, и окраска раствора становится синей. Такой же эффект мы наблюдаем при попадании вещества на любой крахмалосодержащий продукт. Эта реакция, в результате которой получается синий йод, широко применяется в органической химии для подтверждения присутствия полимера в исследуемой смеси.
О полезных свойствах продукта взаимодействия йода и крахмала известно давно. Его применяли в условиях отсутствия противомикробных медикаментозных препаратов для лечения диареи, язвы желудка в состоянии ремиссии, заболеваний дыхательной системы. Широкое распространение крахмальный клейстер, содержащий примерно 1 чайную ложку спиртового раствора йода на 200 мл воды, получил из-за дешевизны ингредиентов и простоты приготовления.
Однако нужно помнить, что синий йод противопоказан в терапии маленьких детей, людей, страдающих повышенной чувствительностью к йодосодержащим препаратам, а также больным базедовой болезнью.
Как неметаллы реагируют между собой
Среди элементов главной подгруппы VII группы с йодом вступает в реакцию фтор — самый активный неметалл, обладающий наивысшей степенью окисления. Процесс проходит на холоде и сопровождается взрывом. С водородом I 2 взаимодействует при сильном нагревании, причем не до конца, продукт реакции — HI — начинает разлагаться на исходные вещества. Йодоводородная кислота достаточно сильная и хоть по своим характеристикам похожа на хлоридную кислоту, все же проявляет более выраженные признаки восстановителя. Как видно, химические свойства йода обусловлены его принадлежностью к активным неметаллам, однако элемент уступает по окислительной способности брому, хлору и, конечно же, фтору.
Роль элемента в живых организмах
Наибольшее содержание ионов I — находится в тканях щитовидной железы, где они входят в состав тиреотропных гормонов: тироксина и трийодтиронина. Они регулируют рост и развитие костной ткани, проведение нервных импульсов, скорость обмена веществ. Особенно опасен недостаток йодсодержащих гормонов в детском возрасте, так как возможна задержка психического развития и появление симптомов такого заболевания, как кретинизм.
Недостаточная секреция тироксина у взрослых связана с в воде и продуктах питания. Она сопровождается выпадением волос, образованием отеков, снижением физической активности. Избыток элемента в организме также крайне опасен, так как развивается базедова болезнь, симптомы которой — возбудимость нервной системы, тремор конечностей, резкое исхудание.
Распространение йодидов в природе и способы получения чистого вещества
Основная масса элемента присутствует в живых организмах и оболочках Земли — гидросфере и литосфере — в связанном состоянии. Соли элемента есть в морской воде, но их концентрация незначительна, поэтому извлекать чистый йод из нее нерентабельно. Гораздо эффективнее получение вещества из золы бурых саргассума.
В промышленных масштабах I 2 выделяют из подземных вод в процессах добычи нефти. При переработке некоторых руд, например в ней встречаются иодаты и гипоиодаты калия, из которых в дальнейшем добывают чистый йод. Достаточно рентабельно получать I 2 из раствора йодоводорода, окисляя его хлором. Полученное соединение является важным сырьем для фармацевтической промышленности.
Кроме уже названного 5% спиртового раствора йода, содержащего не только простое вещество, но и соль — иодид калия, а также спирт и воду, в эндокринологии по медицинским показаниям применяют такие препараты, как «Йод-актив» и «Йодомарин».
В районах с низким содержанием природных соединений, кроме йодированной пищевой соли, можно использовать такое лечебное средство, как «Антиструмин». Он содержит действующее вещество — йодид калия — и рекомендуется в качестве профилактического препарата, применяемого для предотвращения симптомов эндемического зоба.
Морфологические и синтаксические свойства
йод (дореформ. іодъ)
Существительное, неодушевлённое, мужской род, 2-е склонение (тип склонения 1a по классификации А. А. Зализняка).
Существует два варианта написания: иод и йод. Первый вариант, стандартизованный решением ИЮПАК, используется в основном в химической литературе; в медицине и в быту употребителен второй вариант.
Корень: -йод- [Тихонов, 1996].
Произношение
- МФА: [jɵt]
Семантические свойства
Значение
- хим. химический элемент с атомным номером 53, обозначается химическим символом I, типичный неметалл из группы галогенов ◆ Поверхностные воды Чёрного моря содержат хлор, йод, бром, сульфаты, карбонаты, натрий, калий Елена Зенина, «Морская симфония», 15 марта 2001 г. // «Туризм и образование» [НКРЯ]
- простое вещество I2, в нормальных условиях — кристаллы чёрно-серого цвета с металлическим блеском ◆ Кроме того, галогенные лампы (бром и йод, которые подмешивают в газ, относятся к галогенам) можно делать совсем малюсенькими. Мария Русанова, «До лампочки», 2004 г. // «Парадокс» [НКРЯ]
- разг. то же, что йодная настойка; дезинфицирующее средство, водно-спиртовый раствор иода и иодида калия ◆ У меня и бинт, и йод, и спиртику флакончик есть. В. П. Астафьев, «Пролётный гусь», 2000 г. [НКРЯ]
- буква в семитских алфавитах (финикийский, еврейский, арабский) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- иод
- иод
- йодная настойка, раствор Люголя
- —
Антонимы
- —
- —
- —
- —
Гиперонимы
- галоген, неметалл, химический элемент
- простое вещество
- антисептик
- буква
Гипонимы
- —
- —
- —
- йуд, йа
Родственные слова
| Список всех слов с корнем иод | ||
|---|---|---|
|
Этимология
Происходит от франц. iode «иод», далее из др.-греч. ἰοειδής «похожий цветом на фиалку, тёмно-синий», далее из ἴον «фиалка», из праиндоевр. *wiy- «фиалка», + εἶδος «вид, внешность, образ», далее из εἴδω «видеть», далее из праиндоевр. *weide- «видеть».
Фразеологизмы и устойчивые сочетания
Перевод
Библиография
Смотреть также
Морфологические и синтаксические свойства
йод
Существительное, мужской род, склонение 1.
Корень: -йод-.
Произношение
Семантические свойства
Значение
- йод (аналогично русскому слову) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- —
Родственные слова
Этимология
Происходит от франц. iode «иод», далее из др.-греч. ἰοειδής «похожий цветом на фиалку, тёмно-синий», далее из ἴον «фиалка», из праиндоевр. *wiy- «фиалка», + εἶδος «вид, внешность, образ», далее из εἴδω «видеть», далее из праиндоевр. *weide- «видеть».
Фразеологизмы и устойчивые сочетания
Библиография
Морфологические и синтаксические свойства
| падеж | ед. ч. | мн. ч. |
|---|---|---|
| Им. | йо́д | *йо́ди |
| Р. | йо́ду | *йо́дів |
| Д. | йо́дові йо́ду |
*йо́дам |
| В. | йо́д | *йо́ди |
| Тв. | йо́дом | *йо́дами |
| М. | на/у йо́ді по йо́ду |
*на/у йо́дах |
| Зв. | йо́де* | *йо́ди* |
йод
Существительное, неодушевлённое, мужской род, 2-склонение (тип склонения 1a- по классификации А. А. Зализняка); формы мн. ч. не используются.
Корень: -йод-.
Произношение
- МФА: [ˈjɔd]
Семантические свойства
Значение
- йод (аналогично русскому слову) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- —
Родственные слова
Этимология
Происходит от франц. iode «иод», далее из др.-греч. ἰοειδής «похожий цветом на фиалку, тёмно-синий», далее из ἴον «фиалка», из праиндоевр. *wiy- «фиалка», + εἶδος «вид, внешность, образ», далее из εἴδω «видеть», далее из праиндоевр. *weide- «видеть».
Фразеологизмы и устойчивые сочетания
Библиография
Рады помочь вам узнать, как пишется слово «йод».
Пишите и говорите правильно.
Йод, свойства атома, химические и физические свойства.
I 53 Йод
126,90447(3) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5
Йод — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 53. Расположен в 17-й группе (по старой классификации — главной подгруппе седьмой группы), пятом периоде периодической системы.
Атом и молекула йода. Формула йода. Строение атома йода
Изотопы и модификации йода
Свойства йода (таблица): температура, плотность, давление и пр.
Физические свойства йода
Химические свойства йода. Взаимодействие йода. Химические реакции с йодом
Получение йода
Применение йода
Таблица химических элементов Д.И. Менделеева
Атом и молекула йода. Формула йода. Строение атома йода:
Йод (лат. Iodum, от греч. ἰώδης — «фиалковый (фиолетовый)») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением I и атомным номером 53. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), пятом периоде периодической системы.
Йод – неметалл. Относится к группе галогенов.
Йод обозначается символом I.
Как простое вещество йод при нормальных условиях представляет собой кристаллы чёрно-серого цвета с фиолетовым металлическим блеском. Йод легко образует фиолетовые пары, обладающие резким запахом.
Молекула йода двухатомна.
Химическая формула йода I2.
Электронная конфигурация атома йода 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5. Потенциал ионизации (первый электрон) атома йода равен 1008,39 кДж/моль (10,451260(25) эВ).
Строение атома йода. Атом йода состоит из положительно заряженного ядра (+53), вокруг которого по пяти оболочкам движутся 53 электрона. При этом 46 электронов находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку йод расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома йода на 5s-орбитали находятся два спаренных электрона, на 5p-орбитали – четыре спаренных и один неспаренный электрон. В свою очередь ядро атома йода состоит из 53 протонов и 74 нейтронов. Йод относится к элементам p-семейства.
Радиус атома йода (вычисленный) составляет 115 пм.
Атомная масса атома йода составляет 126,90447(3) а. е. м.
Йод – химически активный неметалл.
Изотопы и модификации йода:
Свойства йода (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Йод |
| 102 | Прежнее название | |
| 103 | Латинское название | Iodum |
| 104 | Английское название | Iodine |
| 105 | Символ | I |
| 106 | Атомный номер (номер в таблице) | 53 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Бернар Куртуа, Франция, 1811 г. |
| 110 | Год открытия | 1811 г. |
| 111 | Внешний вид и пр. | Кристаллы чёрно-серого цвета с фиолетовым металлическим блеском. Легко образует фиолетовые пары, обладающие резким запахом |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,000049 % |
| 120 | Содержание в морях и океанах (по массе) | 6,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,000025 % |
| 124 | Содержание в организме человека (по массе) | 0,00002 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 126,90447(3) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O7 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 115 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 139 пм |
| 207 | Радиус иона (кристаллический) | I–
206 (6) пм, I 5+ 109 (6) пм, I 7+ 67 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 198 пм |
| 209 | Электроны, Протоны, Нейтроны | 53 электрона, 53 протона, 74 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0, +1, +2, +3, +4, +5, +6, +7 |
| 302 | Валентность | I, III, V, VII |
| 303 | Электроотрицательность | 2,66 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1008,39 кДж/моль (10,451260(25) эВ) |
| 305 | Электродный потенциал | I2 + 2e– → 2I–, Eo = +0,536,
I3– + 2e– → 3I–, Eo = +0,545 |
| 306 | Энергия сродства атома к электрону | 295,1531(4) кДж/моль (3,0590465(37) эВ) – йод 127I,
295,154(4) кДж/моль (3,059052(38) эВ) – йод 128I |
| 400 | Физические свойства | |
| 401 | Плотность* | 4,933 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело)
4,866 г/см3 (при 60 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | 113,7 °C (386,85 K, 236,66 °F) |
| 403 | Температура кипения* | 184,3 °C (457,4 K, 363,7 °F) |
| 404 | Температура сублимации* | При нагревании при атмосферном давлении |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 15,52 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 41,57 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 54,44 Дж/(K·моль) |
| 411 | Молярный объём | 25,689 см³/моль |
| 412 | Теплопроводность | 0,449 Вт/(м·К) (при стандартных условиях),
0,45 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
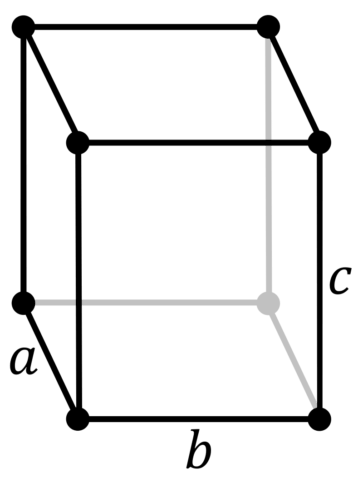
| 512 | Структура решётки | Орторомбическая
|
| 513 | Параметры решётки | a = 7,18 Å, b = 4,71 Å, c = 9,81 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Cmca |
| 517 | Номер пространственной группы симметрии | 64 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7553-56-2 |
Примечание:
205* Эмпирический радиус атома йода согласно [3] составляет 136 пм.
206* Ковалентный радиус йода согласно [1] и [3] составляет 139±3 пм и 133 пм соответственно.
401* Плотность йода согласно [3] и [4] составляет 4,93 г/см3 (при 25 °C и иных стандартных условиях, состояние вещества – твердое тело) и 4,94 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления йода согласно [3] и [4] составляет 113,5 °С (386,65 K, 236,3 °F) и 114 °С (387,15 K, 237,2 °F) соответственно. Жидкий йод согласно [3] можно получить, нагревая его под давлением.
403* Температура кипения йода согласно [3] и [4] составляет 184,35 °C (457,5 K, 363,83 °F) и 185,5 °С (458,65 K, 365,9 °F) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) йода согласно [3] составляет 41,95 кДж/моль.
Физические свойства йода:
Химические свойства йода. Взаимодействие йода. Химические реакции с йодом:
Получение йода:
Применение йода:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Iodine
- https://de.wikipedia.org/wiki/Iod
- https://ru.wikipedia.org/wiki/Иод
- http://chemister.ru/Database/properties.php?dbid=1&id=263
- https://chemicalstudy.ru/yod-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
йод атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле йода йод
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
3 942
История открытия
Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа и его отец собирали водоросли на побережьях Нормандии и Бретани во Франции. Затем они жгли их и смачивали пепел водорослей в воде, чтобы растворить соединения натрия и калия. Однажды в 1811 году Бернар добавил серную кислоту и увидел фиолетовые пары, которые конденсировались, образуя кристаллы с металлическим блеском. Куртуа догадался, что это был новый элемент, который он назвал в честь его цвета (на греческом языке слово «иодес» означает «фиолетовый»).
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:
- Название: Йод.
- Символ: I.
- Атомный номер: 53.
- Атомная масса: 126,90447 а. е. м.
- Температура плавления: 113,5 °C.
- Температура кипения: 184,0 °C.
- Электронная формула йода (Электронная конфигурация): 1s22s22p63s23p63d104s24p64d105s25p5.
- Строение атома: количество протонов — 53, электронов — 53, нейтронов — 74.
- Валентность переменная: -1, +1, (+3), (+4), +5, +7.
- Классификация: галоген.
- Кристаллическая структура: ромбическая.
- Плотность при 20°C: 4,93 г / см3.
- Цвет: чёрно-серый.
Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:
- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:
- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.
Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента
Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:
- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение
Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение
Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
Биологическая роль
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.
Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.
Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, получают необходимое количество для нормальной работы щитовидной железы.
Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
Йод
Йод (тривиальное (общеупотребительное) название — йод; от греч. ἰώδης — «фиалковый (фиолетовый)») — химический элемент с атомным номером 53. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в пятом периоде таблицы. Атомная масса элемента 126,90447 а. е. м.. Обозначается символом I (от лат. Iodum). Химически активный неметалл, относится к группе галогенов.
Простое вещество йод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Элементарный йод высокотоксичен. Молекула простого вещества двухатомна (формула I2).
|
|
|
| Название, символ, номер | Йод / Iodum (I), 53 |
|---|---|
| Атомная масса (молярная масса) |
126,90447(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Радиус атома | 136 пм |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
| Электроотрицательность | 2,66 (шкала Полинга) |
| Электродный потенциал | +0,535 В |
| Степени окисления | +7, +5, +3, +1, 0, −1 |
| Энергия ионизации (первый электрон) |
1008,3 (10,45) кДж/моль (эВ) |
| Плотность (при н. у.) | 4,93 г/см³ |
| Температура плавления | 113,5 °C |
| Температура кипения | 184,35 °C |
| Уд. теплота плавления | 15,52 (I—I) кДж/моль |
| Уд. теплота испарения | 41,95 (I—I) кДж/моль |
| Молярная теплоёмкость | 54,44 Дж/(K·моль) |
| Молярный объём | 25,7 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | a=7,18 b=4,71 c=9,81 |
| Отношение c/a | — |
| Теплопроводность | (300 K) (0,45) Вт/(м·К) |
| ГОСТ | ГОСТ 4159-79 ГОСТ 545-76 |
| Номер CAS | 7553-56-2 |
Содержание
- 1 Название и обозначение
- 2 История
- 3 Нахождение в природе
- 4 Физические свойства
- 4.1 Изотопы
- 5 Химические свойства
- 6 Применение
- 6.1 В медицине
- 6.2 В криминалистике
- 6.3 В технике: рафинирование металлов
- 6.3.1 Источники света
- 6.3.2 Производство аккумуляторов
- 6.3.3 Лазерный термоядерный синтез
- 6.3.4 Радиоэлектронная промышленность
- 6.4 Динамика потребления йода
- 7 Биологическая роль
- 7.1 Йод и щитовидная железа
- 7.2 Токсичность
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Нахождение в природе
Йод — редкий элемент. Его кларк — всего 400 мг/т. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода, например, чилийская Atacama Minerals производит свыше 720 тонн йода в год. Наиболее известный из минералов йода — лаутарит Ca(IO3)2. Некоторые другие минералы йода — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
Физические свойства
Жидкий йод на дне химического стакана
Природный йод состоит только из одного изотопа — йода-127 (см. Изотопы йода). Конфигурация внешнего электронного слоя — 5s2p5. В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома йода 0,136 нм, ионные радиусы I−, I5+ и I7+ равны, соответственно, 0,206; 0,058-0,109; 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома йода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность йода — 2,66, йод принадлежит к числу неметаллов.
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде (0,28 г/л), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.
Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅107 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ.
Химические свойства
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
-
- Hg + I2 → HgI2
- С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
-
- H2 + I2 → 2HI
- Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
-
- I2 + H2S → S + 2HI
-
- I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Последняя реакция также используется в аналитической химии для определения йода.
- При растворении в воде йод частично реагирует с ней (По «Началам Химии» Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
-
- I2 + H2O → HI + HIO , pKc=15,99
- Реакция образования нитрида трийода:
-
- 3I2 + 5NH3 → 3NH4I + NH3 ⋅ NI3↓
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
- Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
-
- KI + I2 → KI3
Применение
В медицине
5 % спиртовой раствор йода
«Раствор йода» ссылается сюда. На эту тему нужна отдельная статья.
Основная статья: Раствор Люголя
5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка, — йодом рисуется сетка на площади, в которую делаются инъекции (напр., на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода (125I, 132I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием йода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг.
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность
Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
|
Соединения йода |
|
|---|---|
| Оксиды |
|
| Галогениды и оксигалогениды |
|
| Кислоты |
|
| Прочие |
|
Характеристика иода
Положение в ПСХЭ
Иод (I) располагается в 5 периоде, в VII группе, главной подгруппе, имеет порядковый номер 53.
Атомные числа
A (массовое число) = 127
P (число протонов) = 53
N (число нейтронов) = A — Z = 127 — 53 = 74
ē (число электронов) = 53
Электронное строение атома
I
+53
2
8
18
18
7
53I 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5
Валентные электроны
| 53I | ↑↓ | ↑↓ | ↑↓ | ↑ | ||||||||
| 5s | 5p | 5d |
| 53I* | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | |||||||
| 5s | 5p | 5d |
| 53I** | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | ||||||
| 5s | 5p | 5d |
| 53I*** | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |||||
| 5s | 5p | 5d |
Степени окисления
минимальная: -1
максимальная: +7
Свойства простого вещества
Иод – p-элемент, неметалл.
Высший оксид
I2O7 – оксид иода (VII).
Проявляет кислотные свойства:
I2O7 + 2NaOH ⟶ 2NaIO4 + H2O
Высший гидроксид
HIO4 – иодная кислота.
Проявляет кислотные свойства:
HIO4 + NaOH ⟶ NaIO4 + H2O
Водородное соединение
HI
Содержание
- История
- Открытие
- Появление названия
- Историческое использование
- Физические и химические свойства
- вид
- Стандартный атомный вес
- Атомный номер (Z)
- Температура плавления
- Точка кипения
- Плотность
- Растворимость
- Запах
- Коэффициент разделения октанол / вода
- Разложение
- Вязкость
- Тройная точка
- Критическая точка
- Теплота плавления
- Теплота испарения
- Молярная калорийность
- Давление газа
- Числа окисления
- Электроотрицательность
- Энергия ионизации
- Теплопроводность
- Удельное электрическое сопротивление
- Магнитный заказ
- Реактивность
- Структура и электронная конфигурация
- — Атом йода и его связи
- — Кристаллы
- Расстояния связи
- — Фазы
- Где найти и получить
- Калише
- Рассол
- Биологическая роль
- — Рекомендуемая диета
- — Гормоны щитовидной железы
- Эффекты править
- — дефицит
- Риски
- Приложения
- Врачи
- Реакции и каталитическое действие
- Фотография и оптика
- Другое использование
- Ссылки
В йод Это реактивный неметаллический элемент, который принадлежит к группе 17 периодической таблицы (галогены) и представлен химическим символом I. По сути, это довольно популярный элемент, от йодированной воды до гормона тирозина.
В твердом состоянии йод темно-серый с металлическим блеском (нижнее изображение), способный при сублимации производить фиолетовый пар, который при конденсации на холодной поверхности оставляет темный осадок. Многочисленные и привлекательные эксперименты продемонстрировали эти характеристики.
Этот элемент был впервые выделен Бернаром Куртуа в 1811 году при получении соединений, которые служили сырьем для производства нитрата. Однако Куртуа не идентифицировал йод как элемент, заслуга, которую разделяют Джозеф Гей-Люссак и Хамфри Дэви. Гей-Люссак определил этот элемент как «iode» — термин, происходящий от греческого слова «ioides», которым обозначается фиолетовый цвет.
Элементарный йод, как и другие галогены, представляет собой двухатомную молекулу, состоящую из двух атомов йода, связанных ковалентной связью. Ван-дер-Ваальсово взаимодействие между молекулами йода — самое сильное среди галогенов. Это объясняет, почему йод является галогеном с самыми высокими температурами плавления и кипения. Кроме того, он наименее реакционноспособен из галогенов и имеет самую низкую электроотрицательность.
Йод — важный элемент, который необходимо принимать внутрь, так как он необходим для роста организма; мозг и умственное развитие; метаболизм в целом и т. д., рекомендуется ежедневная доза 110 мкг / день.
Дефицит йода у плода человека связан с появлением кретинизма, состояния, характеризующегося замедлением роста тела; а также недостаточное умственное и интеллектуальное развитие, косоглазие и др.
Между тем дефицит йода в любом возрасте у человека связан с появлением зоба, характеризующегося гипертрофией щитовидной железы. Зоб является эндемическим заболеванием, поскольку он ограничен определенными географическими районами со своими особенностями питания.
История
Открытие
Йод был открыт французским химиком Бернаром Куртуа в 1811 году, когда он работал со своим отцом над производством нитрата, для чего требовался карбонат натрия.
Это соединение было выделено из морских водорослей, собранных у берегов Нормандии и Бретани. С этой целью водоросли сжигали, а золу промывали водой, а полученные остатки уничтожали добавлением серной кислоты.
Однажды, возможно, по случайной ошибке, Куртуа добавил избыток серной кислоты, и образовался фиолетовый пар, который кристаллизовался на холодных поверхностях, оседая в виде темных кристаллов. Куртуа заподозрил, что он находится в присутствии нового элемента, и назвал его «Вещество X».
Куртуа обнаружил, что это вещество при смешивании с аммиаком образует коричневое твердое вещество (трииодид азота), которое взрывается при малейшем контакте.
Однако Куртуа был ограничен в продолжении своих исследований и решил передать образцы своего вещества Шарлю Десормсу, Николя Клеману, Жозефу Гей-Люссаку и Андре-Мари Амперу, чтобы добиться их сотрудничества.
Появление названия
В ноябре 1813 года Дезорм и Клеман обнародовали открытие Куртуа. В декабре того же года Гей-Люссак указал, что новое вещество может быть новым элементом, предложив название «iode» от греческого слова «ioides», обозначающего фиолетовый.
Сэр Хамфри Дэви, получивший часть образца, переданного Амперу Куртуа, экспериментировал с образцом и отметил сходство с хлором. В декабре 1813 года Лондонское королевское общество участвовало в выявлении нового элемента.
Хотя между Гей-Люссаком и Дэви возникла дискуссия об идентификации йода, они оба признали, что Кертуа был первым, кто выделил его. В 1839 году Кертуа наконец получил Премию Монтина от Королевской академии наук за признание выделения йода.
Историческое использование
В 1839 году Луи Дагер впервые применил йод в коммерческих целях, изобретя метод получения фотографических изображений, называемых дагерротипами, на тонких металлических листах.
В 1905 году североамериканский патолог Дэвид Марин исследовал дефицит йода при некоторых заболеваниях и рекомендовал его прием.
Физические и химические свойства
вид
Твердый темно-серый с металлическим блеском. При сублимации его пары имеют фиолетовый цвет (верхнее изображение).
Стандартный атомный вес
126,904 ед.
Атомный номер (Z)
53
Температура плавления
113,7 ºC
Точка кипения
184,3 ºC
Плотность
Температура окружающей среды: 4,933 г / см3
Растворимость
Он растворяется в воде с образованием коричневых растворов с концентрацией 0,03% при 20 ºC.
Эта растворимость значительно увеличивается, если присутствуют ранее растворенные иодид-ионы, поскольку между ионами I– и я2 с образованием анионных частиц I3–, который сольватируется лучше, чем йод.
В органических растворителях, таких как хлороформ, четыреххлористый углерод и сероуглерод, йод растворяется, давая пурпурный оттенок. Точно так же он растворяется в азотистых соединениях, таких как пиридин, хинолин и аммиак, снова с образованием коричневого раствора.
Разница в окраске заключается в том, что йод растворяется в виде сольватированных молекул I2, или как комплексы для перевалки грузов; последние появляются при работе с полярными растворителями (в том числе с водой), которые ведут себя как основания Льюиса, отдавая электроны йоду.
Запах
Острый, раздражающий и характерный. Порог запаха: 90 мг / м3 порог раздражающего запаха: 20 мг / м3.
Коэффициент разделения октанол / вода
Журнал P = 2,49
Разложение
При нагревании до разложения выделяет дым йодистого водорода и различных йодистых соединений.
Вязкость
2,27 сП при 116 ºC
Тройная точка
386,65 К и 121 кПа
Критическая точка
819 К и 11,7 МПа
Теплота плавления
15,52 кДж / моль
Теплота испарения
41,57 кДж / моль
Молярная калорийность
54,44 Дж / (моль К)
Давление газа
Йод имеет умеренное давление пара, и когда контейнер открывается, он медленно сублимируется до фиолетового пара, раздражающего глаза, нос и горло.
Числа окисления
Степени окисления йода: –1 (я–), +1 (I+), +3 (I3+), +4 (I4+), +5 (I5+), +6 (I6+) и +7 (I7+). Во всех иодидных солях, как и в случае KI, йод имеет степень окисления -1, так как в них мы имеем анион I–.
Йод приобретает положительную степень окисления, когда он соединяется с элементами более электроотрицательными, чем он; например, в его оксидах (I2ИЛИ5 и я4ИЛИ9) или интергалогенированные соединения (I-F, I-Cl и I-Br).
Электроотрицательность
2,66 по шкале Полинга
Энергия ионизации
Первая: 1008,4 кДж / моль
Второй: 1845 кДж / моль
Третий: 3180 кДж / моль
Теплопроводность
0,449 Вт / (м · К)
Удельное электрическое сопротивление
1,39·107 Ом · м при 0 ºC
Магнитный заказ
Диамагнитный
Реактивность
Йод соединяется с большинством металлов с образованием йодидов, а также неметаллических элементов, таких как фосфор и другие галогены. Иодид-ион — сильный восстановитель, самопроизвольно выделяющий электрон. Окисление йодида дает коричневатый оттенок йода.
Йод, в отличие от йодида, является слабым окислителем; слабее брома, хлора и фтора.
Йод со степенью окисления +1 может объединяться с другими галогенами со степенью окисления -1, давая галогениды йода; например: бромид йода, IBr. Точно так же он соединяется с водородом, образуя йодоводород, который после растворения в воде называется йодистоводородной кислотой.
Йодоводородная кислота — очень сильная кислота, способная образовывать йодиды при реакции с металлами или их оксидами, гидроксидами и карбонатами. Йод имеет степень окисления +5 в йодной кислоте (HIO3), который обезвоживается с образованием пятиокиси йода (I2ИЛИ5).
Структура и электронная конфигурация
— Атом йода и его связи
Йод в своем основном состоянии состоит из атома, который имеет семь валентных электронов, и только один из них может завершить свой октет и стать изоэлектронным с благородным газом ксеноном. Эти семь электронов расположены на своих 5s и 5p орбиталях в соответствии с их электронной конфигурацией:
[Kr] 4d10 5 с2 5 шт.5
Следовательно, атомы I демонстрируют сильную тенденцию к ковалентным связям, так что каждый индивидуально имеет восемь электронов на своей внешней оболочке. Таким образом, два атома I сближаются и образуют связь I-I, которая определяет двухатомную молекулу I2 (верхнее изображение); молекулярная единица йода в трех его физических состояниях при нормальных условиях.
На изображении показана молекула I2 представлен пространственной моделью заполнения. Это не только двухатомная молекула, но также гомоядерная и аполярная; поэтому их межмолекулярные взаимодействия (I2 — я2) регулируются лондонскими силами дисперсии, которые прямо пропорциональны их молекулярной массе и размеру атомов.
Однако эта связь I-I слабее по сравнению с другими галогенами (F-F, Cl-Cl и Br-Br). Теоретически это связано с плохим перекрытием их sp-гибридных орбиталей.3.
— Кристаллы
Молекулярная масса I2 позволяет его дисперсионным силам быть направленными и достаточно сильными, чтобы при атмосферном давлении образовался ромбический кристалл. Его высокое содержание электронов заставляет свет способствовать бесконечным энергетическим переходам, из-за чего кристаллы йода окрашиваются в черный цвет.
Однако, когда йод возгоняется, его пары приобретают фиолетовый цвет. Это уже свидетельствует о более специфическом переходе внутри молекулярных орбиталей I2 (с более высокой энергией или антисвязью).
Молекулы I показаны выше2, представленная моделью сфер и стержней, расположенных внутри орторомбической элементарной ячейки.
Видно, что есть два слоя: нижний с пятью молекулами и средний с четырьмя. Также обратите внимание, что молекула йода находится в основании клетки. Стекло создается путем периодического распределения этих слоев во всех трех измерениях.
При движении в направлении, параллельном связям I-I, обнаруживается, что орбитали йода перекрываются, образуя зону проводимости, которая делает этот элемент полупроводником; однако его способность проводить электричество исчезает, если следовать направлению, перпендикулярному слоям.
Расстояния связи
Связь I-I, кажется, расширилась; и на самом деле это так, поскольку длина его связи увеличивается с 266 мкм (газообразное состояние) до 272 мкм (твердое состояние).
Это может быть связано с тем, что в газе молекулы I2 они очень далеки друг от друга, их межмолекулярные силы почти несущественны; в твердом теле эти силы (I-I — I-I) становятся ощутимыми, притягивая атомы йода двух соседних молекул друг к другу и, следовательно, сокращая межмолекулярное расстояние (или межатомное расстояние, если смотреть иначе).
Затем, когда кристалл йода сублимируется, связь I-I сжимается в газовой фазе, поскольку соседние молекулы больше не оказывают одинаковой (дисперсионной) силы притяжения на свое окружение. А также, логично, расстояние I2 — я2 увеличивается.
— Фазы
Ранее упоминалось, что связь I-I слабее по сравнению с другими галогенами. В газовой фазе при температуре 575 ºC 1% молекул I2 они распадаются на отдельные атомы I. Тепловой энергии так много, что сразу два «я» снова соединяются, они разделяются и так далее.
Точно так же разрыв связи может произойти, если к кристаллам йода приложить огромное давление. Сжимая его слишком сильно (под давлением, в сотни тысяч раз превышающим атмосферное), молекулы I2 они перегруппировываются как одноатомная фаза I, и тогда говорят, что йод проявляет металлические свойства.
Однако существуют и другие кристаллические фазы, такие как: объемно-центрированная орторомбическая (фаза II), объемно-центрированная тетрагональная (фаза III) и гранецентрированная кубическая (фаза IV).
Где найти и получить
Весовое соотношение йода по отношению к земной коре составляет 0,46 частей на миллион, занимая 61-е место по содержанию в нем. Иодидные минералы встречаются в дефиците, и коммерчески доступные месторождения йода представляют собой йодаты.
Минералы йода обнаружены в магматических породах с концентрацией от 0,02 мг / кг до 1,2 мг / кг и в магматических породах с концентрацией от 0,02 до 1,9 мг / кг. Его также можно найти в сланцах Киммериджа в концентрации 17 мг / кг веса.
Кроме того, йодные минералы содержатся в фосфатных породах в концентрации от 0,8 до 130 мг / кг. В морской воде концентрация йода варьируется от 0,1 до 18 мкг / л. Ранее основными источниками йода были водоросли, губки и устрицы.
Однако в настоящее время основными источниками являются каличе, месторождения нитрата натрия в пустыне Атакама (Чили) и рассолы, главным образом из японского газового месторождения в Минами Канто, к востоку от Токио, и газового месторождения Анадарко. Бассейн в Оклахоме (США).
Калише
Йод извлекается из калише в виде йодата и обрабатывается бисульфитом натрия, чтобы восстановить его до йодида. Затем раствор реагирует со свежеэкстрагированным йодатом, чтобы облегчить его фильтрацию. Калише был основным источником йода в XIX и начале XX веков.
Рассол
После очистки рассол обрабатывают серной кислотой, в результате чего образуется йодид.
Этот раствор йодида впоследствии реагирует с хлором с образованием разбавленного раствора йода, который испаряется потоком воздуха, который направляется в абсорбционную колонну диоксида серы, вызывая следующую реакцию:
я2 + 2 часа2O + SO2 => 2 HI + H2ЮЗ4
Впоследствии газообразный йодистый водород реагирует с хлором с высвобождением йода в газообразном состоянии:
2 HI + Cl2 => Я2 + 2 HCl
И, наконец, йод фильтруется, очищается и упаковывается для использования.
Биологическая роль
— Рекомендуемая диета
Йод является важным элементом, поскольку он участвует в многочисленных функциях живых существ, которые особенно известны людям. Йод может попасть в человека только через пищу, которую он ест.
Рекомендуемая йодная диета зависит от возраста. Таким образом, ребенку в возрасте 6 месяцев требуется потребление 110 мкг в день; но с 14 лет рекомендуемая диета составляет 150 мкг / день. Кроме того, указано, что потребление йода не должно превышать 1100 мкг / день.
— Гормоны щитовидной железы
Тиреоидостимулирующий гормон (ТТГ) секретируется гипофизом и стимулирует поглощение йода фолликулами щитовидной железы. Йод переносится в фолликулы щитовидной железы, известные как коллоиды, где он связывается с аминокислотой тирозином с образованием монойодтирозина и дииодтирозина.
В фолликулярном коллоиде молекула монойодтиронина соединяется с молекулой дийодтиронина с образованием молекулы, называемой трийодтиронином (T3). С другой стороны, две молекулы дииодтирозина могут соединяться, образуя тетрайодтиронин (T4). Т3 и T4 их называют гормонами щитовидной железы.
Т-гормоны3 и т4 они секретируются в плазму, где связываются с белками плазмы; включая белок транспортера гормонов щитовидной железы (TBG). Большинство гормонов щитовидной железы транспортируются в плазме в виде Т4.
Однако активной формой гормонов щитовидной железы является Т3, поэтому T4 в «белых органах» гормонов щитовидной железы подвергается дейодированию и превращается в Т3 оказывать гормональное действие.
Эффекты править
Эффекты действия гормонов щитовидной железы многочисленны, из них можно указать: усиление метаболизма и синтеза белка; содействие росту тела и развитию мозга; повышение артериального давления и пульса и др.
— дефицит
Дефицит йода и, следовательно, гормонов щитовидной железы, известный как гипотиреоз, имеет многочисленные последствия, которые зависят от возраста человека.
Если дефицит йода возникает во время плода человека, наиболее важным последствием является кретинизм. Это состояние характеризуется такими признаками, как нарушение психической функции, задержка физического развития, косоглазие и задержка полового созревания.
Дефицит йода может вызвать зоб вне зависимости от возраста, в котором возникает дефицит. Зоб — это чрезмерное развитие щитовидной железы, вызванное чрезмерной стимуляцией железы гормоном ТТГ, выделяемым гипофизом в результате дефицита йода.
Чрезмерный размер щитовидной железы (зоб) может сдавливать трахею, ограничивая прохождение через нее воздуха. Кроме того, это может вызвать повреждение гортанных нервов, что может привести к охриплости голоса.
Риски
Отравление от чрезмерного употребления йода может вызвать ожоги рта, горла и жар. Также боль в животе, тошнота, рвота, диарея, слабый пульс и кома.
Избыток йода вызывает некоторые из симптомов, наблюдаемых при его дефиците: происходит подавление синтеза гормонов щитовидной железы, что увеличивает высвобождение ТТГ, что приводит к гипертрофии щитовидной железы; то есть зоб.
Есть исследования, которые показывают, что чрезмерное потребление йода может вызвать тиреоидит и папиллярный рак щитовидной железы. Кроме того, чрезмерное потребление йода может взаимодействовать с лекарствами, ограничивая их действие.
Чрезмерное потребление йода в сочетании с антитиреоидными препаратами, такими как метимазол, используемыми для лечения гипертиреоза, может иметь аддитивный эффект и вызывать гипотиреоз.
Ингибиторы ангиотензинпревращающего фермента (АПФ), такие как беназеприл, используются для лечения гипертонии. Прием чрезмерного количества йодида калия увеличивает риск гиперкалиемии и гипертонии.
Приложения
Врачи
Йод действует как дезинфицирующее средство для кожи или ран. Он обладает почти мгновенным антимикробным действием, проникая внутрь микроорганизмов и взаимодействуя с серными аминокислотами, нуклеотидами и жирными кислотами, что вызывает гибель клеток.
Он оказывает свое противовирусное действие в основном на покрытые вирусы, постулируя, что он атакует белки на поверхности покрытых вирусов.
Йодид калия в виде концентрированного раствора применяется при лечении тиреотоксикоза. Он также используется для контроля воздействия излучения от 131I, блокируя связывание радиоактивного изотопа с щитовидной железой.
Йод используется при лечении дендритного кератита. Для этого роговица подвергается воздействию водяных паров, насыщенных йодом, временно теряя эпителий роговицы; но есть полное выздоровление от него за два-три дня.
Также йод оказывает благотворное влияние при лечении муковисцидоза груди человека. Аналогичным образом было указано, что 131Я мог бы пройти дополнительное лечение рака щитовидной железы.
Реакции и каталитическое действие
Йод используется для обнаружения крахмала, придающего голубой оттенок. Реакция йода с крахмалом также используется для обнаружения поддельных банкнот, напечатанных на бумаге, содержащей крахмал.
Тетраиодомеркурат калия (II), также известный как реактив Несслера, используется для обнаружения аммиака. Кроме того, в йодоформном тесте используется щелочной раствор йода, чтобы показать присутствие метилкетонов.
Неорганические йодиды используются для очистки металлов, таких как титан, цирконий, гафний и торий. На одной стадии процесса должны образоваться тетраиодиды этих металлов.
Йод служит стабилизатором канифоли, масла и других изделий из дерева.
Йод используется в качестве катализатора в реакциях органического синтеза метилирования, изомеризации и дегидрирования. Между тем йодистоводородная кислота используется в качестве катализатора для производства уксусной кислоты в процессах Monsanto и Cativa.
Йод действует как катализатор в процессах конденсации и алкилирования ароматических аминов, а также в процессах сульфатирования и сульфатирования, а также в производстве синтетических каучуков.
Фотография и оптика
Иодид серебра является важным компонентом традиционной фотопленки. Йод используется в производстве электронных инструментов, таких как монокристаллические призмы, поляризационные оптические инструменты и стекло, способное передавать инфракрасные лучи.
Другое использование
Йод используется в производстве пестицидов, анилиновых красителей и фталеина. Кроме того, он используется в синтезе красителей и является средством тушения дыма. И, наконец, йодид серебра служит ядром конденсации водяного пара в облаках, чтобы вызвать дождь.
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Стюарт Ира Фокс. (2003). Физиология человека. Первое издание. Редактировать. McGraw-Hill Interamericana
- Википедия. (2019). Йод. Получено с: en.wikipedia.org
- Такемура Кеничи, Сато Киоко, Фуджихиса Хироши и Онода Мицуко. (2003). Модулированная структура твердого йода при его молекулярной диссоциации под высоким давлением. Том 423, страницы 971–974. doi.org/10.1038/nature01724
- Chen L. et al. (1994). Структурные фазовые переходы йода при высоком давлении. Институт физики, Academia Sinica, Пекин. doi.org/10.1088/0256-307X/11/2/010
- Стефан Шнайдер и Карл Кристе. (26 августа 2019 г.). Йод. Encyclopdia Britannica. Получено с: britannica.com
- Доктор Дуг Стюарт. (2019). Факты об элементе йода. Chemicool. Получено с: chemicool.com
- Национальный центр биотехнологической информации. (2019). Йод. База данных PubChem. CID = 807. Получено с: pubchem.ncbi.nlm.nih.gov
- Ронер, Ф., Циммерманн, М., Йосте, П., Пандав, К., Колдуэлл, К., Рагхаван, Р., и Райтен, Д. Дж. (2014). Биомаркеры питания для развития — йодный обзор. Журнал питания, 144 (8), 1322S-1342S. DOI: 10.3945 / jn.113.181974
- Адвамег. (2019). Йод. Объяснение химии. Получено с: chemistryexplained.com
- Трэйси Педерсен. (19 апреля 2017 г.). Факты о йоде. Получено с: livescience.com
- Меган Уэр, RDN, LD. (30 мая 2017 г.). Все, что вам нужно знать о йоде. Получено с: medicalnewstoday.com
- Национальный институт здоровья. (9 июля 2019 г.). Йод. Получено с: ods.od.nih.gov
химический элемент с атомным номером 53
Химический элемент с атомным номером 53
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Йод | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | () | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | блестящий серый металлик, фиолетовый, как газ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (I) | 126.90447 (3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Йод в Мен таблицаделеева | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 53 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 17 (галогены) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | p-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Реактивный неметалл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Kr ] 4d 5s 5p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 18, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза в STP | твердое тело | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | (I2) 386,85 K (113, 7 ° C, 236,66 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | (I2) 457,4 K (184,3 ° C, 363,7 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около rt ) | 4,933 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тройная точка | 386,65 K, 12,1 кПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Критическая точка | 819 K, 11,7 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | (I2) 15, 52 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | (I2) 41,57 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | (I2) 54,44 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Пар давление (ромбическое)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | −1, +1, +3, +4, +5, + 6, +7 (сильно кислый оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 2,66 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 139 ± 3 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ван-дер-Ваальс радиус | 198 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | исконное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | орторомбическая  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 0,449 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 1,3 × 10 Ом · м (при 0 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | диамагнитный | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | -88,7 · 10 см / моль (298 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 7,7 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7553-56-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дискавери и первая изоляция | Бернар Куртуа (1811) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы йода | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Йод — это химический элемент с символом Iи атомным номером 53. Самый тяжелый из стабильных галогенов, он существует в виде блестящего пурпурно-черного неметаллического твердого вещества при стандартных условиях, которое плавится с образованием темно-фиолетовой жидкости при 114 градусах Цельсия., и закипает до фиолетового газа при 184 градусах Цельсия. Он легко возвышается с помощью нежного тепла, что привело к широко распространенному заблуждению, которое учат в некоторых учебниках естественных наук, что он не плавится. Этот элемент был открыт французским химиком Бернаром Куртуа в 1811 году и был назван двумя годами позже Жозефом Луи Гей-Люссаком в честь греческого ἰώδης «фиолетовый». -крашенный «.
Йод присутствует во многих степенях окисления, включая йодид (I), йодат (IO. 3) и различные анионы периодата. Это самое тяжелое и незаменимое минеральное питательное вещество, являющееся распространенным из стабильных галогенов, являющееся шестидесяти первым. 247>. Дефицит йода исследует около двух миллиардов человек и является ведущей предотвращенной причиной умственной отсталости.
Основные производители йода сегодня это Чили и Япония. Йод и его соединения в основном используются в питании. Благодаря высокому атомному номеру и простоте присоединения к органическим соединениям он также пользуется популярностью как нетоксичный радиоконтрастный из-за специфики его абсорбционный человеческий организм радиоактивные изотопы йода такж е могут для лечения рака щитовидной железы. Йод также используется в катализатора при промышленном производстве уксусной кислоты и некоторых полимеров.
Содержание
- 1 История
- 2 Свойства
- 2.1 Изотопы
- 3 Химия и соединения
- 3.1 Комплексы с переносом заряда
- 3.2 Йодистый водород
- 3.3 Другие бинарные иодиды
- 3.4 Галогениды йода
- 3.5 Оксиды и оксокислоты йода
- 3.6 Полийодиновые соединения
- 3, 7 Йодорганические соединения
- 4 Возникновение и производство
- 5 Области применения
- 5.1 Химический анализ
- 5.2 Спектроскопия
- 5.3 Медицина
- 5.3.1 Элементный йод
- 5.3.2 Другие составы
- 5.4 Другое
- 6 Биологическая роль
- 6.1 Прием пищи
- 6.2 Дефицит
- 7 Меры предосторожности
- 7.1 Токсичность
- 7.1.1 Профессиональное воздействие
- 7.1.2 Аллергические реакции
- 7.2 Статус списка I Управления по борьбе с наркотиками США
- 7.1 Токсичность
- 8 Ссылки
- 9 Библиография
История
В 1811 году йод был открыт французским химиком Бернаром Куртуа, который родился у производителя из селитры (эссенция 1 компонент пороха ). Во время наполеоновских войн селитра пользовалась большим спросом во Франции. Для производства селитры из французских пластов селитры требовался карбонат натрия, который можно было выделить из морских водорослей, собранных на побережьех Нормандии и Бретань. Чтобы карбонат натрия, водоросли сжигали, а золу промывали водой. Оставшиеся отходы были уничтожены добавлением серной кислоты. Куртуа однажды добавил слишком много серной кислоты, и поднялось облако пурпурного пара. Он отметил, что пар кристаллизовался на холодных поверхностях, образуя темные кристаллы. Куртуа подозревал, что этот материал является новым, но ему не хватало средств для его дальнейшего развития.
Куртуа образцов дал своим друзьям, Шарлю Бернару Десорму (1777–1838) и Николя Клеман. (1779–1841), чтобы продолжить исследования. Он также дал некоторое количество вещества химику Жозефу Луи Гей-Люссаку (1778–1850) и физику Андре-Мари Амперу (1775– 1836 г.). 29 ноября 1813 года Десорм и Клеман обнародовали открытие Куртуа. Они описали это вещество на собрании Имперского Франции. 6 декабря Гей-Люссакил, что новое вещество представляет собой элемент или соединение кислорода. Именно Гей-Люссак использует название «иод» от греческого слова οειδής (ioeidēs), означающего фиолетовый (из-за цвета паров йода). Ампер передал часть своего образца английскому химику Хамфри Дэви (1778–1829), который экспериментировал с веществом и отметил его сходство с хлором. Дэви отправил письмо от 10 декабря в Лондонское королевское общество, в котором говорилось, что он обнаружил новый элемент. Между Дэви и Гей-Люссаком разгорелись споры о том, кто первым идентифицировал йод, но оба ученыхли Куртуа первым, кто выделил этот элемент.
Антонио Гроссих (1849–1926), хирург истрийского происхождения, был среди них. первым использовать стерилизацию операционного поля. В 1908 году он представил настойку как способ быстрой стерилизации кожи человека в операционном.
В ранних периодических таблицах йоду часто давали символ J, вместо Jod, его название на немецком языке.
Свойства

Йод — четвертый галоген, входящий в группу 17 в периодической таблице, ниже фтор, хлор и бром ; это самый тяжелый стабильный член своей группы (дефицитный и летучий пятый галоген, радиоактивный астат, плохо изучен из-за его дороговизны и недоступности в больших количествах, но, кажется, проявляет различные необычные свойства из-за к релятивистским эффектом ). Йод имеет электронную конфигурацию [Kr] 4d5s5p, причем семь электронов в пятой и самой внешней оболочке являются его валентными электронами. Как и другие галогены, он на один электрон меньше полного октета и, следовательно, является сильным окислителем, реагируя со многими элементами, чтобы завершить свою внешнюю оболочку, в соответствии с периодическими тенденциями, это самый слабый окислитель среди стабильных галогенов: у него самая низкая электроотрицательность среди них, всего 2,66 по шкале Полинга (сравните фтор, хлор и бром с 3,98, 3,16 и 2,96 соответственно; астат продолжает тенденцию с электроотрицательность 2, 2). Следовательно, элементарный йод образует двухатомные молекулы с химической формулой I 2, где два атома йода общую пару электронов, чтобы каждый из них достиг стабильного октета для себя; при высоких температурах эти двухатомные молекулы обратимо диссоциируют пары атомов йода. Точно так же иодид-анион является самым сильным восстанавливающим агентом среди стабильных галогенов, является наиболее легко окисляемым до двухатомного I 2. (Астатин идет дальше, является действительно нестабильным как At и легко окисляется до At или At, хотя существует At 2 не установлено.)
Галогены темнеют по цвету, поскольку группа произошли: фтор — очень бледно-желтый газ, хлор — зеленовато-желтый, а бром — красновато-коричневая летучая жидкость. Представляет собой блестящее черное кристаллическое твердое вещество, которое плавится при 114 ° C и кипит при 183 ° C с образованием фиолетового газа. Эта тенденция из-за того, что прогрессивное волнение видимого света, увеличивается в группе, достигнутое сравнимым галогенами (хотя эта тенденция может не соответствовать ему, в зависимости от того, насколько металлическим он показывает). В частности, фиолетовый цвет газообразного йода является результатом электронного перехода между самой высокой занятой разрыхляющей π g молекулярной орбиталью и самой низкой вакантной разрыхляющей связью σ u. молекулярная орбиталь.
Элементарный йод слабо растворим в воде, один грамм растворяется в 3450 мл при 20 ° C и 1280 мл при 50 ° C; йодид калия может быть добавлен для увеличения растворимости за счет образования первой трииодида, среди других полииодидов. Неполярные растворители, такие как гексан и четыреххлористый углерод, более высокая либераримость. Полярные растворы, такие как водные растворы, имеют коричневый цвет, что отражает роль этих растворителей как основ Льюиса ; с другой стороны, неполярные растворы имеют фиолетовый цвет, цвет паров йода. Комплексы с переносом заряда образуются, когда йод растворяется в полярных растворителях, что приводит к изменению цвета. Йод имеет фиолетовый цвет при растворении в четыреххлористом углероде, но темно-коричневый цвет в спиртах и аминах, растворителях, которые образуют аддукты с переносом заряда.

Точки плавления и кипения являются самыми высокими среди галогенов, что соответствует возрастающей тенденции по группе, поскольку йод имеет самое большое среди них электронное облако, которое легче всего поляризуется, в результате чего его молекулы имеют самые сильные ван-дер-ваальсовы взаимодействия среди галогенов. Точно так же йод является наименее летучим из галогенов. Атомный радиус среди галогенов, йод имеет самую низкую энергию первой ионизации, самое низкое сродство к электрону, самую низкую электроотрицательность и самая низкая реакционная способность галогенов.

Межгалогенная связь в дийоде является самой слабой из всех галогенов. Таким образом, 1% образца газообразного йода при атмосферном давлении диссоциирует на атомы йода при 575 ° C. Для аналогичной диссоциации фтора, хлора и брома требуются температуры выше 750 ° C. Большинство связей с йодом слабее, чем аналогичные связи с более легкими галогенами. Газообразный йод состоит из молекулы I 2 с длиной связи I — I 266,6 пм. Связь I — I — одна из самых длинных известных одинарных связей. Он даже длиннее (271,5 мкм) в твердом ромбическом кристаллическом йоде, который имеет ту же кристаллическую структуру, что и хлор и бром. (Рекорд принадлежит соседу йода ксенону : длина связи Xe — Xe составляет 308,71 пм.) Такимобразом, внутри молекулы йода происходят основные электронные взаимодействия с двумя соседями каждого атома, и эти взаимодействия приводят к появлению в объеме йода блестящего внешнего вида и полупроводниковых свойств. Йод — это двумерный полупроводник с шириной запрещенной зоны 1,3 эВ (125 кДж / моль): это полупроводник в плоскости своих кристаллических слоев и изолятор в перпендикулярном направлении.
Изотопы
Из тридцати семи известных изотопов йода только один встречается в природе — йод-127. Остальные радиоактивны, и их период полураспада слишком короткий, чтобы быть изначальным. Таким образом, йод является как моноизотопным, так и мононуклидным, и его атомный вес известен с большой точностью, поскольку он является константой природы.
Самый долгоживущий из радиоактивным изотопом йода является йод-129, период полураспада которого составляет 15,7 миллионов лет, распадающийся посредством бета-распада до стабильного ксенона -129. Некоторое количество йода-129 образовалось вместе с йодом-127 для образования Солнечной системы, но к настоящему времени он полностью распался, что сделало его потухшим радионуклидом, тем не менее, по-прежнему полезен для датировки истории ранней Солнечная система или очень старые грунтовые воды из-за их подвижности в окружающей среде. Его прежнее присутствие можно определить по избытку его дочернего ксенона-129. Следы йода-129 все еще существуют сегодня, так как это также космогенный нуклид, образованный расщеплением космическими лучами атмосферного ксенона: эти следы составляют от 10 до 10 всего земного йода. Это также происходит в результате ядерных испытаний на открытом воздухе и не представляет опасности из-за невероятно длительного периода полураспада, самого длинного из всех продуктов деления. На пике термоядерных испытаний в 1960-х и 1970-х годах йод-129 все еще составлял только около 10 всего йода на Земле. Возбужденные состояния йода-127 и йода-129 часто используются в мессбауэровской спектроскопии.
. У других радиоизотопов йода период полураспада намного короче, не более суток. У некоторых из них есть медицинские применения, связанные с щитовидной железой, где йод, поступающий в организм, накапливается и концентрируется. Йод-123 имеет период полураспада тринадцать часов и распадается в результате захвата электрона до теллура-123, испуская гамма-излучение ; он используется в ядерной медицине визуализации, включая однофотонную эмиссионную компьютерную томографию (SPECT) и рентгеновскую компьютерную томографию (X-Ray CT) сканирование. Йод-125 имеет период полураспада пятьдесят девять дней, распадается за счет захвата электронов до теллура-125 и испускает гамма-излучение низкой энергии; второй по продолжительности жизни радиоизотоп йода, он используется в биологических анализах, ядерной медицине визуализации и в лучевой терапии в брахитерапии для лечат ряд состояния, включая рак простаты, увеальную меланому и опухоли головного мозга. Наконец, йод-131 с периодом полураспада восемь дней, бета-распад до возбужденного состояния стабильного ксенона-131, который преобразуется в собственное состояние путем испускания гамма-излучения. Это обычный продукт деления, поэтому он присутствует в больших количествах в радиоактивных выпадающих осадках. Затем он может абсорбироваться через зараженную пищу, а также накапливаться в щитовидной железе. По мере разложения он может повредить щитовидную железу. Первичный риск от воздействия высоких уровней йода-131 — это вероятность возникновения радиогенного рака щитовидной железы в более позднем возрасте. Другие риски включают в себя незлокачественные новообразования и тиреоидит <1168 негатив>Обычным средством защиты от возможности йода-131 обеспечивает насыщение щитовидной железы стабильной йодом-127 в форме калия. йодид таблеток, принимаемых ежедневно для оптимальной профилактики. Однако йод-131 может также использоваться в медицинских целях в лучевой терапии именно по этой причине, когда желательно разрушение ткани после поглощения йода тканью. Йод-131 также используется в качестве радиоактивного индикатора.
Химия и соединения
| X | XX | HX | BX3 | AlX 3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
Хотя это наименее реактивный из стабильных галогенов, йод по-прежнему является одним из наиболее реактивных элементов. Например,органические производные иодид-аниона. Простей йодорганические соединения, алкилйодиды, могут быть синтезированы взаимодействием спиртов с трииодидом фосфора ; затем их можно использовать в реакциях нуклеофильного зазора или для приготовления реагентов Гриньяра. Связь C — I является самой слабой из всех связей — галоген из-за незначительной разницы в электроотрицательности между углеродом (2,55) и йодом (2,66). По существу, йодид является наилучшей уходящей группой 247>среди галогенов до такой степени, что многие йодорганические соединения желтеют при хранении с течением времени из-за разложения на элементарный йод; как таковые, они обычно используются в органический синтезе из-за легкого образования и другие разрыва связи C — I. Они также значительно плотнее, чем галогенорганические соединения, благодаря высокому атомному весу йода. Некоторые органические окислители, такие как йоданы, содержат йод с более высокой степенью окисления, чем -1, 2-йодоксибензойная кислота, обычный реагент для окисления спиртов до альдегиды и йодбензолдихлорид (PhICl 2), используемый для селективного хлорирования алкенов и алкинов. Одним из наиболее известных применений йодорганических соединений является так называемый йодоформный тест, где йодоформ (CHI 3) получают путем исчерпывающего йодирования метилкетон ( или другое соединение, способное окисляться до метилкетона), как указано ниже:
Некоторыми недостатками использования йодорганических соединений по сравнению с хлорорганическими или броморганическими соединениями является большая стоимость и токсичность производных йода, поскольку йод стоит дорого, а йодорганические соединения являются более сильными алкилирующими агентами. Например, йодацетамид и йодауксусная кислота денатурируют белки путем необратимого алкилирования остатков цистеина и предотвращения реформирования дисульфидных связей.
Обмен галогенов для получения йодалканов по реакции Финкельштейна несколько осложняется тем фактом, что йодид является более уходящей группой, чем хлорид или бромид. Разница, тем не менее, достаточно мала, чтобы реакция могла быть до завершения, используя различную растворимость галогенидных солей или используя большой избыток галогенидной соли. В классической реакции Финкельштейна алкилхлорид или алкилбромид превращается в алкилйодид путем обработки раствора йодида натрия в ацетоне. Иодид натрия растворим в ацетоне, а хлорид натрия и бромид натрия — нет. Реакция направляется к продуктам под массы из-за осаждения нерастворимой соли.
Возникновение и образование
Йод является обозначенным распространенным из стабильных галогенов, включая всего 0,46 частей на миллион пород земной коры (сравните: фтор 544 частей на миллион, хлор 126 частей на миллион, бром 2,5 частей на миллион). Среди 84 элементов, которые встречаются в значительных количествах (элементы 1–42, 44–60, 62–83 и 90–92), он занимает 61-е место по содержанию. Йодидные минералы встречаются редко, большинство месторождений, которые достаточно сконцентрированы для рентабельной добычи, представляют собой минералы йодата. Примеры включают лаутарит, Ca (IO 3)2и 7Ca (IO 3)2· 8CaCrO 4. Это минералы, которые присутствуют в виде микропримесей в калише , могут найденный в Чили, основным продуктом которого является нитрат натрия. В целом они содержат не менее 0,02% и не более 1% йода по массе. Натрий иодат экстрагируется из калише и восстанавливается до йодида с помощью бисульфита натрия. Этот раствор реагирует соэкстрагированным йодатом, в результате чего образуется йод, может быть отфильтрован.
Калиша был основным йодом в 19 века и продолжает оставаться незаменимый сегодня, заменяя водоросль (которая больше является экономически жизнеспособным источником), но в конце 20-го века рассолы появились в качестве сопоставимого источника.>Минами Канто к востоку от Токио и американское газовое месторождение Бассейн Ана дарко на северо-западе Оклахома два наших источника. горячее, чем 60 ° C на глубине источника. рассол сначала очищают и подкисляют серной кислотой, присутствующий йодид окисляют до йода с помощью хлора. Производится раствор йода, но он разбавленный и должен быть сконцентрирован. В раствор вдувают воздух для испарения йода, который направляет в абсорбционную башню, где диоксид серы восстанавливает йод. Иодид водорода (HI) реагирует с хлором с осаждением иода. После фильтрации и очистки йод упаковывается.
- 2 HI + Cl 2 → I 2 ↑ + 2 HCl
- I2+ 2 H 2 O + SO 2 → 2 HI + H 2SO4
- 2 HI + Cl 2 → I 2 ↓ + 2 HCl
Эти источники гарантируют, что Чили и Сегодня Япония — крупнейшие производители йода. В качестве альтернативы, рассол можно обработать нитратом серебра для осаждения йода в виде иодида серебра, который разлагается реакцией с железом с образованием металлического серебра и раствора железа. (II) иодид. Затем йод может быть высвобожден путем замещения с помощью хлора.
Применения
Около половины всего произведенного йода переходит в различные йодорганические соединения, еще 15% остается в виде чистого элемента, еще 15% используется для образуют йодид калия и 15% для других неорганических соединений йода. Основных среди применений соединений йода — катализаторы, кормовые добавки для животных, стабилизаторы, красители, красители и пигменты, фармацевтика, санитария (от настойка йода ) и фотография; второстепенные применения подавления смога, засев облаков и применения в аналитической химии.
Химический анализ

Йодид и йодат анионы часто используются для количественного объемного анализа, например, в иодометрии. Йод и крахмал образуют комплекс синего цвета, и эту реакцию используют для проверки на крахмал или йод и в качестве индикатора в иодометрии. Йодный тест на крахмал по-прежнему используется для обнаружения поддельных банкнот, напечатанных на крахмалосодержащей бумаге.
йодное число — это масса потребленного йода в граммах на 100 граммов химического вещества, обычно жиров или масел. Йодные числа часто используются для определения степени ненасыщенности в жирных кислотах. Эта ненасыщенность находится в форме двойных связей, которые реагируют с соединениями йода. В биологии линолевая кислота (C18: 2 n-6), омега-6 и альфа-линоленовая (C18: 3 n-3) омега-3, арахидоновая кислота (AA) — омега-6 (C20: 4n-6) и докозагексаеновая кислота (DHA) — омега-3 (C22: 6n -3) синтезируется с йодом, образовавшимся среди клеточных мембран в эволюции жизни, играет роль в механизме апоптоза, канцерогенеза и дегенеративных заболеваний.
Тетраиодомеркурат калия (II), K 2 HgI 4, также известен как реагент Несслера. Его часто используют в качестве чувствительного точечного теста на аммиак. Аналогично, Cu 2 HgI 4 используется в качестве осаждающего реагента для тестирования алкалоидов. Водный щелочной раствор йода используется в йодоформном тесте на метилкетоны.
Спектроскопия
Спектры молекулы йода I 2 состоят (не исключительно) из десятков тысяч четких спектральных линий в диапазоне длин волн 500–700 нм. Поэтому это обычно используется эталон длины волны (вторичный эталон). При измерении с помощью спектроскопического бездоплеровского метода с фокусировкой на одной из этих линий выявляется сверхтонкая структура молекулы йода. Линия теперь разрешается так, что можно измерить либо 15 компонентов (из четных вращательных квантовых чисел, J, даже), либо 21 компонент (из нечетных вращательных квантовых чисел, J нечетных).
Иодид цезия и йодид натрия, активированный таллием, используются в кристаллических сцинтилляторах для обнаружения гамма-лучей. Эффективность высокая и возможна энергодисперсионная спектроскопия, но разрешение довольно низкое.
Медицина
Элементарный йод
Элементарный йод используется в качестве дезинфицирующего средства либо как элемент, либо как водорастворимый трийодид он I 3 создается in situ путем добавления йодида к плохо растворимому в элементарному йоду (обратная химическая реакция делает некоторое количество свободного водного элемента йода доступным для антисептики). Элементарный йод также может быть использован для лечения йодной недостаточности.
. В качестве альтернативы йод может быть получен из йодофоров, которые содержат комплекс йода с солюбилизирующим агентом (иодид-ион можно свободно рассматривать как йодофор в водных растворах тодида). Примеры таких препаратов включают:
- настойку йода : йод в этаноле или йод и йодид натрия в смесях этанола и воды.
- йод Люголя : йод и иодид только в воде, образуя в основном трииодид. В отличие от настойки йода, йод Люголя имеет минимальное количество компонента свободного йода (I 2).
- Повидон йод (йодофор ).
Антимикробное действие йода выражается в быстро и работает в низких упражнениях, поэтому он используется в работе. Он проникает в микроорганизмы и атакует эффективные аминокислоты (такие как цистеин и метионин ), нуклеотидов и жирных кислот, что витоге приводит к гибели клеток. Он также имеет противовирусное действие, но не липидные вирусы и парвовирусы менее чувствительны, чем вирусы с липидной оболочкой, вероятно, атакует поверхностные белки вирусов в оболочке, а также может дестабилизировать мембранные жирные кислоты, вступая в реакцию с ненасыщенными углеродными связями.
Другие препараты
В медицине насыщенный раствор йодида калия используется для лечения острого тиреотоксикоза. также используется для блокирования йода-131 щитовидной железой (см. раздел об изотопах выше), когда этот изотоп используется в составе радиофармпрепаратов (таких как иобенгуан ), которые не нацелены для щитовидной железы или тканей тироидного типа.
Йод-131 (обычно в виде йодида) является компонентом ядерных выпадений и особенно опасен из-за склонности щитовидной железы к концентрации поступившего йода и норма его в течение периода дольше, чем радиологический период полураспада этого изотопа, равный восьми дням. По этой причине радио подверженным риску воздействие активного йода из окружающей среды (йод-131) в результате выпадения осадков, можно дать указание принимать таблетки нерадиоактивного йодида калия. Типичная доза для взрослых составляет одну таблетку 130 мг в 24 часа, 100 мг (100 000 микрограммов ) ионного йода. (Типичная суточная доза йода для нормального здоровья составляет порядка 100 микрограммов; см. «Прием с пищей» ниже.) Прием этой большой дозы нерадиоактивного йода сводит к минимуму поглощения радиоактивного йода щитовидной железой.

в качестве элемента с высокой электронной плотностью и атомным номером йод поглощает рентгеновские лучи слабее, чем 33,3 кэВ, из-за фотоэлектрического эффект самых внутренних электронов. Йодорганические соединения используются для внутривенных инъекций в качестве рентгеновских радиоконтрастных агентов. Это приложение часто используется вместе с передовыми рентгенологическими методами, такими как ангиография и компьютерная томография. В настоящее время все водорастворимые радиоконтрастные вещества используют йод.
Прочее
Производство дигидроиодида этилендиамина, используемое в качестве пищевых добавок для домашнего скота, потребляет большую часть доступного йода. Другим важным является катализатор для производства уксусной кислоты с помощью процессов Monsanto и Cativa. Эти технологии, которые исходят из мирового спроса на уксус кислоту, иодистоводородная кислота преобразует сырье метанол в метилиодид, который подвергается карбонилированию. Гидролиз образовавшегося ацетилиодида восстанавливает иодистоводородную кислоту и дает уксусную кислоту.
Неорганические йодиды находят специализированное применение. Титан, цирконий, гафний и торий очищаются с помощью процесса Ван Аркеля, который включает обратимое образование тетраиодидов этих элементов. Йодид серебра является основным ингредиентом традиционной фотопленки. Тысячи килограммов йодида ежегодно используются для засева облаков, чтобы вызвать дождь.
Йодорганическое соединение эритрозин является важным пищевым красителем. Перфторалкилиодиды являются предшественниками важных поверхностно-активных веществ, таких как перфтороктансульфоновая кислота.
часовая реакция йода (в которой йод также служит тестом на крахмал, образуя темно-синий комплекс), является популярным обучающий демонстрационный эксперимент и пример, казалось бы, колеблющейся реакции (колеблется только концентрация промежуточного продукта).
Биологическая роль


Йод является важным элементом для жизни и, атомный номер Z = 53, является самым тяжелым элементом, который обычно необходим живым организмам. (Лантан и другие лантаноиды, а также вольфрам с Z = 74, используются несколькими микроорганизмов.) Он необходим для синтеза регулирующих рост гормонов щитовидной железы тироксин и трийодтиронин (T4и T 3 соответственно, названных в честь их количества атомов йода). Дефицит йода приводит к снижению продукции T 3 и T 4 и сопутствующему увеличению ткани щитовидной железы в попытке получить больше йода, вызывая заболевание, известное как простой зоб. Основной формой гормона щитовидной железы в крови является тироксин (T 4), который имеет более длительный период полураспада, чем T 3. У людей соотношение Т 4 к Т 3, высвобождаемых в кровь, составляет от 14: 1 до 20: 1. T 4 преобразуется в активный T 3 (в три-четыре раза более мощный, чем T 4) внутри ячеек на дейодиназы (5′-йодиназа). Далее они обрабатываются декарбоксилированием и дейодированием с получением йодтиронамина (T1а) и тиронамина (T0а ‘). Все три изоформы дейодиназ представляют собой селен -содержащие ферменты; таким образом, диетический селен необходим для производства T 3.
На йод приходится 65% молекулярной массы T 4 и 59% T 3. От 15 до 20 мг йода сосредоточено в тканях и гормонах щитовидной железы, но 70% всего йода в организме содержится в других тканях, включая молочные железы, глаза, слизистую оболочку желудка, тимус плода, спинномозговую жидкость и сосудистое сплетение, артериальное кровообращение. стенки, шейка матки и слюнные железы. В клетки этих тканей йодид поступает непосредственно через симпортер йодида натрия (NIS). Действие йода в тканях молочной железы связано с внутриутробным и неонатальным развитием, но в других тканях оно (по крайней мере) частично неизвестно.
Диетическое потребление
Рекомендации США Институт медицины от 110 до 130 мкг для младенцев до 12 месяцев, 90 мкг для детей до восьми лет, 130 мкг для детей до 13 лет, 150 мкг для взрослых, 220 мкг для беременных и 290 мкг для кормящих. Допустимый верхний уровень потребления (UL) для взрослых составляет 1100 мкг / день. Этот верхний предел был оценен путем анализа влияния добавок на тиреотропный гормон.
Щитовидной железе требуется не более 70 мкг / день для синтеза необходимых суточных количеств Т4 и Т3. Более высокие рекомендованные суточные уровни йода кажутся необходимыми для оптимального функционирования ряда систем организма, включая лактацию, слизистую оболочку желудка, слюнные железы, клетки мозга, сосудистое сплетение, вилочковая железа и стенки артерий.
Природные источники диетического йода включают морепродукты, такие как рыба, водоросли (например, водоросли ) и моллюски, молочные продукты и яйца, пока животные получали достаточно йода, и растения, выращенные на богатой йодом почве. Йодированная соль обогащен йодом в виде йодида натрия.
По состоянию на 2000 год среднее потребление йода с пищей в США составляло от 240 до 300 мкг / день для мужчин и от 190 до 210 мкг / день для женщин.. Основное население США имеет адекватное йодное питание, причем женщины детородного возраста и беременные женщины имеют возможный умеренный риск дефицита йода. В Японии потребление считалось гораздо более высоким: от 5280 мкг / день до 13800 мкг / день из пищевых водорослей или комбу водорослей, часто в форме экстрактов комбу умами для бульона. и картофельные чипсы. Однако новые исследования показывают, что потребление в Японии приближается к 1000–3000 мкг / день. UL для взрослых в Японии последний раз пересматривался до 3000 мкг / день в 2015 году.
После внедрения программ обогащения йодом, таких как йодирование соли, были отмечены некоторые случаи гипертиреоза, вызванного йодом. наблюдается (так называемый феномен Йода-Базедова ). Состояние, по-видимому, встречается в основном у людей старше сорока лет, и риск кажется выше, когда дефицит йода серьезный и начальное повышение потребления йода высокое.
Дефицит
В районах, где его мало йод в рационе, как правило, в удаленных внутренних районах и в полузасушливом экваториальном климате, где не употребляется морская пища, дефицит йода вызывает гипотиреоз, симптомами которого являются крайняя усталость, зоб, замедление умственного развития, депрессия, увеличение веса и низкая базальная температура тела. Дефицит йода — основная причина предотвратимой умственной отсталости, результат, который возникает в первую очередь, когда младенцы или маленькие дети становятся гипотиреозом из-за нехватки этого элемента. Добавление йода в поваренную соль в значительной степени устранило эту проблему в более богатых странах, но дефицит йода остается серьезной проблемой общественного здравоохранения в развивающихся странах сегодня. Дефицит йода также является проблемой в некоторых регионах Европы. Обработка информации, мелкая моторика и решение зрительных проблем улучшаются за счет восполнения запасов йода у детей с умеренным дефицитом йода.
Меры предосторожности
Токсичность
| Опасности | |
|---|---|
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H312, H332, H315, H319, H335, H372, H400 |
| Меры предосторожности GHS | P261, P273, P280, P305, P351, P338, P314 |
| NFPA 704 (огненный алмаз) |  0 3 0 0 3 0 |
Элементарный йод (I 2) токсичен при пероральном приеме в неразбавленном виде. Смертельная доза для взрослого человека составляет 30 мг / кг, что составляет около 2,1–2,4 грамма для человека с массой тела от 70 до 80 кг (даже если эксперименты на крысах показали, что эти животные могут выжить после приема дозы 14000 мг / кг). Избыток йода может быть более цитотоксичным при наличии дефицита селена. Добавление йода в группы населения с дефицитом селена теоретически проблематично, отчасти по этой причине. Токсичность обусловлена его окислительными свойствами, благодаря которым он денатурирует белки (включая ферменты).
Элементарный йод также является раздражителем кожи. Прямой контакт с кожей может вызвать повреждение, поэтому с твердыми кристаллами йода следует обращаться осторожно. Растворы с высокой концентрацией элементарного йода, такие как настойка йода и раствор Люголя, способны вызывать повреждение тканей, если используются для длительной очистки или антисептики; аналогично, жидкий повидон-йод (бетадин), попавший на кожу, в некоторых случаях приводил к химическим ожогам.
Профессиональное воздействие
Люди могут подвергаться воздействию йода в на рабочем месте при вдыхании, проглатывании, попадании на кожу и в глаза. Управление по охране труда (OSHA) установило юридический предел (допустимый предел воздействия ) для воздействия йода на рабочем месте на уровне 0,1 ppm (1 мг / м3) в течение 8- часовой рабочий день. Национальный институт охраны труда (NIOSH) установил Рекомендуемый предел воздействия (REL) 0,1 ppm (1 мг / м3) в течение 8-часового рабочего дня. При уровне 2 частей на миллион йод сразу же опасен для жизни и здоровья.
Аллергические реакции
У некоторых людей развивается гиперчувствительность к продуктам и пищевым продуктам, содержащим йод. Применение настойки йода или бетадина может вызвать сыпь, иногда сильную. Парентеральное использование контрастных веществ на основе йода (см. Выше) может вызвать реакции, варьирующиеся от легкой сыпи до фатальной анафилаксии. Такие реакции привели к заблуждению (широко распространенному даже среди врачей) о том, что у некоторых людей аллергия на сам йод; даже аллергия на морепродукты, богатые йодом, была истолкована так. Фактически, никогда не было подтвержденных сообщений об истинной аллергии на йод, а аллергия на элементарный йод или простые соли йода теоретически невозможна. Реакции гиперчувствительности на продукты и продукты, содержащие йод, по-видимому, связаны с другими их молекулярными компонентами; таким образом, у человека, у которого выявлена аллергия на один продукт или продукт, содержащий йод, может не быть аллергической реакции на другой. Пациенты с различной пищевой аллергией (моллюски, яйца, молоко и др.) Не имеют повышенного риска гиперчувствительности к контрастному веществу. Как и в случае со всеми лекарствами, перед введением любого содержащего йод препарата необходимо выяснить и проконсультироваться у пациента.
Статус списка I DEA США
Фосфор может снизить содержание элементарного йода до йодистоводородной кислоты, который является реагентом, эффективным для восстановления эфедрина или псевдоэфедрина до метамфетамина. По этой причине йод был обозначен Управлением по борьбе с наркотиками США как химический прекурсор Список I в соответствии с 21 CFR 1310.02.