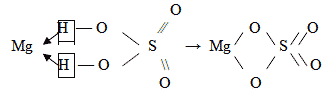Соли: классификация, номенклатура, способы получения
«Не в количестве знаний заключается образование,
а в полном понимании и искусном применении того, что знаешь»
А. Дистервег (немецкий педагог)
Мы живем с вами в мире веществ и их превращений, поэтому должны знать не только состав и применение веществ, но и влияние их на организм человека и окружающий нас мир.
С некоторыми классами веществ вы уже знакомы и сегодня приступим к изучению соединений нового класса –солей.
I. Понятие о солях
Такие вещества, как мрамор, известняк, сода, поташ, поваренная соль, адский камень, квасцы и нашатырь, известны людям ещё с древних времён. Однако первые теоретические представления о сходстве их состава возникли только в XVII веке. Именно в это время такие учёные, как Я. Ван Гельмонт (1580–1644), О. Тахений (1620–1699) и Г. Руэль (1703–1770), развили представление о том, что существует отдельный класс веществ — соли, которые можно рассматривать как продукт взаимодействия кислот с основаниями.
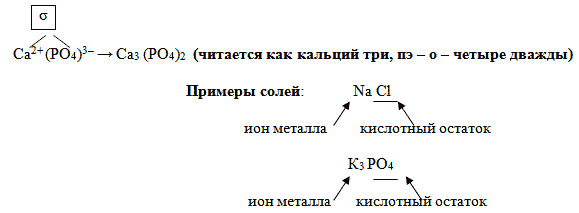
Соли — сложные вещества, состоящие из атомов металлов (иногда входит водород или гидроксильная группа) и кислотных остатков.
Составление формул солей:
II. Классификация солей
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля (1703–1770). Именно он в 1754 г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
|
Средние |
Кислые |
Основные |
Двойные |
Смешанные |
Комплексные |
|
Соли, в состав которых входят металл и кислотный остаток |
Соли, в состав которых, кроме металла и кислотного остатка, входят атомы водорода |
Соли, в состав которых, кроме металла и кислотного остатка, входят гидроксогруппы ОН |
Продукты полного замещения атомов водорода двух- или многоосновной кислоты двумя различными металлами |
||
|
Na2SO4 |
NaHSO4 |
Mg(OH)Cl |
K2NaPO4 |
Ca-OCl2 |
Na[Al(OH)4] |
III. Названия солей
- Для средней соли — название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью. В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония NH4(валентность I).
Na2SO4— сульфат натрия,
CuSO4— сульфат меди (II)
- Для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обратите внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
NaHSO4 – гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
- Для основной соли –«гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
Mg(OH)Cl — гидроксохлорид магния
Fe(OH)(NO3)2 — гидроксонитрат железа(III);
Fe(OH)2NO3 — дигидроксонитрат железа(III).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди(II) (CuOH)2CO3, образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Кроме принятых в науке названий, для многих солей в широком обиходе сохраняются тривиальные названия, то есть названия, которые были присвоены веществам до того, как учёные установили единую номенклатуру.
Тривиальные названия большей частью связаны либо с какими-то особыми свойствами веществ, либо с областями их применения. Многие из этих названий были присвоены солям алхимиками. В таблице приведены обобщённые сведения о наиболее часто встречающихся в литературе тривиальных названиях солей.
|
Тривиальное название соли |
Химическая формула соли |
Систематическое название соли |
| Адский камень | AgNO3 | нитрат серебра |
| Алебастр | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Берлинская лазурь | KFe[Fe(CN)6] | гексацианоферрат(II) железа(III)-калия |
| Бланфикс | BaSO4 | сульфат бария |
| Бура | Na2B4O7⋅10H2O | декагидрат тетрабората натрия |
| Бура ювелирная | Na2B4O7⋅5H2O | пентагидрат тетрабората натрия |
| Гипс | CaSO4⋅2H2O | дигидрат сульфата кальция |
| Гипс жжёный | CaSO4⋅0,5H2O | полугидрат сульфата кальция |
| Гипс строительный | CaSO4⋅0,5H2O | гемигидрат сульфата кальция |
| Золото сусальное | SnS2 | сульфид олова(IV) |
| Квасцы железоаммонийные | NH4Fe(SO4)2⋅12H2O | додекагидрат сульфата железа(III)-аммония |
| Купорос медный | CuSO4⋅5H2O | пентагидрат сульфата меди(II) |
| Ляпис | AgNO3 | нитрат серебра |
| Марганцовка | KMnO4 | перманганат калия |
| Мел | CaCO3 | карбонат кальция |
| Нашатырь | NH4Cl | хлорид аммония |
| Патина | (CuOH)2CO3 | гидроксокарбонат меди(II) |
| Поташ | K2CO3 | карбонат калия |
| Преципитат | CaHPO4⋅2H2O | дигидрат гидрофосфата кальция |
| Растворимое стекло | Na2SiO3⋅9H2O | нонагидрат силиката натрия |
| Свинцовый сахар | (CH3COO)2Pb⋅3H2O | тригидрат ацетата свинца(II) |
| Селитра аммиачная (аммонийная) | NH4NO3 | нитрат аммония |
| Селитра калийная (индийская) | KNO3 | нитрат калия |
| Селитра кальциевая (норвежская) | Ca(NO3)2 | нитрат кальция |
| Селитра натриевая (чилийская) | NaNO3 | нитрат натрия |
| Сода кальцинированная (стиральная) | Na2CO3 | карбонат натрия |
| Сода кристаллическая | Na2CO3⋅10H2O | декагидрат карбоната натрия |
| Сода питьевая | NaHCO3 | гидрокарбонат натрия |
| Сода пищевая | NH4HCO3 | гидрокарбонат аммония |
| Соль Мора | (NH4)2Fe(SO4)2⋅6H2O | гексагидрат сульфата железа(II)-диаммония |
| Соль английская (горькая) | MgSO4⋅7H2O | гептагидрат сульфата магния |
| Соль бертолетова | KClO3 | хлорат калия |
| Соль глауберова | Na2SO4⋅10H2O | декагидрат сульфата натрия |
| Соль жёлтая кровяная | K4[Fe(CN)6]⋅10H2O | декагидрат гексацианоферрата(II) калия |
| Соль поваренная | NaCl | хлорид натрия |
| Соль красная кровяная | K3[Fe(CN)6] | гексацианоферрат(III) калия |
| Сулема | HgCl2 | хлорид ртути |
| Суперфосфат двойной | Ca(H2PO4)2⋅H2O | моногидрат дигидрофосфата кальция |
| Суперфосфат простой | Ca(H2PO4)2⋅2CaSO4 | |
| Турнбулева синь | KFe[Fe(CN)6] | гексацианоферрат(III) железа(II)-калия |
| Хлорная известь | CaOCl2 | гипохлорит-хлорид кальция |
| Хромпик | K2Cr2O7 | дихромат калия |
| Щёлок | K2CO3 | карбонат калия |
IV. Получение
|
1. Из металлов: металл + неметалл = соль Fe + S = FeS металл (металлы до Н2) + кислота (р-р) = соль + Н2 Zn +2 HCl = ZnCl2 + H2 Металл1 + соль1 = металл2 + соль2 Видео: «Взаимодействие металлов с солями» Примечание: (металл2 стоит в ряду активности правее) Fe + CuCl2 = FeCl2 + Cu |
|
2.Из оксидов: кислотный оксид + щелочь = соль + вода SO3 + 2 NaOH = Na2SO4 + H2O основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O основный оксид + кислотный оксид = соль Na2O + CO2 = Na2CO3 |
|
3. Реакция нейтрализации: кислота + основание = соль + вода HCl + NaOH = NaCl + H2O |
|
4. Из солей: соль1 + соль2 = соль3 + соль4↓ NaCl + AgNO3 = NaNO3 +AgCl↓ соль1 + щелочь = нерастворимое основание + соль 2 CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4 соль1 + кислота1 = кислота2 + соль2 2NaCl + H2SO4 = 2HCl + Na2SO4 Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода. |
Это интересно
“Зеркало мира”

V. Тренажеры
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Классификация солей по растворимости в воде»
Тренажёр №3. «Составление названий солей по формуле»
Тренажёр №4. «Составление формул солей»
Тренажёр №5. Задачи на тему «Расчеты с использованием формул солей»
Проверь себя: “Соотнесите формулы солей, расположенных слева с их названиями”
VI. Задания для закрепления
Задание №1. Дайте названия следующим солям:
NaCl, KNO3, FeCl3, Li2SO4, KHSO4, BaOHCl, CaSO3, NaH2PO4, CuCl2
Задание №2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
Задание №3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.
ЦОРы
Видео: “Составление формул солей”
Видео: «Взаимодействие металлов с солями»
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Классификация солей по растворимости в воде»
Тренажёр №3. «Составление названий солей по формуле»
Тренажёр №4. «Составление формул солей»
Тренажёр №5. Задачи на тему «Расчеты с использованием формул солей»
Таблица и формулы солей.
Таблица и формулы солей (1 часть):
| Формула кислоты или основания | Название кислоты или основания | Формула кислотного остатка или остатка основания |
Название соли |
| HN3 | Азотистоводородная (Азоимид, Азидоводород) | N3– | Азид |
| HNO2 | Азотистая | NO2– | Нитрит |
| HNO3 | Азотная | NO3– | Нитрат |
| HBrO2 | Бромистая | BrO2– | Бромит |
| HBrO3 | Бромноватая | BrO3– | Бромат |
| HBrO | Бромноватистая (Гипобромистая кислота) | BrO– | Гипобромит |
| HBr | Бромоводород (Бромистоводородная кислота) | Br– | Бромид |
| HVO3 | Ванадиевая | VO3– | Ванадат |
| H2WO4 | Вольфрамовая | WO42– | Вольфрамат |
| H4GeO4 или Ge(OH)4 | Германиевая кислота (Гидроксид германия (IV)) | GeO44– | Германат |
| Be(OH)2 | Гидроксид бериллия | BeO22– | Бериллат |
| H2S2O7 | Дисерная | S2O72– | Дисульфат |
| H4P2O7 | Дифосфорная | P2O74– | Пирофосфат или дифосфат (по номенклатуре IUPAC) |
| H2Cr2O7 | Дихромовая | Cr2O72– | Дихромат |
| HIO4 | Йодная | IO4– | Периодат |
| HIO | Йодноватистая | IO– | Гипоиодит |
| HI | Йодоводород (Йодоводородная кислота) | I– | Йодид |
| H2SiO3 | Кремниевая | SiO32– | Силикат |
| H2MnO4 | Марганцовистая | MnO42– | Манганат |
| HMnO4 | Марганцовая | MnO4– | Перманганат |
| HCOOH | Метановая (Муравьиная кислота) | HCOO– | Формиат |
| HBO | Метаборная | BO– | Метаборат |
| HAsO2 | Метамышьяковистая | AsO2– | Метаарсенит |
| HPO3 | Метафосфорная | PO3– | Метафосфат |
Таблица и формулы солей (2 часть):
| H2MoO4 | Молибденовая | MoO42– | Молибдат |
| H3BO3 | Ортоборная (Борная кислота) | BO33– | Бораты |
| H3AsO4 | Ортомышьяковая | AsO43– | Арсенат |
| H3AsO3 | Ортомышьяковистая | AsO33– | Ортоарсенит |
| H2PbO4 | Ортосвинцовая кислота | PbO42– | Ортоплюмбат или плюмбат |
| H3PO4 | Ортофосфорная (Фосфорная кислота) | PO43– | Фосфат |
| HNCS | Роданистоводородная (Тиоциановая кислота) | SCN– | Тиоцианат |
| C7H6O3 | Салициловая | C7H6O3– | Салицилат |
| H2SO4 | Серная | SO42– | Сульфат |
| H2SO3 | Сернистая | SO32– | Сульфит |
| H2S | Сероводород (Сероводородная кислота) | S2– | Сульфид |
| H2SO3S | Тиосерная | SO3S2– | Тиосульфат |
| H2CO3 | Угольная | CO32– | Карбонат |
| HF | Фтороводород (Плавиковая кислота) | F– | Фторид |
| HCl | Хлороводород (Соляная кислота) | Cl– | Хлорид |
| H2CrO4 | Хромовая | CrO42– | Хромат |
| HClO2 | Хлористая | ClO2– | Хлорит |
| HClO4 | Хлорная | ClO4– | Перхлорат |
| HClO3 | Хлорноватая | ClO3– | Хлорат |
| HClO | Хлорноватистая | ClO– | Гипохлорит |
| HCN | Циановодород (Синильная кислота) | CN— | Цианид |
| H2C2O4 | Этандиовая (Щавелевая кислота) | C2O42– | Оксалат |
| CH3COOH | Этановая (Уксусная кислота) | CH3COO– | Ацетат |
| C4H6O5 | Яблочная (Оксиянтарная, Гидроксибутандиовая кислота) | C4H4O52– | Малат |
Коэффициент востребованности
7 489
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Краткий список
Выбрана категория:
Соли
со всеми вложенными подкадегориями
Общее число найденных записей: 1494.
Показано записей: 20.
1. Глюконат кальция
Брутто-формула:
C12H22CaO14
CAS# 299-28-5
Названия
Русский:
- Глюконат кальция [Wiki]
- кальция (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаноат(IUPAC)
;
;
English:
- Calcicol
- Calciofon
- Calcipur
- Calcium gluconate [Wiki]
- Calglucol
- Calglucon
- D-Gluconic acid, calcium salt (2:1)(CAS)
- Dragocal
- E 578
- Ebucin
- Glucal
- Glucobiogen
- calcium (2R,3S,4R,5R)- 2,3,4,5,6-pentahydroxyhexanoate(IUPAC)
- calcium;(2R,3S,4R,5R)-2,3,4,5,6-pentahydroxyhexanoate(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
@:A()O^-`/|O`|`<`|wOH>`/<|wOH>`<`|wOH>`/<|dOH>«/HO@; Ca^2+<_(y-2,x-1,N0)@A()>_(x-1,y2,N0)@A()
HO/<|dOH>/<`|wOH><|wOH>/<`|wOH>|O`|/O^-$L(1.4)Ca^2+/0O`^-$L()|O`|/<`|dOH><|dOH>/<`|dOH><|wOH>/OH
2. Сульфат калия
Брутто-формула:
K2O4S
CAS# 7778-80-5
Названия
Русский:
- Сернокислый калий
- Сульфат калия(IUPAC) [Wiki]
- калия сульфат
;
;
;
English:
- Dipotassium sulfate
- E 515
- Potassium sulfate [Wiki]
- Sulfuric acid dipotassium salt
- dipotassium;sulfate(IUPAC)
;
;
;
;
;
K^+O`^-/S<_qq4O><_pp4O>/O^-K^+
3. Нитрат калия
Брутто-формула:
KNO3
CAS# 7757-79-1
Названия
Русский:
- Нитрат калия(IUPAC) [Wiki]
- азотнокислый калий
- калиевая селитра
- калийная селитра
- калия нитрат
;
;
;
;
;
English:
- EINECS:231-818-8
- Nitrate of potash
- Potassium nitrate(IUPAC) [Wiki]
- Saltpetre
;
;
;
;
O`^-/N^+`|O|O^-_(x1,N0)K^+
4. Хлорид калия
Брутто-формула:
ClK
CAS# 7447-40-7
Названия
Русский:
- Хлорид калия(IUPAC) [Wiki]
- калия хлорид
- хлористый калий
;
;
;
English:
- Chlorvescent
- E 508
- Enseal
- Kalitabs
- Kaochlor
- Klor-Con
- Klotrix
- Pfiklor
- Potassium chloride(IUPAC) [Wiki]
- Potavescent
- Slow-K
;
;
;
;
;
;
;
;
;
;
;
5. Карбонат калия
Брутто-формула:
CK2O3
CAS# 584-08-7
Названия
Русский:
- Карбонат калия(IUPAC) [Wiki]
- калия карбонат
- поташ
- углекислый калий
;
;
;
;
English:
- EINECS:209-529-3
- Potash
- Potassium carbonate(IUPAC) [Wiki]
- pearl ash
;
;
;
;
6. Гидрокарбонат калия
Брутто-формула:
CHKO3
CAS# 298-14-6
Названия
Русский:
- Гидрокарбонат калия(IUPAC) [Wiki]
- Углекислый калий, кислый
- бикарбонат калия
- калия гидрокарбонат
;
;
;
;
English:
- EINECS:206-059-0
- EPA Pesticide Chemical Code 073508
- Kaligreen
- Monopotassium carbonate
- Potassium bicarbonate [Wiki]
- Purple K
- compounds
- monopotassium salt;
- potassium acid carbonate
- potassium hydrogen carbonate(IUPAC)
;
;
;
;
;
;
;
;
;
;
7. Сульфат натрия
Брутто-формула:
Na2O4S
CAS# 7757-82-6
Названия
Русский:
- Сульфат натрия(IUPAC) [Wiki]
- натрий сернокислый
- натрия сульфат
;
;
;
English:
- Bisodium sulfate
- Disodium sulfate
- Disodium sulphate
- EINECS:231-820-9
- Salt cake
- Sodium sulfate(IUPAC) [Wiki]
- Sodium sulphate
- Sulfate, sodium
- Sulfuric acid disodium salt
- Sulfuric acid, disodium salt
- Thenardite
- disodium;sulfate(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
$slope(15)Na^+/0O^-<Na^+>|S<`=O><=O>|O^-
$L(1.2)Na^+O`^-/S<_qq4O><_pp4O>/O^-Na^+
8. Нитрат натрия
Брутто-формула:
NNaO3
CAS# 7631-99-4
Названия
Русский:
- Натриевая селитра
- Нитрат натрия(IUPAC) [Wiki]
- азотнокислый натрий
- натрия нитрат
- натронная селитра
- чилийская селитра
;
;
;
;
;
;
English:
- Caliche
- Chile saltpeter
- E 251
- EINECS:231-554-3
- Nitrate of soda
- Nitratine
- Nitric acid monosodium salt
- Nitric acid sodium salt
- Nitric acid sodium salt (1:1)
- Peru saltpeter
- Soda niter
- Sodium nitrate(IUPAC) [Wiki]
- cubic niter
;
;
;
;
;
;
;
;
;
;
;
;
;
O`^-/N^+`|O|O^-_(x1,N0)Na^+
9. Хлорид натрия
Брутто-формула:
ClNa
Названия
Русский:
- Хлорид натрия(IUPAC)
- галит
- каменная соль
- натрия хлорид
- обычная соль
- пищевая соль
- поваренная соль
- столовая соль
;
;
;
;
;
;
;
;
English:
- Common salt
- Halite
- Rock salt
- Saline
- Sodium chloric
- Sodium chloride(IUPAC)
- Table salt
;
;
;
;
;
;
;
10. Карбонат натрия
Брутто-формула:
CNa2O3
CAS# 497-19-8
Названия
Русский:
- Карбонат натрия [Wiki]
- динатрий(IUPAC)
- кальцинированная сода
- натрия карбонат
- триоксокарбонат(IUPAC)
- углекислый натрий
;
;
;
;
;
;
English:
- EINECS:207-838-8
- Soda ash
- Soda crystals
- Sodium carbonate(IUPAC) [Wiki]
- Washing soda
;
;
;
;
;
Na^+|0O`^-/`|O|O^-`|0Na^+
11. Гидрокарбонат натрия
Брутто-формула:
CHNaO3
CAS# 144-55-8
Названия
Русский:
- Гидрокарбонат натрия(IUPAC)
- бикарбонат натрия
- натрий двууглекислый
- натрия гидрокарбонат
- питьевая сода
- пищевая сода
;
;
;
;
;
;
English:
- Baking soda, bicarbonate of soda
- Sodium bicarbonate
- Sodium hydrogen carbonate(IUPAC)
- nahcolite
- sodium hydrogencarbonate
;
;
;
;
;
12. Сульфат кальция
Брутто-формула:
CaO4S
CAS# 7778-18-9
Названия
Русский:
- Сульфат кальция(IUPAC) [Wiki]
- алебастр
- гипс
- кальций сернокислый
- кальция сульфат
- селенит
;
;
;
;
;
;
English:
- Anhydrite
- Anhydrous gypsum
- Calcium sulfate(IUPAC) [Wiki]
- Crysalba
- Drierite
- EINECS:231-900-3
- Gypsum
- Karstenite
- Muriacite
- Osteoset
- Sulfuric acid, calciumsalt (1:1)(CAS)
- Thiolite
;
;
;
;
;
;
;
;
;
;
;
;
Ca^2+O//S`|O|<_(A80,w+)O^->dO^-
Ca^++/0O`^-# -S`|O|<=O>|O^-
13. меди хлорокись
Брутто-формула:
H3ClCu2O3
CAS# 1332-65-6
Названия
Русский:
- Абига-Пик
- Куприкол
- Оксихлорид меди
- ХОМ
- меди хлорокись
;
;
;
;
;
English:
- Dicopper chloride trihydroxide(IUPAC)
- copper chloride hydroxide(CAS)
- copper oxychloride
;
;
;
$L(1.2)Cu^2+Cl^-|0O^-<H`>`/0Cu^2+`O^-<`/H>`|0O^-`H
14. Хлорид кальция
Брутто-формула:
CaCl2
Названия
Русский:
- Хлорид кальция(IUPAC) [Wiki]
- Хлористый кальций
- кальция хлорид
;
;
;
English:
- Anhydrous calcium chloride
- Calcium chloride(IUPAC) [Wiki]
- Calcium dichloride
- Calcium(II) chloride
- Calcosan
- Calplus
- Caltac
- Dowflake
- E509
- EINECS:233-140-8
- Liquidow
- Peladow
- Snomelt
- Superflake anhydrous
;
;
;
;
;
;
;
;
;
;
;
;
;
;
15. Карбонат кальция
Брутто-формула:
CCaO3
CAS# 471-34-1
Названия
Русский:
- Карбонат кальция(IUPAC)
- кальция карбонат
- углекислый кальций
;
;
;
English:
- Calcium carbonate(IUPAC)
- Limestone
- aragonite
- calcite
- chalk
- marble
- pearl
;
;
;
;
;
;
;
$slope(35)Ca^++`/0O^-C|O`|/O^-
16. Гидрокарбонат кальция
Брутто-формула:
C2H2CaO6
Названия
Русский:
- Гидрокарбонат кальция(IUPAC)
- кальция гидрокарбонат
;
;
English:
- Calcium bicarbonate
- Calcium hydrogen carbonate(IUPAC)
;
;
HO/`|O|O^-/0Ca^2+O`^-/`|O|OH
17. Сульфат магния
Брутто-формула:
MgO4S
CAS# 7487-88-9
Названия
Русский:
- Сернокислый магний
- Сульфат магния(IUPAC) [Wiki]
- магний сернокислый
- магния сульфат
- эпсомская соль
;
;
;
;
;
English:
- Magnesium sulfate(IUPAC) [Wiki]
- magnesium sulphate
;
;
Mg^2+O//S`|O|<_(A80,w+)O^->dO^-
Mg^2+/0O`^-# -S`|O|<||O>-O^-
18. Нитрат магния
Брутто-формула:
MgN2O6
CAS# 10377-60-3
Названия
Русский:
- Нитрат магния(IUPAC) [Wiki]
- магния нитрат
;
;
English:
- EINECS:233-826-7
- Magnesium dinitrate
- Magnesium nitrate(IUPAC)
- Magnesium(II) NItrate
- Magnesium(II) Nitrate (1:2)
- Magniosan
- Nitricacid, magnesium salt (8CI,9CI)
;
;
;
;
;
;
;
O`^-/N^+`|O|O^-/0Mg^2+O`^-/N^+`|O|O^-
O=N^+</O^->O^-_(x1.2,y#2,N0)Mg^2+_(x1.2,y#3,N0)O`^-N`^+<`/O`^->=O
19. Хлорид магния
Брутто-формула:
Cl2Mg
CAS# 7786-30-3
Названия
Русский:
- Хлорид магния(IUPAC)
- магния хлорид
- хлористый магний
;
;
;
English:
- Aerotex Accelerator MX
- C-TEK
- Catalyst G
- E 511
- Ekimac
- FIX-Mg
- Freecat MX
- HMC 23D
- Magnesium chloride(IUPAC)(CAS)
- Magnesium dichloride
- Magnesium(II) chloride
- Magnogene
- White Nigari NS
;
;
;
;
;
;
;
;
;
;
;
;
;
20. Карбонат магния
Брутто-формула:
CMgO3
Названия
Русский:
- Карбонат магния(IUPAC)
- Магния карбонат
- магний углекислый
;
;
;
English:
- Magnesite
- Magnesium carbonate(IUPAC)
;
;
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Соли
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Соли по своему составу похожи на кислоты, только вместо атомов водорода – ионы металлов. Поэтому их можно назвать продуктами замещения атомов водорода в кислоте на ионы металлов. Например, поваренную соль NaCl можно рассматривать как продукт замещения водорода в соляной кислоте HCl на ион натрия.
Заряд иона натрия равен 1+, а заряд иона хлора 1-. Поскольку это соединение электрически нейтрально, формула поваренной соли Na⁺Cl⁻. Если нужно вывести формулу сульфида алюминия (III), делается это следующим образом:
- Записывают заряды ионов, входящих в соединение: Al3+S2-. Заряд иона алюминия равен 3+, а заряд иона серы можно определить по формуле соответствующей сероводородной кислоты H2S, он равен 2-.
- Находят наименьшее общее кратное значений зарядов для ионов алюминия и серы (3 и 2), оно равно 6.
- Находят индексы, разделив наименьшее общее кратное на значения зарядов, и записывают формулу:
Аналогичным образом выводят формулы солей со сложными ионами кислородсодержащих кислот. Например, выведем формулу кальциевой соли фосфорной кислоты – фосфата кальция. Используя таблицу Менделеева, определяем, что заряд иона кальция, который является элементом главной подгруппы II группы (IIA группы), равен 2+. Из формулы фосфорной кислоты H3PО4 определяем заряд иона, образованного кислотным остатком: . Отсюда получаем формулу фосфата кальция:
(читается «кальций три, пэ-о-четыре дважды»).
Легко понять, что формулы для солей выводятся по зарядам ионов точно так же, как формулы для бинарных соединений по валентности и степеням окисления составляющих элементов.
Вы уже рассмотрели, как образуются названия солей бескислородных кислот, когда знакомились с номенклатурой бинарных соединений: соли HCl называются хлоридами, а соли H2S – сульфидами.
Название солей кислородсодержащих кислот составляется из двух слов: название иона, образованного кислотным остатком, в именительном падеже и название иона металла в родительном. Названия ионов кислотных остатков образуются из корней названий элементов с суффиксами -aт для высшей степени окисления и -ит для низшей степени окисления атомов неметаллов, которые образуют сложный ион остатка кислородсодержащей кислоты.
Например, соли азотной кислоты HNO3 называются нитратами: KNO3 – нитрат калия, а соли азотистой кислоты HNO2 нитритами: Ca(NO2)2 – нитрит кальция. Если металл имеет разные степени окисления, то они записываются в скобках римской цифрой, например: Fe2+SO3 – сульфит железа (II), – сульфат железа (III).
По растворимости в воде соли делятся на растворимые (P), нерастворимые (H) и малорастворимые (M). Чтобы определить растворимость солей, используют таблицу растворимости кислот, оснований и солей в воде. Если этой таблицы нет под рукой, можно воспользоваться следующими правилами:
- Растворимы все соли азотной кислоты – нитраты.
- Растворимы все соли соляной кислоты – хлориды, кроме AgCl (H), PbCl2 (M).
- Растворимы все соли серной кислоты – сульфаты, кроме BaSO4 (H), PbSO4 (H), CaSO4 (M), Ag2SO4 (M).
- Растворимы соли натрия и калия.
- Нерастворимы все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и K+.
Рассмотрим растворимую натриевую соль бескислородной соляной кислоты – хлорид натрия NaCl – и нерастворимые кальциевые соли угольной и фосфорной кислот – карбонат кальция CaCO3 и фосфат кальция Ca3(PO4)2.
Хлорид натрия NaCl
Хлорид натрия NaCl – хорошо растворимая соль в воде, известная как поваренная соль. Без этой соли жизнь растений, животных и человека была бы невозможна, поскольку она обеспечивает основные физиологические процессы в организмах: соль в крови создаёт необходимые условия для существования кровяных телец, в мышцах она определяет способность к возбуждению, в желудке образует соляную кислоту, без которой переваривание и усвоение пищи было бы невозможным.
С древних времен известно, что соль необходима для жизни. Её важность отображается в многочисленных пословицах, поговорках, обычаях. «Хлеб да соль» – одно из пожеланий русских людей, подчёркивающее, что соль так же важна, как и хлеб. Хлеб и соль стали символами гостеприимства и сердечного радушия русского народа.
Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, ждать не долго: за год один человек съедает 3–5,5 кг соли, поэтому за два года двое съедают пуд соли (16 кг).Слово соль входит в названия многих городов и поселков, таких как Соликамск, Соль-Илецк, Усолье, Усолье-Сибирское, Солт-Лейк-Сити, Солтвиль и Зальцбург и т. д.
Соль образует толстые отложения в земной коре. Например, в Соль-Ирецке толщина слоя соли превышает 1,5 километра. Соли в озере Баскунчак в Астрахани хватит нашей стране на 400 лет. Воды морей и океанов содержат большое количество соли. С помощью соли, добытой из Мирового океана, можно покрыть всю сушу земного шара слоем в 130 метров. Во многих странах Азии и Африки соль часто добывают из соляных озёр, а в европейских странах – из соляных шахт.
Хлорид натрия широко используется в химической промышленности при производстве натрия, хлора и соляной кислоты, в медицине, в кулинарии и при консервировании пищевых продуктов (соление и квашение овощей).
Карбонат кальция CaCO3
Карбонат кальция CaCO3 – нерастворимая в воде соль, из которой многие морские животные (моллюски, раки, простейшие) строят свои покровы тела – раковины и кораллы. Остатки коралловых полипов образуют тропические острова (атоллы) и коралловые рифы. Самым известным из них является Большой Барьерный риф в Австралии. В течение миллионов лет эти раковины, отложившиеся на дне вод, после смерти своих «хозяев», образовывали толстые слои соединений кальция, из которых образовались породы, известные как известняк CaCO3.
Кроме того, мрамор и мел, полученные из карьеров и меловых гор, имеют ту же формулу. Известняк используется для производства негашёной и гашёной извести, и в строительстве. Мрамор используется для изготовления статуй и отделки станций метро.
Наземные животные используют карбонат кальция для создания своего скелета – внутренней опоры для своих мягких тканей, вес которых в десять раз превышает вес самой опоры.
Фосфат кальция Ca3(PO4)2 – нерастворимая в воде соль является основой минералов фосфоритов и апатитов. Они используются для производства фосфатных удобрений, без которых высокие урожаи в сельском хозяйстве были бы невозможны. Фосфат кальция также является компонентом костей животных.
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
ПОЛУЧЕНИЕ СОЛЕЙ
1. Из металлов:
металл + неметалл = соль
Fe + S = FeS
металл (металлы до Н2) + кислота (р-р) = соль + Н2
Zn +2 HCl = ZnCl2 + H2
металл1 + соль1 = металл2 + соль2
Примечание: (металл2 стоит в ряду активности правее)
Fe + CuCl2 = FeCl2 + Cu
ВИДЕО «ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С СОЛЯМИ»
2.Из оксидов:
кислотный оксид + щелочь = соль + вода
SO3 + 2 NaOH = Na2SO4 + H2O
основный оксид + кислота = соль + вода
CuO + H2SO4 = CuSO4 + H2O
основный оксид + кислотный оксид = соль
Na2O + CO2 = Na2CO3
3. Реакция нейтрализации:
кислота + основание = соль + вода
HCl + NaOH = NaCl + H2O
4. Из солей:
соль1 + соль2 = соль3 + соль4↓
NaCl + AgNO3 = NaNO3 +AgCl ↓
соль1 + щелочь = нерастворимое основание + соль 2
CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
соль1 + кислота1 = кислота2 + соль2
2NaCl + H2SO4 = 2HCl + Na2SO4
Примечание: Все реакции обмена протекают до конца, если одно из образующихся веществ нерастворимо в воде (осадок), газ или вода.
ТРЕНАЖЁРЫ
Тренажёр №1. «Составление названий солей по формуле»
Тренажёр №2. Задачи на тему «Расчеты с использованием формул солей»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Дайте названия следующим солям:
NaCl
KNO3
FeCl3
Li2SO4
KHSO4
BaOHCl
CaSO3
Al2S3
NaH2PO4
CuCl2
№2. Составьте химические формулы солей по их названиям: хлорид железа (II), гидросульфид калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
№3. Как двумя способами из оксида кальция можно получить:
а) сульфат кальция; б) ортофосфат кальция.
Составьте уравнения реакций.
Цель урока: ввести понятие о солях,
дать определение, познакомить с важнейшими
неорганическими солями; рассмотреть состав,
названия, номенклатуру, классификацию,
физические свойства и составление структурных
формул солей.
ХОД УРОКА
1. Проверка домашнего задания
На доске записать формулы неорганических
соединений: H2SO4, K2O, Ca(OH)2,
HCl, Cu(OH)2, Al2O3, HNO3, Na2O,
СuO, HF, CO2, KOH, K2O, N2O5, H3PO4,
Fe(OH)2, Al(OH)3, NaOH, Ba(OH)2, NaCl, Na2SO4,
Ca(NaO3)2, K3PO4.
2. Фронтальная беседа
1. Какие классы неорганических соединений вы
знаете?
2. Какие соединения называют оксидами?
3. Подчеркните, синим мелом формулы оксидов и
дайте им названия.
4. Как классифицируют оксиды?
5. Назовите основные оксиды, кислотные оксиды.
6. Какие соединения называют основаниями?
7. Подчеркните желтым мелом формулы оснований и
назовите эти вещества.
8. Как классифицируют эти основания?
9. Пользуясь таблицей растворимости, выберите из
данных формул формулы растворимых и
нерастворимых оснований.
10. Какие соединения называют кислотами.
11. Как классифицируют кислоты.
12. Назовите следующие кислоты и напишите их
структурные формулы: HF, H3PO4, H2SO4.
13. Составьте молекулярные и структурные формулы
следующих оснований: а) гидрооксид натрия; б)
гидрооксид бария.
14. Напишите молекулярные и структурные формулы
оксидов элементов третьего периода.
15. Подчеркните красным мелом формулы кислот и
назовите эти вещества.
3. Изучение нового материала
Обращаем внимание учащихся на то, что на доске
остались неподчеркнутые формулы веществ, с
которыми они еще не знакомы. Это формулы солей.
Соли – это сложные вещества,
состоящие из ионов металла и кислотного остатка.
Как из определения, соли по составу похожи на
кислоты, только вместо ионов водорода они
содержат ионы металла.
Поэтому их можно также назвать продуктами
замещения атомов водорода в кислоте на ионы
металла. Например, всем известная поваренная
соль NaCl может быть рассмотрена как
продукт замещения водорода в соляной кислоте HCl
на ион натрия. Ион натрия имеет заряд 1+, а
ион хлора имеет 1–. Так как соединение
нейтрально, формула поваренной соли имеет вид Na+Cl–.
Аналогично поступают и для вывода формул солей
кислородосодержащих кислот, имеющих сложные
ионы. Выведем, например, формулу кальциевой соли
фосфорной кислоты – фосфата кальция. По таблице
Менделеева определим заряд иона кальция, как
элемента главной подгруппы II группы: 2+. По
формуле фосфорной кислоты H3PO4
определим заряд иона, образованного кислотным
остатком: РО43–.
Отсюда, формула фосфата кальция имеет вид:
КЛАССИФИКАЦИЯ СОЛЕЙ
В зависимости от состава кислотного остатка
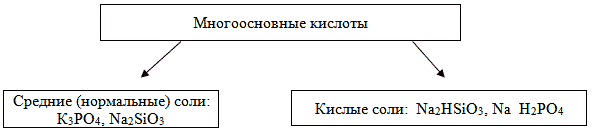
различают средние (нормальные) и кислые соли.
Молекула средней соли состоит из ионов металла и
кислотного остатка: Na NO3, К СО3.
Молекула кислой соли состоит из ионов металла и
кислотного остатка, содержащего ион (ионы)
водорода: Na HSO4, КН2РО4.
Кислые соли образуют только многоосновные
кислоты.
Схема №1.
Из схемы №1 следует, что:
1. Двухосновная кислота образует одну среднюю и
одну кислую соль.
2. Трехосновная кислота образует одну среднюю и
две кислые соли.
По растворимости в воде средние соли делят
на растворимые (Р), нерастворимые (Н) и
малорастворимые (М) (см. таблицу растворимости
кислотные основания и солей в воде №2). Почти все
кислые соли растворимы в воде.
НОМЕНКЛАТУРА (НАЗВАНИЯ) СОЛЕЙ.
I. Средние соли.
Сначала указывают название кислотного остатка,
затем наименование металла в родительном падеже.
1. Соли бескислородных кислот.
Название кислотного остатка составляется из
русского или латинского названия элемента с
добавлением суффикса «-ид».
NaCl – хлорид
натрия
K2S – сульфид калия
2. Соли кислородосодержащих кислот.
Если кислотный остаток содержит кислообразующий
элемент в высшей степени окисления, то и название
добавляется суффикс «-ат».
+6 +5
Na2SO4 – сульфат
натрия KNO3 –
нитрат калия
При более низкой степени окисления
кислотообразующего элемента добавляется
суффикс «-ит».
+4
+3
Na2SO3 – сульфит
натрия
KNO3 – нитрит калия
Если металл проявляет переменную степень
окисления, то её величину указывают римской
цифрой в скобках.
Например:
FeCl2 – хлорид железа
(II) FeCl2 –
хлорид железа (III).
II. Кислые соли
Названия кислых солей образуют также, как и
средних, только при этом к названию кислотного
остатка прибавляют приставку «гидро»,
которая указывает на наличие в молекуле соли
незамещенных ионов водорода (латинское название
водорода «гидрогениум):
Na2CO3 – карбонат
натрия
NaHCO3 – гидрокарбонат натрия
Если в молекуле кислой соли с одним кислотным
остатком связано два иона водорода, то добавляют
еще и числовую приставку «-ди».
KH3PO4 – дигидрофосфат
калия Ca(H2PO4)2
– дигидрофосфат кальция
Номенклатура солей приведена в таблице №1.
Номенклатура солей
|
Название кислоты |
Формула |
Название солей |
Формула |
| Азотистая | HNO3 | нитриты | KNO2 |
| Азотная | HNO3 | нитраты | Al(NO3)3 |
| Хлороводородная | HCl | хлориды | FeCl3 |
| Сернистая | H2SO3 | сульфиты | K2SO3 |
| Серная | H2SO4 | сульфаты | Na2SO4 |
| Сероводородная | H2S | сульфиды | FeS |
| Фосфорная | H2PO4 | фосфаты | Ca3(PO4)2 |
| Угольная | H2CO4 | карбонаты | CaCO3 |
| Кремниевая | H2SiO3 | силикаты | Na2SO3 |
Обращать внимание учащихся на таблицу
растворимости и номенклатуры солей.
Какой вывод о классификации солей по
растворимости можете делать?
Таблица №2
Растворимость солей, кислот и
оснований в воде
| Ионы | H+ | NH+4 | K+ | Na+ | Ag+ | Ba2+ | Ca2+ | Mg2+ | Zn2+ | Cu2+ | Hg2+ | Pb2+ | Fe2+ | Fe3+ | Al3+ |
| OH– | P | P | P | – | P | M | M | Н | H | – | Н | Н | Н | Н | |
| NO3– | P | P | P | P | P | P | P | P | Р | P | Р | Р | Р | Р | Р |
| Cl– | P | P | P | P | H | P | P | P | Р | P | Р | М | Р | Р | Р |
| S2 | P | P | P | P | H | – | – | – | Н | H | Н | Н | Н | Н | – |
| SO2–3 | P | P | P | P | M | M | M | M | М | – | – | Н | М | – | – |
| SO2–4 | P | P | P | P | M | H | M | P | Р | P | Р | Н | Р | Р | Р |
| CO2–3 | P | P | P | P | H | H | H | H | Н | H | – | Н | Н | – | – |
| SiO2–3 | H | – | P | P | H | H | H | H | Н | – | – | Н | Н | – | – |
| PO3–4 | P | P | P | P | H | H | H | H | Н | H | Н | Н | Н | Н | Н |
| CH3COO– | P | P | P | P | P | P | P | P | Р | P | Р | Р | Р | Р | Р |
Р – растворимые (больше 10г. в 1000г воды); М –
малорастворимые (от 10г и до 0,001г в 1000г воды); Н –
нерастворимые (меньше 0,01г в 1000г воды); черточка –
разлагается водой или не существуют).
Вывод.
1. Растворимы все соли азотной кислоты –
нитраты.
2. Растворимы все соли соляной кислоты – хлориды,
кроме AgCl(Н), PbSO4(H).
3. Растворимы все соли серной кислоты – сульфаты,
кроме BaSO4(H), PbSO4(H).
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты,
силикаты и сульфиды, кроме этих солей Na+ и К+.
СТРУКТУРНЫЕ ФОРМУЛЫ
При изображении структурной формулы средней
соли в формуле соответствующей кислоты ионы
водорода заменяют атомом металла.
MgSO4 – сульфат магния образует серная
кислота H2SO4:
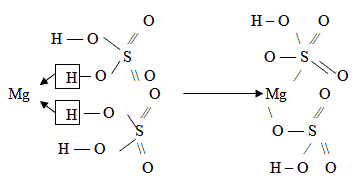
При изображении структурных формул кислых
солей в формуле соответствующей кислоты атомы
водорода только частично (не полностью) заменяют
атомы металла.
Mg(HSO4)2 – в образовании молекул
гидросульфата магния участвуют две молекулы H2SO4.
Затем в каждой молекуле H2SO4 убираем
по одному атому водорода.
Два атома кислорода, у которых убрали атомы
водорода, соединяем с одним атомом магния, так
как магний двухвалентен:
Соли имеют различные физические свойства. Соли
– кристаллические вещества различного цвета. О
растворимости солей в воде можно узнать по
таблице растворимости, в которой по вертикали
расположены знаки гидроксогрупп и кислотных
остатков, а по горизонтали – знак металлов. На
пересечении знаков металла и кислотного остатка
можно найти обозначения растворимости
соответствующих солей: Н – нерастворимая соль, М
– малорастворимая, Р – хорошо растворимая, Тире
– соль в водном растворе разлагается.
Большинство солей имеют немолекулярное
строение. Соли – твердые вещества различного
цвета. Растворимость их различна.
РАСПРОСТРАНЕННОСТЬ СОЛЕЙ В
ПРИРОДЕ И РОЛЬ В ПРОЦЕССАХ ОБМЕНА ВЕЩЕСТВ В
ЖИВОТНЫХ И РАСТИТЕЛЬНЫХ ОРГАНИЗМАХ
Из всех классов неорганических соединений
класс солей наиболее многочисленный.
Соли широко распространены в природе и играют
важную роль в процессе обмена веществ в животных
и растительных организмах. Соли содержатся в
клеточном соке живых организмов, входят в состав
различных тканей: костный, нервный, мышечный и др.
В организме человека содержится около 5,5% солей.
Живые организмы нуждаются в постоянном
поступлении солей извне.
Велика роль солей в хозяйстве страны. Соль
используют, например, для получения целого ряда
металлов, минеральных удобрений, стекла, моющих
веществ и т.д.
Многие соли получают в промышленности в очень
больших количествах.
Хлорид натрия
NaCl – хорошо растворимая в воде соль
под названием «поваренная соль». Без этой
соли невозможна жизнь растений, животных и
человека, так как она обеспечивает важнейшие
физиологические процессы в организмах: в крови
соль создает необходимые условия для
существования красных кровяных телец, в мышцах
обуславливает способность к возбудимости, в
желудке образует соляную кислоту, без которой
было бы невозможно переваривание и усвоение
пищи.
Необходимость соли для жизни была известна со
времен глубочайшей древности. Значение соли
отражено в многочисленных пословицах,
поговорках, обычаях.
«Хлеб да соль» – вот одно из пожеланий, которым
русские люди с древних пор обменивались, друг с
другом во время приёма пищи, подчеркивая
равноценное с хлебом значение соли.
Хлеб и соль стали символом гостеприимства и
радушия русской нации. Говорят: «Чтобы узнать
человека надо с ним пуд соли съесть».
Оказывается, ждать не так уж долго: за два года
двое съедают пуд соли (16 кг.), так как в год каждый
человек с пищей потребляет от 3 до 5,5 кг. соли.
В названиях многих городов и поселков разных
стран присутствуют слово соль: Соликамск, Соль-Илецк,
Усолье, Усолье-Сибирское, Солт-Лейк-Сити,
Зальцбург и т.д.
Соль образует мощные отложения в земной коре. В
Соль-Илецке, например, толщина пласта соли
превышает полтора километра. Соли, находящиеся в
озере Баскунчак в Астраханской области, хватит
нашей стране на 400 лет, Огромные количества соли
содержат в себе воды морей и океанов. Солью,
извлеченной из Мирового океана, можно было бы
засыпать всю сушу земного шара слоем 130 метров.
Хлорид натрия широко используют в химической
промышленности для получения натрия, хлора,
соляной кислоты, в медицине, для приготовления
пищи, для консервирования продуктов питания
(соление и квашение овощей) и т.д.
Карбонат кальция
CaCO3 – нерастворимый в воде,
важнейшая соль, из которой многочисленные
морские животные (моллюски, раки, простейшие)
строят покровы своего тела – разнообразные по
форме, многоцветные по окраске раковины.
Скапливаясь после гибели своих хозяев на дне
водоемов и главным образом морей, эти раковины за
десятки и сотни миллионов лет образовали мощные
пласты соединений кальция, давших начало
образованию горных пород – известняков CaCO3.
Эту же формулу имеет и замечательный
строительный камень – мрамор, столь привычный
каждому, стоящему у доски мел. Из известняка
получают негашеную и гашеную известь, строят
дома.
Мрамор идет на изготовление статуй, мрамором
отделаны станции московского метро.
Из этой соли наземные животные и строят свои
скелеты – внутреннюю опору для мягких тканей,
которые, в десятки раз, превышают вес самой
опоры.
Сульфат магния
MgSO4 х 7H2O (горькая соль)
содержится в морской воде и придает ей горький
вкус.
Горькую воду применяют для утяжеления хлопка и
шелка, в медицине в качестве слабительного.
Фосфат кальция
Ca(PO4)2 – нерастворим в воде,
это основа минералов фосфоритов и апатитов. Из
них производят необходимые в сельском хозяйстве
фосфорные удобрения, без которых, в свою очередь
было бы невозможно получение высоких урожаев. Он
входит в состав костей животных.
Растворы силиката натрия
Na3SiO3 – используют для
приготовления клея (с помощью силикатного клея
склеивают обычно картонные изделия).
4. Закрепление изученного материала
1. С каким классом неорганических веществ вы
сегодня познакомились?
2. Выпишите из приведенных формул солей – K2S,
NaB2, Na2SiO3, Mg(H2PO4), Mg HPO4,
Mg3(PO4)2, KHS, NaHSiO3 – отдельно
средние и кислые соли, назовите их.
3. Что такое соли и как их классифицируют?
4. Какие соли называются кислыми и средними?
5. Какие вещества называются солями?
6. Какими физическими свойствами обладают соли?
7. Назовите важнейшие соли?
8. Соли в природе.
9. Соли и их применение.
10. Соли и их значение для живого мира (фауны и
флоры).
5. Заканчиваем урок подведением
итогов, выставляем отметки и предлагаем домашнее
задание.
Литература:
1. Журнал Химия в школе №7. 2012 год [стр. 24-25];
2. И.И. Новошинский, Н.С. Новошинская Химия 8
класс Москва « Оникс 21 век», « Мир и образование»
2003 год, [§21 стр.95];
3. О.С. Габриелян Химия 8 класс Дрофа Москва
2002г. §21 [стр.75 – 78];
4. Г.Е. Рудзитис, Ф.Г. Фельдман Химия 7-11
класс Москва «Просвещение» 1985г. [§5 стр.86];
5. С.А. Балезин, Н.Г. Ключников , В.С. Полозин Неорганическая
химия.