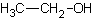В статье описывается формула водки и химический состав крепкого напитка. Вы узнаете, из каких составляющих производится качественный 40-градусный алкоголь по ГОСТу.
Также сможете ознакомиться со списком дополнительных компонентов, которые могу входить в состав. Предлагаемая информация поможет сориентироваться при выборе качественного продукта для вашего застолья.
Содержание
- 1. Кто вывел формулу водки
- 2. Химическая формула
- 3. Состав
- 3.1. Какие могут быть примеси и пищевые добавки
Кто вывел формулу водки
История появления формулы водки часто упоминается в связке с именем великого учёного Д. И. Менделеева. Опираясь на информацию из докторской диссертации «О соединении спирта с водой», ему приписывают создание и усовершенствование спиртного напитка. На самом же деле учёный имеет лишь опосредованное отношение к изобретению алкоголя, так как изучал удельный вес спиртоводных растворов в зависимости от концентрации и температуры. В диссертации рассматривалось взаимодействие этилового спирта при смешивании с водой, а также последствия таких действий.
Но нет никаких данных, что Д. И. Менделеев изучал какие-либо биохимические свойства подобных спиртоводных растворов разной концентрации. И уж тем более их физиологическое воздействие на человеческий организм. Речь шла об установлении предельной концентрации, при которой происходит максимальное взаимное растворение воды и спирта друг в друге.
Так кто же вывел формулу водки на самом деле? Конкретного имени в источниках не встречается, но следует упомянуть, что в некотором смысле создателем прототипа можно считать персидского врача Ар-Рази, который выделил спирт путём перегонки. Зато известно, что традиционное 40-процентное соотношение спирта к воде – результат изысканий чиновников. До того как своё распространение получили спиртометры, крепость смеси измеряли отжигом.
Для этого вино поджигали. Если выгорала ровно половина, то такое питие называли «полугаром». Его крепость составляла 38° и официально была закреплена в 1843 году. Так как эта цифра была не совсем удобна при подсчётах объёмов произведённого вина и поступающих акцизов, министром финансов
Российской империи М. Х. Рейтерном было предложено округлить значение до сорока. 6 декабря 1886 года норма в 40° была официально закреплена в «Уставе о питейных заведениях».
Химическая формула
Химическая формула 40-градусной водки записывается как соотношение 40 % этилового спирта и 60 % очищенной питьевой воды. Для обозначения крепкого напитка используется уравнение, так как он относится к смесям. Поэтому в химии формула водки выглядит следующим образом:
С2Н5ОН 40 % + H2O 60 %
Состав
В 1936 году в СССР был принят первый ГОСТ, по которому крепкий напиток, имеющий 40° и состоящий из этилового спирта и воды, получил своё название – водка. Остальные алкогольные изделия, обогащённые различными добавками, относились к категории винно-водочных изделий. На сегодняшний день формула водки, её крепость в 40 градусов, составляющие по ГОСТу остаются неизменными.
Это спиртное изделие обладает характерным вкусом и запахом, является абсолютно бесцветным.
Сто грамм напитка содержит приблизительно 237 ккал. Химический состав водки по формуле и ГОСТу должен содержать в себе установленное количество щелочей, а также определённую концентрацию уксусного альдегида, сивушных масел, сложных эфиров. Нарушение количества допустимых параметров обычно приводит к тому, что изготовленная партия алкоголя не допускается к последующей продаже.
Спиртное изделие в составе не содержит полиненасыщенных жиров, мононенасыщенных кислот, углеводов, белков и холестерина. Также в чистом напитке отсутствуют какие-либо витамины, железо, магний, но отмечается присутствие натрия и калия. Качественный продукт может создаваться только при использовании тщательно очищенной воды и спирта. Для этого используются специальные фильтры.
Если рассматривать состав с физико-химической стороны, он содержит следующие компоненты:
- вода;
- этиловый спирт;
- углеводы;
- минералы – кальций, калий, натрий;
- соляная кислота;
- уксусный альдегид.
Какие могут быть примеси и пищевые добавки
Несмотря на то, что основными ингредиентами для качественного продукта являются именно вода и спирт, в «особые» виды спиртного могут добавляться другие компоненты. Некоторые марки содержат в себе концентраты специй, особые травяные экстракты, вытяжки из фруктов и ягод, овсяные хлопья.
Например, линейка водок «Бульбашъ» выпускается с добавлением разнообразных натуральных ингредиентов, среди которых встречаются берёзовые почки, мёд, перец, настой липового цвета и другие. Также спиртные напитки могут производиться на основе кедровых орехов, например «Деревенька», и пряных продуктов. В составе могут встречаться красители, ароматизаторы и эфирные масла.
Для очищения и обогащения вкуса спиртного разрешено использовать следующие составляющие:
- сахар;
- лимонная кислота;
- соляная кислота;
- мёд;
- ванилин;
- активированный уголь;
- соль;
- фруктоза;
- сухое молоко;
- питьевая сода;
- уксусная кислота;
- перманганат калия.
Конечно же, все это должно содержаться в минимальных количествах. Производители крепких спиртных напитков добавляют в состав различные компоненты, руководствуясь разными причинами. Так как конкуренция на алкогольном рынке довольно серьёзная, продукт должен выделяться вкусом и качеством. Естественно, что необычные ингредиенты способны привлечь большее количество покупателей.
Также благодаря дополнительным ингредиентам, например меду, конечный продукт становится более мягким, что также влияет на его конкурентоспособность. «Русская Эскадра», которая относится к сегменту премиум-алкоголя, содержит в составе сахар, помогающий сделать её вкус более лёгким.
Но если одни производители гонятся за качеством, то другие подобными добавками пытаются скрыть недостатки своей продукции. Поэтому, ориентируясь на такие показатели, следует быть очень осторожным.
В большинстве случаев покупатель при выборе алкоголя опирается на личный опыт, рекомендации друзей, рекламу и, конечно же, состав. Имея представление о том, каким образом выглядят составляющие качественного продукта, а также какие добавки могут использоваться, вы сможете более тщательно подойти к выбору спиртного.
Какое спиртное вы предпочитаете употреблять – чистое, без примесей или же имеющее в составе вкусоароматические добавки? Чем руководствуетесь при выборе? Обязательно поделитесь своими предпочтениями в комментариях.
Менделеев
В России о «горькой» ходит много легенд. Один из мифов указывает на связь появления водки с деятельностью Д.И. Менделеева. Основанием послужила его докторская диссертация, которая называлась «О соединении спирта с водой».
О, эта формула водки Менделеева! Какая же она на самом деле? В мифе рассказывается о следующем:
- Занимаясь диссертацией, ученый установил необычные свойства водно-спиртовой жидкости. Смесь имела концентрацию этанола 43% по объёму и странно воздействовала на живой организм.
- С подобной концентрацией водно-спиртовую жидкость можно получить, лишь смешивая весовые части спирта и воды.
- Основываясь на этих фактах, Менделеев смог разработать рецептуру под названием «Московская особенная». Этот эксклюзив в 1894 году был запатентован российским правительством как национальная русская водка.
Конечно же, Д.И. Менделеев никогда не принимал участия в создании либо модернизации водки. Лишь немногие его работы впоследствии были использованы для изготовления этой жидкости.
fb.ru
Как определить, насколько качественный напиток
Опытные пользователи могут определить качество продукта по запаху. В недостаточно хорошо очищенных напитках содержатся сивушные масла, которые придают характерные вкусовые нотки и аромат. Однако в некоторых случаях опасные компоненты обладают приятным запахом, поэтому данный метод не является точным. Например, альдегид фурфурол, который традиционно попадает в спирт из злаковой браги, имеет аромат ржаного хлеба.
При приобретении продукта важно обратить внимание на внешний вид бутылки. На поверхности должны присутствовать этикетки и голографические знаки
Клеевой слой традиционно плотно прилегает к стеклу. Желательно приобретать одну и ту же марку, чтобы было проще отличить подделку. Ключевое значение имеет ценовая категория. Качественный очищенный этанол стоит дорого из-за особенностей технологии производства. Низкая цена может свидетельствовать об использовании технического спирта, наличии лишних примесей или повышенном содержании воды.
Для проверки качества можно интенсивно потрясти бутылку. Если в состав входит слишком много воды, пузырьки будут большими. В норме они должны быть мелкими. В качественном напитке пузырьки исчезают в течение 2-3 секунд. Недопустимо выпадение осадка, появление мутности после встряхивания или отсутствие прозрачности еще до проведения манипуляций. Если в продукте присутствуют сторонние примеси, такой напиток может вызвать , аллергию или другие побочные эффекты. Существует риск отравления и летального исхода.
В лабораторных условиях проверить химический состав водки можно с помощью оборудования. Ареометр позволяет определить фактическую крепость напитка. Косвенно о концентрации этилового спирта свидетельствует вес продукта. При стандартной крепости (40%) масса 1 л водки должна составлять 953 г. Допускается незначительное отклонение (5 г) в большую или меньшую сторону. При взвешивании необходимо учитывать вес тары.
Наличие кислот в напитке можно определить с помощью лакмусовой бумаги. В домашних условиях ее можно заменить луковой шелухой. При повышенной концентрации кислот она окрашивается в алый цвет. Также при погружении в некачественный напиток изменится оттенок лепестков василька.
Проверку можно провести с помощью температурного воздействия. Самый простой способ — заморозка. При температуре -20°C качественный продукт должен оставаться жидким. Если напиток частично или полностью превращается в лед, он содержит сторонние примеси. Чем сильнее замерзает жидкость, тем больше лишних веществ в ней присутствует. При наличии специального оборудования можно довести продукт до кипения. Для метанола верхний температурный порог составляет +640°C, для этилового спирта — +780°C.
В домашних условиях можно попытаться поджечь жидкость
Это следует делать осторожно, чтобы избежать пожара. Достаточно налить слегка нагретую водку в небольшую пробку и поднести источник огня
Качественный продукт начнет гореть. Пламя должно быть ровным и слегка синеватым. При наличии примесей жидкость либо не загорится, либо вспыхнет ненадолго, либо будет потрескивать при горении и издавать неприятный запах, характерный для сивушных масел.
В лабораторных условиях для оценки качества можно использовать реагенты. Для выявления метилового спирта добавляют несколько кристаллов марганцовки. Если в продукте содержится чистый этанол, в ходе реакции появится специфический запах уксуса. При наличии метанола образуется углекислый газ. Также можно опустить в жидкость нагретую медную проволоку. Если в напитке присутствует метиловый спирт, возникнет запах формалина.
https://youtube.com/watch?v=fkFRYe7_I9o%3Ffeature%3Doembed
История
Впервые царскую водку описал Псевдо-Гебер. Он был неизвестным алхимиком. Его трактаты распространялись в Европе в четырнадцатом веке. Задолго до обнаружения соляной кислоты в латинских трудах была описана химическая формула царской водки. Эту жидкость получали путём сухой сублимации смеси квасцов, селитры, медного купороса и нашатыря в стеклянном замазанном сосуде. Ёмкость снабжалась колпаком либо стеклянной крышкой.
Альберт великий в своих сочинениях называет царскую водку aqua secunda. Это название означает «вторичная водка». Aqua prima переводится как «первичная водка», что значит азотная кислота. У иных алхимиков формула водки называется aqua regia.
Бонавентура в 1270 году предал огласке свой собственный метод получения чудо-жидкости: он разжижал нашатырь в «крепкой водке» (aqua fortis, азотная кислота). Бонавентура смог установить, что азотная кислота может растворять серебро, отсоединяя его от золота. Он определил, что «царская водка» способна растворить «царя металлов» — золото. А ведь до некоторых пор считалось, что это вещество невозможно подвергнуть изменениям.
Таким образом, появилось наименование aqua regia. Царскую водку стали обозначать алхимическим символом, составленным из знака воды и буквы «R».
Химическая формула
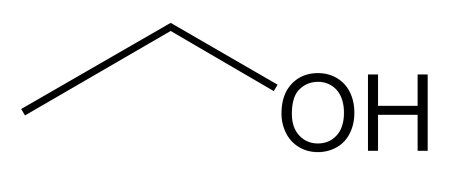
Откройте учебник химии. Или Википедию. Там вы обнаружите такой набор обозначений химических элементов: C2H5OH. Собственно, это и есть формула водки. Означает она следующее. Алкоголь состоит из:
- двух атомов углерода;
- шести атомов водорода;
- одного атома кислорода.
Химики-профессионалы скажут вам, что на само деле все гораздо сложнее, но для нас, простых обывателей, этих знаний будет достаточно, чтобы понимать: в качественной водке не должно быть ничего, кроме двух компонентов – спирта и воды.
Бытует мнение: формулу открыл Дмитрий Менделеев. Нельзя сказать, что это чистая правда: у Менделеева действительно были исследования, касающиеся изучения свойств спирта, соединенного с водой.
Ученый писал об этом докторскую диссертацию. Но никакую «Московскую особенную» он не изобретал и вообще не ставил себе задачу спаивать народ. Он занимался свойствами химических составов, преследуя совершенно иные цели.
Водка известна в мире с XII века. Именно тогда стали получать спиртовые растворы методом дистилляции.
Дистилляция применялась до конца XIX в., а затем появилась методика разведения спирта водой. Спирт используют ректификованный (то есть очищенный).
Водно-спиртовой раствор очищают крахмалом или активированным углем, фильтруют, затем разливают по бутылкам.
И вот она, наша заветная бутылочка, — уже на полке магазина.
Состав и формула
Этанол — а именно так звучит одно из его официальных названий — относится к простым спиртам. Он знаком практически всем под теми или иными наименованиями. Часто его называют просто спиртом, иногда прибавляют прилагательные «этиловый» или «винный», химики могут также назвать его метилкарбинолом. Но суть одна — С2Н5ОН. Эта формула знакома, пожалуй, практически всем еще со школьных времен. И очень многие помнят, насколько это вещество подобно своему ближайшему родственнику — метанолу. Проблема лишь в том, что последний крайне токсичен. Но об этом позже, сначала стоит рассмотреть подробнее этанол.
Кстати, в химии есть много похожих терминов, так что не стоит путать этиловый спирт, например, с этиленом. Последний является бесцветным горючим газом и совсем не похож на прозрачную жидкость с характерным запахом. А еще есть газ этан, и его название тоже созвучно с наименованием «этанол». Но это тоже совсем разные вещества.
Сорта и виды
Существует множество сортов, видов, марок водки, которые производится в России, странах СНГ, Европе, США. Различные технологии позволяют получить напиток, отличающийся по вкусу, аромату, легкости питья, мягкости, классу спирта. Все сорта в свою очередь делятся на «обыкновенные» (без примесей) и «особые» (с добавками). Самые знаменитые классические марки – это «Русская» и «Московская» — они изготавливаются из спирта класса «экстра» и имеют количество оборотов 40%. Стандартный процент алкоголя содержат и «Старорусская», «Столичная», «Пшеничная». А вот «Юбилейная» отличается повышенной крепостью в 45 градусов, однако и это не предел – «Крепкая» имеет 56 оборотов. Также многие знаменитые марки водки названы согласно добавкам — «Лимонная», «Перцовка» и т.д.
Из каких кислот состоит царская водка
Что касается состава царской водки, оказалось, что химическая смесь соляной и азотной кислоты при взаимодействии своих компонентов усиливает свои способности в несколько раз. Смесь получилась настолько сильной, что в ней растворяется золото, и даже платина при соотношении 1:4 (соляная кислота при реакции с азотной кислотой высвобождает хлор, при этом раствор зеленеет, а частицы свободного хлора атакуют золото).
Формула взаимодействия выглядит так:• Кислота азотная окисляет кислоту солянуюHNO3 + 3HCl = NOCl + Cl2 + 2H2O.• Во время этого процесса появляется два активных вещества: нитрозилхлорид и хлор, которые в состоянии растворить золото:• Au + NOCl2 + Cl2 = AuCl3 + NO.
Хлорид золота моментально присоединяет к себе молекулу HCl, при этом образуется тетрахлорозолотая кислота, еще известна в народе как «хлорное золото»: AuCl3 + HCl = H (AuCl4).
Приготовление царской водки в домашних условиях должно проходить с соблюдением всех мер безопасности и хорошо проветриваемом помещении.Чтобы приготовить царскую водку, Вам понадобиться обзавестись двумя основными ингредиентами: концентрированная соляная и азотная кислота.Так же настоятельно рекомендуем использовать только стеклянные пробирки (с отметками) и стеклянную палочку для равномерного размешивания «гремучей смеси». Оригинальный состав представляет собой смесь двух кислот в количественном соотношении 1: 3. Смешивайте, используя только одну пробирку, не отмеряйте кислоты в других емкостях, таким образом Вы минимизируете шанс проливания кислоты. Теперь нужно обговорить по отдельности те компоненты, с которыми Вам придётся столкнуться при изготовлении царской водки.
Химические свойства спиртов
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные группы, поэтому химические свойства спиртов определяются взаимодействием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
- Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал,с одной стороны, и вещества,содержащего гидроксильную группу и не содержащего углеводородный радикал,-с другой. Такими веществами могут быть,например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами(замещаться на них)
- Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов.
- Межмолекулярная дегидратация спиртов- отщепление молекулы воды от двух молекул спиртов при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры.Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140°С образуется диэтиловый (серный) эфир. - Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров( реакция этерификации)Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксусной кислоты образуется-этилацетат:
- Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры,чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140°С в присутствии концентрированной серной кислоты:
- Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты: При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе. - Дегидрирование спиртов. При пропускании паров спирта при 200-300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
- Качественная реакция на многоатомные спирты.
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Экскурс в прошлое этанола
Предлагаем окунуться в мир химии и узнать больше об одном из известнейших элементов. Вдруг окажется, что вы знаете не так много о нём?
Первым спиртом, который человек открыл и начал использовать, был этанол. К сожалению, история не сохранила для потомков имени этого человека. Легенды говорят о том, что впервые вещество было получено из виноградного сока, а случилось открытие в XI столетии. Позже изобретатели алкоголя были удивлены его чудесными свойствами. Такие качества нового открытия подтолкнули их к мысли назвать вещество «благородный».
С давних времён этанол можно было найти в напитках, лекарствах. В проведении некоторых религиозных обрядов его тоже использовали. В стране пирамид перерабатывали растительные продукты, добывая это вещество. Но так получался только его раствор. Чтобы увеличить его насыщенность, древние китайцы начали перегонять вещество. Открыли этот процесс более девяти тысяч лет тому назад. Около десяти тысяч лет назад открытием этанола на территории стран Востока послужил виноград. Подтверждение этому – надписи на табличках-кирпичиках Междуречья.
В Средние века алкоголь был главной основой в приготовлении различных лекарств. На латыни средневековые учёные-химики называли его «живая вода».
Только в конце XVIII века русскому учёному-химику Ловицу удалось провести химический эксперимент, получив чистый этанол. В начале XIX столетия швейцарский учёный получил химическую формулу этилового спирта, а через пятьдесят лет профессор из Швейцарии предложил его химическое строение и это, безусловно, был большой прорыв в науке.
Свойства
Царская водка имеет жёлто-оранжевый цвет с сильным запахом диоксида азота и хлора. Только что приготовленная жидкость бесцветна, однако быстро приобретает оранжевый цвет.
Из чего готовится царская водка? Формула её довольно-таки интересна. При взаимодействии HNO3 и HCI возникает сложная смесь продуктов с высокой активностью, в числе которых находятся ассоциаты и свободные радикалы. Эта жидкость является одним из мощнейших окислителей. Смесь готовят прямо перед использованием, так как при хранении она распадается и теряет окислительные качества:
3HCl+HNO3=2Cl+NOCl+2H2O
NOCl=NO+Cl
2NO+O2=2No2
Эффективность царской водки как окислителя в большей степени связана с уменьшением возможности окисления металлов. Это происходит благодаря образованию комплексных хлоридных соединений. Комплексообразование в окислительной сильнокислой среде делает возможным разжижение таких металлов с низкой активностью, как платина, золото и палладий, уже при комнатной температуре.
Как проверить качество напитка
Для того чтобы определить содержит ли продукт, находящийся перед вами в своем составе метиловый спирт, довольно просто. Существуют методики, которые можно повторить только в условиях лаборатории или в домашних условиях.
Находясь в лабораторных условиях, жидкость нагревают до определенной температуры. От этой температуры и зависит результат. Температура кипения этилового спирта составляет семьсот восемьдесят градусов Цельсия, в отличие от него метил закипает при шестистах сорока.
В домашних условиях в небольшую емкость с подозрительной жидкостью можно добавить пару гранул марганцовки. Если в напитке содержится этил, то появится ярко выраженный запах уксуса. Если в растворе содержится метанол, то в емкости появятся пузырьки газа. Помимо этого, можно пару раз встряхнуть бутылку с жидкостью. В напитке, отвечающем всем стандартам качества, пузырьки воздуха исчезают за две секунды.
Эти несложные методы позволяют определить качество напитка, находящегося перед вами. Они позволяют обезопасить себя от развития возможных последствий, в результате употребления поддельной продукции
Именно поэтому очень важно уметь определять качество водки «на глаз» с помощью последнего метода.
https://youtube.com/watch?v=RYfV_KInxI0%3F
Бальзам Болотова
Очень многих интересует информация о бальзаме Болотова. Известно, что смесь концентрированных кислот — азотной и соляной — это царская водка. Состав по Болотову – это более слабый раствор. Бальзам, который готовят в аптеках, соответствует 3-процентному раствору кислоты соляной. Поэтому он не оказывает разрушительного воздействия на желудок человека и его принимают внутрь. Какое же воздействие оказывает это средство на организм человека?
Серная кислота растворяет соединительную ткань благодаря превращению сахара в мукополисахариды. Другими словами, она растворяет старые клетки и способствует улучшению пищеварения. Азотная кислота улучшает работу надпочечников и повышает уровень адреналина. Также происходит улучшение питания клеток, где большую роль играет пировиноградная кислота. Бальзам Болотова способствует образованию в организме витаминов и аминокислот и восстанавливает белковые молекулы. Он благотворно влияет на все процессы, происходящие в организме, и предотвращает воспаления. Бальзам выполняет несколько функций. Во-первых, это увеличение количества новых клеток. Во-вторых, это снижение зашлакованности организма, то есть превращение шлаков в соли и выведение их из организма. Третье — это борьба с микробами и восстановление органов.
Состав виноградного вина
Качественное виноградное вино обладает очень сложным составом, в нем выявлено приблизительно 600 компонентов. Разумеется, на долю воды припадает самое большое количество процентов. Количество экстракта в этом напитке зависит от множества факторов и от вида вина. В белом, к примеру, в среднем его 22г/л, в красном – больше, — примерно 30г/л. У десертных и крепких вин экстракта еще больше – до 40г/л. Кроме того в продукте переработки виноградного сока содержатся белки, липиды, углеводы, спирт, минеральные соли, микро- и макроэлементы, витамины, полифенолы и прочие вещества. Химический состав виноградного вина таков: спирты – 75-160г/л. Кроме этилового спирта в вине содержатся также другие его виды – амиловый, бутиловый, пропиловый. Метиловый (крайне ядовитый) спирт содержится в этом напитке в мизерных количествах; протеины – 1-2г/л; углеводы (фруктоза, глюкоза, сорбитол, глицерол) – 2-3г/л; минеральные соли – калий, магний, кальций, фосфор, натрий и др. – от 50 до1600мг/л; микроэлементы – цинк, медь, феррум, марганец – от 0,1 до 10мг/л; витамины – преимущественно группы В; полифенолы – от 1,2 до 3 г/л.
izlechenie-alkogolizma.ru
Калорийность
Вот мы и подошли к самому интересному. При таком простом составе разве имеет напиток собственные калории? Оказывается имеет, и притом побольше, чем огурцы или помидоры: в 100 г крепкого алкоголя содержится 237 Ккал.
Много ли это? В сравнении с шоколадом (500 Ккал на 100 г) – мало, с картофелем вареным (120 Ккал на 100 г) – много. Но тут дело не в количестве.
От водки как таковой поправиться нельзя. Ее калории не оседают на боках в прямом смысле: в напитке нет жиров. Калории здесь представляют собой чистую энергию. Человек, «принявший на грудь», мобилизуется и начинает буквально «кипеть энергией» (пока не переберет).
Организм старается быстро потратить свалившиеся на него невесть откуда энергетические запасы, а переработку собственного жира оставляет «на потом». Поэтому мы вряд ли похудеем, если будем пить домашний алкоголь без закуски.
Еще по теме: Правильное очищение водки в домашних условиях
Кстати, о закуске. В ней-то и таится главная причина вырастания животика после обильных застолий. Выпил водки – получил чистую энергию, которую организм сразу тратит – закусил – приобрел дополнительные запасы жира. Набор веса идет по этой схеме.
Советуем почитать: Чем лучше закусывать водку, какие закуски приготовить, чтобы не болеть
В общем, водка требует аккуратности при приеме даже в «терапевтических дозах». Этот напиток способствует появлению лишних килограммов, не говоря уже об эффекте привыкания. «Пей, да меру разумей!» – это про нее, про нашу родимую «горькую». Послушаемся народной мудрости.
posamogonu.ru
| Этанол | |
|---|---|
 |
|
 |
|
 |
|
| Систематическое наименование |
Этанол |
| Традиционные названия | Этиловый спирт |
| Хим. формула | C2H5OH |
| Рац. формула | СH3СH2OH |
| Состояние | жидкость |
| Молярная масса | 46,069 г/моль |
| Плотность | 0,7893 г/см³ |
| Поверхностное натяжение | 22,39×10−3 Н/м при 20 °C Н/м |
| Энергия ионизации | 10,47 ± 0,01 эВ |
| Т. плав. | -114,3 °C |
| Т. кип. | +78,4 °C |
| Т. всп. | 13 °C |
| Т. свспл. | +363 °C |
| Пр. взрв. | 3,28 — 18,95 % |
| Тройная точка | -114,3 °C, ? Па |
| Кр. точка | +241 °C, 63 бар |
| Мол. теплоёмк. | 112,4 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Давление пара | 44 ± 1 мм рт.ст. и 58 гПа |
| pKa | 15,9 |
| Растворимость в воде | неограничена |
| Показатель преломления | 1,3611 |
| Дипольный момент | (газ) 1,69 Д |
| ГОСТ | ГОСТ 17299-78 ГОСТ Р 55878-2013 ГОСТ 18300-87 ГОСТ 5962-2013 ГОСТ Р 51999-2002 ГОСТ Р 52574-2006 |
| Рег. номер CAS | 64-17-5 |
| PubChem | 702 |
| Рег. номер EINECS | 200-578-6 |
| SMILES |
CCO |
| InChI |
1S/C2H6O/c1-2-3/h3H,2H2,1H3 LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
| Кодекс Алиментариус | E1510 |
| RTECS | KQ6300000 |
| ChEBI | 16236 |
| Номер ООН | 1170 |
| ChemSpider | 682 |
| ЛД50 | 10 300 мг/кг |
| Токсичность |
метаболит, малотоксичен |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Этанол (этиловый спирт, метилкарбинол, винный спирт или алкоголь, часто в просторечии просто «спирт») — одноатомный спирт с формулой C2H5OH (эмпирическая формула C2H6O), рациональная формула: CH3-CH2-OH, аббревиатура EtOH, второй представитель гомологического ряда одноатомных спиртов, при стандартных условиях летучая, горючая, бесцветная прозрачная жидкость.
Действующий компонент алкогольных напитков является депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека.
Этиловый спирт также используется как топливо, в качестве растворителя, как наполнитель в спиртовых термометрах и как дезинфицирующее средство (или как компонент его).
Содержание
- 1 Получение
- 1.1 Брожение
- 1.1.1 Промышленное производство спирта из биологического сырья
- 1.1.2 Гидролизное производство
- 1.2 Гидратация этилена
- 1.3 Очистка этанола
- 1.4 Абсолютный спирт
- 1.1 Брожение
- 2 Свойства
- 2.1 Физические свойства
- 2.2 Химические свойства
- 2.3 Пожароопасные свойства
- 3 Применение
- 3.1 Топливо
- 3.2 Химическая промышленность
- 3.3 Медицина
- 3.4 Парфюмерия и косметика
- 3.5 Пищевая промышленность
- 3.6 Прочее
- 4 Мировое производство этанола
- 5 Применение этанола в качестве автомобильного топлива
- 5.1 Автомобильный парк, работающий на этаноле
- 5.2 Экономичность
- 5.3 Экологические аспекты
- 6 Безопасность и регулирование
- 7 Действие этанола на организм человека
- 8 Виды и марки этанола
- 9 Этимология названий
- 9.1 Этимология термина «этанол»
- 9.2 Этимология названия «алкоголь»
- 9.3 Этимология слова «спирт»
Получение
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена).
Брожение
См. также: Биоэтанол § Брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала картофеля, риса, кукурузы. Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
-
- C6H12O6 → 2C2H5OH + 2CO2
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции.
Для получения этанола этим способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
Промышленное производство спирта из биологического сырья
Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
- Подготовка и измельчение крахмалистого сырья — зерна (прежде всего — ржи, пшеницы), картофеля, кукурузы, яблок и т. п.
- Ферментация. На этой стадии происходит ферментативное расщепление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путём — глюкамилаза, амилосубтилин.
- Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в браге спирта.
- Брагоректификация. Осуществляется на разгонных колоннах.
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ), не является безводным, содержание этанола в нём до 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
- Альфа
- Люкс
- Экстра
- базис
- высшей очистки
- 1 сорт
Производительность современного спиртового завода составляет около 30 000—100 000 литров спирта в сутки.
Гидролизное производство
Основная статья: Гидролизный спирт
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
Гидратация этилена
В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
- прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
-
- CH2 = CH2 + H2O → C2H5OH
- гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
-
- CH2 = CH2 + H2SO4 → CH3CH2OSO2OH
-
- CH3CH2OSO2OH + H2O → CH3CH2OH + H2SO4
Эта реакция осложняется параллельной реакцией образования диэтилового эфира.
Очистка этанола
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.); эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15 °C.
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 °C, в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами, например, спирт обрабатывают веществами, реагирующими с водой или поглощающими воду, такими, как негашёная известь CaO или прокалённый медный купорос CuSO4.
Свойства
Физические свойства
В обычных условиях представляет собой бесцветную, легкоподвижную, летучую жидкость с характерным запахом и сладковато-жгучим вкусом.
Плотность этилового спирта 0,7905 г/см3 при 20 °C, он легче воды.
Является хорошим растворителем многих органических веществ и некоторых неорганических солей.
Физические свойства абсолютированного этанола (100 %) немного отличаются от свойств спирта-ректификата с концентрацией 95,57 %. Их свойства почти одинаковы, но численные величины различаются на 0,1—0,01 %.
| Молекулярная масса | 46,069 а. е. м. |
| Температура плавления | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | Смешивается в произвольных отношениях с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | Показатель преломления (для D-линии натрия) 1,3611 (при 20 °C) (температурный коэффициент показателя преломления −4,0⋅10−4/°C, почти постоянный в интервале температур 10—30 °C) |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 4,81 кДж/моль |
| Энтальпия кипения ΔHкип | 839,3 кДж/моль |
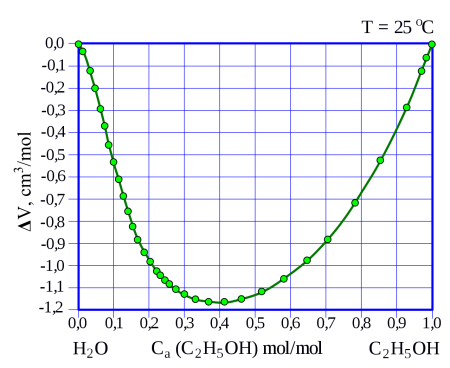
Уменьшение объёма смеси при смешивании этанола с водой при разных мольных долях этанола в растворе. При мольной доле в 40 % снижение объёма максимально.
Смесь по массе 95,57 % этанола и 4,43 % воды является азеотропной, т. е. не разделяется при перегонке, кипит при нормальном давлении при температуре 78,174 °C, в то время как абсолютированный этанол имеет более высокую точку кипения 78,39 °C.
С водой этанол смешивается в произвольном отношении, при смешивании наблюдается значительное, до нескольких процентов уменьшение объёма смеси относительно исходного суммарного объёма чистых веществ, например, при смешивании 50 мл этанола с 50 мл воды образуется 97 мл раствора. Также смешивание сопровождается некоторым нагревом смеси.
Абсолютный этанол затвердевает при температуре −114,5 °C. Температура плавления смесей этанола с водой уменьшается при увеличении концентрации этанола в растворе и достигает минимума при массовой концентрации этанола в воде равной 93,5 % — эвтектики этанол-вода, имеющей температуру плавления −118 °C. При низких температурах, ниже −20 °С водный раствор этанола (96 %) практически не испаряется и превращается в вязкую жидкость. При −70 °C он становится ещё более вязким и по текучести напоминает густой мёд.
Химические свойства
Анимация трёхмерной модели молекулы этанола
Типичный представитель одноатомных спиртов.
Горюч. Легко воспламеняется. При достаточном доступе воздуха горит (за счёт его кислорода) светлым голубоватым пламенем, образуя терминальные продукты окисления — диоксид углерода и воду:
-
- C2H5OH + 3O2 → 2CO2 + 3H2O
Ещё энергичнее эта реакция протекает в атмосфере чистого кислорода.
При определённых условиях (температура, давление, катализаторы) возможно и контролируемое окисление (как элементным кислородом, так и многими другими окислителями) до ацетальдегида, уксусной кислоты, щавелевой кислоты и некоторых других продуктов, например:
- 3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
Обладает слабо выраженными кислотными свойствами, в частности, подобно кислотам взаимодействует со щелочными металлами, а также магнием, алюминием и их гидридами, выделяя при этом водород и образуя солеподобные этилаты, являющиеся типичными представителями алкоголятов:
-
- 2C2H5OH + 2K → 2C2H5OK + H2
-
- C2H5OH + NaH → C2H5ONa + H2
Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров:
-
- C2H5OH + RCOOH ⇄ RCOOC2H5 + H2O
-
- C2H5OH + HNO2 ⇄ C2H5ONO + H2O
С галогеноводородами (HCl, HBr, HI) вступает в обратимые реакции нуклеофильного замещения:
-
- C2H5OH + HX ⇄ C2H5X + H2O
Без катализаторов реакция с HCl идет относительно медленно; значительно быстрее — в присутствии хлорида цинка и некоторых других кислот Льюиса.
Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты, например:
-
- 3C2H5OH + PCl3 → 3C2H5Cl + H3PO3
Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например:
-
- C2H5OH + CH2 = CHCN → C2H5OCH2CH2CN
реагирует с альдегидами с образованием полуацеталей и ацеталей:
-
- C2H5OH + RCHO → RCH(OH)OC2H5
-
- C2H5OH + RCH(OH)OC2H5 → RCH(OC2H5)2 + H2O
При умеренном (не выше 120 °C) нагревании с концентрированной серной кислотой или другими водоотнимающими средствами кислотного характера образует диэтиловый эфир:
-
- 2C2H5OH → C2H5OC2H5
При более сильном нагревании с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия происходит более глубокая дегидратация. При этом образуется этилен:
-
- C2H5OH → CH2 = CH2 + H2O
При использовании катализаторов, содержащих наряду с оксидом алюминия высокодисперсное серебро и другие компоненты, процесс дегидратации может быть совмещён с контролируемым окислением этилена элементным кислородом, в результате чего с удовлетворительным выходом удается реализовать одностадийный процесс получения окиси этилена:
-
- 2C2H5OH + O2 → 2C2H4O + 2H2O
В присутствии катализатора, содержащего оксиды алюминия, кремния, цинка и магния, претерпевает серию сложных превращений с образованием в качестве основного продукта бутадиена (реакция Лебедева):
-
- 2C2H5OH → CH2 = CH — CH = CH2 + 2H2O + O2
В 1932 году на основе этой реакции в СССР было организовано первое в мире крупнотоннажное производство синтетического каучука.
В слабощелочной среде образует иодоформ:
-
- C2H5OHA + 4I2 + 6NaHCO3 → CHI3 + HCOONa + 5NaI + 5H2O + 6CO2
Эта реакция имеет некоторое значение для качественного и количественного определения этанола в отсутствии других веществ, дающих подобную реакцию.
Пожароопасные свойства
Легковоспламеняющаяся бесцветная жидкость; давление насыщенного пара, кПа: lg p = 7.81158-1918.508/(252.125+t) при температуре от −31 до 78°С; теплота сгорания — 1408 кДж/моль; теплота образования −239,4 кДж/моль; температура вспышки 13°С (в закрытом тигле), 16°С (в открытом тигле); температура воспламенения 18°С; температура самовоспламенения 400°С; концентрационные пределы распространения пламени 3,6—17,7 % объёма; температурные пределы распространения пламени: нижний 11°С, верхний 41°С; минимальная флегматизирующая концентрация, % объёма: CO2 — 29.5, H2O — 35.7, N2 — 46; максимальное давление взрыва 682 кПа; максимальная скорость нарастания давления 15,8 МПа/с; скорость выгорания 0,037 кг/(м2•с); максимальная нормальная скорость распространения пламени — 0,556 м/с; минимальная энергия зажигания — 0,246 МДж; минимальное взрывоопасное содержание кислорода 11,1 % объёма.
Применение
Топливо
Первым использовал этанол в качестве моторного топлива Генри Форд, который в 1880 г. создал первый автомобиль, работающий на этаноле. Возможность использования спиртов в качестве моторного топлива была показана также в 1902 г., когда на конкурсе в Париже были выставлены более 70 карбюраторных двигателей, работающих на этаноле и смесях этанола с бензином.
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей (так, 75%-й водный этанол использовался в качестве топлива в первой в мире серийной баллистической ракете — немецкой «Фау-2» и ранних советских ракетах конструкции Королёва — от Р-1 до Р-5), двигателей внутреннего сгорания, бытовых, походных и лабораторных нагревательных приборов (т. н. «спиртовок»), грелок для туристов и военнослужащих (каталитическое автоокисление на платиновом катализаторе). Ограниченно (в силу своей гигроскопичности) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — Этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ.
Химическая промышленность
- служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- является компонентом антифризов и стеклоомывателей;
- в бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
В медицине этиловый спирт в первую очередь используется как растворитель, экстрагент и антисептик
См. также: Медицинский антисептический раствор
- по своему действию этиловый спирт можно отнести к антисептикам;
- как обеззараживающее и подсушивающее средство, наружно;
- подсушивающие и дубящие свойства 97%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
- консервант настоек и экстрактов (минимальная концентрация 18 %);
- пеногаситель при подаче кислорода, искусственной вентиляции лёгких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания);
- компонент общей анестезии в ситуации дефицита медикаментозных средств;
- как пеногаситель при отёке лёгких в виде ингаляции 33 % раствора;
- этанол является противоядием при отравлении некоторыми токсичными спиртами, такими, как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты).
Парфюмерия и косметика
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
Наряду с водой, является основным компонентом спиртных напитков (водка, вино, джин, пиво и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 %), в квасе — от 0,5 до 1,2 %.
Растворитель для пищевых ароматизаторов. Может быть использован как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Зарегистрирован в качестве пищевой добавки E1510.
Энергетическая ценность этанола — 7,1 ккал/г.
Прочее
Применяется для фиксирования и консервирования биологических препаратов.
Мировое производство этанола
Производство этанола по странам, млн литров.
| Страна | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 |
|---|---|---|---|---|---|---|---|
| США | 13 362 | 16 117 | 19 946 | 24 565 | 34 776 | 40 068 | 45 360 |
| Бразилия | 15 078 | 15 978 | 16 977 | 18 972,58 | 24 464,9 | — | — |
| Евросоюз | — | — | — | 2 155,73 | 2 773 | — | — |
| Китай | 3 643 | 3 795 | 3 845 | 1 837,08 | 1 897,18 | — | — |
| Индия | 1 746 | 1 697 | 1 897 | 199,58 | 249,48 | — | — |
| Франция | 827 | 907 | 948 | — | — | — | — |
| Германия | 268 | 430 | 764 | — | — | — | — |
| Россия | 760 | 860 | 608 | 609 | 536 | 517 | 700 |
| ЮАР | 415 | 389 | 387 | — | — | — | — |
| Великобритания | 400 | 351 | 279 | — | — | — | — |
| Испания | 298 | 298 | 463 | — | — | — | — |
| Таиланд | 279 | 298 | 352 | 299,37 | 339,4 | — | — |
| Колумбия | — | — | 279 | 283,12 | 299,37 | — | — |
| Весь мир: | 40 710 | 45 927 | 50 989 | 49 524,42 | 65 527,05 | — | — |
Применение этанола в качестве автомобильного топлива
Основная статья: Биоэтанол
Топливный этанол делится на биоэтанол и этанол, полученный другими методами (из отходов пластмасс, синтезированный из газа и т. п.).
Биоэтанол — это жидкое этанолсодержащее топливо, получаемое специальными заводами из крахмал-, целлюлозно- или сахаросодержащего сырья по системе укороченной дистилляции (позволяет получать качество, достаточное для использования в качестве топлива). Содержит метанол и сивушные масла, что делает его совершенно непригодным для питья. Применяется в чистом виде (точнее в виде азеотропа 96,6 %), а чаще в смеси с бензином (так называемый газохол) или дизельным топливом. Производство и использование биоэтанола увеличивается в большинстве стран мира, как более экологичная и возобновляемая альтернатива нефти.
Полноценно использовать биоэтанол способны лишь автомобили с соответствующим двигателем или с универсальным Flex-Fuel (способен потреблять смеси бензин/этанол с любым соотношением). Бензиновый двигатель способен потреблять бензин с добавкой этанола не более 30 %, возможно также переоборудование обычного бензинового двигателя, но это экономически нецелесообразно.
Проблемой является недостаточная смешиваемость бензина и дизельного топлива с этанолом, из-за чего последний нередко выслаивается (при низких температурах всегда). Особенно эта проблема актуальна для России. Решения этой проблемы на данный момент не найдено.
Преимуществом смесей этанола с другими видами топлива перед «чистым» этанолом является лучшая зажигаемость, благодаря низкому содержанию влаги, тогда как «чистый» этанол (марка E100, с практическим содержанием C2H5OH 96,6 %) является неразделяемым дистилляцией азеотропом. Разделение же иными способами невыгодно. При добавлении этанола к бензину или дизелю происходит выслаивание воды.
В разных странах действуют следующие государственные программы применения этанола и содержащих его смесей на транспорте с двигателями внутреннего сгорания:
| Страна | Требования |
|---|---|
| Бразилия | 22—25 % этанола в бензине, 2 % в дизельном топливе, доступны высокоэтанольные марки (E85, E100), их процент на рынке плавно увеличивают. Основной источник — сахарный тростник. Около 45 % мирового производства. |
| США | На США приходится 44,7 % мирового производства топливного спирта. Внедряются марки смеси этанола и бензина (E85, E10). Предполагается ввести 20 % к 2020 году. |
| Венесуэла | 10 % этанола в бензине. |
| Евросоюз | До ~6 % добавляется в обязательном порядке, внедряются этанольные марки E10 и выше. |
| Китай | Производит ежегодно 3 млн тонн к 2010 году. |
| Аргентина | Обязательна 5 % добавка этанола в любых марках бензина, внедряются марки с большим содержанием. |
| Таиланд | 5 % этанола является минимальным допустимым содержанием в бензине. |
| Украина | Законодательно установлено содержание 5 % этанола в бензине с 2013, и 7 % с 2014 года. На заправках широко продается топливо с содержанием биоэтанола от 30 до 37,2 % |
| Колумбия | 10%-я смесь в больших городах к сентябрю 2005 года. |
| Канада | 5%-я смесь с сентября 2010 года |
| Япония | Разрешено 3%-е содержание этанола в бензине и менее. |
| Индия | 20 % биотоплив к 2017 году. Сейчас 5 %. Производится из самого различного сырья, в частности из древесной стружки. |
| Австралия | Этанола в бензине не более 10 %, марка E10. |
| Индонезия | 10 % спирта в бензине. |
| Филиппины | E10 постепенно внедряется. |
| Ирландия | Марки E5-E10 достаточно широко применяются и продолжат внедряться. |
| Дания | Аналогично Ирландии. |
| Чили | Разрешено 2 % содержание этанола в автомобильном топливе. |
| Мексика | 3,2 % биотоплива в автомобильном топливе к 2012 году обязательно. В Америке самая неохотно внедряющая биотопливо страна. |
В США «Энергетический билль», подписанный президентом Бушем в августе 2005 года, предусматривает производство к 2012 году ежегодно 30 миллиардов литров этанола из зерна и 3,8 миллиардов литров из целлюлозы (стебли кукурузы, рисовая солома, отходы лесной промышленности).
Внедрение производства биотоплива является затратным процессом, однако дает экономике преимущества впоследствии. Так, например, строительство завода по производству этанола мощностью 40 млн галлонов даёт экономике (на примере США):
- 142 млн долл. инвестиций во время строительства;
- 41 рабочее место на заводе, плюс 694 рабочих места во всей экономике;
- Увеличивает местные цены на зерновые на 5—10 центов за бушель;
- Увеличивает доходы местных домохозяйств на 19,6 млн долл. ежегодно;
- Приносит в среднем 1,2 млн долларов налогов;
- Доходность инвестиций 13,3 % годовых.
В 2006 г. этаноловая индустрия дала экономике США:
- 160231 новых рабочих мест во всех секторах, включая 20000 рабочих мест в строительстве;
- Увеличила доходы домохозяйств на $6,7 миллиарда;
- Принесла $2,7 млрд федеральных налогов и $2,3 млрд местных налогов.
В 2006 году в США было переработано в этанол 2,15 миллиарда бушелей кукурузы, что составляет 20,5 % годового производства кукурузы. Этанол стал третьим по величине потребителем кукурузы после животноводства и экспорта. На этанол перерабатывается 15 % урожая сорго США.
Производство барды этаноловой промышленностью США, метрических тонн в сухом весе.
| 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2020 прогноз |
|---|---|---|---|---|---|---|---|---|
| 2,3 млн. | 2,7 млн. | 3,1 млн | 3,6 млн. | 5,8 млн. | 7,3 млн. | 9,0 млн. | 12 млн. | 20 млн. |
Барда является вторичным кормовым сырьём, а также может быть использована для получения биогаза.
Автомобильный парк, работающий на этаноле
Смесь этанола с бензином обозначается буквой Е. Цифрой у буквы Е обозначается процентное содержание этанола. Е85 означает смесь из 85 % этанола и 15 % бензина.
Смеси до 20 % содержания этанола могут применяться на любом автомобиле. Однако некоторые производители автомобилей ограничивают гарантию при использовании смеси с содержанием более 10 % этанола. Смеси, содержащие более 20 % этанола, во многих случаях требуют внесения изменения в систему зажигания автомобиля.
Автопроизводители выпускают автомобили, способные работать и на бензине, и на Е85. Такие автомобили называются «Flex-Fuel». В Бразилии такие автомобили называют «гибридными». В русском языке названия нет. Большинство современных автомобилей либо изначально поддерживают использование такого топлива, либо опционально, по соответствующему запросу.
В 2005 году в США более 5 млн автомобилей имели гибридные двигатели. В конце 2006 г. в США эксплуатировалось 6 млн автомобилей с такими двигателями. Общий автопарк составляет 230 млн автомобилей.
1200 заправочных станций продают Е85 (май 2007). Всего в США автомобильное топливо продают около 170 000 заправочных станций.
В Бразилии около 29 000 заправочных станций продают этанол.
Экономичность
Себестоимость бразильского этанола (около 0,19 долларов США за литр в 2006 г.) делает его использование экономически выгодным.
Экологические аспекты
Биоэтанол как топливо часто называют «нейтральным» в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующем сгорании выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями. Однако ректификация этанола требует дополнительных затрат энергии, вырабатываемой одним из «традиционных» способов (в том числе и сжиганием ископаемого топлива).
В 2006 году применение этанола в США позволило сократить выбросы около 8 млн тонн парниковых газов (в CO2 эквиваленте), что примерно равно годовым выхлопам 1,21 млн автомобилей.
Безопасность и регулирование
- Этанол — горючее вещество, смесь его паров с воздухом взрывоопасна.
- Спирт этиловый синтетический, технический и пищевой, непригодный для производства алкогольной продукции, входит в список ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации.
- С 2005 года розничная продажа спирта в России запрещена (за исключением районов Крайнего Севера).
- О налогообложении питьевого спирта см. Алкогольные напитки — Акциз
Действие этанола на организм человека
Основные статьи: Токсикология этанола, Алкоголизм
В биохимии этанола существенную роль играет тот факт, что он образует растворы в широком диапазоне пропорций как с водой, так и с жирами. Является побочным продуктом метаболизма глюкозы, в крови здорового человека может содержаться до 0,01% эндогенного этанола.
В зависимости от дозы, концентрации, пути попадания в организм и длительности воздействия этанол также может обладать наркотическим и токсическим действием. Под наркотическим действием обозначается его способность вызвать кому, ступор, нечувствительность к боли, угнетение функций ЦНС, алкогольное возбуждение, привыкание, а также его наркозное действие. Под действием этанола происходит выделение эндорфинов в прилежащем ядре (Nucleus accumbens), у страдающих алкоголизмом также в орбитофронтальной коре (поле 10). Тем не менее с юридической точки зрения этиловый спирт наркотиком не признан, так как это вещество не включено в международный список контролируемых веществ конвенции ООН 1988 года. В определённых дозах к массе тела и концентрациях приводит к острому отравлению и смерти (смертельная разовая доза — 4—12 граммов этанола на килограмм массы тела).
Основной метаболит этанола ацетальдегид является токсичным, мутагенным и канцерогенным веществом. Существуют доказательства канцерогенности ацетальдегида в экспериментах на животных; кроме того, ацетальдегид повреждает ДНК.
Длительное употребление этанола может вызвать такие заболевания, как цирроз печени, гастрит, некротизирующий панкреатит, язва желудка, рак груди, рак желудка и рак пищевода (то есть является канцерогеном), гемолитическая анемия, артериальная гипертензия, инсульт, стать причиной внезапной смерти людей, страдающих ишемической болезнью сердца; может вызвать серьёзные нарушения обмена веществ. Алкоголь может увеличить риск рождения ребёнка с врождёнными аномалиями нервной системы и обусловить задержку роста.
Употребление этанола может вызвать оксидативное повреждение нейронов головного мозга, а также их гибель вследствие повреждения гемато-энцефалического барьера.
Злоупотребление алкогольными напитками может привести к клинической депрессии и алкоголизму.
Приём алкогольных напитков на фоне приёма лекарств очень нежелателен, так как алкоголь извращает действие лекарственных средств и вследствие этого становится опасен для жизни человека. Отрицательное влияние алкогольных напитков на результаты фармакотерапии многообразно и зависит от различных факторов: индивидуальных свойств больного, его чувствительности, тяжести заболевания, но во всех случаях у пациентов, принимающих лекарства и потребляющих алкоголь, эффективность фармакотерапии ослабляется, а порой и сводится на нет.
Этанол может в небольших количествах синтезироваться в просвете желудочно-кишечного тракта в результате процессов ферментации углеводной пищи микроорганизмами (условный эндогенный алкоголь). Существование биохимических реакций с синтезом этанола в тканях организма человека (истинно эндогенный алкоголь) полагается возможным, но не доказано к настоящему моменту. Количество эндогенного алкоголя редко превышает 0,18 промилле, что находится на границе чувствительности самых современных приборов. Обычный алкотестер такие количества определить не может.
Виды и марки этанола
- Ректификат (точнее, спирт-ректификат) — это очищенный путём ректификации этиловый спирт, содержит 95,57 %, химическая формула C2H5OH.
- Спирт этиловый абсолютированный — содержание спирта >99,9 %.
- Спирт медицинский — содержание спирта 96,4—97 %.
Этимология названий
Для обозначения данного вещества используется несколько наименований. Технически наиболее правильным является термин этанол или этиловый спирт. Однако значительное распространение получили названия алкоголь, винный спирт или просто спирт, хотя спирты, или алкоголи — это более широкий класс веществ.
Этимология термина «этанол»
Названия этанол и этиловый спирт указывают на то, что данное соединение содержит в своей основе этил — радикал этана. При этом слово спирт (суффикс -ол) в названии указывает на содержание гидроксильной группы (-OH), характерной для спиртов.
Этимология названия «алкоголь»
Название алкоголь происходит от араб. الكحل аль-кухуль, означающего мелкий порошок, полученный возгонкой, порошкообразная сурьма, порошок для подкрашивания век. В средневековой латыни словом лат. alcohol обозначали порошки, дистиллированную воду.
В русский язык слово «алкоголь» пришло через его немецкий вариант нем. alkohol. Однако в русском языке сохранился в виде архаизма, по всей видимости, и омоним слова «алкоголь» в значении «мелкий порошок».
Этимология слова «спирт»
Наименование этанола винный спирт произошло от лат. spiritus vini (дух вина). В русский язык слово «спирт» пришло через английский его вариант англ. spirit.
В английском языке слово «спирт» в данном значении использовалось уже в середине XIII века, и только начиная с 1610 года слово «спирт» стало употребляться алхимиками для обозначения летучих веществ, что соответствует основному значению слова «spiritus» (испарения) в латинском языке. К 1670-м годам значение слова сузилось до «жидкостей с высоким процентным содержанием алкоголя», а летучие жидкости получили название эфиров.
См. также Этимология названия в статье «Спирты».
|
Спирты |
|
|---|---|
| (0°) |
Метанол |
| Первичные спирты (1°) |
Этанол · Пропанол · н-Бутанол · Изобутанол · Амиловый спирт · Гексанол · Гептанол · Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) |
Изопропиловый спирт · втор-Бутанол · Гексан-2-ол |
| Третичные спирты (3°) |
трет-Бутанол · 2-Метилбутан-2-ол |
|
Алкогольные напитки |
|
|---|---|
| Высокоалкогольные (66—96 %) |
|
| Крепкие (31—65 %) |
|
| Среднеалкогольные (9—30 %) |
|
| Слабоалкогольные (1,5—8 %) |
|
Владимир Шильцев, Елизавета Шильцева
«Наука из первых рук» №3(83), 2019
Периодическую таблицу химических элементов, изобретенную великим русским химиком Дмитрием Ивановичем Менделеевым в 1869 г., сегодня можно встретить в классных комнатах во всех уголках мира. Генеральная Ассамблея ООН объявила 2019 г. Международным годом Периодической таблицы, чтобы отметить заслуги нашего выдающегося соотечественника. Но народный миф также приписывает Менделееву изобретение классической русской водки — смеси 40 частей спирта и 60 частей воды. Хотя Дмитрий Иванович действительно написал революционную работу о соединении спирта с водой, сам миф состоит из двух частей правды и, как водка, трех частей «воды».
Об авторах
|
Владимир Дмитриевич Шильцев — русский и американский физик, специалист в области физики частиц высоких энергий и физики ускорителей. Работает в Национальной ускорительной лаборатории им. Э. Ферми (США). Награжден рядом престижных премий и наград, в том числе Премией им. Нишикава за выдающиеся достижения в области ускорителей (2019). Председатель Международного академического совета Новосибирского государственного университета. |
|
Елизавета Владимировна Шильцева — студентка II курса биологического факультета Иллинойсского университета в г. Урбана-Шампейн (США). |
«Образование — это то, что остается после того, как вы забыли все, чему вас учили» — различные варианты этого выражения приписывают лорду Галифаксу, Агнес Перкинс и Альберту Эйнштейну. С этой точки зрения вклад науки в культуру может быть представлен именами и лицами, получившими широкое признание, а иногда и мифами, связанными с величайшими учеными.
Возьмем, к примеру, Исаака Ньютона. Трудно сказать, как много людей старше тридцати могут вспомнить точные формулировки закона всемирного тяготения или трех законов механики Ньютона. Но все помнят, что на голову ученого упало яблоко, прервавшее его размышления и заставившее его впервые задуматься о земном притяжении. Кстати, этот миф считают выдумкой Вольтера.
Высказывание Eppur si muove! («И все-таки она вертится!») приписывают Галилею, которого пытались заставить отказаться от системы Коперника и признать, что Земля стоит в центре Вселенной. Эти слова, предположительно сказанные им на смертном одре, символизируют непоколебимость свободного духа настоящего исследователя. А Бенджамин Франклин прославился своим экспериментом с воздушным змеем, с помощью которого он «извлек электричество из небес» во время грозы. Как утверждают, Франклину удалось передать заряд атмосферного электричества к земле по «громоотводу» — мокрой веревке с ключом, привязанной к металлическому штырю на змее. Теперь его лицо, напечатанное на стодолларовой купюре, знают все.
Само собой разумеется, многие из этих мифов развенчаны современной наукой. Но они, тем не менее, продолжают жить, так как «подшивают» великие имена к ткани нашей общей культуры.
К этому же редкому созвездию гениев принадлежит Дмитрий Иванович Менделеев. Периодическая таблица химических элементов, которую он изобрел в 1869 г., занимает, возможно, самое большое место на стенах в каждой классной комнате во всем мире. Как и в случае с другими эпохальными открытиями, таблицу знают все, но детали ее прочно забыты подавляющим большинством. При этом имя ученого узнаваемо: в России оно известно практически всем, за рубежом — многим (хотя для «чужого» уха у него длинноватое имя). Портрет Менделеева легко идентифицируется как «кто-то из классиков», поскольку он обладал замечательной шевелюрой, как и Эйнштейн, Галилео, Ньютон и Франклин. Хотя сомнительно, что более 5% респондентов из случайной выборки смогут отличить портрет Менделеева от портрета его современника, английского эволюциониста Чарльза Дарвина.
Главный миф о Менделееве состоит в том, что его периодический закон был бессознательным продуктом «идеи-инкубации». Якобы, уснув однажды февральским вечером после утомительного рабочего дня, Дмитрий Иванович во сне увидел, каким образом должны быть сгруппированы химические элементы с похожими свойствами. Проснувшись, записал мысль на клочке бумаги и опять уснул. Конечно, это легенда, но сама идея подобной продуктивности сна для научных изысканий очень популярна среди студентов и молодых исследователей. Несмотря на отсутствие объективных доказательств эффективности такого метода.
«Дискурс о соединении спирта и воды»
То, что делает имя Менделеева еще более известным, связано с еще одним широко распространенным мифом. Менделееву приписывают изобретение водки — смеси из 40 частей чистого спирта и 60 частей воды.
В России эта легенда появилась после смерти ученого в 1907 г., удовлетворив общее стремление придать легитимность любому потенциальному фрагменту национальной культуры, и до сих живет в многочисленных анекдотах, фильмах, книгах и даже научных трудах. Миф легко распространился за границей вместе с водкой. Например, каждый раз, посещая винный магазин в США, на одной из бутылок с красочной этикеткой можно прочитать, что «… в 1894 г. Дмитрий Менделеев, величайший ученый России, получил указ установить Имперский стандарт качества для русской водки, и так появился „Русский Стандарт“» (конечно, речь здесь идет о торговой марке, но упор делается на высокий научный стандарт).
Этот миф, как и сама водка, состоит из двух частей правды и трех частей «воды». Правда в том, что докторская диссертация Менделеева 1865 г. действительно была «дискурсом о соединении спирта и воды». Это был шедевр физика-экспериментатора, который пытался выяснить, что можно узнать о взаимодействии молекул с помощью прецизионных (с точностью выше 0,01%) измерений плотности и теплового расширения смеси разных количеств алкоголя и воды.
Менделеев подробно изучил изменение плотности такой смеси и обнаружил, что при 52% содержании спирта по объему или 46% по массе, она увеличивается примерно на 1/40. У него возникла идея о существовании ассоциаций молекул H2O и C2H5OH (благодаря, как мы теперь знаем, водородным связям), которые наиболее стабильны при определенных концентрациях. Например, при 46% спирта по массе наиболее стабильна ассоциация из трех молекул воды и одной молекулы спирта. Он также явственно увидел указания на существование устойчивых ассоциаций из трех молекул спирта и одной молекулы воды в более «крепком» растворе и одной молекулы спирта и двенадцати молекул воды — в более слабых растворах.
Водка — это…
Вот так, без современных микроскопов и методов, великий ученый смог понять взаимодействие молекул разных соединений и даже оценить силу этого взаимодействия. И сделал это задолго до последующих работ лауреата Нобелевской премии, голландца Ван дер Ваальса и других ученых. В качестве побочного результата исследований Менделеев изобрел наиболее эффективный способ получения самого чистого 100% спирта того времени путем химической очистки из сравнительно легко получаемой многократной дистилляцией и ректификацией смеси, содержащей 96% спирта и 4% воды.
Во второй половине XIX в. Менделеев, как эксперт по химическим технологиям в целом и по ректификации алкоголя в частности, а также как сторонник государственного курса на промышленное развитие страны, входил в Правительственную комиссию по введению эффективного акцизного налога. Речь шла о косвенных налогах на предметы внутреннего производства, которые производились и продавались частными лицами. В российском государственном бюджете в 1890 г. на долю таких косвенных налогов приходилось 45,4% всех доходов (Вебер, 1906). И главными источниками пополнения бюджета были доходы от государственной винной монополии и акцизы на алкогольную продукцию: в 1906 г. по этим статьям поступило более трети всего государственного бюджета.
Но, конечно, как в диссертации не было ни слова о том, что 40% (по объему) водка является оптимальной в каком-либо аспекте, так и в комиссии не велись обсуждения о лучшем способе ее смешивать.
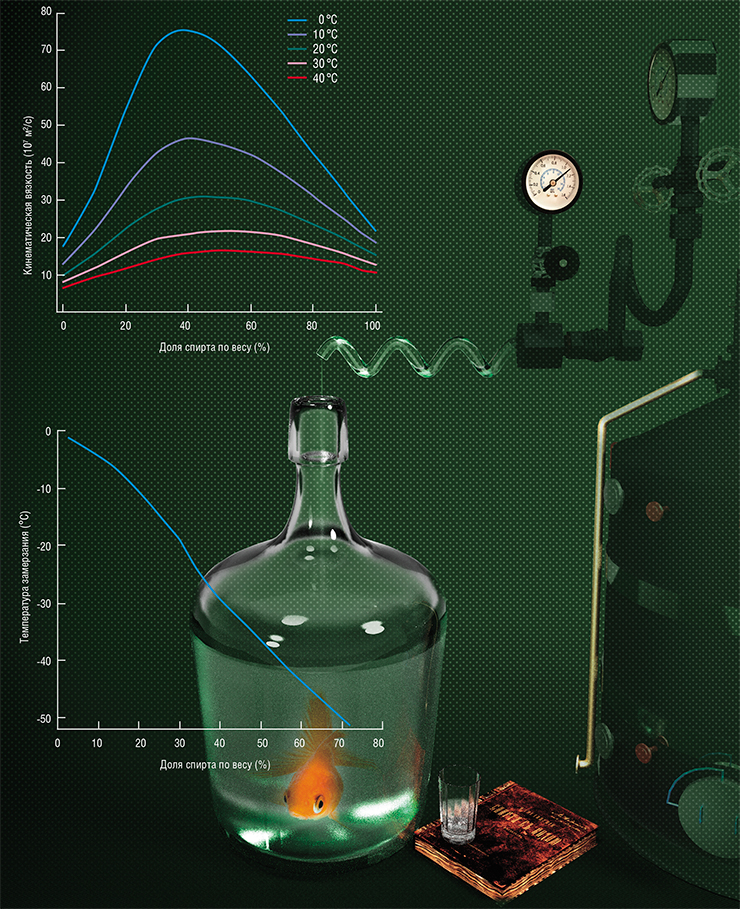
Тем не менее 40-процентная водка действительно обладает несколькими замечательными свойствами. При комнатной температуре такая смесь в три раза более вязкая, чем любая из первичных жидкостей, а водка из морозильника еще примерно в 2,5 раза более «сиропообразна». Поэтому настоятельно рекомендуется пить ее очень холодной, чтобы полностью насладиться тягучей «питкостью». И не следует бояться оставлять водку при низких температурах: бутылка не лопнет, как это случилось бы с любым напитком, в котором преобладает вода. Спирт действует как антифриз, позволяя смеси оставаться жидкой даже при температурах намного ниже нуля — водка замерзнет только при −25°C.
При содержании 40% и более алкоголя пары смеси можно поджечь при комнатной температуре. Этот эффект использовался еще со времен государственной монополии на производство и распределение водки, которая была введена в 1474 г. дедом Ивана Грозного, для простой проверки содержания алкоголя — чтобы кабатчики не разбавляли водку.
Метод не был достаточно точным, и следующая государственная монопольная реформа, проведенная Петром I в 1698 г., потребовала более сложного способа для определения качества продукции. Для этих целей поджигался полугар («сжигаемый пополам») — дистилляционная спиртовая смесь, обладающая приятным хлебным вкусом. При тестировании ее предварительно нагревали до кипения, а потом пары поджигали. После завершения горения оставшийся объем должен был составлять половину от исходного. Это соответствовало стандартной 38% смеси алкоголя плюс-минус несколько процентов.
Чиста как слеза
Что отличает водку от всех других крепких алкогольных напитков, таких как виски, ром, текила или шнапс, так это ее вкус, или, точнее, его отсутствие. До середины XIX в. водка представляла собой чистую или относительно чистую смесь с мягким хлебным вкусом, унаследованным от стадии дистилляции. Но в то время как другие крепкие напитки по-прежнему получают дистилляцией и потому сохраняют свои собственные специфические ароматы, водка — единственная из напитков — прошла революционную стадию химической технологии и теперь производится по-другому.
Процесс проходит четыре основных этапа: дистилляция (несколько раз), дополнительная ректификация (очистка), в результате которой получается смесь с содержанием спирта 90% или более, при этом все примеси отделяются. Затем следует разведение водой до 40% и дополнительная фильтрация через активированный уголь или другие виды абсорбентов. В результате концентрация простых эфиров, альдегидов, метилового спирта, фурфурола и комплексных масел — всех тех компонентов, которые составляют вкус и аромат и отличают, например, коньяк от виски, — уменьшается примерно до 0,01%. Это на два-три порядка меньше, чем в любом другом напитке.
Можно было ожидать, что в результате вкуса вообще не будет, но нет. На самом деле остается небольшой привкус, и различные конкурсы водок показывают, что действительно существуют различия, которые отражают качество исходного ректифицированного спирта, особенности воды и окончательной фильтрации. Таким образом, «плохая водка» может быть обнаружена, как говорится, прямо «на месте» только в том случае, если она имеет ярко выраженный вкус. Но все хорошие водки не имеют такого вкуса, весьма мягки и обладают «питкостью». Так что единственным реальным показателем их превосходного качества является «состояние на следующее утро».
На протяжении как минимум шести веков водка глубоко укоренилась в культуре России, Польши и скандинавских стран. В России хорошая вечеринка требует, по крайней мере, обязательного наличия хорошего повода, хорошей компании, хорошей еды и хорошей водки. Считается, что соблюдение этих условий противодействуют алкоголизму. Трудно сказать, насколько они эффективны, но, к примеру, тосты в России почти обязательны, причем три наиболее распространенных — «за повод» (причина собрания), «за здоровье!» и «за дам!». Также принято считать, что оптимальный размер компании, способной вести дискуссию за столом, варьирует «между числом граций и числом муз» (т. е. от трех до девяти согласно греческой мифологии).
Водку полагается пить холодной и залпом, одним глотком. Учитывая высокую концентрацию алкоголя, типичный объем разового «залпа» варьирует от 50 до 100 г. Соответственно, традиционные формы водочных рюмок (лафитников, стопок) таковы, что позволяют выпить содержимое «разом», поэтому имеют широкую верхнюю часть и широкое или утяжеленное дно.
Чтобы получать удовольствие, а не проблемы, с водкой, как и с огнем, нужно обращаться должным образом. И помнить, что у водки есть не только долгая история и принадлежность к нашему культурному наследию, но и вполне предсказуемые последствия, как приятные и неприятные. Сам Менделеев, у которого один из старших братьев злоупотреблял алкоголем, водку не пил, предпочитая хорошее красное вино. И с экономической точки зрения особых надежд на нее как на источник казенного дохода не возлагал — в отличие от производства и продажи за границу качественного, хорошо очищенного этилового спирта (Бондаренко, 1999).
«Неужели, в самом деле, положение наше таково, — писал он в 1883 г., — что в кабаке, казенном или частном, должно видеть спасение для экономического быта народа, т. е. России, и в водке, да в способах ее потребления искать исхода для улучшения современного состояния дел народных и государственных» (РГИА. Ф. 575. Оп. 2. Д. 1229, 485 об.; цит. по: Бондаренко, 1999).
Авторы и редакция благодарят д. х. н. И. С. Дмитриева, директора Музея-архива Д. И. Менделеева СПбГУ, за помощь в подготовке дополнительного и иллюстративного материалов к статье.
Литература
1. Бондаренко Л. Б. Из истории русской спиртометрии // Вопросы истории естествознания и техники. 1999. № 2.
2. Дмитриев И. С. Герой мифов и легенд // Природа. 2009. № 1. С. 110–116.
3. Михайлов О. В. Легенды и были о Менделееве, русской водке и сверхкритических флюидах // Вестник Российской академии наук. 2013. Т. 83. № 4. С. 381–384.
4. Похлебкин В. В. История водки (IX–XX вв.). М.: Интер-Версо, 1991.
5. Родионов Б. В. История русской водки от полугара до наших дней. М.: ЭКСМО, 2011.
6. Сажин В. Б., Панов А. Ю. Национально-культурные и экономические аспекты бражничества в России до и после диссертации Д. И. Менделеева «О соединении спирта с водой» // Успехи в химии и химической технологии. 2007. Т. XXI. № 5(73). C. 95–101.
7. Элерт А. Х. Русские сибиряки и алкоголь. По материалам Второй Камчатской экспедиции // Наука из первых рук. 2006. Т. 12. № 6. С. 64–83.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Этиловый спирт
Брутто-формула:
C2H6O
CAS# 64-17-5
Категории:
Спирты
, Растворители
PubChem CID: 702
| ChemSpider ID: 682
| CHEBI:16236
| CHEMBL545
| CB2362508
| MolPort-001-785-844
Названия
Русский:
- Этанол(IUPAC) [Wiki]
- Этиловый спирт
- метилкарбинол
English:
- Absolute alcohol
- Alcohol
- Drinking alcohol
- EINECS:270-649-4
- Ethanol(IUPAC)(CAS) [Wiki]
- Ethyl alcohol
- Ethyl hydrate
- Ethyl hydroxide
- Ethylic alcohol
- Ethylol
- Grain alcohol
- Hydroxyethane
- Methylcarbinol
Варианты формулы:
CH3-CH2-OH
H-C-C-OH; H|#2|H; H|#3|H
/OH
H|C`/C|H; H_(A15,w-)#3_(A-120,d+)H; H_(A-120,w-)#2_(A15,d+)OH
C2H5OH
CH3CH2OH
HO/CH3
H3C/OH
H3C-CH2-OH
CH3CH2-OH
HO/
Вещества, имеющие отношение…
Альдегид:
Ацетальдегид
Предыдущий гомолог:
метиловый спирт
Следущий гомолог:
Пропиловый спирт
Химический состав
Реакции, в которых участвует Этиловый спирт
-
2C2H5OH + 2{M} = 2C2H5O{M} + H2″|^»
, где M =
Na K -
CH3CH2OH + {M}H -> CH3CH2O{M} + H2″|^»
, где M =
Na K -
CH3CH2OH + NaOH <=> CH3CH2ONa + H2O
-
CH2=CH2 + H2O -> C2H5OH
-
CH3CH2OH + H{Hal} -> CH3CH2{Hal} + H2O
, где Hal =
Cl Br
И ещё 42 реакции…
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
этиловый спирт
Синонимы:
винный спирт
метилкарбинол
этанол
Внешний вид:
бесцветн. жидкость
Брутто-формула (система Хилла): C2H6O
Формула в виде текста: C2H5OH
Молекулярная масса (в а.е.м.): 46,069
Температура плавления (в °C): -114,15
Температура кипения (в °C): 78,39
Температурные константы смесей:
64,79 °C (температура кипения азеотропа, давление 1 атм) бензол 62,4% вода 6,8% гептан 12,1% этиловый спирт 18,7%
78,174 °C (температура кипения азеотропа, давление 1 атм) вода 4% этиловый спирт 96%
76 °C (температура кипения азеотропа, давление 1 атм) нитрометан 29% этиловый спирт 71%
Растворимость (в г/100 г или характеристика):
бензол: смешивается
вода: смешивается
глицерин: смешивается
диэтиловый эфир: смешивается
метанол: смешивается
уксусная кислота: смешивается
хлороформ: смешивается
этанол: смешивается
Вкус, запах, гигроскопичность:
вкус: жгучий
Дополнительное описание:
Порог восприятия запаха в воздухе (мг/л) = 0,25
Метод очистки или выделения из смесей 1.
Источник информации: Гитис С.С., Глаз А.И., Иванов А.В. «Практикум по органической химии: Органический синтез» М.: Высшая школа, 1991 стр. 45
В круглодонную колбу вместимостью 2 л, снабженную обратным холодильником с хлоркальциевой трубкой, помещают 5 г магниевой стружки, 0,5 г иода и приливают 70… 75 мл этилового спирта. Смесь нагревают до тех пор, пока окраска иода не исчезнет. Если водород выделяется медленно, то добавляют еще 0,5 г нода и продолжают нагревать, пока весь магний не превратится в этилат. После этого в колбу вливают 900 мл абсолютного спирта и кипятят смесь в течение 30 мин. Затем колбу охлаждают, заменяют обратный холодильник нисходящим, герметично присоединяют приемник через алонж с хлоркальциевой трубкой и перегоняют. Если соблюдать все меры предосторожности против попадания влаги воздуха, то чистота полученного спирта превышает 99,95%. Такой обезвоженный спирт чрезвычайно гигроскопичен.
Плотность:
0,7893 (20°C, г/см3)
Показатель преломления (для D-линии натрия):
1,3611 (20°C)
Показатель диссоциации:
pKa (1) = 18 (20 C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-234,8 (г)
Стандартная энтропия образования S (298 К, Дж/моль·K):
281,38 (г)
Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
1,197 (г)
Энтальпия плавления ΔHпл (кДж/моль):
4,81
Энтальпия кипения ΔHкип (кДж/моль):
839,3
Температура вспышки в воздухе (°C):
13
Температура самовоспламенения на воздухе (°C):
404
Летальная доза (ЛД50, в мг/кг):
9000 (крысы, перорально)
Разные дозы:
Смертельная доза для взрослого человека = 300-400 мл 96% этанола в течение часа или 250 мл в течение 30 минут.
Смертельной дозой для детей может оказатся доза в 6-30 мл 96% этанола.
Биологическое действие:
При соприкосновении с тканями вызывает их раздражение. Дегидратирует протоплазму, растворяет жиры и вызывает коагуляцию белков (вяжущий эффект). Местнораздражающее действие сопровождается рефлекторным учащением дыхания, учащением пульса и сужением кровеносных сосудов, а также «отвлекающий» эффект. Обладает наибольшей бактерицидностью в концентрации 70%.
В малых дозах стимулирует дыхание, в больших дозах — угнетает. В малых дозах вызывает учащение и усиление сокращений сердца, в результате чего возможно небольшое повышение артериального давления. В больших дозах угнетает возбудимость вазомоторных центров, отчего расширяются кровеносные сосуды и давление понижается. Прямого действия на серце спирт не оказывает даже в очень больших концентрациях. Обладает незначительным мочегонным действием. Улучшает аппетит, усиливает выделение слюны и желудочного сока. Спирт способен тормозить окисление жиров и способствует превращению углеводов в жиры. Из-за нарушения работы терморегулирующих центров понижает температуру тела при увеличении теплоотдачи; это часто вызывает недооценку пьяными людьми температуры окружающего воздуха и их переохлаждение.
Симптомы острого отравления:
Относится к наркозным средствам жирного ряда. В результате действия на кору головного мозга вызывает опъянение с характерным алкогольным возбуждением. В больших дозах вызывает наркотический эффект. Заметная интоксикация этанолом начинается при содержании в крови 1,5 г/л, сильная интоксикация — при 3,5 г/л, уровень алкоголя в крови выше 5,5 г/л обычно смертелен. При тяжелом отравлении спиртом наблюдается стопорозное или коматозное состояние; кожа бледная, влажная, дыхание редкое, выдыхаемый воздух имеет запах спирта, пульс частый, температура тела понижена.
При обычном отравлении (алкогольное опъянение): Затрудняет сенсорные восприятия, понижает внимание, ослабляет память. При действии спирта характерно расстройство ассоциативных процессов, вследствие чего появляются дефекты мышления, суждений, дефекты ориентировки, самоконтроля, утрачивается критическое отношение к себе и окружающим событиям. Как правило имеет место переоценка собственных возможностей. Рефлекторные реакции замедленные и менее точные. Часто появляется говорливость. В эмоциональной сфере — эйфория, понижение болевой чувствительности (анальгезия). Угнетаются спинномозговые рефлексы, расстаивается координация движений. В большой дозе возбуждение сменяется угнетением и наступает сон.
Лечение отравлений:
Промывание желудка. Рвотные не рекомендуются. Использование аналептиков. Наилучшие результаты дает фенамин, также эффективны кофеин и эфедрин. При ослаблении дыхания необходимо назначать коразол или кордиамин, кислород, углекислоту. Положительное значение имеет внутривенное введение инсулина с глюкозой, а также тиамин-бромида и никотиновой кислоты. Пострадавший обязательно должен находится в тепле.
Критическая температура (в °C):
243
Критическое давление (в МПа):
6,38
Критическая плотность (в г/см3):
0,2755
Применение:
Растворитель в лакокрасочной и фармацевтической химии, в производстве кинофотоматериалов, товаров радиоэлектроники и бытовой химии. Сырье в получении диэтилового эфира, хлороформа, тетраэтилсвинца, ацетальдегида, уксусной кислоты, этилацетата, этилена и др. Компонент антифриза. Топливо для ракетных двигателей. Для производства спиртных напитков.
- «Неотложная помощь при острых отравлениях: Справочник по токсикологии» под ред. Голикова С.Н. М.:Медицина, 1977 стр. 105
- «Химическая энциклопедия» т.5 М.: Советская энциклопедия, 1999 стр. 501-503
- Гурвич Я.А. «Справочник молодого аппаратчика-химика» М.:Химия, 1991 стр. 229
- Закусов В.В. «Фармакология» М.:Медгиз, 1960 стр. 65-72
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 198-199
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- ЭТИЛОВЫЙ СПИРТ — химическая энциклопедия
- этиловый спирт — химическая энциклопедия
- Этиловый спирт — Токсикологическая химия
- Спирт этиловый — фармацевтический справочник
- Спирт этиловый — лекарственные препараты
- Этиловый спирт — лекарственные препараты
: 20 Авг 2019 , История «певчей» хромосомы , том 83,
№3
Менделеев и водка: синергия науки и мифа
Периодическую таблицу химических элементов, изобретенную великим русским химиком Дмитрием Ивановичем Менделеевым в 1869 г., сегодня можно встретить в классных комнатах во всех уголках мира. Генеральная Ассамблея ООН объявила 2019 г. Международным годом Периодической таблицы, чтобы отметить заслуги нашего выдающегося соотечественника. Но народный миф также приписывает Менделееву изобретение классической русской водки – смеси 40 частей спирта и 60 частей воды. Хотя Дмитрий Иванович действительно написал революционную работу о соединении спирта с водой, сам миф состоит из двух частей правды и, как водка, трех частей «воды»
«Образование – это то, что остается после того, как вы забыли все, чему вас учили» – различные варианты этого выражения приписывают лорду Галифаксу, Агнес Перкинс и Альберту Эйнштейну. С этой точки зрения вклад науки в культуру может быть представлен именами и лицами, получившими широкое признание, а иногда и мифами, связанными с величайшими учеными.
Возьмем, к примеру, Исаака Ньютона. Трудно сказать, как много людей старше тридцати могут вспомнить точные формулировки закона всемирного тяготения или трех законов механики Ньютона. Но все помнят, что на голову ученого упало яблоко, прервавшее его размышления и заставившее его впервые задуматься о земном притяжении. Кстати, этот миф считают выдумкой Вольтера.
В 1817 г. был принят «Устав о питейном сборе в 29 великороссийских губерниях», в соответствии с которым чиновник Министерства финансов должен был проверять «доброту» (крепость) вина «посредством отжига» его в отжигательнице. «В отжигательницу, которая есть простая кострюлька, вливают две равные стклянки вина и зажигают его; по окончании горения остаток вливается в одну из стклянок, и если вино действительный полугар, то остаток должен наполнить эту стклянку» (Бурнашев, 1843, с. 94).
По: (Бондаренко, 1999)
Высказывание Eppur si muove! («И все-таки она вертится!») приписывают Галилею, которого пытались заставить отказаться от системы Коперника и признать, что Земля стоит в центре Вселенной. Эти слова, предположительно сказанные им на смертном одре, символизируют непоколебимость свободного духа настоящего исследователя. А Бенджамин Франклин прославился своим экспериментом с воздушным змеем, с помощью которого он «извлек электричество из небес» во время грозы. Как утверждают, Франклину удалось передать заряд атмосферного электричества к земле по «громоотводу» – мокрой веревке с ключом, привязанной к металлическому штырю на змее. Теперь его лицо, напечатанное на стодолларовой купюре, знают все.
Само собой разумеется, многие из этих мифов развенчаны современной наукой. Но они, тем не менее, продолжают жить, так как «подшивают» великие имена к ткани нашей общей культуры.
К этому же редкому созвездию гениев принадлежит Дмитрий Иванович Менделеев. Периодическая таблица химических элементов, которую он изобрел в 1869 г., занимает, возможно, самое большое место на стенах в каждой классной комнате во всем мире. Как и в случае с другими эпохальными открытиями, таблицу знают все, но детали ее прочно забыты подавляющим большинством. При этом имя ученого узнаваемо: в России оно известно практически всем, за рубежом – многим (хотя для «чужого» уха у него длинноватое имя). Портрет Менделеева легко идентифицируется как «кто-то из классиков», поскольку он обладал замечательной шевелюрой, как и Эйнштейн, Галилео, Ньютон и Франклин. Хотя сомнительно, что более 5 % респондентов из случайной выборки смогут отличить портрет Менделеева от портрета его современника, английского эволюциониста Чарльза Дарвина.
«РУСИ ЕСТЬ ВЕСЕЛИЕ ПИТЬ!» Технологию производства водки в XVIII в. подробно описал И. Г. Гмелин, один из участников академического отряда Второй Камчатской экспедиции (1733–1743 гг.), для чего ученые специально посетили казенный винокуренный завод (каштак) в 6 верстах от Иркутска.
«Там имеется 37 перегонных кубов в одном ряду, и из каждого ведут две трубы, лежащие в желобе, по которому постоянно течет свежая вода… Водка течет по трубам в кадку, поставленную к каждой паре труб. Напротив перегонных кубов, но на более высоком месте, поставлены 8 деревянных бочек, в которых бродит солод. Каждая бочка вмещает 147 пудов солода, а заправляются одновременно две из них. В каждую бочку, через засыпанный туда солод, пускают столько кипятку, пока он на несколько футов не покрывает последний. Кипяток из большого котла пускают через желоб. Как это требует время года, добавляют из этого котла столько теплой воды, чтобы поддерживать брожение. Это длится обычно три дня. Когда брожение закончилось, добавляют холодной воды, пока бочки не заполняются почти до края. На четвертый день начинают перегонку и две бочки опустошаются за 24 часа. Водка не лучше и не крепче, чем молочная водка языческих народов и, вероятно, по этой причине ее называют аракой, как называют язычники свою водку. Через повторную перегонку из нее делают вино, или настоящую водку. Чтобы сделать крепкую водку (Spiritus vini rectificatus), ее еще раз перегоняют».
Гмелин со своими глубокими познаниями в химии усмотрел массу недостатков в описанной технологии: «Если бы улучшить устройство, водку можно было бы отпускать за половину нынешней цены, если только соблюсти определенную температуру брожения и не допускать, чтобы при перегонке так много улетучивалось. Я пошел в чулан, где хранится водка и где за пять минут можно потерять сознание из-за спиртных испарений. Кадки, куда стекает водка, имеют в диаметре по меньшей мере один фут и стоят открыто, и трубка кончается на высоте в полфута над кадкой. В камере, куда стекает арака, все так же, хотя запах не так уж силен, можно все же видеть, как много улетучивается. А так как в гуще солода, в самом низу бочки, содержится больше всего спирту, было бы разумно этот осадок перегонять отдельно. Таким путем можно было бы сразу получить водку». Рекомендации ученого оказались невостребованными – в своих записках он сетует на это: «Но когда даешь такие советы, отвечают: “Как делали наши деды, так и мы продолжаем”» (Элерт, 2006)
Главный миф о Менделееве состоит в том, что его периодический закон был бессознательным продуктом «идеи-инкубации». Якобы, уснув однажды февральским вечером после утомительного рабочего дня, Дмитрий Иванович во сне увидел, каким образом должны быть сгруппированы химические элементы с похожими свойствами. Проснувшись, записал мысль на клочке бумаги и опять уснул. Конечно, это легенда, но сама идея подобной продуктивности сна для научных изысканий очень популярна среди студентов и молодых исследователей. Несмотря на отсутствие объективных доказательств эффективности такого метода.
«Дискурс о соединении спирта и воды»
То, что делает имя Менделеева еще более известным, связано с еще одним широко распространенным мифом. Менделееву приписывают изобретение водки – смеси из 40 частей чистого спирта и 60 частей воды.
В 1891 г. Технический комитет при Министерстве финансов постановил признать водочными изделиями все напитки, приготовляемые из спирта произвольной крепости, содержащие различные посторонние вещества, несвойственные спирту как продукту винокуренного производства и добавляемые в напитки при их приготовлении.
Но в докладах и протоколах заседаний встречались и такие термины: «очищенное вино» – для 40° напитка из «ректификованного» спирта и воды; «простые водки, очищенные и проч.» – для напитков из спирта и воды и др.
В работах, посвященных спиртометрии либо винокурению, также использовались оба термина – вино и водка. Помимо этих общих названий существовали более конкретные, соответствующие определенной крепости напитков и их чистоте.
Так, в продаже встречались: «полугар» с крепостью 38 % (по объему, что соответствует градусам), «пенное вино» – 44,25 %, «трехпробное» – 47,4 % и «двойной спирт» – 74,7 %, который употреблялся в медицине, фармакологии и парфюмерии.По: (Бондаренко, 1999)
В России эта легенда появилась после смерти ученого в 1907 г., удовлетворив общее стремление придать легитимность любому потенциальному фрагменту национальной культуры, и до сих живет в многочисленных анекдотах, фильмах, книгах и даже научных трудах. Миф легко распространился за границей вместе с водкой. Например, каждый раз, посещая винный магазин в США, на одной из бутылок с красочной этикеткой можно прочитать, что «… в 1894 г. Дмитрий Менделеев, величайший ученый России, получил указ установить Имперский стандарт качества для русской водки, и так появился “Русский Стандарт”» (конечно, речь здесь идет о торговой марке, но упор делается на высокий научный стандарт).
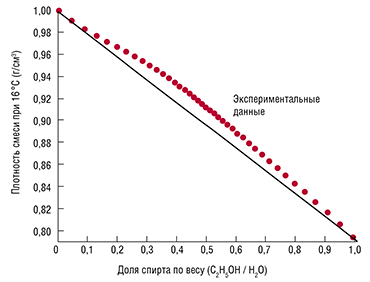
Менделеев подробно изучил изменение плотности такой смеси и обнаружил, что при 52 % содержании спирта по объему или 46 % по массе, она увеличивается примерно на 1/40. У него возникла идея о существовании ассоциаций молекул H2O и C2H5OH (благодаря, как мы теперь знаем, водородным связям), которые наиболее стабильны при определенных концентрациях. Например, при 46 % спирта по массе наиболее стабильна ассоциация из трех молекул воды и одной молекулы спирта. Он также явственно увидел указания на существование устойчивых ассоциаций из трех молекул спирта и одной молекулы воды в более «крепком» растворе и одной молекулы спирта и двенадцати молекул воды – в более слабых растворах.
Водка – это…
Вот так, без современных микроскопов и методов, великий ученый смог понять взаимодействие молекул разных соединений и даже оценить силу этого взаимодействия. И сделал это задолго до последующих работ лауреата Нобелевской премии, голландца Ван дер Ваальса и других ученых. В качестве побочного результата исследований Менделеев изобрел наиболее эффективный способ получения самого чистого 100 % спирта того времени путем химической очистки из сравнительно легко получаемой многократной дистилляцией и ректификацией смеси, содержащей 96 % спирта и 4 % воды.
Бытовое пьянство среди сибирских аборигенов в XVIII в. было весьма редким явлением, да и распространялось оно лишь на немногих коренных жителей, которые утратили связь с сородичами и жили в городах и острогах, нанимаясь на работу к русским. Так, ительмены Камчатки к середине века уже успели приобщиться к этим своеобразным «плодам цивилизации», с которыми они познакомились лишь четверть века назад. Один из участников академического отряда Второй Камчатской экспедиции, Г. В. Стеллер писал: «Многие ительмены очень любят водку, напиваясь ею до бесчувствия во время своего пребывания в русских острогах и в значительной мере от этого разоряясь. Другие же безо всякого удовольствия только для того изрядно напиваются, чтобы походить на казаков; они полагают, что такое опьянение – признак культурности последних. В состоянии же опьянения они очень стараются не упустить без подражания ничего из того, что они когда-либо замечали у пьяных казаков; при этом они навещают всех, даже лиц, которых обязаны уважать, чрезвычайно смешно хвастаясь, заявляя: “Я пьян, не сердись… я русскую натуру приобрел… я ведь русский…”, – и изрекая разные тому подобные глупости. Из этого видно, чего недостает этим бедным и добрым людям, а именно: просвещения, хороших примеров и рассудительности» (Элерт, 2007)
Во второй половине XIX в. Менделеев, как эксперт по химическим технологиям в целом и по ректификации алкоголя в частности, а также как сторонник государственного курса на промышленное развитие страны, входил в Правительственную комиссию по введению эффективного акцизного налога. Речь шла о косвенных налогах на предметы внутреннего производства, которые производились и продавались частными лицами. В российском государственном бюджете в 1890 г. на долю таких косвенных налогов приходилось 45,4 % всех доходов (Вебер, 1906). И главными источниками пополнения бюджета были доходы от государственной винной монополии и акцизы на алкогольную продукцию: в 1906 г. по этим статьям поступило более трети всего государственного бюджета.
В МИНИСТЕРСТВЕ ФИНАНСОВ В1850-е гг. в правительстве Российской империи началась работа по пересмотру питейной налоговой системы. В ходе разработки реформы нужно было определить способ взимания налога. По мнению Государственного совета, акциз должно было назначить «с ведра вина и разных водок по расчету на одну нормальную крепость». Но поскольку «обычное вино» в разных губерниях имело разную крепость, то «верный расчет» акциза с напитков возможен был только при определении содержания в них безводного спирта. Таким образом, введение акцизной формы питейного налога должно было опираться на строгую систему учета количества и качества спиртовой продукции. Но ее еще требовалось создать и укоренить вместо прежней, «ведерной», державшейся за счет невысокого уровня специальных знаний среди заводчиков и чиновников и отсутствия достаточного количества контрольно-измерительных приборов.
В1863 г. при Министерстве финансов начинает работать Комитет для пересмотра Положения о питейном сборе, призванный решать проблемы, возникающие при введении акцизной налоговой системы. В Технический отдел комитета вошел и Д. И. Менделеев (Сборник сведений и материалов по ведомству Министерства финансов, 1865 г.). Каким же образом Менделеев, едва начавший преподавательскую деятельность и к тому же отсутствовавший в России в течение двух предыдущих лет, оказался привлеченным к столь важному государственному делу, как питейная налоговая реформа?
По возвращении зимой 1861 г. в Петербург из Гейдельберга, где Менделеев устроил собственную лабораторию и занимался исследованием явления капиллярности, он сразу приступил к поискам работы. Его место в университете оказалось занятым, найти в это время преподавательскую работу было трудно, и Менделеев взялся за работу литературную, в том числе за издание на русском языке известной и популярной в Европе книги «Технология по Вагнеру» (в русском варианте), вышедшей в Лейпциге в 1858 г. Идея перевода книги Р. Вагнера у Менделеева постепенно преобразилась в создание многотомной «Технической энциклопедии», а сам он стал редактором и автором отдельных статей. В этой работе – истоки многих его трудов и научных исследований, имевших большое прикладное значение, в том числе и для винокуренной промышленности (третий выпуск «Технологии по Вагнеру» (СПб., 1862) был посвящен производству виноградного вина, пива и спирта). «Это издание служило мне поводом для изучения технической химии», – вспоминал спустя много лет и сам Менделеев (Архив Д. И. Менделеева, т. 1, 1951, с. 50).
В 1863 г. физико-математический факультет Петербургского университета ходатайствует о назначении его исполняющим должность экстраординарного профессора на кафедру технической химии. Министерство просвещения ходатайство отклонило, поскольку Менделеев не имел ученой степени по этому предмету и степени доктора наук. Однако, как сказано выше, его знания в области технической химии были востребованы в другом министерстве – финансов.
Одно из заданий министерства состояло в уточнении удельного веса «разных сортов вина и спирта». Весной и летом 1863 г. Менделеев провел опыты с растворами спирта, в следующем году сделал расчеты по полученным данным и в ноябре 1864 г. представил свою работу «Рассуждение о соединении спирта с водою» в физико-математический факультет Петербургского университета на соискание докторской степени. Во введении к диссертации Менделеев написал: «…рассмотрение совокупности ныне известных фактов, относящихся к неопределенным химическим соединениям, приводит меня к убеждению о том, что определенные химические соединения составляют только частный случай неопределенных химических соединений… Собрание материалов, нужных для решения вопроса о неопределенных соединениях, составляет задачу моих работ, которых первый пример и предлагаю в этом сочинении» (Менделеев, т. 4, с. 2). В 1865 г. он стал доктором наук и профессором университета.
Результаты проделанных Менделеевым опытов и расчетов очень скоро были использованы при корректировании спиртометрических таблиц в Голландии, Пруссии и Австрии. Спустя много лет знаменитый химик А. М. Бутлеров, говоря в Академии наук о научных заслугах Менделеева, подчеркнул «капитальное прикладное значение» его докторской диссертации (Доклад академика А. Бутлерова…, 1882, с. 101). А академик П. И. Вальден на Первом Менделеевском съезде по общей и прикладной химии так оценил работы ученого по растворам: «Практическое значение безусловно большое и прочное. Классические монографии Д.И. об удельных весах растворов представляют настоящий Standartwork, который действительно незаменим в лабораториях техники и промышленности, а равно в лаборатории ученого физика и химика» (Вальден, 1909, с. 72).
По: (Бондаренко, 1999)
Но, конечно, как в диссертации не было ни слова о том, что 40 % (по объему) водка является оптимальной в каком-либо аспекте, так и в комиссии не велись обсуждения о лучшем способе ее смешивать.

При содержании 40 % и более алкоголя пары смеси можно поджечь при комнатной температуре. Этот эффект использовался еще со времен государственной монополии на производство и распределение водки, которая была введена в 1474 г. дедом Ивана Грозного, для простой проверки содержания алкоголя – чтобы кабатчики не разбавляли водку.
Метод не был достаточно точным, и следующая государственная монопольная реформа, проведенная Петром I в 1698 г., потребовала более сложного способа для определения качества продукции. Для этих целей поджигался полугар («сжигаемый пополам») – дистилляционная спиртовая смесь, обладающая приятным хлебным вкусом. При тестировании ее предварительно нагревали до кипения, а потом пары поджигали. После завершения горения оставшийся объем должен был составлять половину от исходного. Это соответствовало стандартной 38 % смеси алкоголя плюс-минус несколько процентов.
Чиста как слеза
Что отличает водку от всех других крепких алкогольных напитков, таких как виски, ром, текила или шнапс, так это ее вкус, или, точнее, его отсутствие. До середины XIX в. водка представляла собой чистую или относительно чистую смесь с мягким хлебным вкусом, унаследованным от стадии дистилляции. Но в то время как другие крепкие напитки по-прежнему получают дистилляцией и потому сохраняют свои собственные специфические ароматы, водка – единственная из напитков – прошла революционную стадию химической технологии и теперь производится по-другому.
Русская национальная диета и водка просто идеально подходят друг другу, что не мудрено после столетий параллельного развития. Правильная пища включает в себя соленые (не маринованные) огурцы, грибы и помидоры, икру (черную и красную), соленую и копченую рыбу (например, осетрину, лосося и особенно сельдь), сало, пироги, горячие супы, пельмени, жаркое из говядины или свинины, русские тонкие блины, простые или фаршированные и т. д. Желающие почерпнуть дополнительные детали могут обратиться к классике. Например, к роману Л. Толстого «Анна Каренина» (к части первой, где Стива ведет Левина на обед в ресторан), к рассказу Чехова «Закуска» или к описанию обеда в трактире Тестова в произведении В. Гиляровского «Москва и москвичи». Делать это лучше за уже накрытым столом
Процесс проходит четыре основных этапа: дистилляция (несколько раз), дополнительная ректификация (очистка), в результате которой получается смесь с содержанием спирта 90 % или более, при этом все примеси отделяются. Затем следует разведение водой до 40 % и дополнительная фильтрация через активированный уголь или другие виды абсорбентов. В результате концентрация простых эфиров, альдегидов, метилового спирта, фурфурола и комплексных масел – всех тех компонентов, которые составляют вкус и аромат и отличают, например, коньяк от виски, – уменьшается примерно до 0,01 %. Это на два-три порядка меньше, чем в любом другом напитке.
Можно было ожидать, что в результате вкуса вообще не будет, но нет. На самом деле остается небольшой привкус, и различные конкурсы водок показывают, что действительно существуют различия, которые отражают качество исходного ректифицированного спирта, особенности воды и окончательной фильтрации. Таким образом, «плохая водка» может быть обнаружена, как говорится, прямо «на месте» только в том случае, если она имеет ярко выраженный вкус. Но все хорошие водки не имеют такого вкуса, весьма мягки и обладают «питкостью». Так что единственным реальным показателем их превосходного качества является «состояние на следующее утро».
ДОКАЗАНО: ВОДКА В СТОПКЕ ВЫДЫХАЕТСЯ Есть легенда, что оставленная на столе водка в стопке потеряет вес (от испарения), но не крепость. Этот миф кочует не только в русскоговорящей среде, но и выплеснулся в Америку: например, его повторили в газете Boston Globe (от 22 ноября 2010 г.), где с большим уважением описали разные необычные свойства водки. Иногда это «открытие» также приписывают Менделееву – видимо, в знак уважения. Но такого свойства у водки на самом деле нет. Проведя простые домашние измерения с оптическим спиртометром, мы обнаружили, что после примерно двух дней стояния при комнатной температуре крепость водки в рюмке падает с 40 до 25 %.
Правда, и тут есть место для научного прорыва. Исследовательская группа нобелевского лауреата А. Гейма из Университета Манчестера создала мембрану из нескольких слоев оксида графена (Nair et al., 2012). Когда ученые запечатали такой мембраной металлический контейнер, они обнаружили удивительный эффект. В контейнере могли без проблем удерживаться разные газы и жидкости, начиная с простого воздуха. Тонкая пленка останавливала даже гелий, который умеет просачиваться через самые разные материалы. Но вода, помещенная в контейнер, улетучивалась очень быстро – она проходила сквозь многослойную графеновую мембрану в 10 млрд раз быстрее, чем гелий. Ради шутки физики запечатали мембраной бутылку водки и обнаружили, что крепость напитка вскоре сильно выросла за счет испарения воды, поскольку спирт через эту мембрану пройти не мог
На протяжении как минимум шести веков водка глубоко укоренилась в культуре России, Польши и скандинавских стран. В России хорошая вечеринка требует, по крайней мере, обязательного наличия хорошего повода, хорошей компании, хорошей еды и хорошей водки. Считается, что соблюдение этих условий противодействуют алкоголизму. Трудно сказать, насколько они эффективны, но, к примеру, тосты в России почти обязательны, причем три наиболее распространенных – «за повод» (причина собрания), «за здоровье!» и «за дам!». Также принято считать, что оптимальный размер компании, способной вести дискуссию за столом, варьирует «между числом граций и числом муз» (т. е. от трех до девяти согласно греческой мифологии).
Водка, являясь самым чистым из всех алкогольных напитков, вызывает наименьшее похмелье, которое обычно следует за потреблением ее в объеме от 150 до 500 мл (примерно от 50 до 200 г чистого алкоголя). Биологические эффекты индивидуальны и широко варьируют в зависимости от веса тела, пола, возраста и предыдущего опыта. Конечно, большинство последствий отрицательные – алкоголь вреден для здоровья. В любом случае водка, по-видимому, оказывает наименьшее негативное влияние на мыслительные способности. Об этом свидетельствует и пример многих великих русских математиков прошлого и настоящего, многие из которых предпочитали водку другим алкогольным напиткам
Водку полагается пить холодной и залпом, одним глотком. Учитывая высокую концентрацию алкоголя, типичный объем разового «залпа» варьирует от 50 до 100 г. Соответственно, традиционные формы водочных рюмок (лафитников, стопок) таковы, что позволяют выпить содержимое «разом», поэтому имеют широкую верхнюю часть и широкое или утяжеленное дно.

Чтобы получать удовольствие, а не проблемы, с водкой, как и с огнем, нужно обращаться должным образом. И помнить, что у водки есть не только долгая история и принадлежность к нашему культурному наследию, но и вполне предсказуемые последствия, как приятные и неприятные. Сам Менделеев, у которого один из старших братьев злоупотреблял алкоголем, водку не пил, предпочитая хорошее красное вино. И с экономической точки зрения особых надежд на нее как на источник казенного дохода не возлагал – в отличие от производства и продажи за границу качественного, хорошо очищенного этилового спирта (Бондаренко, 1999).
МАГИЧЕСКИЕ СОРОК С введением акцизной системы, при которой величина налога прямо зависела от содержания спирта в напитках, крепость их стала жестко регламентироваться. Так, с 1863 г. простое хлебное вино (водка) должно было содержать не менее 38°, а немного позже, с 1868 г., не ниже 40° по спиртомеру Траллеса. Крепость в 38° – это узаконенная фактическая крепость полугара. Но откуда появилась цифра сорок?
Анализ сведений, запрошенных Министерством финансов от губернских акцизных управлений, показал, что не только в великороссийских губерниях, но и в западных и малороссийских, где «народ привык издавна к употреблению вина высшей крепости», напитки на самом деле продаются гораздо меньшей крепости, и нередко сдабриваются вредными примесями для придания им мнимой крепости и вкуса» [50, л. 2, 3]. В результате народ платил больше, чем стоил продукт, казна получала меньше, чем могла бы, а виноторговцы имели колоссальные прибыли от продажи некачественного вина. Поэтому с целью увеличения казенных доходов и сохранения народного здравия министр предлагал сохранить обязательную крепость продажного вина в 38° по Траллесу и даже повысить ее на два градуса для мест оптовой продажи и хранения вина, т. к. при хранении и транспортировке вино утрачивает часть своей крепости. Так появилась новая редакция статьи об обязательной крепости Устава о питейных сборах. В дальнейших распоряжениях по акцизному ведомству, а также в новом монопольном уставе крепость продажного вина уже не опускалась ниже 40° по Траллесу, и даже полугар со временем «подтянулся» к этой цифре. Так, например, в статье «Винокурение», написанной для Энциклопедического словаря Брокгауза и Ефрона в 1892 г., Менделеев писал: «Русские продажные сделки ведутся на «полугар», или на число ведер водки, содержащей 40 объемных процентов безводного спирта, потому что продажная водка по узаконениям России должна содержать не менее 40 % безводного спирта [9, т. 16, с. 408; 52, т. 6, с. 486].
Кстати, слова «не ниже 40» отнюдь не означают ровно сорок. А в Технической энциклопедии, изданной в начале нынешнего века, определение водки практически не отличается от домонопольного: «Водка, напиток с различным содержанием спирта (25–65 объемных процентов), получаемый перегонкой сбродивших жидкостей без всяких примесей или с небольшой прибавкой эфирных масел, сахара или красящих веществ, иногда с прибавлением воды [53, с. 315].
И понадобились еще годы и годы, чтобы число «40» и слово «водка» соединились в нерушимом союзе. Традиция оказалась весьма устойчивой, наша водка так и осталась 40-градусной и, что самое удивительное, остается таковой до сих пор. Спиртометрическая реформа конца 1920-х гг., основанная на менделеевских данных по удельным весам спиртоводных растворов разной концентрации, никак не повлияла на это магическое число. А ведь между градусами Траллеса и Менделеева имеется существенная разница: в основе спиртометрических таблиц Траллеса был спирт, содержащий, как показал Менделеев, всего 88,55 % безводного. Так что 40° по Траллесу будут соответствовать чуть больше 33° по Менделееву.
По: (Бондаренко, 1999)
«Неужели, в самом деле, положение наше таково, – писал он в 1883 г., – что в кабаке, казенном или частном, должно видеть спасение для экономического быта народа, т. е. России, и в водке, да в способах ее потребления искать исхода для улучшения современного состояния дел народных и государственных»*.
* РГИА. Ф. 575. Оп. 2. Д. 1229, 485 об.; цит. по: (Бондаренко, 1999).
Литература
Бондаренко Л. Б. Из истории русской спиртометрии // Вопросы истории естествознания и техники. 1999. № 2.
Дмитриев И. С. Герой мифов и легенд // Природа. 2009. № 1. С. 110–116.
Михайлов О. В. Легенды и были о Менделееве, русской водке и сверхкритических флюидах // Вестник Российской академии наук. 2013. Т. 83. № 4. С. 381–384.
Похлебкин В. В. История водки (IX–XX вв.). М.: Интер-Версо, 1991.
Родионов Б. В. История русской водки от полугара до наших дней. М.: ЭКСМО, 2011.
Сажин В. Б., Панов А. Ю. Национально-культурные и экономические аспекты бражничества в России до и после диссертации Д. И. Менделеева «О соединении спирта с водой» // Успехи в химии и химической технологии. 2007. Т. XXI. № 5(73). C. 95–101.
Элерт А. Х. Русские сибиряки и алкоголь. По материалам Второй Камчатской экспедиции // НАУКА из первых рук. 2006. Т. 12. № 6. С. 64–83.
Авторы и редакция благодарят д.х.н. И. С. Дмитриева, директора Музея-архива Д. И. Менделеева СПбГУ, за помощь в подготовке дополнительного и иллюстративного материалов к статье
: 20 Авг 2019 , История «певчей» хромосомы , том 83,
№3