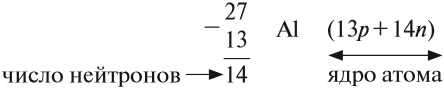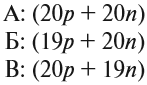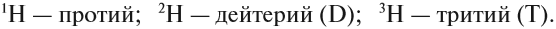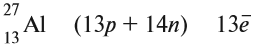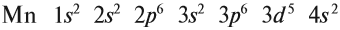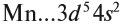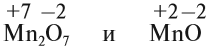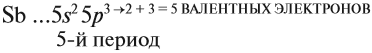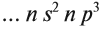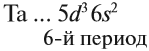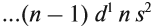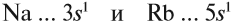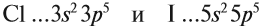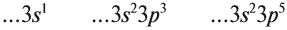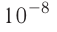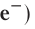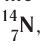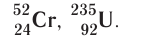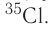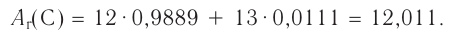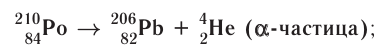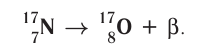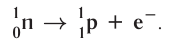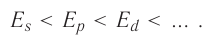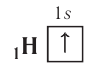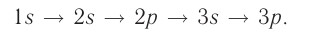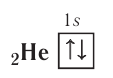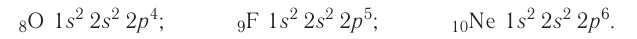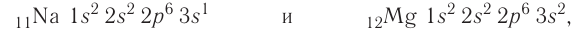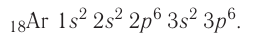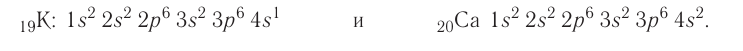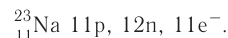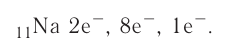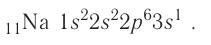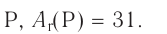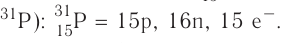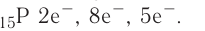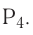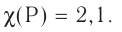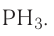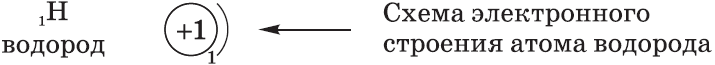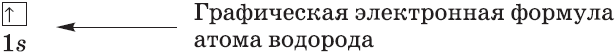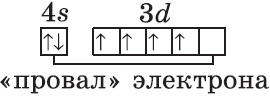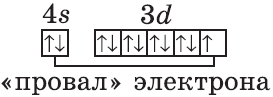Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Одну из первых моделей строения атома — «пудинговую модель» — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
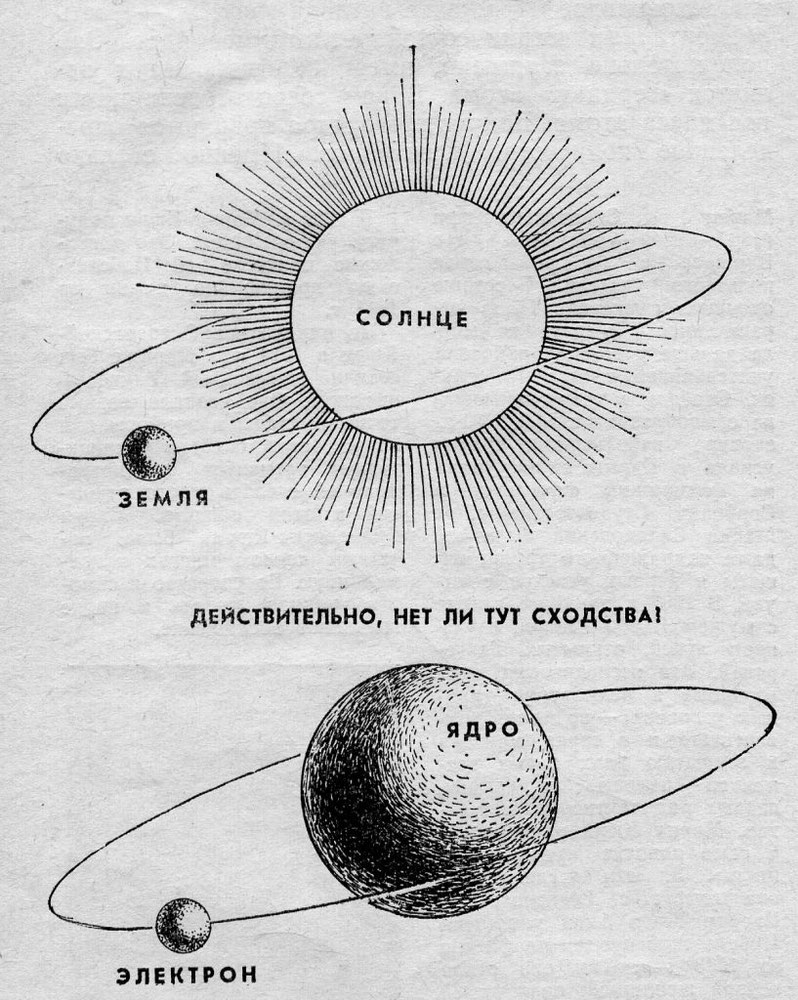
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
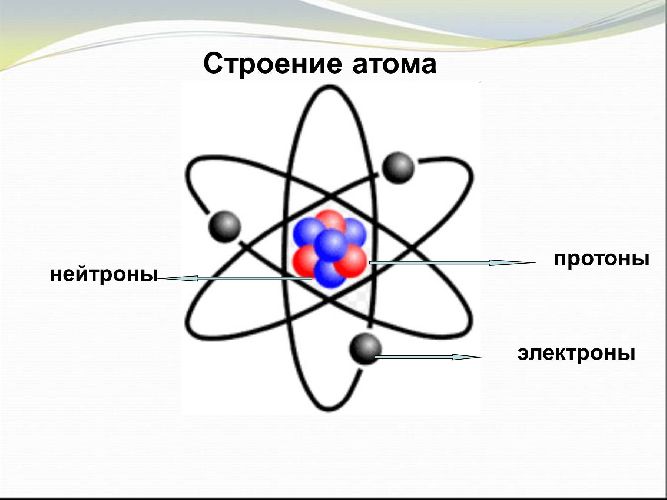
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой.
Атомное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны. Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10-27 кг
1 элементарный заряд = 1,60219·10-19 Кл
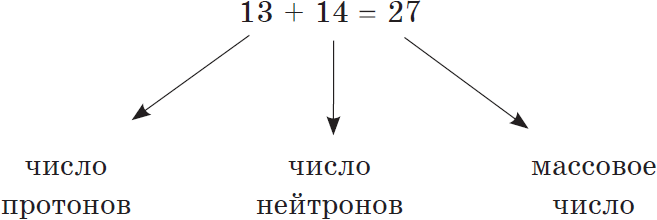
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома. Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это электронейтральная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома (массовое число A) примерно равна суммарной массе крупных частиц, которые входят в состав атома — протонов и нейтронов. Поскольку масса протона и нейтрона примерно равна 1 атомной единице массы, можно использовать формулу:
M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
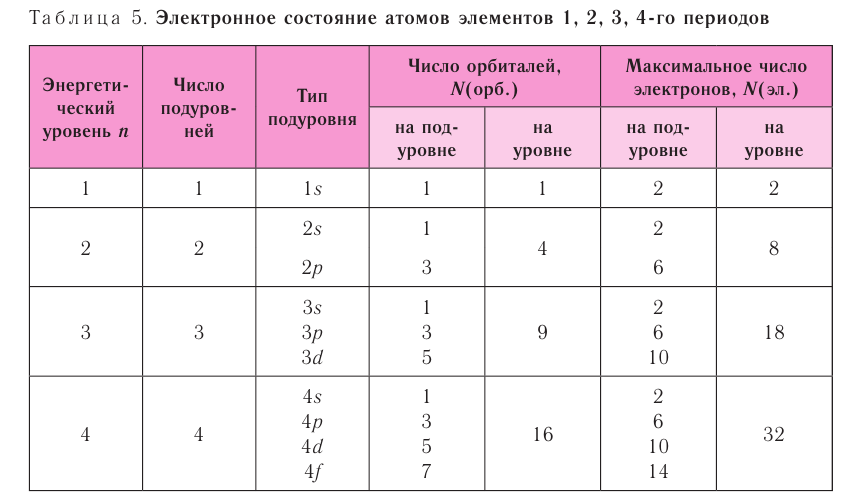
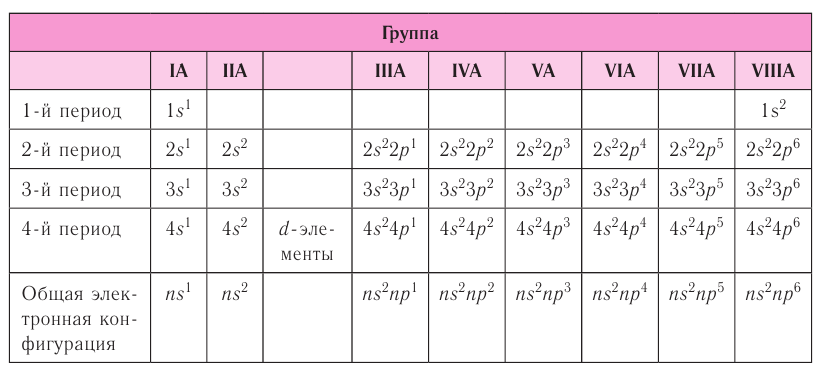
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
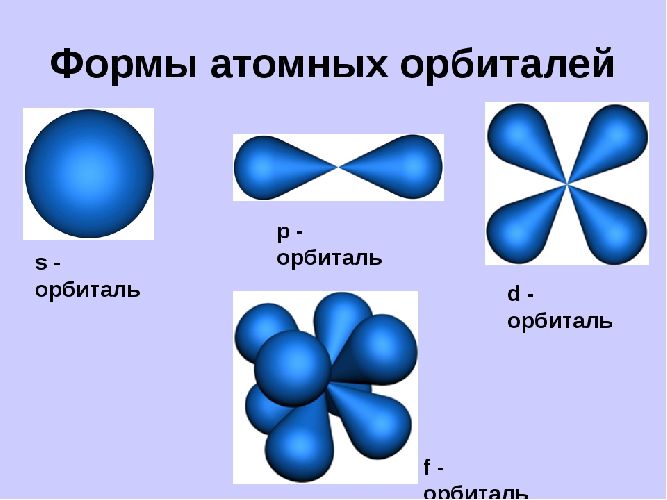
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
|
Номер уровня, n |
Подуровень | Число
АО |
Максимальное количество электронов |
| 1 | 1s | 1 | |
| 2 | 2s | 1 | |
| 2p | 3 | ||
|
3 |
3s | 1 | |
| 3p | 3 | ||
| 3d | 5 | ||
|
4 |
4s | 1 | |
| 4p | 3 | ||
| 4d | 5 | ||
| 4f | 7 |
|
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: , а не так:
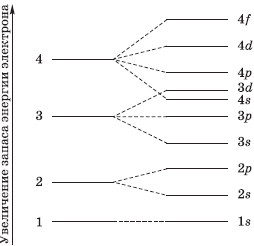
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
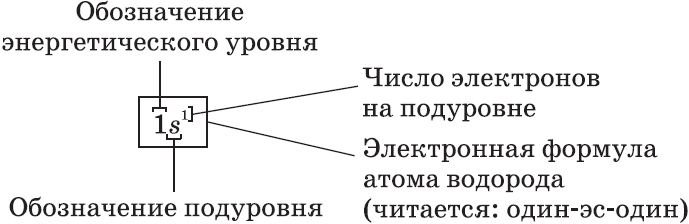
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
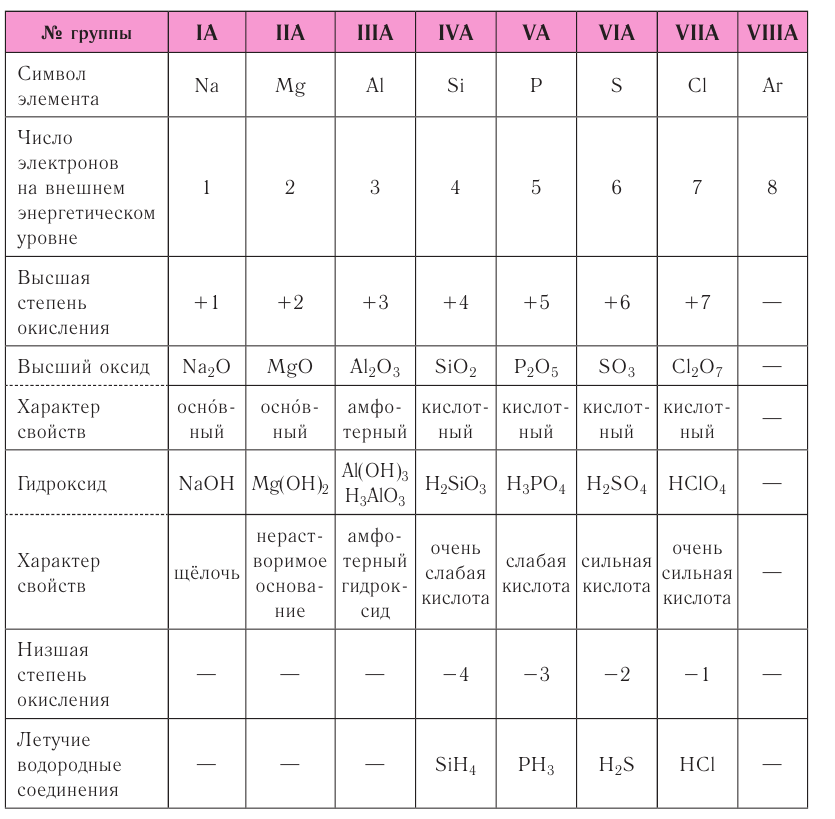
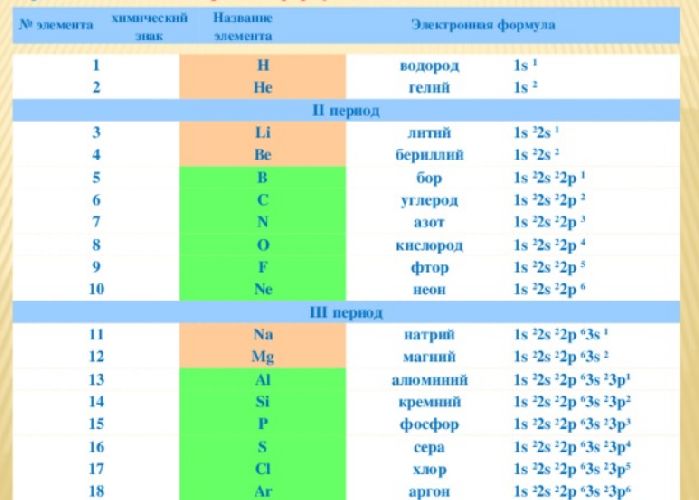
Электронные формулы элементов первых четырех периодов
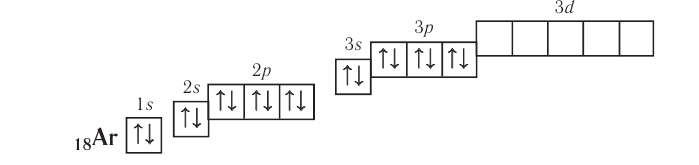
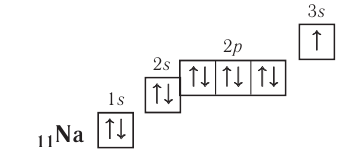
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
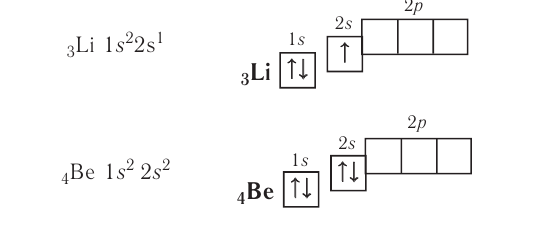
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
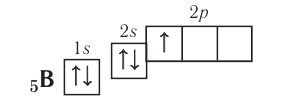
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s
2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s
2p
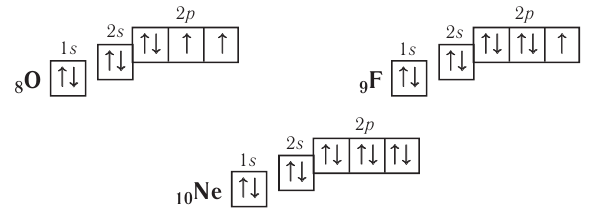
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s
2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s
2p
3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s
2p
3s
3p
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d14s2 [Ar] 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti [Ar]3d24s2 [Ar] 4s 3d
+23V [Ar]3d34s2 [Ar] 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d54s1 [Ar] 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn [Ar]3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s 2s
2p
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s 2s
2p
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е = +11Na+ 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому неона.
Тренажер по теме «Строение атома» — 10 вопросов, при каждом прохождении новые.
250
Создан на
03 января, 2022 От Admin
Тренировочный тест «Строение атома»
Тренировочный тест по теме «Строение атома»
1 / 10
1) Se 2) K 3) Al 4) C 5) Ca
Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона.
2 / 10
1) K 2) Na 3) Se 4) Mg 5) S
Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона.
3 / 10
1) Mn 2) Cr 3) Al 4) F 5) Ba
Определите, атомы каких из указанных в ряду элементов в основном энергетическом состоянии содержат одинаковое количество электронов на внешнем энергетическом уровне.
4 / 10
1) Li 2) Si 3) S 4) Al 5) F
Какие из указанных элементов в основном состоянии имеют на внешнем уровне больше s-электронов, чем p-электронов? Запишите в поле ответа номера выбранных элементов в порядке возрастания.
5 / 10
1) S 2) Na 3) Al 4) Si 5) Mg
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
6 / 10
1) Fe 2) Mg 3) S 4) P 5) Cu
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют на внешнем энергетическом уровне два электрона.
7 / 10
1) Sc 2) F 3) N 4) C 5) Ca
Определите элементы, атомы которых в основном состоянии содержат одинаковое число неспаренных электронов.
8 / 10
1) Na 2) Cl 3) C 4) H 5) S
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных p-электронов.
9 / 10
1) Cu 2) Cl 3) Zn 4) Si 5) P
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
10 / 10
1) S 2) Na 3) Al 4) C 5) Mg
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат два неспаренных электрона.
Ваша оценка
The average score is 32%
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s
2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s
2p
7. Электронная формула фтора:
8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s
2p
3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s
2p
3s
3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s
2p
3s
3p
11. Электронная формула фосфора:
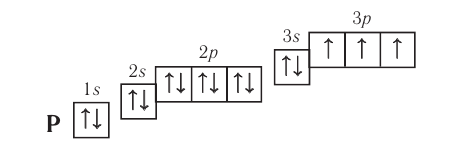
+15P 1s22s22p63s23p3 1s 2s
2p
3s
3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s
2p
3s
3p
13. Электронная формула хлора:
14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s
2p
3s
3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s
2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s
2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Вспомните:
- что такое атом;
- из чего состоит атом;
- изменяется ли атом в химических реакциях?
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Содержание
- Структура Периодической системы Менделеева
- Ядро атома. Изотопы
- Распределение электронов в поле ядра атома
- Строение атома и свойства элементов
- Выводы
Структура Периодической системы Менделеева
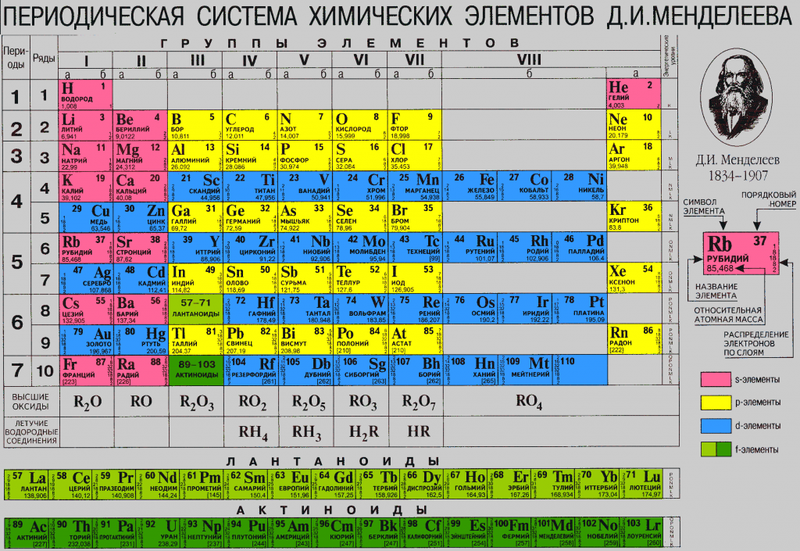
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
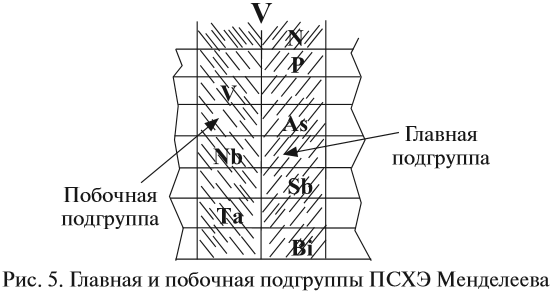
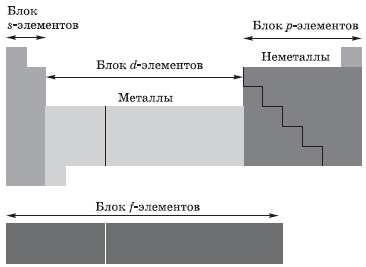
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
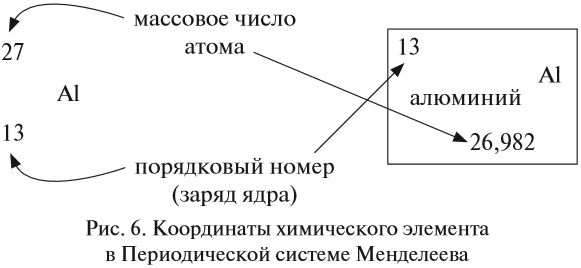
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
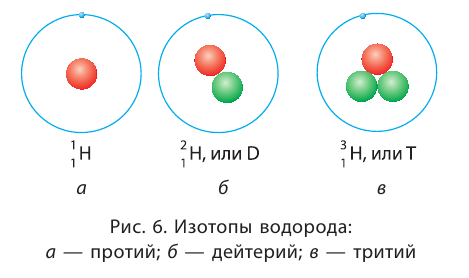
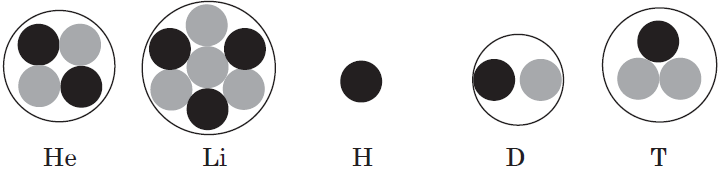
Элемент «водород» встречается в природе в виде трёх изотопов:
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.
Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
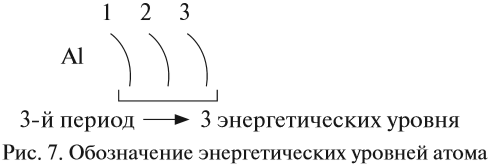
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
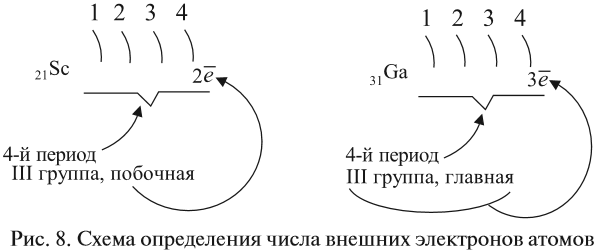
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Например:
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
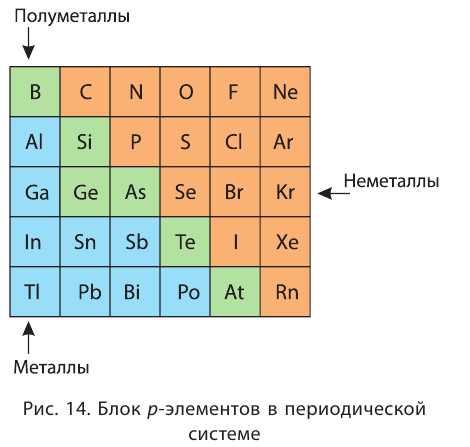
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
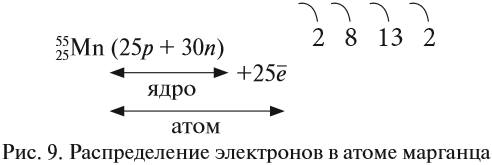
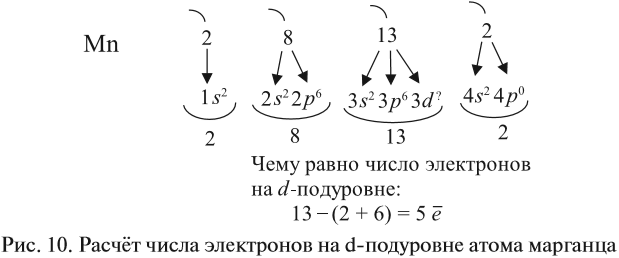
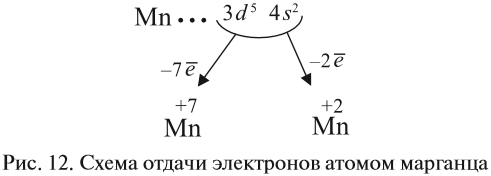
Например, согласно пунктам 1…4 для атома марганца определено:
Получили распределение электронов в атоме марганца (рис. 9):
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
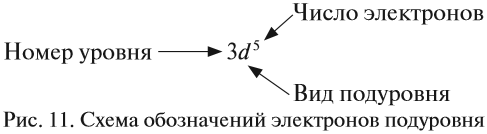
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:
или сокращённо:
Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень).
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.
Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Сделаем выводы.
- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Сравним свойства:
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
- у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства;
- у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства;
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Выводы:
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Сравним строение атомов и свойства химических элементов одного периода:
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
- определить общее число электронов в атоме (по порядковому номеру);
- определить число энергетических уровней (по номеру периода);
- определить число внешних электронов (по виду подгруппы и номеру группы);
- указать число электронов на всех энергетических уровнях, кроме предпоследнего;
- рассчитать число электронов на предпоследнем уровне.
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц — кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие «моль». 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
Размеры атомов чрезвычайно малы. Так, самый маленький атом – это атом Гелия, его радиус – 32 пикометра. Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?
Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами — 126) элементов, не считая изотопов. Но так было далеко не всегда.
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.
Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.
Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Содержание:
Строение атома:
Атом — наименьшая составная часть простых и сложных веществ. Говоря об атомах, мы подчёркивали, что это химически неделимые частицы, не исчезающие и не возникающие при химических реакциях.
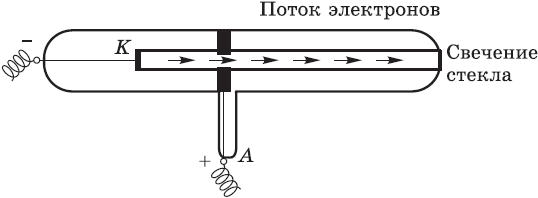
В течение многих веков атом считался элементарной, т. е. далее неделимой частицей. И только открытия, сделанные физиками в XIX веке, дали весомые доказательства сложности строения атома. К этим открытиям относятся прежде всего: а) изучение электролиза, т. е. процесса разложения веществ электрическим током; б) открытие катодных лучей — потока отрицательно заряженных частиц, которые впоследствии получили название электроны; и, наконец, в) обнаружение явления радиоактивности, которое представляет собой самопроизвольный распад атомов одних элементов с образованием атомов других элементов.
Ядерная модель строения атома
В начале XX века на основе исследований многих учёных и прежде всего английского физика Э. Резерфорда была установлена принципиальная модель строения атома, получившая название ядерная (планетарная). Согласно этой модели атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Почти вся масса атома (более 99,96 %) сосредоточена в его ядре. Диаметр ядра приблизительно в 100 000 раз меньше диаметра всего атома (порядка
Состав атомных ядер
Согласно современным представлениям ядра атомов состоят из двух видов частиц: протонов и нейтронов, имеющих общее название нуклоны (от лат. nucleus — ядро).
Протоны и нейтроны имеют практически одинаковую массу, равную примерно lu, т. е. одной атомной единице массы (см. § 4). Протон (его символ р) имеет заряд 1+, а нейтрон (символ n) электронейтрален.
Заряд электрона (символическое обозначение
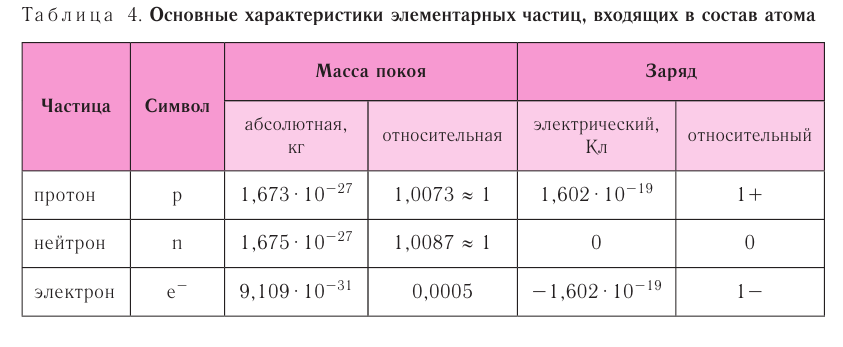
В таблице 4 приведены основные характеристики элементарных частиц, входящих в состав атома.
Протоны и нейтроны удерживаются в ядре особыми силами, которые так и называются ядерные силы. Ядерные силы действуют только на очень малых расстояниях (порядка 10-13 см), но их величина в сотни и тысячи раз превышает силу отталкивания одноимённо заряженных протонов. Энергия связи нуклонов в ядрах атомов в миллион раз превышает энергию химической связи. Поэтому при химических реакциях ядра атомов не разрушаются, а происходит лишь перегруппировка атомов.
Число протонов (Z) в ядре атома носит название протонное число. Оно равно атомному номеру элемента и определяет его место в периодической системе. В этом заключается физический смысл атомного номера. Атомный номер определяет место элемента в периодической системе и поэтому его часто называют порядковым номером.
Заряд ядра определяется числом протонов, и поскольку атом в целом электроцентралей, то очевидно, что число протонов в его ядре равно числу электронов.
Общее число протонов (Z) и нейтронов (N) называется массовым (или нуклонным) числом (A):
A=Z + N.
Массовое число практически определяет массу атома в атомных единицах, так как масса электронов составляет ничтожную часть общей массы атома.
Заряд ядра атома (протонное число) и его массовое число указывают числовыми индексами слева от символа химического элемента 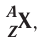
Вид атомов с определёнными значениями атомного номера и массового числа называется нуклидом.
Для обозначения нуклидов используют названия элементов или их символы, указывая массовые (нуклонные) числа: углерод-12, или 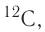
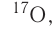
Изотопы
Большинство элементов существуют в виде нескольких нуклидов, которые отличаются друг от друга своими массовыми числами. Это объясняется тем, что в их ядрах при одном и том же числе протонов может находиться разное число нейтронов. Так, природный кислород (Z = 18), кроме атомов, в ядрах которых находится 8 нейтронов 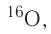
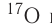
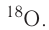
Изотопы — нуклиды, имеющие одинаковый атомный номер, но различные массовые числа.
Другими словами, изотопы — это нуклиды одного и того же элемента. Поэтому термин «изотопы» следует употреблять только во множественном числе. Изотопы любого элемента действительно занимают одно место в периодической системе, так как принадлежат одному и тому же элементу. Следовательно, и химические свойства изотопов данного элемента также будут практически одинаковы.
Теперь мы можем дать более точное определение химического элемента.
Химический элемент — это совокупность всех нуклидов, имеющих одинаковый атомный номер (т. е. одинаковый заряд ядра).
Названия и символы изотопов совпадают с названиями и символами соответствующих элементов.
Только изотопы водорода имеют собственные названия и символы: протий —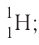
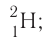
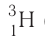
Так как большинство химических элементов в природе существует в виде смеси нуклидов, то относительная атомная масса данного элемента является средней величиной массовых чисел нуклидов с учётом доли каждого из них в природной смеси. Это объясняет тот факт, что относительные атомные массы большинства элементов не являются целочисленными величинами.
Например, углерод существует в природе в виде двух нуклидов —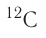
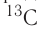
Явление радиоактивности
Все нуклиды делятся на два типа: стабильные и радиоактивные (радионуклиды). Стабильные нуклиды могут существовать без изменения состава ядер неограниченно долго. Поэтому большинство природных нуклидов, входящих в состав окружающих нас веществ, стабильны.
Устойчивому состоянию ядер атомов соответствуют определённые соотношения чисел протонов и нейтронов: для лёгких элементов (с атомными номерами от 1 до 20) — 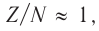
Радиоактивностью называется самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
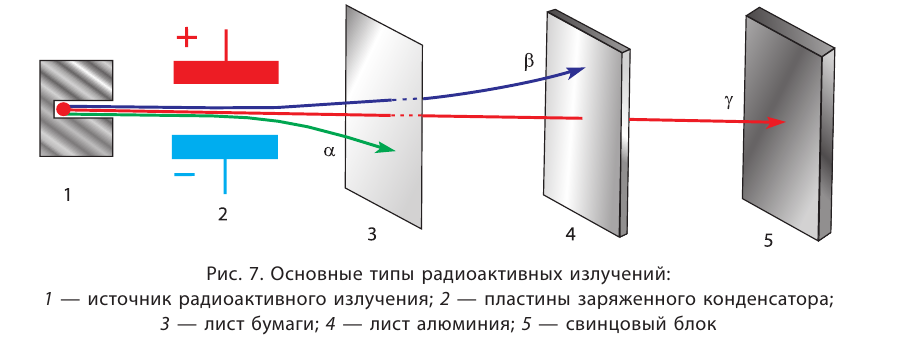
Основными типами радиоактивных превращений являются (рис. 7):
1) а-распад:
а-частицы представляют собой ядра атомов нуклида 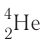
2) 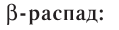
В данном случае 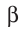
Радиоактивный распад часто сопровождается испусканием 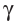
Устойчивость радионуклида характеризуется периодом полураспада 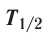
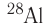
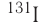
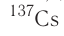
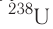
После открытия явления радиоактивности стало возможным искусственное превращение одних химических элементов в другие, синтез ядер элементов, которые не существуют на Земле. Так были получены элементы, находящиеся в периодической системе после урана U. Конечно, такие процессы, хотя и называются ядерными реакциями, не являются химическими реакциями, при которых атомы не исчезают и не возникают вновь.
Изучение радиоактивности привело к созданию ядерной энергетики и, к сожалению, ядерного оружия. Явление радиоактивности широко применяется в науке, медицине, промышленности и сельском хозяйстве. Вместе с тем перед человечеством возникли проблемы, связанные с вредным воздействием радиации на живые организмы. Поэтому использование ядерных процессов и радиоактивных веществ должно осуществляться в строго контролируемых условиях, с соблюдением строжайших мер безопасности.
Атом является электронейтральной микросистемой, состоящей из положительно заряженного ядра и отрицательно заряженных электронов.
Атомный номер химического элемента равен относительному заряду ядра его атома, числу протонов в ядре и числу электронов в атоме. Вид атомов с определёнными значениями атомного номера и массового числа называется нуклидом. Радиоактивность — самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
Состояние электрона в атоме
Химические свойства атомов проявляются только при химических реакциях. Так как состав ядер атомов при этом не меняется, то очевидно, что все изменения, происходящие с данным атомом в процессе химического превращения, являются результатом изменения его электронного состояния.
Большинство свойств атома определяется его электронным строением. Как оно влияет на конкретные свойства атома, на свойства веществ, в составе которых атом находится, можно понять, только правильно представляя состояние электрона в атоме.
Электронное облако
Основой современной теории строения атома являются законы и положения квантовой волновой механики — раздела физики, изучающего движение микрообъектов (электронов, протонов, нейтронов и других частиц).
Согласно квантово-механическим представлениям движущемуся электрону присуща двойственная природа. Он является частицей (имеет определённую массу, заряд), но его движение вблизи ядра имеет волновой характер (отсутствует определённая траектория движения, точное местоположение в пространстве и др.). Следовательно, микрообъекты, в том числе и электрон, обладают одновременно корпускулярными и волновыми свойствами.
Поскольку у движущегося электрона в атоме отсутствует траектория, то для описания такого движения используется вероятностный подход. Математически определяется не точное положение электрона в атоме, а вероятность его нахождения в той или иной области около ядерного пространства.
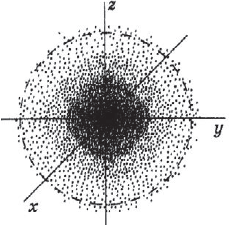
Состояние (в квантовой механике синоним слова движение) электрона в атоме описывается с помощью квантово-механической модели — электронного облака (рис. 8). Электрон движется возле ядра с огромной скоростью, при которой его отрицательный заряд как бы «размазывается» в пространстве. Получается, что ядро окружено трёхмерным электронным облаком. Плотность такого электронного облака оказывается различной в разных местах. В тех местах, где чаще находится электрон, образуется зона большей электронной плотности.
Поскольку существует вероятность нахождения электрона даже на относительно большом расстоянии от ядра, электронное облако не имеет определённых границ. Поэтому обычно его ограничивают условной поверхностью, которая охватывает примерно 90 % электронного облака. Такую область околоядерного пространства называют атомной электронной орбиталью или просто орбиталью.
Орбиталь — область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона.
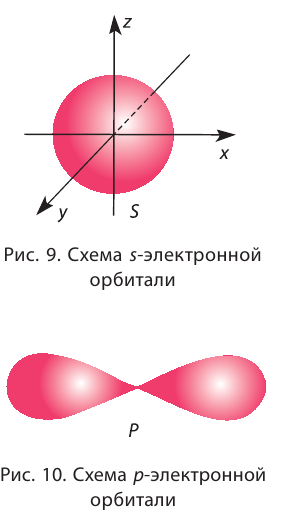
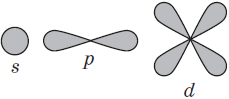
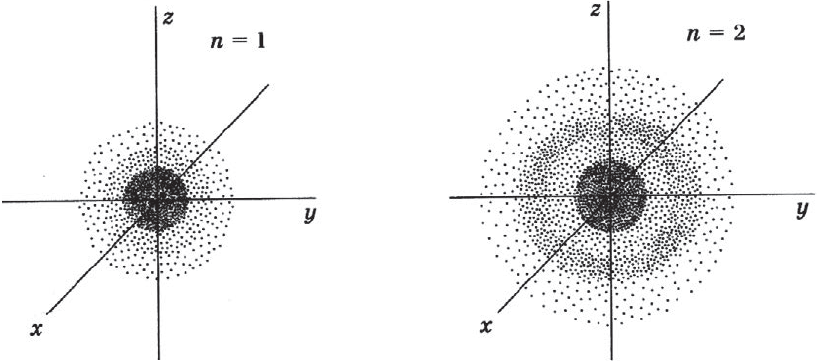
Орбитали, в зависимости от энергии электронов, имеют различные формы и размеры. Так, орбиталь единственного электрона атома водорода имеет сферическую (шарообразную) форму. Такие орбитали, имеющие шарообразную форму, обозначаются буквой s, а электроны, которые занимают эти орбитали, называются s-электронами (рис. 9).
Чем выше энергия электрона в атоме, тем слабее он притягивается к ядру, тем больше по размеру его орбиталь (электронное облако). Электронная плотность с увеличением размера орбитали уменьшается.
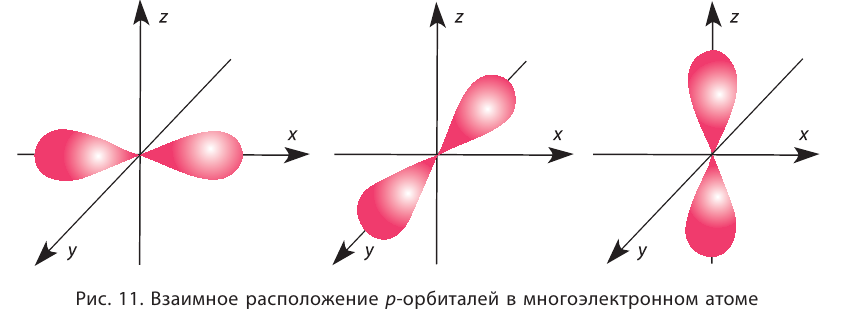
Орбитали в многоэлектронных атомах могут иметь и другие формы, например форму гантели («объёмной восьмёрки») (рис. 10). Такие орбитали обозначают буквой р, а электроны, которым они соответствуют, называют р-электронами.
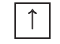
Три р-орбитали располагаются (ориентируются) в околоядерном пространстве взаимно перпендикулярно вдоль каждой из трёх осей системы координат (рис. 11).
Более сложную форму имеют орбитали d-типа и f-типа.
Графически орбиталь изображают в виде клеточки (квантовой ячейки), а электрон — в виде стрелки. Так, орбиталь атома водорода с его единственным электроном можно изобразить следующим образом:
Кроме движения вокруг ядра, каждый электрон характеризуется собственным моментом движения, который называется спином. Упрощённо спин (от англ, spin — вращение) можно представить как вращение электрона вокруг собственной оси. Спиновое вращение электрона возможно только по часовой или против часовой стрелки. На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины. В этом случае два электрона называются спаренными:
Такое их состояние в атоме энергетически выгодно, в отличие от состояния с одинаковыми спинами:
Если на орбитали находится один электрон, то он является неспаренным.
Энергетические уровни
Электроны в атоме различаются своей энергией. Чем выше энергия электрона в атоме, тем дальше он находится от ядра, следовательно, тем больше размер электронного облака (орбитали). И наоборот, электроны, обладающие относительно небольшой энергией, находятся большую часть времени вблизи ядра, заслоняя (экранируя) его от других электронов, которые притягиваются к ядру слабее и находятся на большем удалении от него. Так образуются как бы оболочки из электронов с близкими значениями энергии. Можно сказать, что электроны с близкими значениями энергии составляют в атоме единый электронный слой, или энергетический уровень.
Энергетический уровень (электронный слой, электронная оболочка) — это совокупность электронов с близкими значениями энергий.
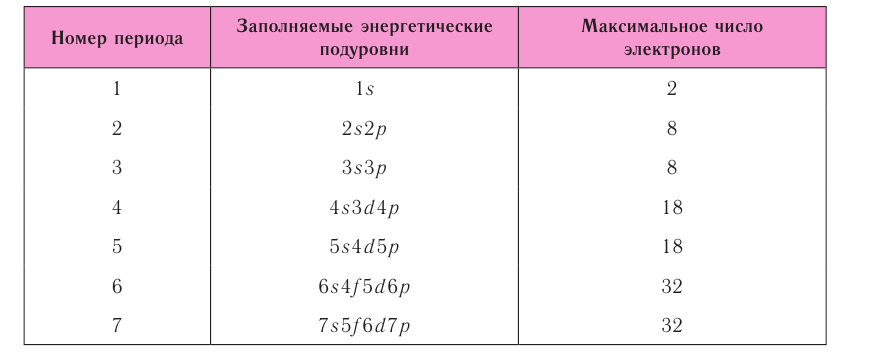
Число энергетических уровней в атоме, на которых находятся электроны, равно номеру периода, в котором располагается химический элемент в периодической системе. Каждый энергетический уровень обозначается своим номером: n = 1, 2, 3, 4, … , 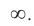
Число орбиталей 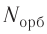
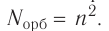
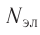
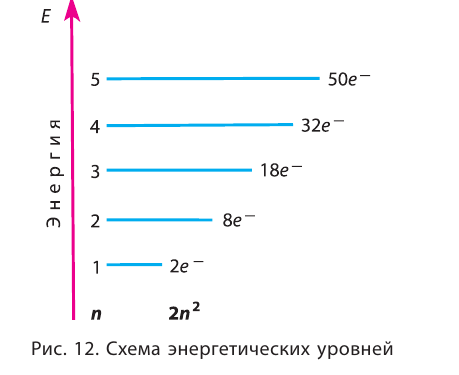
На рисунке 12 приведена схема энергетических уровней и их электронной ёмкости.
Энергетические подуровни
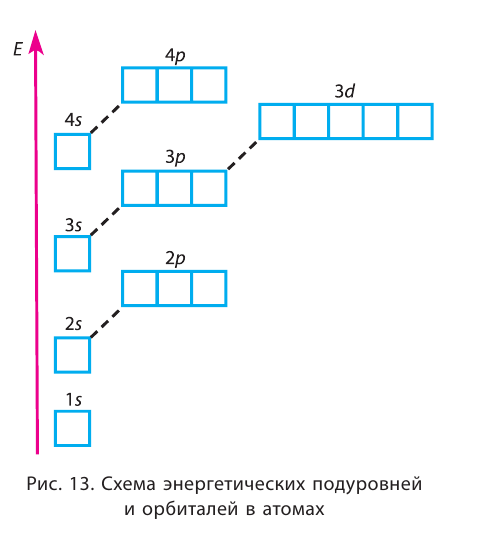
Электроны одного и того же энергетического уровня могут немного различаться значениями энергии. Они образуют в пределах данного уровня энергетические подуровни. Следовательно, энергетический уровень представляет собой совокупность энергетических подуровней, несколько различающихся по энергиям. Они обозначаются буквами s, р, d, f … . Число подуровней, из которых состоит данный энергетический уровень, равно его номеру.
Первый энергетический уровень (n = 1) состоит из одного подуровня (s), второй (n = 2) — из двух
(s, р), третий (п = 3) — из трёх (s, р, d) и т. д. Каждый подуровень, в свою очередь, состоит из определённого числа атомных орбиталей. Так, s-подуровень состоит из одной орбитали, р-подуровень — из трёх, d-подуровень — из пяти орбиталей (рис. 13).
Из приведённой схемы видно, что s-подуровень каждого энергетического уровня обладает наименьшим запасом энергии:
Для того чтобы различать энергетические подуровни и орбитали разных энергетических уровней, их обозначают двумя знаками: 1s, 2р, 3s, 3d. Цифра соответствует номеру энергетического уровня, а буква — типу энергетического подуровня.
Обобщим сведения об электронном состоянии атомов элементов первых четырёх периодов в виде таблицы 5.
Движущемуся электрону в атоме присуща двойственная природа: он является частицей, имеющей волновой характер движения.
Электронное облако — это квантово-механическая модель движения электрона вокруг ядра.
Атомная орбиталь — область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона.
На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины.
Совокупность электронов с близкими значениями энергий называется энергетическим уровнем (или, что то же самое, электронным слоем, электронной оболочкой).
Электронные конфигурации атомов
Общее число электронов в атоме определяется зарядом его ядра, т. е. протонным числом. Оно равно атомному номеру элемента. Электроны в зависимости от их энергии распределяются в атоме по энергетическим уровням и подуровням, каждый из которых состоит из определённого числа орбиталей.
Распределение электронов выражается с помощью электронных конфигураций атома. Например, у водорода, элемента с атомным номером 1, электронная конфигурация — 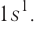
Схематически электронное строение атома изображается с помощью электронно-графической схемы, в которой орбитали представляются в виде клеточек, а электроны — в виде стрелок. Электронно-графическая схема атома водорода изображается так:
При составлении формул электронных конфигураций атомов необходимо соблюдать следующие правила. 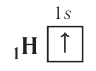
Поэтому орбитали в атомах элементов первых трёх периодов заполняются электронами в порядке увеличения их энергии:
Правило:
На каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
Таким образом, у следующего за водородом гелия 
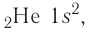
Поскольку на первом электронном слое могут находиться только два электрона, то этот слой в атоме гелия является завершённым и, следовательно, очень устойчивым.
У атомов элементов второго периода заполняется второй энергетический уровень, на котором может находиться не более 8 электронов. Сначала электроны заполняют 2s-орбиталь (у атомов лития и бериллия):
Поскольку 2.s-орбиталь заполнена, то пятый электрон у атома бора В занимает одну из трёх 2р-орбиталей. Электронная конфигурация атома бора —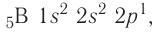
Обратите внимание, что подуровень 2р изображён вплотную к подуровню 2s, но несколько выше. Так подчёркивается его принадлежность к одному и тому же уровню (второму) и одновременно больший запас энергии.
Правило:
Оно устанавливает порядок заполнения орбиталей одного подуровня. Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два.
Следовательно, электронные конфигурации атомов углерода и азота:
а их электронно-графические схемы:
Электронная конфигурация внешнего слоя 2.S2 2р6 соответствует его полному заполнению и поэтому является весьма устойчивой.
У атомов кислорода, фтора и неона число электронов увеличивается, и они вынуждены размещаться на р-орбиталях второго энергетического уровня по два:
Электронно-графические схемы атомов этих элементов:
Электронная конфигурация внешнего слоя 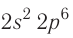
В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами s-подуровень у натрия и магния:
а затем /7-подуровень у алюминия, кремния, хлора и аргона:
Электронно-графическая схема атома аргона:
В атоме аргона на внешнем электронном слое находится 8 электронов. Следовательно, он завершён, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более 8 электронов.
Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой 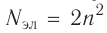
Только после этого начнёт заполняться электронами d-подуровень третьего, теперь уже предвнешнего, энергетического уровня.
Кроме электронных конфигураций и электронно-графических схем иногда используют и электронные схемы атомов, в которых указывают только число электронов на каждом энергетическом уровне (электронном слое):
С такими схемами вы познакомились ещё в 8-м классе.
Электронное строение атома определяется зарядом его ядра, который равен атомному номеру элемента в периодической системе.
Распределение электронов по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных конфигураций и электронно-графических схем, а также электронных схем атомов.
На внешнем электронном слое в атоме любого элемента может находиться не более 8 электронов.
Периодический закон и периодическая система химических элементов
Вот уже четвёртый год вы изучаете химию и всё это время пользуетесь таблицей химических элементов, которая представляет собой графическое изображение периодической системы элементов. Периодическая система, в свою очередь, является выражением периодического закона, открытого русским химиком
Д. И. Менделеевым в 1869 году. С тех пор периодический закон — основа современной химии. Физический смысл периодического закона стал понятен только после создания теории строения атома. Но сама эта теория развивалась и развивается на основе периодического закона и периодической системы.
Согласно этой теории главной характеристикой атома является положительный заряд ядра. Заряд ядра определяет число электронов в атоме, его электронное строение и, следовательно, все свойства атомов данного элемента и его положение в периодической системе. Поэтому современная формулировка периодического закона такова:
Свойства атомов химических элементов, а также состав и свойства образуемых ими веществ, находятся в периодической зависимости от зарядов атомных ядер.
Структура периодической системы
Со структурой периодической системы в общих чертах вы уже знакомы. Все химические элементы в ней располагаются в порядке возрастания атомного номера, который поэтому имеет ещё одно название — порядковый номер. Численная величина атомного номера равна положительному заряду ядра атома соответствующего элемента.
В таблице семь горизонтальных рядов элементов, которые называются периодами, а также восемнадцать вертикальных столбцов — групп. Таким образом, каждый химический элемент имеет свой атомный (порядковый) номер, находится в определённом периоде и определённой группе.
Известно около 700 форм графического изображения периодической системы. Но принципиальный подход к построению таблиц единый — элементы располагаются в порядке возрастания зарядов ядер их атомов. По мере увеличения атомного номера происходит постепенная застройка электронной структуры атомов элементов в соответствии с принципами заполнения. Таким образом, структура периодической системы связана с электронной структурой элементов.
В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают четыре типа (семейства) элементов:
- s-элементы — последним заполняется s-подуровень внешнего энергетического уровня;
- р-элементы — последним заполняется p-подуровень внешнего энергетического уровня;
- d-элементы — последним заполняется d-подуровень предвнешнего энергетического уровня;
- f-элементы — последним заполняется f-подуровень третьего снаружи уровня.
Периоды
Периодом в периодической системе называется последовательный ряд элементов, в атомах которых электронная конфигурация внешнего энергетического уровня изменяется от 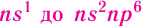
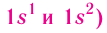
Таблица 6. Последовательность заполнения энергетических подуровней у элементов различных периодов
При этом номер периода совпадает с номером п внешнего энергетического уровня.
Другими словами, номер периода указывает на число энергетических уровней, на которых находятся электроны в атомах данного элемента. В этом заключается физический смысл номера периода.
Каждый из периодов (исключая первый) начинается типичным металлом (металл щелочной группы) и заканчивается благородным газом, которому предшествует неметалл, т. е. в периоде с увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связывается с увеличением числа электронов на внешнем энергетическом уровне.
Первые три периода содержат только s- и p-элементы. Четвёртый, пятый и последующие периоды включают в свой состав также элементы, у атомов которых происходит заполнение d-подуровня предвнешнего энергетического уровня. У элементов шестого и седьмого периодов, помимо S-, р- и d-подуровней заполняются и f-подуровни третьего снаружи электронного слоя. f-Элементы
объединяются в семейства, называемые лантанидами (4f-элементы) и актинидами (5f-элементы), которые вынесены за пределы таблицы (см. форзац 1).
Группы
В вертикальных колонках, называемых группами, объединены элементы, атомы которых имеют сходное электронное строение. Всего в таблице 18 групп, пронумерованных арабскими цифрами. Кроме того, группы имеют традиционную нумерацию римскими цифрами от I до VIII с добавлением букв А или В. У атомов элементов групп А последними заполняются s- и р-подуровни внешних энергетических уровней (табл. 7). Элементы, у которых последними заполняются d-подуровни второго снаружи или f-подуровни третьего снаружи энергетического уровня, составляют группы В.
Таблица 7. Электронная конфигурация внешнего энергетического уровня у атомов элементов групп А (1—4-й периоды)
Атомы элементов групп А и В различаются своими химическими свойствами, однако им присуще и общее, что объединяет их в группы с одинаковыми римскими номерами (I, II и т. д.).
Номер группы (римскими цифрами), как правило, указывает число электронов в атоме, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы.
Электроны, которые принимают участие в образовании химических связей, называются валентными. У элементов групп А валентными являются электроны внешнего энергетического уровня, а у элементов групп В — ещё и электроны предпоследних уровней. Это основное различие между элементами групп А и В.
Сейчас мы можем дать более точное определение понятия группа.
Группа — вертикальный столбец элементов с одинаковым числом валентных электронов в атомах.
Таким образом, строгая периодичность расположения химических элементов в периодической системе полностью объясняется последовательным характером заполнения энергетических уровней и подуровней их атомов.
Главной характеристикой атома является положительный заряд ядра, который численно равен атомному номеру элемента. Каждый химический элемент имеет свой атомный (порядковый) номер, находится в определённом периоде и определённой группе. Горизонтальный ряд элементов, расположенных в порядке возрастания их атомных номеров, начинающийся щелочным металлом и заканчивающийся благородным газом, называется периодом. Вертикальный столбец элементов, атомы которых имеют одинаковое строение внешних электронных слоев, называется группой.
Периодичность изменения свойств атомов химических элементов и их соединений
Поскольку электронная конфигурация атомов химических элементов изменяется периодически с ростом заряда их ядер, все их свойства, определяемые электронным строением, закономерно изменяются по периодам и группам периодической системы. К таким свойствам относятся прежде всего различные характеристики атомов: атомные и ионные радиусы, электроотрицательность, степень окисления и др. Периодически изменяются также многие химические и физические свойства простых и сложных веществ, образованных элементами-аналогами.
Атомные и ионные радиусы
С точки зрения квантовой механики атом не имеет строго определённых границ, так как орбитали, на которых расположены его электроны, также не имеют точных размеров. О размерах атомов и ионов судят по экспериментальным данным о расстояниях между соседними атомами в молекулах или кристаллах. Условно форму атома или иона считают шарообразной, поэтому количественной характеристикой их размера служит радиус.
Различают атомные радиусы и ионные радиусы. При этом радиусы положительных ионов (катионов) всегда меньше радиусов атомов соответствующих элементов, так как они образованы в результате отдачи электронов. Радиусы отрицательных ионов (анионов) больше радиусов атомов, поскольку они образовались путём присоединения дополнительных электронов. Например, радиус атома натрия Na — 189 пм, а иона натрия 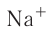
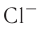
Как изменяются радиусы атомов в группе и в периоде с ростом атомного номера элементов? У элементов, находящихся в одной группе, при переходе сверху вниз от одного элемента к другому увеличивается число электронных слоёв и, следовательно, увеличивается радиус как атомов, так и ионов. Например, в группе щелочных металлов радиусы атомов: Li — 155 пм, Na — 189 пм, К — 236 пм, а ионов: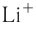
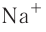
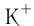
В периодах периодической системы по мере увеличения заряда ядра атомов увеличивается притяжение к нему электронов, находящихся на одном и том же электронном слое, что приводит к уменьшению радиуса атомов. Например, у элементов третьего периода атомные радиусы уменьшаются от натрия до хлора — от 189 пм до 99 пм.
Электроотрицательность
Проявление металлических или неметаллических свойств у атомов данного элемента связано прежде всего с их способностью терять или приобретать электроны. Отдача или присоединение электронов атомами обычно происходит в процессе их химического взаимодействия. Характеристикой атома, учитывающей его способность смещать к себе валентные электроны, является электроотрицательность. Она обозначается буквой греческого алфавита X (хи).
Электроотрицательность атома — условная величина, характеризующая его способность в химических соединениях смещать к себе электроны от других атомов.
Для практической оценки этой способности атомов введена условная относительная шкала электроотрицательностей. По этой шкале наиболее электроотрицательным среди элементов, способных образовывать химические соединения, является фтор F (X = 4,1), а наименее электроотрицательным — франций Fr (X = 0,86).
У элементов групп А в периодах с ростом атомного номера элементов электроотрицательность возрастает, а в группах, как правило, убывает.
По величине электроотрицательности можно определить принадлежность элемента к металлам или неметаллам. Все неметаллы обычно имеют значение электроотрицательности больше двух.
Они располагаются в правой верхней части периодической таблицы.
У металлов значение электроотрицательности меньше двух. Несколько элементов (В, Si, Ge, As,Те) со значением электроотрицательности, близким к 2, располагаются вдоль диагонали от бора В к астату At. Атомы этих элементов проявляют промежуточные свойства, поэтому их часто называют полуметаллами (рис. 14).
Периодичность изменения свойств соединений
Периодический характер изменения строения, физических и химических свойств присущ также простым и сложным веществам. Рассмотрим в качестве примера закономерности изменения некоторых свойств атомов и соединений элементов 3-го периода (табл. 8).
Таблица 8. Изменение свойств атомов элементов 3-го периода и их соединений
Как следует из таблицы, в периоде при переходе слева направо от одного элемента к другому происходит увеличение высшей степени окисления и понижение (по абсолютной величине) низшей степени окисления. Периоды начинаются щелочными металлами, которые образуют растворимые в воде основные оксиды и гидроксиды. При переходе от одного элемента к другому наблюдается ослабление основных и усиление кислотных свойств высших оксидов и гидроксидов.
Элементы, расположенные в одной группе, имеют одинаковое строение внешних электронных оболочек атомов и поэтому их атомы проявляют сходные химические свойства.
Такой характер изменения свойств в основном повторяется во всех периодах (кроме первого), следовательно, такое изменение свойств называется периодическим.
Таким образом, при последовательном увеличении зарядов атомных ядер периодически повторяется конфигурация внешних электронных оболочек и, как следствие, периодически повторяются химические свойства атомов элементов и их соединений. В этом заключается физический смысл периодического закона.
Атомные и ионные радиусы атомов элементов с ростом атомного номера уменьшаются в периодах слева направо и увеличиваются в группах сверху вниз. С увеличением атомного номера в пределах каждого периода электроотрицательность возрастает, а в группе — уменьшается, т. е. металлические свойства атомов элементов в периоде ослабевают, а в группе — усиливаются. Периодическое изменение свойств атомов химических элементов при увеличении положительного заряда ядер объясняется тем, что периодически повторяется строение внешних электронных слоёв атомов.
Характеристика химического элемента по его положению в периодической системе и строению атома
Периодический закон и отражающая его периодическая система элементов представляют собой как бы краткое обобщение химии элементов и их соединений. Таблица периодической системы содержит сведения, позволяющие описать строение атомов химических элементов, предсказать состав, строение и свойства образованных ими простых веществ и наиболее характерных соединений: оксидов, соответствующих им гидроксидов, солей, летучих водородных соединений и т. д. Именно поэтому таблица периодической системы является непременной составляющей любого учебного и справочного пособия по химии.
В описании любого элемента особую роль играет его атомный номер Z, с которым связано положение элемента в периодической системе. Атомный номер даёт возможность знать не только порядковый номер элемента в периодической системе, но и его место в периоде и группе, а также электронное строение его атомов.
Описание любого химического элемента необходимо проводить по определённому алгоритму, т. е. соблюдая строгую последовательность действий. В этой последовательности главными этапами являются следующие:
- а) общие сведения об элементе;
- б) определение положения элемента в периодической системе;
- в) характеристика состава атомов элемента;
- г) описание электронного строения атомов;
- д) состав и свойства простого вещества;
- е) состав и свойства кислородных и водородных соединений.
Составим более детальный алгоритм такого описания химического элемента.
1. Общие сведения об элементе:
- а) название химического элемента;
- б) его химический знак;
- в) относительная атомная масса.
2. Положение химического элемента в периодической системе:
- а) атомный номер;
- б) номер периода;
- в) номер группы и её тип: А или В.
3. Состав атома:
- а) заряд ядра атома;
- б) число протонов, электронов и нейтронов (для определённого нуклида).
4. Электронное строение атомов элемента:
- а) электронная схема атома;
- б) электронная конфигурация атома;
- в) электронно-графическая схема атома;
- г) электронная конфигурация внешнего энергетического уровня;
- д) электронный тип элемента (s-, р-d.-f-)
5. Состав и свойства простого вещества:
- а) металл — неметалл;
- б) формула простого вещества;
- в) агрегатное состояние при обычных условиях.
6. Степени окисления элемента в высших оксидах и летучих водородных соединениях. Электроотрицательность.
7. Формулы оксидов и соответствующих им гидроксидов. Характеристика кислотно-основных свойств этих соединений.
8. Формула летучего водородного соединения.
Охарактеризуем, согласно приведённому алгоритму, два химических элемента — натрий и фосфор.
Натрий
1. Название химического элемента — натрий, химический знак — Na, относительная атомная масса — 23.
2. Натрий — элемент с атомным номером 11, находится в 3-м периоде, в группе IA.
3. Заряд ядра атома натрия 11+, следовательно, в ядре находится 11 протонов, общее число электронов также 11. В ядре нуклида натрия 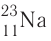
Кратко состав этого атома выражается так:
4. Электронная схема атома натрия:
Электронная конфигурация:
Электронно-графическая схема:
Электронная конфигурация внешнего энергетического уровня: 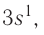
5. Так как на внешнем энергетическом уровне у натрия находится 1 электрон, то этот элемент относится к группе металлов. Простое вещество при обычных условиях — твёрдый металл. Формула простого вещества — Na.
6. Степень окисления в высшем оксиде +1. Летучих водородных соединений не образует. Электроотрицательность натрия 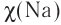
7. Формула высшего оксида — 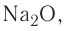
8. Летучего водородного соединения не образует.
Следующий элемент — фосфор — проанализируем по тому же алгоритму, но более сжато.
Фосфор
1. Фосфор
2. Z = 15. Положение в периодической системе: 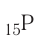
3. Состав атома (нуклида
4. Электронная схема:
Электронная конфигурация: 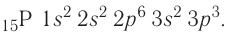
Электронная конфигурация внешнего энергетического уровня: 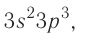
5. Фосфор — неметалл. При обычных условиях — твёрдое вещество; молекулярная формула —
6. Степени окисления:
а) в высших оксидах — +5;
б) в летучих водородных соединениях — —3.
Электроотрицательность:
7. Формула высшего оксида — 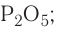
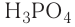
8. Летучее водородное соединение —
Периодический закон Д. И. Менделеева — один из наиболее общих и фундаментальных законов природы. Он является основой развития не только химии, но и всего естествознания в целом, позволяет раскрывать новые закономерности природы и проникать в их суть.
Периодическая система химических элементов представляет собой естественно-научную классификацию элементов по электронному строению их атомов, на основе которой строится изучение химии и решение её практических задач.
- Кислород как химический элемент
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Основные законы и понятия химии
- Место химии в системе наук
- Перспективы химического производства
- Типы химических реакций в химии
Строение электронных оболочек атомов элементов первых четырех периодов: $s-$, $p-$ и $d-$элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В $1891$ г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь».
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу $(–1)$. Томсон даже сумел определить скорость движения электрона (она равна скорости света — $300 000$ км/с) и массу электрона (она в $1836$ раз меньше массы атома водорода).
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
На рисунке показан «разрез» такой электронной плотности в атоме водорода, проходящей через ядро, а штриховой линией ограничена сфера, внутри которой вероятность обнаружения электрона составляет $90%$. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона — $10%$, вероятность обнаружения электрона внутри второго от ядра контура составляет $20%$, внутри третьего — $≈30%$ и т.д. В состоянии электрона есть некая неопределенность. Чтобы охарактеризовать это особое состояние, немецкий физик В. Гейзенберг ввел понятие о принципе неопределенности, т.е. показал, что невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона максимальна.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
В нем заключено приблизительно $90%$ электронного облака, и это означает, что около $90%$ времени электрон находится в этой части пространства. По форме различают $4$ известных ныне типа орбиталей, которые обозначаются латинскими буквами $s, p, d$ и $f$. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра: $1, 2, 3, 4, 5, 6$ и $7$.
Целое число $n$, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
$N=2n^2,$
где $N$ — максимальное число электронов; $n$ — номер уровня, или главное квантовое число. Следовательно: на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более $8$; на третьем — не более $18$; на четвертом — не более $32$. А как, в свою очередь, устроены энергетические уровни (электронные слои)?
Начиная со второго энергетического уровня $(n = 2)$, каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Каждому значению $n$ соответствует число орбиталей, равное $n^2$. По данным, представленным в таблице, можно проследить связь главного квантового числа $n$ с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
| Энергетический уровень $(n)$ | Число подуровней, равное $n$ | Тип орбитали | Число орбиталей | Максимальное число электронов | ||
| в подуровне | в уровне, равное $n^2$ | в подуровне | на уровне, равное $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ |
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: $s, p, d, f$. Так:
- $s$-подуровень — первый, ближайший к ядру атома подуровень каждого энергетического уровня, состоит из одной $s$-орбитали;
- $р$-подуровень — второй подуровень каждого, кроме первого, энергетического уровня, состоит из трех $р$-орбиталей;
- $d$-подуровень — третий подуровень каждого, начиная с третьего, энергетического уровня, состоит из пяти $d$-орбиталей;
- $f$-подуровень каждого, начиная с четвертого, энергетического уровня, состоит из семи $f$-орбиталей.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
- $α$-лучи, которые состоят из $α$-частиц, имеющих заряд в $2$ раза больше заряда электрона, но с положительным знаком, и массу в $4$ раза больше массы атома водорода;
- $β$-лучи представляют собой поток электронов;
- $γ$-лучи — электромагнитные волны с ничтожно малой массой, не несущие электрического заряда.
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеяние $α$-частиц, проходящих через тоненькую золотую фольгу и падаюших на экран. Альфа-частицы обычно отклонялись от первоначального направления всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг исследователи заметили, что некоторые $α$-частицы резко меняли направление своего пути, будто наталкиваясь на какую-то преграду.
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда $α$-частицы, отразившись от атомов золота, летели в противоположном направлении.
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку $(+1)$, и массу, равную массе атома водорода (она принята в химии за единицу). Обо значаются протоны знаком $↙{1}↖{1}p$ (или $р+$). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, т.е. $1$. Обозначают нейтроны знаком $↙{0}↖{1}n$ (или $n^0$).
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают так: $e↖{-}$.
Поскольку атом электронейтрален, также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Например, в ядре атома железа содержится $26$ протонов, а вокруг ядра вращается $26$ электронов. А как определить число ней тронов?
Как известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента $(Z)$, т.е. число протонов, и массовое число $(А)$, равное сумме чисел протонов и нейтронов, можно найти число нейтронов $(N)$ по формуле:
$N=A-Z$
Например, число нейтронов в атоме железа равно:
$56 – 26 = 30$.
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон — $p^+$ | $1$ | $+1$ | Число протонов равно порядковому номеру элемента |
| Нейтрон — $n^0$ | $1$ | $0$ | Число нейтронов находят по формуле: $N=A-Z$ |
| Электрон — $e↖{-}$ | ${1}/{1837}$ | $-1$ | Число электронов равно порядковому номеру элемента |
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой $12, 13, 14$; кислород — три изотопа с массой $16, 17, 18$ и т. д.
Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому значения атомных масс довольно часто являются дробными. Например, атомы природного хлора представляют собой смесь двух изотопов — $35$ (их в природе $75%$) и $37$ (их $25%$); следовательно, относительная атомная масса хлора равна $35.5$. Изотопы хлора записываются так:
$↖{35}↙{17}{Cl}$ и $↖{37}↙{17}{Cl}$
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
$↖{39}↙{19}{K}$ и $↖{40}↙{19}{K}$, $↖{39}↙{18}{Ar}$ и $↖{40}↙{18}{Ar}$
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки: протий — $↖{1}↙{1}{H}$; дейтерий — $↖{2}↙{1}{H}$, или $↖{2}↙{1}{D}$; тритий — $↖{3}↙{1}{H}$, или $↖{3}↙{1}{T}$.
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем $2$ электрона.
Водород и гелий — $s$-элементы, у этих атомов заполняется электронами $s$-орбиталь.
Элементы второго периода.
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют $s-$ и $р$-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала $s$, а затем $р$) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем $8$ электронов.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
У атома магния достраивается $3,5$-электронная орбиталь. $Na$ и $Mg$ — $s$-элементы.
У алюминия и последующих элементов заполняется электронами $3d$-подуровень.
В атоме аргона на внешнем слое (третьем электронном слое) $8$ электронов. Как внешний слой завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными $3d$-орбитали.
Все элементы от $Al$ до $Ar$ — $р$-элементы.
$s-$ и $р$-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого периода.
У атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, т.к. он имеет меньшую энергию, чем $3d$-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода:
- обозначим условно графическую электронную формулу аргона так: $Ar$;
- не будем изображать подуровни, которые у этих атомов не заполняются.
$К, Са$ — $s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами 3d-подуровень. Это $3d$-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с $4s-$ на $3d$-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций $3d^5$ и $3d^{10}$:
$↙{24}{Cr}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{4} 4s^{2}…$
$↙{29}{Cu}$ $1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{9}4s^{2}…$
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙{19}{K}$ Калий | 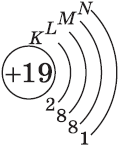 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1$ | 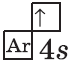 |
| $↙{20}{C}$ Кальций | 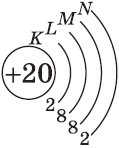 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2$ | 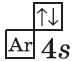 |
| $↙{21}{Sc}$ Скандий | 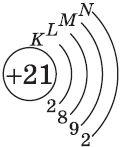 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^1$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^1{4}s^1$ | 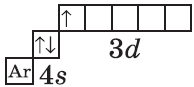 |
| $↙{22}{Ti}$ Титан | 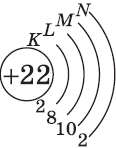 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^2$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^2{4}s^2$ | 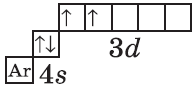 |
| $↙{23}{V}$ Ванадий | 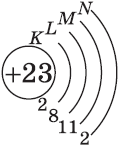 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^3$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^3{4}s^2$ | 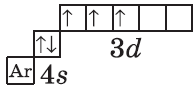 |
| $↙{24}{Сr}$ Хром | 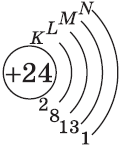 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^5$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^5{4}s^1$ | 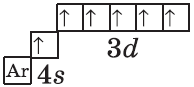 |
| $↙{29}{Сu}$ Хром | 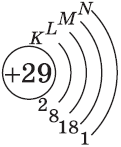 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^1{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^1$ | 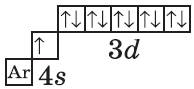 |
| $↙{30}{Zn}$ Цинк | 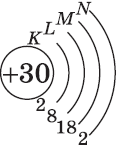 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^2$ | 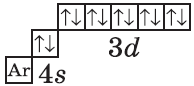 |
| $↙{31}{Ga}$ Галлий | 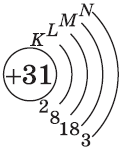 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^{1}$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^{1}$ | 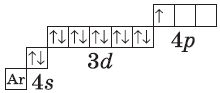 |
| $↙{36}{Kr}$ Криптон | 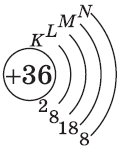 |
$1s^2{2}s^2{2}p^6{3}p^6{4}s^2{3}d^{10}4p^6$ или $1s^2{2}s^2{2}p^6{3}p^6{3}d^{10}{4}s^{2}4p^6$ | 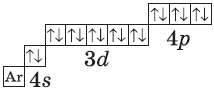 |
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни $3s, 3р$ и $3d$, всего на них $18$ электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, $4р$-подуровень. Элементы от $Ga$ до $Кr$ — $р$-элементы.
У атома криптона внешний (четвертый) слой завершен, имеет $8$ электронов. Но всего в четвертом электронном слое, как вы знаете, может быть $32$ электрона; у атома криптона пока остаются незаполненными $4d-$ и $4f$-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: $5s → 4d → 5р$. И также встречаются исключения, связанные с «провалом» электронов, у $↙{41}Nb$, $↙{42}Мо$, $↙{44}Ru$, $↙{45}Rh$, $↙{46}Pd$, $↙{47}Ag$. В шестом и седьмом периодах появляются $f$-элементы, т.е. элементы, у которых идет заполнение соответственно $4f-$ и $5f$-подуровней третьего снаружи электронного слоя.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: $↙{55}Cs$ и $↙{56}Ва$ — $6s$-элементы; $↙{57}La … 6s^{2}5d^{1}$ — $5d$-элемент; $↙{58}Се$ – $↙{71}Lu — 4f$-элементы; $↙{72}Hf$ – $↙{80}Hg — 5d$-элементы; $↙{81}Т1$ – $↙{86}Rn — 6d$-элементы. Но и здесь встречаются элементы, у которых нарушается порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных $f$-подуровней, т.е. $nf^7$ и $nf^{14}$.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
- $s$-элементы; электронами заполняется $s$-подуровень внешнего уровня атома; к $s$-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
- $р$-элементы; электронами заполняется $р$-подуровень внешнего уровня атома; к $р$-элементам относятся элементы главных подгрупп III–VIII групп;
- $d$-элементы; электронами заполняется $d$-подуровень предвнешнего уровня атома; к $d$-элементам относятся элементы побочных подгрупп I–VIII групп, т.е. элементы вставных декад больших периодов, расположенных между $s-$ и $р-$элементами. Их также называют переходными элементами;
- $f$-элементы; электронами заполняется $f-$подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Швейцарский физик В. Паули в $1925$ г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — веретено), т.е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси по часовой стрелке или против. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s$-орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия $Не$, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s-$орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.
$р-$Орбиталь имеет форму гантели, или объемной восьмерки. Все три $р$-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с $n= 2$, имеет три $р$-орбитали. С увеличением значения $n$ электроны занимают $р$-орбитали, расположенные на больших расстояниях от ядра и направленные по осям $x, y, z$.
У элементов второго периода $(n = 2)$ заполняется сначала одна $s$-орбиталь, а затем три $р$-орбитали; электронная формула $Li: 1s^{2}2s^{1}$. Электрон $2s^1$ слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион лития $Li^+$.
В атоме бериллия Be четвертый электрон также размещается на $2s$-орбитали: $1s^{2}2s^{2}$. Два внешних электрона атома бериллия легко отрываются — $В^0$ при этом окисляется в катион $Ве^{2+}$.
У атома бора пятый электрон занимает $2р$-орбиталь: $1s^{2}2s^{2}2p^{1}$. Далее у атомов $C, N, O, F$ идет заполнение $2р$-орбиталей, которое заканчивается у благородного газа неона: $1s^{2}2s^{2}2p^{6}$.
У элементов третьего периода заполняются соответственно $3s-$ и $3р$-орбитали. Пять $d$-орбиталей третьего уровня при этом остаются свободными:
$↙{11}Na 1s^{2}2s^{2}2p^{6}3s^{1}$,
$↙{17}Cl 1s^{2}2s^{2}2p^{6}3s^{2}3p^{5}$,
$↙{18}Ar 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}$.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
$↙{11}Na 2, 8, 1;$ $↙{17}Cl 2, 8, 7;$ $↙{18}Ar 2, 8, 8$.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно $4s-$ и $5s$-орбитали: $↙{19}K 2, 8, 8, 1;$ $↙{38}Sr 2, 8, 18, 8, 2$. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие $3d-$ и $4d-$орбитали соответственно (у элементов побочных подгрупп): $↙{23}V 2, 8, 11, 2;$ $↙{26}Fr 2, 8, 14, 2;$ $↙{40}Zr 2, 8, 18, 10, 2;$ $↙{43}Tc 2, 8, 18, 13, 2$. Как правило, когда будет заполнен предыдущий $d$-подуровень, начнет заполняться внешний (соответственно $4р-$ и $5р-$) $р-$подуровень: $↙{33}As 2, 8, 18, 5;$ $↙{52}Te 2, 8, 18, 18, 6$.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступают на внешний $s-$подуровень: $↙{56}Ba 2, 8, 18, 18, 8, 2;$ $↙{87}Fr 2, 8, 18, 32, 18, 8, 1$; следующий один электрон (у $La$ и $Са$) на предыдущий $d$-подуровень: $↙{57}La 2, 8, 18, 18, 9, 2$ и $↙{89}Ac 2, 8, 18, 32, 18, 9, 2$.
Затем последующие $14$ электронов поступят на третий снаружи энергетический уровень, на $4f$ и $5f$-орбитали соответственно лантоноидов и актиноидов: $↙{64}Gd 2, 8, 18, 25, 9, 2;$ $↙{92}U 2, 8, 18, 32, 21, 9, 2$.
Затем снова начнет застраиваться второй снаружи энергетический уровень ($d$-подуровень) у элементов побочных подгрупп: $↙{73}Ta 2, 8, 18, 32, 11, 2;$ $↙{104}Rf 2, 8, 18, 32, 32, 10, 2$. И, наконец, только после полного заполнения десятью электронами $d$-подуровня будет снова заполняться $р$-под уровень: $↙{86}Rn 2, 8, 18, 32, 18, 8$.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Электронные формулы химических элементов

4.6
Средняя оценка: 4.6
Всего получено оценок: 615.
4.6
Средняя оценка: 4.6
Всего получено оценок: 615.
Расположение электронов на энергетических оболочках или уровнях записывают с помощью электронных формул химических элементов. Электронные формулы или конфигурации помогают представить структуру атома элемента.
Строение атома
Чтобы читать электронные формулы, необходимо понять строение атома.
Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые располагаются вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
Орбитали могут иметь разную геометрическую конфигурацию:
- s-орбитали – сферические;
- р-, d и f-орбитали – гантелеобразные, лежащие в разных плоскостях.
На первом энергетическом уровне любого атома всегда располагается s-орбиталь с двумя электронами (исключение – водород). Начиная со второго уровня, на одном уровне находятся s- и р-орбитали.
Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
Запись формулы
Электронные конфигурации атомов химических элементов записываются по следующим принципам:
- каждому энергетическому уровню соответствует порядковый номер, обозначаемый арабской цифрой;
- за номером следует буква, означающая орбиталь;
- над буквой пишется верхний индекс, соответствующий количеству электронов на орбитали.
Примеры записи:
- кальций –
1s22s22p63s23p64s2;
- кислород –
1s22s22p4;
- углерод –
Записать электронную формулу помогает таблица Менделеева. Количеству энергетических уровней соответствует номер периода. На заряд атома и количество электронов указывает порядковый номер элемента. Номер группы показывает, сколько валентных электронов находится на внешнем уровне.
Для примера возьмём Na. Натрий находится в первой группе, в третьем периоде, под 11 номером. Это значит, что атом натрия имеет положительно заряженное ядро (содержит 11 протонов), вокруг которого на трёх энергетических уровнях располагается 11 электронов. На внешнем уровне находится один электрон.
Вспомним, что первый энергетический уровень содержит s-орбиталь с двумя электронами, а второй – s- и р-орбитали. Остаётся заполнить уровни и получить полную запись:
+11 Na )2)8)1 или 1s22s22p63s1.
Для удобства созданы специальные таблицы электронных формул элемента. В длинной периодической таблице формулы также указываются в каждой клетке элемента.
Для краткости в квадратных скобках записаны элементы, электронная формула которых совпадает с началом формулы элемента. Например, электронная формула магния – [Ne]3s2, неона – 1s22s22p6. Следовательно, полная формула магния – 1s22s22p63s2.
Что мы узнали?
Электронные формулы элементов отражают расположение электронов в атоме на разных орбиталях. Количество электронов равно порядковому номеру элемента, количество уровней – номеру периода. На последнем уровне находятся валентные электроны, соответствующие номеру группы элемента. Цифры в электронной формуле показывают уровень, буквы – орбиталь, индексы – количество электронов на уровне.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 615.
А какая ваша оценка?
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и электронной оболочки.
В состав ядра входят нуклоны, или ядерные частицы. Это протоны и нейтроны. Электронная оболочка образована электронами. Протоны, нейтроны и электроны называют элементарными частицами атома.
Нуклоны в ядре удерживаются ядерным взаимодействием, энергия которого намного больше энергии химической связи. Поэтому в химических реакциях ядра не разрушаются.
Протон ((p)) — это частица с относительным зарядом (+1) и относительной массой (1).
Нейтрон ((n)) не имеет заряда, а его относительная масса тоже равна (1).
Электрон (
e−
) имеет заряд (-1), а его масса в (1837) раз меньше массы протона и нейтрона.
Строение атома можно охарактеризовать по положению химического элемента в периодической системе.
Порядковый номер элемента равен заряду ядра, числу протонов в ядре и числу электронов в его электронной оболочке.
Учитывая, что масса атома в основном сосредоточена в ядре и масса каждого нуклона равна (1), можно определить число нейтронов. Для этого от массового числа нужно отнять число протонов (порядковый номер).
Пример:
порядковый номер радия
Ra
(88), относительная атомная масса равна (226). Значит, в атоме содержится (88) протонов и (88) электронов, а число нейтронов равно (226 — 88 = 138).
Число нейтронов в атомах одного элемента непостоянно. Поэтому атомы одного химического элемента могут различаться своими массами и существуют в виде разных нуклидов (изотопов).
Изотопы (нуклиды) — разновидности атомов с одинаковым зарядом ядра, но разными массами.
Изотопы с одинаковым зарядом ядра составляют химический элемент. Их обозначают, указывая справа вверху от символа элемента массовое число. Справа внизу часто записывают также протонное число (порядковый номер):
O816
,
O817
.
Большинство химических элементов в природе представлено несколькими разновидностями атомов. Всего их известно более (2500).
Пример:
водород в природе представлен тремя изотопами. Ядро самого лёгкого изотопа (протия) состоит только из одного протона. В ядре дейтерия один протон и один нейтрон, а в ядре трития один протон и два нейтрона.
Рис. (1). Изотопы водорода
Указанная в периодической системе относительная атомная масса — это средняя масса всех существующих в природе изотопов данного элемента. Когда мы её округляем до целых, то получаем массу самого распространённого изотопа.
Источники:
Рис. 1. Изотопы водорода. © ЯКласс