From Wikipedia, the free encyclopedia
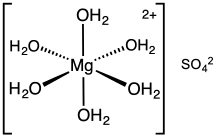
Magnesium sulfate hexahydrate |
|

Anhydrous magnesium sulfate |
|

Epsomite (Magnesium sulfate heptahydrate) |
|
| Names | |
|---|---|
| IUPAC name
Magnesium sulfate |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.028.453 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgSO4 |
| Molar mass |
|
| Appearance | white crystalline solid |
| Odor | odorless |
| Density |
|
| Melting point |
|
|
Solubility in water |
|
|
Solubility product (Ksp) |
738 (502 g/L) |
| Solubility |
|
|
Magnetic susceptibility (χ) |
−50·10−6 cm3/mol |
|
Refractive index (nD) |
1.523 (monohydrate) 1.433 (heptahydrate) |
| Structure | |
|
Crystal structure |
monoclinic (hydrate) |
| Pharmacology | |
|
ATC code |
A06AD04 (WHO) A12CC02 (WHO) B05XA05 (WHO) D11AX05 (WHO) V04CC02 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Related compounds | |
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium sulfate or magnesium sulphate (in English-speaking countries other than the US) is a chemical compound, a salt with the formula MgSO4, consisting of magnesium cations Mg2+ (20.19% by mass) and sulfate anions SO2−4. It is a white crystalline solid, soluble in water but not in ethanol.
Magnesium sulfate is usually encountered in the form of a hydrate MgSO4·nH2O, for various values of n between 1 and 11. The most common is the heptahydrate MgSO4·7H2O, known as Epsom salt, which is a household chemical with many traditional uses, including bath salts.[1]
The main use of magnesium sulfate is in agriculture, to correct soils deficient in magnesium (an essential plant nutrient because of the role of magnesium in chlorophyll and photosynthesis). The monohydrate is favored for this use; by the mid 1970s, its production was 2.3 million tons per year.[2] The anhydrous form and several hydrates occur in nature as minerals, and the salt is a significant component of the water from some springs.
Hydrates[edit]
Magnesium sulfate can crystallize as several hydrates, including:
- Anhydrous, MgSO4; unstable in nature, hydrates to form epsomite.[3]
- Monohydrate, MgSO4·H2O; kieserite, monoclinic.[4]
- Monohydrate, MgSO4·H2O; triclinic.[5]
- MgSO4·1.25H2O or 4MgSO4·5H2O.[6]
- Dihydrate, MgSO4·2H2O; orthorhombic.
- MgSO4·2.5H2O or 2MgSO4·5H2O.[6]
- Trihydrate, MgSO4·3H2O.[6]
- Tetrahydrate, MgSO4·4H2O; starkeyite, monoclinic.[7]
- Pentahydrate, MgSO4·5H2O; pentahydrite, triclinic.[4]
- Hexahydrate, MgSO4·6H2O; hexahydrite, monoclinic.
- Heptahydrate, MgSO4·7H2O («Epsom salt»); epsomite, orthorhombic.[4]
- Enneahydrate, MgSO4·9H2O, monoclinic.[8]
- Decahydrate, MgSO4·10H2O.[7]
- Undecahydrate, MgSO4·11H2O; meridianiite, triclinic.[7]
As of 2017, the existence of the decahydrate apparently has not been confirmed.[8]
All the hydrates lose water upon heating. Above 320 °C, only the anhydrous form is stable. It decomposes without melting at 1124 °C into magnesium oxide (MgO) and sulfur trioxide (SO3).
Heptahydrate[edit]
The heptahydrate takes its common name «Epsom salt» from a bitter saline spring in Epsom in Surrey, England, where the salt was produced from the springs that arise where the porous chalk of the North Downs meets the impervious London clay.
The heptahydrate readily loses one equivalent of water to form the hexahydrate.
It is a natural source of both magnesium and sulphur. Epsom salts are commonly used in bath salts, exfoliants, muscle relaxers and pain relievers. However, these are different from Epsom salts that are used for gardening, as they contain aromas and perfumes not suitable for plants.[9]
Monohydrate[edit]
Magnesium sulfate monohydrate, or kieserite, can be prepared by heating the heptahydrate to 120 °C.[10] Further heating to 250 °C gives anhydrous magnesium sulfate.[10] Kieserite exhibits monoclinic symmetry at pressures lower than 2.7 GPa after which it transforms to phase of triclinic symmetry.[5]
Undecahydrate[edit]
The undecahydrate MgSO4·11H2O, meridianiite, is stable at atmospheric pressure only below 2 °C. Above that temperature, it liquefies into a mix of solid heptahydrate and a saturated solution. It has a eutectic point with water at −3.9 °C and 17.3% (mass) of MgSO4.[6] Large crystals can be obtained from solutions of the proper concentration kept at 0 °C for a few days.[6]
At pressures of about 0.9 GPa and at 240 K, meridianiite decomposes into a mixture of ice VI and the enneahydrate MgSO4·9H2O.[8]
Enneahydrate[edit]
The enneahydrate MgSO4·9H2O was identified and characterized only recently, even though it seems easy to produce (by cooling a solution of MgSO4 and sodium sulfate Na2SO4 in suitable proportions).
The structure is monoclinic, with unit-cell parameters at 250 K: a = 0.675 nm, b = 1.195 nm, c = 1.465 nm, β = 95.1°, V = 1.177 nm3 with Z = 4. The most probable space group is P21/c. Magnesium selenate also forms an enneahydrate MgSeO4·9H2O, but with a different crystal structure.[8]
Natural occurrence[edit]
As Mg2+ and SO2−4 ions are respectively the second cation and the second anion present in seawater after Na+ and Cl−, magnesium sulfates are common minerals in geological environments. Their occurrence is mostly connected with supergene processes. Some of them are also important constituents of evaporitic potassium-magnesium (K-Mg) salts deposits.
Bright spots observed by the Dawn Spacecraft in Occator Crater on the dwarf planet Ceres are most consistent with reflected light from magnesium sulfate hexahydrate.[11]
Almost all known mineralogical forms of MgSO4 are hydrates. Epsomite is the natural analogue of «Epsom salt». Meridianiite, MgSO4·11H2O, has been observed on the surface of frozen lakes and is thought to also occur on Mars. Hexahydrite is the next lower hydrate. Three next lower hydrates – pentahydrite, starkeyite, and especially sanderite – are rare. Kieserite is a monohydrate and is common among evaporitic deposits. Anhydrous magnesium sulfate was reported from some burning coal dumps.
Preparation[edit]
Magnesium sulfate is usually obtained directly from dry lake beds and other natural sources. It can also be prepared by reacting magnesite (magnesium carbonate, MgCO3) or magnesia (oxide, MgO) with sulfuric acid (H2SO4).
Another possible method is to treat seawater or magnesium-containing industrial wastes so as to precipitate magnesium hydroxide and react the precipitate with sulfuric acid.
Also, magnesium sulfate heptahydrate (epsomite, MgSO4·7H2O) is manufactured by dissolution of magnesium sulfate monohydrate (kieserite, MgSO4·H2O) in water and subsequent crystallization of the heptahydrate.
Physical properties[edit]
Magnesium sulfate relaxation is the primary mechanism that causes the absorption of sound in seawater at frequencies above 10 kHz[12] (acoustic energy is converted to thermal energy). Lower frequencies are less absorbed by the salt, so that low frequency sound travels farther in the ocean. Boric acid and magnesium carbonate also contribute to absorption.[13]
Uses[edit]
Medical[edit]
Magnesium sulfate is used both externally (as Epsom salt) and internally.
The main external use is the formulation as bath salts, especially for foot baths to soothe sore feet. Such baths have been claimed to also soothe and hasten recovery from muscle pain, soreness, or injury.[14] Potential health effects of magnesium sulfate are reflected in medical studies on the impact of magnesium on resistant depression[15] and as an analgesic for migraine and chronic pain.[16] Magnesium sulfate has been studied in the treatment of asthma,[17] preeclampsia and eclampsia.[18]
Magnesium sulfate is the usual component of the concentrated salt solution used in isolation tanks to increase its specific gravity to approximately 1.25–1.26. This high density allows an individual to float effortlessly on the surface of water in the closed tank, eliminating as many of the external senses as possible.
In the UK, a medication containing magnesium sulfate and phenol, called «drawing paste», is useful for small boils or localized infections[19] and removing splinters.[20]
Internally, magnesium sulfate may be administered by oral, respiratory, or intravenous routes. Internal uses include replacement therapy for magnesium deficiency,[21] treatment of acute and severe arrhythmias,[22] as a bronchodilator in the treatment of asthma,[23] preventing eclampsia,[24] a tocolytic agent,[25] and as an anticonvulsant.[25]
It also may be used as laxative.[26]
Agriculture[edit]
In agriculture, magnesium sulfate is used to increase magnesium or sulfur content in soil. It is most commonly applied to potted plants, or to magnesium-hungry crops such as potatoes, tomatoes, carrots, peppers, lemons, and roses. The advantage of magnesium sulfate over other magnesium soil amendments (such as dolomitic lime) is its high solubility, which also allows the option of foliar feeding. Solutions of magnesium sulfate are also nearly pH neutral, compared with the slightly alkaline salts of magnesium as found in limestone; therefore, the use of magnesium sulfate as a magnesium source for soil does not significantly change the soil pH.[25] Contrary to the popular belief that magnesium sulfate is able to control pests and slugs, helps seeds germination, produce more flowers, improve nutrient uptake, and is environmentally friendly, it does none of the purported claims except for correcting magnesium deficiency in soils. Magnesium sulfate can even pollute water if used in excessive amounts.[27]
Magnesium sulfate was historically used as a treatment for lead poisoning prior to the development of chelation therapy, as it was hoped that any lead ingested would be precipitated out by the magnesium sulfate and subsequently purged from the digestive system.[28] This application saw particularly widespread use among veterinarians during the early-to-mid 20th century; Epsom salt was already available on many farms for agricultural use, and it was often prescribed in the treatment of farm animals that inadvertently ingested lead.[29][30]
Food preparation[edit]
Magnesium sulfate is used as
- Brewing salt in making beer.[31]
- coagulant for making tofu.[32]
- Salt substitute.
Chemistry[edit]
Anhydrous magnesium sulfate is commonly used as a desiccant in organic synthesis owing to its affinity for water and compatibility with most organic compounds. During work-up, an organic phase is treated with anhydrous magnesium sulfate. The hydrated solid is then removed by filtration, decantation, or by distillation (if the boiling point is low enough). Other inorganic sulfate salts such as sodium sulfate and calcium sulfate may be used in the same way.
Construction[edit]
Magnesium sulfate is used to prepare specific cements by the reaction between magnesium oxide and magnesium sulfate solution, which are of good binding ability and more resistance than Portland cement. This cement is mainly adopted in the production of lightweight insulation panels. Weakness in water resistance limits its usage.
Magnesium (or sodium) sulfate is also used for testing aggregates for soundness in accordance with ASTM C88 standard, when there are no service records of the material exposed to actual weathering conditions. The test is accomplished by repeated immersion in saturated solutions followed by oven drying to dehydrate the salt precipitated in permeable pore spaces. The internal expansive force, derived from the rehydration of the salt upon re-immersion, simulates the expansion of water on freezing.
Magnesium sulfate is also used to test the resistance of concrete to external sulfate attack (ESA).
Aquaria[edit]
Magnesium sulfate heptahydrate is also used to maintain the magnesium concentration in marine aquaria which contain large amounts of stony corals, as it is slowly depleted in their calcification process. In a magnesium-deficient marine aquarium, calcium and alkalinity concentrations are very difficult to control because not enough magnesium is present to stabilize these ions in the saltwater and prevent their spontaneous precipitation into calcium carbonate.[33]
Double salts[edit]
Double salts containing magnesium sulfate exist. There are several known as sodium magnesium sulfates and potassium magnesium sulfates. A mixed copper-magnesium sulfate heptahydrate (Mg,Cu)SO4·7H2O was recently found to occur in mine tailings and has been given the mineral name alpersite.[34]
Research[edit]
Research on topical magnesium (for example epsom salt baths) is very limited.[35][36][37] The Epsom Salt Council recommends bathing 2 or 3 times/ week, using 500-600g Epsom salts each time.[38][dubious – discuss]
See also[edit]
- Calcium sulfate
- Magnesium chloride
References[edit]
- ^ «Quick Cures/Quack Cures: Is Epsom Worth Its Salt?». The Wall Street Journal. 9 April 2012. Archived from the original on 12 April 2012. Retrieved 15 June 2019.
- ^ Industrial Inorganic Chemistry, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner, John Wiley & Sons, 2d edition, 2000, ISBN 978-3-527-61333-5
- ^ «Unnamed (Mg Sulphate)».
- ^ a b c Odochian, Lucia (1995). «Study of the nature of the crystallization water in some magnesium hydrates by thermal methods». Journal of Thermal Analysis and Calorimetry. 45 (6): 1437–1448. doi:10.1007/BF02547437. S2CID 97855885. Archived from the original on 26 August 2011. Retrieved 7 August 2010.
- ^ a b Meusburger, Johannes (15 January 2020). «Polymorphism of Mg-sulfate monohydrate kieserite under pressure and its occurrence on giant icy jovian satellites».
- ^ a b c d e A. Dominic Fortes, Frank Browning, and Ian G. Wood (2012): «Cation substitution in synthetic meridianiite (MgSO4·11H2O) I: X-ray powder diffraction analysis of quenched polycrystalline aggregates». Physics and Chemistry of Minerals, volume 39, issue, pages 419–441. doi:10.1007/s00269-012-0497-9
- ^ a b c R. C. Peterson, W. Nelson, B. Madu, and H. F. Shurvell (2007): «Meridianiite: A new mineral species observed on Earth and predicted to exist on Mars». American Mineralogist, volume 92, issue 10, pages 1756–1759. doi:10.2138/am.2007.2668
- ^ a b c d A. Dominic Fortes, Kevin S. Knight, and Ian G. Wood (2017): «Structure, thermal expansion and incompressibility of MgSO4·9H2O, its relationship to meridianiite (MgSO4·11H2O) and possible natural occurrences». Acta Crystallographica Section B: Structureal Science, Crystal Engineering and Materials, volume 73, part 1, pages 47-64. doi:10.1107/S2052520616018266
- ^ «What Is Epsom Salt And Why Is It So Important For My Cannabis Garden?». Herbies. Retrieved 28 October 2020.
- ^ a b PubChem. «Hazardous Substances Data Bank (HSDB) : 664». pubchem.ncbi.nlm.nih.gov. Retrieved 15 March 2022.
- ^ M. C. De Sanctis; E. Ammannito; A. Raponi; S. Marchi; T. B. McCord; H. Y. McSween; F. Capaccioni; M. T. Capria; F. G. Carrozzo; M. Ciarniello; A. Longobardo; F. Tosi; S. Fonte; M. Formisano; A. Frigeri; M. Giardino; G. Magni; E. Palomba; D. Turrini; F. Zambon; J.-P. Combe; W. Feldman; R. Jaumann; L. A. McFadden; C. M. Pieters (2015). «Ammoniated phyllosilicates with a likely outer Solar System origin on (1) Ceres» (PDF). Nature. 528 (7581): 241–244. Bibcode:2015Natur.528..241D. doi:10.1038/nature16172. PMID 26659184. S2CID 1687271.
- ^ «Underlying physics and mechanisms for the absorption of sound in seawater». Resource.npl.co.uk. Archived from the original on 18 June 2009. Retrieved 6 July 2009.
- ^ Michael A. Ainslie, Principles of Sonar Performance Modeling, p.18
- ^ Ingraham, Paul. «Does Epsom Salt Work? The science of Epsom salt bathing for recovery from muscle pain, soreness, or injury». Pain Science. Archived from the original on 10 September 2016. Retrieved 29 August 2016.
- ^ Eby, George A.; Eby, Karen L. (April 2010). «Magnesium for treatment-resistant depression: a review and hypothesis». Medical Hypotheses. 74 (4): 649–660. doi:10.1016/j.mehy.2009.10.051. ISSN 1532-2777. PMID 19944540.
- ^ [citation needed]
- ^ «Magnesium sulfate asthma – Search Results». PubMed. Retrieved 29 June 2021.
- ^ «Magnesium sulfate eclampsia – Search Results». PubMed. Retrieved 29 June 2021.
- ^ «Boots Magnesium Sulfate Paste B.P. — Patient Information Leaflet (PIL) — (eMC)». www.medicines.org.uk. Retrieved 14 April 2018.
- ^ «Removing a splinter with Magnesium Sulphate».
- ^ «Pharmaceutical Information – Magnesium Sulfate». RxMed. Archived from the original on 3 April 2009. Retrieved 6 July 2009.
- ^ «CPR and First Aid: Antiarrhythmic Drugs During and Immediately After Cardiac Arrest (section)». American Heart Association. Retrieved 29 August 2016.
Previous ACLS guidelines addressed the use of magnesium in cardiac arrest with polymorphic ventricular tachycardia (ie, torsades de pointes) or suspected hypomagnesemia, and this has not been reevaluated in the 2015 Guidelines Update. These previous guidelines recommended defibrillation for termination of polymorphic VT (ie, torsades de pointes), followed by consideration of intravenous magnesium sulfate when secondary to a long QT interval.
- ^ Blitz M, Blitz S, Hughes R, Diner B, Beasley R, Knopp J, Rowe BH (2005). «Aerosolized magnesium sulfate for acute asthma: a systematic review». Chest. 128 (1): 337–344. doi:10.1378/chest.128.1.337. PMID 16002955..
- ^ Duley, L; Gülmezoglu, AM; Henderson-Smart, DJ; Chou, D (10 November 2010). «Magnesium sulphate and other anticonvulsants for women with pre-eclampsia». The Cochrane Database of Systematic Reviews. 2010 (11): CD000025. doi:10.1002/14651858.CD000025.pub2. PMC 7061250. PMID 21069663.
- ^ a b c «Pubchem: Magnesium Sulfate». PubChem. Archived from the original on 29 April 2021. Retrieved 13 September 2021.
- ^ Izzo, A. A.; Gaginella, T. S.; Capasso, F. (June 1996). «The osmotic and intrinsic mechanisms of the pharmacological laxative action of oral high doses of magnesium sulphate. Importance of the release of digestive polypeptides and nitric oxide». Magnesium Research. 9 (2): 133–138. ISSN 0953-1424. PMID 8878010.
- ^ «Horticulture myths». University of Vermont Extension Department of Plant and Soil Science. Archived from the original on 7 September 2019. Retrieved 18 October 2021.
- ^ Wood, H. C. (1877). A Treatise on Therapeutics, Comprising Materia Medica and Toxicology, with Especial Reference to the Application of the Physiological Action of Drugs to Clinical Medicine. Philadelphia: J. B. Lippincott & Co. p. 34.
The treatment of acute lead-poisoning consists in the evacuation of the stomach, if necessary, the exhibition of the sulphate of sodium or of magnesium, and the meeting of the indications as they arrive. The Epsom and Glauber’s salts act as chemical antidotes, by precipitating the insoluble sulphate of lead, and also, if in excess, empty the bowel of the compound formed.
- ^ Barker, C. A. V. (January 1945). «Experience with Lead Poisoning». Canadian Journal of Comparative Medicine and Veterinary Science. 9 (1): 6–8. PMC 1660962. PMID 17648099.
Udall (1) suggests sodium citrate as of some value together with Epsom salts which will bring about a precipitation of the lead in the form of an insoluble compound. Nelson (3) reported a case that survived following the use of a 20% magnesium sulphate solution intravenously, subcutaneously and orally. McIntosh (5) has suggested that purgative doses of Epsom salts may be effective in combining with the lead and overcoming the toxicity.
- ^ Herriot, James (1972). All Creatures Great and Small. New York: St. Martin’s Press. p. 157. ISBN 0-312-08498-6.
The specific antidotes to metal poisoning had not been discovered and the only thing which sometimes did a bit of good was magnesium sulphate which caused the precipitation of insoluble lead sulphate. The homely term for magnesium sulphate is, of course, epsom salts.
- ^ «Magnesium Sulphate». National Home Brew. Archived from the original on 1 August 2016. Retrieved 4 January 2019.
- ^ US 6042851, Matsuura, Masaru; Sasaki, Masaoki & Sasakib, Jun et al., «Process for producing packed tofu», published 2000-03-28
- ^ «Do-It-Yourself Magnesium Supplements for the Reef Aquarium». Reefkeeping. 2006. Archived from the original on 22 March 2008. Retrieved 14 March 2008.
- ^ Peterson, Ronald C.; Hammarstrom, Jane M.; Seal, II, Robert R (February 2006). «Alpersite (Mg,Cu)SO4·7H2O, a new mineral of the melanterite group, and cuprian pentahydrite: Their occurrence within mine waste». American Mineralogist. 91 (2–3): 261–269. doi:10.2138/am.2006.1911. S2CID 56431885.
- ^ «Epsom Salt: Benefits, Uses, and Side Effects». Healthline. 13 December 2018.
- ^ «Magnesium Oil Benefits: Forms, Benefits, Uses, and Risks». Healthline. 25 January 2021.
- ^ Rath, Linda. «Why Take an Epsom Salts Bath?». WebMD.
- ^ (PDF) http://www.epsomsaltcouncil.org/wp-content/uploads/2015/10/report_on_absorption_of_magnesium_sulfate.pdf.
External links[edit]
- International Chemical Safety Cards—Magnesium Sulfate
From Wikipedia, the free encyclopedia

Magnesium sulfate hexahydrate |
|

Anhydrous magnesium sulfate |
|

Epsomite (Magnesium sulfate heptahydrate) |
|
| Names | |
|---|---|
| IUPAC name
Magnesium sulfate |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.028.453 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgSO4 |
| Molar mass |
|
| Appearance | white crystalline solid |
| Odor | odorless |
| Density |
|
| Melting point |
|
|
Solubility in water |
|
|
Solubility product (Ksp) |
738 (502 g/L) |
| Solubility |
|
|
Magnetic susceptibility (χ) |
−50·10−6 cm3/mol |
|
Refractive index (nD) |
1.523 (monohydrate) 1.433 (heptahydrate) |
| Structure | |
|
Crystal structure |
monoclinic (hydrate) |
| Pharmacology | |
|
ATC code |
A06AD04 (WHO) A12CC02 (WHO) B05XA05 (WHO) D11AX05 (WHO) V04CC02 (WHO) |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Related compounds | |
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium sulfate or magnesium sulphate (in English-speaking countries other than the US) is a chemical compound, a salt with the formula MgSO4, consisting of magnesium cations Mg2+ (20.19% by mass) and sulfate anions SO2−4. It is a white crystalline solid, soluble in water but not in ethanol.
Magnesium sulfate is usually encountered in the form of a hydrate MgSO4·nH2O, for various values of n between 1 and 11. The most common is the heptahydrate MgSO4·7H2O, known as Epsom salt, which is a household chemical with many traditional uses, including bath salts.[1]
The main use of magnesium sulfate is in agriculture, to correct soils deficient in magnesium (an essential plant nutrient because of the role of magnesium in chlorophyll and photosynthesis). The monohydrate is favored for this use; by the mid 1970s, its production was 2.3 million tons per year.[2] The anhydrous form and several hydrates occur in nature as minerals, and the salt is a significant component of the water from some springs.
Hydrates[edit]
Magnesium sulfate can crystallize as several hydrates, including:
- Anhydrous, MgSO4; unstable in nature, hydrates to form epsomite.[3]
- Monohydrate, MgSO4·H2O; kieserite, monoclinic.[4]
- Monohydrate, MgSO4·H2O; triclinic.[5]
- MgSO4·1.25H2O or 4MgSO4·5H2O.[6]
- Dihydrate, MgSO4·2H2O; orthorhombic.
- MgSO4·2.5H2O or 2MgSO4·5H2O.[6]
- Trihydrate, MgSO4·3H2O.[6]
- Tetrahydrate, MgSO4·4H2O; starkeyite, monoclinic.[7]
- Pentahydrate, MgSO4·5H2O; pentahydrite, triclinic.[4]
- Hexahydrate, MgSO4·6H2O; hexahydrite, monoclinic.
- Heptahydrate, MgSO4·7H2O («Epsom salt»); epsomite, orthorhombic.[4]
- Enneahydrate, MgSO4·9H2O, monoclinic.[8]
- Decahydrate, MgSO4·10H2O.[7]
- Undecahydrate, MgSO4·11H2O; meridianiite, triclinic.[7]
As of 2017, the existence of the decahydrate apparently has not been confirmed.[8]
All the hydrates lose water upon heating. Above 320 °C, only the anhydrous form is stable. It decomposes without melting at 1124 °C into magnesium oxide (MgO) and sulfur trioxide (SO3).
Heptahydrate[edit]
The heptahydrate takes its common name «Epsom salt» from a bitter saline spring in Epsom in Surrey, England, where the salt was produced from the springs that arise where the porous chalk of the North Downs meets the impervious London clay.
The heptahydrate readily loses one equivalent of water to form the hexahydrate.
It is a natural source of both magnesium and sulphur. Epsom salts are commonly used in bath salts, exfoliants, muscle relaxers and pain relievers. However, these are different from Epsom salts that are used for gardening, as they contain aromas and perfumes not suitable for plants.[9]
Monohydrate[edit]
Magnesium sulfate monohydrate, or kieserite, can be prepared by heating the heptahydrate to 120 °C.[10] Further heating to 250 °C gives anhydrous magnesium sulfate.[10] Kieserite exhibits monoclinic symmetry at pressures lower than 2.7 GPa after which it transforms to phase of triclinic symmetry.[5]
Undecahydrate[edit]
The undecahydrate MgSO4·11H2O, meridianiite, is stable at atmospheric pressure only below 2 °C. Above that temperature, it liquefies into a mix of solid heptahydrate and a saturated solution. It has a eutectic point with water at −3.9 °C and 17.3% (mass) of MgSO4.[6] Large crystals can be obtained from solutions of the proper concentration kept at 0 °C for a few days.[6]
At pressures of about 0.9 GPa and at 240 K, meridianiite decomposes into a mixture of ice VI and the enneahydrate MgSO4·9H2O.[8]
Enneahydrate[edit]
The enneahydrate MgSO4·9H2O was identified and characterized only recently, even though it seems easy to produce (by cooling a solution of MgSO4 and sodium sulfate Na2SO4 in suitable proportions).
The structure is monoclinic, with unit-cell parameters at 250 K: a = 0.675 nm, b = 1.195 nm, c = 1.465 nm, β = 95.1°, V = 1.177 nm3 with Z = 4. The most probable space group is P21/c. Magnesium selenate also forms an enneahydrate MgSeO4·9H2O, but with a different crystal structure.[8]
Natural occurrence[edit]
As Mg2+ and SO2−4 ions are respectively the second cation and the second anion present in seawater after Na+ and Cl−, magnesium sulfates are common minerals in geological environments. Their occurrence is mostly connected with supergene processes. Some of them are also important constituents of evaporitic potassium-magnesium (K-Mg) salts deposits.
Bright spots observed by the Dawn Spacecraft in Occator Crater on the dwarf planet Ceres are most consistent with reflected light from magnesium sulfate hexahydrate.[11]
Almost all known mineralogical forms of MgSO4 are hydrates. Epsomite is the natural analogue of «Epsom salt». Meridianiite, MgSO4·11H2O, has been observed on the surface of frozen lakes and is thought to also occur on Mars. Hexahydrite is the next lower hydrate. Three next lower hydrates – pentahydrite, starkeyite, and especially sanderite – are rare. Kieserite is a monohydrate and is common among evaporitic deposits. Anhydrous magnesium sulfate was reported from some burning coal dumps.
Preparation[edit]
Magnesium sulfate is usually obtained directly from dry lake beds and other natural sources. It can also be prepared by reacting magnesite (magnesium carbonate, MgCO3) or magnesia (oxide, MgO) with sulfuric acid (H2SO4).
Another possible method is to treat seawater or magnesium-containing industrial wastes so as to precipitate magnesium hydroxide and react the precipitate with sulfuric acid.
Also, magnesium sulfate heptahydrate (epsomite, MgSO4·7H2O) is manufactured by dissolution of magnesium sulfate monohydrate (kieserite, MgSO4·H2O) in water and subsequent crystallization of the heptahydrate.
Physical properties[edit]
Magnesium sulfate relaxation is the primary mechanism that causes the absorption of sound in seawater at frequencies above 10 kHz[12] (acoustic energy is converted to thermal energy). Lower frequencies are less absorbed by the salt, so that low frequency sound travels farther in the ocean. Boric acid and magnesium carbonate also contribute to absorption.[13]
Uses[edit]
Medical[edit]
Magnesium sulfate is used both externally (as Epsom salt) and internally.
The main external use is the formulation as bath salts, especially for foot baths to soothe sore feet. Such baths have been claimed to also soothe and hasten recovery from muscle pain, soreness, or injury.[14] Potential health effects of magnesium sulfate are reflected in medical studies on the impact of magnesium on resistant depression[15] and as an analgesic for migraine and chronic pain.[16] Magnesium sulfate has been studied in the treatment of asthma,[17] preeclampsia and eclampsia.[18]
Magnesium sulfate is the usual component of the concentrated salt solution used in isolation tanks to increase its specific gravity to approximately 1.25–1.26. This high density allows an individual to float effortlessly on the surface of water in the closed tank, eliminating as many of the external senses as possible.
In the UK, a medication containing magnesium sulfate and phenol, called «drawing paste», is useful for small boils or localized infections[19] and removing splinters.[20]
Internally, magnesium sulfate may be administered by oral, respiratory, or intravenous routes. Internal uses include replacement therapy for magnesium deficiency,[21] treatment of acute and severe arrhythmias,[22] as a bronchodilator in the treatment of asthma,[23] preventing eclampsia,[24] a tocolytic agent,[25] and as an anticonvulsant.[25]
It also may be used as laxative.[26]
Agriculture[edit]
In agriculture, magnesium sulfate is used to increase magnesium or sulfur content in soil. It is most commonly applied to potted plants, or to magnesium-hungry crops such as potatoes, tomatoes, carrots, peppers, lemons, and roses. The advantage of magnesium sulfate over other magnesium soil amendments (such as dolomitic lime) is its high solubility, which also allows the option of foliar feeding. Solutions of magnesium sulfate are also nearly pH neutral, compared with the slightly alkaline salts of magnesium as found in limestone; therefore, the use of magnesium sulfate as a magnesium source for soil does not significantly change the soil pH.[25] Contrary to the popular belief that magnesium sulfate is able to control pests and slugs, helps seeds germination, produce more flowers, improve nutrient uptake, and is environmentally friendly, it does none of the purported claims except for correcting magnesium deficiency in soils. Magnesium sulfate can even pollute water if used in excessive amounts.[27]
Magnesium sulfate was historically used as a treatment for lead poisoning prior to the development of chelation therapy, as it was hoped that any lead ingested would be precipitated out by the magnesium sulfate and subsequently purged from the digestive system.[28] This application saw particularly widespread use among veterinarians during the early-to-mid 20th century; Epsom salt was already available on many farms for agricultural use, and it was often prescribed in the treatment of farm animals that inadvertently ingested lead.[29][30]
Food preparation[edit]
Magnesium sulfate is used as
- Brewing salt in making beer.[31]
- coagulant for making tofu.[32]
- Salt substitute.
Chemistry[edit]
Anhydrous magnesium sulfate is commonly used as a desiccant in organic synthesis owing to its affinity for water and compatibility with most organic compounds. During work-up, an organic phase is treated with anhydrous magnesium sulfate. The hydrated solid is then removed by filtration, decantation, or by distillation (if the boiling point is low enough). Other inorganic sulfate salts such as sodium sulfate and calcium sulfate may be used in the same way.
Construction[edit]
Magnesium sulfate is used to prepare specific cements by the reaction between magnesium oxide and magnesium sulfate solution, which are of good binding ability and more resistance than Portland cement. This cement is mainly adopted in the production of lightweight insulation panels. Weakness in water resistance limits its usage.
Magnesium (or sodium) sulfate is also used for testing aggregates for soundness in accordance with ASTM C88 standard, when there are no service records of the material exposed to actual weathering conditions. The test is accomplished by repeated immersion in saturated solutions followed by oven drying to dehydrate the salt precipitated in permeable pore spaces. The internal expansive force, derived from the rehydration of the salt upon re-immersion, simulates the expansion of water on freezing.
Magnesium sulfate is also used to test the resistance of concrete to external sulfate attack (ESA).
Aquaria[edit]
Magnesium sulfate heptahydrate is also used to maintain the magnesium concentration in marine aquaria which contain large amounts of stony corals, as it is slowly depleted in their calcification process. In a magnesium-deficient marine aquarium, calcium and alkalinity concentrations are very difficult to control because not enough magnesium is present to stabilize these ions in the saltwater and prevent their spontaneous precipitation into calcium carbonate.[33]
Double salts[edit]
Double salts containing magnesium sulfate exist. There are several known as sodium magnesium sulfates and potassium magnesium sulfates. A mixed copper-magnesium sulfate heptahydrate (Mg,Cu)SO4·7H2O was recently found to occur in mine tailings and has been given the mineral name alpersite.[34]
Research[edit]
Research on topical magnesium (for example epsom salt baths) is very limited.[35][36][37] The Epsom Salt Council recommends bathing 2 or 3 times/ week, using 500-600g Epsom salts each time.[38][dubious – discuss]
See also[edit]
- Calcium sulfate
- Magnesium chloride
References[edit]
- ^ «Quick Cures/Quack Cures: Is Epsom Worth Its Salt?». The Wall Street Journal. 9 April 2012. Archived from the original on 12 April 2012. Retrieved 15 June 2019.
- ^ Industrial Inorganic Chemistry, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner, John Wiley & Sons, 2d edition, 2000, ISBN 978-3-527-61333-5
- ^ «Unnamed (Mg Sulphate)».
- ^ a b c Odochian, Lucia (1995). «Study of the nature of the crystallization water in some magnesium hydrates by thermal methods». Journal of Thermal Analysis and Calorimetry. 45 (6): 1437–1448. doi:10.1007/BF02547437. S2CID 97855885. Archived from the original on 26 August 2011. Retrieved 7 August 2010.
- ^ a b Meusburger, Johannes (15 January 2020). «Polymorphism of Mg-sulfate monohydrate kieserite under pressure and its occurrence on giant icy jovian satellites».
- ^ a b c d e A. Dominic Fortes, Frank Browning, and Ian G. Wood (2012): «Cation substitution in synthetic meridianiite (MgSO4·11H2O) I: X-ray powder diffraction analysis of quenched polycrystalline aggregates». Physics and Chemistry of Minerals, volume 39, issue, pages 419–441. doi:10.1007/s00269-012-0497-9
- ^ a b c R. C. Peterson, W. Nelson, B. Madu, and H. F. Shurvell (2007): «Meridianiite: A new mineral species observed on Earth and predicted to exist on Mars». American Mineralogist, volume 92, issue 10, pages 1756–1759. doi:10.2138/am.2007.2668
- ^ a b c d A. Dominic Fortes, Kevin S. Knight, and Ian G. Wood (2017): «Structure, thermal expansion and incompressibility of MgSO4·9H2O, its relationship to meridianiite (MgSO4·11H2O) and possible natural occurrences». Acta Crystallographica Section B: Structureal Science, Crystal Engineering and Materials, volume 73, part 1, pages 47-64. doi:10.1107/S2052520616018266
- ^ «What Is Epsom Salt And Why Is It So Important For My Cannabis Garden?». Herbies. Retrieved 28 October 2020.
- ^ a b PubChem. «Hazardous Substances Data Bank (HSDB) : 664». pubchem.ncbi.nlm.nih.gov. Retrieved 15 March 2022.
- ^ M. C. De Sanctis; E. Ammannito; A. Raponi; S. Marchi; T. B. McCord; H. Y. McSween; F. Capaccioni; M. T. Capria; F. G. Carrozzo; M. Ciarniello; A. Longobardo; F. Tosi; S. Fonte; M. Formisano; A. Frigeri; M. Giardino; G. Magni; E. Palomba; D. Turrini; F. Zambon; J.-P. Combe; W. Feldman; R. Jaumann; L. A. McFadden; C. M. Pieters (2015). «Ammoniated phyllosilicates with a likely outer Solar System origin on (1) Ceres» (PDF). Nature. 528 (7581): 241–244. Bibcode:2015Natur.528..241D. doi:10.1038/nature16172. PMID 26659184. S2CID 1687271.
- ^ «Underlying physics and mechanisms for the absorption of sound in seawater». Resource.npl.co.uk. Archived from the original on 18 June 2009. Retrieved 6 July 2009.
- ^ Michael A. Ainslie, Principles of Sonar Performance Modeling, p.18
- ^ Ingraham, Paul. «Does Epsom Salt Work? The science of Epsom salt bathing for recovery from muscle pain, soreness, or injury». Pain Science. Archived from the original on 10 September 2016. Retrieved 29 August 2016.
- ^ Eby, George A.; Eby, Karen L. (April 2010). «Magnesium for treatment-resistant depression: a review and hypothesis». Medical Hypotheses. 74 (4): 649–660. doi:10.1016/j.mehy.2009.10.051. ISSN 1532-2777. PMID 19944540.
- ^ [citation needed]
- ^ «Magnesium sulfate asthma – Search Results». PubMed. Retrieved 29 June 2021.
- ^ «Magnesium sulfate eclampsia – Search Results». PubMed. Retrieved 29 June 2021.
- ^ «Boots Magnesium Sulfate Paste B.P. — Patient Information Leaflet (PIL) — (eMC)». www.medicines.org.uk. Retrieved 14 April 2018.
- ^ «Removing a splinter with Magnesium Sulphate».
- ^ «Pharmaceutical Information – Magnesium Sulfate». RxMed. Archived from the original on 3 April 2009. Retrieved 6 July 2009.
- ^ «CPR and First Aid: Antiarrhythmic Drugs During and Immediately After Cardiac Arrest (section)». American Heart Association. Retrieved 29 August 2016.
Previous ACLS guidelines addressed the use of magnesium in cardiac arrest with polymorphic ventricular tachycardia (ie, torsades de pointes) or suspected hypomagnesemia, and this has not been reevaluated in the 2015 Guidelines Update. These previous guidelines recommended defibrillation for termination of polymorphic VT (ie, torsades de pointes), followed by consideration of intravenous magnesium sulfate when secondary to a long QT interval.
- ^ Blitz M, Blitz S, Hughes R, Diner B, Beasley R, Knopp J, Rowe BH (2005). «Aerosolized magnesium sulfate for acute asthma: a systematic review». Chest. 128 (1): 337–344. doi:10.1378/chest.128.1.337. PMID 16002955..
- ^ Duley, L; Gülmezoglu, AM; Henderson-Smart, DJ; Chou, D (10 November 2010). «Magnesium sulphate and other anticonvulsants for women with pre-eclampsia». The Cochrane Database of Systematic Reviews. 2010 (11): CD000025. doi:10.1002/14651858.CD000025.pub2. PMC 7061250. PMID 21069663.
- ^ a b c «Pubchem: Magnesium Sulfate». PubChem. Archived from the original on 29 April 2021. Retrieved 13 September 2021.
- ^ Izzo, A. A.; Gaginella, T. S.; Capasso, F. (June 1996). «The osmotic and intrinsic mechanisms of the pharmacological laxative action of oral high doses of magnesium sulphate. Importance of the release of digestive polypeptides and nitric oxide». Magnesium Research. 9 (2): 133–138. ISSN 0953-1424. PMID 8878010.
- ^ «Horticulture myths». University of Vermont Extension Department of Plant and Soil Science. Archived from the original on 7 September 2019. Retrieved 18 October 2021.
- ^ Wood, H. C. (1877). A Treatise on Therapeutics, Comprising Materia Medica and Toxicology, with Especial Reference to the Application of the Physiological Action of Drugs to Clinical Medicine. Philadelphia: J. B. Lippincott & Co. p. 34.
The treatment of acute lead-poisoning consists in the evacuation of the stomach, if necessary, the exhibition of the sulphate of sodium or of magnesium, and the meeting of the indications as they arrive. The Epsom and Glauber’s salts act as chemical antidotes, by precipitating the insoluble sulphate of lead, and also, if in excess, empty the bowel of the compound formed.
- ^ Barker, C. A. V. (January 1945). «Experience with Lead Poisoning». Canadian Journal of Comparative Medicine and Veterinary Science. 9 (1): 6–8. PMC 1660962. PMID 17648099.
Udall (1) suggests sodium citrate as of some value together with Epsom salts which will bring about a precipitation of the lead in the form of an insoluble compound. Nelson (3) reported a case that survived following the use of a 20% magnesium sulphate solution intravenously, subcutaneously and orally. McIntosh (5) has suggested that purgative doses of Epsom salts may be effective in combining with the lead and overcoming the toxicity.
- ^ Herriot, James (1972). All Creatures Great and Small. New York: St. Martin’s Press. p. 157. ISBN 0-312-08498-6.
The specific antidotes to metal poisoning had not been discovered and the only thing which sometimes did a bit of good was magnesium sulphate which caused the precipitation of insoluble lead sulphate. The homely term for magnesium sulphate is, of course, epsom salts.
- ^ «Magnesium Sulphate». National Home Brew. Archived from the original on 1 August 2016. Retrieved 4 January 2019.
- ^ US 6042851, Matsuura, Masaru; Sasaki, Masaoki & Sasakib, Jun et al., «Process for producing packed tofu», published 2000-03-28
- ^ «Do-It-Yourself Magnesium Supplements for the Reef Aquarium». Reefkeeping. 2006. Archived from the original on 22 March 2008. Retrieved 14 March 2008.
- ^ Peterson, Ronald C.; Hammarstrom, Jane M.; Seal, II, Robert R (February 2006). «Alpersite (Mg,Cu)SO4·7H2O, a new mineral of the melanterite group, and cuprian pentahydrite: Their occurrence within mine waste». American Mineralogist. 91 (2–3): 261–269. doi:10.2138/am.2006.1911. S2CID 56431885.
- ^ «Epsom Salt: Benefits, Uses, and Side Effects». Healthline. 13 December 2018.
- ^ «Magnesium Oil Benefits: Forms, Benefits, Uses, and Risks». Healthline. 25 January 2021.
- ^ Rath, Linda. «Why Take an Epsom Salts Bath?». WebMD.
- ^ (PDF) http://www.epsomsaltcouncil.org/wp-content/uploads/2015/10/report_on_absorption_of_magnesium_sulfate.pdf.
External links[edit]
- International Chemical Safety Cards—Magnesium Sulfate
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Магния сульфат
- Брутто формула
- Фармакологическая группа вещества Магния сульфат
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Магния сульфат
- Противопоказания
- Ограничения к применению
- Применение при беременности и кормлении грудью
- Побочные действия вещества Магния сульфат
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Торговые названия с действующим веществом Магния сульфат
Структурная формула
Русское название
Магния сульфат
Английское название
Magnesium sulfate
Латинское название вещества Магния сульфат
Magnesii sulfas (род. Magnesii sulfatis)
Фармакологическая группа вещества Магния сульфат
Нозологическая классификация
Список кодов МКБ-10
- O60 Преждевременные роды
- G40.9 Эпилепсия неуточненная
- I49 Другие нарушения сердечного ритма
- K94* Диагностика заболеваний ЖКТ
- K82.8.0* Дискинезия желчного пузыря и желчных путей
- T56.0 Свинца и его соединений
- E61.2 Недостаточность магния
- R33 Задержка мочи
- R25.2 Судорога и спазм
- E61.7 Недостаточность многих элементов питания
- I47.2 Желудочковая тахикардия
- O15 Эклампсия
- I10 Эссенциальная (первичная) гипертензия
- K83.0 Холангит
- T57.0 Токсическое действие мышьяка и его соединений
- K81 Холецистит
- I15 Вторичная гипертензия
- R29.0 Тетания
- F10.2 Синдром алкогольной зависимости
- T57.8 Других уточненных неорганических веществ
- Z54 Период выздоровления
- R45.7 Состояние эмоционального шока и стресса неуточненное
- K59.0 Запор
- T56.1 Ртути и ее соединений
Фармакологическое действие
—
антиаритмическое, вазодилатирующее, гипотензивное, желчегонное, противосудорожное, седативное, слабительное, спазмолитическое, токолитическое.
Характеристика
Бесцветные призматические кристаллы, выветривающиеся на воздухе. Очень легко растворимы в воде (1:1 в холодной и 3,3:1 в кипящей); практически нерастворимы в этаноле. Водные растворы имеют горько-соленый вкус.
Фармакология
Магний является физиологическим антагонистом кальция и способен вытеснять его из мест связывания. Регулирует обменные процессы, нейрохимическую передачу и мышечную возбудимость, препятствует поступлению ионов Ca2+ через пресинаптическую мембрану, снижает количество ацетилхолина в периферической нервной системе и ЦНС. Внутриклеточный дефицит Mg2+ способствует развитию желудочковых аритмий. При инъекционном введении блокирует нервно-мышечную трансмиссию (в больших дозах обладает курареподобными свойствами) и предотвращает развитие судорог, вызывает периферическую вазодилатацию, замедляет AV-проводимость и уменьшает ЧСС. При инъекциях магния сульфата в низких дозах наблюдаются только приливы и потливость, в высоких — понижение АД. Оказывает угнетающее действие на ЦНС. В зависимости от дозы может наблюдаться седативный, снотворный или общеанестезирующий эффект. Понижает возбудимость дыхательного центра, большие дозы могут вызвать паралич дыхания. Является антидотом при отравлении солями тяжелых металлов. Системные эффекты развиваются через 1 ч после в/м введения и почти мгновенно после в/в. Длительность действия при в/в введении — около 30 мин, при в/м — 3–4 ч.
При пероральном применении способствует выделению холецистокинина, раздражает рецепторы двенадцатиперстной кишки, оказывает желчегонное действие. Плохо всасывается (не более 20%), повышает осмотическое давление в ЖКТ, вызывает задержку жидкости и ее выход (по градиенту концентрации) в просвет кишечника, увеличивая перистальтику на всем его протяжении, приводит к дефекации (через 4–6 ч). Абсорбированная часть выводится почками, при этом усиливается диурез, скорость почечной экскреции пропорциональна концентрации в плазме и величине клубочковой фильтрации. Проходит через ГЭБ и плаценту, создает в молоке концентрации, в 2 раза превышающие концентрации в плазме.
Применение вещества Магния сульфат
Инъекционно: гипертонический криз (в т.ч. с явлениями отека мозга), эклампсия, энцефалопатия, гипомагниемия, в т.ч. профилактика (неполноценное или несбалансированное питание, прием контрацептивов, диуретиков, миорелаксантов, хронический алкоголизм), повышенная потребность в магнии (беременность, период роста, период выздоровления, стрессы, чрезмерная потливость), острая гипомагниемия (признаки тетании, нарушение функции миокарда), судороги при гестозе, угроза преждевременных родов; желудочковые аритмии, связанные с удлинением интервала QT; желудочковая тахикардия типа «пируэт»; возникновение аритмий на фоне низкой плазменной концентрации калия и/или магния, эпилептический синдром, задержка мочи, отравление солями тяжелых металлов (ртуть, мышьяк, свинец).
Внутрь: запор, холангит, холецистит, дискинезия желчного пузыря по гипотоническому типу (для проведения тюбажей), дуоденальное зондирование (для получения пузырной порции желчи), очищение кишечника перед диагностическими манипуляциями. Отравление солями тяжелых металлов (ртуть, мышьяк, свинец, барий).
Противопоказания
Гиперчувствительность, гипермагниемия. Для инъекционного введения (дополнительно): артериальная гипотензия, угнетение дыхательного центра, выраженная брадикардия, AV блокада, выраженная почечная недостаточность (клиренс креатинина менее 20 мл/мин), предродовый период (за 2 ч до родов).
Для назначения внутрь (дополнительно): аппендицит, ректальное кровотечение (в т.ч. предполагаемое), кишечная непроходимость, дегидратация.
Ограничения к применению
Для инъекционного введения: миастения, заболевания органов дыхания, нарушение функции почек, хроническая почечная недостаточность, острые воспалительные заболевания ЖКТ. Для назначения внутрь: блокада сердца, поражение миокарда, хроническая почечная недостаточность.
Применение при беременности и кормлении грудью
Исследований на животных с в/в применением магния сульфата не проводили. Неизвестно, может ли магния сульфат оказывать неблагоприятное эмбриональное воздействие при в/в введении беременным женщинам или влиять на репродуктивную способность. Следует использовать при беременности только в случае необходимости.
При парентеральном введении при эклампсии у беременных женщин быстро проходит через плаценту и в сыворотке плода достигает концентраций, примерно равных таковым у матери. Эффекты магния сульфата у новорожденных сходны с таковыми у матери и могут включать гипотонию, гипорефлексию, угнетение дыхания, если женщина получала магния сульфат до родоразрешения. Поэтому обычно магния сульфат не применяют в предродовый период (за 2 ч до родов), за исключением случаев, когда требуется предотвращение судорог при эклампсии. Магния сульфат можно вводить непрерывно в/в капельно со скоростью 1–2 г каждый час при условии, что проводится тщательный мониторинг плазменной концентрации магния, АД, частоты дыхания и глубоких сухожильных рефлексов.
Побочные действия вещества Магния сульфат
При инъекционном введении: признаки и симптомы гипермагниемии — брадикардия, диплопия, прилив крови к лицу, потливость, снижение АД, угнетение деятельности сердца и ЦНС, при концентрации Mg2+ в крови 2–3,5 ммоль/л — снижение глубоких сухожильных рефлексов; 2,5–5 ммоль/л — удлинение интервала PQ и расширение комплекса QRS на ЭКГ; 4–5 ммоль/л — утрата глубоких сухожильных рефлексов; 5–6,5 ммоль/л — угнетение дыхательного центра; 7,5 ммоль/л — нарушение проводимости сердца; 12,5 ммоль/л — остановка сердца. Кроме того, тревога, головная боль, слабость, атония матки, гипотермия. Сообщалось о гипокальциемии с признаками вторичной тетании при купировании эклампсии. При чрезмерно высокой плазменной концентрации магния (например при очень быстром в/в введении, при почечной недостаточности): тошнота, парестезия, рвота, полиурия.
При приеме внутрь: тошнота, рвота, диарея, обострение воспалительных заболеваний ЖКТ, нарушение электролитного баланса (повышенная утомляемость, астения, спутанность сознания, аритмия, судороги), метеоризм, абдоминальная боль спастического характера, жажда, признаки и симптомы гипермагниемии (особенно при почечной недостаточности).
Взаимодействие
Прием нефротоксичных ЛС, таких как амфотерицин В, цисплатин, циклоспорин, гентамицин, повышает потребность в магнии. Петлевые и тиазидные диуретики при длительном применении могут снижать магнийсохраняющую способность почек, что приводит к гипомагниемии (необходим мониторинг уровня магния в крови). Калийсберегающие диуретики при длительном применении повышают тубулярную реабсорбцию магния в почках, что может вызвать гипермагниемию, особенно у пациентов с почечной недостаточностью. Соли кальция (для в/в введения) нейтрализуют эффекты магния сульфата, вводимого парентерально. Однако кальция глюконат или кальция хлорид применяют для устранения токсических эффектов при гипермагниемии. Совместный прием кальцийсодержащих ЛС для перорального применения и магнийсодержащих ЛС может привести к повышению сывороточных концентраций кальция или магния у чувствительных пациентов, главным образом у пациентов с почечной недостаточностью. Депримирующее действие на ЦНС при парентеральном введении увеличивается при сочетании со средствами, угнетающими ЦНС. Сообщалось о развитии гипомагниемии у пациентов, одновременно принимающих гликозиды наперстянки, что может привести к дигиталисной интоксикации (следует мониторировать уровень магния в сыворотке крови). При одновременном пероральном использовании препараты магния могут снижать абсорбцию и концентрацию в крови гликозидов наперстянки (необходима крайняя осторожность, особенно в случаях, когда к тому же применяются в/в соли кальция; возможны нарушение сердечной проводимости и блокада сердца. Миорелаксанты усиливают нейромышечную блокаду. Снижает абсорбцию этидроновой кислоты, тетрациклинов (образует неабсорбирующиеся комплексы с пероральными тетрациклинами). При чрезмерном употреблении алкоголя или глюкозы повышается почечная экскреция магния.
Передозировка
Симптомы при парентеральном введении: исчезновение коленного рефлекса (классический клинический признак начала интоксикации), тошнота, рвота, резкое понижение АД, брадикардия, угнетение дыхания и ЦНС.
Лечение: в качестве антидота вводят в/в (медленно) препараты кальция (кальция хлорид или кальция глюконат — 5–10 мл 10%), оксигенотерапия, вдыхание карбогена, ИВЛ, перитонеальный диализ или гемодиализ, симптоматические средства (корригирующие функции ЦНС и сердечно-сосудистой системы).
Симптомы при приеме внутрь: тяжелая диарея.
Лечение: симптоматическое.
Способ применения и дозы
В/м, в/в, внутрь. В/м или в/в (медленно, первые 3 мл — в течение 3 мин) — 5–20 мл 20–25% раствора ежедневно 1–2 раза в сутки. При отравлении ртутью, мышьяком, тетраэтилсвинцом — в/в 5–10 мл 5–10% раствора. Для купирования судорог у детей в/м 20–40 мг/кг (0,1–0,2 мл/кг 20% раствора) в/м. Максимальная доза — 40 г/сут (160 ммоль/сут).
Внутрь: в качестве слабительного (на ночь или натощак) взрослым — по 10–30 г в 0,5 стакана воды, детям — из расчета 1 г на 1 год жизни; в качестве желчегонного — по 1 ст.ложке 20–25% раствора 3 раза в день, при дуоденальном зондировании вводят через зонд 50 мл 25% раствора или 100 мл 10% раствора. При отравлении растворимыми солями бария промывают желудок 1% раствором магния сульфата или дают его внутрь (20–25 г в 200 мл воды для образования нетоксичного бария сульфата). При отравлениях ртутью, мышьяком, свинцом вводят в/в (5–10 мл 5–10% раствора).
Меры предосторожности
При длительном лечении рекомендуется мониторинг АД, деятельности сердца, сухожильных рефлексов, функции почек, частоты дыхания. При необходимости одновременного в/в применения солей магния и кальция их следует вводить в разные вены.
Больные с тяжелым нарушением функции почек не должны получать более 20 г магния сульфата (81 ммоль Mg2+) в течение 48 ч, больным с олигурией или тяжелым нарушением функции почек не следует вводить магния сульфат в/в слишком быстро.
Торговые названия с действующим веществом Магния сульфат
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Магния сульфат |
от 22.00 до 189.00 |
| Магния сульфат буфус |
63.00 |
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Сульфат магния
Брутто-формула:
MgO4S
CAS# 7487-88-9
Названия
Русский:
- Сернокислый магний
- Сульфат магния(IUPAC) [Wiki]
- магний сернокислый
- магния сульфат
- эпсомская соль
English:
- Magnesium sulfate(IUPAC) [Wiki]
- magnesium sulphate
Варианты формулы:
Mg^2+O//S`|O|<_(A80,w+)O^->dO^-
Mg^2+/0O`^-# -S`|O|<||O>-O^-
Реакции, в которых участвует Сульфат магния
-
{M}O + H2{A} -> {M}{A} + H2O
, где M =
Cu Ca Mg Ba Sr Hg Mn Cr Ni Fe Zn Pb Co; A =
SO4 -
{M}(OH)2 + H2{X} = {M}{X} + 2H2O
, где M =
Mg Ca Ba Sr Cu Zn; X =
SO4 SO3 CO3 -
{M} + H2{X} -> {M}{X} + H2″|^»
, где M =
Mg Ca Ba Sr Zn Cd Fe; X =
SO4 -
MgSO4 + H2S «700^oC»—> MgO + SO2 + S + H2O
-
MgSO4 + SiO2 «680^oC»—> MgSiO3 + SO3″|^»
| Сульфат магния | |
|---|---|
| Систематическое наименование |
Сульфат магния |
| Традиционные названия | Сернокислый магний, эпсомская соль |
| Хим. формула | MgSO4 |
| Молярная масса | 120,37 г/моль |
| Плотность | 2,66 г/см³ |
| Т. плав. | 1137 °C |
| Мол. теплоёмк. | 96,40 Дж/(моль·К) |
| Энтальпия образования | -1288,8 кДж/моль |
| Растворимость в воде | 35,120; 54,880; 68,3100 г/100 мл |
| Растворимость в эфире | 1,1618 г/100 мл |
| ГОСТ | ГОСТ 4523-77 |
| Рег. номер CAS | 7487-88-9 |
| PubChem | 24083 |
| Рег. номер EINECS | 231-298-2 |
| SMILES |
[Mg+2].[O-]S([O-])(=O)=O |
| InChI |
1S/Mg.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 CSNNHWWHGAXBCP-UHFFFAOYSA-L |
| Кодекс Алиментариус | E518 |
| RTECS | OM4500000 |
| ChEBI | 32599 |
| ChemSpider | 22515 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сульфат магния — неорганическое вещество, соль металла магния и серной кислоты с формулой MgSO4, белый порошок, образует несколько кристаллогидратов. В медицине используется при лечении ожирения как солевое слабительное, для достижения так называемого магниевого стресса.
Впервые была найдена в воде эпсомского источника в Англии ботаником Неемией Грю в 1695 году.
Получение
- Взаимодействие серной кислоты и магния
Mg + H2SO4 → MgSO4 + H2
- Взаимодействием серной кислоты с оксидом, гидроксидом и карбонатом магния:
-
- MgO + H2SO4 → MgSO4 + H2O
- Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
- MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O
- Обменными реакциями:
-
- MgCO3 + (NH4)2SO4 →100oC MgSO4 + 2NH3↑ + CO2↑ + H2O
- Безводный сульфат магния получают сушкой кристаллогидрата:
-
- MgSO4 ⋅ 7H2O →200oC MgSO4 + 7H2O
- В промышленности сульфат магния получают из морской воды, минералов кизерита и карналлита.
Физические свойства
Сульфат магния — белый гигроскопичный порошок, кристаллы ромбической сингонии, параметры ячейки a = 0,482 нм, b = 0,672 нм, c = 0,833 нм. При температуре 1010 °С происходит переход в другую ромбическую фазу.
Образует несколько кристаллогидратов: MgSO4·nH2O, где n = 1, 2, 3, 4, 5, 6, 7, 12.
Наиболее изучены кристаллогидраты — MgSO4·7H2O (эпсомит), MgSO4·6H2O и MgSO 4·H2O (кизерит).
Растворим в этаноле, глицерине и диэтиловом эфире. Не растворим в ацетоне.
Входит в число основных соединений в морской воде, отвечающих за поглощение звука, при этом звуковая энергия преобразуется в тепловую. Поглощение зависит от частоты звуковых колебаний: низкочастотный звук поглощается хуже, а высокочастотный — лучше (зависимость практически линейная при логарифмическом масштабе частоты и поглощения), что объясняет большую дальность распространения низкочастотных звуковых волн.
Химические свойства
- При нагревании выше температуры плавления разлагается:
-
- 2MgSO4 →1200∘C 2MgO + 2SO2 + O2
- С концентрированной серной кислотой образует гидросульфат:
-
- MgSO4 + H2SO4 → Mg(HSO4)2
- при нагревании выпадают сольваты состава MgSO4·H2SO4 и MgSO4·3H2SO4.
- При нагревании взаимодействует с сероводородом, диоксидом кремния, углеродом:
-
- MgSO4 + H2S →700∘C MgO + SO2 + S + H2O
- MgSO4 + SiO2 →680∘C MgSiO3 + SO3
- 2MgSO4 + C →800∘C 2MgO + 2SO2 + CO2
- MgSO4 + 2C →>800∘C MgS + 2CO2
Применение
- Сульфат магния относится к многотоннажному производству, цена ≈130 USD/т.
- Магния сульфат широко применяется в медицине, обычно в виде 25 % раствора, оказывает многогранное влияние на организм. При внутривенном введении быстро снижает давление, усиливая диурез. При приёме внутрь плохо всасывается, действует как слабительное средство, также оказывает желчегонное действие, что связано с рефлексами, возникающими при раздражении нервных окончаний слизистой оболочки двенадцатиперстной кишки. При парентеральном введении сульфат магния оказывает успокаивающее действие на ЦНС. В зависимости от дозы может наблюдаться седативный, снотворный или наркотический эффект. Более подробно см. статью Сульфат магния (лекарственное средство).
- Сульфат магния применяется как добавка для устройства дорожных и аэродромных оснований и покрытий.
- Входит в состав магнезиального цемента.
- В целлюлозно-бумажной промышленности используется как наполнитель, а также как компонент, позволяющий сохранить и улучшить физико-механические показатели бумаги при использовании отбеливателей (особенно хлорсодержащих) и для получения огнестойких изделий из бумаги.
- Используется для приготовления огнестойких составов для пропитки различных материалов.
- Для производства синтетических моющих средств (например, как стабилизатор перекисных соединений).
- Широко применяется в текстильной промышленности как наполнитель материалов, утяжелитель шёлка и хлопка, протрава для покраски тканей и как отбеливающий компонент.
- В лабораторных условиях безводный сульфат магния используется для сушки растворителей.
Физические свойства
Сульфат магния MgSO4 — соль щелочного металла магния и серной кислоты. Белый, разлагается выше температуры плавления. Хорошо растворяется в воде (слабый гидролиз по катиону).
Относительная молекулярная масса Mr = 120,37; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 1137º C;
Способ получения
1. В результате взаимодействия карбоната магния и концентрированного раствора сульфата аммония при кипении образуется сульфат магния, аммиак, углекислый газ и воды:
MgCO3 + (NH4)2SO4 = MgSO4 + 2NH3↑ + CO2↑ + H2O
Качественная реакция
Качественная реакция на сульфат магния — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария, сульфат магния образует сульфат бария и хлорид магния:
MgSO4 + BaCl2 = BaSO4↓ + MgCl2
Химические свойства
1. Сульфат магния вступает в реакцию со многими сложными веществами:
1.1. Сульфат магния взаимодействует с основаниями:
1.1.1. Сульфат магния реагирует с разбавленным раствором гидроксидом натрия с образованием гидроксида магния и сульфата натрия:
MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4
1.2. Сульфат магния может реагировать с кислотами:
1.2.1. При взаимодействии с концентрированной и холодной серной кислотой твердый сульфат магния образует гидросульфат магния:
MgSO4 + H2SO4 = Mg(HSO4)2
1.3. Сульфат магния реагирует с солями:
1.3.1. Сульфат магния взаимодействует с концентрированным гидратом аммиака. При этом образуются гидроксид магния и сульфат аммония:
MgSO4 + 2(NH3 · H2O) = Mg(OH)2↓ + (NH4)2SO4
1.3.2. Сульфат магния вступает в реакцию с перхлоратами кальция, стронция и бария образуя сульфат этого металла и перхлорат магния:
MgSO4 + Ca(ClO4)2 = CaSO4 + Mg(ClO4)2
MgSO4 + Sr(ClO4)2 = SrSO4 + Mg(ClO4)2
MgSO4 + Ba(ClO4)2 = BaSO4 + Mg(ClO4)2
1.3.3. Сульфат магния вступает во взаимодействие с гидрокарбонатом калия и образует карбонат магния, сульфат калия, воду и углекислый газ:
MgSO4 + 2KHCO3 = MgCO3↓ + K2SO4 + H2O + CO2↑
1.3.4. В результате реакции между насыщенным сульфатом магния и насыщенным хроматом кальция образуется хромат магния и сульфат кальция:
MgSO4 + CaCrO4 = MgCrO4 + CaSO4↓
2. Сульфат магния разлагается при температуре выше 1200º С, образуя оксид магния, оксид серы и кислород:
2MgSO4 = 2MgO + 2SO2 + O2
| Сульфат магния | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфат магния |
| Традиционные названия | Сернокислый магния, эпсомская соль |
| Химическая формула | MgSO4 |
| Физические свойства | |
| Молярная масса | 120,37 г/моль |
| Плотность | 2,66 г/см³ |
| Термические свойства | |
| Температура плавления | 1137 °C |
| Молярная теплоёмкость (ст. усл.) | 96,40 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -1288,8 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,120; 54,880; 68,3100 г/100 мл |
| Растворимость в эфире | 1,1618 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7487-88-9 |
| SMILES | [Mg+2].[O-]S([O-])(=O)=O |
| RTECS | OM4500000 |
Сульфат магния — неорганическое вещество, соль металла магния и серной кислоты с формулой MgSO4, белый порошок, образует несколько кристаллогидратов. В медицине используется при лечении ожирения как солевое слабительное, для достижения так называемого магниевого стресса.
Впервые была найдена в эпсомском источнике в Англии.
Получение
- Взаимодействием серной кислоты с оксидом, гидроксидом и карбонатом магния:
- Обменными реакциями:
- Безводный сульфат магния получают сушкой кристаллогидрата:
- В промышленности сульфат магния получают из морской воды, минералов кизерита и карналлита.
Физические свойства
Сульфат магния — белый гигроскопичный порошок, кристаллы ромбической сингонии, параметры ячейки a = 0,482 нм, b =0,672 нм, c = 0,833 нм. При температуре 1010°С происходит переход в другую ромбическую фазу.
Образует несколько кристаллогидратов: MgSO4•nH2O, где n=1, 2, 3, 4, 5, 6, 7, 12.
Наиболее изучена кристаллогидраты MgSO4•7H2O, MgSO4•6H2O и MgSO4•H2O.
Растворим в этаноле, глицерине и диэтиловом эфире.
Химические свойства
- При нагревании выше температуры плавления разлагается:
- С концентрированной серной кислотой образует гидросульфаты:
-
- при нагревании выпадают сольваты состава MgSO4•H2SO4 и MgSO4•3H2SO4.
- При нагревании взаимодействует с сероводородом, двуокисью кремния, углеродом:
Применение
- Сульфат магния относится к многотоннажному производству, цена ≈130$/т.
- Сульфат магния применяется как добавка для устройства дорожных и аэродромных оснований и покрытий.
- Входит в состав магнезиального цемента.
- В целлюлозно-бумажной промышленности используется как наполнитель, а также как компонент позволяющий сохранить и улучшить физико-механические показатели бумаги при использовании отбеливателей (особенно хлорсодержащих) и для получения огнестойких изделий из бумаги.
- Используется для приготовления огнестойких составов для пропитки различных материалов
- Для производства синтетических моющих средств (например как стабилизатор перекисных соединений).
- Широкая область применения в текстильной промышленности как наполнитель материалов, утяжелитель шелка и хлопка, протрава для покраски тканей и как отбеливающий компонент.
См. также
- Гептагидрат сульфата магния
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5














