| Сульфат железа (III) | |
|---|---|
 |
|
| Систематическое наименование |
сульфат железа (III) |
| Традиционные названия | сернокислое железо (III), тетрасульфид (VI) железа (III) |
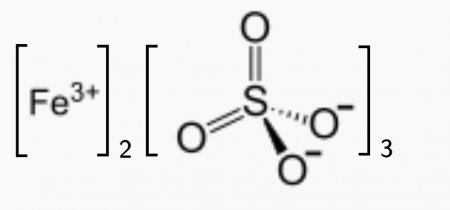
| Хим. формула | Fe2(SO4)3 |
| Рац. формула | Fe2O12S3 |
| Состояние | безводный — светло-жёлтый порошок |
| Молярная масса |
(безв.) 399.88 г/моль (пентагидрат) 489.96 г/моль |
| Плотность |
(безв.) 3.097 г/см³ (пентагидрат) 1.898 (нонагидрат) 2.1 г/см³ |
| Температура | |
| • плавления |
(безв.) 480 °C (с разл.) (нонагидрат) 175 °C |
| • разложения | 600 |
| Мол. теплоёмк. | 271,75 Дж/(моль·К) |
| Энтальпия | |
| • образования | −2580 кДж/моль |
| Растворимость | |
| • в воде | (безв.) растворим(нонагидрат) 440 г/100 мл |
| • в этаноле | (нонагидрат) растворим |
| Рег. номер CAS |
10028-22-5 15244-10-7 (для всех гидратов с формулой Fe2(SO4)3·nH2O (где n=1, 3, 4, 6, 7, 9, 10, 12) |
| PubChem | 24826 |
| Рег. номер EINECS | 233-072-9 |
| SMILES |
[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[Fe+3].[Fe+3] |
| InChI |
1S/2Fe.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 RUTXIHLAWFEWGM-UHFFFAOYSA-H |
| RTECS | NO8505000 |
| ChEBI | 53438 |
| ChemSpider | 23211 и 21493902 |
| ЛД50 | (крысы, орально) 500 мг/кг |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат железа (III) (лат. Ferrum sulfuricum oxydatum) — неорганическое химическое соединение, соль, химическая формула—Fe2(SO4)3.
Содержание
- 1 Физические свойства
- 2 Нахождение в природе
- 2.1 Марс
- 3 Получение
- 4 Химические свойства
- 5 Использование
Физические свойства
Безводный сульфат железа (III) — светло-жёлтые парамагнитные очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм, c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде, трудно растворим в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 4, 3, 1. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа (III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды). В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минералогическая форма сульфата железа (III) — микасаит (англ. mikasaite), смешанный сульфат железа-алюминия. Его химическая формула — (Fe3+, Al3+)2(SO4)3. Этот минерал содержит безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще, например:
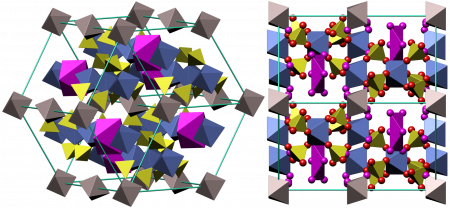
- Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
Кристаллическая структура кокимбита
- Паракокимбит (англ. paracoquimbite) — другой нонагидрат — редкая форма.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — тоже встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат (самостоятельность этого минерала под вопросом).
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Марс
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта. Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа (III) получают прокаливанием пирита или марказита с NaCl на воздухе:
- 2FeS2 + 2NaCl +
2 ⟶ Fe2(SO4)3 + Na2SO4 + Cl2
или растворяют оксид железа (III) в серной кислоте:
- Fe2O3 + 3H2SO4 ⟶ Fe2(SO4)3 + 3H2O
В лабораторной практике сульфат железа (III) можно получить из гидроокиси железа (III):
- 2Fe(OH)3 + 3H2SO4 ⟶ Fe2(SO4)3 + 6H2O
Препарат той же чистоты можно получить окислением сульфата железа (II) азотной кислотой:
- 2FeSO4 + H2SO4 + 2 HNO3 ⟶ Fe2(SO4)3 + 2NO2 + 2H2O
также окисление можно провести кислородом или оксидом серы:
- 12FeSO4 + 3O2 ⟶ 4Fe2(SO4)3 + 2Fe2O3
- 2FeSO4 + 2SO3 ⟶ Fe2(SO4)3 + SO2
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа (III):
- 2FeS + H2SO4 + 18HNO3 ⟶ Fe2(SO4)3 + 18NO2↑ + 10H2O
Дисульфид железа можно окислить концентрированной серной кислотой:
- 2FeS2 + 14H2SO4 ⟶ Fe2(SO4)3 + 15SO2↑ + 14H2O
Сульфат-аммоний железа (II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа (III), хрома (III), аммония и калия, и вода:
- 6Fe(NH4)2(SO4)2 + 7H2SO4 + K2Cr2O7 ⟶ Fe2(SO4)3 + Cr2(SO4)3 + 6(NH4)2SO4 + K2SO4 + 7H2O
Сульфат железа (III) можно получить как один из продуктов термического разложения сульфата железа (II):
- 6FeSO4 →T Fe2(SO4)3 + 2Fe2O3 + 3SO2
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа (III):
- 4K2FeO4 + 10H2SO4 → 2Fe2(SO4)3 + 3O2↑ + 4K2SO4 + 10H2O
При нагревании пентагидрата до температуры 70—175 °C получается безводный сульфат железа (III):
- Fe2(SO4)3 ⋅ 5H2O →70−175oC Fe2(SO4)3 + 5H2O
Сульфат железа (II) можно окислить триоксидом ксенона:
- XeO3 + 3H2SO4 + 6FeSO4 ⟶ 3Fe2(SO4)3 + Xe↑ + 3H2O
Химические свойства
Сульфат железа (III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
- Fe[(H2O)6]3+ + H2O ⇄ Fe[(H2O)5(OH)]2+ + H3O+ ; pK = 2,17
- Fe[(H2O)5(OH)]2+ + H2O ⇄ Fe[(H2O)4(OH)2]+ + H3O+ ; pK = 3,26
- [2Fe(H2O)6]3+ + 2H2O ⇄ [Fe2(H2O)8(OH)2]4+ + 2H3O+ ; pK = 2,91
Горячая вода или пар разлагают сульфат железа (III):
- Fe2(SO4)3 + 2H2O →100oC 2FeSO4(OH)↓ + H2SO4
Безводный сульфат железа (III) при нагревании разлагается:
- Fe2(SO4)3 →500−700oC Fe2O3 + 3SO3
- 2Fe2(SO4)3 →900−1000oC 2Fe2O3 + 6SO2 + 3O2
Растворы щелочей разлагают сульфат железа (III), продукты реакции зависят от концентрации щёлочи:
- Fe2(SO4)3 + 2NaOH ⟶ 2FeSO4(OH)↓ + Na2SO4
- Fe2(SO4)3 + 6NaOH ⟶ 2FeO(OH)↓ + 3Na2SO4 + 2H2O
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа (III) и железа (II), то в результате получится сложный оксид железа:
- Fe2(SO4)3 + FeSO4 + 8NaOH ⟶ Fe3O4↓ + 4Na2SO4 + 4H2O
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа (III):
- Fe2(SO4)3 + Fe ⟶ 3FeSO4
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа (III):
- CuS + Fe2(SO4)3 ⟶ 2FeSO4 + CuSO4 + S
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа (III) (гетерозит):
- Fe2(SO4)3 + 2NaH2PO4 ⟶ Na2SO4 + 2H2SO4 + 2FePO4↓
Использование
- Как реактив при гидрометаллургической переработке медных руд.
- Как коагулянт при очистке сточных вод, коммунальных и промышленных стоков.
- Как протрава при окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационный регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химической промышленности как окислитель и катализатор.
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
Iron(III) sulfate |
|
| Other names
Ferric sulfate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.054 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Fe2(SO4)3 |
| Molar mass | 399.88 g/mol (anhydrous) 489.96 g/mol (pentahydrate) 562.00 g/mol (nonahydrate) |
| Appearance | grayish-white crystals |
| Density | 3.097 g/cm3 (anhydrous) 1.898 g/cm3 (pentahydrate) |
| Melting point | 480 °C (896 °F; 753 K) (anhydrous) 175 °C (347 °F) (nonahydrate) |
|
Solubility in water |
256g/L (monohydrate, 293K) |
| Solubility | sparingly soluble in alcohol negligible in acetone, ethyl acetate insoluble in sulfuric acid, ammonia |
|
Refractive index (nD) |
1.814 (anhydrous) 1.552 (nonahydrate) |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
500 mg/kg (oral, rat) |
| NIOSH (US health exposure limits): | |
|
REL (Recommended) |
TWA 1 mg/m3[1] |
| Related compounds | |
|
Other anions |
Iron(III) chloride Iron(III) nitrate |
|
Related compounds |
Iron(II) sulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Iron(III) sulfate (or ferric sulfate), is a family of inorganic compounds with the formula Fe2(SO4)3(H2O)n. A variety of hydrates are known, including the most commonly encountered form of «ferric sulfate». Solutions are used in dyeing as a mordant, and as a coagulant for industrial wastes. Solutions of ferric sulfate are also used in the processing of aluminum and steel.[2][3]
Speciation[edit]
The various crystalline forms of Fe2(SO4)3(H2O)n are well-defined, often by X-ray crystallography. The nature of the aqueous solutions is often less certain, but aquo-hydroxo complexes such as [Fe(H2O)6]3+ and [Fe(H2O)5(OH)]2+ are often assumed.[4] Regardless, all such solids and solutions feature ferric ions, each with five unpaired electrons. By virtue of this high spin d5 electronic configuration, these ions are paramagnetic and are weak chromophores.
Production[edit]
Ferric sulfate solutions are usually generated from iron wastes. The actual identity of the iron species is often vague, but many applications do not demand high purity materials. It is produced on a large scale by treating sulfuric acid, a hot solution of ferrous sulfate, and an oxidizing agent. Typical oxidizing agents include chlorine, nitric acid, and hydrogen peroxide.[5]
- 2 FeSO4 + H2SO4 + H2O2 → Fe2(SO4)3 + 2 H2O
Natural occurrences[edit]
Iron sulfates occur as a variety of rare (commercially unimportant) minerals. Mikasaite, a mixed iron-aluminium sulfate of chemical formula (Fe3+, Al3+)2(SO4)3[6] is the name of mineralogical form of iron(III) sulfate. This anhydrous form occurs very rarely and is connected with coal fires. The hydrates are more common, with coquimbite[7] (nonahydrate) as probably the most often met among them. Paracoquimbite is the other, rarely encountered natural nonahydrate. Kornelite (heptahydrate) and quenstedtite (decahydrate) are rarely found. Andradite garnet is a yellow-green example found in Italy.[8] Lausenite (hexa- or pentahydrate) is a doubtful species. All the mentioned natural hydrates are unstable connected with the weathering (aerobic oxidation) of Fe-bearing primary minerals (mainly pyrite and marcasite).
Coquimbite crystal structure
See also[edit]
- Iron(II) sulfate or ferrous sulfate
- Ammonium iron(II) sulfate
- Ammonium iron(III) sulfate
References[edit]
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0346». National Institute for Occupational Safety and Health (NIOSH).
- ^ Ferric sulfate. The Columbia Encyclopedia, Sixth Edition. Retrieved November, 2007.
- ^ Wildermuth, Egon; Stark, Hans; Friedrich, Gabriele; Ebenhöch, Franz Ludwig; Kühborth, Brigitte; Silver, Jack; Rituper, Rafael (2000). «Iron Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a14_591.
- ^ Grant, M.; Jordan, R. B. (1981). «Kinetics of Solvent Water Exchange on Iron(III)». Inorganic Chemistry. 20: 55–60. doi:10.1021/ic50215a014.
- ^ Iron compounds. Encyclopædia Britannica Article. Retrieved November, 2007
- ^ Mikasaite
- ^ «Minerals Colored by Metal Ions». minerals.gps.caltech.edu. Retrieved 2023-03-01.
- ^ «Minerals Colored by Metal Ions». minerals.gps.caltech.edu. Retrieved 2023-03-01.
External links[edit]
- Material Safety Data Sheet
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
Iron(III) sulfate |
|
| Other names
Ferric sulfate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.054 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Fe2(SO4)3 |
| Molar mass | 399.88 g/mol (anhydrous) 489.96 g/mol (pentahydrate) 562.00 g/mol (nonahydrate) |
| Appearance | grayish-white crystals |
| Density | 3.097 g/cm3 (anhydrous) 1.898 g/cm3 (pentahydrate) |
| Melting point | 480 °C (896 °F; 753 K) (anhydrous) 175 °C (347 °F) (nonahydrate) |
|
Solubility in water |
256g/L (monohydrate, 293K) |
| Solubility | sparingly soluble in alcohol negligible in acetone, ethyl acetate insoluble in sulfuric acid, ammonia |
|
Refractive index (nD) |
1.814 (anhydrous) 1.552 (nonahydrate) |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
500 mg/kg (oral, rat) |
| NIOSH (US health exposure limits): | |
|
REL (Recommended) |
TWA 1 mg/m3[1] |
| Related compounds | |
|
Other anions |
Iron(III) chloride Iron(III) nitrate |
|
Related compounds |
Iron(II) sulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Iron(III) sulfate (or ferric sulfate), is a family of inorganic compounds with the formula Fe2(SO4)3(H2O)n. A variety of hydrates are known, including the most commonly encountered form of «ferric sulfate». Solutions are used in dyeing as a mordant, and as a coagulant for industrial wastes. Solutions of ferric sulfate are also used in the processing of aluminum and steel.[2][3]
Speciation[edit]
The various crystalline forms of Fe2(SO4)3(H2O)n are well-defined, often by X-ray crystallography. The nature of the aqueous solutions is often less certain, but aquo-hydroxo complexes such as [Fe(H2O)6]3+ and [Fe(H2O)5(OH)]2+ are often assumed.[4] Regardless, all such solids and solutions feature ferric ions, each with five unpaired electrons. By virtue of this high spin d5 electronic configuration, these ions are paramagnetic and are weak chromophores.
Production[edit]
Ferric sulfate solutions are usually generated from iron wastes. The actual identity of the iron species is often vague, but many applications do not demand high purity materials. It is produced on a large scale by treating sulfuric acid, a hot solution of ferrous sulfate, and an oxidizing agent. Typical oxidizing agents include chlorine, nitric acid, and hydrogen peroxide.[5]
- 2 FeSO4 + H2SO4 + H2O2 → Fe2(SO4)3 + 2 H2O
Natural occurrences[edit]
Iron sulfates occur as a variety of rare (commercially unimportant) minerals. Mikasaite, a mixed iron-aluminium sulfate of chemical formula (Fe3+, Al3+)2(SO4)3[6] is the name of mineralogical form of iron(III) sulfate. This anhydrous form occurs very rarely and is connected with coal fires. The hydrates are more common, with coquimbite[7] (nonahydrate) as probably the most often met among them. Paracoquimbite is the other, rarely encountered natural nonahydrate. Kornelite (heptahydrate) and quenstedtite (decahydrate) are rarely found. Andradite garnet is a yellow-green example found in Italy.[8] Lausenite (hexa- or pentahydrate) is a doubtful species. All the mentioned natural hydrates are unstable connected with the weathering (aerobic oxidation) of Fe-bearing primary minerals (mainly pyrite and marcasite).
Coquimbite crystal structure
See also[edit]
- Iron(II) sulfate or ferrous sulfate
- Ammonium iron(II) sulfate
- Ammonium iron(III) sulfate
References[edit]
- ^ NIOSH Pocket Guide to Chemical Hazards. «#0346». National Institute for Occupational Safety and Health (NIOSH).
- ^ Ferric sulfate. The Columbia Encyclopedia, Sixth Edition. Retrieved November, 2007.
- ^ Wildermuth, Egon; Stark, Hans; Friedrich, Gabriele; Ebenhöch, Franz Ludwig; Kühborth, Brigitte; Silver, Jack; Rituper, Rafael (2000). «Iron Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a14_591.
- ^ Grant, M.; Jordan, R. B. (1981). «Kinetics of Solvent Water Exchange on Iron(III)». Inorganic Chemistry. 20: 55–60. doi:10.1021/ic50215a014.
- ^ Iron compounds. Encyclopædia Britannica Article. Retrieved November, 2007
- ^ Mikasaite
- ^ «Minerals Colored by Metal Ions». minerals.gps.caltech.edu. Retrieved 2023-03-01.
- ^ «Minerals Colored by Metal Ions». minerals.gps.caltech.edu. Retrieved 2023-03-01.
External links[edit]
- Material Safety Data Sheet
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфат железа(III)
Брутто-формула:
Fe2O12S3
CAS# 10028-22-5
Категории:
Неорганические соли
PubChem CID: 24826
| ChemSpider ID: 23211
| CHEBI:53438
Названия
Русский:
- Сульфат железа(III)(IUPAC) [Wiki]
- сернокислое железо(III)
- тетрасульфид(VI) железа(III)
English:
- Diiron trisulfate
- Ferric persulfate
- Ferric sesquisulfate
- Ferric sulfate
- Ferric tersulfate
- Iron persulfate
- Iron sesquisulfate
- Iron tersulfate
- Iron(3+) sulfate
- Iron(III) sulfate(IUPAC) [Wiki]
- Sulfuric acid, iron(3+) salt (3:2)(CAS)
- iron(3+);trisulfate(IUPAC)
Варианты формулы:
Fe2(SO4)3
Fe(+3)2(S(+6)O(-2)4)3
$slope(45)O^-`S`/O/`O/O^-Fe^3+/0O`^-S`/O/c/O`/O^-/0Fe^3+/0O`^-S/O`/O«/O`^-
Вещества, имеющие отношение…
Анион:
Сульфаты
Химический состав
Реакции, в которых участвует Сульфат железа(III)
-
Fe2(SO4)3 + SO2 + 2H2O -> 2FeSO4 + 2H2SO4
-
Fe2(SO4)3 «500-700^oC»—> Fe2O3 + 3SO3″|^»
-
Fe2O3 + 3H2SO4 -> Fe2(SO4)3 + 3H2O
-
2FeS2 + 14H2SO4 «100^oC»—> Fe2(SO4)3 + 15SO2″|^» + 14H2O
-
2{M}(OH)3 + 3H2{X} -> {M}2({X})3 + 6H2O
, где M =
La Cr Al Ga Fe; X =
SO4
И ещё 30 реакций…
Химическое название
Железа(II) сульфат, сульфат железа (III).
Химические свойства
Двухвалентное сернокислое железо – неорганическое соединение, соль образованная серной кислотой и железом. Вещество не имеет запаха, не летуче. Безводная форма имеет вид бесцветных не прозрачных мелких гигрокопичных кристаллов. Кристаллогидраты имеют характерный зеленовато-голубой окрас, тетрагидраты зеленого цвета. Химическая формула Сульфата Железа 2: FeSO4, рацемическая: O4SFe. На вкус соединение вяжущее, с привкусом металла. Средство хорошо растворяется в воде. Молекулярная масса = 151,9 грамм на моль.
Вещество выделяется из железного купороса. Раствор сульфата Fe(2) под действием кислорода окисляется в переходит в Сульфат Железа 3. Разлагается при температуре выше 480 градусов Цельсия на оксиды.
Сульфат Железа 2 можно получить при воздействии разбавленной серной кислоты на обрезки железа; в виде побочного продукта реакции травления железных листов, при удалении окалины, при окислительном обжиге пирита.
Гидролиз Сульфата Железа 2 протекает по катиону в кислой среде. Первая ступень гидролиза: Fe2+ + SO42- + HOH ↔ FeOH+ + SO42- + H+; теоретически может протекать и вторая ступень гидролиза: FeOH+ + SO42- + HOH ↔ Fe(OH)2↓ + SO42- + H+.
Вещество применяют:
- для окраски изделий и шерстяной ткани в черный цвет, при производстве чернила, при консервировании древесины;
- в химической дозиметрии, для обработки садовых деревьев в сельском хозяйстве;
- в медицине при лечении железодефицитной анемии.
Сернокислое железо 3 или тетрасульфид 6 железа 3 – это светло-желтые парамагнитные мелкие кристаллы. Вещество хорошо растворяется в воде, медленно – в этиловом спирте. Химическая формула Сульфата Железа 3: Fe2(SО4)3, рацемическая: Fe2O12S3. Вещество обладает способностью кристаллизоваться в форме кристаллогидратов Fe2(SO4)3•n H2O. Наибольшее значение имеет нонагидрат сульфата железа(III). Водные растворы приобретают красно-коричневую окраску из-за реакции гидролиза, протекающей по катиону. Соединение разлагается под действие горячей воды и высоких температур. При 98 градусах нонагидрат превращается в тетрагидрат, при температуре выше 125 градусов – в моногидрат и выше 175 – в безводный сульфат Fe, который при температуре более 600 градусов разлагается на оксиды серы и железа.
Вещество используют:
- при переработке медной руды, для очистки сточных вод, промышленных и коммунальных стоков;
- при окраске ткани и дублении в кожевельном производстве;
- в качестве флотационного регулятора, в виде катализатора некоторых реакций или окислителя;
- в медицине в качестве кровоостанавливающего средства.
Фармакологическое действие
Противоанемическое, устраняющее железодефицит. Кровоостанавливающее (Сульфат Железа 3).
Фармакодинамика и фармакокинетика
Железо является основным микроэлементом, входящим в состав гемоглобина, миоглобина и прочих компонентов крови. Вещество принимает участие в окислительно-восстановительных реакциях, связывается и переносит молекулы кислорода по организму, стимулирует гемопоэз и эритропоэз. Сульфат Железа обеспечивает синтез всех железосодержащих метаболитов. После поступления Fe с пищей, оно усваивается в двенадцатиперстной кишке и переносится в депо тканей с помощью ферментов трансферетинов.
После приема лекарства внутрь, его активные компоненты полностью усваиваются организмом. Максимальная концентрация в крови наблюдается через 2-4 часа.
Показания к применению
Средство используют:
- для лечения и профилактики железодефицитной анемии у детей и взрослых;
- при нарушении всасывания железа из пищеварительного тракта;
- у пациентов с повышенной потребностью в железе, при беременности, кормлении грудью, во время интенсивного роста, при несбалансированном питании;
- при хроническом гастрите, сопровождающимся секреторной недостаточностью;
- на некоторых стадиях лечения B12-дефицитной анемии;
- при обострении язвы желудка и 12-перстной кишки;
- во время реабилитации после резекции желудка;
- для лечения недоношенных детей;
- для стимуляции иммунитета во время инфекционных заболеваний и при опухолях;
- при лечении пациентов с ахлоргидрией, хронической диареей, болезнью Крона, синдромом мальабсорбции.
Противопоказания
Сульфат Железа 2 противопоказан к приему:
- при аллергии на средство;
- у пациентов с нарушениями обменных процессов в организме, при гемосидерозе, гемохроматозе;
- больным с дисфункцией ЖКТ, которая препятствует всасыванию железа;
- при апластической и гемолитической анемии;
- пациентам с талассемией.
Побочные действия
Побочные реакции во время лечения Сульфатом Железа возникают не часто.
Могут проявиться:
- головокружение, головная боль, общая слабость и раздражительность, эпилептический синдром и энцефалопатия;
- чувство давления в груди, понос или запор, тошнота;
- зубная боль, боль в эпигастральной области;
- высыпания на коже, зуд, боль в горле;
- очень редко – анафилактические реакции.
Инструкция по применению (Способ и дозировка)
Лекарство назначают внутрь. Минимальная эффективная дозировка в пересчете на элементарное железо составляет 100 мг. Максимальное количество лекарства, которое можно принять – до 400 мг.
В профилактических целях назначают от 30 до 60 мг элементарного железа в сутки.
Передозировка
При передозировке усиливаются побочные реакции от приема лекарства. Возникают: диарея, тошнота, болезненные ощущения в животе, рвота, аритмия и рост ЧСС, повышается проницаемость капилляров, возможен сердечно-сосудистый коллапс. В качестве терапии промывают желудок, вводят дефероксамин для связывания ионов железа.
Взаимодействие
При сочетании с аскорбиновой кислотой улучшается всасывание препаратов железа.
Сочетанный прием сульфата и антацидных средств с магнием, алюминием, кальцием, пеницилламином и колестирамином замедляет всасывание железа.
Не рекомендуется сочетать лекарство с тетрациклиновыми антибиотиками, так как происходит взаимное снижение системной абсорбции обоих препаратов.
При сочетании лекарства с ГКС взаимно усиливается эритропоэз.
Условия хранения
Препараты хранят в сухом, темном, прохладном месте в оригинальной упаковке. Нельзя использовать лекарство после истечения срока годности.
Особые указания
Во время лечения Сульфатом Железа ii может наблюдаться окрашивание кала в черный цвет и потемнение эмали зубов.
При заболеваниях почек и печени железо может накапливаться в организме.
Особую осторожность соблюдают при лечении пациентов с язвенной болезнью желудка и 12-персной кишки, при язвенном колите и энтерите.
Вещество рекомендуется комбинировать с Фолиевой кислотой при железодефицитной анемии с дефицитом фол. к-ты.
При курсовом приеме лекарства рекомендуют периодически проводить контроль гемоглобина и уровня сывороточного железа.
При беременности и лактации
Лекарство можно использовать во время кормления грудью и при беременности по показаниям.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Железа закисного сульфат является активным компонентом следующих препаратов: Ферроградумет, Ферроплекс, Тардиферон, Гемофер пролонгатум, Сорбифер Дурулес, Актиферрин, Витатресс, Гематоген С, Олиговит и так далее.
Отзывы
Некоторые отзывы о применении препаратов Сульфата Железа:
- “… Лекарство назначила врач на 7 месяце беременности, так как сильно упал гемоглобин. Сказала, что питанием его уже в норму не привести и сказала пить это лекарство. Побочных действий у меня от таблеток не было, только кал окрашивался в черный цвет, но это меня не беспокоило”;
- “… От приема этого лекарства у меня был сильный запор, иногда тошнило после приема таблетки, но я терпела. В целом, мне препарат очень помог, гемоглобин через месяц нормализовался”;
- “… Три месяца с помощью этого препарата лечила железодефицитную анемию. Анализы были в норме уже после первых 4 недель применения. Хорошее лекарство”.
Цена Сульфата Железа, где купить
Цена на лекарство варьирует в зависимости от производителя и лек. формы. Купить Сульфат Железа можно в любой аптеке. Например, стоимость таблеток пролонгированного действия Тардиферон составляет порядка 200 рублей за 30 штук.
- Справочник
- Справочник структурных формул
- с
- Сульфат железа(III)
Сульфат железа(III)
Fe2(SO4)3
Fe(+3)2(S(+6)O(-2)4)3
$slope(45)O^-`S`/O/`O/O^-Fe^++/0O`^-S`/O/c/O`/O^-/0Fe^++/0O`^-S/O`/O«/O`^-
Брутто-формула: Fe2O12S3
Молекулярная масса: 399.878
Химический состав
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Fe | Железо (Iron) | 55.849 | 2 | 27.9% |
| O | Кислород (Oxygen) | 15.999 | 12 | 48% |
| S | Сера (Sulfur) | 32.064 | 3 | 24.1% |
Синонимы
- Сульфат железа(III)(IUPAC)
- сернокислое железо(III)
- тетрасульфид(VI) железа(III)
- Diiron trisulfate
- Ferric persulfate
- Ferric sesquisulfate
- Ferric sulfate
- Ferric tersulfate
- Iron persulfate
- Iron sesquisulfate
- Iron tersulfate
- Iron(3+) sulfate
- Iron(III) sulfate(IUPAC)
- Sulfuric acid, iron(3+) salt (3:2)(CAS)
- iron(3+);trisulfate(IUPAC)
Входит в группы
Неорганические соли
Сульфат железа (III) — Iron(III) sulfate
 |
|
| Имена | |
|---|---|
| Название ИЮПАК
Сульфат железа (III) |
|
| Другие имена
Сульфат железа |
|
| Идентификаторы | |
|
Количество CAS |
|
|
3D модель (JSmol ) |
|
| ЧЭБИ |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.054 |
|
PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
|
Панель управления CompTox (EPA) |
|
|
ИнЧИ
|
|
|
Улыбки
|
|
| Свойства | |
|
Химическая формула |
Fe2(ТАК4)3 |
| Молярная масса | 399,88 г / моль (безводный) 489,96 г / моль (пентагидрат) 562,00 г / моль (нонагидрат) |
| Внешность | серовато-белые кристаллы |
| Плотность | 3,097 г / см3 (безводный) 1,898 г / см3 (пентагидрат) |
| Температура плавления | 480 ° С (896 ° F, 753 К) (безводный) 175 ° C (347 ° F) (нонагидрат) |
|
Растворимость в воде |
256г / дм3 (моногидрат, 293 К) |
| Растворимость | умеренно растворим в алкоголь незначительный в ацетон, этилацетат не растворим в серная кислота, аммиак |
|
Показатель преломления (пD) |
1,814 (безводный) 1,552 (нонагидрат) |
| Опасности | |
| NFPA 704 (огненный алмаз) |
0 1 0 |
| Смертельная доза или концентрация (LD, LC): | |
|
LD50 (средняя доза ) |
500 мг / кг (перорально, крыса) |
| NIOSH (Пределы воздействия на здоровье в США): | |
|
REL (Рекомендуемые) |
TWA 1 мг / м3[1] |
| Родственные соединения | |
|
Другой анионы |
Хлорид железа (III) Нитрат железа (III) |
|
Родственные соединения |
Сульфат железа (II) |
|
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). |
|
| Ссылки на инфобоксы | |
Сульфат железа (III) (или сульфат железа), это химическое соединение с формулой Fe2(ТАК4)3. Обычно желтый, это соль, растворимая в воде. Также известны различные гидраты. Растворы используются при крашении как едкий, и как коагулянт для промышленных отходов. Он также используется в пигментах и в ваннах для травления алюминия и стали.[2][3]
Производство
Обычно сульфат трехвалентного железа используется в виде раствора, образующегося из отходов железа. Фактический вид неясен, но его применение не требует материалов высокой чистоты.
Сульфат железа (III) часто образуется в виде раствора, а не выделяется в виде твердого вещества. Он производится в больших масштабах путем обработки серной кислоты, горячего раствора сульфат железа, и окислитель. Типичные окислители включают: хлор, азотная кислота и пероксид водорода.[4]
- 2 FeSO4 + H2ТАК4 + H2О2 → Fe2(ТАК4)3 + 2 часа2О
Природные явления
Микасайте, смешанный сульфат железа и алюминия химической формулы (Fe3+, Al3+)2(ТАК4)3[5] — это название минералогической формы сульфата железа (III). Эта безводная форма встречается очень редко и связана с угольными пожарами. Гидраты встречаются чаще, с кокимбит (нонагидрат), как, вероятно, наиболее часто встречающийся среди них. Паракокимбит другой, редко встречающийся природный нонагидрат. Корнелит (гептагидрат) и Quenstedtite (декагидрат) встречаются редко. Лаузенит (гекса- или пентагидрат) — сомнительный вид. Все указанные природные гидраты представляют собой нестабильные соединения, связанные с железистыми первичными минералами (в основном пирит и марказит ) окисление в рудных пластах. В растворах зон окисления рудных пластов сульфат железа (III) также играет важную роль. окислитель.
Кристаллическая структура кокимбита
Смотрите также
- Сульфат железа (II)
- Сульфат железа (II) аммония
- Сульфат железа (III) аммония
использованная литература
- ^ Карманный справочник NIOSH по химической опасности. «#0346». Национальный институт охраны труда и здоровья (NIOSH).
- ^ Сульфат железа. Энциклопедия Колумбии, шестое издание. Проверено ноябрь 2007 года.
- ^ Вильдермут, Эгон; Старк, Ганс; Фридрих, Габриэле; Эбенхох, Франц Людвиг; Кюборт, Бриджит; Сильвер, Джек; Ритупер, Рафаэль (2000). «Соединения железа». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a14_591.
- ^ Соединения железа. Encyclopdia Britannica Article. Проверено ноябрь 2007 г.
- ^ Микасайте
внешние ссылки
- Паспорт безопасности материала

 2 ⟶ Fe2(SO4)3 + Na2SO4 + Cl2
2 ⟶ Fe2(SO4)3 + Na2SO4 + Cl2
