Одна из самых первых минеральных кислот, которая стала известна человеку, — это серная, или сульфатная. Не только сама она, но и многие ее соли использовались в строительстве, медицине, пищевой промышленности, в технических целях. До сих пор в этом отношении ничего не изменилось. Ряд характеристик, которыми обладает сульфатная кислота, делают ее просто незаменимой в химических синтезах. Кроме этого, практически во всех отраслях быта и промышленности находят применение ее соли. Поэтому подробно рассмотрим, что она собой представляет и в чем заключаются особенности проявляемых свойств.
Разнообразие названий
Начнем с того, что названий у этого вещества немало. Среди них есть и те, что образуются по рациональной номенклатуре, и те, которые исторически сложились. Итак, это соединение обозначают как:
- сульфатная кислота;
- купоросное масло;
- серная кислота;
- олеум.
Хотя термин «олеум» не совсем подходит для данного вещества, поскольку является смесью серной кислоты и высшего оксида серы — SO3.
Сульфатная кислота: формула и строение молекулы
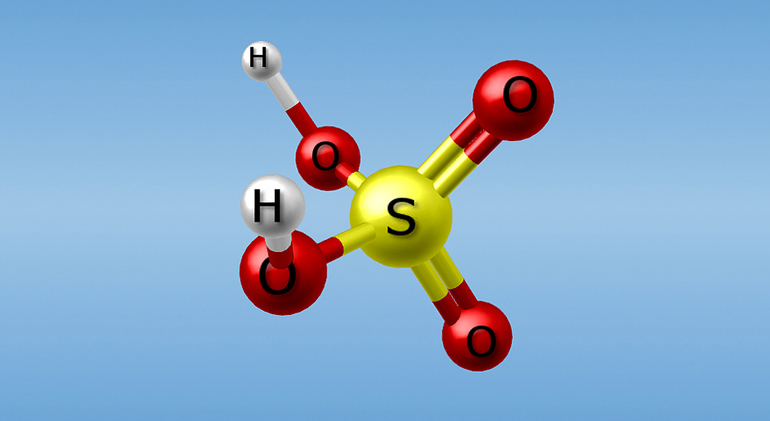
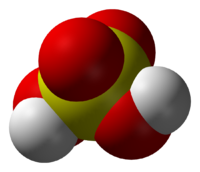
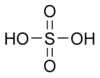
С точки зрения химической аббревиатуры записать формулу данной кислоты можно так: H2SO4. Очевидно, что молекула состоит из двух катионов водорода и аниона кислотного остатка — сульфат-иона, имеющего заряд 2+.
При этом внутри молекулы действуют следующие связи:
- ковалентная полярная между серой и кислородами;
- ковалентная сильно полярная между водородом и кислотным остатком SO4.
Сера, имея 6 неспаренных электронов, образует две двойные связи с двумя атомами кислорода. Еще с парой — одинарные, а те, в свою очередь, — одинарные с водородами. В результате строение молекулы позволяет быть ей достаточно прочной. В то же время катион водорода очень подвижен и легко уходит, ведь сера и кислород гораздо больше по электроотрицательности. Стягивая электронную плотность на себя, они предоставляют водороду частично положительный заряд, который при отсоединении становится полным. Так формируются кислые растворы, в которых находится Н+.
Если говорить о степенях окисления элементов в соединении, то сульфатная кислота, формула которой H2SO4, легко позволяет рассчитать их: у водорода +1, у кислорода -2, у серы +6.
Как и в любой молекуле, суммарный заряд равен нулю.
История открытия
Сульфатная кислота известна людям с самой древности. Еще алхимики умели получать ее методами прокаливания разных купоросов. С самого IX века люди получали и использовали это вещество. Позже в Европе Альберт Магнус научился извлекать кислоту в процессе разложения железного купороса.
Однако ни один из способов выгодным не был. Затем стал известен так называемый камерный вариант синтеза. Для этого сжигали серу и селитру, а выделяющиеся пары поглощали водой. В результате формировалась сульфатная кислота.
Еще позже англичане сумели найти самый дешевый метод получения данного вещества. Для этого использовался пирит — FeS2, железный колчедан. Его обжиг и последующее взаимодействие с кислородом до сих пор составляют один из самых главных промышленных способов синтеза серной кислоты. Такое сырье более доступное, дешевое и качественное для больших объемов производства.
Физические свойства
Есть несколько параметров, в том числе и наружные, по которым отличается от других сульфатная кислота. Физические свойства ее можно описать в нескольких пунктах:
- При стандартных условиях — жидкость.
- В концентрированном состоянии является тяжелой, маслянистой, за что и получила название «купоросное масло».
- Плотность вещества — 1,84 г/см3.
- Не имеет цвета и запаха.
- Обладает выраженным «медным» вкусом.
- Растворяется в воде очень хорошо, практически неограниченно.
- Гигроскопична, способна улавливать как свободную, так и связанную воду из тканей.
- Нелетучая.
- Температура кипения — 296оС.
- Плавление при 10,3оС.
Одна из важнейших особенностей данного соединения заключается в способности гидратироваться с выделением большого количества теплоты. Именно поэтому еще со школьной скамьи детям внушается, что добавлять воду к кислоте ни в коем случае нельзя, а только наоборот. Ведь по плотности вода легче, поэтому будет скапливаться на поверхности. Если резко добавить ее к кислоте, то в результате реакции растворения выделится настолько большое количество энергии, что вода вскипит и начнет разбрызгиваться вместе с частицами опасного вещества. Это может вызвать сильные химические ожоги кожи рук.
Поэтому следует тоненькой струйкой вливать кислоту в воду, тогда смесь сильно нагреется, но вскипания не произойдет, а значит, разбрызгивания жидкости тоже.
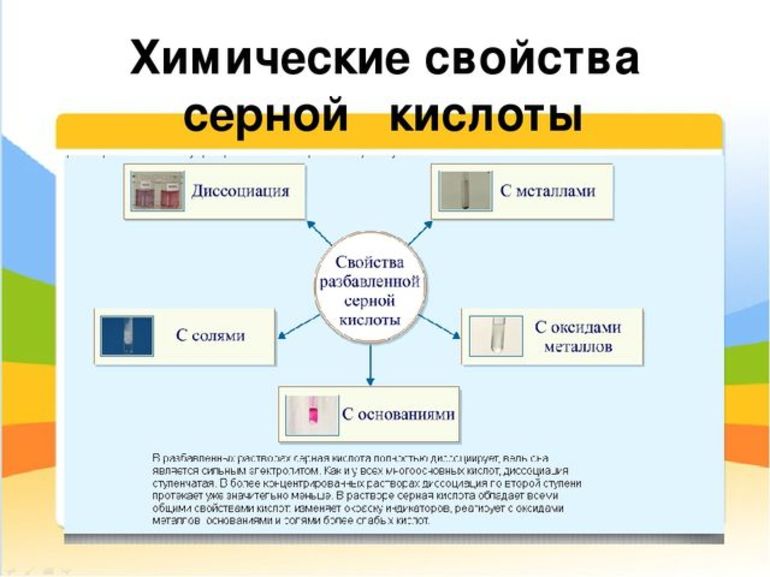
Химические свойства
С точки зрения химии данная кислота является очень сильной, особенно если это концентрированный раствор. Она двухосновная, поэтому диссоциирует ступенчато, с образованием гидросульфат- и сульфат-аниона.
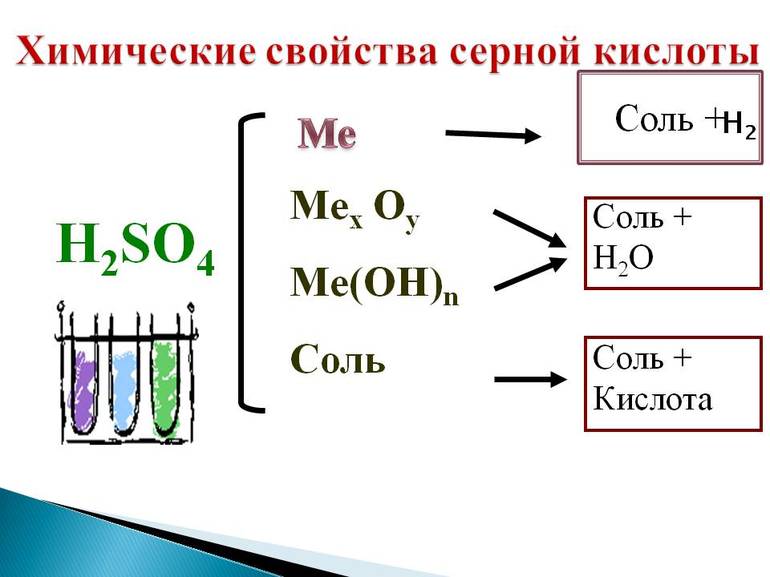
В целом ее взаимодействие с различными соединениями соответствует всем основным реакциям, характерным для этого класса веществ. Можно привести примеры нескольких уравнений, в которых принимает участие сульфатная кислота. Химические свойства проявляются в ее взаимодействии с:
- солями;
- оксидами и гидроксидами металлов;
- амфотерными оксидами и гидроксидами;
- металлами, стоящими в ряду напряжений до водорода.
В результате подобных взаимодействий практически во всех случаях образуются средние соли данной кислоты (сульфаты) либо кислые (гидросульфаты).
Особенной чертой также является то, что с металлами по обычной схеме Me + H2SO4 = MeSO4 + H2↑ реагирует лишь раствор данного вещества, то есть разбавленная кислота. Если же взять концентрированный или сильно насыщенный (олеум), то продукты взаимодействия будут совсем иными.
Особые свойства серной кислоты
К таковым относится как раз взаимодействие концентрированных растворов с металлами. Так, существует определенная схема, отражающая весь принцип таких реакций:
- Если металл активный, то в результате происходит образование сероводорода, соли и воды. То есть сера восстанавливается до -2.
- Если металл средней активности, то в результате — сера, соль и вода. То есть восстановление сульфат-иона до свободной серы.
- Металлы низкой химической активности (после водорода) — сернистый газ, соль и вода. Сера в степени окисления +4.
Также особыми свойствами сульфатной кислоты являются способности окислять некоторые неметаллы до их высшей степени окисления и вступать в реакции со сложными соединениями и окислять их до простых веществ.
Способы получения в промышленности
Сульфатный процесс получения серной кислоты складывается из двух основных типов:
- контактный;
- башенный.
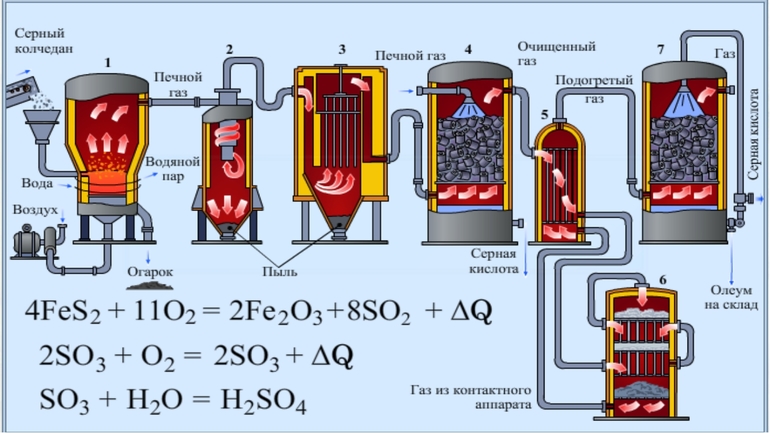
Оба являются самыми распространенными способами в промышленности во всех странах мира. Первый вариант основан на использовании в качестве сырья железного колчедана или серного пирита — FeS2. Всего выделяют три этапа:
- Обжиг сырья с образованием в качестве продукта горения сернистого газа.
- Пропускание этого газа через кислород над ванадиевым катализатором с образованием серного ангидрида — SO3.
- В поглотительной башне осуществляется растворение ангидрида в растворе сульфатной кислоты с формированием раствора высокой концентрации — олеума. Очень тяжелая маслянистая густая жидкость.
Второй вариант — это практически то же самое, но в качестве катализатора используются оксиды азота. С точки зрения таких параметров, как качество продукции, стоимость и энергозатраты, чистота сырья, производительность, первый способ более эффективен и приемлем, поэтому чаще используется именно он.
Синтез в лаборатории
Если необходимо получить серную кислоту в небольших количествах для лабораторных исследований, то лучше всего подходит способ взаимодействия сероводорода с сульфатами малоактивных металлов.
В этих случаях происходит образование черных сульфидов металлов, и как побочный продукт образуется серная кислота. Для небольших исследований такой вариант подходит, однако чистотой такая кислота отличаться не будет.
Также в лаборатории можно провести качественную реакцию на сульфатные растворы. Самым распространенным реактивом является хлорид бария, так как ион Ва2+ вместе с сульфат-анионом выпадает в белый осадок — баритовое молоко: H2SO4 + BaCL2 = 2HCL + BaSO4↓
Самые распространенные соли
Сульфатная кислота и сульфаты, которые она образует, являются важными соединениями во многих отраслях промышленности и быта, в том числе и пищевой. Самыми распространенными солями серной кислоты являются следующие:
- Гипс (алебастр, селенит). Химическое название — водный кристаллогидрат сульфата кальция. Формула: CaSO4. Используется в строительстве, медицине, целлюлозно-бумажной промышленности, изготовлении ювелирных изделий.
- Барит (тяжелый шпат). Сульфат бария. В растворе представляет собой молочный осадок. В твердом виде — прозрачные кристаллы. Используется в оптических приборах, рентгеновских излучениях, для изготовления изолирующего покрытия.
- Мирабилит (глауберова соль). Химическое название — кристаллогидрат сульфата натрия десятиводный. Формула: Na2SO4*10H2O. Применяется в медицине как слабительное средство.
Можно привести в качестве примеров много солей, которые имеют практическую значимость. Однако упомянутые выше — самые распространенные.
Сульфатный щелок
Данное вещество представляет собой раствор, который образуется вследствие термической обработки древесины, то есть целлюлозы. Главное назначение этого соединения — получение на его основе сульфатного мыла методом отстаивания. Химический состав сульфатного щелока следующий:
- лигнин;
- гидроксикислоты;
- моносахариды;
- фенолы;
- смолы;
- летучие и жирные кислоты;
- сульфиды, хлориды, карбонаты и сульфаты натрия.
Существуют два основных вида данного вещества: белый и черный сульфатный щелок. Белый уходит на целлюлозно-бумажное производство, а черный используется для получения сульфатного мыла в промышленности.
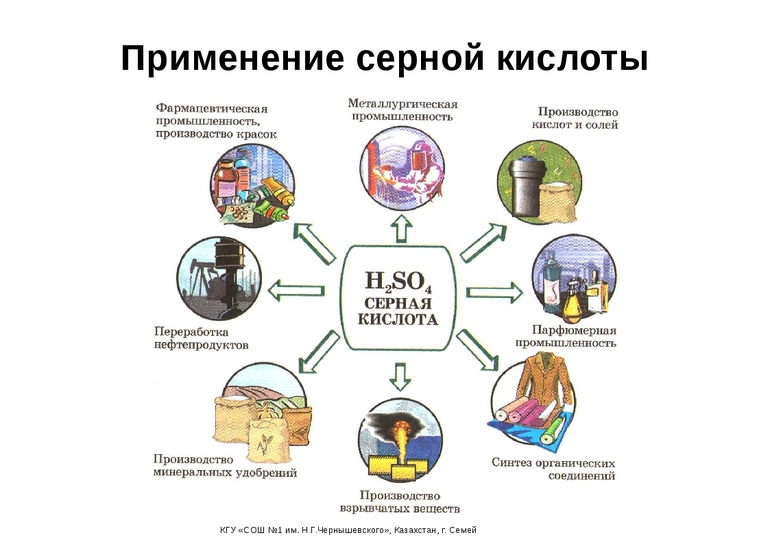
Основные области применения
Ежегодное производство серной кислоты составляет 160 млн. тонн в год. Это очень значительная цифра, которая говорит о важности и распространенности данного соединения. Можно выделить несколько отраслей и мест, где необходимо использование сульфатной кислоты:
- В аккумуляторах в качестве электролита, особенно в свинцовых.
- На заводах, где производятся сульфатные удобрения. Основная масса данной кислоты идет именно на изготовление минеральных подкормок для растений. Поэтому заводы по производству серной кислоты и изготовлению удобрений чаще всего строят рядом.
- В пищевой промышленности в качестве эмульгатора, обозначаемого кодом Е513.
- В многочисленных органических синтезах в качестве водоотнимающего средства, катализатора. Так получают взрывчатые вещества, смолы, чистящие и моющие средства, капроны, полипропилен и этилен, красители, химические волокна, сложные эфиры и прочие соединения.
- Используют в фильтрах для очистки воды и изготовления дистиллированной воды.
- Применяют при добыче и обработке редких элементов из руды.
Также много серной кислоты уходит на лабораторные исследования, где ее получают местными способами.
| Серная кислота | |
 |
|
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | серная кислота |
| Химическая формула | H2SO4 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 98,082 а. е. м. |
| Молярная масса | 98,082 г/моль |
| Плотность | 1,8356 г/см³ |
| Термические свойства | |
| Температура плавления | -10,38 °C |
| Температура кипения | 279,6 °C |
| Температура воспламенения | не воспламеняется °C |
| Удельная теплота плавления | 10,73 Дж/кг |
| Химические свойства | |
| pKa | -3 |
| Растворимость в воде | смешивается г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1.397 |
| Структура | |
| Дипольный момент | 2.72 Д |
| Классификация | |
| Рег. номер CAS | 7664-93-9 |
| Регистрационный номер EC | 231-639-5 |
| RTECS | WS5600000 |
| Безопасность | |
| ЛД50 | 510 мг/кг |
| Токсичность |
0 3 2
|
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум).
Содержание
- 1 Название
- 2 Физические и физико-химические свойства
- 2.1 Олеум
- 3 Химические свойства
- 4 Применение
- 5 Токсическое действие
- 6 Исторические сведения
- 7 Дополнительные сведения
- 8 Получение серной кислоты
- 9 Стандарты
- 10 Примечания
- 11 Литература
- 12 Ссылки
Название
До XX века часто серную кислоту называли купоросом (как правило это был кристаллогидрат, по консистенции напоминающий масло) или купоросным маслом, очевидно отсюда происхождение названия ее солей (а точнее именно кристаллогидратов) — купоросы.
Физические и физико-химические свойства
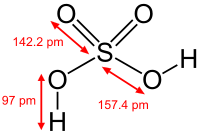
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H+, HSO4−, и SO₄2−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме, общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
Уравнение температурной зависимости константы равновесия:
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO³ увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H₂SO₄·SO₃, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO₃ и 92 % H₂SO₄ и максимально при концентрации 84 и 99,8 % H₂SO₄[источник не указан 395 дней]. Для олеума минимальное ρ при концентрации 10 % SO₃. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства
Серная кислота — сильный окислитель, особенно при нагревании и в концентрированном виде; окисляет HI и частично HBr до свободных галогенов, углерод до CO2, S — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S и H2S. Концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
Применение
Серную кислоту применяют:
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
- Для восстановления смол в фильтрах на производстве дистилированной воды.
Мировое производство серной кислоты ок. 160 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
Исторические сведения
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озер вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. И только в середине 18 столетия, когда было установлено, что свинец не растворяется в серной кислоте, от стеклянной лабораторной посуды перешли к большим промышленным свинцовым камерам.
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[1]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3·107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994 [2].
Получение серной кислоты
Стандарты
- Кислота серная техническая ГОСТ 2184—77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667—73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262—78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204—77
Примечания
- ↑ см. статью «Вулканы и климат» (рус.)
- ↑ Русский архипелаг — Виновато ли человечество в глобальном изменении климата? (рус.)
Литература
- Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971
Ссылки
- Статья «Серная кислота» (Химическая энциклопедия)
- Плотность и значение pH серной кислоты при t=20 °C
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Сульфаты |
|---|
|
Алюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[Fe][SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • Сульфат актиния(III) (Ac2(SO4)3) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюмонатрия (NaAl(SO4)2) • Сульфат аммония ((NH4)2SO4) • Сульфат бария (BaSO4) • Сульфат бериллия (BeSO4) • Сульфат ванадила (VOSO4) • Сульфат ванадия(III) (V2(SO4)3) • Сульфат висмута (Bi2(SO4)3) • Сульфат гидроксиаммония ((NH3OH)2SO4) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат индия(III) (In2(SO4)3) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфат кадмия (CdSO4) • Сульфат калия (K2SO4) • Сульфат кальция (CaSO4) • Сульфат кобальта(II) (CoSO4) • Сульфат кобальта(III) (Co2(SO4)3) • Сульфат лития (Li2SO4) • Сульфат магния (MgSO4) • Сульфат марганца(II) (MnSO4) • Сульфат марганца(III) (Mn2(SO4)3) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфат натрия (Na2SO4) • Сульфат никеля(II) (NiSO4) • Сульфат олова(II) (SnSO4) • Сульфат празеодима (Pr2(SO4)3) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфат свинца(II) (PbSO4) • Сульфат серебра (Ag2SO4) • Сульфат стронция (SrSO4) • Сульфат сурьмы (Sb2(SO4)3) • Сульфат таллия(I) (Tl2SO4) • Сульфат таллия(III) (Tl2(SO4)3) • Сульфат тетраамина меди (Cu(NH3)4SO4) • Сульфат титана(III) (Ti2(SO4)3) • Сульфат титана(IV) (Ti(SO4)2) • Сульфат урана (U(SO4)2) • Сульфат уранила (UO2SO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфат цезия (Cs2SO4) • Сульфат церия(IV) (Ce(SO4)2) • Сульфат цинка (ZnSO4) • Сульфат циркония (Zr(SO4)2) |
Оксид серы(VI)
Oксид серы((VI)) образуется при каталитическом окислении сернистого газа:
При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
Эта реакция протекает даже с парами воды. Поэтому оксид серы((VI)) дымит на воздухе.
Особенностью оксида серы((VI)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
Оксид серы((VI)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
Степень окисления серы в этом оксиде — (+6). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота
H2SO4
— важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Рис. (1). Смешивание серной кислоты с водой
Серная кислота очень гигроскопична и используется для осушки разных веществ.
Химические свойства серной кислоты зависят от её концентрации.
Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
;
- с солями, если образуется газ или нерастворимое вещество:
,
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
.
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):
Рис. (2). Обугливание сахара концентрированной серной кислотой
Серная кислота образует два ряда солей. Средние соли называются сульфатами (
Na2SO4,CaSO4
), а кислые — гидросульфатами (
NaHSO4,Ca(HSO4)2
).
Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.
Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.
Соли серной кислоты также находят применение. Медный купорос
CuSO4⋅5H2O
используется для борьбы с заболеваниями растений, гипс
CaSO4⋅2H2O
применяется в строительстве, сульфат бария
BaSO4
— в медицине.
Источники:
Рис. 1. Смешивание серной кислоты с водой © ЯКласс
Рис. 2. Обугливание сахара концентрированной серной кислотой © ЯКласс
Одна из самых первых минеральных кислот, которая стала известна человеку, — это серная, или сульфатная. Не только сама она, но и многие ее соли использовались в строительстве, медицине, пищевой промышленности, в технических целях. До сих пор в этом отношении ничего не изменилось. Ряд характеристик, которыми обладает сульфатная кислота, делают ее просто незаменимой в химических синтезах. Кроме этого, практически во всех отраслях быта и промышленности находят применение ее соли. Поэтому подробно рассмотрим, что она собой представляет и в чем заключаются особенности проявляемых свойств.
Разнообразие названий
Начнем с того, что названий у этого вещества немало. Среди них есть и те, что образуются по рациональной номенклатуре, и те, которые исторически сложились. Итак, это соединение обозначают как:
Особенности серной кислоты, ее хранение и транспортировка. Основные области применения вещества….
- сульфатная кислота;
- купоросное масло;
- серная кислота;
- олеум.
Хотя термин «олеум» не совсем подходит для данного вещества, поскольку является смесью серной кислоты и высшего оксида серы — SO3.
Сульфатная кислота: формула и строение молекулы
С точки зрения химической аббревиатуры записать формулу данной кислоты можно так: H2SO4. Очевидно, что молекула состоит из двух катионов водорода и аниона кислотного остатка — сульфат-иона, имеющего заряд 2+.
При этом внутри молекулы действуют следующие связи:
- ковалентная полярная между серой и кислородами;
- ковалентная сильно полярная между водородом и кислотным остатком SO4.
Сера, имея 6 неспаренных электронов, образует две двойные связи с двумя атомами кислорода. Еще с парой — одинарные, а те, в свою очередь, — одинарные с водородами. В результате строение молекулы позволяет быть ей достаточно прочной. В то же время катион водорода очень подвижен и легко уходит, ведь сера и кислород гораздо больше по электроотрицательности. Стягивая электронную плотность на себя, они предоставляют водороду частично положительный заряд, который при отсоединении становится полным. Так формируются кислые растворы, в которых находится Н+.
Попробуем выяснить, что представляют собой сильные окислители, как их можно использовать. Приведем…
Если говорить о степенях окисления элементов в соединении, то сульфатная кислота, формула которой H2SO4, легко позволяет рассчитать их: у водорода +1, у кислорода -2, у серы +6.
Как и в любой молекуле, суммарный заряд равен нулю.
История открытия
Сульфатная кислота известна людям с самой древности. Еще алхимики умели получать ее методами прокаливания разных купоросов. С самого IX века люди получали и использовали это вещество. Позже в Европе Альберт Магнус научился извлекать кислоту в процессе разложения железного купороса.
Однако ни один из способов выгодным не был. Затем стал известен так называемый камерный вариант синтеза. Для этого сжигали серу и селитру, а выделяющиеся пары поглощали водой. В результате формировалась сульфатная кислота.
Еще позже англичане сумели найти самый дешевый метод получения данного вещества. Для этого использовался пирит — FeS2, железный колчедан. Его обжиг и последующее взаимодействие с кислородом до сих пор составляют один из самых главных промышленных способов синтеза серной кислоты. Такое сырье более доступное, дешевое и качественное для больших объемов производства.
Великое множество реакций, в которые могут вступать неорганические соединения, пугающе действует на…
Физические свойства
Есть несколько параметров, в том числе и наружные, по которым отличается от других сульфатная кислота. Физические свойства ее можно описать в нескольких пунктах:
- При стандартных условиях — жидкость.
- В концентрированном состоянии является тяжелой, маслянистой, за что и получила название «купоросное масло».
- Плотность вещества — 1,84 г/см3.
- Не имеет цвета и запаха.
- Обладает выраженным «медным» вкусом.
- Растворяется в воде очень хорошо, практически неограниченно.
- Гигроскопична, способна улавливать как свободную, так и связанную воду из тканей.
- Нелетучая.
- Температура кипения — 296оС.
- Плавление при 10,3оС.
Одна из важнейших особенностей данного соединения заключается в способности гидратироваться с выделением большого количества теплоты. Именно поэтому еще со школьной скамьи детям внушается, что добавлять воду к кислоте ни в коем случае нельзя, а только наоборот. Ведь по плотности вода легче, поэтому будет скапливаться на поверхности. Если резко добавить ее к кислоте, то в результате реакции растворения выделится настолько большое количество энергии, что вода вскипит и начнет разбрызгиваться вместе с частицами опасного вещества. Это может вызвать сильные химические ожоги кожи рук.
Поэтому следует тоненькой струйкой вливать кислоту в воду, тогда смесь сильно нагреется, но вскипания не произойдет, а значит, разбрызгивания жидкости тоже.
Химические свойства
С точки зрения химии данная кислота является очень сильной, особенно если это концентрированный раствор. Она двухосновная, поэтому диссоциирует ступенчато, с образованием гидросульфат- и сульфат-аниона.
В целом ее взаимодействие с различными соединениями соответствует всем основным реакциям, характерным для этого класса веществ. Можно привести примеры нескольких уравнений, в которых принимает участие сульфатная кислота. Химические свойства проявляются в ее взаимодействии с:
- солями;
- оксидами и гидроксидами металлов;
- амфотерными оксидами и гидроксидами;
- металлами, стоящими в ряду напряжений до водорода.
В результате подобных взаимодействий практически во всех случаях образуются средние соли данной кислоты (сульфаты) либо кислые (гидросульфаты).
Особенной чертой также является то, что с металлами по обычной схеме Me + H2SO4 = MeSO4 + H2↑ реагирует лишь раствор данного вещества, то есть разбавленная кислота. Если же взять концентрированный или сильно насыщенный (олеум), то продукты взаимодействия будут совсем иными.
Особые свойства серной кислоты
К таковым относится как раз взаимодействие концентрированных растворов с металлами. Так, существует определенная схема, отражающая весь принцип таких реакций:
- Если металл активный, то в результате происходит образование сероводорода, соли и воды. То есть сера восстанавливается до -2.
- Если металл средней активности, то в результате — сера, соль и вода. То есть восстановление сульфат-иона до свободной серы.
- Металлы низкой химической активности (после водорода) — сернистый газ, соль и вода. Сера в степени окисления +4.
Также особыми свойствами сульфатной кислоты являются способности окислять некоторые неметаллы до их высшей степени окисления и вступать в реакции со сложными соединениями и окислять их до простых веществ.
Способы получения в промышленности
Сульфатный процесс получения серной кислоты складывается из двух основных типов:
- контактный;
- башенный.
Оба являются самыми распространенными способами в промышленности во всех странах мира. Первый вариант основан на использовании в качестве сырья железного колчедана или серного пирита — FeS2. Всего выделяют три этапа:
- Обжиг сырья с образованием в качестве продукта горения сернистого газа.
- Пропускание этого газа через кислород над ванадиевым катализатором с образованием серного ангидрида — SO3.
- В поглотительной башне осуществляется растворение ангидрида в растворе сульфатной кислоты с формированием раствора высокой концентрации — олеума. Очень тяжелая маслянистая густая жидкость.
Второй вариант — это практически то же самое, но в качестве катализатора используются оксиды азота. С точки зрения таких параметров, как качество продукции, стоимость и энергозатраты, чистота сырья, производительность, первый способ более эффективен и приемлем, поэтому чаще используется именно он.
Синтез в лаборатории
Если необходимо получить серную кислоту в небольших количествах для лабораторных исследований, то лучше всего подходит способ взаимодействия сероводорода с сульфатами малоактивных металлов.
В этих случаях происходит образование черных сульфидов металлов, и как побочный продукт образуется серная кислота. Для небольших исследований такой вариант подходит, однако чистотой такая кислота отличаться не будет.
Также в лаборатории можно провести качественную реакцию на сульфатные растворы. Самым распространенным реактивом является хлорид бария, так как ион Ва2+ вместе с сульфат-анионом выпадает в белый осадок — баритовое молоко: H2SO4 + BaCL2 = 2HCL + BaSO4↓
Самые распространенные соли
Сульфатная кислота и сульфаты, которые она образует, являются важными соединениями во многих отраслях промышленности и быта, в том числе и пищевой. Самыми распространенными солями серной кислоты являются следующие:
- Гипс (алебастр, селенит). Химическое название — водный кристаллогидрат сульфата кальция. Формула: CaSO4. Используется в строительстве, медицине, целлюлозно-бумажной промышленности, изготовлении ювелирных изделий.
- Барит (тяжелый шпат). Сульфат бария. В растворе представляет собой молочный осадок. В твердом виде — прозрачные кристаллы. Используется в оптических приборах, рентгеновских излучениях, для изготовления изолирующего покрытия.
- Мирабилит (глауберова соль). Химическое название — кристаллогидрат сульфата натрия десятиводный. Формула: Na2SO4*10H2O. Применяется в медицине как слабительное средство.
Можно привести в качестве примеров много солей, которые имеют практическую значимость. Однако упомянутые выше — самые распространенные.
Сульфатный щелок
Данное вещество представляет собой раствор, который образуется вследствие термической обработки древесины, то есть целлюлозы. Главное назначение этого соединения — получение на его основе сульфатного мыла методом отстаивания. Химический состав сульфатного щелока следующий:
- лигнин;
- гидроксикислоты;
- моносахариды;
- фенолы;
- смолы;
- летучие и жирные кислоты;
- сульфиды, хлориды, карбонаты и сульфаты натрия.
Существуют два основных вида данного вещества: белый и черный сульфатный щелок. Белый уходит на целлюлозно-бумажное производство, а черный используется для получения сульфатного мыла в промышленности.
Основные области применения
Ежегодное производство серной кислоты составляет 160 млн. тонн в год. Это очень значительная цифра, которая говорит о важности и распространенности данного соединения. Можно выделить несколько отраслей и мест, где необходимо использование сульфатной кислоты:
- В аккумуляторах в качестве электролита, особенно в свинцовых.
- На заводах, где производятся сульфатные удобрения. Основная масса данной кислоты идет именно на изготовление минеральных подкормок для растений. Поэтому заводы по производству серной кислоты и изготовлению удобрений чаще всего строят рядом.
- В пищевой промышленности в качестве эмульгатора, обозначаемого кодом Е513.
- В многочисленных органических синтезах в качестве водоотнимающего средства, катализатора. Так получают взрывчатые вещества, смолы, чистящие и моющие средства, капроны, полипропилен и этилен, красители, химические волокна, сложные эфиры и прочие соединения.
- Используют в фильтрах для очистки воды и изготовления дистиллированной воды.
- Применяют при добыче и обработке редких элементов из руды.
Также много серной кислоты уходит на лабораторные исследования, где ее получают местными способами.
Формула и физические свойства
Одно из основных соединений в промышленности — серная кислота — имеет химическую формулу H2SO4. Её молекула состоит из четырёх атомов кислорода, двух — водорода и одного — серы. Эта токсичная плотная маслянистая жидкость без запаха в очищенном состоянии не имеет цвета и обладает характерным «медным» привкусом. Плотность при нормальных условиях составляет 1,84 г/куб. см. Примеси придают неочищенному продукту желтоватую или буро-жёлтую окраску.
Соединение кипит при +296 °C, плавится при температуре +10,3 °C. Его кристаллы гигроскопичны и активно отнимают воду у всего окружающего, обугливают бумагу, древесину, сахар. Теплота гидратации при растворении столь велика, что вызывает вскипание смеси и разбрызгивание. Именно поэтому для смешения добавляют кислоту к воде, а не наоборот. Старинное название «купоросное масло» отсылает к XVIII—XIX вв. , когда серу для изготовления пороха получали разложением пирита на купоросных заводах. И до сих пор кристаллогидраты её солей именуются купоросами.
Медикам и строителям давно известен природный гипс — кристаллогидрат сульфата кальция. Садоводы и огородники любят медный купорос — ценный помощник в борьбе с различными вредителями и болезнями растений. Квасцы незаменимы в производстве красок и для дубления кожи. Десятиводный кристаллогидрат сульфата натрия — «глауберова соль» — используется в химической промышленности, деревопереработке и медицине (слабительное и желчегонное средство для людей и животных).
Сульфат бария или «бариевая каша» обладает уникальной способностью взаимодействовать с рентгеновским излучением, задерживая его, и это большой плюс при исследованиях полых органов человеческого тела.
Способы промышленного производства
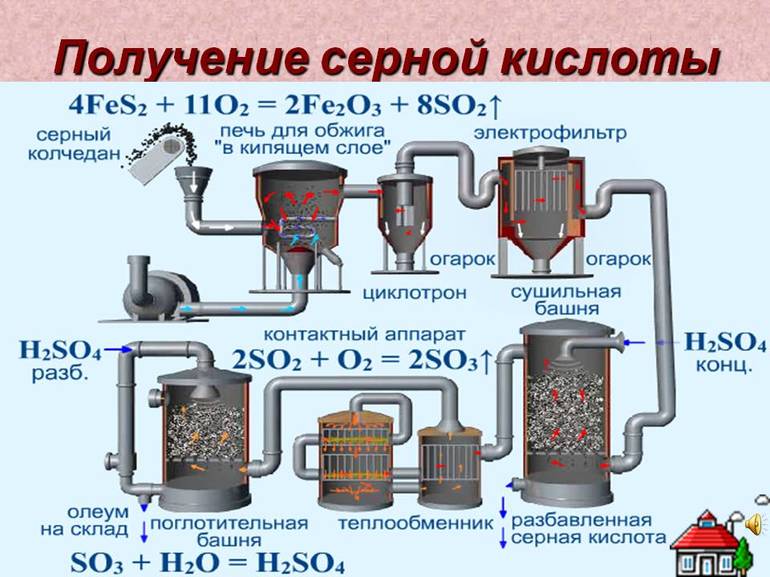
В качестве сырья долгое время использовался природный минерал пирит — «серный колчедан». Сегодня ему на смену пришли элементарная сера или её соединения: сероводород, соли — сульфиты и сульфаты, а также газовые отходы теплоэлектростанций, работающих на неочищенной нефти. Производство имеет ряд последовательных стадий:
- Получение оксида серы (II), сернистого газа, путём сжигания серосодержащего сырья или его обжига в кислороде.
- Очистка газообразной фазы реагентов от твёрдых примесей.
- Окисление до оксида серы (III). Процесс описывается уравнением: 2SO2 + O2 = 2SO3.
- Поглощение водой: H2O + SO3 = H2SO4.
В общем объёме минеральных кислот, которые производятся сегодня химической промышленностью, H2SO4 занимает почётное первое место. При этом она является наиболее дешёвой, технологичной и не разрушает чёрные металлы в концентрированном состоянии.
Камерный метод получения
В эпоху средневековья алхимики синтезировали купоросное масло т. н. камерным способом. Для этого использовались специальные большие, размером с целую комнату, камеры, обложенные изнутри свинцом. Поверхности стенок в результате окисления покрывались защитным слоем сульфата свинца. При горении в присутствии воздуха смеси, состоящей из серы и калиевой селитры, образовывался твёрдый остаток оксидов азота и солей калия и выделялся газообразный оксид серы (III).
Он поглощался водой, имевшейся в камере, и позволял получить продукт малой крепости, которая требовала дальнейшей концентрации. После открытия каталитических свойств оксидов азота, камерный метод уступил место менее трудоёмким и более эффективным технологиям производства.
Современные способы синтеза
«Едва ли найдётся другое, искусственно добываемое вещество, столь часто применяемое в технике» — эти слова гениального русского учёного Д. И. Менделеева наглядно характеризуют ценность серной кислоты. Сегодня при её производстве используются две методики окисления диоксида серы:
- контактная, использующая твёрдые катализаторы;
- башенная (нитрозная), где катализаторами служат газообразные оксиды азота, а окислителем выступает кислород.
При контактном способе смесь реагентов пропускается сквозь твёрдый катализатор, расположенный слоями для увеличения поверхности. Нитрозный метод подразумевает орошение сырья водой или разбавленной кислотой в башенных реакторах. Первый способ более производителен и компактен, позволяет получать продукт большей чистоты при меньших затратах и постепенно вытесняет нитрозного конкурента.
Ускорителей процесса окисления было открыто немало. Наибольший эффект проявляют платина, оксиды ванадия V2O5 и железа Fe2O3. Но первая стоит дорого и быстро отравляется примесями мышьяка, содержащимися в газовой фазе SO2. Для поддержания каталитической активности оксида железа необходимы температуры свыше 600 °C. Наиболее экономичным признан ванадиевый катализатор — он и применяется в производстве.
При улавливании SO3 водой выделяется много тепла, и продукт закипает с образованием аэрозоля. Поэтому используется 100% концентрированная кислота, и получается олеум, который затем разбавляется до необходимых пропорций.
Химические свойства продукта
Серная кислота занимает привилегированное положение среди наиболее сильных минеральных кислот. Такую активность легко охарактеризовать высокой полярностью молекулярной связи водород — кислород, и, соответственно, лёгкостью её разрыва. Это придаёт H2SO4 не только ряд общих для всех соединений её класса свойств, например, взаимодействие кислот с металлами, но и специфические качества. Среди основных химических свойств стоит отметить:
- Действие на индикаторы. Кислая среда водных растворов изменяет окраску фиолетового лакмуса, метилового оранжевого и универсального индикатора — они приобретают красный цвет.
- Реакция диссоциации. В водном растворе проявляются свойства сильного электролита, и в результате двухступенчатой диссоциации соединение распадается на два однозарядных положительных иона водорода и сульфат-ион с двойным отрицательным зарядом.
- Взаимодействие с металлами. Разбавленная серная кислота может реагировать с металлами, которые стоят в электрохимическом ряду активности левее водорода. При этом образуется сернокислая соль, которая называется сульфатом, и водород. Сульфаты не имеют цвета, хорошо растворимы в воде и легко кристаллизуются.
- Реакция нейтрализации. В результате взаимодействия с растворимыми и нерастворимыми основаниями образуется сульфатная соль и вода. Молекула H2SO4 имеет два атома водорода, поэтому кислота — двухосновная, и для полной нейтрализации требуется две молекулы основания.
- Взаимодействие с основными оксидами. Соединения с кислородом одно- и двухвалентных металлов (MgO, FeO, Li2O, Na2O) тоже участвуют в реакции нейтрализации. При этом образуется сульфат металла из состава оксида и вода.
- Обменные реакции с солями более слабых или легколетучих кислот. Происходит вытеснение и в результате образуется сульфатная соль и кислота (или выделяется летучий газ, а вода остаётся в растворе). Выпадение белого нерастворимого осадка BaSO4 — это качественная реакция на сульфат-ионы.
Специфические свойства концентрированных растворов обусловлены структурными особенностями формулы серной кислоты: в молекуле H2SO4 положительно заряженный атом серы находится в максимальной, четвёртой степени окисления. Поэтому он может только принимать электроны и сообщать соединению высокие окислительные свойства. Стоит отметить некоторые из них:
- Окисление большинства металлов, в т. ч. пассивных (цинк и медь). В этих реакциях водород уже не выделяется, а H2SO4 восстанавливается до сероводорода, серы или оксида серы (II). Это определяется концентрацией исходных компонентов и местом, которое занимает метал в электрохимическом ряду активности. Исключение составляют золото, железо, алюминий и платиноиды, поэтому для перевозки автомобильным и железнодорожным транспортом используют стальные цистерны.
- Окисление многих неметаллов. В результате реакции неметалл образует соединение с максимальным окислительным числом, а H2SO4 восстанавливается до оксида серы (IV).
- Окисление сложных соединений. При обработке калиевых солей галогеноводородных кислот (KBr или KI) образуется сульфатная соль и выделяется свободный галоген. Хлорид-ионы не окисляются до хлора и позволяют получать соляную кислоту реакцией обмена.
- Дегидратация органических веществ. Химически связанная вода легко удаляется из гидроксильных групп в присутствии концентрированной H2SO4: из этилового спирта образуется этилен. Обугливание углеводов тоже объясняется обезвоживанием.
Интересно, что в природе эта едкая кислота встречается в чистом 100%-м виде: на итальянском острове Сицилия существует уникальное Озеро смерти, к которому не приближаются даже насекомые и птицы. В этих местах дисульфид железа из земной коры выступает сырьём для синтеза H2SO4, и продукт сочится прямо из дна! Действующие вулканы тоже вносят вклад — извергают в земную атмосферу сернокислотные выбросы, которые причиняют непоправимый вред окружающей среде и становятся причиной серьёзных климатических изменений.
Применение в народном хозяйстве
Достижения химии всегда служили научно-техническому прогрессу. Высокие окислительные способности позволили H2SO4 стать важным компонентом в ряде отраслей промышленности. Её используют:
- добыча редких элементов (очистка урановых, иридиевых, циркониевых и осмиевых руд);
- производство минеральных удобрений, высокомолекулярных нитей, красок и пиротехники;
- неорганический синтез солей и кислот;
- текстильная и кожевенная отрасли;
- нефтехимия и металлообработка;
- пищевая промышленность (добавка-эмульгатор E513);
- автомобилестроение (электролит в аккумуляторах);
- дистиллирование воды (реагент для восстановления смол в фильтрах).
Отдельно стоит упомянуть промышленный органический синтез — источник эфиров и спиртов, синтетических моющих средств и искусственных волокон. Он немыслим реакций дегидратации, гидратации, сульфирования, алкилирования. Металлообрабатывающие заводы очищают поверхности изделий от окислов, образующихся при сильном нагревании. Но основным потребительским сегментом является изготовление минеральных удобрений (больше всего — фосфорных). Из-за этого сернокислотные заводы рекомендуется размещать недалеко от предприятий по производству этих ценных химических продуктов.
Все приведённые положительные характеристики были бы неполными, если не вспомнить, что серная кислота и олеум — опасные, чрезвычайно агрессивные продукты. Атмосферные кислотные аэрозоли периодически образуются в результате выбросов металлургических и химических заводов и выпадают в виде осадков. Они поражают кожу и слизистые, что приводит к затруднению дыхания, провоцирует кашель и бронхолёгочные заболевания с отёками гортани.
При попадании на кожные покровы возникают химические ожоги, их тяжесть напрямую зависит от концентрации и площади контакта. При проглатывании появляются резкие боли во рту и пищеводе, затем начинается рвота, кашель, затрудняется дыхание и ослабляется сердечная деятельность, а смертельной считается доза 5 мг. Первая помощь при отравлении парами заключается в обеспечении притока свежего воздуха и промывании слизистых содовым раствором. При растекании по коже поражённое место обильно орошают водой, а проглатывание требует промывания желудка и приёма известковой воды.
Серная кислота
Другие названия: сульфатная кислота.
Серная кислота — неорганическое соединение с химической формулой H2SO4.
Соли серной кислоты:
- сульфаты SO42-
- гидросульфаты HSO4—
Физические свойства
| Молярная масса | 98,078 г/моль |
| Температура плавления, tпл. | 10,31 °C |
| Температура кипения, tкип. | 279,6 °C разлагается |
| Плотность, ρ | 1,83 г/см3 |
Химические свойства и методы получения
Список использованной литературы
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. — Мн.: Современная школа, 2005. — 608 с ISBN 985-6751-04-7. [c. 151]
Sulfuric Acid or Sulphuric Acid is a mineral acid consisting of one Sulfur, four Oxygen, and two Hydrogen atoms. The chemical or molecular formula of Sulfuric Acid is H2SO4. Sulfuric Acid is one most important commercially used chemicals. It is also known as Mattling acid or Hydrogen Sulfate or Vitriol. Sulphuric acid is a very strong acid and viscous liquid. It is a colorless, odorless, oily liquid, and corrosive in nature. Sulfuric acid is a component of acid rain as it is soluble in water.
Sulfuric acid is a highly acidic liquid. As a result, it is used for the cleaning of metals, the extraction of impurities from oil, the production of chemicals such as nitric acid and hydrochloric acid, and the manufacture of dye, medicines, detergents, and explosives, among other processes. The molar mass of Sulfuric Acid is 98.079 g/mol. The density of Sulfuric acid is 1.83 g/cm3. The H2SO4 molecule is covalent and has a tetrahedral structure and monoclinic crystal structure.
What is Sulfuric Acid?
Sulfuric acid is a highly reactive chemical. Sulfuric acid is used in many industries like lead-based automobile batteries, the production of various chemicals, glue, and explosives, the refinement of petroleum, the curing of metal, etc. Hence, due to these wide applications, it is referred to as the “King of Chemicals“. The chemical formula for Sulfuric or Sulphuric Acid is H2SO4.
As shown below, Sulfuric Acid (H2SO4) is a covalent compound that consists of a Sulfur atom, which is attached to two Oxygen atoms and two Hydroxyl molecules (-OH).
Properties of Sulfuric Acid (H2SO4)
Physical Properties of Sulfuric Acid
- H2SO4 is a viscous, thick, colorless, and oily liquid
- Sulfuric acid has a density of 1.84 g/mL, a boiling point of 337 °C, and a melting point of 10 °C.
- Concentrated sulfuric acid is 98% in water, and is the most stable form. Many other concentrations, with different names, are available for various purposes like Battery acid which is 29–32%, chamber acid which is 62-70%, and tower acid which is 78-80%.
- It has a specific gravity of 1.84 at 298 K.
- It turns blue litmus red and the pH values of sulphuric acid in mmol/l are mentioned in the table below,
| pH values | 1 mM | 10 mM | 100 mM |
| Sulphuric acid (in mmol/l) | 2.75 | 1.87 | 1.01 |
- It is highly corrosive, making it dangerous to touch.
Chemical Properties of Sulfuric Acid
- H2SO4 is a strong acid that completely dissociates into ions in its aqueous solution as,
H2SO4 ⇢ H2+ + SO4-2
- Sulphuric Acid is a good oxidizing agent, as it oxidizes other substances by donating its oxygen atoms, in a chemical reaction. As shown below, it oxidizes carbon and sulphur.
2H2SO4 + C ⇢ 2H2O + 2SO2 + CO2
2H2SO4 + S ⇢ 2H2O + 3SO2
- Sulfuric acid reacts vigorously with water in a highly exothermic reaction (i.e., releases heat).
- Sulphuric Acid is a dibasic acid and releases two hydrogen ions per molecule.
- Sulphuric Acid has hygroscopic properties, which implies that H2SO4 can draw and control moisture from its surroundings. This effect makes it a good dehydrating agent.
- It is less volatile. This is why it contributes to preparing more volatile acids from their complementary salts.
Structure of Sulphuric Acid
Two oxygen atoms form double bonds with the Sulphur atom, while two hydroxyl groups (OH) form single bonds with the Sulphur atom. Due to its ability to release two protons, it is a diprotic acid. As shown below, the molecule has a tetrahedral structure and is covalent.
Preparation of Sulfuric Acid
Sulfuric Acid is generally prepared and manufactured by the following two methods, which are widely used.
- Contact Process
- Lead Chamber Process
Contact Process for manufacturing of Sulfuric Acid
The Contact Process comprises three phases in the production of sulphuric acid:
- Preparation of Sulphur dioxide by burning sulphur or sulphide ores in the air.
S (s) + O2 (g) → SO2 (g)
- Reaction between sulphur dioxide with oxygen in the presence of V2O5 catalyst to produce Sulphur trioxide (SO3) as,
2SO2 (g) + O2 (g) → 2SO3 (g)
- Conversion of Sulphur Trioxide into Sulphuric Acid as,
SO3 + H2SO4 (Oleum) → H2S2O7
H2S2O7 (l) + H2O (l) → 2H2SO4 (Sulfuric Acid)
The sulphuric acid obtained by the Contact process is 96–98% pure.
Lead Chamber Process
One of the most popular manufacturing processes is the lead Chamber method. It produces around 50 to 60 B-grade acids. Wet SO2 in the presence of nitrogenous oxides is used in this procedure (dynamic impetus). As a result, it undergoes oxidation with airborne oxygen to produce sulphur trioxide. This reaction is stated as,
2SO2 + O2 → 2SO3
Then, water and sulphur trioxide are allowed to interact, resulting in H2SO4. This reaction is stated as,
SO3 + H2O → H2SO4
Molecular Mass of Sulphuric Acid
Sulphuric acid has the chemical formula H2SO4. According to this formula, one molecule of sulphuric acid (H2SO4) comprises 2 moles of hydrogen, 1 mole of sulfur, and 4 moles of oxygen atoms. As a result, the molecular mass of H2SO4 will be equal to the sum of the masses of two moles of hydrogen, one mole of sulfur, and four moles of oxygen. Because hydrogen has an atomic mass of 1u, sulfur has an atomic mass of 32u, and oxygen has an atomic mass of 16u, the molecular mass of sulphuric acid may be computed as follows:
The molecular mass of H2SO4 = Mass of 2 moles of hydrogen atoms + Mass of 1 mole of sulphur + Mass of 4 moles of oxygen atoms
= 2 × 1 + 32 + 4 × 16
= 2 + 32 + 64
= 98 u
Thus, the molecular mass of sulphuric acid is 98u and the molecular weight of sulphuric acid is 98 g/mol.
Reactions of Sulfuric Acid
- Dissociation- When pure water-free sulphuric acid is cooked, sulfur trioxide and water are formed.
H2SO4 → SO3 + H2O
- Acidic Character of Sulphuric Acid- It’s a common dibasic acid that turns blue litmus crimson when exposed to it. It divides into two groups of salts.
NaOH + H2SO4 → NaHSO4 + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
- Sulphonating Action of Sulphuric Acid- Concentrated sulphuric acid combines with a variety of organic molecules, such as benzene, toluene, and others, to form sulphonic acids, as an example.
C6H6 + H2SO4 → C6H5SO3H + H2O
- Precipitation Reactions with Sulphuric Acid- It creates insoluble sulfates that precipitate when handled with aqueous solutions of barium, lead, and other salts, for example.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
- Reaction with Sulphur Trioxide- Oleum, commonly known as fuming sulphuric acid, is formed when it dissolves sulfur trioxide.
H2SO4 + SO3 → H2S2O7
Uses of Sulfuric Acid
Sulfuric acid is known as one of the most essential reagents, and it has several industrial uses. Several instances include:
- Fertilizers such as ammonium sulfate, lime superphosphate, and others are made in this way.
- In the production of colors, explosives, and pharmaceuticals.
- H2SO4 is used in the production of acids such as HCl and HNO3.
- In the production of pigments, paints, and polymers, for example.
- In the paper and textile industries, for example.
- Nitrocellulose is used in the production of goods.
- Applications in metallurgy (Example: Cleaning metals before enameling, electroplating, and galvanizing).
- In the leather business.
- In storage compartments.
- In the oil and gas sector.
- In the detergent business.
- It works as a dehydrator.
- As a reagent in the laboratory.
FAQs on Sulfuric Acid
Question 1: What are the uses of sulphuric acid?
Answer:
Fertilizers, dyestuffs, explosives, and pharmaceuticals are all made with sulphuric acid. It is also used to make acids such as HCl and HNO3. It’s frequently utilised in the metallurgical industry (Example: Cleaning metals before enamelling, electroplating and galvanising).
Question 2: Why is Sulphuric acid called the king of chemicals?
Answer:
Sulphuric acid, sometimes known as the “king of chemicals,” is one of the most significant substances. It’s also known as vitriol oil since it used to be made from green vitriol back in the day. It is very corrosive and more reactive than other acids. As a result, it has a wide range of uses, including usage in laboratories, batteries, detergents, and the manufacture of numerous medications.
Question 3: What will happen when Sulphuric Acid reacts with aqueous solutions of the salts of barium?
Answer:
It generates insoluble sulphates that precipitate when handled with aqueous solutions of barium salts.
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
Question 4: What will happen when Sulphuric Acid reacts with Sulphur Trioxide?
Answer:
Sulphuric acid dissolves sulphur trioxide to generate oleum, often known as fuming sulphuric acid.
H2SO4 + SO3 → H2S2O7
Question 5: What is the structure of sulphuric acid?
Answer:
In sulphuric acid, two hydrogen atoms are firmly bonded to two oxygen atoms, resulting in two-OH groups. The molecule is covalent and has a tetrahedral structure.
Question 6: Which acid is the strongest in the world?
Answer:
Fluoroantimonic acid is a superacid mixture of Antimony Pentafluoride and Hydrofluoric Acid, which is the strongest in the world.
Related Articles
- Acids, Bases, and Salts
- Types of Acids
- Sulfurous Acid Formula