Сульфид железа (II) – неорганическое вещество, имеет химическую формулу FeS.
Краткая характеристика сульфида железа (II)
Физические свойства сульфида железа (II)
Получение сульфида железа (II)
Химические свойства сульфида железа (II)
Химические реакции сульфида железа (II)
Применение и использование сульфида железа (II)
Краткая характеристика сульфида железа (II):
Сульфид железа (II) – неорганическое вещество коричнево-черного цвета с металлическим блеском, соединение железа и серы, соль железа и сероводородной кислоты.
Сульфид железа (II) представляет собой коричнево-черные кристаллы.
Химическая формула сульфида железа (II) FeS.
Не растворяется в воде. Не притягивается магнитом. Тугоплавок.
Разлагается при нагревании в вакууме.
Во влажном состоянии чувствителен к кислороду воздуха, т.к. вступает с кислородом в реакцию, образуя сульфит железа (II).
Физические свойства сульфида железа (II):
| Наименование параметра: | Значение: |
| Химическая формула | FeS |
| Синонимы и названия иностранном языке | iron (II) sulfide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | коричнево-черные гексагональные кристаллы |
| Цвет | коричнево-черный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 4840 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 4,84 |
| Температура кипения, °C | — |
| Температура плавления, °C | 1194 |
| Молярная масса, г/моль | 87,91 |
* Примечание:
— нет данных.
Получение сульфида железа (II):
Сульфид железа (II) получается в результате следующих химических реакций:
- 1. взаимодействия железа и серы:
Fe + S → FeS (t = 600-950 оС).
Реакция протекает путем сплавления алюминия с углеродом в дуговой печи.
- 2. взаимодействия оксида железа и сероводорода:
FeO + H2S → FeS + H2O (t = 500 оС).
- 3. взаимодействия хлорида железа и сульфида натрия:
FeCl2 + Na2S → FeS + 2NaCl.
- 4. взаимодействия сульфата железа и сульфида натрия:
FeSO4 + Na2S → FeS + Na2SO4.
Химические свойства сульфида железа (II). Химические реакции сульфида железа (II):
Химические свойства сульфида железа (II) аналогичны свойствам сульфидов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция сульфида железа (II) и кремния:
Si + FeS → SiS + Fe (t = 1200 оС).
В результате реакции образуются сульфид кремния и железо.
2. реакция сульфида железа (II) и кислорода:
FeS + 2O2 → FeSO4.
В результате реакции образуются сульфат железа (II). Реакция протекает медленно. В ходе реакции используется влажный сульфид железа. Также образуются примеси: сера S, полигидрат оксида железа (III) Fe2O3 • nH2O.
3. реакция сульфида железа (II), кислорода и воды:
4FeS + O2 + 10H2O → 4Fe(OH)3 + 4H2S.
В результате реакции образуются гидроксид железа и сероводород.
4. реакция сульфида железа (II), оксида кальция и углерода:
FeS + CaO + C → Fe + CO + CaS (tо).
В результате реакции образуются железо, оксид углерода и сульфид кальция.
5. реакция сульфида железа (II) и сульфида меди:
CuS + FeS → CuFeS2.
В результате реакции образуются дитиоферрата (II) меди (II) (халькопирит).
6. реакции сульфида железа (II) с кислотами:
Сульфид железа (II) реагирует с сильными минеральными кислотами.
7. реакция термического разложения сульфида железа (II):
FeS → Fe + S (t = 700 оС).
В результате реакции термического разложения сульфида железа (II) образуются железо и сера. Реакция протекает в вакууме.
Применение и использование сульфида железа (II):
Сульфид железа (II) используется лишь в нескольких отраслях:
– в качестве исходного продукта для получения сероводорода в лабораторных условиях,
– в качестве сырья в производстве чугуна, как твердый источник сероводорода.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
6 816
| Сульфид железа(II) | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Сульфид железа(II) |
| Химическая формула | FeS |
| Эмпирическая формула | FeS |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 87,910 г/моль |
| Плотность | 4,84 г/см³ |
| Термические свойства | |
| Температура плавления | 1194 °C |
| Классификация | |
| Рег. номер CAS | 1317-37-9 |
Сульфид железа (II) — сложное неорганическое вещество с химической формулой FeS.
Описание
Сульфид железа (II) — бескислородная соль. Черно-серого цвета с зеленым оттенком, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа (II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода.
Получение
1. Взаимодействие железа с серой:
2. Взаимодействие оксида железа (III) с водородом и сероводородом:
Химические свойства
1. Взаимодействие с концентрированной HCl:
2. Взаимодействие с концентрированной HNO3:
См. также
- Сульфиды
Литература
- Лидин Р. А. «Справочник школьника. Химия» М.: Астерель, 2003.
From Wikipedia, the free encyclopedia
(Redirected from Iron(II)sulfide)

|
|

|
|
| Names | |
|---|---|
| Other names
Iron sulfide, ferrous sulfide, black iron sulfide, protosulphuret of iron |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.881 |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
FeS |
| Molar mass | 87.910 g/mol |
| Appearance | Grey, sometimes in lumps or powder |
| Density | 4.84 g/cm3 |
| Melting point | 1,194 °C (2,181 °F; 1,467 K) |
|
Solubility in water |
negligible (insoluble) |
| Solubility | reacts in acid |
|
Magnetic susceptibility (χ) |
+1074·10−6 cm3/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Source of hydrogen sulfide, can be pyrophoric |
| NFPA 704 (fire diamond) |
1 2 2 |
|
Autoignition |
variable |
| Related compounds | |
|
Other anions |
Iron(II) oxide Iron(II) selenide Iron(II) telluride |
|
Other cations |
Manganese(II) sulfide Cobalt(II) sulfide |
|
Related Iron sulfides |
Iron(III) sulfide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Iron(II) sulfide or ferrous sulfide (Br.E. sulphide) is one of a family chemical compounds and minerals with the approximate formula FeS. Iron sulfides are often iron-deficient non-stoichiometric. All are black, water-insoluble solids.
Preparation and structure[edit]
FeS can be obtained by the heating of iron and sulfur:[1]
- Fe + S → FeS
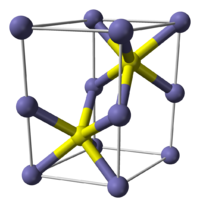
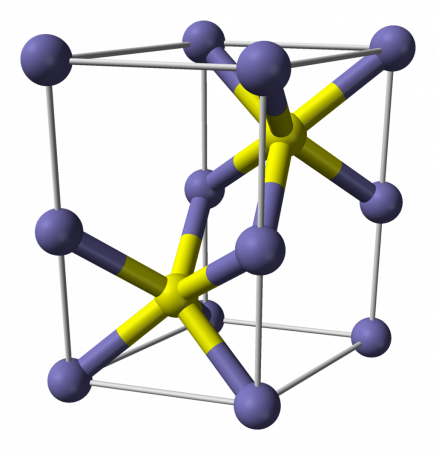
FeS adopts the nickel arsenide structure, featuring octahedral Fe centers and trigonal prismatic sulfide sites.
Reactions[edit]
Iron sulfide reacts with hydrochloric acid, releasing hydrogen sulfide:[2]
- FeS + 2 HCl → FeCl2 + H2S
- FeS + H2SO4 → FeSO4 + H2S
In moist air, iron sulfides oxidize to hydrated ferrous sulfate.
Biology and biogeochemistry[edit]
Iron sulfides occur widely in nature in the form of iron–sulfur proteins.
As organic matter decays under low-oxygen (or hypoxic) conditions such as in swamps or dead zones of lakes and oceans, sulfate-reducing bacteria reduce various sulfates present in the water, producing hydrogen sulfide. Some of the hydrogen sulfide will react with metal ions in the water or solid to produce iron or metal sulfides, which are not water-soluble. These metal sulfides, such as iron(II) sulfide, are often black or brown, leading to the color of sludge.
Pyrrhotite is a waste product of the Desulfovibrio bacteria, a sulfate reducing bacteria.
When eggs are cooked for a long time, the yolk’s surface may turn green. This color change is due to iron(II) sulfide, which forms as iron from the yolk reacts with hydrogen sulfide released from the egg white by the heat.[3] This reaction occurs more rapidly in older eggs as the whites are more alkaline.[4]
The presence of ferrous sulfide as a visible black precipitate in the growth medium peptone iron agar can be used to distinguish between microorganisms that produce the cysteine metabolizing enzyme cysteine desulfhydrase and those that do not. Peptone iron agar contains the amino acid cysteine and a chemical indicator, ferric citrate. The degradation of cysteine releases hydrogen sulfide gas that reacts with the ferric citrate to produce ferrous sulfide.
See also[edit]
- Iron sulfide
- Troilite
- Pyrite
- Iron-sulfur world theory
References[edit]
- ^ H. Lux «Iron (II) Sulfide» in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 1502.
- ^ Hydrogen Sulfide Generator
- ^ Belle Lowe (1937), «The formation of ferrous sulfide in cooked eggs», Experimental cookery from the chemical and physical standpoint, John Wiley & Sons
- ^ Harold McGee (2004), McGee on Food and Cooking, Hodder and Stoughton
From Wikipedia, the free encyclopedia
(Redirected from Iron(II)sulfide)

|
|

|
|
| Names | |
|---|---|
| Other names
Iron sulfide, ferrous sulfide, black iron sulfide, protosulphuret of iron |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.881 |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
FeS |
| Molar mass | 87.910 g/mol |
| Appearance | Grey, sometimes in lumps or powder |
| Density | 4.84 g/cm3 |
| Melting point | 1,194 °C (2,181 °F; 1,467 K) |
|
Solubility in water |
negligible (insoluble) |
| Solubility | reacts in acid |
|
Magnetic susceptibility (χ) |
+1074·10−6 cm3/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Source of hydrogen sulfide, can be pyrophoric |
| NFPA 704 (fire diamond) |
1 2 2 |
|
Autoignition |
variable |
| Related compounds | |
|
Other anions |
Iron(II) oxide Iron(II) selenide Iron(II) telluride |
|
Other cations |
Manganese(II) sulfide Cobalt(II) sulfide |
|
Related Iron sulfides |
Iron(III) sulfide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Iron(II) sulfide or ferrous sulfide (Br.E. sulphide) is one of a family chemical compounds and minerals with the approximate formula FeS. Iron sulfides are often iron-deficient non-stoichiometric. All are black, water-insoluble solids.
Preparation and structure[edit]
FeS can be obtained by the heating of iron and sulfur:[1]
- Fe + S → FeS
FeS adopts the nickel arsenide structure, featuring octahedral Fe centers and trigonal prismatic sulfide sites.
Reactions[edit]
Iron sulfide reacts with hydrochloric acid, releasing hydrogen sulfide:[2]
- FeS + 2 HCl → FeCl2 + H2S
- FeS + H2SO4 → FeSO4 + H2S
In moist air, iron sulfides oxidize to hydrated ferrous sulfate.
Biology and biogeochemistry[edit]
Iron sulfides occur widely in nature in the form of iron–sulfur proteins.
As organic matter decays under low-oxygen (or hypoxic) conditions such as in swamps or dead zones of lakes and oceans, sulfate-reducing bacteria reduce various sulfates present in the water, producing hydrogen sulfide. Some of the hydrogen sulfide will react with metal ions in the water or solid to produce iron or metal sulfides, which are not water-soluble. These metal sulfides, such as iron(II) sulfide, are often black or brown, leading to the color of sludge.
Pyrrhotite is a waste product of the Desulfovibrio bacteria, a sulfate reducing bacteria.
When eggs are cooked for a long time, the yolk’s surface may turn green. This color change is due to iron(II) sulfide, which forms as iron from the yolk reacts with hydrogen sulfide released from the egg white by the heat.[3] This reaction occurs more rapidly in older eggs as the whites are more alkaline.[4]
The presence of ferrous sulfide as a visible black precipitate in the growth medium peptone iron agar can be used to distinguish between microorganisms that produce the cysteine metabolizing enzyme cysteine desulfhydrase and those that do not. Peptone iron agar contains the amino acid cysteine and a chemical indicator, ferric citrate. The degradation of cysteine releases hydrogen sulfide gas that reacts with the ferric citrate to produce ferrous sulfide.
See also[edit]
- Iron sulfide
- Troilite
- Pyrite
- Iron-sulfur world theory
References[edit]
- ^ H. Lux «Iron (II) Sulfide» in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 1502.
- ^ Hydrogen Sulfide Generator
- ^ Belle Lowe (1937), «The formation of ferrous sulfide in cooked eggs», Experimental cookery from the chemical and physical standpoint, John Wiley & Sons
- ^ Harold McGee (2004), McGee on Food and Cooking, Hodder and Stoughton
Сульфид железа — бинарное неорганическое соединение железа и серы:
- Сульфид железа(II) — FeS;
- Сульфид железа(II,III) — Fe3S4;
- Сульфид железа(III) — Fe2S3 (нестабилен);
- Дисульфид железа(II) — FeS2.
В природе эти вещества образуют ряд минералов:
- серный колчедан, или Пирит, железный колчедан — кубический дисульфид железа FeS2
- Марказит, или лучистый колчедан — орторомбический дисульфид железа FeS2
- Пирротин, или магнитный колчедан — Fe1-xS (где x = 0…0,2), или Fe7S8
- Троилит FeS, предельный случай пирротина.
- Грейгит или мельниковит, форма сульфида железа(II,III) (Fe3S4), аналог магнетита Fe3O4;
- Маккинавит, Fe1+xS (где x = 0…0,1);
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфид железа(II)
Брутто-формула:
FeS
CAS# 1317-37-9
Категории:
Неорганические соли
PubChem CID: 10290742
| ChemSpider ID: 8466211
Названия
Русский:
- Сульфид железа(II) [Wiki]
English:
- Black IronSulfide
- C.I. 77540
- EINECS:215-268-6
- Ferrous monosulfide
- Ferrous sulfide(FeS)
- Iron monosulfide
- Iron monosulfide (FeS)
- Iron sulfide
- Iron(II) sulfide [Wiki]
- black iron sulfide
- ferrous sulfide
- ferrous sulphide
- iron(2+);sulfide(IUPAC)
Варианты формулы:
FeS
Fe(+2)S(-2)
Fe^++S^—
Fe=S
Вещества, имеющие отношение…
Анион:
Сульфиды
Химический состав
Реакции, в которых участвует Сульфид железа(II)
-
2Fe(OH)3 + 3H2S -> FeS2 + FeS + 6H2O
-
FeS2 «1170^oc»—> FeS + S
-
FeS + S -> FeS2
-
4Fe2P + 18S -> P4S10 + 8FeS
-
4Fe2P + 18FeS2 «T»-> P4S10 + 26FeS
И ещё 7 реакций…
| Сульфид железа (II) | |
|---|---|
 |
|
| Систематическое наименование |
Сульфид железа (II) |
| Хим. формула | FeS |
| Состояние | твёрдое |
| Молярная масса | 87,910 г/моль |
| Плотность | 4,84 г/см³ |
| Температура | |
| • плавления | 1194 °C |
| Рег. номер CAS | 1317-37-9 |
| PubChem | 14828 |
| Рег. номер EINECS | 215-268-6 |
| SMILES |
[Fe+2].[S-2] |
| InChI |
1S/Fe.S MBMLMWLHJBBADN-UHFFFAOYSA-N |
| ChemSpider | 8466211 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид железа (II) — сложное неорганическое вещество с химической формулой FeS класса неорганических сульфидов .
Описание и структура
Сульфид железа (II) — бескислородная соль. Кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа (II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода. Не притягивается магнитом.
Получение
1. Взаимодействие железа с серой:
-
- Fe + S ⟶ FeS
Реакция начинается при нагревании смеси железа с серой в пламени горелки, далее может протекать и без подогрева, с выделением теплоты.
2. Взаимодействие оксида железа (III) с водородом и сероводородом:
-
- Fe2O3 + H2 + 2H2S ⟶ 2FeS + 3H2O
Химические свойства
1. Взаимодействие с концентрированной HCl:
-
- FeS + 2HCl ⟶ FeCl2 + H2S
2. Взаимодействие с концентрированной HNO3:
-
- FeS + 12HNO3 ⟶ Fe(NO3)3 + 9NO2 + 5H2O + H2SO4
Применение
Сульфид железа (II) служит обычным исходным продуктом при получении сероводорода в лабораторных условиях. Гидросульфид железа [Fe(SH)2] и/или отвечающая ему основная соль [Fe(SH)OH] является важнейшей составной частью некоторых лечебных грязей.






