| Свинец | |||
|---|---|---|---|
| ← Таллий | Висмут → | |||
|
|||
| тяжёлый металл серебристо-серого цвета с синеватым оттенком | |||

Слитки свинца |
|||
| Название, символ, номер | Свине́ц / Plumbum (Pb), 82 | ||
| Атомная масса (молярная масса) |
207,2(1)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 | ||
| Радиус атома | 175 пм | ||
| Ковалентный радиус | 147 пм | ||
| Радиус иона | (+4e) 84 (+2e) 120 пм | ||
| Электроотрицательность | 2,33 (шкала Полинга) | ||
| Электродный потенциал | Pb←Pb2+ −0,126 В Pb←Pb4+ 0,80 В |
||
| Степени окисления | 4, 2, 0 | ||
| Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) | ||
| Плотность (при н. у.) | 11,3415[2] г/см³ | ||
| Температура плавления | 600,61 K (327,46 °C, 621,43 °F)[3] | ||
| Температура кипения | 2022 K (1749 °C, 3180 °F)[3] | ||
| Уд. теплота плавления | 4,77 кДж/моль | ||
| Уд. теплота испарения | 177,8 кДж/моль | ||
| Молярная теплоёмкость | 26,65[2] Дж/(K·моль) | ||
| Молярный объём | 18,3 см³/моль | ||
| Структура решётки | кубическая гранецентрированая | ||
| Параметры решётки | 4,950 Å | ||
| Температура Дебая | 88,00 K | ||
| Теплопроводность | (300 K) 35,3 Вт/(м·К) | ||
| Номер CAS | 7439-92-1 |
Свине́ц (лат. Plumbum; обозначается символом Pb) — элемент 14-й группы (по устаревшей[4] классификации — главной подгруппы IV группы), шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82 и, таким образом, содержит магическое число протонов. Простое вещество свинец — ковкий, сравнительно легкоплавкий тяжёлый металл серебристо-белого цвета с синеватым отливом. Плотность свинца — 11,35 г/см³. Свинец токсичен. Известен с глубокой древности[5].
Исторические сведения[править | править код]
Свинец используется многие тысячелетия, поскольку он широко распространён, легко добывается и обрабатывается. Он очень ковкий и легко плавится. Выплавка свинца была первым из известных человеку металлургических процессов. Бусины из свинца, датируемые 6400 годами до н. э., были найдены в культуре Чатал-Хююк[6]:8. Самым древним предметом, сделанным из свинца, часто считается[6]:8 статуэтка стоящей женщины в длинной юбке времён первой династии Египта, датируемая 3100—2900 годами до н. э., хранящаяся в Британском музее (инвентарный номер EA 32138)[7]. Она была найдена в храме Осириса в Абидосе и привезена из Египта в 1899 году[8]. В Древнем Египте использовались медальоны из свинца. В раннем бронзовом веке свинец использовался наряду с сурьмой и мышьяком. Указание на свинец как на определённый металл имеется в Ветхом Завете (Зах. 5:7).
Свинцовые трубы древнеримского водопровода с надписями
Самым крупным производителем свинца доиндустриальной эпохи был Древний Рим, с годовым производством до 80 000 тонн. Добыча свинца римлянами происходила в Центральной Европе, римской Британии, на Балканах, в Греции, Малой Азии и Испании. Римляне широко применяли свинец в производстве труб для водопроводов, на свинцовые трубы часто наносились надписи с именами римских императоров. Однако ещё Плиний и Витрувий считали применение свинца для производства труб вредным для общественного здоровья.
Папская булла 1637 года со свинцовой печатью
После падения Римской империи в V веке н. э. использование свинца в Европе упало и оставалось на низком уровне в течение около 600 лет. Затем свинец начали добывать в восточной Германии.
Свинцовый сахар ещё с римских времён добавляли в вино для улучшения его вкусовых качеств, это стало широко применяться и продолжалось даже после запрета папской буллой в 1498 году. Такое использование свинца в средние века приводило к эпидемиям свинцовой колики[9].
В Древней Руси свинец использовали для покрытия крыш церквей, а также широко применяли в качестве материала навесных печатей к грамотам[10]:119-120[6]:16,28. Позднее, в 1633 году, в Кремле был сооружён водопровод со свинцовыми трубами, вода по которому поступала из Водовзводной башни, он просуществовал до 1737 года[6]:101.
В алхимии свинец ассоциировался с планетой Сатурн и обозначался её символом ♄[11]. В древности олово, свинец и сурьму часто не отличали друг от друга, считая их разными видами одного и того же металла, хотя ещё Плиний Старший различал олово и свинец, называя олово «plumbum album» (белый плюмбум), а свинец — «plumbum nigrum» (чёрный плюмбум)[6]:8-9.
Индустриальная революция привела к новому росту потребности в свинце. К началу 1840-х годов годовое производство очищенного свинца впервые превысило 100 000 тонн и выросло до более чем 250 000 тонн в течение последующих 20 лет. До последних десятилетий XIX века добыча свинца в основном проводилась тремя странами: Британией, Германией и Испанией. К началу XX века добыча свинца в странах Европы стала меньше, чем в других странах, благодаря увеличению добычи в США, Канаде, Мексике и Австралии[12].
До 1990 года большое количество свинца использовалось (вместе с сурьмой и оловом) в типографских сплавах для отливки типографских шрифтов, а также в производства тетраэтилсвинца, применяемого для повышения октанового числа моторного топлива[13].
Этимология[править | править код]
Происхождение слова «свинец» неясно. Этот металл по-болгарски называется «оло́во», в большинстве других славянских языков (сербско-хорватском, чешском, польском) свинец называется словом, близким по звучанию к «олово»: волава, olovo, ołów и т. п. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в нескольких славянских — русском, украинском (свинець), белорусском (свінец) и словенском (svinec).
Латинское plumbum дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для ковки полос и пайки), и название венецианской тюрьмы со свинцовой крышей — Пьомби, из которой, по некоторым данным, ухитрился бежать Казанова.
Нахождение в природе[править | править код]
Содержание свинца в земной коре — 1,6·10−3 % по массе. Самородный свинец встречается редко, виды горных пород, в которых он присутствует, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В этих образованиях он часто образует интерметаллические соединения (например, звягинцевит (Pd, Pt)3(Pb, Sn) и др.) и сплавы с другими элементами (например, (Pb + Sn + Sb)).
Свинец входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4 (сульфат свинца); из минералов более сложного состава — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11.
Свинец всегда присутствует в минералах, содержащих уран и торий, имея часто радиогенную природу. Часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на Земле, где в породах присутствует больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана[14].
Галенит, Дальнегорское скарновое месторождение
В таблице приведены некоторые параметры распространённости свинца в природных условиях по А. П. Виноградову[15]:
Обобщённые концентрации элементов в минералах приведены в таблице, в скобках — количества минералов, по которым рассчитаны средние содержания компонентов[16].
| Минерал | Свинец (общ) | Уран | Торий |
|---|---|---|---|
| 00Настуран | 04,750 (308) | 58,87 (242) | 2,264 (108) |
| 00Монацит | 00,6134 (143) | 0,2619 (160) | 6,567 (150) |
| 000Ортит | 00,0907 (90) | 0,1154 (88) | 6,197 (88) |
| 000Циркон | 00,0293 (203) | 0,1012 (290) | 0,1471 (194) |
| Сфен (Титанит) | 00,0158 (12) | 0,0511 (14) | 0,0295 (21) |
Получение[править | править код]
Для получения свинца в основном используют руды, содержащие галенит. Сначала методом флотации получают концентрат, содержащий 40—70 процентов свинца. Затем возможно несколько способов переработки концентрата в веркблей (черновой свинец): прежде широко распространённый метод шахтной восстановительной плавки, разработанные в СССР метод кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых продуктов (КИВЦЭТ-ЦС), метод плавки Ванюкова (плавка в жидкой ванне)[6]:37-38. Для плавки в шахтной (ватержакетной) печи предварительно производят агломерационный обжиг концентрата, а затем его загружают в шахтную печь, где происходит восстановление свинца из оксида.
Веркблей, содержащий более 90 процентов свинца, подвергается дальнейшей очистке. Сначала для удаления меди применяют зейгерование и последующую обработку серой[6]:42. Затем щелочным рафинированием удаляют мышьяк и сурьму. Далее выделяют серебро и золото с помощью цинковой пены и отгоняют цинк[6]:45. Обработкой кальцием и магнием удаляют висмут. В результате рафинирования содержание примесей падает до менее чем 0,2 %[11].
Производство в мире[править | править код]
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG):
| Страна | Количество в метрических килотоннах |
|---|---|
| Евросоюз | 2200 |
| США | 1400 |
| Китай | 1200 |
| Россия | 1100 |
| Южная Корея | 600 |
| Казахстан | 550 |
| Украина | 400 |
Физические свойства[править | править код]
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К), при температуре 0 °C. Металл мягкий, режется ножом, легко царапается ногтем[17]. Его поверхность обычно покрыта более или менее толстой плёнкой оксидов, на срезе имеет металлический блеск, который на воздухе со временем тускнеет.
Температура плавления — 600,61 K (327,46 °C)[3], кипит при 2022 K (1749 °C)[3]. Относится к группе тяжёлых металлов; его плотность — 11,3415 г/см3 (при +20 °C)[2]. С повышением температуры плотность свинца падает:
| Температура, °C | Плотность, г/см3 |
|---|---|
| 327,6 | 10,686 |
| 450 | 10,536 |
| 650 | 10,302 |
| 850 | 10,078 |
Предел прочности на растяжение — 12—13 МПа (МН/м2).
При температуре 7,26 К (-265.89 °C) переходит в сверхпроводящее состояние.
Химические свойства[править | править код]
Электронная конфигурация: 5s25p65d106s26p2. Энергия ионизации (Pb → Pb+ + e−) равна 7,42 эВ. На внешней электронной оболочке находятся 4 неспаренных электрона (2 на p- и 2 на d-подуровнях), поэтому основные степени окисления атома свинца — +2 и +4.
- Соли двухвалентного свинца реагируют со щелочами, образуя почти нерастворимый гидроксид свинца:
- При избытке щёлочи гидроксид растворяется:
- Реагирует со щелочами и кислотами:
Свинец образует комплексные соединения с координационным числом 4, например,
Реакция диспропорционирования между PbO2 и Pb лежит в основе работы свинцовых аккумуляторов.
С разбавленными соляной и серной кислотами свинец практически не реагирует, но растворяется в концентрированной серной кислоте с образованием гидросульфата свинца (II). Также растворяется в азотной, а также в уксусной в присутствии растворённого кислорода. Вода на воздухе тоже постепенно разрушает свинец с образованием гидроксида свинца (II)[18].
Основные соединения свинца[править | править код]
Свинец в соединениях может находиться в степенях окисления +2 и +4, образуя ряды соединений Pb(II) и Pb(IV) соответственно. В обеих степенях окисления соединения свинца амфотерны и могут как быть в роли катионов Pb2+ и Pb4+, так и входить в состав анионов (плюмбита[en] PbO2-
2 с Pb(II) и плюмбатов с Pb(IV): метаплюмбата PbO2-
3 и ортоплюмбата PbO4-
4), поэтому свинец может образовывать четыре типа солей.
Галогениды свинца[править | править код]
Свинец образует галогениды в степени окисления +2 вида PbHal2 для всех галогенов. Известны также галогениды свинца(IV): PbF4 и PbCl4, тетрабромиды и тетраиодиды не получены.
- Фторид свинца(II)
- Хлорид свинца(II) — белый кристаллический порошок, растворим в горячей воде. Хорошо растворяется также в растворах других хлоридов, особенно в хлориде аммония NH4Cl.
- Бромид свинца(II)
- Иодид свинца(II)
Халькогениды свинца[править | править код]
Халькогениды свинца — сульфид свинца PbS, селенид свинца(II) PbSe и теллурид свинца PbTe — представляют собой кристаллические вещества чёрного цвета, которые являются узкозонными полупроводниками.
Оксиды свинца[править | править код]
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На поверхности свинцовой отливки могут наблюдаться цвета побежалости — явление интерференции света в тонкой плёнки оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе.
Свинец образует два простых оксида — оксид свинца(II) PbO и оксид свинца(IV) PbO2 — и один смешанный Pb3O4 (свинцовый сурик), фактически являющийся плюмбатом(IV) свинца(II) Pb2PbO4.
Соли свинца[править | править код]
- Сульфат свинца(II) PbSO4
- Нитрат свинца(II) Pb(NO3)2
- Ацетат свинца(II) Pb(CH3COO)2 (свинцовый сахар).
- Хромат свинца(II) PbCrO4
Изотопы[править | править код]
Весь свинец в основном является смесью стабильных изотопов 204Pb, 206Pb, 207Pb, 208Pb. Свинец — последний элемент по номеру в периодической таблице, у которого существуют стабильные изотопы, элементы после свинца стабильных изотопов не имеют. Следующий за свинцом висмут стабильных изотопов уже не имеет, хотя висмут-209 практически можно считать стабильным, так как его период полураспада примерно в миллиард раз больше возраста Вселенной.
Стабильные изотопы 206Pb, 207Pb, 208Pb являются радиогенными и образуются в результате радиоактивного распада соответственно 238U, 235U и 232Th.
Изотоп 208
82Pb126
является одним из пяти существующих в природе дважды магических ядер.
Схемы радиоактивного распада имеют вид:
- 238U → 206Pb + 84He;
- 235U → 207Pb + 74He;
- 232Th → 208Pb + 64He.
Уравнения распада имеют вид соответственно:
- где 238U, 235U, 232Th — современные концентрации изотопов; : год−1;
- год−1;
- год−1 — постоянные распада атомов соответственно урана 238U, урана 235U и тория 232Th[19].
Кроме этих изотопов известны и нестабильные изотопы 194Pb — 203Pb, 205Pb, 209Pb — 214Pb. Из них наиболее долгоживущие — 202Pb и 205Pb (с периодами полураспада 52,5 тысяч и 17,3 млн лет)[20]. Короткоживущие изотопы свинца 210Pb (радий D), 211Pb (актиний B), 212Pb (торий B) и 214Pb (радий B) имеют периоды полураспада соответственно 22,2 года, 36,1 мин, 10,64 ч и 26,8 мин (в скобках приведены сейчас редко используемые исторические названия этих изотопов). Эти четыре радиоактивных изотопа входят в состав радиоактивных рядов урана и тория и, следовательно, также встречаются в природе, хотя и в крайне малых количествах[21].
Количество ядер изотопа 204Pb (нерадиогенного и нерадиоактивного) является стабильным, в минералах свинца концентрация 204Pb во многом зависит от концентрации радиогенных изотопов, образованных как в процессе распада радиоактивных ядер, так и в процессах вторичного преобразования содержащих свинец минералов. Поскольку число радиогенных ядер, образовавшихся в результате радиоактивного распада, зависит от времени, то и абсолютные, и относительные концентрации зависят от времени образования минерала. Этим свойством пользуются при определении возраста горных пород и минералов[22].
Распространённость изотопов свинца[править | править код]
| Изотоп | 204Pb | 206Pb | 207Pb | 208Pb |
|---|---|---|---|---|
| Содержание в природе (в %) [23] | 01,40 | 024,10 | 22,1 | 52,4 |
Свинец, состав которого приведён в таблице, отражает изотопный состав свинца преимущественно в галенитах, в которых урана и тория практически нет, и породах, преимущественно осадочных, в которых количество урана находится в кларковых пределах. В радиоактивных минералах этот состав существенно отличается и зависит от вида радиоактивного элемента, слагающего минерал. В урановых минералах, таких, как уранинит UO2, настуран UO2 (урановая смолка), урановые черни, в которых существенно преобладает уран, радиогенный изотоп 206Pbрад существенно преобладает над другими изотопами свинца, и его концентрации могут достигать 90 %. Например, в урановой смолке (Сан-Сильвер, Франция) концентрация 206Pb равна 92,9 %, в урановой смолке из Шинколобве (Киншаса) — 94,25 %[24]. В ториевых минералах, например, в торите ThSiO4, существенно преобладает радиогенный изотоп 208Pbрад. Так, в монаците из Казахстана концентрация 208Pb равна 94,02 %, в монаците из пегматита Бекета (Зимбабве) — 88,8 %[15]. Имеется комплекс минералов, например, монацит (Ce, La, Nd)[PO4], циркон ZrSiO4 и др., в которых в переменных соотношениях находятся уран и торий и соответственно в разных соотношениях присутствуют все или большинство изотопов свинца. В цирконах содержание нерадиогенного свинца крайне мало, что делает их удобным объектом для уран-торий-свинцового метода датирования (метод цирконометрии).
Применение[править | править код]
- Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ.
- Азид свинца применяется как наиболее широко употребляемый детонатор (инициирующее взрывчатое вещество).
- Перхлорат свинца используется для приготовления тяжёлой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд; также он иногда применяется в мощных смесевых взрывчатых веществах, как окислитель.
- Фторид свинца(II) самостоятельно, а также совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока.
- Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях.
- Хлорид свинца PbCl2 — в качестве катодного материала в резервных источниках тока.
- Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-ЭДС 350 мкВ/К), самый широко применяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников.
- Диоксид свинца PbO2 широко применяется не только в свинцовом аккумуляторе, также на его основе производятся многие резервные химические источники тока, например, свинцово-хлорный элемент, свинцово-плавиковый элемент и другие.
- Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлёвки, в технологии цемента и свинцовокарбонатной бумаги.
- Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
- Метаборат свинца(II) Pb(BO2)2•H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора.
- Хлорид свинца(II) PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
- Хромат свинца PbCrO4 известен как хромовый жёлтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат свинца применяют в основном в производстве жёлтых пигментов.
- Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее вещество ограниченного применения. В промышленности его используют в спичечном производстве, при крашении и производстве набивке текстиля, окраске рогов и гравировке.
- Сульфат свинца PbSO4, нерастворимый в воде белый порошок, применяют в аккумуляторах, как пигмент в литографии, в технологии набивных тканей.
- Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для качественного обнаружения ионов свинца.
- Тетраэтилсвинец (C2H5)4Pb до недавнего времени применялся к качестве присадки к бензину для повышения октанового числа.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Свинец издавна применялся для изготовления пуль (а до изобретения огнестрельного оружия — других метательных снарядов, например, для пращи) благодаря своей высокой плотности и, как следствие, большому импульсу и пробивной способности снаряда.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85—90 % Sn и 15—10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Было время, когда на оболочки кабелей шла значительная часть производимого в мире свинца, благодаря хорошим влагозащитным свойствам таких изделий. Однако впоследствии свинец в существенной мере вытеснили из этой области алюминий и полимеры. Так, в странах Запада использование свинца на оболочки кабелей упало с 342 тысяч тонн в 1976 году до 51 тысячи тонн в 2002 году[25].
В медицине[править | править код]
Используется для защиты пациентов и персонала от излучения рентгеновских аппаратов[26].
В геологии[править | править код]
Измерение содержания изотопов свинца используется для определения возраста минералов и горных пород в абсолютной геохронологии. Обобщённая сводка геохронологических методов приведена в работе[22]. Уран-торий-свинцовый метод датирования основан на уравнениях (1) распада изотопов урана и тория (см. подраздел Изотопный состав). Достаточно широко применяется комбинация этих уравнений; так, для урана:
Современное изотопное отношение [27] в большинстве природных объектов на Земле одинаково и практически не зависит от вида и интенсивности протекания природных геологических процессов (единственным известным исключением является природный ядерный реактор в Окло, Габон, Африка).
Экономические показатели[править | править код]
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл. США/кг.
Страны, крупнейшие потребители свинца в 2004 году, в тысячах тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Физиологическое действие[править | править код]
Свинец и большинство его соединений токсичны[28]. Являются потенциальными канцерогенами для организма человека. Особенно ядовиты водорастворимые соединения, например, ацетат свинца(II) и летучие металлоорганические, например, тетраэтилсвинец, соединения. Токсичны также пары расплавленного свинца.
При остром отравлении наступают боли в животе, в суставах, судороги, обмороки. Свинец может накапливаться в костях, вызывая их постепенное разрушение, концентрируется в печени и почках.
Особенно опасно воздействие свинца на детей: при длительном воздействии он вызывает умственную отсталость и хронические заболевания мозга.
До принятия многими странами законодательных актов запрета применения тетраэтилсвинца в качестве антидетонационной присадки в моторные топлива, существенное загрязнение окружающей среды свинцом вызывалось выхлопами автомобильных двигателей, так как это металлоорганическое соединение свинца добавлялось в топливо с целью повышения октанового числа — так называемое этилирование бензина. В России этилированный бензин был запрещён с 15 ноября 2002 года. В Европейском союзе использование свинца существенно ограничено директивой RoHS.
ПДК соединений свинца в атмосферном воздухе — 0,003 мг/м³, в воде — 0,03 мг/л, почве — 20,0 мг/кг. Выброс свинца и его соединений в Мировой океан составляет 430—650 тысяч тонн в год.
См. также[править | править код]
- Свинцово-кислотный аккумулятор
- Интерметаллиды свинца
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 4 Редкол.:Зефиров Н. С. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 300. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8.
- ↑ 1 2 3 4 Lead: physical properties (англ.). WebElements. Дата обращения: 20 августа 2013.
- ↑ Сайфуллин Р.С., Сайфуллин А.Р. Современная форма таблицы Менделеева // Наука и жизнь № 7 , 2004
- ↑ Pb — свинец (недоступная ссылка). РХТУ. Дата обращения: 20 августа 2013. Архивировано 2 декабря 2012 года.
- ↑ 1 2 3 4 5 6 7 8 Лебедев Ю. А. Второе дыхание марафонца (о свинце). — М.: Металлургия, 1990. — 144 с. — ISBN 5-229-00435-5.
- ↑ см. фото статуэтки в книге: Eaton-Krauss M. Dawn of Egyptian Art. — Metropolitan Museum of Art, 2011. — С. 176.
- ↑ The History of Lead. Part 3
- ↑ The History of Lead. Part 1
- ↑ Аристов Н. Я. Промышленность Древней Руси. — 1866.
- ↑ 1 2 Свинец // Большая Советская Энциклопедия. 3-е изд. — М.: Советская Энциклопедия, 1976. — Т. 23. Сафлор—Соан. — С. 77.
- ↑ Rich V. The International Lead Trade. — Woodhead Publishing, 1994. — С. 10—11.
- ↑ Химия. Справочник Дидин, Аликберова
- ↑ Дмитрий Целиков. Кажется, найден «потерянный» пласт мантии (недоступная ссылка). Компьюлента (17 июля 2013). — «Материал с высоким содержанием свинца не удаётся отыскать на поверхности, потому что он практически никогда на поверхность не выходит.». Дата обращения: 18 июля 2013. Архивировано 21 июля 2013 года.
- ↑ 1 2 Войткевич Г. В., Мирошников А. Е., Поваренных А. С., Прохоров В. Г. Краткий справочник по геохимии. — М.: Недра, 1970.
- ↑ Макаров В. П. Некоторые методологические проблемы геохронологии. Материалы XI научного семинара «Система планета Земля». М.: РОО «Гармония строения Земли и планет». 2003, С.71- 95.
- ↑ Свинец — статья из Большой советской энциклопедии
- ↑ Общая химия: учебное пособие/Н. Л. Глинка. — Изд. стер. — М.: КНОРУС, 2012. — 752 с. — ISBN 978-5-406-02149-1
- ↑ Известия АН СССР, сер. Геологическая, 1978, № 11, с. 148.
- ↑ NuDat 2.8. National Nuclear Data Center. Дата обращения: 7 декабря 2020.
- ↑ Титаева Н. А. Ядерная геохимия. М.: Изд-во МГУ, 2000.
- ↑ 1 2 Шуколюков Ю. А. и др. Графические методы изотопной геологии. М.: Наука, 1976.
- ↑ Atomic weights of the elements. Review 2000 (IUPAC Technical Report). Pure Appl. Chem. Vol. 75, No. 6, pp. 683-800, (2003).
- ↑ Войткевич Г. В., Мирошников А. Е., Поваренных А. С., Прохоров В. Г. Краткий справочник по геохимии. М.: Недра, 1970.
- ↑ Thompson M. Base Metals Handbook (неопр.). — Woodhead Publishing Limited (англ.) (рус., 2006. — С. 4.2/3.
- ↑ Илья Леенсон. Свинец. Энциклопедия Кругосвет. Дата обращения: 11 июля 2013. Архивировано 15 июля 2013 года.
- ↑ Известия АН СССР, сер. Геологическая, 1978, № 11, С. 148.
- ↑ Книжников В. А., Бережной Р. В., Рубцов А. Ф., Григорян Э. А., Марченко Е. Н., Самойлов Д. Н., Соркина Н. С., Цивильно М. А. Свинец // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1984. — Т. 23. Сахароза — Сосудистый тонус. — С. 21—26 . — 544 с. — 150 800 экз.
Ссылки[править | править код]
- Свинец. Популярная библиотека химических элементов. Дата обращения: 20 августа 2013.
Данное видео продолжит рассказ о свойствах свинца:
Электропроводность
Тепло- и электропроводность металлов довольно хорошо коррелируют друг с другом. Свинец не слишком хорошо проводит тепло и к лучшим проводникам электричества тоже не относится: удельное сопротивление составляет 0,22 Ом-кв. мм/м при сопротивлении той же меди 0,017.
Коррозионная стойкость
Свинец – металл неблагородный, однако по уровню химической инертности к таковым приближается. Низкая активность и способность покрываться оксидной пленкой и обуславливает достойную коррозионную стойкость.
Во влажной сухой атмосфере металл практически не корродирует. Причем в последнем случае сероводород, угольный ангидрид и серная кислота – обычные «виновники» коррозии, на него не влияют.
Показатели коррозии в разной атмосфере такие:
- в городской (смог) – 0,00043–0,00068 мм/год,
- в морской (соли) – 0,00041–0,00056 мм/год;
- сельской – 0,00023– ,00048 мм/год.
Воздействие пресной или дистиллированной воды нулевое.
- Металл устойчив к действию хромовой, плавиковой, концентрированной уксусной, сернистой и фосфорной кислоте.
- А вот в разбавленной уксусной или азотной с концентрацией менее 70% быстро разрушается.
- Так же действует и концентрированная – более 90%, серная кислота.
Газы – хлор, сернистый газ, сероводород на металл не действуют. Однако под влиянием фтористого водорода свинец корродирует.
На коррозионные качества его влияют другие металлы. Так, контакт с железом и никак не сказывается на коррозионной стойкости, а добавка висмута или снижает стойкость вещества к кислоте.
Токсичность

Наибольшую опасность представляют собой пары металла и его пыль, поскольку в таком состоянии они легче всего проникает в организм.
Основной путь – дыхательный тракт. Часть может усвоиться и через кишечно-желудочный тракт и даже кожу при непосредственном контакте – те же свинцовые белила и краски.
- Попадая в легкие, свинец всасывается кровью, разносится по всему телу и скапливается в основном в костях. Главное его отравляющее действие связано с нарушениями в синтезе гемоглобина. Типичные признаки свинцового отравления сходны с анемией – усталость, головные боли, расстройства сна и пищеварения, но сопровождаются постоянными ноющими болями в мышцах и костях.
- Длительное отравление может вызвать «свинцовый паралич». Острое отравление провоцирует повышение давления, склерозирование сосудов и так далее.
Лечение специфическое и длительное, поскольку вывести тяжелый металл из организма непросто.
О том, какими экологическими свойствами обладает свинец, расскажем ниже.
Экологические характеристики
Загрязнение свинцом окружающей среды считается одним из самых опасных. Все изделия, где используется свинец, нуждаются в специальной утилизации, которая проводится только лицензированными службами.
К сожалению, загрязнение свинцом обеспечивается не только деятельностью предприятий, где это хоть худо-бедно, да регулируется. В городском воздухе наличие свинцовых паров обеспечивает сгорание топлива в автомобилях. На этом фоне наличие свинцовых стабилизаторов в таких, например, привычных конструкциях, как металлопластиковое окно уже не кажется стоящим внимания.
Свинец – металл, имеющий . Несмотря на токсичность, в народном хозяйстве он используется слишком широко, чтобы можно было металл чем-то заменить.
О свойствах солей свинца поведает данное видео:
ОПРЕДЕЛЕНИЕ
Свинец
— восемьдесят второй элемент Периодической таблицы. Обозначение — Pb от латинского «plumbum». Расположен в шестом периоде, IVA группе. Относится к металлам. Заряд ядра равен 82.
Свинец — голубовато-белый тяжелый металл (рис. 1). В разрезе поверхность свинца блестит. На воздухе покрывается пленкой оксидов и из-за этого тускнеет. Он очень мягок и режется ножом. Обладает низкой теплопроводностью. Плотность 11,34 г/см 3 . Температура плавления 327,46 o С, кипения 1749 o С.
Рис. 1. Свинец. Внешний вид.
Атомная и молекулярная масса свинца
Относительной молекулярная масса вещества
(M r) — это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента
(A r) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии свинец существует в виде одноатомных молекул Pb, значения его атомной и молекулярной масс совпадают. Они равны 207,2.
Изотопы свинца
Известно, что в природе свинец может находиться в виде четырех стабильных изотопов 204 Pb, 206 Pb, 207 Pb и 208 Pb. Их массовые числа равны 204, 206, 207 и 208 соответственно. Ядро атома изотопа свинца 204 Pb содержит восемьдесят два протона и сто двадцать два нейтрона, а остальные отличаются от него только числом нейтронов.
Существуют искусственные нестабильные изотопы свинца с массовыми числами от 178-ми до 215-ти, а также более десяти изомерных состояний ядер, среди которых наиболее долгоживущими являются изотопы 202 Pb и 205 Pb, периоды полураспада которых равны 52,5 тысячи и 15,3 млн. лет соответственно.
Ионы свинца
На внешнем энергетическом уровне атома свинца имеется четыре электрона, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5р 6 5d 10 6s 2 6р 2 .
В результате химического взаимодействия свинец отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Pb 0 -2e → Pb 2+ ;
Pb 0 -4e → Pb 4+ .
Молекула и атом свинца
В свободном состоянии свинец существует в виде одноатомных молекул Pb. Приведем некоторые свойства, характеризующие атом и молекулу свинца:
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | К раствору нитрата свинца (II) массой 80г (массовая доля соли 6,6%) прилили раствор йодида натрия массой 60 г (массовая доля NaI 5%). Рассчитайте массу йодида свинца (II), выпадающего в осадок. |
| Решение | Запишем уравнение реакции взаимодействия нитрата свинца (II) с иодидом натрия:
Pb(NO 3) 2 + 2NaI = PbI 2 ↓ + 2NaNO 3 . Найдем массы растворенных веществ нитрата свинца (II) и иодидом натрия: ω = m solute / m solution × 100%; m solute = ω /100%×m solution ; m solute (Pb(NO 3) 2)=ω(Pb(NO 3) 2) /100%×m solution (Pb(NO 3) 2); m solute (Pb(NO 3) 2) = 6,6 /100%× 80 = 5,28 г; m solute (NaI) = ω (NaI) /100%×m solution (NaI); m solute (NaI) =5 /100% × 60 = 3 г. Найдем количество моль веществ, вступивших в реакцию (молярная масса нитрата свинца (II) равна 331 г/моль, иодида натрия — 150 г/моль) и определим, какое из них находится в избытке: n(Pb(NO 3) 2) =m solute (Pb(NO 3) 2) / M (Pb(NO 3) 2); n (Pb(NO 3) 2) = 5,28 / 331 = 0,016моль. n(NaI) =m solute (NaI) / M (NaI); n (NaI) = 3 / 150 = 0,02 моль. Иодид натрия находится в избытке, следовательно, все дальнейшие расчеты ведем по нитрату свинца (II). n (Pb(NO 3) 2) : n (PbI 2) = 1:1, т.е. n (Pb(NO 3) 2) = n (PbI 2) = 0,016 моль. Тогда масса иодида свинца (II) будет равна (молярная масса — 461 г/моль): m (PbI 2) = n (PbI 2) × M (PbI 2); m (PbI 2) = 0,016 × 461 = 7,376 г. |
| Ответ | Масса иодида свинца (II) равна 7,376 г. |
Свинец – мягкий тяжелый металл серебристо-серого цвета, блестящий, но довольно быстро теряющий свой блеск. Наравне с и относится к элементам, известным человечеству с самых древних времен. Использовался свинец весьма широко, да и сейчас его применение чрезвычайно разнообразно. Итак, сегодня мы узнаем, свинец — это металл или неметалл, а также цветной или черный металл, узнаем о его видах, свойствах, применении и добыче.
Свинец – элемент 14 группы таблицы Д. И. Менделеева, расположен в одной группе с углеродом, кремнием и оловом. Свинец является типичным металлом, но инертным: вступает в реакции крайне неохотно даже с сильными кислотами.
Молекулярная масса – 82. Это не только указывает на так называемое магическое число протонов в ядре, но и на большой вес вещества. Самые интересные качества металла связаны именно с его большим весом.
Понятие и особенности металла свинец рассмотрены в данном видео:
Понятие и особенности
Свинец – металл достаточно мягкий при нормальной температуре, его несложно процарапать или расплющить. Такая пластичность позволяет получить листы и прутки металла очень малой толщины и любой формы.
Ковкость и была одной из причин, по которой свинец стал использоваться с самой древности.
Свинцовые водопроводные трубы Древнего Рима общеизвестны. С тех пор такого рода водопровод устанавливался не единожды и не в одном месте, но действовал не столь долго. Что, без сомнений, сохранило немалое количество человеческих жизней, так как свинец, увы, при длительном контакте с водой, в конце концов, образует растворимые соединения, которые являются токсичными.
Токсичность – то самое свойство металла, благодаря которому его применение стараются ограничить. Пары металла и множество его органических и неорганических солей очень опасны и для окружающей среды, и для людей. В основном, конечно, опасности подвергаются работники таких предприятий и жители зоны вокруг промышленного объекта. 57% выбрасывается вместе с большими объемами запыленного газа, а 37% – с конвертерными газами. Проблема этого одна – несовершенство очистительных установок.
Однако и в других случаях люди становятся жертвами свинцового загрязнения. До недавнего времени самым эффективным и популярным стабилизатором бензина являлся тетраэтилсвинец. При сгорании топлива он выделялся в атмосферу и загрязнял ее.
Зато свинец обладает другим, крайне полезным и необходимым качеством – способностью поглощать радиоактивное излучение. Причем жесткую составляющую металл поглощает даже лучше, чем мягкую. Свинцовый слой толщиной в 20 см способен защитить от всех видов излучения, известных на Земле и в ближайшем космосе.
Плюсы и минусы

К плюсам с точки зрения народного хозяйства можно отнести:
- легкоплавкость и ковкость – это позволяет формировать из металла изделия любой степени сложности и любой тонкости. Так, для производства звукопоглощающих мембран используются свинцовые пластины толщиной в 0,3–0,4 мм;
- свинец в состоянии образовать сплав с другими металлами (в т.ч. , и др.) которые при обычных условиях друг с другом не сплавляются, на этом качестве основано его применение в качестве припоя;
- металл поглощает радиационное излучение. На сегодня все элементы защиты от радиации – от одежды до отделки рентген-кабинетов и помещений на испытательных полигонах, производятся из свинца;
- металл устойчив к кислотам, уступая в этом лишь благородному золоту и серебру. Так что его активно применяют для облицовки кислотоупорной аппаратуры. По этим же причинам из него производят трубы для передачи кислоты и для стоков на опасных химических предприятиях;
- свинцовый аккумулятор пока что не потерял своего значения в электротехнике, так как позволяет получить ток большого напряжения;
- низкая стоимость – свинец в 1,5 раза дешевле цинка, в 3 раза меди, и едва и не в 10 раз олова. Этим объясняется очень большая выгодность применения именно свинца, а не других металлов.
Недостатками являются:
- токсичность – использование металла в любом виде производства составляет опасность для персонала, а при авариях – чрезвычайную опасность для окружающей среды и населения. Свинец относится к веществам 1 класса опасности;
- изделия из свинца нельзя выбрасывать как обычный мусор. Они требуют утилизации и порой весьма затратной. Потому вопрос о вторичной переработке металла всегда актуален;
- свинец – металл мягкий, так что использоваться в качестве конструкционного материала не может. Учитывая все остальные его качества это, скорее, стоит считать плюсом.
Свойства и характеристики
Свинец – мягкий, ковкий, но при этом тяжелый и плотный металл. Молекулярная решетка – кубическая, гранецентрированная. Прочность его невелика, а вот пластичность превосходна. Физические характеристики металла таковы:
- плотность при нормальной температуре 11,34 г/куб см;
- температура плавления – 327,46 С;
- температуры кипения – 1749 С;
- стойкость к нагрузке на разрыв – 12– 3 МПа;
- стойкость к нагрузке на сжатие – 50 МПа;
- твердость по Бринеллю – 3,2–3,8 НВ;
- теплопроводность – 33,5 вт/(м·К);
- удельное сопротивление составляет 0,22 Ом-кв. мм/м.
Как и всякий металл он проводит электроток, хотя, надо отметить, и намного хуже меди – почти в 11 раз.
Однако металл обладает другими интересным свойством: при температуре 7,26 К он становится сверхпроводником и проводит электричество без всякого сопротивления. Свинец был первым элементом, который проявил это свойство.
На воздухе кусок металла или изделие из него довольно быстро пассивируется оксидной пленкой, которая успешно защищает металл от внешнего воздействия. Да и само вещество не склонно к химической активности, из-за чего его и используют при изготовлении кислотоупорного оборудования.
Почти такими же устойчивыми к коррозии являются и краски, включающие соединения свинца. Из-за токсичности они не применяются внутри помещений, однако успешно используются при окрашивании мостов, например, каркасных сооружений и так далее.
О том, как сделать чистый свинец, расскажет видео ниже:
Структура и состав
Во всем диапазоне температур выделяют только одну модификацию свинца, так что и под действием температуры, и с течением времени свойства металл изменяет совершенно закономерно. Никаких резких переходов, когда качества меняются кардинально, не отмечено.
Производство металла

Производство пирометаллургическим методом включает следующие стадии:
- добыча руды;
- дробление и обогащение в основном флотационным методом;
- плавка с целью получения чернового свинца – восстановительная, горновая, щелочная и так далее;
- рафинирование, то есть, очистка черного свинца от примесей и получение чистого металла.
Несмотря на одинаковость технологии производства оборудование может использоваться самое разное. Это зависит от содержания металла в руде, объемов производства, требований к качеству продукта и так далее.
Об использовании и цене за 1 кг свинца читайте ниже.
Область применения
Первое – изготовление водопроводов и предметов быта, к счастью, относится к довольно давним временам. На сегодня в жилище металл попадает только с защитным слоем и при условии отсутствия контактов с пищей, водой и человеком.
- А вот использование свинца для сплавов и в качестве припоя началось еще на заре цивилизации и продолжается до сих пор.
- Свинец – металл стратегического значения, особенно с тех пор, как из него стали отливать пули. Боеприпас для стрелкового и спортивного оружия и сейчас изготавливается только из свинца. А его соединения применяются в качестве взрывчатых веществ.
- 75% производимого в мире металла используется для производства свинцовых аккумуляторов. Вещество продолжает оставаться одним из главных элементов химических источников тока.
- Коррозийная устойчивость металла эксплуатируется при изготовлении кислотоупорной аппаратуры, трубопроводов, а также защитных оболочек для силовых кабелей.
- Ну и, конечно, свинец применяют при оборудовании рентген-кабинетов: облицовка стен, потолка, пола, защитные перегородки, защитные костюмы – все изготавливается с участием свинца. На испытательных полигонах, в том числе и ядерных, металл незаменим.
Стоимость металлов определяется на нескольких биржах мирового значения. Наиболее известной является Лондонская биржа металлов. Стоимость свинца в октябре 2016 года составляет 2087,25 $ за тонну.
Свинец – металл, очень востребованный в современной промышленности. Некоторые его качества – коррозионная стойкость, способность поглощать жесткое излучение, совершенно уникальны и делают металл незаменимым несмотря на его высокую токсичность.
Данное видео расскажет, что будет если вылить свинец в воду:
Свинец – это химический элемент с атомным номером 82 и символом Pb (от латинского plumbum – слиток). Это тяжелый металл с плотностью, превышающей плотность большинства обычных материалов; свинец мягкий, податливый и плавится при относительно низких температурах. Свежесрубленный свинец имеет голубовато-белый оттенок; он притупляется до тускло-серого при воздействии воздуха. Свинец имеет второй по величине атомный номер классически устойчивых элементов и стоит в конце трех основных цепочек распада более тяжелых элементов. Свинец является относительно нереактивным постпереходным элементом. Его слабый металлический характер иллюстрируется его амфотерной природой (оксиды свинца и свинец реагируют как с кислотами, так и с основаниями) и склонностью к образованию ковалентных связей. Соединения свинца обычно находятся в состоянии окисления +2, а не +4, как правило, с более легкими членами углеродной группы. Исключения, в основном, ограничены органическими соединениями. Как и более легкие члены этой группы, свинец проявляет тенденцию связываться сам с собой; он может образовывать цепи, кольца и многогранные структуры. Свинец легко извлекается из свинцовых руд и был известен уже доисторическим людям в Западной Азии. Основная руда свинца, галена, часто содержит в себе серебро, и интерес к серебру способствовал широкомасштабной экстракции свинца и его использованию в Древнем Риме. Производство свинца сократилось после падения Римской империи и не доходило до тех же уровней вплоть до промышленной революции. В настоящее время, мировое производство свинца составляет около десяти миллионов тонн в год; вторичная добыча от переработки составляет более половины от этого количества. Свинец обладает несколькими свойствами, которые делают его полезным: высокая плотность, низкая температура плавления, пластичность и относительная инертность к окислению. В сочетании с относительным изобилием и низкой стоимостью, эти факторы привели к широкому использованию свинца в строительстве, сантехнике, производстве батарей, пуль, весов, припоев, сплавов олова со свинцом, плавких сплавов и радиационной защите. В конце 19-го века, свинец был признан высокотоксичным, и с тех пор его применение было постепенно сокращено. Свинец является нейротоксином, который накапливается в мягких тканях и костях, повреждая нервную систему и вызывая нарушения головного мозга, а у млекопитающих – расстройства крови.
Физические свойства
Атомные свойства
Атом свинца имеет 82 электрона, расположенных в электронной конфигурации 4f145d106s26p2. Объединенная первая и вторая энергии ионизации – полная энергия, необходимая для удаления двух 6p электронов – близка к энергии олова, верхнего соседа свинца в углеродной группе. Это необычно; энергии ионизации обычно идут вниз по группе, так как внешние электроны элемента становятся более отдаленными от ядра и более экранированы меньшими орбиталями. Сходство энергий ионизации обусловлено сокращением лантанидов – уменьшением радиусов элементов из лантана (атомный номер 57) до лютеция (71) и относительно малыми радиусами элементов после гафния (72). Это связано с плохим экранированием ядра электронами лантанида. Объединенные первые четыре энергии ионизации свинца превышают объёмы олова , вопреки предсказаниям периодических тенденций. Релятивистские эффекты, которые становятся значительными в более тяжелых атомах, способствуют такому поведению. Одним из таких эффектов является эффект инертной пары: электроны 6s свинца неохотно участвуют в связывании, делая расстояние между ближайшими атомами в кристаллическом свинце необычайно длинными .
Более легкие углеродные группы свинца образуют стабильные или метастабильные аллотропы с тетраэдрически координированной и ковалентно связанной алмазной кубической структурой. Энергетические уровни их внешних s- и p-орбиталей достаточно близки, чтобы позволить смешивать их с четырьмя гибридными sp3-орбиталями. В свинце, эффект инертных пар увеличивает расстояние между его s- и p-орбиталями, и разрыв не может быть преодолен энергией, которая будет высвобождаться дополнительными связями после гибридизации. В отличие от алмазной кубической структуры, свинец образует металлические связи, в которых только p-электроны делокализуются и разделяются между ионами Pb2 +. Следовательно, свинец имеет гранецентрированную кубическую структуру, такую как двухвалентные металлы одинакового размера, кальций и стронций.
Большие объемы
Чистый свинец имеет яркий серебристый цвет с оттенком синего. Он тускнеет при контакте с влажным воздухом, и его оттенок зависит от преобладающих условий. Характерные свойства свинца включают высокую плотность, пластичность и высокую устойчивость к коррозии (из-за пассивации).
Плотная кубическая структура и высокий атомный вес свинца приводит к плотности 11,34 г / см3, что больше, чем у обычных металлов, таких как железо (7,87 г / см3), медь (8,93 г / см3) и цинк (7,14 г / см3).
Некоторые более редкие металлы имеют большую плотность: вольфрам и золото – 19,3 г / см3, а осмий – самый плотный металл – имеет плотность 22,59 г / см3, что почти в два раза больше, чем у свинца .
Свинец – очень мягкий металл с твердостью по Моосу 1,5; его можно поцарапать ногтем. Он довольно ковкий и в некотором смысле пластичный. Объемный модуль свинца – мера его легкости сжимаемости – составляет 45,8 ГПа. Для сравнения, объемный модуль алюминия составляет 75,2 ГПа; меди – 137,8 ГПа; а мягкой стали – 160-169 ГПа. Прочность на растяжение при 12-17 МПа низка (у алюминия в 6 раз выше, у меди – в 10 раз, а у мягкой стали – в 15 раз); её можно усилить добавлением небольшого количества меди или сурьмы.
Точка плавления свинца – 327,5 ° C (621,5 ° F) – является низкой по сравнению с большинством металлов. Его температура кипения составляет 1749 °C (3180 °F) и является самой низкой среди элементов углеродной группы. Электросопротивление свинца при 20 °С составляет 192 нанометра, что почти на порядок выше, чем у других промышленных металлов (медь при 15,43 nΩ·m, золото 20,51 nΩ·m и алюминий при 24,15 nΩ·m). Свинец представляет собой сверхпроводник при температурах ниже 7,19 К, это самая высокая критическая температура всех сверхпроводников I типа. Свинец является третьим по величине элементным сверхпроводником.
Изотопы свинца
Естественный свинец состоит из четырех устойчивых изотопов с массовым числом 204, 206, 207 и 208, и следов пяти короткоживущих радиоизотопов . Большое количество изотопов согласуется с тем, что число атомов свинца является четным. Свинец имеет магическое число протонов (82), для которых модель ядерной оболочки точно предсказывает особенно стабильное ядро. Свинец-208 имеет 126 нейтронов, другое магическое число, которое может объяснить, почему свинец-208 необычайно устойчив. Учитывая его высокий атомный номер, свинец является самым тяжелым элементом, естественные изотопы которого считаются стабильными. Это звание ранее принадлежало висмуту, имеющему атомный номер 83, до тех пор, пока в 2003 году не было обнаружено, что его единственный изначальный изотоп, висмут-209, очень медленно распадается. Четыре стабильных изотопа свинца теоретически могли пройти альфа-распад на изотопы ртути с высвобождением энергии, но это нигде не наблюдалось, их предсказанные периоды полураспада варьируются от 1035 до 10189 лет. Три стабильных изотопа встречаются в трех из четырех основных цепей распада: свинец-206, свинец-207 и свинец-208 являются конечными продуктами распада урана-238, урана-235 и тория-232 соответственно; эти цепочки распада называются сериями урана, сериями актиния и сериями тория. Их изотопная концентрация в образце природной породы очень зависит от наличия этих трех родительских изотопов урана и тория. Например, относительное обилие свинца-208 может варьироваться от 52% в нормальных образцах до 90% в ториевых рудах, поэтому стандартная атомная масса свинца дается только в одном знаке после запятой . С течением времени, отношение свинца-206 и свинца-207 к свинцу-204 увеличивается, поскольку первые два дополняются радиоактивным распадом более тяжелых элементов, в то время как последний не дополняется; это позволяет осуществлять связи свинец-свинец. Поскольку уран распадается на свинец, их относительные количества меняются; это основа для создания урана-свинца. Помимо стабильных изотопов, составляющих почти весь свинец, который существует естественным образом, имеются следовые количества нескольких радиоактивных изотопов. Один из них – свинец-210; хотя его период полураспада составляет всего 22,3 года, в природе присутствуют лишь небольшие количества этого изотопа, потому что свинец-210 вырабатывается длинным циклом распада, который начинается с урана-238 (который присутствует на Земле миллиарды лет). В цепях распада урана-235, тория-232 и урана-238 присутствуют свинец-211, -212 и -214, поэтому естественным образом обнаруживаются следы всех этих трех изотопов свинца. Небольшие следы свинца-209 возникают из-за очень редкого кластерного распада радия-223, одного из дочерних продуктов природного урана-235. Свинец-210 особенно полезен для того, чтобы помочь идентифицировать возраст образцов путем измерения его отношения к свинцу-206 (оба изотопа присутствуют в одной цепи распада). Всего было синтезировано 43 изотопа свинца, с массовыми номерами 178-220. Свинец-205 является наиболее стабильным с периодом полураспада около 1,5 × 107 лет. [I] Вторым по стабильности является свинец-202, период полураспада которого составляет около 53000 лет, дольше, чем у любого естественного следового радиоизотопа. Оба являются вымершими радионуклидами, которые были произведены в звездах вместе со стабильными изотопами свинца, но давно уже распались.
Химия
Большой объем свинца, подвергнутый воздействию влажного воздуха, образует защитный слой различного состава. Сульфит или хлорид также могут присутствовать в городских или морских условиях. Этот слой делает большой объем свинца эффективно химически инертным в воздухе. Мелкопорошковый свинец, как и многие металлы, является пирофорным и горит голубовато-белым пламенем .
Фтор вступает в реакцию со свинцом при комнатной температуре, образуя фторид свинца (II). Реакция с хлором аналогична, но требует нагревания, так как полученный хлоридный слой уменьшает реакционную способность элементов. Расплавленный свинец реагирует с халькогенами с образованием халькогенидов свинца (II).
Металл свинца не подвергается воздействию разбавленной серной кислоты, а растворяется в концентрированной форме. Он медленно реагирует с соляной кислотой и энергично – с азотной кислотой с образованием оксидов азота и нитрата свинца (II) . Органические кислоты, такие как уксусная кислота, растворяют свинец в присутствии кислорода. Концентрированные щелочи растворяют свинец и формируют плюмбиты.
Неорганические соединения
Свинец имеет два основных состояния окисления: +4 и +2. Четырехвалентное состояние является общим для углеродной группы. Двухвалентное состояние редко встречается для углерода и кремния, незначительно для германия, важно (но не преобладающее) для олова, и более важно для свинца. Это объясняется релятивистскими эффектами, в частности, эффектом инертных пар, который проявляется, когда наблюдается большая разница в электроотрицательности между свинцовыми и оксидными, галогенидными или нитридными анионами, что приводит к значительным частичным положительным зарядам свинца. В результате наблюдается более сильное сжатие 6s-орбитали свинца, чем 6p-орбитали, что делает свинец весьма инертным в ионных соединениях. Это менее применимо к соединениям, в которых свинец образует ковалентные связи с элементами аналогичной электроотрицательности, такими как углерод в органолептических соединениях. В таких соединениях, 6s и 6p-орбитали имеют одинаковый размер, и sp3-гибридизация все еще энергетически выгодна. Свинец, как и углерод, преимущественно четырехвалентный в таких соединениях.
Относительно большая разница в электроотрицательности свинца (II) при 1,87 и свинца (IV) составляет 2,33. Эта разница подчеркивает обратную тенденцию повышения устойчивости состояния окисления +4 с понижением концентрации углерода; олово, для сравнения, имеет значения 1,80 в состоянии окисления +2 и 1,96 в состоянии +4.
Соединения свинца (II) характерны для неорганической химии свинца. Даже сильные окислители, такие как фтор и хлор, реагируют со свинцом при комнатной температуре, образуя только PbF2 и PbCl2 . Большинство из них менее ионны, чем соединения других металлов, и поэтому они в значительной степени нерастворимы. Ионы свинца (II) обычно бесцветны в растворе и частично гидролизуются с образованием Pb (OH)+ и, наконец, Pb4 (OH) 4 (в котором гидроксильные ионы действуют как мостиковые лиганды). В отличие от ионов олова (II), они не являются восстанавливающими агентами. Методы идентификации присутствия иона Pb2+ в воде обычно полагаются на осаждение хлорида свинца (II) с использованием разбавленной соляной кислоты. Поскольку хлоридная соль немного растворима в воде, затем предпринимается попытка осаждения сульфида свинца (II) путем барботирования сероводорода через раствор.
Моноксид свинца существует в двух полиморфах: красный α-PbO и желтый β-PbO, последний стабилен только при температуре выше 488 °C. Это наиболее часто используемое соединение свинца. Гидроокись свинца (II) может существовать только в растворе; известно, что она образует плюмбитные анионы. Свинец обычно реагирует с более тяжелыми халькогенами. Сульфид свинца представляет собой полупроводник, фотопроводник и чрезвычайно чувствительный детектор инфракрасного излучения. Другие два халькогенида, селенид свинца и теллурид свинца, также являются фотопроводниками. Они необычны тем, что их цвет становится тем светлее, чем ниже группа.
Дигалиды свинца хорошо описаны; они включают диастатид и смешанные галогениды, такие как PbFCl. Относительная нерастворимость последних является полезной основой для гравиметрического определения фтора. Дифторид был первым твердым ионопроводящим соединением, которое было обнаружено (в 1834 году Майклом Фарадеем). Другие дигалогениды разлагаются при воздействии ультрафиолетового или видимого света, особенно дийодид. Известно много псевдогалогенидов свинца. Свинец (II) образует большое количество галогенидных координационных комплексов, таких как 2-, 4- и анион n5n-цепи.
Сульфат свинца (II) нерастворим в воде, как и сульфаты других тяжелых двухвалентных катионов. Нитрат свинца (II) и ацетат свинца (II) являются очень растворимыми, и это используется при синтезе других соединений свинца .
Известно несколько неорганических соединений свинца (IV), и они обычно являются сильными окислителями или существуют только в сильнокислотных растворах . Оксид свинца (II) дает смешанный оксид при дальнейшем окислении, Pb3O4. Он описывается как оксид свинца (II, IV) или структурно 2PbO·PbO2 и является наиболее известным смешанным валентным соединением свинца. Двуокись свинца является сильным окислителем, способным окислять хлористоводородную кислоту до газообразного хлора. Это связано с тем, что ожидаемый PbCl4, который будет производиться, нестабилен и спонтанно разлагается до PbCl2 и Cl2. Аналогично монооксиду свинца, диоксид свинца способен образовывать вспененные анионы. Дисульфид свинца и диселенид свинца устойчивы при высоких давлениях. Тетрафторид свинца, желтый кристаллический порошок, стабилен, но в меньшей степени, чем дифторид. Тетрахлорид свинца (желтое масло) разлагается при комнатной температуре, тетрабромид свинца еще менее стабилен, а существование тетрайодида свинца оспаривается.
Другие состояния окисления
Некоторые соединения свинца существуют в формальных состояниях окисления, отличных от +4 или +2. Свинец (III) может быть получен в качестве промежуточного соединения между свинцом (II) и свинцом (IV) в более крупных органолептических комплексах; это состояние окисления нестабильно, так как и ион свинца (III), и более крупные комплексы, содержащие его, являются радикалами. То же самое относится и к свинцу (I), который можно найти в таких видах. Известны многочисленные смешанные оксиды свинца (II, IV). Когда PbO2 нагревается на воздухе, он становится Pb12O19 при 293 °C, Pb12O17 при 351 °C, Pb3O4 при 374 °C и, наконец, PbO при 605 °C. Еще один полуторный оксид Pb2O3 может быть получен при высоком давлении наряду с несколькими нестехиометрическими фазами. Многие из них показывают дефектные структуры флюорита, в которых некоторые атомы кислорода заменяются пустотами: PbO можно рассматривать как имеющий такую структуру, причем каждый альтернативный слой атомов кислорода отсутствует. Отрицательные состояния окисления могут возникать как фазы Цинтля, как либо в случае Ba2Pb, причем свинец формально представляет собой свинец (-IV), или как в случае чувствительных к кислороду кольцеобразных или полиэдрических кластерных ионов, таких как тригональный бипирамидный ион Pb52-i, где два свинцовых атома – свинец (- I), а три – свинец (0). В таких анионах, каждый атом находится на полиэдральной вершине и вносит два электрона в каждую ковалентную связь по краю от их sp3-гибридных орбиталей, а остальные два являются внешней одиночной парой. Они могут быть сформированы в жидком аммиаке путем восстановления свинца натрием.
Свинецорганическое соединение
Свинец может образовывать многосвязные цепи, и это свойство он разделяет с более легким своим гомологом, углеродом. Его способность к этому намного меньше, потому что энергия связи Pb-Pb в три с половиной раза ниже, чем у C-C-связи. Сам с собой, свинец может строить металло-металлические связи до третьего порядка. С углеродом, свинец формирует свинецорганические соединения, сходные с, но обычно менее стабильные, чем типичные органические соединения (из-за слабости связи Pb-C). Это делает металлоорганическую химию свинца гораздо менее широкой, чем у олова. Свинец преимущественно образует органические соединения (IV), даже если это образование начинается с неорганических реагентов свинца (II); известно очень мало соединений органолата (II). Наиболее хорошо охарактеризованными исключениями являются Pb 2 и Pb (η5-C5H5)2. Свинцовый аналог простейшего органического соединения, метан, является плюмбаном. Плюмбан может быть получен в реакции между металлическим свинцом и атомарным водородом. Два простых производных, тетраметиладин и тетраэтилэлид, являются наиболее известными свинецорганическими соединениями. Эти соединения являются относительно стабильными: тетраэтилэлид начинает разлагаться только при 100 °С или при воздействии солнечного света или ультрафиолетового излучения. (Тетрафенилсвинец еще более термически устойчив, разлагаясь при 270 °C). С натрием-металлом, свинец легко образует эквимолярный сплав, который реагирует с алкилгалогенидами с образованием металлоорганических соединений, таких как тетраэтилэлид. Окислительная природа многих органоорганических соединений также используется: тетраацетат свинца является важным лабораторным реагентом для окисления в органической химии, а тетраэтилэлид производился в больших количествах, чем любое другое металлоорганическое соединение . Другие органические соединения менее химически стабильны. Для многих органических соединений не существует свинцового аналога.
Происхождение и распространенность
В космосе
Распространенность свинца на частицу в Солнечной системе составляет 0,121 чнм (частей на миллиард). Эта цифра в два с половиной раза выше, чем у платины, в восемь раз выше, чем у ртути, и в 17 раз выше, чем у золота. Количество свинца во Вселенной медленно увеличивается, поскольку самые тяжелые атомы (все из которых нестабильны) постепенно распадаются на свинец. Обилие свинца в Солнечной системе с момента её образования 4,5 миллиарда лет назад увеличилось примерно на 0,75%. Таблица численности изотопов солнечной системы показывает, что свинец, несмотря на его относительно высокий атомный номер, более распространен, чем большинство других элементов с атомными числами больше 40. Изначальный свинец, который содержит изотопы свинца-204, свинца-206, свинца-207 и свинца-208-, в основном, были созданы в результате повторяющихся процессов захвата нейтронов, происходящих в звездах. Двумя основными режимами захвата являются s- и r-процессы. В s-процессе (s означает «медленный»), захваты разделяются годами или десятилетиями, позволяя менее стабильным ядрам проходить бета-распад. Устойчивое ядро таллия-203 может захватить нейтрон и стать таллием-204; это вещество подвергается бета-распаду, давая стабильный свинец-204; при захвате другого нейтрона, он становится свинцом-205, период полураспада которого составляет около 15 миллионов лет. Дальнейшие захваты приводят к образованию свинца-206, свинца-207 и свинца-208. При захвате другого нейтрона, свинец-208 становится свинцом-209, который быстро распадается на висмут-209. При захвате другого нейтрона, висмут-209 становится висмутом-210, бета которого распадается на полоний-210, а альфа распадается на свинец-206. Цикл, следовательно, заканчивается у свинца-206, свинца-207, свинца-208 и висмута-209.
В r-процессе (r означает «быстрый»), захваты бывают быстрее, чем ядра могут распадаться. Это происходит в средах с высокой плотностью нейтронов, таких как сверхновая или слияние двух нейтронных звезд. Поток нейтронов может быть порядка 1022 нейтронов на квадратный сантиметр в секунду. R-процесс не формирует столько же свинца, сколько s-процесс. Он имеет тенденцию останавливаться, как только нейтрон-богатые ядра достигают 126 нейтронов. В этот момент, нейтроны располагаются в полных оболочках в атомном ядре, и становится сложнее энергетически вместить большее их количество. Когда поток нейтронов спадает, их бета-ядра распадаются на стабильные изотопы осмия, иридия и платины.
На Земле
Свинец классифицируется как халькофил по классификации Гольдшмидта, что означает, что он обычно встречается в сочетании с серой. Он редко встречается в своей естественной металлической форме. Многие минералы свинца относительно легки и, в течение истории Земли, остались в коре, а не погружались глубже в недра Земли. Это объясняет относительно высокий уровень содержания свинца в коре, 14 чнм; это 38-й наиболее распространенный элемент в коре. Основным свинцовым минералом является галенит (PbS), который, в основном, содержится в цинковых рудах. Большинство других минералов свинца в какой-то мере связаны с галенитом; буланжерит, Pb5Sb4S11, представляет собой смешанный сульфид, полученный из галенита; англезит, PbSO4, является продуктом окисления галенита; а серусит или белая свинцовая руда, PbCO3, является продуктом разложения галенита. Мышьяк, олово, сурьма, серебро, золото, медь и висмут являются распространенными примесями в свинцовых минералах.
Мировые ресурсы свинца превышают 2 миллиарда тонн. Значительные запасы свинца были обнаружены в Австралии, Китае, Ирландии, Мексике, Перу, Португалии, России и США. Глобальные резервы – ресурсы, которые экономически целесообразно добывать – в 2015 году составили 89 млн. тонн, 35 млн из которых находятся в Австралии, 15,8 млн – в Китае, и 9,2 млн. – в России. Типичные фоновые концентрации свинца не превышают 0,1 мкг / м3 в атмосфере; 100 мг / кг в почве; и 5 мкг / л в пресной воде и морской воде.
Этимология
Современное английское слово «lead» (свинец) имеет германское происхождение; оно происходит из среднеанглийского и староанглийского языка (со знаком долготы над гласным «е», означающим, что гласный звук этой буквы длинный). Староанглийское слово происходит от гипотетического реконструированного протогерманского *lauda- («lead»). Согласно принятой лингвистической теории, это слово «родило» потомков на нескольких германских языках с точно таким же значением. Происхождение протогерманского *lauda не однозначно в лингвистическом сообществе. Согласно одной из гипотез, это слово является производным от протоиндоевропейского *lAudh- («свинец»). Согласно другой гипотезе, это слово заимствовано из прото-кельтского * ɸloud-io- («свинец»). Это слово связано с латинским plumbum, который давал этому элементу химический символ Pb. Слово *ɸloud-io- также может быть источником протогерманского *bliwa- (что также означает «свинец»), из которого вытекает немецкое Blei. Название химического элемента не связано с глаголом такого же написания, полученного из протогерманского *layijan- («to lead»).
История
Предыстория и ранняя история
Металлические свинцовые бусины, относящиеся к 7000-6500 г. до н.э., найденные в Малой Азии, могут представлять собой первый пример плавки металлов. В то время, у свинца было несколько применений (если вообще было) из-за его мягкости и блеклого внешнего вида. Основной причиной распространения производства свинца была его связь с серебром, которое может быть получено путем сжигания галенита (общего свинцового минерала). Древние египтяне первыми использовали свинец в косметике, что распространилось на Древнюю Грецию и за ее пределы. Египтяне, возможно, использовали свинец в качестве грузила в рыболовных сетях, а также при изготовлении глазури, очков, эмали и украшений. Различные цивилизации Плодородного Полумесяца использовали свинец в качестве письменного материала, как валюту и в строительстве. Свинец использовался в древнекитайском королевском дворе в качестве стимулятора, в качестве валюты и в качестве противозачаточного средства. В цивилизации долины Инда и у мезоамериканцев, свинец использовался для изготовления амулетов; восточные и южноафриканские народы использовали свинец при волочении проволоки.
Классическая эпоха
Поскольку серебро широко использовалось в качестве декоративного материала и средства обмена, свинцовые отложения стали обрабатываться в Малой Азии с 3000 г. до н.э.; позже месторождения свинца были разработаны в Эгейском и Лорионском районах. Эти три региона, в совокупности, доминировали в производстве добытого свинца до приблизительно 1200 г. до н.э. С 2000 года до н.э., финикийцы работали на месторождениях на Иберийском полуострове; к 1600 г. до н.э. добыча свинца существовала на Кипре, в Греции и на Сицилии .
Территориальная экспансия Рима в Европе и Средиземноморье, а также развитие горной промышленности привели к тому, что эта область стала крупнейшим производителем свинца в классическую эпоху, при этом ежегодный объем производства достиг 80000 тонн. Как и их предшественники, римляне получали свинец, главным образом, как побочный продукт плавки серебра. Ведущими добытчиками были Центральная Европа, Британия, Балканы, Греция, Анатолия и Испания, на долю которых приходится 40% мирового производства свинца.
Свинец использовался для изготовления водопроводных труб в Римской империи; латинское слово, обозначающее этот металл, plumbum, является источником английского слова «plumbing» (сантехника). Легкость в обращении с данным металлом и его устойчивость к коррозии обеспечили его широкое применение в других областях, включая фармацевтические препараты, кровельные материалы, валюту и военное обеспечение. Писатели того времени, такие как Катон-старший, Колумелла и Плиний Старший, рекомендовали свинцовые сосуды для приготовления подсластителей и консервантов, добавленных к вину и пище. Свинец давал приятный вкус из-за образования «сахара свинца» (ацетат свинца (II), тогда как медные или бронзовые сосуды могли придать пище горький вкус из-за образования вердигров.
Этот металл был, безусловно, наиболее распространенным материалом в классической древности, и уместно сослаться на (римскую) Свинцовую Эру. Свинец для римлян находился в столь же широком употреблении, как для нас пластик.
Римский автор Витрувий сообщил об опасностях, которые свинец может представлять для здоровья, и современные авторы предположили, что отравление свинцом сыграло важную роль в упадке Римской империи. [l] Другие исследователи критиковали такие утверждения, указывая, например, что не все боли в животе были вызваны отравлением свинцом. Согласно археологическим исследованиям, римские свинцовые трубы увеличили уровни свинца в водопроводной воде, но такой эффект «вряд ли был бы действительно вредным». Жертв отравления свинцом стали называть «сатурнинами», в честь страшного отца богов Сатурна. По ассоциации с этим, свинец считался «отцом» всех металлов. Его статус в римском обществе был низким, поскольку он был легко доступенным и дешевым.
Путаница с оловом и сурьмой
В классическую эпоху (и даже до XVII века), олово часто не отличали от свинца: римляне называли свинец plumbum nigrum («черный свинец»), а олово – plumbum candidum («светлый свинец»). Связь свинца и олова можно проследить и в других языках: слово «olovo» на чешском языке означает «свинец», но на русском языке родственное олово означает «олово». Кроме этого, свинец имеет близкое отношение к сурьме: оба элемента обычно встречаются в виде сульфидов (галена и стибнит), часто вместе. Плиний неправильно написал, что стибнит дает при нагревании свинец вместо сурьмы.
В таких странах, как Турция и Индия, первоначально персидское название сурьмы относилось к сульфиду сурьмы или сульфиду свинца, а на некоторых языках, таких как русский, называлось сурьмой.
Средние века и Ренессанс
Добыча свинца в Западной Европе сократилась после падения Западной Римской империи, причем Аравийская Иберия была единственным регионом, имеющим значительный выход свинца. Наибольшее производство свинца наблюдалось в Южной и Восточной Азии, особенно в Китае и Индии, где добыча свинца сильно увеличивалась.
В Европе, производство свинца начало возрождаться только в 11 и 12 веках, где свинец снова начал использоваться для кладки кровли и трубопроводов. Начиная с 13-го века, свинец использовался для создания витражей. В европейских и арабских традициях алхимии, свинец (символ Сатурна в европейской традиции) считался нечистым базовым металлом, который путем разделения, очистки и балансировки его составных частей мог быть преобразован в чистое золото. В течение этого периода, свинец все чаще использовался для загрязнения вина. Использование такого вина было запрещено в 1498 году приказом Папы, поскольку оно считалось непригодным для использования в священных обрядах, но его продолжали пить, что приводило к массовым отравлениям вплоть до конца 18-го века. Свинец был ключевым материалом в частях печатного станка, который был изобретен около 1440 года; печатные рабочие обычно вдыхали свинцовую пыль, что вызывало отравления свинцом. Огнестрельное оружие было изобретено примерно в то же время, и свинец, несмотря на то, что был дороже железа, стал основным материалом для изготовления пуль. Он был менее опасен для железных орудийных стволов, имел более высокую плотность (что способствовало лучшему удержанию скорости), а его более низкая точка плавления упрощала производство пуль, поскольку они могли быть изготовлены с использованием древесного огня. Свинец, в виде венецианской керамики, широко использовался в косметических средствах среди западноевропейской аристократии, поскольку отбеленные лица считались признаком скромности . Эта практика позже расширилась до белых париков и карандашей для глаз и исчезла только во время французской революции, в конце 18 века. Подобная мода появилась в Японии в XVIII веке с появлением гейш, практика, которая продолжалась в течение 20-го века. «Белые лица воплощали добродетель японских женщин», при этом в качестве отбеливателя обычно использовался свинец.
За пределами Европы и Азии
В Новом Свете, свинец стал производиться вскоре после прибытия европейских поселенцев. Самое раннее зарегистрированное производство свинца датируется 1621 годом в английской колонии Вирджиния, спустя четырнадцать лет после её основания. В Австралии, первая шахта, открытая колонистами на континенте, была ведущей шахтой в 1841 году. В Африке, добыча и плавка свинца были известны в Бенуэ-Тауре и нижнем бассейне Конго, где свинец использовался для торговли с европейцами и в качестве валюты к 17 веку, задолго до борьбы за Африку.
Промышленная революция
Во второй половине 18 века, в Британии, а затем и в континентальной Европе и Соединенных Штатах, произошла индустриальная революция. Это был первый случай, когда темпы производства свинца где-либо в мире превысили темпы производства свинца в Риме . Британия была ведущим производителем свинца, однако, она потеряла этот статус к середине 19-го века с истощением своих шахт и с развитием добычи свинца в Германии, Испании и Соединенных Штатах. К 1900 году, Соединенные Штаты были лидерами мирового производства свинца, а другие неевропейские страны – Канада, Мексика и Австралия – начали значительное производство свинца; производство за пределами Европы увеличилось. Значительная доля спроса на свинец приходилась на водопровод и краски – свинцовые краски тогда регулярно использовались. В это время больше людей (рабочий класс) контактировали с металлами и увеличивались случаи отравления свинцом. Это привело к исследованию влияния потребления свинца на организм. Свинец оказался более опасным в своей дымовой форме, чем твердый металл. Была обнаружена связь между отравлением свинцом и подагрой; британский врач Альфред Баринг Гаррод отметил, что треть его пациентов с подагрой были водопроводчиками и художниками. Последствия постоянного попадания свинца в организм, включая психические расстройства, также изучались в XIX веке. Первые законы, направленные на снижение случаев отравления свинцом на фабриках, были введены в действие в 1870-х и 1880-х годах в Соединенном Королевстве.
Новое время
Дальнейшие свидетельства угрозы, которая связана со свинцом, были обнаружены в конце 19-го и начале 20-го веков. Механизмы вреда были лучше поняты, а также была задокументирована свинцовая слепота. Страны Европы и США приступили к усилиям по сокращению количества свинца, с которым люди вступали в контакт. В 1878 году Соединенное Королевство ввело обязательные обследования на фабриках и назначило первого медицинского инспектора заводов в 1898 году; в результате сообщалось о 25-кратном сокращении случаев отравления свинцом с 1900 по 1944 годы. Последним основным воздействием свинца на человека было добавление тетраэтилового эфира к бензину в качестве антидетонационного вещества, практика, которая появилась в Соединенных Штатах в 1921 году. Она была постепенно прекращена в Соединенных Штатах и Европейском союзе к 2000 году. Большинство европейских стран запретили свинцовую краску, обычно используемую из-за ее непрозрачности и водонепроницаемости для украшения интерьеров к 1930 году. Воздействие было значительным: в последней четверти 20-го века процент людей с избыточным уровнем свинца в крови снизился с более чем трех четвертей населения Соединенных Штатов до немногим более двух процентов. Основным продуктом из свинца к концу 20-го века была свинцово-аккумуляторная батарея, которая не представляла непосредственной угрозы для человека. С 1960 по 1990 годы производство свинца в Западном блоке выросло на треть. Доля мирового производства свинца в Восточном блоке увеличилась втрое с 10% до 30% с 1950 по 1990 годы, когда Советский Союз был крупнейшим в мире производителем свинца в середине 1970-х и 1980-х годов, а Китай начал обширное производство свинца в конце 20-го века. В отличие от европейских коммунистических стран, в середине 20-го века Китай был, в основном, неиндустриализированой страной; в 2004 году Китай превзошел Австралию как крупнейшего производителя свинца. Как и в случае европейской индустриализации, свинец негативно сказался на здоровье в Китае.
Производство
Производство свинца увеличивается во всем мире из-за его использования в свинцово-аккумуляторных батареях. Существуют две основные категории продукции: первичные, из руд; и вторичные, от лома. В 2014 году, из первичной продукции было произведено 4,58 млн. тонн свинца, а из вторичной – 5,64 млн. тонн. В этом году, тройку ведущих производителей добытого свинцового концентрата возглавили Китай, Австралия и Соединенные Штаты. Тройку производителей рафинированного свинца возглавили Китай, США и Южная Корея.
Согласно докладу Международной ассоциации экспертов по металлам, сделанном в 2010 году, общий объем использования свинца, накопленный, выброшенный или рассеянный в окружающую среду на глобальном уровне на душу населения, составляет 8 кг. Значительная часть из этого объема приходится на более развитые страны (20-150 кг на душу населения), а не на менее развитые страны (1-4 кг на душу населения). Производственные процессы для первичного и вторичного свинца аналогичны. Некоторые первичные производственные заводы в настоящее время дополняют свою деятельность листами свинца, и эта тенденция, вероятно, будет увеличиваться в будущем. При адекватных методах производства, вторичный свинец неотличим от первичного свинца. Отходы металлолома от строительной торговли обычно довольно чисты и повторно расплавляются без необходимости плавки, хотя иногда требуется перегонка. Таким образом, производство вторичного свинца является более дешевым с точки зрения энергетических потребностей, чем производство первичного свинца, часто на 50% и более.
Основное
Большинство свинцовых руд содержат низкий процент свинца (богатые руды имеют типичное содержание свинца 3-8%), который должен быть сконцентрирован для извлечения. Во время первоначальной обработки, руды обычно подвергаются дроблению, отделению плотных сред, шлифованию, пенной флотации и сушке. Полученный концентрат с содержанием свинца 30-80% по массе (обычно 50-60%) затем превращается в (нечистый) свинцовый металл. Существует два основных способа сделать это: двухступенчатый процесс, включающий обжиг с последующим извлечением из доменной печи, осуществляемый в отдельных сосудах; или прямой процесс, в котором экстракция концентрата происходит в одном сосуде. Последний способ стал более распространенным, хотя первый по-прежнему значителен.
Двухстадийный процесс
Во-первых, сульфидный концентрат обжаривается на воздухе для окисления сульфида свинца: 2 PbS + 3 O2 → 2 PbO + 2 SO2 Первоначальный концентрат не был чистым сульфидом свинца, и обжиг дает оксид свинца и смесь сульфатов и силикатов свинца и других металлов, содержащихся в руде. Этот неочищенный оксид свинца восстанавливается в коксовой печи до (опять же нечистого) металла: 2 PbO + C → Pb + CO2 . Примеси, в основном, представляют собой мышьяк, сурьму, висмут, цинк, медь, серебро и золото. Расплав обрабатывают в реверберационной печи воздухом, паром и серой, которая окисляет примеси, за исключением серебра, золота и висмута. Окисленные загрязняющие вещества плавают в верхней части расплава и снимаются. Металлическое серебро и золото удаляются и извлекаются экономически с помощью процесса Паркса, в который цинк добавляется к свинцу. Цинк растворяет серебро и золото, оба из которых, не смешиваясь в свинце, могут быть разделены и извлечены. Обессеребрянный свинец освобождается висмутом методом Беттертона-Кролла, обрабатывая его металлическим кальцием и магнием. Полученные висмутсодержащие шлаки могут быть сняты. Очень чистый свинец может быть получен путем электролитической обработки плавленого свинца с использованием процесса Беттса. Аноды нечистого свинца и катоды чистого свинца помещают в электролит фторосиликата свинца (PbSiF6). После применения электрического потенциала, нечистый свинец на аноде растворяется и накладываются на катод, оставляя подавляющее большинство примесей в растворе.
Прямой процесс
В этом процессе, свинцовый слиток и шлак получают непосредственно из свинцовых концентратов. Сульфидный концентрат свинца расплавляется в печи и окисляется, образуя монооксид свинца. Углерод (кокс или угольный газ) добавляется к расплавленному заряду вместе с флюсами. Таким образом, монооксид свинца восстанавливается до металлического свинца в середине шлака, богатого монооксидом свинца. До 80% свинца в высококонцентрированных исходных концентратах можно получить в виде слитков; остальные 20% образуют шлак, богатый монооксидом свинца. Для низкосортного сырья, весь свинец может быть окислен до высокосортного шлака. Металлический свинец далее получают из высокосортных (25-40%) шлаков с помощью сжигания или впрыскивания с подводным топливом, с помощью вспомогательной электропечи или комбинации обоих методов.
Альтернативы
Продолжаются исследования более чистого и менее энергоемкого процесса добычи свинца; основным его недостатком является то, что либо слишком много свинца теряется в качестве отходов, либо альтернативные методы приводят к высокому содержанию серы в полученном свинцовом металле. Гидрометаллургическая экстракция, в которой аноды нечистого свинца погружены в электролит, и чистый свинец осаждаются на катод, является методом, который может иметь потенциал.
Вторичный метод
Плавление, являющееся неотъемлемой частью первичной продукции, часто пропускается во время вторичного производства. Это происходит только тогда, когда металлический свинец подвергся значительному окислению. Этот процесс аналогичен процессу первичной добычи в доменной печи или роторной печи, причем существенным отличием является большая изменчивость выходов. Процесс выплавки свинца – это более современный метод, который может выступать в качестве продолжения первичной продукции; аккумуляторная паста из отработанных свинцово-аккумуляторных батарей удаляет серу, обрабатывая ее щелочью, и затем обрабатывается в печи с угольным топливом в присутствии кислорода, что приводит к образованию нечистого свинца, причем сурьма является наиболее распространенной примесью. Переработка вторичного свинца аналогична переработке первичного свинца; Некоторые процессы очистки могут быть пропущены в зависимости от переработанного материала и его потенциального загрязнения, причем висмут и серебро чаще всего принимаются в качестве примесей. Из источников свинца для утилизации, свинцово-аккумуляторные батареи являются наиболее важными источниками; свинцовая труба, лист и оболочка кабеля также являются значительными.
Применения
Вопреки распространенному мнению, графит в деревянных карандашах никогда не делался из свинца. Когда карандаш был создан как инструмент для намотки графита, конкретный тип используемого графита был назван plumbago (в буквальном смысле – для свинца или свинцового макета).
Элементарная форма
Металл свинца имеет несколько полезных механических свойств, включая высокую плотность, низкую температуру плавления, пластичность и относительную инертность. Многие металлы превосходят свинец в некоторых из этих аспектов, но, как правило, они менее распространены и их труднее извлекать из руд. Токсичность свинца привела к поэтапному отказу от некоторых видов его использования. Свинец использовался для изготовления пуль с момента их изобретения в средние века. Свинец недорог; его низкая температура плавления означает, что стрелковые боеприпасы могут быть отлиты с минимальным использованием технического оборудования; кроме того, свинец плотнее других обычных металлов, что позволяет лучше удерживать скорость. Были высказаны опасения, что свинцовые пули, используемые для охоты, могут нанести вред окружающей среде. Его высокая плотность и устойчивость к коррозии были использованы в ряде связанных применений. Свинец используется в качестве киля на кораблях. Его вес позволяет ему уравновешивать эффект взвода ветра на парусах; будучи настолько плотным, он занимает небольшой объем и минимизирует водостойкость. Свинец используется при подводных погружениях, чтобы противостоять способности дайвера держаться на поверхности. В 1993 году, базу Пизанской башни в Пизе стабилизировали с помощью 600 тонн свинца. Из-за своей коррозионной стойкости, свинец используется как защитная оболочка для подводных кабелей. Свинец используется в архитектуре. Листы свинца используются в качестве кровельных материалов, при облицовке, оплавлении, при изготовлении водосточных желобов и соединений водосточных труб, а также парапетов на крыше. Свинцовые молдинги используются в качестве декоративного материала для фиксации свинцовых листов. Свинец все еще используется при изготовлении статуй и скульптур. В прошлом, свинец часто использовался для балансировки колес автомобилей; по экологическим причинам, это использование постепенно прекращается. Свинец добавляется к медным сплавам, таким как латунь и бронза, для улучшения их обрабатываемости и смазочных свойств. Будучи практически нерастворимым в меди, свинец образует твердые глобулы в несовершенствах по всему сплаву, такие как границы зерен. В низких концентрациях, а также в качестве смазки, глобулы препятствуют образованию стружки при работе сплава, тем самым улучшая обрабатываемость. В подшипниках используются медные сплавы с большей концентрацией свинца. Свинец обеспечивает смазку, а медь обеспечивает несущую опору. Благодаря своей высокой плотности, атомному номеру и формуемости, свинец используется в качестве барьера, поглощающего звук, вибрацию и излучение. Свинец не имеет естественных резонансных частот, в результате, лист свинца используется в качестве звукоизоляционного слоя в стенах, полах и потолках звуковых студий. Органические трубы часто изготавливаются из свинцового сплава, смешанного с различными количествами олова, чтобы контролировать тон каждой трубы. Свинец – это защитный материал, используемый от излучения в ядерной науке и в рентгеновских камерах: гамма-лучи поглощаются электронами. Атомы свинца плотно упакованы и плотность их электронов велика; большой атомный номер означает, что на атом приходится много электронов. Расплавленный свинец использовался в качестве охлаждающей жидкости для быстрых реакторов со свинцовым охлаждением. Наибольшее использование свинца наблюдалось в начале XXI века в свинцово-аккумуляторных батареях. Реакции в батарее между свинцом, диоксидом свинца и серной кислотой обеспечивают надежный источник напряжения. Свинец в батареях не подвергается непосредственному контакту с людьми, поэтому связан с меньшей угрозой токсичности. Суперконденсаторы, содержащие свинцово-аккумуляторные батареи, были установлены в киловаттах и мегаваттах в Австралии, Японии и США в области частотного регулирования, сглаживания солнечной энергии и для других применений. Эти батареи имеют более низкую плотность энергии и эффективность разряда заряда, чем литий-ионные батареи, но значительно дешевле. Свинец используется в высоковольтных силовых кабелях в качестве материала оболочки для предотвращения диффузии воды при теплоизоляции; такое использование уменьшается по мере постепенного прекращения использования свинца. В некоторых странах также сокращается использование свинца в припоях для электроники, чтобы уменьшить количество экологически опасных отходов. Свинец является одним из трех металлов, используемых в тесте Одди для музейных материалов, помогая обнаружить органические кислоты, альдегиды и кислые газы.
Соединения
Соединения свинца используются в качестве или в составе красящих агентов, окислителей, пластика, свечей, стекла и полупроводников. Красители на основе свинца используются в керамической глазури и стекле, особенно для красных и желтых оттенков. В качестве окислителей в органической химии используют тетраацетат свинца и диоксид свинца. Свинец часто используется в поливинилхлоридных покрытиях электрических шнуров. Его можно использовать для обработки свечных фитилей, чтобы обеспечить более продолжительное, более равномерное сжигание. Из-за токсичности свинца, европейские и североамериканские производители используют такие альтернативы, как цинк. Стекло свинца состоит из 12-28% оксида свинца. Он изменяет оптические характеристики стекла и уменьшает передачу ионизирующего излучения. Свинцовые полупроводники, такие как теллурид свинца, селенид свинца и антимонид свинца, используются в фотогальванических элементах и инфракрасных детекторах.
Биологические и экологические эффекты
Биологические эффекты
Свинец не имеет подтвержденной биологической роли. Его распространенность в организме человека, в среднем, составляет 120 мг у взрослого человека – его распространенность превосходит только цинк (2500 мг) и железо (4000 мг) среди тяжелых металлов. Соли свинца очень эффективно поглощаются телом. Небольшое количество свинца (1%) будет храниться в костях; остальное будет выводиться с мочой и фекалиями в течение нескольких недель после воздействия. Ребенок будет способен выводить из организма только около трети свинца. Постоянное воздействие свинца может привести к биоаккумуляции свинца.
Токсичность
Свинец – чрезвычайно ядовитый металл (при вдыхании или проглатывании), затрагивающий почти каждый орган и систему в организме человека. При уровне в воздухе 100 мг / м3, он представляет собой немедленную опасность для жизни и здоровья. Свинец быстро всасывается в кровоток. Основной причиной его токсичности является его склонность вмешиваться в правильное функционирование ферментов. Он делает это путем связывания с сульфгидрильными группами, обнаруженными на многих ферментах, или имитирует и вытесняет другие металлы, которые действуют как кофакторы во многих ферментативных реакциях.
Среди основных металлов, с которыми взаимодействует свинец, находятся кальций, железо и цинк. Высокие уровни кальция и железа, как правило, обеспечивают некоторую защиту от отравления свинцом; низкие уровни вызывают повышенную восприимчивость.
Эффекты
Свинец может нанести серьезный ущерб мозгу и почкам и, в конечном счете, привести к смерти. Как и кальций, свинец может пересекать гематоэнцефалический барьер. Он разрушает миелиновые оболочки нейронов, уменьшает их количество, препятствует пути нейротрансмиссии и уменьшает рост нейронов.
Симптомы отравления свинцом включают нефропатию, коликовые боли в животе и, возможно, слабость в пальцах, запястьях или лодыжках. Малое кровяное давление увеличивается, особенно у людей среднего и старшего возраста, что может вызывать анемию. У беременных женщин, высокий уровень воздействия свинца может вызывать выкидыш. Было показано, что хроническое воздействие высоких уровней свинца снижает фертильность у мужчин. В развивающемся мозге ребенка, свинец препятствует образованию синапсов в коре головного мозга, нейрохимическому развитию (в том числе нейротрансмиттеров) и организации ионных каналов. Раннее воздействие свинца на детей связано с повышенным риском нарушений сна и чрезмерной дневной сонливости в более позднем детском возрасте. Высокий уровень свинца в крови связан с задержкой полового созревания у девочек. Увеличение и снижение воздействия переносимого по воздуху свинца от сжигания тетраэтилсвинца в бензине в течение 20-го века связано с историческим ростом и снижением уровня преступности, однако, эта гипотеза не является общепринятой.
Лечение
Лечение отравления свинцом обычно включает введение димеркапрола и сукцимера. Острые случаи могут потребовать использования динатрия кальция эдетата, хелата кальция динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТК). Свинец имеет большее сродство к свинцу, чем кальций, в результате чего хелат свинца образуется путем обмена и выводится с мочой, оставляя безвредный кальций.
Источники воздействия
Воздействие свинца является глобальной проблемой, поскольку добыча и плавка свинца распространены во многих странах мира. Отравление свинцом обычно происходит в результате приема пищи или воды, зараженной свинцом, и реже – в результате случайного попадания в организм загрязненной почвы, пыли или краски на основе свинца. Продукты морской воды могут содержать свинец, если вода подвергается воздействию промышленных вод. Плоды и овощи могут быть заражены высоким содержанием свинца в почвах, в которых они выращивались. Почва может быть загрязнена путем накопления твердых частиц из свинца в трубах, свинцовой краске и остаточных выбросов из этилированного бензина.
Использование свинца в водопроводных трубах проблематично в районах с мягкой или кислой водой. Твердая вода образует нерастворимые слои в трубах, тогда как мягкая и кислая вода растворяет свинцовые трубы. Растворенный диоксид углерода в перевозимой воде может привести к образованию растворимого бикарбоната свинца; кислородсодержащая вода может аналогичным образом растворять свинец в виде гидроксида свинца (II). Питьевая вода со временем может вызывать проблемы со здоровьем из-за токсичности растворенного свинца. Чем тверже вода, тем больше она будет содержать бикарбоната и сульфата кальция, и тем больше внутренняя часть труб будет покрыта защитным слоем карбоната свинца или сульфата свинца.
Проглатывание свинцовой краски является основным источником воздействия свинца на детей. По мере того как краска разрушается, она отслаивается, измельчается в пыль, а затем поступает в организм через контакт с руками или загрязненную пищу, воду или спирт. Проглатывание некоторых народных средств может привести к воздействию свинца или его соединений. Вдыхание – это второй важный путь воздействия свинца, в том числе для курящих, и особенно для работников, занятых свинцом. Сигаретный дым содержит, среди других токсичных веществ, радиоактивный свинец-210. Почти весь вдыхаемый свинец всасывается в тело; для приема внутрь, показатель составляет 20-70%, при этом дети поглощают больше свинца, чем взрослые.
Кожное воздействие может быть значительным для узкой категории людей, работающих с органическими соединениями свинца. Скорость поглощения свинца в коже ниже для неорганического свинца.
Экология
Добыча, производство, использование и утилизация свинца и его продуктов вызвали значительное загрязнение почв и вод Земли. Атмосферные выбросы свинца находились на пике во время промышленной революции, а бензиновый период свинца был во второй половине двадцатого века. Повышенные концентрации свинца сохраняются в почвах и отложениях в постиндустриальных и городских районах; промышленные выбросы, в том числе, связанные со сжиганием угля, продолжаются во многих частях мира.
Свинец может накапливаться в почвах, особенно с высоким содержанием органических веществ, где он сохраняется в течение от сотен до тысяч лет. Он может занять место других металлов в растениях и может накапливаться на их поверхностях, тем самым замедляя процесс фотосинтеза и предотвращая их рост или убивая их. Загрязнение почв и растений влияет на микроорганизмы и на животных. Пострадавшие животные имеют уменьшенную способность синтезировать эритроциты, что вызывает анемию. Аналитические методы определения свинца в окружающей среде включают спектрофотометрию, рентгеновскую флуоресценцию, атомную спектроскопию и электрохимические методы. Конкретный ион-селективный электрод был разработан на основе ионофора S, S»-метиленбиса (N, N-диизобутилдитиокарбамат).
Ограничение и восстановление
К середине 1980-х годов произошел значительный сдвиг в использовании свинца. В Соединенных Штатах, природоохранные правила сокращают или исключают использование свинца в не-аккумуляторных продуктах, включая бензин, краски, припои и системы водоснабжения. Устройства для контроля твердых частиц могут использоваться на угольных электростанциях для сбора выбросов свинца. Использование свинца еще более ограничено Директивой Европейского союза об ограничении использования опасных веществ. Использование свинцовых пуль для охоты и спортивной стрельбы было запрещено в Нидерландах в 1993 году, что привело к значительному сокращению выбросов свинца с 230 тонн в 1990 году до 47,5 тонн в 1995 году. В Соединенных Штатах Америки, Администрация профессиональной безопасности и здоровья установила допустимый предел воздействия свинца на рабочем месте на уровне 0,05 мг / м3 в течение 8-часового рабочего дня; это относится к металлическому свинцу, неорганическим свинцовым соединениям и свинцовым мылам. Национальный институт безопасности и гигиены труда США рекомендует, чтобы концентрации свинца в крови находились ниже 0,06 мг на 100 г крови. Свинец может все еще встречаться во вредных количествах в керамике, виниле (используемом для прокладки труб и изоляции электрических шнуров) и китайской латуни. В старых домах, все еще может содержаться свинцовая краска. Белая свинцовая краска была выведена из продажи в промышленно развитых странах, но желтый хромат свинца все ещё остается в употреблении. Удаление старой краски путем шлифования дает пыль, которую человек может вдыхать.
Свойства свинца
Существует не только свекольный или тростниковый , но и свинцовый. Так называют одно из соединений металла.
Ацетат выглядит как сладкая добавка к пище, — мелкие белого цвета или порошок, хорошо растворимый в воде.
Однако, свинцовый сахар
не сладкий, да и есть его, не рекомендуется. Вещество содержит яд, коим являются как раз ионы металла.
Применяют ацетат только в ветеринарии исключительно наружно, поскольку обладает вяжущими свойствами.
Ядовитость некоторых соединений свинца, как это ни странно, используется во благо человека, но не насекомых.
Вещество под названием арсенат, содержащее металл, — отрава для вредителей полей, таких как долгоносик хлопковый и непарный шелкопряд.
Есть целый спектр и безобидных сочетаний свинца с другими элементами.
В сочетании с металл обладает сушащими свойствами, веществом обрабатывают картины, чтобы краска быстрее запустевала.
— Хромат свинца солнечного цвета. Его применяют для окрашивания тканей, .
— Без сульфата металла не обходятся аккумуляторы.
— Тетраэтилсвинец служит добавкой к машинному топливу, улучшает качественные параметры .
— Без сульфида металла не возможен обжиг посуды и изделий из .
— Хлорид свинца
замедляет рост опухолей, поэтому используется медиками в качестве мази.
Это, применение химических соединений свинца
. В чистом же виде элемент пригождается в промышленности.
Применение свинца
Металл не благородный, зато, помогает получить драгоценные и в их чистом виде. Процесс называется купелирование.
В процессе плавления смеси и свинца под воздействием окисления, отделяется драгоценный металл без каких-либо примесей.
Добавляют свинец
и в смеси, которые употребляют в качестве припоев.
Их применяют для спаивания между собой деталей . Сам по себе свинец не отличается эстетической красотой.
Не соприкасаясь с воздухом, он блестящий, бело-голубой. Но, стоит металлу прореагировать с кислородом в атмосфере, как он теряет лоск, покрывается непрозрачной, мутной пленкой. Так что, с эстетической точки зрения свинец не представляет ценности.
Зато, элемент под порядковым номером 82 в – герой многих литературных трудов. Писатели любят эпитет «свинцовый».
Обычно, он означает неимоверную тяжесть чего-либо. К примеру, фраза «свинцовые ноги
» трактуется, как конечности, которыми невозможно передвигать из-за ощущения в них тяжести.
Металл №82, действительно, не легок, но далеко не самый тяжелый из известных веществ. К примеру, в кусочек свинца плавает на поверхности.
Так что, более точно другое литературное применение образа элемента. Понятие «свинцовый» употребляют по отношению к цвету.
Часто говорят «свинцовый цвет лица». Это значит что покровы нездоровой серо-синей окраски, такой, какую металл приобретает при соприкосновении с воздухом.
В переводе некоторых текстов можно встретить фразу «оловянные аккумуляторы».
Это издержки перевода текстов на литовском, латышском, болгарском языках не совсем компетентными людьми.
Дело в том, что слова свинец во многих странах просто нет. Этот элемент называют оловом.
Еще древние люди путали два похожих друг на друга металла. Правда, олово тысячелетия назад не удостоилось чести представлять какую-нибудь планету.
Другие металлы, известные с незапамятных времен, древние люди разделили по небесным телам. Не секрет, что символизировало Марс. Свинец же стал обозначать Сатурн.
82-ым элементом буквально напичкана земля и, это касается не только природных запасов металла, но и коммуникационных систем.
Свойства свинца
спасают от коррозии линии электропередач, телеграфные провода. Их часто приходится прокладывать не по воздуху, а под водоемами или, просто, под землей.
Не обходятся без бело-голубого металла и водопроводные системы. В них элемент свинец
– материал для запорных устройств. Они препятствуют незапланированному доступу, в коллекторы, к примеру.
Количество свинца во внешней среде влияет на уровень преступности. К такому выводу пришли ученые США.
Они обследовали все штаты страны, соотнесли цифры и выявили закономерность.
Там, где концентрация металл максимальна, совершается в 4 раза больше правонарушений, чем в областях с меньшими показателями элемента №82.
Ученые мужи даже нашли объяснение статистическим данным. Они предположили, что металл свинец
способствует нарушению нейронных связей в мозге, разрушает некоторые химические соединения, необходимые для нормальной работы органа.
Возможно, это способствует перепрограммированию человека на более нестандартное и агрессивное поведение.
Кстати, свинец
в истории человечества часто был связан именно с агрессией. Металл применяли в пытках.
Лили в расплавленном виде на кожные покровы, рот. В индии сплав заливали в уши представителям низшей касты, если те подслушали разговоры своих высших собратьев.
А в Венеции для опасных преступников делали свинцовые потолки
камер на верхнем этаже тюрьмы.
В жару они раскалялись, — узники изнывали от температур и духоты. В прохладную погоду, напротив, в помещениях было очень холодно.
Но, к счастью, сейчас металл №82 используют, в основном, в благих целях. Основной добытчик свинца
– КНР.
В Поднебесной добывают около 2-х миллионов тонн элемента в год. Для сравнения, все запасы России равны лишь 17-ти миллионам тонн. Большинство из них скрыты в недрах Приморского, Алтайского, Красноярского краев.
Загрузка…
Свинец
обычно имеет грязно-серый цвет, хотя свежий его разрез имеет синеватый отлив и блестит. Однако блестящий металл быстро покрывается тускло-серой защитной пленкой оксида. Плотность свинца (11,34 г/см3) в полтора раза больше, чем у железа, вчетверо больше, чем у алюминия; даже серебро легче свинца. Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
Свинец кристаллизуется в гранецентрированной кубической решётке (а = 4,9389), аллотропических модификаций не имеет. Атомный радиус 1,75, ионные радиусы: Pb 2+ 1,26 , Pb 4+ 0,76: плотность 11,34 г/см 3 (20°C); удельная теплоёмкость при 20°C 0,128 кДж/(кг·К) ; теплопроводность 33,5 вт/(м·К); температурный коэффициент линейного расширения 29,1·10 -6 при комнатной температуре; твёрдость по Бринеллю 25-40 Мн/м 2 (2,5-4 кгс/мм 2); предел прочности при растяжении 12-13 Мн/м 2 , при сжатии около 50 Мн/м 2 ; относительное удлинение при разрыве 50-70%. Наклёп не повышает механических свойств свинца, т. к. температура его рекристаллизации лежит ниже комнатной (около -35 °C при степени деформации 40% и выше). Свинец диамагнитен, его магнитная восприимчивость — 0,12·10 -6 . При 7,18 К становится сверхпроводником.
Относительная атомная масса (A r = 207,2) является усредненной из масс нескольких изотопов: 204 Pb (1,4%), 206 Pb (24,1%), 207 Pb (22,1%) и 208 Pb (52,4%). Последние три нуклида – конечные продукты естественных радиоактивных превращений урана, актиния и тория. Известно также более 20 радиоактивных изотопов свинца, из которых наиболее долгоживущие – 202 Pb и 205 Pb (с периодами полураспада 300 тысяч и 15 млн. лет). В природе образуются также и короткоживущие изотопы свинца с массовыми числами 209, 210, 212 и 214 с периодами полураспада соответственно 3,25 ч, 27,1 года, 10,64 ч и 26,8 мин. Соотношение различных изотопов в разных образцах свинцовых руд может несколько различаться, что не дает возможности определить для свинца значение A r с большей точностью.
Свинец (Pb от лат. Plumbum) – химический элемент, который находится в IV группе Таблицы Менделеева. Свинец имеет множество изотопов, среди которых более 20 обладают радиоактивными свойствами. Изотопы свинца являются продуктами распада урана и тория, поэтому содержание свинца в литосфере постепенно увеличивалось в течение миллионов лет и сейчас составляет около 0,0016% по массе, но он более распространен, чем его ближайшие родственники, такие как золото и . Свинец легко выделяется из рудных месторождений. Основные источники свинца — галенит, англезит и церуссит. В руде со свинцом очень часто соседствуют другие металлы, например, цинк , кадмий и висмут. В самородном виде свинец встречается исключительно редко.
Свинец — интересные исторические факты
Этимология слова «свинец» до сих пор точно не выяснена и является предметом очень интересных исследований. Свинец очень похож на олово, очень часто их путали, поэтому в большинстве западнославянских языков свинец это олово. Зато слово «свинец» встречается в литовском (svinas) и латышском (svin) языках. Свинец в переводе на английский lead, на голландский lood. Видимо отсюда и пошло слово «лудить», т.е. покрывать изделие слоем олова (или свинца). Не до конца понятно также происхождение латинского слова Plumbum, от которого произошло английское слово plumber – водопроводчик. Дело в том, что когда-то водопроводные трубы «запечатывали» свинцом, «пломбировали» (франц. plomber «запечатывать свинцом»). Кстати, отсюда же всем известное слово «пломба». Но на этом путаница не заканчивается, греки всегда называли свинец «молибдос», отсюда и латинское «molibdaena», незнающему человеку легко спутать это название с наименованием химического элемента молибден . Так в древности называли блестящие минералы оставляющие тёмный след на светлой поверхности. Этот факт оставил свой след в немецком языке: «карандаш» по-немецки называется Bleistift, т.е. свинцовый стержень.
Человечество знакомо со свинцом с незапамятных времен. Археологами найдены свинцовые изделия выплавленные 8000 лет тому назад. В Древнем Египте из свинца даже отливали статуи. В Древнем Риме из свинца были изготовлены водопроводные трубы, именно он предопределил первую в истории экологическую катастрофу. Римляне не имели никакого представления о вреде свинца, им нравился податливый, прочный и простой в работе металл. Считалось даже, что свинец, добавленный в вино, улучшает его вкус. Поэтому почти каждый римлянин был отравлен свинцом. О симптомах отравления свинцом мы расскажем ниже, а пока лишь укажем, что одним из них является расстройство рассудка. Видимо отсюда и берут свое начало все эти безумные выходки знатных римлян и бесчисленные сумасшедшие оргии. Некоторые исследователи даже считают, что свинец явился чуть ли основной причиной падения Древнего Рима.
В древности гончары мололи свинцовую руду, разводили водой и обливали полученной смесью глиняные предметы. После обжига такие сосуды покрывались тонким слоем блестящего свинцового стекла.
Англичанин Джордж Равенскрофт в 1673 году усовершенствовал состав стекла, добавив к исходным компонентам оксид свинца и таким образом получил легкоплавкое блестящее стекло, которое было очень похоже на натуральный горный хрусталь. А в конце 18 века Георг Страсс при производстве стекла сплавил вместе белый песок, поташ и оксид свинца, получив такое чистое и блестящее стекло, что его сложно было отличить от алмаза. Отсюда и пошло название «стразы», по сути подделка под драгоценные камни. К сожалению, среди современников Страсс прослыл мошенником и его изобретение находилось в забвении до тех пор, пока в начале XX века Даниэль Сваровски не смог сделать из производства страз целую индустрию моды и направление искусства.
После появления и широкого распространения огнестрельного оружия, свинец начал использоваться для производства пуль и дроби. Из свинца изготавливали типографские литеры. Свинец ранее входил в состав белой и красной красок, ими писали почти все старинные художники.
Свинцовая дробь
Химические свойства свинца кратко
Свинец — металл матового серого цвета. Однако его свежий срез хорошо блестит, но к сожалению почти моментально покрывается грязноватой оксидной плёнкой. Свинец очень тяжелый металл, он тяжелее железа в полтора раза, а алюминия в четыре. Недаром в русском языке слово «свинцовый» является в некоторой мере синонимом тяжести. Свинец очень легкоплавкий металл, он плавится уже при 327 ° С. Ну, этот факт известен всем рыбакам, которые с легкостью выплавляют нужные по весу грузила. Также свинец очень мягок, его можно резать обычным стальным ножом. Свинец очень малоактивный металл, провести с ним реакцию или растворить его не составляет никакого труда даже при комнатной температуре.
Органические производные свинца являются очень ядовитыми веществами. К сожалению, одно из них, тетраэтилсвинец, широко использовалось как присадка к бензину, позволяющая повысить октановое число. Но зато к счастью, тетраэтилсвинец больше не применяется в такой ипостаси, химики и производственники научились повышать октановое число более безопасными способами.
Влияние свинца на организм человека и симптомы отравления
Любые соединения свинца очень ядовиты. Металл проникает в организм вместе с едой или со вдыхаемым воздухом и разносится кровью. Причем вдыхание паров свинцовых соединений и пыли намного более опасно, чем присутствие его в пище. Свинец имеет свойство накапливаться в костях, частично замещая в этом случае кальций . При повышении концентрации свинца в организме развивается анемия, поражается головной мозг, что приводит к снижению интеллекта, а у детей может вызвать необратимые задержки в развитии. Достаточно растворить один миллиграмм свинца в литре воды и она станет не только непригодной, но и опасной для питья. Такое низкое количество свинца представляет также определенную опасность, ни цвет ни вкус воды не изменяется. Основные симптомы отравления свинцом:
- серая кайма на деснах,
- вялость,
- апатия,
- потеря памяти,
- слабоумие,
- проблемы со зрением,
- раннее старение.
Применение свинца
Всё же, несмотря на токсичность, отказаться от использования свинца пока нет никакой возможности ввиду его исключительных свойств и дешевизны. Свинец в основном используется для производства аккумуляторных пластин, на эти нужды в настоящее время тратится около 75% добываемого на планете свинца. Свинец используется как оболочка для электрических кабелей, благодаря своей пластичности и неподверженности коррозии. Этот металл широко используется в химической и нефтеперерабатывающей промышленности, например, для облицовки реакторов в которых получают серную кислоту. Свинец обладает свойством задерживать радиоактивное излучение, этим тоже широко пользуются в энергетике, медицине и химии. В свинцовых контейнерах, к примеру, транспортируют радиоактивные элементы. Свинец идет в производство сердечников пуль и шрапнели. Также этот металл находит свое применение в производстве подшипников.

Данное видео продолжит рассказ о свойствах свинца:
Электропроводность
Тепло- и электропроводность металлов довольно хорошо коррелируют друг с другом. Свинец не слишком хорошо проводит тепло и к лучшим проводникам электричества тоже не относится: удельное сопротивление составляет 0,22 Ом-кв. мм/м при сопротивлении той же меди 0,017.
Коррозионная стойкость
Свинец – металл неблагородный, однако по уровню химической инертности к таковым приближается. Низкая активность и способность покрываться оксидной пленкой и обуславливает достойную коррозионную стойкость.
Во влажной сухой атмосфере металл практически не корродирует. Причем в последнем случае сероводород, угольный ангидрид и серная кислота – обычные «виновники» коррозии, на него не влияют.
Показатели коррозии в разной атмосфере такие:
- в городской (смог) – 0,00043–0,00068 мм/год,
- в морской (соли) – 0,00041–0,00056 мм/год;
- сельской – 0,00023– ,00048 мм/год.
Воздействие пресной или дистиллированной воды нулевое.
- Металл устойчив к действию хромовой, плавиковой, концентрированной уксусной, сернистой и фосфорной кислоте.
- А вот в разбавленной уксусной или азотной с концентрацией менее 70% быстро разрушается.
- Так же действует и концентрированная – более 90%, серная кислота.
Газы – хлор, сернистый газ, сероводород на металл не действуют. Однако под влиянием фтористого водорода свинец корродирует.
На коррозионные качества его влияют другие металлы. Так, контакт с железом и никак не сказывается на коррозионной стойкости, а добавка висмута или снижает стойкость вещества к кислоте.
Токсичность

Наибольшую опасность представляют собой пары металла и его пыль, поскольку в таком состоянии они легче всего проникает в организм.
Основной путь – дыхательный тракт. Часть может усвоиться и через кишечно-желудочный тракт и даже кожу при непосредственном контакте – те же свинцовые белила и краски.
- Попадая в легкие, свинец всасывается кровью, разносится по всему телу и скапливается в основном в костях. Главное его отравляющее действие связано с нарушениями в синтезе гемоглобина. Типичные признаки свинцового отравления сходны с анемией – усталость, головные боли, расстройства сна и пищеварения, но сопровождаются постоянными ноющими болями в мышцах и костях.
- Длительное отравление может вызвать «свинцовый паралич». Острое отравление провоцирует повышение давления, склерозирование сосудов и так далее.
Лечение специфическое и длительное, поскольку вывести тяжелый металл из организма непросто.
О том, какими экологическими свойствами обладает свинец, расскажем ниже.
Экологические характеристики
Загрязнение свинцом окружающей среды считается одним из самых опасных. Все изделия, где используется свинец, нуждаются в специальной утилизации, которая проводится только лицензированными службами.
К сожалению, загрязнение свинцом обеспечивается не только деятельностью предприятий, где это хоть худо-бедно, да регулируется. В городском воздухе наличие свинцовых паров обеспечивает сгорание топлива в автомобилях. На этом фоне наличие свинцовых стабилизаторов в таких, например, привычных конструкциях, как металлопластиковое окно уже не кажется стоящим внимания.
Свинец – металл, имеющий . Несмотря на токсичность, в народном хозяйстве он используется слишком широко, чтобы можно было металл чем-то заменить.
О свойствах солей свинца поведает данное видео:
В художественной литературе часто приходится встречаться с эпитетом «свинцовый». Как правило, он означает тяжесть в прямом или переносном смысле; иногда же он указывает на угрюмый сине-серый цвет. Против последнего сравнения возражать не приходится. Первое же требует уточнений. Среди металлов, используемых техникой нашего времени, многие тяжелее свинца. Свинец всплывает на поверхность, будучи погружен в . В расплаве меди свинцовый кораблик, несомненно, опустился бы на дно, тогда как в золоте плавал бы с очень большой легкостью. «Бы» — потому, что этого произойти не может: свинец плавится задолго до меди или золота (температуры плавления — 327, 1083 и 1063°С соответственно), и кораблик расплавится раньше, чем утонет.
Народы древности не могли изготовить из свинца ни меча, ни лемеха, ни даже горшка — для этого он слишком мягок и легкоплавок. Но в природе нет ни одного металла, который при обычных условиях мог бы соперничать с ним в пластичности. По десятибалльной «алмазной» шкале Мооса сравнительная твердость элемента № 82 выражается цифрой 1,5. Чтобы получить на свинце какое-нибудь изображение или надпись, нет надобности прибегать к чекану, достаточно простого тиснения. Отсюда — свинцовые печати старины. И в наше время принято товарные вагоны, сейфы, складские помещения опечатывать свинцовой пломбой. Кстати, само слово «пломба» (а их сейчас делают из разных материалов) произошло, видимо, от латинского названия свинца plumbum; по-французски название элемента — plomb.
Столь примитивное использование пластичности свинца, как получение на нем оттисков, для современной техники кажется анахронизмом. Тем не менее отпечатки на свинце иногда незаменимы и в наше время.
При глубинном бурении инструмент отнюдь не застрахован от поломок, вызывающих подчас аварии. Если на глубине нескольких сот метров в скважине останется сломанный бур, то как его извлечь обратно, как подцепить?
Самое простое и падежное в таком случае средство — свинцовая болванка. Ее опускают в скважину, и она расплющивается от удара, наткнувшись на сломанный бур. Извлеченная на поверхность болванка «предъявит» отпечаток, по которому можно определить, каким образом, за какую часть зацепить обломок. Появились, правда, гораздо более удобные «осведомители» — каротажные телеустановки. Но насколько они дороже, прихотливей, сложнее!
Свинец очень легко куется и прокатывается. Уже при давлении 2 т/см 2 свинцовая стружка спрессовывается в сплошную монолитную массу. С увеличением давления до 5 т/см 2 твердый свинец переходит в текучее состояние. Свинцовую проволоку получают, продавливая через фильеру не расплав, а твердый свинец. Обычным волочением ее сделать нельзя из-за малой разрывной прочности свинца.
Свинец и наука
В Аламогордо — место первого атомного взрыва — Энрико Ферми выехал в танке, оборудованном свинцовой защитой. Чтобы понять, почему от гамма-излучения защищаются именно свинцом, нам необходимо обратиться к сущности поглощения коротковолнового излучения.
Гамма-лучи, сопровождающие радиоактивный распад, идут из ядра, энергия которого почти в миллион раз превышает ту, что «собрана» во внешней оболочке атома. Естественно, что гамма-лучи неизмеримо энергичнее лучей световых. Встречаясь с веществом, фотон или квант любого излучения теряет свою энергию, этим-то и выражается его поглощение. Но энергия лучей различна. Чем короче их волна, тем они энергичнее, или, как принято выражаться, жестче. Чем плотнее среда, через которую проходят лучи, тем сильнее она их задерживает. Свинец плотен. Ударяясь о поверхность металла, гамма-кванты выбивают из нее электроны, на что расходуют свою энергию. Чем больше атомный номер элемента, тем труднее выбить электрон с его внешней орбиты из-за большей силы притяжения ядром.
Возможен и другой случай, когда гамма-квант сталкивается с электроном, сообщает ему часть своей энергии и продолжает свое движение. Но после встречи он стал менее энергичным, более «мягким», и в дальнейшем слою тяжелого элемента поглотить такой квант легче. Это явление носит название комптон-эффекта по имени открывшего его американского ученого.
Чем жестче лучи, тем больше их проникающая способность — аксиома, не требующая доказательств. Однако ученых, положившихся на эту аксиому, ожидал весьма любопытный сюрприз. Вдруг выяснилось, что гамма-лучи энергией более 1 млн. эв задерживаются свинцом не слабее, а сильнее менее жестких! Факт, казалось, противоречащий очевидности. После проведения тончайших экспериментов выяснилось, что гамма-квант энергией более 1,02 Мэв в непосредственной близости от ядра «исчезает», превращаясь в пару электрон — позитрон, и каждая из частиц уносит с собой половину затраченной на их образование энергии. Позитрон недолговечен и, столкнувшись с электроном, превращается в гамма-квант, но уже меньшей энергии. Образование электронно-позитронных пар наблюдается только у гамма-квантов высокой энергии и только вблизи от «массивного» ядра, то есть в элементе с большим атомным номером.
Свинец — один из последних стабильных элементов таблицы Менделеева
. И из тяжелых элементов — самый доступный, с отработанной веками технологией добычи, с разведанными рудами. И очень пластичный. И очень удобный в обработке. Вот почему свинцовая защита от излучения — самая распространенная. Пятнадцати-двадцатисантиметрового слоя свинца достаточно, чтобы предохранить людей от действия излучения любого известного науке вида.
Коротко упомянем еще об одной стороне служения свинца науке. Она тоже связана с радиоактивностью.
В часах, которыми мы пользуемся, нет свинцовых деталей. Но в тех случаях, когда время измеряют не часами и минутами, а миллионами лет, без свинца не обойтись. Радиоактивные превращения урана и тория завершаются образованием стабильных изотопов элемента № 82. При этом, правда, получается разный свинец. Распад изотопов 235U и 238U приводит в конечном итоге к изотопам 207РЬ и 208РЬ. Наиболее распространенный изотоп тория 232Th заканчивает свои превращения изотопом 208РЬ. Установив соотношение изотопов свинца в составе геологических пород, можно узнать, сколько времени существует тот или иной минерал. При наличии особо точных приборов (масс- спектрометров) возраст породы устанавливают по трем независимым определениям — по соотношениям 206Pb: 238U: 207Pb: 235U и 208Pb: 232Th.
Начнем с того, что эти строчки отпечатаны литерами, изготовленными из свинцового сплава. Главные компоненты типографских сплавов — свинец, олово и сурьма. Интересно, что свинец и олово стали использовать в книгопечатании с первых его шагов. Но тогда они не составляли единого сплава. Немецкий первопечатник Иоганн Гутенберг литеры из олова отливал в свинцовые формы, так как считал удобным чеканить из мягкого свинца формы, которые выдерживали определенное количество заливок олова. Нынешние оловянно-свинцовые типографские сплавы составляют так, чтобы они удовлетворяли многим требованиям: они должны иметь хорошие литьевые свойства и незначительную усадку, быть достаточно твердыми и химически стойкими по отношению к краскам и смывающим их растворам; при переплавке должно сохраняться постоянство состава.
Однако служение свинца человеческой культуре началось задолго до появления первых книг. Живопись появилась раньше письменности. На протяжении многих столетий художники использовали краски на свинцовой основе, и они до сих пор не вышли из употребления: желтая — свинцовый крон, красная — сурик и, конечно, свинцовые белила. Между прочим, именно из-за свинцовых белил кажутся темными картины старых мастеров. Под действием микропримесей сероводорода в воздухе свинцовые белила превращаются в темный сернистый свинец PbS…
С давних пор стенки гончарных изделий покрывали глазурями. Простейшая глазурь делается из окиси свинца и кварцевого песка. Ныне санитарный надзор запрещает использовать эту глазурь при изготовлении предметов домашнего обихода: контакт пищевых продуктов с солями свинца должен быть исключен. Но в составе майоликовых глазурей, предназначенных для декоративных целей, сравнительно легкоплавкие соединения свинца используют, как и прежде.
Наконец, свинец входит в состав хрусталя, точнее, не свинец, а его окись. Свинцовое стекло варится без каких-либо осложнений, оно легко выдувается и гранится, сравнительно просто нанести на него узоры и обычную нарезку, винтовую, в частности. Такое стекло хорошо преломляет световые лучи и потому находит применение в оптических приборах.
Добавляя в шихту свинец и поташ (вместо извести), приготовляют страз — стекло с блеском, большим, чем у драгоценных камней .
Свинец в медицине
Попадая в организм, свинец, как и большинство тяжелых металлов, вызывает отравления. И тем не менее свинец нужен медицине. Со времен древних греков остались во врачебной практике свинцовые примочки и пластыри, но этим не ограничивается медицинская служба свинца.
Желчь нужна не только сатирикам. Содержащиеся в ней органические кислоты, прежде всего гликохолевая С 23 Н 36 (ОН) 3 СОNНСН 2 СH 2 COOН, а также таурохолевая С 23 Н 36 (ОН) 3 СОNНСН 2 СH 2 SO 3 Н, стимулируют деятельность печени. А поскольку не всегда и не у всех печень работает с точностью хорошо отлаженного механизма, эти кислоты нужны медицине. Выделяют их и разделяют с помощью уксуснокислого свинца. Свинцовая соль гликохолевой кислоты выпадает при этом в осадок, а таурохолевой — остается в маточном растворе. Отфильтровав осадок, из маточного раствора выделяют и второй препарат, действуя опять же свинцовым соединением — основной уксусной солью.
Но главная работа свинца в медицине связана с диагностикой и рентгенотерапией. Он защищает врачей от постоянного рентгеновского облучения. Для практически полного поглощения лучей Рентгена достаточно на их пути поставить слой свинца в 2-3 мм. Вот почему медицинский персонал рентгеновских кабинетов облачен в фартуки, рукавицы и шлемы из резины, в состав которой введен свинец. И изображение на экране наблюдают через свинцовое стекло.
Таковы главные аспекты взаимоотношений человечества со свинцом — элементом, известным с глубокой древности, но и сегодня служащим человеку во многих областях его деятельности.
Свинец (Pb) — элемент с атомным номером 82 и атомным весом 207,2. Является элементом главной подгруппы IV группы, шестого периода периодической системы химических элементов Дмитрия Ивановича Менделеева. Свинцовый слиток имеет грязно-серый цвет, однако, на свежем срезе металл блестит и имеет синевато-серый оттенок. Это объясняется тем, что на воздухе свинец быстро окисляется и покрывается тонкой окисной пленкой, которая препятствует дальнейшему разрушению металла. Свинец очень пластичный и мягкий металл — слиток можно разрезать ножом и даже поцарапать ногтем. Устоявшееся выражение «свинцовая тяжесть» верно лишь отчасти — действительно — свинец (плотность11,34 г/см 3) тяжелее железа (плотность 7,87 г/см 3) в полтора раза, вчетверо тяжелее алюминия (плотность 2,70 г/см 3) и даже более тяжел, чем серебро (плотность 10,5 г/см 3). Однако многие металлы, используемые современной промышленностью гораздо тяжелее свинца — золото почти в два раза (плотность 19,3 г/см 3), тантал в полтора раза (плотность 16,6 г/см 3); будучи погруженный в ртуть, свинец всплывает на поверхность, ведь он легче ртути (плотность 13,546 г/см 3).
Природный свинец состоит из пяти стабильных изотопов с массовыми числами 202 (следы), 204 (1,5 %), 206 (23,6 %), 207 (22,6 %), 208 (52,3 %). Причем последние три изотопа — конечные продукты радиоактивных превращений 238 U, 235 U и 232 Th. В ходе ядерных реакций происходит образование многочисленных радиоактивных изотопов свинца.
Свинец наряду с золотом, серебром, оловом, медью, ртутью и железом относится к элементам, известным человечеству с глубокой древности. Существует предположение, что впервые люди выплавили свинец из руды более восьми тысяч лет назад. Еще за 6-7 тысяч лет до нашей эры из этого металла в Месопотамии и Египте изготовляли статуи божеств, предметы культа и домашнего обихода, таблички для письма. Римляне, изобретя водопровод, сделали свинец материалом для труб, несмотря на то, что ядовитость этого металла отмечали еще в первом веке нашей эры греческие врачи Диоскорид и Плиний Старший. Такие соединения свинца, как «свинцовая зола» (PbO) и свинцовые белила (2 PbCO 3 ∙Pb(OH) 2) применялись в Древней Греции и Риме как составные части лекарств и красок. В средневековье семерка древних металлов была в почете у алхимиков и магов, каждый из элементов получил отождествление с одной из известных тогда планет, свинцу соответствовал Сатурн, знаком этой планеты и обозначали металл. Именно свинцу алхимики приписывали способность превращаться в благородные металлы — серебро и золото, по этой причине он был частым участником их химических опытов. С появлением огнестрельного оружия свинец стал применяться в качестве материала для пуль.
Свинец широко используется в технике. Наибольшее его количество расходуется при изготовлении оболочек кабелей и пластин аккумуляторов. В химической промышленности на сернокислотных заводах из свинца изготовляют кожухи башен, змеевики холодильников и многие другие ответственные части аппаратуры, так как серная кислота (даже 80 % концентрации) не разъедает свинец. Свинец используется в оборонной промышленности — идет на изготовление боеприпасов и на выделку дроби. Этот металл входит в состав многих сплавов, например, сплавов для подшипников, типографского сплава (гарта), припоев. Свинец великолепно поглощает опасное гамма-излучение, поэтому его используют в качестве защиты от него при работе с радиоактивными веществами. Определенное количество свинца расходуется на производство тетраэтилсвинца — для повышения октанового числа моторного топлива. Свинец активно используют стекольная и керамическая промышленности для производства хрусталя и специальных лазурей. Свинцовый сурик — вещество ярко-красного цвета (Pb 3 O 4) — является основным ингредиентом краски, применяемой для защиты металлов от коррозии.
Биологические свойства
Свинец, как и большинство других тяжелых металлов, попадая в организм, вызывает отравления, которые могут быть скрытыми (носительство), протекать в легкой, средней тяжести и тяжелой формах. Основные признаки отравления свинцом — лиловато-аспидный окрас края десен, бледно-серая окраска кожных покровов, нарушения в кроветворении, поражения нервной системы, боли в брюшной полости, запоры, тошнота, рвота, подъем АД, температуры тела до 37 °С и выше. При тяжелых формах отравления и хронической интоксикации весьма вероятны необратимые поражения печени, сердечно-сосудистой системы, нарушения в работе эндокринной системы, угнетение иммунной системы организма и онкологические заболевания.
Каковы же причины отравления свинцом и его соединениями? Ранее такими причинами были — употребление воды из свинцовых водопроводов; хранение пищи в глиняной посуде, покрытой глазурью из свинцового сурика или глета; использование свинцовых припоев при починке металлической посуды; широкое использование свинцовых белил (даже в косметических целях) — все это неизбежно приводило к накоплению тяжелого металла в организме. В наши дни, когда о токсичности свинца и его соединений известно каждому, такие факторы проникновения металла в человеческий организм почти исключены. Однако развитие прогресса привело к возникновению огромного ряда новых рисков — это отравления на предприятиях по добыче и выплавке свинца; при производстве красителей на основе восемьдесят второго элемента (в том числе для полиграфии); при получении и использовании тетраэтилсвинца; на предприятиях кабельной промышленности. Ко всему этому нужно прибавить возрастающее загрязнение окружающей среды свинцом и его соединениями, поступающими в атмосферу, почву и воду.
Растения, в том числе потребляемые в пищу, поглощают свинец из почвы, воды и воздуха. В человеческий организм свинец поступает с пищей (более 0,2 мг), водой (0,1 мг) и пылью вдыхаемого воздуха (около 0,1 мг). Причем, поступающий с вдыхаемым воздухом свинец наиболее полно усваивается организмом. Безопасным суточным уровнем поступления свинца в человеческий организм считается 0,2—2 мг. Выделяется главным образом через кишечник (0,22-0,32 мг) и почки (0,03-0,05 мг). В теле взрослого человека в среднем постоянно содержится около 2 мг свинца, причем у жителей крупных промышленных городов содержание свинца выше, чем у сельчан.
Основной концентратор свинца в человеческом теле — костная ткань (90 % всего свинца организма), кроме того, свинец накапливается в печени, поджелудочной железе, почках, головном и спинном мозге, крови.
В качестве лечения отравлений могут рассматриваться некоторые специфические препараты комплексообразователи и общеукрепляющие средства — витаминные комплексы, глюкоза и им подобные. Также необходимы курсы физиотерапии и санаторно-курортное лечение (минеральные воды, грязевые ванны). Необходимы профилактические меры на предприятиях, связанных со свинцом и его соединениями: замена свинцовых белил цинковыми или титановыми; замена тетраэтилсвинца менее токсичными антидетонаторами; автоматизация ряда процессов и операций в производстве свинца; установка мощных вытяжных систем; использование СИЗ и периодические осмотры рабочего персонала.
Тем не менее, несмотря на токсичность свинца и его отравляющее действие на человеческий организм, он может приносить и пользу, что используется в медицине. Свинцовые препараты применяют наружно, как вяжущие и антисептические средства. Примером может служить «свинцовая вода» Pb(CH3COO)2.3H2O, которую применяют при воспалительных заболеваниях кожи и слизистых оболочек, а также при ушибах и ссадинах. Простые и сложные свинцовые пластыри помогают при гнойно-воспалительных заболеваниях кожи, фурункулах. При помощи уксуснокислого свинца получают препараты, стимулирующие деятельность печени при выделении желчи.
В Древнем Египте выплавкой золота занимались исключительно жрецы, ведь процесс считался священным искусством, неким таинством недоступным простым смертным. Поэтому именно служители культа подвергались завоевателями самым жестоким пыткам, однако тайна не была раскрыта в течение долгого времени. Как оказалось, египтяне обрабатывали золотую руду расплавленным свинцом, растворяющим благородные металлы, и таким образом извлекали золото из руд. Получившийся раствор подвергали окислительному обжигу, и свинец превращался в окись. Следующая стадия содержала главный секрет жрецов — горшки для обжига, изготовленные из костяной золы. При плавке окись свинца впитывалась в стенки горшка, увлекая при этом случайные примеси, на дне же оставался чистый сплав.
В современном строительстве свинец используют для уплотнения швов и создания сейсмостойких фундаментов. А ведь традиция использования этого металла в строительных целях идет из глубины веков. Древнегреческий историк Геродот (V в. до н. э.) писал о методе укрепления железных и бронзовых скоб в каменных плитах путем заливки отверстий легкоплавким свинцом. Позднее при раскопках Микен археологи обнаружили свинцовые скобы в каменных стенах. В селении Старый Крым и сейчас сохранились руины так называемой свинцовой мечети, сооруженной в XIV столетии. Такое название здание получило оттого, что зазоры в каменной кладке залиты свинцом.
Существует целая легенда о том, как впервые была получена краска сурик. Свинцовые белила люди научились изготовлять более трех тысяч лет назад, только в те времена этот товар был редкостью и имел весьма высокую цену. По этой причине художники древности с большим нетерпением всегда ожидали в порту торговые корабли, везущие столь драгоценный товар. Не был исключением и великий греческий мастер Никий, который однажды в волнении высматривал корабль с острова Родос (основного поставщика свинцовых белил во всем Средиземноморье), везущий груз с краской. Вскоре корабль вошел в порт, но вспыхнул пожар и ценный груз был поглощен огнем. В безысходной надежде, что огонь пожалел хотя бы один сосуд с краской, Никий вбежал на обгоревший корабль. Огонь не уничтожил сосуды с краской, те лишь обгорели. Как же были удивлены художник и хозяин груза, когда, вскрыв сосуды, они обнаружили вместо белой краски ярко-красную!
Простота получения свинца заключается не только в том, что его легко выплавлять из руд, но и в том, что в отличие от многих других промышленно важных металлов, свинец не требует каких-либо специальных условий (создания вакуума или инертной среды) повышающих качество конечного продукта. Все потому, что газы не оказывают на свинец абсолютно никакого влияния. Ведь кислород, водород, азот, углекислый газ и прочие «вредные» для металлов газы не растворяются ни в жидком, ни в твердом свинце!
Средневековые инквизиторы использовали расплавленный свинец в качестве орудия пытки и казни. Особо несговорчивым (а порой наоборот) лицам металл вливали в горло. В далекой от католичества Индии было похожее наказание, ему подвергались лица низших каст, которые имели несчастье услышать (подслушать) чтение священных книг браминов. Нечестивцу заливали в уши расплавленный свинец.
Одной из венецианских «достопримечательностей» является средневековая тюрьма для государственных преступников, соединенная «Мостом вздохов» с Дворцом дожей. Особенность этой тюрьмы заключается в наличии необычных «VIP» камер на чердаке под крышей из свинца. В летний зной узник изнывал от жары, порой задыхаясь насмерть в такой камере, зимой заключенный замерзал от холода. Прохожие на «Мосту вздохов» могли слышать стенания и мольбы узников, при этом постоянно осознавая силу и власть правителя, находящегося рядом — за стенами Дворца дожей…
История
В ходе раскопок в Древнем Египте археологи обнаружили изделия из серебра и свинца в захоронениях до династического периода. Примерно к этому же времени (8—7 тысячелетие до нашей эры) относятся аналогичные находки, сделанные в районе Месопотамии. Совместные находки изделий из свинца и серебра неудивительны. С давних времен внимание людей привлекли красивые тяжелые кристаллы свинцового блеска PbS — наиболее важной руды, из которой добывается свинец. Богатые залежи этого минерала находили в горах Армении и в центральных районах Малой Азии. Минерал галенит помимо свинца содержит значительные примеси серебра и серы и если положить куски этого минерала в костер, то сера выгорит и потечет расплавленный свинец — древесный уголь препятствует окислению свинца. В шестом веке до нашей эры богатые залежи галенита были обнаружены в Лаврионе — гористой местности недалеко от Афин, а во времена римских пунических войн на территории современной Испании в многочисленных шахтах, заложенных еще финикийцами, активно добывался свинец, который римские инженеры использовали в строительстве труб водопровода.
Определенно установить первичное значение слова «свинец» не удалось до сих пор, так как неизвестно происхождение самого слова. Догадок и предположений множество. Так одни лингвисты утверждают, что греческое название свинца связано с определенной местностью, где его добывали. Некоторые филологи ошибочно сопоставляют более ранее греческое название с поздним латинским plumbum и утверждают, что последнее слово образовалось из mlumbum, а оба слова берут корни от санскритского bahu-mala, что можно перевести, как «очень грязный». Кстати, считается, что слово «пломба» произошло именно от латинского plumbum, а по-французски название восемьдесят второго элемента так и звучит — plomb. Это связано с тем, что мягкий металл с древних времен было принято использовать в качестве печатей и пломб. Даже в наше время товарные вагоны и складские помещения опечатывают свинцовыми пломбами.
Достоверно можно утверждать, что свинец часто путали с оловом, в XVII в. различали plumbum album (белый свинец, т. е. олово) и plumbum nigrum (черный свинец — собственно свинец). Можно было бы предположить, что в путанице виновны средневековые алхимики, именовавшие свинец множеством секретных имен, и трактовавших греческое название, как как plumbago — свинцовая руда. Однако такая путаница существует и в более ранних славянских названиях свинца. Так на древнеболгарском, сербскохорватском, чешском и польских языках свинец именовался оловом! О чем свидетельствует сохранившееся до нашего времени чешское название свинца — olovo.
Немецкое имя свинца — blei вероятно берет свои корни из древнегерманского blio (bliw), а то в свою очередь созвучно с литовским bleivas (свет, ясный). Вполне возможно, что от немецкого blei происходит и английское слово lead (свинец) и датское lood.
Происхождение русского слова «свинец» неизвестно, также как и близких восточнославянских — украинского (свинець) и белорусского (свінец). Кроме того, созвучие имеется в балтийской группе языков: литовский švinas и латышский svins. Существует теория о том, что эти слова следует связывать со словом «вино», что в свою очередь идет от традиции древних римлян и некоторых кавказских народов хранить вино в свинцовых сосудах для придания ему определенного своеобразного вкуса. Однако эта теория не подтверждена и имеет малую доказательную базу своей правоты.
Благодаря археологическим находкам стало известно, что древние мореплаватели обшивали корпуса деревянных кораблей тонкими пластинами из свинца. Одно из таких судов было поднято со дна Средиземного моря в 1954 году недалеко от Марселя. Древнегреческий корабль ученые датировали третьим веком до нашей эры! А уже в средние века крыши дворцов и шпили некоторых церквей покрывали свинцовыми пластинами, которые были устойчивы ко многим атмосферным явлениям.
Нахождение в природе
Свинец довольно редкий металл, его содержание в земной коре (кларк) составляет 1,6·10 -3 % по массе. Однако этот элемент гораздо более распространен, чем его ближайшие соседи по периоду — золото (всего 5∙10 -7 %), ртуть (1∙10 -6 %) и висмут (2∙10 -5 %). Очевидно, что данный факт связан с постепенным накоплением свинца в земной коре за счет ядерных реакций проходящих в недрах нашей планеты — изотопы свинца являющиеся конечными продуктами распада урана и тория, постепенно пополняют запасы Земли восемьдесят вторым элементом уже в течение миллиардов лет и процесс этот продолжается.
Основное скопление свинцовых минералов (более 80 — главный из них галенит PbS) связано с формированием гидротермальных месторождений. Кроме гидротермальных месторождений, некоторое значение имеют также окисленные (вторичные) руды — это полиметаллические руды, образующиеся в результате процессов выветривания приповерхностных частей рудных тел (до глубины 100-200 метров). Они обычно представлены гидроокислами железа, содержащими сульфаты (англезит PbSO 4), карбонаты (церуссит РbCO 3), фосфаты — пироморфит Рb 5 (РО 4) 3 Сl, смитсонит ZnCO 3 , каламин Zn 4 ∙H 2 O, малахит, азурит и другие.
И если свинец и цинк — главные ценные компоненты комплексных полиметаллических руд, то их спутниками часто являются более ценные металлы — золото, серебро, кадмий, олово, индий, галлий и иногда висмут. Содержания основных ценных компонентов в промышленных месторождениях полиметаллических руд колеблются от нескольких процентов и до более чем 10 %. В зависимости от концентрации рудных минералов различают сплошные или вкрапленные полиметаллические руды. Рудные тела полиметаллических руд отличаются разнообразием размеров, имея длину от нескольких метров до километра. Различны по морфологии — гнезда, пластообразные и линзообразные залежи, жилы, штоки, сложные трубообразные тела. Также различны условия залегания — пологие, крутые, секущие, согласные и другие.
При переработке полиметаллических руд получают два основных вида концентратов, содержащих соответственно 40-70 % свинца и 40-60 % цинка и меди.
Основные месторождения полиметаллических руд в России и странах СНГ — Алтай, Сибирь, Северный Кавказ, Приморский край, Казахстан. Богаты залежами полиметаллических комплексных руд Соединенные Штаты Америки, Канада, Австралия, Испания, Германия.
В биосфере свинец рассеян — его мало в живом веществе (5·10 -5 %) и морской воде (3·10 -9 %). Из природных вод этот металл отчасти сорбируется глинами и осаждается сероводородом, поэтому он накапливается в морских илах с сероводородным заражением и в образовавшихся из них черных глинах и сланцах.
Доказательством значимости свинцовых руд может служить один исторический факт. В рудниках, расположенных недалеко от Афин, греки из добываемого в шахтах свинца извлекали серебро методом купелирования (VI в. до н.э.). Причем древним «металлургам» удавалось извлечь практически весь драгоценный металл! Современные исследования утверждают, что серебра в породе оставалось всего 0,02 %. Вслед за греками отвалы перерабатывали римляне, добывая как свинец, так и остаточное серебро, содержание которого им удалось довести до 0,01 % и менее. Казалось бы — руда пуста и поэтому рудник был заброшен почти две тысячи лет. Однако в конце девятнадцатого века отвалы вновь стали перерабатывать на этот раз исключительно ради серебра, содержание которого составляло менее 0,01 %. На современных же металлургических предприятиях в свинце оставляют еще в сотни раз меньше драгоценного металла.
Применение
С древнейших времен свинец широко использовался человечеством, и области его применения были весьма разнообразны. Древние греки и египтяне использовали этот металл для очистки золота и серебра методом купелирования. Многие народы использовали расплавленный металл в качестве цементирующего раствора при строительстве зданий. Римляне использовали свинец в качестве материала для трубопроводов водопровода, а средневековые европейцы изготовляли из этого металла водостоки и дренажные трубы, облицовывали крыши некоторых зданий. С появлением огнестрельного оружия свинец стал главным материалом при изготовлении пуль и дроби.
В наше время восемьдесят второй элемент и его соединения лишь расширили сферы своего потребления. Аккумуляторная промышленность — один из самых емких потребителей свинца. Огромное количество металла (в некоторых странах до 75 % от всего объема производимого) расходуется на производство свинцовых аккумуляторов. Более прочные и менее тяжелые щелочные аккумуляторы активно завоевывают рынок, однако более емкие и мощные свинцовые аккумуляторы не сдают своих позиций.
Немало свинца расходуется на нужды химической промышленности при изготовлении заводской аппаратуры, стойкой в агрессивных газах и жидкостях. Так в сернокислотной промышленности основное оборудование — трубы, камеры, желоба, промывные башни, холодильники, детали насосов — все это изготовляется из свинца или свинцом облицовывается. Вращающиеся детали и механизмы (мешалки, крыльчатки вентилятора, вращающиеся барабаны) изготовляют из свинцово-сурьмянистого сплава гартблея.
Кабельная промышленность — еще один серьезный потребитель свинца, на эти цели в мире расходуется до 20 % этого металла. Им предохраняют от коррозии телеграфные и электрические провода при подземной или подводной прокладке.
До конца шестидесятых годов двадцатого века росло производство тетраэтилсвинца Pb(С2 Н5)4 — бесцветной ядовитой жидкости, которая является превосходным антидетонатором, улучшающим качество топлива. Однако после того как ученые подсчитали, что ежегодно с автомобильными выхлопами выбрасываются сотни тысяч тонн свинца, отравляя окружающую среду, многие страны сократили потребление ядовитого металла, а некоторое полностью отказались от его использования.
В связи с высокой плотностью и тяжестью свинца его применение в оружейном деле было известно задолго до появления огнестрельного оружия — пращники армии Ганнибала метали в римлян свинцовые шары. Лишь позже люди стали отливать из свинца пули и дробь. Для придания большей твердости к свинцу добавляют другие элементы, так при изготовлении шрапнели, в свинец добавляют до 12 % сурьмы, а свинец ружейной дроби содержит не более 1 % мышьяка. Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ. Кроме того, свинец входит в состав некоторых инициирующих взрывчатых веществ (детонаторы): азид (PbN6) и тринитрорезорцинат свинца (ТНРС).
Свинец активно поглощает гамма- и рентгеновские лучи, благодаря чему его применяют как материал для защиты от их действия (контейнеры для хранения радиоактивных веществ, аппаратура рентгеновских кабинетов и других).
Главные компоненты типографских сплавов — свинец, олово и сурьма. Причем свинец и олово использовались в книгопечатании с первых его шагов, но не были единым сплавом, каковым являются в современной типографии.
Такое же, если не большее значение имеют соединения свинца, так некоторые соединения свинца защищают металл от коррозии не в условиях агрессивных сред, а просто на воздухе. Эти соединения вводят в состав лакокрасочных покрытий, например, свинцовые белила (затертая на олифе основная углекислая соль свинца 2PbCO3 Pb(OH)2), которые обладают рядом замечательных качеств: высокая кроющая способность, прочность и долговечность образуемой пленки, устойчивость к действию воздуха и света. Однако есть несколько отрицательных моментов, которые сводят применение свинцовых белил к минимуму (наружная окраска судов и металлоконструкций) — высокая токсичность и восприимчивость к сероводороду. В состав масляных красок входят и другие соединения свинца. Ранее в качестве желтого пигмента использовали глет PbO, который сменил свинцовый крон PbCrO4, однако использование свинцового глета продолжается — в качестве вещества ускоряющего высыхания масел (сиккатив). По сей день самый популярный и массовый пигмент на свинцовой основе — сурик Pb3O4. Этой замечательной краской ярко-красного цвета красят, в частности, подводные части кораблей.
Арсенат Pb3(AsO4)2 и арсенит свинца Pb3(AsO3)2 применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
Производство
Наиболее важная руда, из которой добывается свинец — свинцовый блеск PbS, а также комплексные сульфидные полиметаллические руды. Первая металлургическая операция при получении свинца это окислительный обжиг концентрата в агломерационных ленточных машинах непрерывного действия. При обжиге сульфид свинца превращается в оксид:
2PbS + ЗО2 → 2РbО + 2SO2
Помимо этого, получается и немного сульфата PbSO4, который переводят в силикат PbSiO3, для чего в шихту добавляют кварцевый песок и другие флюсы (CaCO3, Fe2O3), благодаря которым образуется жидкая фаза, цементирующая шихту.
В ходе реакции окисляются и сульфиды других металлов (медь, цинк, железо), присутствующие как примеси. Конечным результатом обжига вместо порошкообразной смеси сульфидов получают агломерат — пористую спекшуюся сплошную массу, состоящую преимущественно из оксидов РbО, CuO, ZnO, Fe2O3. Полученный агломерат содержит 35-45 % свинца. Куски агломерата смешивают с коксом и известняком и эту смесь загружают в ватержакетную печь, в которую снизу через трубы («фурмы») подают воздух под давлением. Кокс и оксид углерода (II) восстанавливают оксид свинца до свинца уже при невысоких температурах (до 500 °С):
PbO + C → Pb + CO
PbO + CO → Pb + CO2
При более высоких температурах идут другие реакции:
СаСО3 → СаО + СО2
2РbSiO3 + 2СаО + С → 2Рb + 2CaSiO3+ CO2
Оксиды цинка и железа, находящиеся в виде примесей в шихте, частично переходят в ZnSiO3 и FeSiO3, которые вместе с CaSiO3 образуют шлак, всплывающий на поверхность. Оксиды свинца восстанавливаются до металла. Процесс протекает в два этапа:
2PbS + 3O2 → 2PbO + 2SO2,
PbS + 2PbO → 3Pb + SO2
Сырой — черновой свинец содержит 92-98 % Pb, остальное — примеси меди, серебра (иногда золота), цинка, олова, мышьяка, сурьмы, Bi, Fe, которые удаляют различными методами, так медь и железо удаляют зейгерованием. Для удаления олова, сурьмы и мышьяка через расплавленный металл продувают воздух. Выделение золота и серебра производится добавкой цинка, который образует «цинковую пену», состоящую из соединений цинк с серебром (и золотом), более легких, чем свинец, и плавящихся при 600-700° C. Затем избыток цинка удаляют из расплавленного свинца пропусканием воздуха, водяного пара или хлора. Для очистки от висмута к жидкому свинцу добавляют магний или кальций, которые образуют трудноплавкие соединения Ca3Bi2 и Mg3Bi2. Рафинированный этими способами свинец содержит 99,8-99,9 % Рb. Дальнейшая очистка производится электролизом, в результате чего достигается чистота не менее 99,99 %. Электролитом служит водный раствор фторосиликата свинца PbSiF6. На катоде оседает чистый свинец, а примеси концентрируются в анодном шламе, содержащем много ценных компонентов, которые затем выделяют.
Объем добываемого свинца во всем мире растет каждый год. Так в начале девятнадцатого века во всем мире было добыто около 30 000 тонн. Спустя пятьдесят лет уже 130 000 тонн, в 1875 — 320 000 тонн, в 1900 — 850 000 тонн, 1950 — почти 2 млн тонн, а в настоящее время в год добывают около пяти млн тонн. Соответственно растет и потребление свинца. По объему производства свинец занимает четвертое место среди цветных металлов — после алюминия, меди и цинка. Можно выделить несколько стран — лидеров по производству и потреблению свинца (включая вторичный свинец) — это Китай, Соединенные Штаты Америки, Корея и страны Европейского Союза. В то же самое время многие страны в виду ядовитости соединений свинца отказываются от его употребления, так Германия и Голландия ограничили употребления этого металла, а Дания, Австрия и Швейцария, вообще запретили использование свинца. К этому стремятся все страны ЕС. Россия и США развивают технологии, которые помогут найти альтернативу применению свинца.
Физические свойства
Свинец — металл темно-серого цвета, на свежем срезе блестит и имеет светло-серый оттенок, отливающий синевой. Однако на воздухе быстро окисляется и покрывается защитной пленкой окисла. Свинец — тяжелый металл, его плотность 11,34 г/см3 (при температуре 20 °C), кристаллизуется в гранецентрированной кубической решетке (а = 4,9389A), аллотропических модификаций не имеет. Атомный радиус 1,75A, ионные радиусы: Рb2+ 1,26A, Рb4+ 0,76A.
У восемьдесят второго элемента немало ценных физических качеств, важных для промышленности, например низкая температура плавления — всего 327,4 °C (621,32 °F или 600,55 K), что позволяет сравнительно легко получать металл из руд. При переработке главного свинцового минерала — галенита (PbS) — металл легко отделяется от серы, для этого достаточно обжечь руду в смеси с углем на воздухе. Температура кипения восемьдесят второго элемента 1 740 °C (3 164 °F или 2 013,15 K), металл проявляет летучесть уже при 700 °C. Удельная теплоемкость свинца при комнатной температуре 0,128 кДж/(кг∙К) или 0,0306 кал/г∙°С. Свинец имеет довольно низкую теплопроводность 33,5 вт/(м∙К) или 0,08 кал/см∙сек∙°C при температуре 0 °C , температурный коэффициент линейного расширения свинца 29,1∙10-6 при комнатной температуре.
Другое важное для промышленности качество свинца — его высокая пластичность — металл легко куется, прокатывается в листы и проволоку, что позволяет применять его в машиностроительной промышленности для изготовления различных сплавов с другими металлами. Известно, что при давлении 2 т/см2 свинцовая стружка спрессовывается в сплошную монолитную массу. При увеличении давления до 5 т/см2 металл из твердого состояния переходит в текучее. Свинцовую проволоку получают, продавливая через фильеру не расплав, а твердый свинец, потому что обычным волочением ее изготовить невозможно в связи с малой разрывной прочностью свинца. Предел прочности при растяжении для свинца 12-13 Мн/м2, предел прочности при сжатии около 50 Мн/м2; относительное удлинение при разрыве 50-70 %. Твердость свинца по Бринеллю 25-40 Мн/м2 (2,5-4 кгс/мм2). Известно, что наклеп не повышает механических свойств свинца, так как температура его рекристаллизации лежит ниже комнатной (в пределах -35°C при степени деформации 40% и выше).
Восемьдесят второй элемент — один из первых металлов, переведенных в состояние сверхпроводимости. Кстати, температура, ниже которой свинец приобретает способность пропускать электрический ток без малейшего сопротивления, довольно высока — 7,17 °K. Для сравнения у олова эта температура равна 3,72 °K, у цинка — 0,82 °K, у титана — всего 0,4 °K. Именно из свинца была сделана обмотка первого сверхпроводящего трансформатора, построенного в 1961 году.
Металлический свинец — очень хорошая защита от всех видов радиоактивного излучения и рентгеновских лучей. Встречаясь с веществом, фотон или квант любого излучения тратит свою энергию, именно этим выражается его поглощение. Чем плотнее среда, через которую проходят лучи, тем сильнее она их задерживает. Свинец в этом отношении весьма подходящий материал — он довольно плотен. Ударяясь о поверхность металла, гамма-кванты выбивают из нее электроны, на что расходуют свою энергию. Чем больше атомный номер элемента, тем труднее выбить электрон с его внешней орбиты из-за большей силы притяжения ядром. Пятнадцати-двадцати-сантиметрового слоя свинца достаточно, чтобы предохранить людей от действия излучения любого известного науке вида. По этой-то причине свинец введен в резину фартука и защитных рукавиц врача-рентгенолога, задерживая рентгеновские лучи и предохраняя организм от их губительного действия. Защищает от радиоактивного излучения и стекло, содержащее окислы свинца.
Химические свойства
Химически свинец сравнительно малоактивен — в электрохимическом ряду напряжений этот металл стоит непосредственно перед водородом.
На воздухе восемьдесят второй элемент быстро окисляется, покрываясь тонкой пленкой оксида PbO, препятствующему дальнейшему разрушению металла. Вода сама по себе не взаимодействует со свинцом, но в присутствии кислорода металл постепенно разрушается водой с образованием амфотерного гидроксида свинца (II):
2Pb + O2 + 2H2O → 2Pb(OH)2
При соприкосновении с жесткой водой свинец покрывается защитной пленкой нерастворимых солей (в основном сульфата и основного карбоната свинца), препятствующей дальнейшему действию воды и образованию гидроксида.
Разбавленные соляная и серная кислоты почти не действуют на свинец. Это связано со значительным перенапряжением выделения водорода на свинцовой поверхности, а также с образованием защитных пленок трудно-растворимых хлорида РbCl2 и сульфата PbSO4 свинца, закрывающих поверхность растворяющегося металла. Концентрированные серная H2SO4 и хлорная НCl кислоты, особенно при нагревании, действуют на восемьдесят второй элемент, причем получаются растворимые комплексные соединения состава Pb(HSO4)2 и Н2[РbCl4]. В HNO3 свинец растворяется легко, причем в кислоте низкой концентрации быстрее, чем в концентрированной азотной кислоте. Это явление легко объяснить — растворимость продукта коррозии (нитрата свинца) снижается с увеличением концентрации кислоты.
Pb + 4HNO3 → Pb(NO3)2 + 2NO2 + H2O
Сравнительно легко свинец растворяется рядом органических кислот: уксусной (CH3COOH), лимонной, муравьиной (HCOOH), это связано с тем фактом, что органические кислоты образуют свинцовые легкорастворимые соли, которые ни в коей мере не могут защитить поверхность металла.
В щелочах свинец также растворяется, хотя и с небольшой скоростью. Концентрированные растворы едких щелочей при нагревании реагируют со свинцом с выделением водорода и гидроксоплюмбитов типа Х2[Рb(ОН)4], например:
Pb + 4KOH + 2H2O → K4 + H2
По растворимости в воде соли свинца делятся на растворимые (ацетат, нитрат и хлорат свинца), малорастворимые (хлорид и фторид) и нерастворимые (сульфат, карбонат, хромат, фосфат, молибдат и сульфид). Все растворимые соединения свинца ядовиты. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Pb(NO3)2 + H2O → Pb(OH)NO3 + HNO3
Для восемьдесят второго элемента характерны степени окисления +2 и +4. Значительно более устойчивы и многочисленны соединения со степенью окисления свинца +2.
Соединение свинца с водородом PbH4 получается в небольших количествах при действии разбавленной соляной кислоты на Mg2Pb. PbH4 — бесцветный газ, который очень легко разлагается на свинец и водород. С азотом свинец не реагирует. Азид свинца Pb(N3)2 — получаемый взаимодействием растворов азида натрия NaN3 и солей свинца (II) — бесцветные игольчатые кристаллы труднорастворимые в воде, при ударе или нагреве разлагается на свинец и азот со взрывом. Сера действует на свинец при нагревании с образованием сульфида PbS — черного амфотерного порошка. Сульфид может быть получен также при пропускании сероводорода в растворы солей Pb (II). В природе сульфид встречается в виде свинцового блеска — галенита.
При нагревании свинец соединяется с галогенами, образуя галогениды PbX2, где X — галоген. Все они малорастворимы в воде. Получены также галогениды PbX4: тетрафторид PbF4 — бесцветные кристаллы и тетрахлорид PbCl4 — желтая маслянистая жидкость. Оба соединения легко разлагаются водой, выделяя фтор или хлор; гидролизуются водой.
Свинец (Pb) — мягкий серебристо-белый или сероватый металл 14-й (IVa) группы периодической таблицы с атомным номером 82. Это очень податливое, пластичное и плотное вещество, которое плохо проводит электричество. Электронная формула свинца — [Хе] 4f 14 5d 10 6s 2 6p 2 . Известный в древности и считавшийся алхимиками старейшим из металлов, он очень долговечен и устойчив к коррозии, о чем свидетельствует продолжающаяся эксплуатация водопроводных труб, установленных древними римлянами. Символ Pb в химической формуле свинца является аббревиатурой латинского слова plumbum.
Распространенность в природе
Свинец часто упоминается в ранних библейских текстах. Вавилоняне использовали металл для изготовления пластин для письма. Римляне делали из него водопроводные трубы, монеты и даже кухонные принадлежности. Результатом последнего стало отравление населения свинцом в эпоху императора Августа Цезаря. Соединение, известное как белый свинец, использовалось в качестве декоративного пигмента еще в 200 г. до н. э.
В весовом отношении содержание свинца в земной коре соответствует олову. В космосе на 10 6 атомов кремния приходится 0,47 атома свинца. Это сопоставимо с содержанием цезия, празеодима, гафния и вольфрама, каждый из которых рассматривается как достаточно дефицитный элемент.
Добыча
Хотя свинца не так много, процессы естественной концентрации привели к значительным залежам коммерческого значения, особенно в Соединенных Штатах, Канаде, Австралии, Испании, Германии, Африке и Южной Америке. Редко встречающийся в чистом виде свинец присутствует в нескольких минералах, но все они имеют второстепенное значение, за исключением сульфида PbS (галенита), который является основным источником промышленного производства данного химического элемента во всем мире. Металл также содержится в англезите (PbSO 4) и церуссите (PbCO 3). К началу XXI в. ведущими мировыми производителями концентрата свинца являлись такие страны, как Китай, Австралия, США, Перу, Мексика и Индия.
Свинец может быть извлечен путем обжига руды с последующей плавкой в доменной печи или методом прямой плавки. Примеси удаляются в ходе дополнительной очистки. Почти половина всего очищенного свинца извлекается из переработанного лома.
Химические свойства
Элементарный свинец может быть окислен до иона Pb 2+ ионами водорода, но нерастворимость его большинства солей делает этот химический элемент устойчивым к воздействию многих кислот. Окисление в щелочной среде происходит легче и благоприятствует образованию растворимых соединений при степени окисления свинца +2. Оксид PbO 2 с ионом Pb 4+ является одним из в кислом растворе, но он сравнительно слабый в щелочном растворе. Окисление свинца облегчается путем образования комплексов. Электроосаждение лучше всего проводить из водных растворов, содержащих гексафторсиликат свинца и гексафторсиликатную кислоту.
На воздухе металл быстро окисляется, образуя тусклое серое покрытие, ранее считавшееся субоксидом Pb 2 O. Теперь общепризнано, что это смесь Pb и оксида PbO, который защищает металл от дальнейшей коррозии. Хотя свинец растворяется в разбавленной азотной кислоте, он лишь поверхностно подвергается воздействию соляной или серной кислот, потому что образующиеся нерастворимые хлориды (PbCl 2) или сульфаты (PbSO 4) предотвращают продолжение реакции. Химические свойства свинца, обуславливающие его общую стойкость, позволяют использовать металл для изготовления кровельных материалов, оболочки электрических кабелей, размещенных в грунте или под водой, и в качестве прокладки для водопроводных труб и конструкций, служащих для транспортировки и переработки коррозионных веществ.
Применение свинца
Известна только одна кристаллическая модификация данного химического элемента с плотно упакованной металлической решеткой. В свободном состоянии проявляется нулевая степень окисления свинца (как и любого другого вещества). Широкое применение элементарной формы элемента обусловлено ее пластичностью, легкостью сварки, низкой температурой плавления, высокой плотностью и способностью поглощать гамма- и рентгеновское излучение. Расплавленный свинец является отличным растворителем и позволяет концентрировать свободное серебро и золото. Конструкционное применение свинца ограничено его низкой прочностью на растяжение, усталостью и текучестью даже при малой нагрузке.
Элемент находит применение в производстве аккумуляторных батарей, в боеприпасах (выстрелах и пулях), в составе припоя, типографском, подшипниковых, легких сплавах и сплавах с оловом. В тяжелом и промышленном оборудовании для снижения шума и вибрации могут использоваться детали из соединений свинца. Поскольку металл эффективно поглощает коротковолновое электромагнитное излучение, он применяется для защитного экранирования ядерных реакторов, ускорителей частиц, рентгеновского оборудования и контейнеров для транспортировки и хранения В составе оксида (PbO 2) и сплава с сурьмой или кальцием элемент используется в обычных аккумуляторных батареях.
Действие на организм
Химический элемент свинец и его соединения токсичны и накапливаются в организме в течение длительного периода времени (данное явление известно как кумулятивное отравление) до достижения смертельной дозы. Токсичность возрастает по мере увеличения растворимости соединений. У детей накопление свинца может привести к когнитивным расстройствам. У взрослых оно вызывает прогрессирующую болезнь почек. К симптомам отравления относятся боль в животе и диарея, за которыми следуют запоры, тошнота, рвота, головокружение, головная боль и общая слабость. Устранение контакта с источником свинца обычно является достаточным для лечения. Устранение химического элемента из инсектицидов и пигментных красок, а также использование респираторов и других защитных устройств в местах воздействия значительно уменьшили число случаев отравления свинцом. Признание того, что тетраэтилсвинец Pb (C 2 H 5) 4 в виде антидетонационной присадки к бензину загрязняет воздух и воду, привело к прекращению его применения в 1980-х годах.
Биологическая роль
Свинец не играет никакой биологической роли в организме. Токсичность этого химического элемента вызвана его способностью имитировать такие металлы, как кальций, железо и цинк. Взаимодействие свинца с теми же молекулами белка, что и эти металлы, приводит к прекращению их нормального функционирования.
Ядерные свойства
Химический элемент свинец образуется как в результате нейтронно-абсорбционных процессов, так и при распаде радионуклидов более тяжелых элементов. Существуют 4 стабильных изотопа. Относительная распространенность 204 Pb составляет 1,48 %, 206 Pb — 23,6 %, 207 Pb — 22,6 % и 208 Pb — 52,3 %. Стабильные нуклиды являются конечными продуктами естественного радиоактивного распада урана (до 206 Pb), тория (до 208 Pb) и актиния (до 207 Pb). Известно более 30 радиоактивных изотопа свинца. Из них в процессах естественного распада участвуют 212 Pb (ряд тория), 214 Pb и 210 Pb (серия урана) и 211 Pb (ряд актиния). Атомный вес естественного свинца варьируется от источника к источнику в зависимости от его происхождения.
Монооксиды
В соединениях степени окисления свинца в основном равны +2 и +4. В число наиболее важных из них входят оксиды. Это PbO, в котором химический элемент находится в состоянии +2, диоксид PbO 2 , в котором проявляется высшая степень окисления свинца (+4), и тетраоксид, Pb 3 O 4 .
Монооксид существует в двух модификациях — литарга и глета. Литарг (альфа-оксид свинца) представляет собой красное или красновато-желтое твердое вещество с тетрагональной кристаллической структурой, стабильная форма которого существует при температурах ниже 488 °С. Глет (бета-монооксид свинца) является желтым твердым веществом и имеет орторомбическую кристаллическую структуру. Его стабильная форма существует при температурах, превышающих 488 °C.
Обе формы нерастворимы в воде, но растворяются в кислотах с образованием солей, содержащих ион Pb 2+ или в щелочах с образованием плюмбитов, которые имеют PbO 2 2- -ион. Литарг, который образуется при реакции свинца с кислородом воздуха, является самым важным коммерческим соединением этого химического элемента. Вещество используется в больших количествах непосредственно и как исходный материал для получения других соединений свинца.
Значительное количество PbO расходуется при изготовлении пластин свинцово-кислотных аккумуляторных батарей. Высококачественная стеклянная посуда (хрусталь) содержит до 30 % литарга. Это увеличивает показатель преломления стекла и делает его блестящим, прочным и звонким. Литарг также служит осушителем в лаках и применяется в производстве свинцовокислого натрия, который используется для удаления из бензина неприятно пахнущих тиолов (органических соединений, содержащих серу).
Диоксид
В природе PbO 2 существует в виде коричнево-черного минерала платтнерита, который коммерчески производится из тетраоксида триалада окислением хлором. Он разлагается при нагревании и дает кислород и оксиды с более низкой степенью окисления свинца. PbO 2 используется в качестве окислителя при производстве красителей, химикатов, пиротехники и спиртов и как отвердитель для полисульфидных каучуков.
Тетраоксид трисвинца Pb 3 O 4 (известный как или миниум) получают путем дальнейшего окисления PbO. Это пигмент от оранжево-красного до кирпично-красного цвета, который входит в состав коррозионностойких красок, применяемых для защиты подверженных воздействию окружающей среды железа и стали. Он также реагирует с оксидом железа с образованием феррита, используемого при изготовлении постоянных магнитов.
Ацетат
Также экономически значимым соединением свинца степени окисления +2 является ацетат Pb(C 2 H 3 O 2) 2 . Это водорастворимая соль, получаемая путем растворения глета в концентрированной уксусной кислоте. Общая форма, тригидрат, Pb(C 2 H 3 O 2) 2 · 3H 2 O, называемый сахаром свинца, используется в качестве закрепителя при окрашивании тканей и как сиккатив в некоторых красках. Кроме того, он применяется в производстве других соединений свинца и в установках для цианирования золота, где он в виде PbS служит для осаждения из раствора растворимых сульфидов.
Другие соли
Основные карбонат, сульфат и силикат свинца когда-то широко применялись в качестве пигментов для белых красок наружного применения. Однако с середины ХХ в. использование т. н. белых свинцовых пигментов значительно уменьшилось из-за беспокойства по поводу их токсичности и сопутствующей опасности для здоровья человека. По той же причине практически прекратилось применение арсената свинца в инсектицидах.
Помимо основных состояний окисления (+4 и +2) свинец может иметь отрицательные степени -4, -2, -1 в фазах Цинтля (например, BaPb, Na 8 Ba 8 Pb 6), а +1 и +3 — в свинецорганических соединениях, таких как гексаметилдиплюмбан Pb 2 (CH 3) 6 .
Министерство образования и науки РФ
«Свинец и его свойства»
Выполнил:
Проверил:
СВИНЕЦ (лат. Plumbum), Pb, химический элемент IV группы периодической системы Менделеева, атомный номер 82, атомная масса 207,2.
1.Свойства
Свинец обычно имеет грязно-серый цвет, хотя свежий его разрез имеет синеватый отлив и блестит. Однако блестящий металл быстро покрывается тускло-серой защитной пленкой оксида. Плотность свинца (11,34 г/см3) в полтора раза больше, чем у железа, вчетверо больше, чем у алюминия; даже серебро легче свинца. Недаром в русском языке «свинцовый» – синоним тяжелого: «Ненастной ночи мгла по небу стелется одеждою свинцовой»; «И как свинец пошел ко дну» – эти пушкинские строки напоминают, что со свинцом неразрывно связано понятие гнета, тяжести.
Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
2.Химические свойства
По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ней в виде пушистого налета из мелких кристалликов, имеющего старинного название «сатурнова дерева». Если затормозить реакцию, обернув цинк фильтровальной бумагой, вырастают более крупные кристаллы свинца. Наиболее типична для свинца степень окисления +2; соединения свинца(IV) значительно менее устойчивы. В разбавленных соляной и серной кислотах свинец практически не растворяется, в том числе из-за образования на поверхности нерастворимой пленки хлорида или сульфата. С крепкой серной кислотой (при концентрации более 80%) свинец реагирует с образованием растворимого гидросульфата Pb(HSO4)2, а в горячей концентрированной соляной кислоте растворение сопровождается образованием комплексного хлорида H 4
PbCl 6
. Разбавленной азотной кислотой свинец легко окисляется:
Pb + 4HNO 3
= Pb(NO 3) 2
+ 2NO 2
+ H 2
O.
Разложение нитрата свинца(II) при нагревании – удобный лабораторный метод получения диоксида азота:
2Pb(NO 3) 2
= 2PbO + 4NO 2
+ O 2
.
В присутствии кислорода свинец растворяется также в ряде органических кислот. При действии уксусной кислоты образуется легкорастворимый ацетат Pb(CH 3
COO) 2
(старинное название – «свинцовый сахар»). Свинец заметно растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Pb(NO 3) 2
+ H 2
O = Pb(OH)NO 3
+ HNO 3
.
Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства. Свинец медленно растворяется и в концентрированных щелочах с выделением водорода:
Pb + 2NaOH + 2H 2
O = Na 2
Pb(OH) 4
+ H 2
что указывает на амфотерные свойства соединений свинца. Белый гидроксид свинца(II), легко осаждаемый из растворов его солей, также растворяется как в кислотах, так и в сильных щелочах:
Pb(OH) 2
+ 2HNO 3
= Pb(NO 3) 2
+ 2H 2
O;
Pb(OH) 2
+ 2NaOH = Na 2
Pb(OH) 4
При стоянии или нагревании Pb(OH) 2
разлагается с выделением PbO. При сплавлении PbO со щелочью образуется плюмбит состава Na 2
PbO 2
. Из щелочного раствора тетрагидроксоплюмбата натрия Na2Pb(OH)4 тоже можно вытеснить свинец более активным металлом. Если в такой нагретый раствор положить маленькую гранулу алюминия, быстро образуется серый пушистый шарик, который насыщен мелкими пузырьками выделяющегося водорода и потому всплывает. Если алюминий взять в виде проволоки, выделяющийся на ней свинец превращает ее в серую «змею». При нагревании свинец реагирует с кислородом, серой и галогенами. Так, в реакции с хлором образуется тетрахлорид PbCl 4
– желтая жидкость, дымящая на воздухе из-за гидролиза, а при нагревании разлагающаяся на PbCl 2
и Cl 2
. (Галогениды PbBr 4
и PbI 4
не существуют, так как Pb(IV) – сильный окислитель, который окислил бы бромид- и иодид-анионы.) Тонкоизмельченный свинец обладает пирофорными свойствами – вспыхивает на воздухе. При продолжительном нагревании расплавленного свинца он постепенно переходит сначала в желтый оксид PbO (свинцовый глет), а затем (при хорошем доступе воздуха) – в красный сурик Pb 3
O 4
или 2PbO·PbO 2
. Это соединение можно рассматривать также как свинцовую соль ортосвинцовой кислоты Pb 2
. С помощью сильных окислителей, например, хлорной извести, соединения свинца(II) можно окислить до диоксида:
Pb(CH 3
COO) 2
+ Ca(ClO)Cl + H 2
O = PbO 2
+ CaCl 2
+ 2CH 3
COOH
Диоксид образуется также при обработке сурика азотной кислотой:
Pb 3
O 4
+ 4HNO 3
= PbO 2
+ 2Pb(NO 3) 2
+ 2H 2
O.
Если сильно нагревать коричневый диоксид, то при температуре около 300° С он превратится в оранжевый Pb 2
O 3
(PbO·PbO 2), при 400° С – в красный Pb 3
O 4
, а выше 530° С – в желтый PbO (разложение сопровождается выделением кислорода). В смеси с безводным глицерином свинцовый глет медленно, в течение 30–40 минут реагирует с образованием водоупорной и термостойкой твердой замазки, которой можно склеивать металл, стекло и камень. Диоксид свинца – сильный окислитель. Струя сероводорода, направленная на сухой диоксид, загорается; концентрированная соляная кислота окисляется им до хлора:
PbO 2
+ 4HCl = PbCl 2
+ Cl 2
+ H 2
O,
сернистый газ – до сульфата:
PbO 2
+ SO 2
= PbSO 4
,
а соли Mn 2+
– до перманганат-ионов:
5PbO 2
+ 2MnSO 4
+ H 2
SO 4
= 5PbSO 4
+ 2HMnO 4
+ 2H 2
O.
Диоксид свинца образуется, а затем расходуется при зарядке и последующем разряде самых распространенных кислотных аккумуляторов. Соединения свинца(IV) обладают еще более типичными амфотерными свойствами. Так, нерастворимый гидроксид Pb(OH) 4
бурого цвета легко растворяется в кислотах и щелочах:
Pb(OH) 4
+ 6HCl = H 2
PbCl 6
;
Pb(OH) 4
+ 2NaOH = Na 2
Pb(OH) 6
.
Диоксид свинца, реагируя со щелочью, также образует комплексный плюмбат(IV):
PbO 2
+ 2NaOH + 2H 2
O = Na 2
.
Если же PbO2 сплавить с твердой щелочью, образуется плюмбат состава Na2PbO3. Из соединений, в которых свинец(IV) входит в состав катиона, наиболее важен тетраацетат. Его можно получить кипячением сурика с безводной уксусной кислотой:
Pb 3
O 4
+ 8CH 3
COOH = Pb(CH 3
COO) 4
+ 2Pb(CH 3
COO) 2
+ 4H 2
O.
При охлаждении из раствора выделяются бесцветные кристаллы тетраацетата свинца. Другой способ – окисление ацетата свинца(II) хлором:
2Pb(CH 3
COO) 2
+ Cl 2
= Pb(CH 3
COO) 4
+ PbCl 2
.
Водой тетраацетат мгновенно гидролизуется до PbO 2
и CH 3
COOH. Тетраацетат свинца находит применение в органической химии в качестве селективного окислителя. Например, он весьма избирательно окисляет только некоторые гидроксильные группы в молекулах целлюлозы, а 5-фенил-1-пентанол под действием тетраацетата свинца окисляется с одновременной циклизацией и образованием 2-бензилфурана. Органические производные свинца – бесцветные очень ядовитые жидкости. Один из методов их синтеза – действие алкилгалогенидов на сплав свинца с натрием:
4C 2
H 5
Cl + 4PbNa = (C 2
H 5) 4
Pb + 4NaCl + 3Pb
Действием газообразного HCl можно отщеплять от тетразамещенных свинца один алкильный радикал за другим, заменяя их на хлор. Соединения R4Pb разлагаются при нагревании с образованием тонкой пленки чистого металла. Такое разложение тетраметилсвинца было использовано для определения времени жизни свободных радикалов. Тетраэтилсвинец – антидетонатор моторного топлива.
3.Применение
Используют для изготовления пластин для аккумуляторов (около 30% выплавляемого свинца), оболочек электрических кабелей, защиты от гамма-излучения (стенки из свинцовых кирпичей), как компонент типографских и антифрикционных сплавов, полупроводниковых материалов
Содержание статьи
СВИНЕЦ
– химический элемент IV группы периодической таблицы. Относительная атомная масса (A
r = 207,2) является усредненной из масс нескольких изотопов: 204 Pb (1,4%), 206 Pb (24,1%), 207 Pb (22,1%) и 208 Pb (52,4%). Последние три нуклида – конечные продукты естественных радиоактивных превращений урана , актиния и тория. Известно также более 20 радиоактивных изотопов свинца, из которых наиболее долгоживущие – 202 Pb и 205 Pb (с периодами полураспада 300 тысяч и 15 млн. лет). В природе образуются также и короткоживущие изотопы свинца с массовыми числами 209, 210, 212 и 214 с периодами полураспада соответственно 3,25 ч, 27,1 года, 10,64 ч и 26,8 мин. Соотношение различных изотопов в разных образцах свинцовых руд может несколько различаться, что не дает возможности определить для свинца значение A
r с большей точностью.
В земной коре свинца немного – 0,0016% по массе, но этот один из самых тяжелых металлов распространен гораздо больше, чем его ближайшие соседи – золото, ртуть и висмут. Это связано с тем, что разные изотопы свинца являются конечными продуктами распада урана и тория, так что содержание свинца в земной коре медленно увеличивалось в течение миллиардов лет.
Известно много рудных месторождений, богатых свинцом, причем металл легко выделяется из минералов. Всего известно более ста свинцовых минералов. Из них основные – галенит (свинцовый блеск) PbS и продукты его химических превращений – англезит (свинцовый купорос) PbSO 4 и церуссит («белая свинцовая руда») PbCO 3 . Реже встречаются пироморфит («зеленая свинцовая руда») PbCl 2 ·3Pb 3 (PO 4) 2 , миметит PbCl 2 ·3Pb 3 (AsO 4) 2 , крокоит («красная свинцовая руда») PbCrO 4 , вульфенит («желтая свинцовая руда») PbMoO 4 , штольцит PbWO 4 . В свинцовых рудах часто находятся также другие металлы – медь, цинк, кадмий, серебро, золото, висмут и др. В месте залегания свинцовых руд этим элементом обогащена почва (до 1% Pb), растения и воды.
В сильноокислительной щелочной среде степей и пустынь возможно образование диоксида свинца – минерала платтнерита. И исключительно редко встречается самородный металлический свинец.
История.
Происхождение слова «свинец» неясно. В старину свинец не всегда четко отличали от олова. В большинстве славянских языков (болгарском, сербскохорватском, чешском, польском) свинец и называется оловом. Наш же «свинец» встречается только в языках балтийской группы: svinas (литовский), svin (латышский). У некоторых горе-переводчиков это приводило к забавным недоразумениям, например, к «оловянным аккумуляторам» в автомобилях. Английское название свинца lead и голландское lood, возможно, связаны с нашим «лудить». Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber – водопроводчик (когда-то трубы зачеканивали мягким свинцом. И еще одна путаница, связанная со свинцом. Древние греки называли свинец «молибдос» (название сохранилось и в новогреческом языке). Отсюда – латинское molibdaena: так в средние века называли и свинцовый блеск PbS, и более редкий молибденовый блеск (MoS 2), и другие похожие минералы, оставлявшие черный след на светлой поверхности. Такой же след оставляли графит и сам свинец. Тонкими свинцовыми стержнями можно было писать на пергаменте; недаром по-немецки карандаш – Bleistift, т.е. свинцовый стержень.
Свинец вместе с золотом, серебром, медью, оловом, железом и ртутью входит в семерку металлов, известных с глубокой древности. Эти металлы сопоставлялись с известными тогда планетами (свинцу соответствовал Сатурн). Считается, что впервые люди выплавили свинец из руд 8 тысяч лет назад. Раскопки в Древнем Египте обнаружили изделия из серебра и свинца в захоронениях до династического периода. К этому же времени относятся аналогичные находки, сделанные в Месопотамии. Совместные находки серебряных и свинцовых изделий не удивительны. Еще в доисторические времена внимание людей привлекли красивые тяжелые кристаллы свинцового блеска. Залежи этого минерала находили в горах Армении, в центральных районах Малой Азии. А минерал галенит часто содержит значительные примеси серебра. Если положить куски этого минерала в костер, то сера выгорит и потечет расплавленный свинец (древесный уголь препятствует окислению свинца). Уже за много тысячелетий до новой эры в Месопотамии, Египте из него отливали статуи.
В VI в. до н.э. богатые залежи галенита были обнаружены в Лаврионе – гористой местности недалеко от Афин. Во времена пунических войн (264–146 до н.э.) на территории современной Испании работали многочисленные свинцовые шахты, которые были заложены греками и финикийцами. Позднее они разрабатывались римлянами; римские инженеры использовали свинец для изготовления труб древнего водопровода. Древнегреческий историк Геродот (V в. до н.э.) писал о методе укрепления железных и бронзовых скоб в каменных плитах путем заливки отверстий легкоплавким свинцом. Позднее при раскопках Микен нашли свинцовые скобы в каменных стенах.
При получении свинца античные металлурги сначала прокаливали руду, при этом шли реакции
2PbS + 3O 2 ® 2PbO + 2SO 2 и PbS + 2O 2 ® PbSO 4 . Затем температуру повышали, что приводило к выплавке свинца:
PbS + 2PbO ® 3Pb + SO 2 ; PbS + PbSO 4 ® 2Pb + 2SO 2 . Первые плавильные печи, сделанные из глины и камней, были весьма примитивны. Их старались установить на склонах холмов, где дуют ветры, помогающие обжигу. Выплавленный свинец, как правило, содержал серебро – иногда до 0,5% и более. При медленном охлаждении такого расплава сначала кристаллизуется чистый свинец, а жидкость обогащается серебром – примерно до 2%. Для выделения серебра использовали метод купелирования: окисляли расплавленный свинец в пористом глиняном сосуде – купели, а его оксид затем снова восстанавливали до металла. Механизм этого процесса был изучен только в 1833.
Использовали свинец и для очистки золота и серебра методом купелирования. Для этого подлежащий очистке драгоценный металл сплавляли со свинцом. Свинец и другие примеси легко окислялись при высокой температуре; образующиеся оксиды сдувались струей воздуха, а частично впитывались в поры купели, а на дне оставался слиток чистого серебра или золота. Оксид свинца затем снова могли превратить в металл, нагревая его с древесным углем. Археологические находки в Уре и Трое свидетельствуют, что купелирование было известно на северо-западе Малой Азии уже в первой половине III тыс. до н.э. А греческим умельцам из добытого в Лаврионе свинца удавалось извлечь почти все серебро: по современным анализам его оставалось в свинце всего 0,02%! Искусство древних металлургов достойно удивления: ведь у них не было ни возможности контролировать температуру на разных стадиях процесса, ни проводить химических анализов. И все же в отвалах рудников оставалось много неизвлеченного свинца. Еще лучших результатов добились римские металлурги, вдвое снизив остаточное количество серебра. Конечно, их беспокоила не чистота свинца, а полнота извлечения из него драгоценного металла. Более того, как свидетельствует греческий историк Страбон, перерабатывая старые отвалы в Лаврионе, римляне смогли извлечь довольно много и свинца, и серебра, оставив около двух миллионов тонн отработанной руды в отвалах. После этого рудники были заброшены почти на два тысячелетия, но в 1864 отвалы снова начали перерабатывать – теперь уже ради только серебра (его в них оставалось около 0,01%). На современных металлургических предприятиях в свинце оставляют еще в сотни раз меньше серебра.
Древние гончары, размалывая свинцовый блеск с глиной и водой, обливали этой смесью подлежащие обжигу глиняные сосуды. При высокой температуре поверхность сосуда покрывалась легкоплавким свинцовым стеклом. В 1673 английский стекольный мастер Джордж Равенскрофт, добавив в состав стекла оксид свинца, изобрел хрустальное стекло, которое легко плавится, прекрасно поддается обработке и обладает особым блеском, приближающим его к настоящему горному хрусталю. Позднее, сплавив чистый белый песок, поташ и оксид свинца, получили страз (от имени жившего в конце 18 в. ювелира Страсса) – сорт стекла с таким сильным блеском, что оно хорошо имитировало алмаз, а с примесью разных пигментов – другие драгоценные камни.
Тонкими свинцовыми пластинами обшивали деревянные корпуса древних кораблей. Один такой греческий корабль, построенный в III в. до н.э., был найден в 1954 на дне Средиземного моря недалеко от Марселя. Римляне изготовляли также из свинца трубы длиной 3 метра и разного, но строго определенного диаметра (всего было 15 вариантов). Это первый в истории пример стандартизированного промышленного производства. Сначала из свинца отливали пластину, оборачивали ее вокруг деревянного стержня и запаивали шов оловянно-свинцовым припоем (его состав с тех пор практически не изменился). В трубах нередко обнаруживались течи, и их надо было ремонтировать. До сих пор во время раскопок в Италии и в Англии находят такие трубы в очень хорошем состоянии. Римский зодчий и инженер Марк Витрувий Поллион рекомендовал заменить свинцовые трубы керамическими – из обожженной глины. Он обратил внимание на болезненность рабочих, занятых выплавкой свинца и считал, что свинец «лишает кровь ее силы». Однако не все разделяли это мнение. Так, римский государственный деятель, ученый и писатель Плиний, автор знаменитой «Естественной истории», писал о пользе свинцовых препаратов, о том, что свинцовая мазь помогает выводить шрамы, излечивать язвы и глазные болезни.
В средние века крыши церквей и дворцов нередко покрывали свинцовыми пластинами, устойчивыми к атмосферным влияниям. Еще в 669 свинцом покрыли крышу монастырской церкви в Йорке, а в 688 епископ в Нортумберленде приказал обшить свинцовыми пластинами крышу и стены церкви. Знаменитые витражи в соборах собирали с помощью свинцовых рамок с желобками, в которых укрепляли пластинки цветного стекла. Делали из свинца, по примеру римлян, и водопроводные, а также дренажные трубы. Так, в 1532 в Вестминстерском дворце установили свинцовые водосточные трубы квадратного сечения. Все эти изделия в те времена не прокатывали, а отливали в формах, на дно которых насыпали тонко просеянный песок. Со временем на свинцовых изделиях появлялся прочный защитный слой – патина. Некоторые облицованные свинцом средневековые шпили сохранились в течение почти семисот лет. К сожалению, пожар 1561 в Лондоне уничтожил такой шпиль величайшего собора святого Петра.
Когда появилось огнестрельное оружие, большие количества свинца пошли для изготовления пуль и дроби, и свинец начал ассоциироваться также со смертельной опасностью: «Засвищет вокруг меня губительный свинец» (А.Пушкин), «За твой окоп другой боец подставил грудь под злой свинец» (К.Симонов). Сначала дробь отливали в разъемных формах. В 1650 английский принц Руперт изобрел более быстрый и удобный способ. Он обнаружил, что если к свинцу добавить немного мышьяка и лить этот сплав через своего рода большой дуршлаг в бак с водой, то получаются шарики дроби правильной сферической формы. А после того, как в 1436 Иоганн Гутенберг изобрел способ печатать книги с использованием подвижных металлических литер, печатники в течение сотен лет отливали буквы из так называемого типографского сплава на основе свинца (с примесью олова и сурьмы).
Из соединений свинца с древних времен использовали свинцовый сурик Pb 3 O 4 и основной карбонат свинца (свинцовые белила) в качестве красной и белой краски. Почти все картины старых мастеров писаны красками, приготовленными на основе свинцовых белил. Оригинальным был старинный способ их получения: горшки с крепким уксусом ставили в навоз, а над ними подвешивали скрученные в спираль тонкие свинцовые пластины. Разлагаясь, навоз давал тепло (оно необходимо для усиленного испарения уксусной кислоты) и углекислый газ. Совместное действие на свинец этих веществ, а также кислорода воздуха и давало белила. Помимо ядовитости, эти белила темнеют со временем, так как реагируют со следами сероводорода, который всегда присутствует в воздухе: 2PbCO 3 ·Pb(OH) 2 + 3H 2 S ® 3PbS + 2CO 2 + 4H 2 O. При реставрации таких картин потемневшие участки осторожно обрабатывают раствором Н 2 О 2 , что переводит черный сульфид в белый сульфат: PbS + 4H 2 O 2 ® PbSO 4 + 4H 2 O. В настоящее время ядовитые свинцовые белила заменены более дорогими, но безвредными титановыми. Ограниченное применение (например, в качестве пигментов для художественных масляных красок) имеют пигменты, содержащих свинец: свинцовый крон лимонный 2PbCrO 4 ·PbSO 4 , свинцовый крон желтый 13PbCrO 4 ·PbSO 4 , красного цвета свинцово-молибдатный крон 7PbCrO 4 ·PbSO 4 ·PbMoO 4 .
Свойства свинца.
Свинец обычно имеет грязно-серый цвет, хотя свежий его разрез имеет синеватый отлив и блестит. Однако блестящий металл быстро покрывается тускло-серой защитной пленкой оксида. Плотность свинца (11,34 г/см 3) в полтора раза больше, чем у железа, вчетверо больше, чем у алюминия; даже серебро легче свинца. Недаром в русском языке «свинцовый» – синоним тяжелого: «Ненастной ночи мгла по небу стелется одеждою свинцовой»; «И как свинец пошел ко дну» – эти пушкинские строки напоминают, что со свинцом неразрывно связано понятие гнета, тяжести.
Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ней в виде пушистого налета из мелких кристалликов, имеющего старинного название «сатурнова дерева». Если затормозить реакцию, обернув цинк фильтровальной бумагой, вырастают более крупные кристаллы свинца.
Наиболее типична для свинца степень окисления +2; соединения свинца(IV) значительно менее устойчивы. В разбавленных соляной и серной кислотах свинец практически не растворяется, в том числе из-за образования на поверхности нерастворимой пленки хлорида или сульфата. С крепкой серной кислотой (при концентрации более 80%) свинец реагирует с образованием растворимого гидросульфата Pb(HSO 4) 2 , а в горячей концентрированной соляной кислоте растворение сопровождается образованием комплексного хлорида H 4 PbCl 6 . Разбавленной азотной кислотой свинец легко окисляется:
Pb + 4HNO 3 ® Pb(NO 3) 2 + 2NO 2 + H 2 O. Разложение нитрата свинца(II) при нагревании – удобный лабораторный метод получения диоксида азота:
2Pb(NO 3) 2 ® 2PbO + 4NO 2 + O 2 .
В присутствии кислорода свинец растворяется также в ряде органических кислот. При действии уксусной кислоты образуется легкорастворимый ацетат Pb(CH 2 COO) 2 (старинное название – «свинцовый сахар»). Свинец заметно растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Pb(NO 3) 2 + H 2 O Pb(OH)NO 3 + HNO 3 . Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства.
Свинец медленно растворяется и в концентрированных щелочах с выделением водорода: Pb + 2NaOH + 2H 2 O ® Na 2 Pb(OH) 4 + H 2 , что указывает на амфотерные свойства соединений свинца. Белый гидроксид свинца(II), легко осаждаемый из растворов его солей, также растворяется как в кислотах, так и в сильных щелочах:
Pb(OH) 2 + 2HNO 3 ® Pb(NO 3) 2 + 2H 2 O; Pb(OH) 2 + 2NaOH ® Na 2 Pb(OH) 4 . При стоянии или нагревании Pb(OH) 2 разлагается с выделением PbO. При сплавлении PbO со щелочью образуется плюмбит состава Na 2 PbO 2 .
Из щелочного раствора тетрагидроксоплюмбата натрия Na 2 Pb(OH) 4 тоже можно вытеснить свинец более активным металлом. Если в такой нагретый раствор положить маленькую гранулу алюминия, быстро образуется серый пушистый шарик, который насыщен мелкими пузырьками выделяющегося водорода и потому всплывает. Если алюминий взять в виде проволоки, выделяющийся на ней свинец превращает ее в серую «змею».
При нагревании свинец реагирует с кислородом, серой и галогенами. Так, в реакции с хлором образуется тетрахлорид PbCl 4 – желтая жидкость, дымящая на воздухе из-за гидролиза, а при нагревании разлагающаяся на PbCl 2 и Cl 2 . (Галогениды PbBr 4 и PbI 4 не существуют, так как Pb(IV) – сильный окислитель, который окислил бы бромид- и иодид-анионы.) Тонкоизмельченный свинец обладает пирофорными свойствами – вспыхивает на воздухе. При продолжительном нагревании расплавленного свинца он постепенно переходит сначала в желтый оксид PbO (свинцовый глет), а затем (при хорошем доступе воздуха) – в красный сурик Pb 3 O 4 или 2PbO·PbO 2 . Это соединение можно рассматривать также как свинцовую соль ортосвинцовой кислоты Pb 2 . С помощью сильных окислителей, например, хлорной извести, соединения свинца(II) можно окислить до диоксида:
Pb(CH 3 COO) 2 + Ca(ClO)Cl + H 2 O ® PbO 2 + CaCl 2 + 2CH 3 COOH. Диоксид образуется также при обработке сурика азотной кислотой:
Pb 3 O 4 + 4HNO 3 ® PbO 2 + 2Pb(NO 3) 2 + 2H 2 O. Если сильно нагревать коричневый диоксид, то при температуре около 300° С он превратится в оранжевый Pb 2 O 3 (PbO·PbO 2), при 400° С – в красный Pb 3 O 4 , а выше 530° С – в желтый PbO (разложение сопровождается выделением кислорода). В смеси с безводным глицерином свинцовый глет медленно, в течение 30–40 минут реагирует с образованием водоупорной и термостойкой твердой замазки, которой можно склеивать металл, стекло и камень.
Диоксид свинца – сильный окислитель. Струя сероводорода, направленная на сухой диоксид, загорается; концентрированная соляная кислота окисляется им до хлора:
PbO 2 + 4HCl ® PbCl 2 + Cl 2 + H 2 O, сернистый газ – до сульфата: PbO 2 + SO 2 ® PbSO 4 , а соли Mn 2+ – до перманганат-ионов: 5PbO 2 + 2MnSO 4 + H 2 SO 4 ® 5PbSO 4 + 2HMnO 4 + 2H 2 O. Диоксид свинца образуется, а затем расходуется при зарядке и последующем разряде самых распространенных кислотных аккумуляторов. Соединения свинца(IV) обладают еще более типичными амфотерными свойствами. Так, нерастворимый гидроксид Pb(OH) 4 бурого цвета легко растворяется в кислотах и щелочах: Pb(OH) 4 + 6HCl ® H 2 PbCl 6 ; Pb(OH) 4 + 2NaOH ® Na 2 Pb(OH) 6 . Диоксид свинца, реагируя с щелочью, также образует комплексный плюмбат(IV):
PbO 2 + 2NaOH + 2H 2 O ® Na 2 . Если же PbO 2 сплавить с твердой щелочью, образуется плюмбат состава Na 2 PbO 3 . Из соединений, в которых свинец(IV) входит в состав катиона, наиболее важен тетраацетат. Его можно получить кипячением сурика с безводной уксусной кислотой:
Pb 3 O 4 + 8CH 3 COOH ® Pb(CH 3 COO) 4 + 2Pb(CH 3 COO) 2 + 4H 2 O. При охлаждении из раствора выделяются бесцветные кристаллы тетраацетата свинца. Другой способ – окисление ацетата свинца(II) хлором: 2Pb(CH 3 COO) 2 + Cl 2 ® Pb(CH 3 COO) 4 + PbCl 2 . Водой тетраацетат мгновенно гидролизуется до PbO 2 и CH 3 COOH. Тетраацетат свинца находит применение в органической химии в качестве селективного окислителя. Например, он весьма избирательно окисляет только некоторые гидроксильные группы в молекулах целлюлозы, а 5-фенил-1-пентанол под действием тетраацетата свинца окисляется с одновременной циклизацией и образованием 2-бензилфурана.
Органические производные свинца – бесцветные очень ядовитые жидкости. Один из методов их синтеза – действие алкилгалогенидов на сплав свинца с натрием:
4C 2 H 5 Cl + 4PbNa ® (C 2 H 5) 4 Pb + 4NaCl + 3Pb. Действием газообразного HCl можно отщеплять от тетразамещенных свинца один алкильный радикал за другим, заменяя их на хлор. Соединения R 4 Pb разлагаются при нагревании с образованием тонкой пленки чистого металла. Такое разложение тетраметилсвинца было использовано для определения времени жизни свободных радикалов. Тетраэтилсвинец – антидетонатор моторного топлива.
Получение свинца.
Количество добываемого свинца непрерывно возрастает. Если в 1800 во всем мире его было получено около 30 000 тонн, то в 1850 – 130 000 т, в 1875 – 320 000 т, в 1900 – 850 000 т, 1950 – почти 2 млн. т, а в настоящее время в год добывают около 5 млн. т. По объему производства свинец занимает четвертое место среди цветных металлов – после алюминия, меди и цинка.
Основной источник свинца – сульфидные полиметаллические руды, содержащие от 1 до 5% свинца. Руду концентрируют до содержания свинца 40 – 75%, затем подвергают обжигу: 2PbS + 3O 2 ® 2PbO + 2SO 2 и восстанавливают свинец коксом и оксидом углерода(II). Более экономичный, так называемый автогенный, способ заключается в проведении реакции PbS + 2PbO ® 3Pb + SO 2 (PbO образуется при частичном обжиге PbS). Получаемый из руды свинец содержит от 3 до 7% примесей в виде меди, сурьмы, мышьяка, олова, алюминия, висмута а также золота и серебра. Их удаление (или выделение, если это экономически рентабельно), требует сложных и длительных операций. Очистку свинца можно проводить также методом электрохимического рафинирования. Электролитом служит водный раствор фторосиликата свинца PbSiF 6 . На катоде оседает чистый свинец, а примеси концентрируются в анодном шламе, содержащем много ценных компонентов, которые затем выделяют.
Свинец в организме человека.
Соединения свинца ядовиты. Но очевидным это стало далеко не сразу. В прошлом покрытия гончарных изделий свинцовой глазурью, изготовление свинцовых водопроводных труб, использование свинцовых белил (особенно в косметических целях), применение свинцовых трубок в конденсаторах паров на винокуренных заводах – все это приводило к накоплению свинца в организме. Древние греки знали, что вино и кислые соки нельзя держать в глазурованных глиняных сосудах (глазурь содержала свинец), а вот римляне этим правилом пренебрегали. Джемс Линд, рекомендовавший в 1753 английскому адмиралтейству лимонный сок как средство против цинги для моряков в дальнем плавании, предостерегал от хранения сока в гончарных глазурованных изделиях. Тем не менее случаи отравления, в том числе и смертельные, наблюдались по той же причине и двести лет спустя.
Свинец проникает в организм через желудочно-кишечный тракт или дыхательную систему и разносится затем кровью по всему организму. Причем вдыхание свинцовой пыли значительно опаснее присутствия свинца в пище. В воздухе городов содержание свинца составляет в среднем от 0,15 до 0,5 мкг/м 3 . В районах, где расположены предприятия по переработке полиметаллических руд, эта концентрация выше.
Свинец накапливается в костях, частично замещая кальций в фосфате Са 3 (РО 4) 2 . Попадая в мягкие ткани – мышцы, печень, почки, головной мозг, лимфатические узлы, свинец вызывает заболевание – плюмбизм. Как и многие другие тяжелые металлы, свинец (в виде ионов) блокирует деятельность некоторых ферментов. Было установлено, что их активность снижается в 100 раз при увеличении концентрации свинца в крови в 10 раз – с 10 до 100 микрограммов на 100 мл крови. При этом развивается анемия, поражаются кроветворная система, почки и мозг, снижается интеллект. Признак хронического отравления – серая кайма на деснах, расстройство нервной системы. Особенно опасен свинец для детей, так как он вызывает задержку в развитии. В то же время десятки миллионов детей во всем мире в возрасте до 6 лет имеют свинцовое отравление; основная причина – попадание в рот краски, содержащей свинец. Антидотом при отравлении может служить кальциевая соль этилендиаминтетрауксусной кислоты. В отравленном организме происходит замещение кальция на ионы свинца, которые удерживаются в этой соли очень прочно и в таком виде выводятся.
Свинец легко может попасть в организм с питьевой водой, если она соприкасалась с металлом: в присутствии углекислого газа в раствор медленно переходит растворимый гидрокарбонат Pb(HCO 3) 2 . В Древнем Риме, где для подачи воды использовали свинцовые трубы, такое отравление было весьма распространенным, на что указывают анализы останков римлян. Причем отравлялись, в основном, богатые римляне, пользовавшиеся водопроводом, хранившие вино, оливковое масло и другие продукты в освинцованных сосудах, использовавшие содержащие свинец косметические средства. Достаточно, чтобы в литре воды был всего один миллиграмм свинца – и питье такой воды становится очень опасным. Это количество свинца так малó, что не изменяет ни запаха, ни вкуса воды, и только точные современные приборы могут его обнаружить.
Свинцовым отравлением некоторые историки объясняют и болезненность ряда русских царей. В 1633 в московском Кремле закончили строительство водопровода. Вода в него поступала из колодца в нижнем этаже Свибловой башни, стоявшей на слиянии Неглинной и Москвы-реки. Воду из колодца качали при помощи подъемной машины – взвода (с тех пор эта кремлевская башня называется Водовзводной). Машину приводили в движение лошади. Воду закачивали в большой бак, а оттуда вода сама по трубам текла на царскую кухню, в сады, другие места. Трубы были изготовлены из свинца; бак для воды изнутри тоже был выложен свинцовыми листами, чтобы вода из него не просачивалась в щели. Особенно много свинца накапливалось в воде за ночь, после ее неподвижного стояния в свинцовом баке и трубах.
Кремлевский «свинцовый водопровод» работал чуть больше 100 лет – его уничтожил пожар 1737. И в период действия этого водопровода русские цари жили меньше обычного. Так, царь и великий князь Иван V Алексеевич, сын царя Алексея Михайловича и первой жены его, Милославской, прожил всего 29 лет. Незадолго до смерти он выглядел дряхлым стариком. С детства он был, как писали тогда, «слабый и болезненный, немощен телом и рассудком, заикался, скорбен головою, страдал цингою и глазною болезнью». Из шести братьев царя пятеро не дожили до 20 лет. Некоторые ученые считают, что это последствия свинцового отравления. А вот шестой брат, Петр Алексеевич, будущий Петр I, избежал отравления – детство и отрочество он провел не в Кремле, а в подмосковных селах. Да и позднее он мало бывал в Кремле – много воевал, путешествовал по Европе, а потом и вовсе перенес столицу на берега Невы. Кстати, первый водопровод в Петербурге, который давал воду для дворцов и фонтанов Летнего сада, был деревянным. Его трубы были сделаны из бревен с просверленными в них отверстиями. Свинец же Петр использовал в военных целях – для отливки пуль.
А вот как пишут о свинцовом отравлении современные медицинские справочники: вялость, апатия, потеря памяти, раннее слабоумие, ослабление зрения, больные выглядят старше своих лет. Удивительно напоминает старинное описание царя Ивана Алексеевича!
Травились когда-то не только «свинцовой водой». Свинец широко использовали при изготовлении посуды (свинцовая глазурь), свинцовых белил, которыми окрашивали стены домов. Сейчас такое применение свинца строжайше запрещено. Белила, например, делают цинковые или титановые. Тем не менее у жителей промышленно развитых стран свинца в организме больше, чем у жителей отсталых и развивающихся стран, а у городских жителей больше, чем у сельских. Разница может быть огромной – в сотни раз.
Свинцовое загрязнение приобрело в 20 в. глобальный характер. Даже в снегах Гренландии его содержание за сто лет увеличилось в пять раз, а в центрах крупных городов в почве и растениях свинца в 25 раз больше, чем на окраинах! Загрязнение свинцом наблюдается в районах его добычи, а также в местах переработки и автострад, особенно если еще используется этилированный бензин. Немало свинца оседает на дне озер в виде охотничьей дроби. Каждый год в Мировой океан со сточными водами попадает более полумиллиона тонн этого ядовитого металла. А кто не видел выброшенные в мусорные ящики, а то и просто в канавы отработанные аккумуляторы! Пока свинец дешев, собирание и переработка его отходов невыгодна. Малая растворимость большинства соединений свинца, к счастью, не позволяет ему накапливаться в значительных количествах в воде. В водах Мирового океана его содержится в среднем 0,03 мкг/л (3·10 –9 %). Мало в среднем свинца и в живом веществе – 10 –4 %.
Применение свинца.
Несмотря на ядовитость свинца, отказаться от него невозможно. Свинец дешев – вдвое дешевле алюминия, в 11 раз дешевле олова. После того как в 1859 французский физик Гастон Планте изобрел свинцовый аккумулятор, для изготовления аккумуляторных пластин с тех пор израсходовали миллионы тонн свинца; в настоящее время на эти цели уходит в ряде стран до 75% всего добываемого свинца! Постепенно снижается применение свинца для изготовления очень ядовитого антидетонатора – тетраэтилсвинца. Способность тетраэтилсвинца улучшать качество бензина было открыто группой молодых американских инженеров в 1922; в своих поисках они руководствовались периодической таблицей элементов, планомерно приближаясь к наиболее эффективному средству. С тех пор производство тетраэтилсвинца непрерывно росло; максимум приходится на конец 1960-х, когда только в США ежегодно с выхлопами выбрасывались сотни тысяч тонн свинца – по килограмму на каждого жителя! В последние годы применение этилированного бензина запрещено во многих регионах, и его производство снижается.
Мягкий и пластичный свинец, не ржавеющий в присутствии влаги, – незаменимый материал для изготовления оболочек электрических кабелей; на эти цели в мире расходуется до 20% свинца. Малоактивный свинец используют для изготовления кислотоупорной аппаратуры для химической промышленности, например, для облицовки реакторов, в которых получают соляную и серную кислоты. Тяжелый свинец хорошо задерживает губительные для человека излучения и потому свинцовые экраны используются для защиты работников рентгеновских кабинетов, в свинцовых контейнерах хранят и перевозят радиоактивные препараты. Свинец содержат также подшипниковые сплавы баббиты, «мягкие» припои (самый известный – «третник» – сплав свинца с оловом).
В строительстве свинец используют для уплотнения швов и создания сейсмостойких фундаментов. В военной технике – для изготовления шрапнели и сердечников пуль.
Илья Леенсон
Литература:
A History of Technology
. Vol. I – V. Oxford: Clarendon Press, 1956–1958
Chisolm J.J. Lead Poisoning. Scientific American
, 1971, February
Свинец
. Женева: изд-во ООН и ВОЗ, 1980
Полянский Н.Г. Свинец
. М., «Наука», 1986
Давыдова С.Л., Пименов Ю.Т., Милаева Е.Р. Ртуть, олово, свинец и их органические производные в окружающей среде
. Астрахань, 2001
Свинец известен с III — II тысячелетия до н.э. в Месопотамии, Египте и других древних странах, где из него изготовляли большие кирпичи (чушки), статуи богов и царей, печати и различные предметы быта. Из свинца делали бронзу, а также таблички для письма острым твердым предметом. В более позднее время римляне стали изготовлять из свинца трубы для водопроводов. В древности свинец сопоставлялся с планетой Сатурн и часто именовался сатурном. В средние века благодаря своему тяжелому весу свинец играл особую роль в алхимических операциях, ему приписывали способность легко превращаться в золото.
Нахождение в природе, получение:
Содержание в земной коре 1,6·10 -3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В основном встречается в виде сульфидов (PbS — свинцовый блеск).
Получение свинца из свинцового блеска проводят путем обжигательно-реакционной плавки: сначала подвергают шихту неполному обжигу (при 500-600°С), при котором часть сульфида переходит в оксид и сульфат:
2PbS + 3О 2 = 2РbО + 2SO 2 PbS + 2О 2 = РbSO 4
Затем, продолжая нагревание, прекращают доступ воздуха; при этом оставшийся сульфид регирует с оксидом и сульфатом, образуя металлический свинец:
PbS + 2РbО = 3Рb + SO 2 PbS + РbSO 4 = 2Рb +2SO 2
Физические свойства:
Один из самых мягких металлов, легко режется ножом. Обычно покрыт более или менее толстой плёнкой оксидов грязно-серого цвета, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Плотность — 11,3415 г/см 3 (при 20°C).
Температура плавления — 327,4°C, температура кипения — 1740°C
Химические свойства:
При большой температуре свинец образует с галогенами соединения вида РbХ 2 , с азотом прямо не реагирует, при нагревании с серой образует сульфид PbS, кислородом окисляется до PbO.
В отсутствии кислорода свинец не реагирует с водой при комнатной температуре, но при действии горячего водяного пара образует оксиды свинца и водород. В ряду напряжений свинец стоит левее водорода, но он не вытесняет водород из разбавленных HCl и H 2 SO 4 , из-за перенапряжения выделения Н 2 на свинце, а также из-за образования на поверхности металла плёнки труднорастворимых солей, защищающих металл от дальнейшего действия кислот.
В концентрированных серной и соляной кислотах при нагревании свинец растворяется, образуя соответственно Pb(HSO 4) 2 и Н 2 [РbCl 4 ]. Азотная, а также некоторые органические кислоты (например, лимонная) растворяют свинец с получением солей Рb(II). Реагирует свинец и с концентрированными растворами щелочей:
Pb + 8HNO 3 (разб.,гор.) = 3Pb(NO 3) 2 + 2NO + 4H 2 O.
Pb + 3H 2 SO 4 (>80%) = Pb(HSO 4) 2 + SO 2 + 2H 2 O
Pb + 2NаOН (конц.) + 2H 2 O = Nа 2 + Н 2
Для свинца наиболее характерны соединения со степенью окисления: +2 и +4.
Важнейшие соединения:
Оксиды свинца
— с кислородом свинец образует ряд соединений Рb 2 О, РbО, Рb 2 О 3 , Рb 3 О 4 , РbО 2 , преимущественно амфотерного характера. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета.
Оксид свинца (II)
— РbО. Красный (низкотемпературная a
-модификация, глет) или желтый (высокотемпературная b
-модификация, массикот). Термически устойчив. Очень плохо реагируют с водой, раствором аммиака. Проявляет амфотерные свойства, реагирует с кислотами и щелочами. Окисляется кислородом, восстанавливается водородом и монооксидом углерода.
Оксид свинца (IV)
— РbО 2 . Платтнерит. Темно-коричневый, тяжелый порошок, при слабом нагревании разлагается без плавления. Не реагирует с водой, разбавленными кислотами и щелочами, раствором аммиака. Разлагается концентрированными кислотами, концентрированными щелочами при кипячении медленно переводится в раствор с образованием….
Сильный окислитель в кислой и щелочной среде.
Оксидам РbО и РbО 2 соответствуют амфотерные гидрооксиды
Рb(ОН) 2 и Рb(ОН) 4 . Получение…, Свойства…
Рb 3 О 4 — свинцовый сурик
. Рассматривается как смешаный оксид или орто-плюмбат свинца(II) — Рb 2 PbО 4 . Оранжево-красный порошок. При сильном нагревании разлагается, плавится только под избыточном давлением О 2 . Не реагирует с водой, гидратом аммиака. Разлагается конц. кислотами и щелочами. Сильный окислитель.
Соли свинца(II)
. Как правило бесцветны, по растворимости в воде делятся на нерастворимые (например, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (йодид, хлорид и фторид) и растворимые (к примеру, ацетат, нитрат и хлорат свинца).
Ацетат свинца, или свинцовый сахар
, Pb(CH 3 COO) 2 ·3H 2 O, бесцветные кристаллы или белй порошок сладкого вкуса, медленно выветривается с потерей гидратной воды, относится к очень ядовитым веществам.
Халькогениды свинца
— PbS, PbSe, и PbTe — кристаллы чёрного цвета, узкозонные полупроводники.
Соли свинца(IV)
могут быть получены электролизом сильно подкисленных серной кислотой растворов солей свинца(II). Свойства…
Гидрид свинца(IV)
— PbH 4 — газообразное вещество без запаха, которое очень легко разлагается на свинец и водород. Получается в небольших количествах при реакции Mg 2 Pb и разбавленной HCl.
Применение:
Свинец хорошо экранирует радиацию и рентгеновские лучи, применяется в качестве защитного материала, в частности, в рентгеновских кабинетах, в лабораториях, где существует опасность облучения радиацией. Также используют для изготовления пластин аккумуляторов (около 30% выплавляемого свинца), оболочек электрических кабелей, защиты от гамма-излучения (стенки из свинцовых кирпичей), как компонент типографских и антифрикционных сплавов, полупроводниковых материалов.
Свинец и его соединения, особенно органические, токсичны. Попадая в клетки, свинец дезактивирует ферменты, тем самым нарушая обмен веществ, вызывая умственную отсталость у детей, заболевания мозга. Свинец может заменять кальций в костях, становясь постоянным источником отравления. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м 3 , в воде 0,03 мг/л, почве 20,0мг/кг.
Барсукова М.
Петрова М.
ХФ ТюмГУ, 571 группа.
Источники: Википедия: http://ru.wikipedia.org/wiki/Свинец и др.,
Н.А.Фигуровский «Открытие элементов и происхождение их названий». Москва, Наука, 1970. (на сайте ХФ МГУ http://www.chem.msu.su/rus/history/element/Pb.html)
Реми Г. «Курс неорганической химии», т.1. Изд-во иностранной литературы, Москва.
Лидин Р.А. «Химические свойства неорганических соединений». М.: Химия, 2000. 480 с.: ил.
Свинец – мягкий тяжелый металл серебристо-серого цвета, блестящий, но довольно быстро теряющий свой блеск. Наравне с и относится к элементам, известным человечеству с самых древних времен. Использовался свинец весьма широко, да и сейчас его применение чрезвычайно разнообразно. Итак, сегодня мы узнаем, свинец — это металл или неметалл, а также цветной или черный металл, узнаем о его видах, свойствах, применении и добыче.
Свинец – элемент 14 группы таблицы Д. И. Менделеева, расположен в одной группе с углеродом, кремнием и оловом. Свинец является типичным металлом, но инертным: вступает в реакции крайне неохотно даже с сильными кислотами.
Молекулярная масса – 82. Это не только указывает на так называемое магическое число протонов в ядре, но и на большой вес вещества. Самые интересные качества металла связаны именно с его большим весом.
Понятие и особенности металла свинец рассмотрены в данном видео:
Понятие и особенности
Свинец – металл достаточно мягкий при нормальной температуре, его несложно процарапать или расплющить. Такая пластичность позволяет получить листы и прутки металла очень малой толщины и любой формы.
Ковкость и была одной из причин, по которой свинец стал использоваться с самой древности.
Свинцовые водопроводные трубы Древнего Рима общеизвестны. С тех пор такого рода водопровод устанавливался не единожды и не в одном месте, но действовал не столь долго. Что, без сомнений, сохранило немалое количество человеческих жизней, так как свинец, увы, при длительном контакте с водой, в конце концов, образует растворимые соединения, которые являются токсичными.
Токсичность – то самое свойство металла, благодаря которому его применение стараются ограничить. Пары металла и множество его органических и неорганических солей очень опасны и для окружающей среды, и для людей. В основном, конечно, опасности подвергаются работники таких предприятий и жители зоны вокруг промышленного объекта. 57% выбрасывается вместе с большими объемами запыленного газа, а 37% – с конвертерными газами. Проблема этого одна – несовершенство очистительных установок.
Однако и в других случаях люди становятся жертвами свинцового загрязнения. До недавнего времени самым эффективным и популярным стабилизатором бензина являлся тетраэтилсвинец. При сгорании топлива он выделялся в атмосферу и загрязнял ее.
Зато свинец обладает другим, крайне полезным и необходимым качеством – способностью поглощать радиоактивное излучение. Причем жесткую составляющую металл поглощает даже лучше, чем мягкую. Свинцовый слой толщиной в 20 см способен защитить от всех видов излучения, известных на Земле и в ближайшем космосе.
Плюсы и минусы

К плюсам с точки зрения народного хозяйства можно отнести:
- легкоплавкость и ковкость – это позволяет формировать из металла изделия любой степени сложности и любой тонкости. Так, для производства звукопоглощающих мембран используются свинцовые пластины толщиной в 0,3–0,4 мм;
- свинец в состоянии образовать сплав с другими металлами (в т.ч. , и др.) которые при обычных условиях друг с другом не сплавляются, на этом качестве основано его применение в качестве припоя;
- металл поглощает радиационное излучение. На сегодня все элементы защиты от радиации – от одежды до отделки рентген-кабинетов и помещений на испытательных полигонах, производятся из свинца;
- металл устойчив к кислотам, уступая в этом лишь благородному золоту и серебру. Так что его активно применяют для облицовки кислотоупорной аппаратуры. По этим же причинам из него производят трубы для передачи кислоты и для стоков на опасных химических предприятиях;
- свинцовый аккумулятор пока что не потерял своего значения в электротехнике, так как позволяет получить ток большого напряжения;
- низкая стоимость – свинец в 1,5 раза дешевле цинка, в 3 раза меди, и едва и не в 10 раз олова. Этим объясняется очень большая выгодность применения именно свинца, а не других металлов.
Недостатками являются:
- токсичность – использование металла в любом виде производства составляет опасность для персонала, а при авариях – чрезвычайную опасность для окружающей среды и населения. Свинец относится к веществам 1 класса опасности;
- изделия из свинца нельзя выбрасывать как обычный мусор. Они требуют утилизации и порой весьма затратной. Потому вопрос о вторичной переработке металла всегда актуален;
- свинец – металл мягкий, так что использоваться в качестве конструкционного материала не может. Учитывая все остальные его качества это, скорее, стоит считать плюсом.
Свойства и характеристики
Свинец – мягкий, ковкий, но при этом тяжелый и плотный металл. Молекулярная решетка – кубическая, гранецентрированная. Прочность его невелика, а вот пластичность превосходна. Физические характеристики металла таковы:
- плотность при нормальной температуре 11,34 г/куб см;
- температура плавления – 327,46 С;
- температуры кипения – 1749 С;
- стойкость к нагрузке на разрыв – 12– 3 МПа;
- стойкость к нагрузке на сжатие – 50 МПа;
- твердость по Бринеллю – 3,2–3,8 НВ;
- теплопроводность – 33,5 вт/(м·К);
- удельное сопротивление составляет 0,22 Ом-кв. мм/м.
Как и всякий металл он проводит электроток, хотя, надо отметить, и намного хуже меди – почти в 11 раз.
Однако металл обладает другими интересным свойством: при температуре 7,26 К он становится сверхпроводником и проводит электричество без всякого сопротивления. Свинец был первым элементом, который проявил это свойство.
На воздухе кусок металла или изделие из него довольно быстро пассивируется оксидной пленкой, которая успешно защищает металл от внешнего воздействия. Да и само вещество не склонно к химической активности, из-за чего его и используют при изготовлении кислотоупорного оборудования.
Почти такими же устойчивыми к коррозии являются и краски, включающие соединения свинца. Из-за токсичности они не применяются внутри помещений, однако успешно используются при окрашивании мостов, например, каркасных сооружений и так далее.
О том, как сделать чистый свинец, расскажет видео ниже:
Структура и состав
Во всем диапазоне температур выделяют только одну модификацию свинца, так что и под действием температуры, и с течением времени свойства металл изменяет совершенно закономерно. Никаких резких переходов, когда качества меняются кардинально, не отмечено.
Производство металла

Производство пирометаллургическим методом включает следующие стадии:
- добыча руды;
- дробление и обогащение в основном флотационным методом;
- плавка с целью получения чернового свинца – восстановительная, горновая, щелочная и так далее;
- рафинирование, то есть, очистка черного свинца от примесей и получение чистого металла.
Несмотря на одинаковость технологии производства оборудование может использоваться самое разное. Это зависит от содержания металла в руде, объемов производства, требований к качеству продукта и так далее.
Об использовании и цене за 1 кг свинца читайте ниже.
Область применения
Первое – изготовление водопроводов и предметов быта, к счастью, относится к довольно давним временам. На сегодня в жилище металл попадает только с защитным слоем и при условии отсутствия контактов с пищей, водой и человеком.
- А вот использование свинца для сплавов и в качестве припоя началось еще на заре цивилизации и продолжается до сих пор.
- Свинец – металл стратегического значения, особенно с тех пор, как из него стали отливать пули. Боеприпас для стрелкового и спортивного оружия и сейчас изготавливается только из свинца. А его соединения применяются в качестве взрывчатых веществ.
- 75% производимого в мире металла используется для производства свинцовых аккумуляторов. Вещество продолжает оставаться одним из главных элементов химических источников тока.
- Коррозийная устойчивость металла эксплуатируется при изготовлении кислотоупорной аппаратуры, трубопроводов, а также защитных оболочек для силовых кабелей.
- Ну и, конечно, свинец применяют при оборудовании рентген-кабинетов: облицовка стен, потолка, пола, защитные перегородки, защитные костюмы – все изготавливается с участием свинца. На испытательных полигонах, в том числе и ядерных, металл незаменим.
Стоимость металлов определяется на нескольких биржах мирового значения. Наиболее известной является Лондонская биржа металлов. Стоимость свинца в октябре 2016 года составляет 2087,25 $ за тонну.
Свинец – металл, очень востребованный в современной промышленности. Некоторые его качества – коррозионная стойкость, способность поглощать жесткое излучение, совершенно уникальны и делают металл незаменимым несмотря на его высокую токсичность.
Данное видео расскажет, что будет если вылить свинец в воду:
×òî òàêîå «ÑÂÈÍÅÖ»? Êàê ïðàâèëüíî ïèøåòñÿ äàííîå ñëîâî. Ïîíÿòèå è òðàêòîâêà.
ÑÂÈÍÅÖ ÑÂÈÍÅÖ ì. êðóøåö, ìåòàëë, îäèí èç ñàìûõ ìÿãêèõ è âåñêèõ, öâåòîì ïîñèíåå îëîâà; âñòàðü çûâàëè åãî îëîâîì, îòêóäà è ïîãîâîðêà: ñëîâî îëîâî, ò. å. âåñêî.  Âàñèëüåâ âå÷åð ëèòü îëîâî, ñâèíåö, âîñê. Ðóæåéíûå ïóëè ñâèíöîâûå. Ñâèíöîâàÿ ðóäà âñåãäà ñêàçûâàåòñÿ òÿæåñòüþ ñâîåþ. Ñâèíöîâûé ñàõàð, ÿäîâèòàÿ ñâèíöîâàÿ ñîëü. — áëåñê, ñåðèñòûé ñâèíåö, ðóäà. — êàðàíäàø (îøèá÷.), ãðàôèòîâûé. -ðóêà, òÿæåëàÿ. Ñâèíöåâàîòîå ñåðåáðî, íåñêîëüêî ñâèíöó â ñåáå ñîäåðæàù. Ñâèíöîâèöà? ðàñòåí. Molybdaena. Ñâèíöîâêà? ðàñòåí. Plumbago. Çåëåíàÿ òâåðäàÿ ïîðîäà ÿáëîê. Ñâèí÷àòêà, áàáêà, íàëèòàÿ ñâèíöîì, áèòîê, áèòêà èëè íàëèòîê. âîëæñê. ðå÷íàÿ ïëàâíàÿ ñåòü, ñî ñâèíöîâûìè ãðóçèëàìè (êîëüöàìè), íà ñòåðëÿäü è ñåâðþãó. Ñâèí÷àòûé, ñâèíöîâûé, èç ñâèíöà. Êóï÷àÿ äà äóõîâíàÿ îáå íà õàðàòüÿõ, ñî ñâèí÷àòûìà ïå÷àòüìè, ñòàð. Ñâèí÷àê, ñåðèñòûé ñâèíåö, ðóäà. Ñâèí÷àêîâûå ðóäû. Ñâèíêà, ñëèòîê ñâèíöó, îêîëî äâóõ ïóäîâ. Ñâèíêîâûé ñâèíåö, â ñëèòêàõ, íå ëèñòîâîé. Ñì. ñâèíüÿ. Ñâèíêè, àðõ. ðàçîðâàííûå îáëàêà, êëî÷èñòûå.
ÑÂÈÍÅÖ —
(ëàò. Plumbum)
Pb, õèìè÷åñêèé ýëåìåíò IV ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû Ìåíäåëååâà; àòîìíûé í… Áîëüøàÿ Ñîâåòñêàÿ ýíöèêëîïåäèÿ
ÑÂÈÍÅÖ — ÑÂÈÍÅÖ, ñâèíöà, ìí. íåò, ì. 1. Ìÿãêèé, î÷åíü òÿæåëûé ìåòàëë ñèíåâàòî-ñåðîãî öâåòà. Ïëîìáà èç ñâèíöà…. Òîëêîâûé ñëîâàðü Óøàêîâà
ÑÂÈÍÅÖ — ì. 1. Òÿæåëûé ìÿãêèé ëåãêîïëàâêèé ìåòàëë ñèíåâàòî-ñåðîâàòîãî öâåòà. 2. ïåðåí. Òî æå, ÷òî: ïóëÿ (1*)… Òîëêîâûé ñëîâàðü Åôðåìîâîé
ÑÂÈÍÅÖ — ÑÂÈÍÅÖ (Plumbum), Pb, õèìè÷åñêèé ýëåìåíò IV ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû, àòîìíûé íîìåð 82, àòîìíàÿ … Ñîâðåìåííàÿ ýíöèêëîïåäèÿ
ÑÂÈÍÅÖ —
Pb (plumbum),
ìåòàëëè÷åñêèé õèìè÷åñêèé ýëåìåíò IVÀ ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû ýëåìåíòîâ, ÷ëåí ñåì… Ýíöèêëîïåäèÿ Êîëüåðà
ÑÂÈÍÅÖ — ÑÂÈÍÅÖ (ëàò. Plumbum) — Pb, õèìè÷åñêèé ýëåìåíò IV ãðóïïû ïåðèîäè÷åñêîé ñèñòåìû Ìåíäåëååâà, àòîìíûé í… Áîëüøîé ýíöèêëîïåäè÷åñêèé ñëîâàðü
ÑÂÈÍÅÖ —
ÑÂÈÍÅÖ
òÿæåëûé ìåòàëë (óä. âåñ 11,34) ñ ñèëüíûì ìåòàëë. áëåñêîì íà ñâåæåì ðàçðåçå; íà âîçäóõå á… Òåõíè÷åñêèé æåëåçíîäîðîæíûé ñëîâàðü
ÑÂÈÍÅÖ — (Ðb) õèì. ýëåìåíò IV ãð. ïåðèîäè÷åñêîé ñèñòåìû, ïîðÿäêîâûé íîìåð 82, àò. â. 207,19. Äëÿ Ñ. õàðàêòå… Ãåîëîãè÷åñêàÿ ýíöèêëîïåäèÿ
ÑÂÈÍÅÖ —
«…Ñâèíåö ïðåäñòàâëÿåò ñîáîé òÿæåëûé ãîëóáîâàòî-ñåðûé ìåòàëë, îí îòëè÷àåòñÿ âûñîêîé ïëàñòè÷íîñòüþ,… Îôèöèàëüíàÿ òåðìèíîëîãèÿ
|
|
|
| Название, символ, номер | Свинец / Plumbum (Pb), 82 |
|---|---|
| Атомная масса (молярная масса) |
207,2(1) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p2 |
| Радиус атома | 175 пм |
| Ковалентный радиус | 147 пм |
| Радиус иона | (+4e) 84 (+2e) 120 пм |
| Электроотрицательность | 2,33 (шкала Полинга) |
| Электродный потенциал | Pb←Pb2+ −0,126 В Pb←Pb4+ 0,80 В |
| Степени окисления | 4, 2, 0 |
| Энергия ионизации (первый электрон) |
715,2 (7,41) кДж/моль (эВ) |
| Плотность (при н. у.) | 11,3415 г/см³ |
| Температура плавления | 600,61 K (327,46 °C, 621,43 °F) |
| Температура кипения | 2022 K (1749 °C, 3180 °F) |
| Уд. теплота плавления | 4,77 кДж/моль |
| Уд. теплота испарения | 177,8 кДж/моль |
| Молярная теплоёмкость | 26,65 Дж/(K·моль) |
| Молярный объём | 18,3 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,950 Å |
| Температура Дебая | 88,00 K |
| Теплопроводность | (300 K) 35,3 Вт/(м·К) |
| Номер CAS | 7439-92-1 |
Содержание
- 1 Исторические сведения
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение
- 4.1 Производство в мире
- 5 Физические свойства
- 6 Химические свойства
- 7 Основные соединения свинца
- 7.1 Галогениды свинца
- 7.2 Халькогениды свинца
- 7.2.1 Оксиды свинца
- 7.3 Соли свинца
- 8 Изотопы
- 8.1 Распространённость изотопов свинца
- 9 Применение
- 9.1 В медицине
- 9.2 В геологии
- 9.3 Экономические показатели
- 10 Физиологическое действие
Слитки свинца
Исторические сведения
Свинец используется многие тысячелетия, поскольку он широко распространён, легко добывается и обрабатывается. Он очень ковкий и легко плавится. Выплавка свинца была первым из известных человеку металлургических процессов. Бусины из свинца, датируемые 6400 г. до н. э., были найдены в культуре Чатал-Хююк. Самым древним предметом, сделанным из свинца, часто считается статуэтка стоящей женщины в длинной юбке времён первой династии Египта, датируемая 3100—2900 гг. до н. э., хранящаяся в Британском музее (инвентарный номер EA 32138). Она была найдена в храме Осириса в Абидосе и привезена из Египта в 1899 году. В Древнем Египте использовались медальоны из свинца. В раннем бронзовом веке свинец использовался наряду с сурьмой и мышьяком. Указание на свинец как на определённый металл имеется в Ветхом Завете.
Свинцовые трубы древнеримского водопровода с надписями
Самым крупным производителем свинца доиндустриальной эпохи был Древний Рим, с годовым производством 80 000 тонн. Добыча римлянами свинца происходила в Центральной Европе, римской Британии, на Балканах, в Греции, Малой Азии и Испании. Римляне широко применяли свинец в производстве труб для водопроводов, свинцовые трубы часто имели надписи римских императоров. Правда, ещё Плиний и Витрувий считали, что это нехорошо для общественного здоровья.
Папская булла 1637 года со свинцовой печатью
После падения Римской империи в V в. н. э. использование свинца в Европе упало и оставалось на низком уровне около 600 лет. Затем свинец начали добывать в восточной Германии. Свинцовый сахар ещё с римских времён добавляли в вино для улучшения его вкусовых качеств, это стало широко распространено и продолжалось даже после запрета папской буллой в 1498 году. Такое использование свинца в средние века приводило к эпидемиям свинцовой колики. В Древней Руси свинец использовали для покрытия крыш церквей, а также широко применяли в качестве материала навесных печатей к грамотам Позднее, в 1633 году, в Кремле был сооружён водопровод со свинцовыми трубами, вода по которому шла из Водовзводной башни, он просуществовал до 1737 года.
В алхимии свинец ассоциировался с планетой Сатурн и обозначался её символом ♄. В древности олово, свинец и сурьму часто не отличали друг от друга, считая их разными видами одного и того же металла, хотя ещё Плиний Старший различал олово и свинец, называя олово «plumbum album», а свинец — «plumbum nigrum».
Индустриальная революция привела к новому росту потребности в свинце. К началу 1840-х гг. годовое производство очищенного свинца впервые превысило 100 000 тонн и выросло до более чем 250 000 тонн в течение следующих 20 лет. До последних десятилетий XIX века добыча свинца в основном проводилась тремя странами: Британией, Германией и Испанией. К началу XX века добыча свинца в Европе стала меньше, чем в остальном мире, благодаря увеличившейся добыче в США, Канаде, Мексике и Австралии. До 1990 года большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Происхождение названия
Происхождение слова «свинец» неясно. Этот металл по-болгарски называется «оло́во», в большинстве других славянских языков (сербско-хорватском, чешском, польском свинец называется словом, близким по звучанию к «олово»: волава, olovo, ołów и т. п. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в нескольких славянских — русском, украинском (свинець), белорусском (свінец) и словенском (svinec).
Латинское plumbum дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомби, из которой, по некоторым данным, ухитрился бежать Казанова.
Нахождение в природе
Содержание в земной коре — 1,6·10−3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В этих образованиях он часто образует интерметаллические соединения (например, звягинцевит (Pd,Pt)3(Pb,Sn) и др.) и сплавы с другими элементами (например, (Pb + Sn + Sb)). Он входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4 (сульфат свинца); из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория, имея часто радиогенную природу. В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на земле, где в породах больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана.
Галенит, Дальнегорское скарновое месторождение
В таблице приведены некоторые параметры распространённости свинца в природных условиях по А. П. Виноградову:
| Породы | Каменные метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Граниты и др. | Глины и др. | Земная кора |
|---|---|---|---|---|---|---|---|
| Содержание, масс.% | 0000002×10−5 | 0001×10−5 | 0008×10−4 | 0001,5×10−3 | 0002×10−3 | 0002×10−3 | 1,6×10−3 |
| Объекты | Живое вещество Земли | Литосфера | Почва0 | Растения (в золе) | Вода океанов (мг/л) |
|---|---|---|---|---|---|
| Содержание, масс.% | 000000005×10−5 | 000,0016 | 00,001 | 000000,001 | 0000000,00003 |
Обобщённые концентрации элементов в минералах приведены в таблице, в скобках — количества минералов, по которым рассчитаны средние содержания компонентов.
| Минерал | Свинец (общ) | Уран | Торий |
|---|---|---|---|
| 00Настуран | 04,750 (308) | 58,87 (242) | 2,264 (108) |
| 00Монацит | 00,6134 (143) | 0,2619 (160) | 6,567 (150) |
| 000Ортит | 00,0907 (90) | 0,1154 (88) | 6,197 (88) |
| 000Циркон | 00,0293 (203) | 0,1012 (290) | 0,1471 (194) |
| Сфен (Титанит) | 00,0158 (12) | 0,0511 (14) | 0,0295 (21) |
Получение
Для получения свинца в основном используют руды, содержащие галенит. Сначала методом флотации получают концентрат, содержащий 40—70 процентов свинца. Затем возможно несколько способов переработки концентрата в веркблей (черновой свинец): прежде широко распространённый метод шахтной восстановительной плавки, разработанные в СССР метод кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых продуктов (КИВЦЭТ-ЦС), метод плавки Ванюкова (плавка в жидкой ванне). Для плавки в шахтной (ватержакетной) печи предварительно производят агломерационный обжиг концентрата, а затем его загружают в шахтную печь, где происходит восстановление свинца из оксида.
Веркблей, содержащий более 90 процентов свинца, подвергается дальнейшему очищению. Сначала для удаления меди применяют зейгерование и последующую обработку серой. Затем щелочным рафинированием удаляют мышьяк и сурьму. Далее выделяют серебро и золото с помощью цинковой пены и отгоняют цинк. Обработкой кальцием и магнием удаляют висмут. В результате содержание примесей падает до менее чем 0,2 %.
Производство в мире
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG):
| Страна | Количество в метрических килотоннах |
|---|---|
| Евросоюз | 2200 |
| США | 1400 |
| Китай | 1200 |
| Россия | 1100 |
| Южная Корея | 600 |
| Казахстан | 550 |
| Украина | 400 |
Физические свойства
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К), при температуре 0 °C. Металл мягкий, режется ножом, легко царапается ногтем. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет. Температура плавления — 600,61 K (327,46 °C), кипит при 2022 K (1749 °C). Относится к группе тяжёлых металлов; его плотность — 11,3415 г/см3 (при +20 °C). С повышением температуры плотность свинца падает:
| Температура, °C | Плотность, г/см3 |
|---|---|
| 327,6 | 10,686 |
| 450 | 10,536 |
| 650 | 10,302 |
| 850 | 10,078 |
Предел прочности на растяжение — 12—13 МПа (МН/м2).
При температуре 7,26 К становится сверхпроводником.
Химические свойства
Электронная формула: 5s25p65d106s26p2, энергия ионизации (Pb → Pb+ + e−) равна 7,42 эВ. На внешней электронной оболочке находятся 4 неспаренных электрона (2 на p- и 2 на d-подуровнях), поэтому основные степени окисления атома свинца — +2 и +4.
- Соли двухвалентного свинца реагируют со щелочами, образуя почти нерастворимый гидроксид свинца:
- Pb2+ + 2OH− = Pb(OH)2
- При избытке щёлочи гидроксид растворяется:
- Pb(OH)2 + 2OH− = [Pb(OH)4]2−
- Реагирует со щелочами и кислотами:
- Pb + 2NaOH + 2H2O = Na2[Pb(OH)4] + H2↑
- Pb + 4HNO3 = Pb(NO3)2 + 2NO2↑ + 2H2O
- Pb + 2HCl = PbCl2 + H2↑
Свинец образует комплексные соединения с координационным числом 4, например, [Pb(OH)4]2−
Реакция диспропорционирования между PbO2 и Pb лежит в основе работы свинцовых аккумуляторов.
Основные соединения свинца
Основная статья: Категория:Соединения свинца
Свинец в соединениях может находиться в степенях окисления +2 и +4, образуя соединения Pb(II) и Pb(IV), соответственно. В обеих степенях окисления свинец является амфотерным и может как выступать в роли катионов Pb2+ и Pb4+, так и входить в состав анионов (плюмбита PbO2-
2 с Pb(II) и плюмбатов с Pb(IV): метаплюмбата PbO2-
3 и ортоплюмбата PbO4-
4), в связи с этим может образовывать четыре типа солей.
Галогениды свинца
Свинец образует галогениды в степени окисления +2 вида PbHal2 для всех галогенов. Известны также галогениды свинца(IV): PbF4 и PbCl4, тетрабромиды и тетрайодиды не получены.
- Фторид свинца(II)
- Хлорид свинца(II) — белый кристаллический порошок, растворим в горячей воде. Хорошо растворяется также в растворах других хлоридов, особенно в хлориде аммония NH4Cl.
- Бромид свинца(II)
- Йодид свинца(II)
Халькогениды свинца
Халькогениды свинца — сульфид свинца PbS, селенид свинца(II) PbSe и теллурид свинца PbTe — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Оксиды свинца
Основная статья: Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе. Свинец образует два простых оксида — оксид свинца(II) PbO и оксид свинца(IV) PbO2 — и один смешанный Pb3O4 (свинцовый сурик), фактически являющийся плюмбатом (IV) свинца(II) Pb2PbO4.
Соли свинца
- Сульфат свинца(II) PbSO4
- Нитрат свинца(II) Pb(NO3)2
- Ацетат свинца(II) Pb(CH3COO)2 (свинцовый сахар).
- Хромат свинца(II) PbCrO4
Изотопы
Основная статья: Изотопы свинца
Весь свинец в основном является смесью изотопов 204Pb, 206Pb, 207Pb, 208Pb. Эти изотопы не радиоактивны, то есть стабильны. Свинец — последний элемент в периодической таблице, у которого существуют стабильные изотопы, элементы после свинца стабильных изотопов не имеют (хотя висмут-209 на практике можно считать стабильным, т.к. его период полураспада примерно в миллиард раз больше возраста Вселенной). Изотопы 206Pb, 207Pb, 208Pb являются радиогенными и образуются в результате радиоактивного распада соответственно 238U, 235U и 232Th. Изотоп 208
82Pb126
является одним из пяти существующих в природе дважды магических ядер. Схемы радиоактивного распада имеют вид:
-
- 238U → 206Pb + 84He;
- 235U → 207Pb + 74He;
- 232Th → 208Pb + 64He.
Уравнения распада имеют вид соответственно:
-
- 206Pb =238 U (eλ8t − 1 ),
- 207Pb =235 U (eλ5t − 1 ),
- 208Pb =232 Th(eλ2t − 1 ),
где 238U, 235U, 232Th — современные концентрации изотопов; λ8 = 1,55125 ⋅ 10−10 год−1, λ5 = 9,8485 ⋅ 10−10 год−1, λ2 = 4,9475 ⋅ 10−11 год−1 — постоянные распада атомов соответственно урана 238U, урана 235U и тория 232Th.
Кроме этих изотопов, известны и нестабильные изотопы 194Pb — 203Pb, 205Pb, 209Pb — 214Pb. Из них наиболее долгоживущие — 202Pb и 205Pb (с периодами полураспада 52,5 тысяч и 15,3 млн лет). Короткоживущие изотопы свинца 210Pb (радий D), 211Pb (актиний B), 212Pb (торий B) и 214Pb (радий B) имеют периоды полураспада соответственно 22,2 года, 36,1 мин, 10,64 ч и 26,8 мин (в скобках приведены редко используемые исторические названия этих изотопов); эти четыре радиоактивных изотопа входят в состав радиоактивных рядов урана и тория и, следовательно, также встречаются в природе, хотя и в крайне малых количествах.
Количество ядер изотопа 204Pb (нерадиогенного и нерадиоактивного) является стабильным, в минералах свинца концентрация 204Pb во многом зависит от концентрации радиогенных изотопов, образованных как в процессе распада радиоактивных ядер, так и в процессах вторичного преобразования свинецсодержащих минералов. Поскольку число радиогенных ядер, образовавшихся в результате радиоактивного распада, зависит от времени, то и абсолютные, и относительные концентрации зависят от времени образования минерала. Этим свойством пользуются при определении возраста горных пород и минералов.
Распространённость изотопов свинца
| Изотоп | 204Pb | 206Pb | 207Pb | 208Pb |
|---|---|---|---|---|
| Содержание в природе (в %) | 01,40 | 024,10 | 22,1 | 52,4 |
Свинец, состав которого приведён в таблице, отражает изотопный состав свинца преимущественно в галенитах, в которых урана и тория практически нет, и породах, преимущественно осадочных, в которых количество урана находится в кларковых пределах. В радиоактивных минералах этот состав существенно отличается и зависит от вида радиоактивного элемента, слагающего минерал. В урановых минералах, таких, как уранинит UO2, настуран UO2 (урановая смолка), урановые черни, в которых существенно преобладает уран, радиогенный изотоп 206Pbрад существенно преобладает над другими изотопами свинца, и его концентрации могут достигать 90 %. Например, в урановой смолке (Сан-Сильвер, Франция) концентрация 206Pb равна 92,9 %, в урановой смолке из Шинколобве (Киншаса) — 94,25 %. В ториевых минералах, например, в торите ThSiO4, существенно преобладает радиогенный изотоп 208Pbрад. Так, в монаците из Казахстана концентрация 208Pb равна 94,02 %, в монаците из пегматита Бекета (Зимбабве) — 88,8 %. Имеется комплекс минералов, например, монацит (Ce, La, Nd)[PO4], циркон ZrSiO4 и др., в которых в переменных соотношениях находятся уран и торий и соответственно в разных соотношениях присутствуют все или большинство изотопов свинца. Следует отметить, что в цирконах содержание нерадиогенного свинца крайне мало, что делает их удобным объектом для уран-торий-свинцового метода датирования (цирконометрия).
Свинцовые пульки
Применение
Нитрат свинца применяется для производства мощных смесевых взрывчатых веществ.
Азид свинца применяется как наиболее широко употребляемый детонатор (инициирующее взрывчатое вещество).
Перхлорат свинца используется для приготовления тяжёлой жидкости (плотность 2,6 г/см³), используемой во флотационном обогащении руд, он иногда применяется в мощных смесевых взрывчатых веществах как окислитель.
Фторид свинца самостоятельно, а также совместно с фторидом висмута, меди, серебра применяется в качестве катодного материала в химических источниках тока.
Висмутат свинца, сульфид свинца PbS, йодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях.
Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока.
Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с. 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников.
Диоксид свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но и также на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и другие.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлёвки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
Борат свинца Pb(BO2)2•H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора.
Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый жёлтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве жёлтых пигментов.
Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке.
Сульфат свинца PbSO4, нерастворимый в воде белый порошок, применяют как пигмент в аккумуляторах, литографии, в технологии набивных тканей.
Сульфид свинца PbS, чёрный нерастворимый в воде порошок, используют при обжиге глиняной посуды и для обнаружения ионов свинца.
Тетраэтилсвинец (C2H5)4Pb до недавнего времени применялся к качестве присадки к бензину для повышения октанового числа.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Свинец издавна применялся для изготовления пуль (а до изобретения огнестрельного оружия — других метательных снарядов, — например, для пращи) благодаря своей высокой плотности и, как следствие, большому импульсу и пробивной способности снаряда.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85—90 % Sn и 15—10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Было время, когда на оболочки кабелей шла значительная часть производимого в мире свинца, благодаря хорошим влагозащитным свойствам таких изделий. Однако впоследствии свинец в существенной мере вытеснили из этой области алюминий и полимеры. Так, в странах Запада использование свинца на оболочки кабелей упало с 342 тысяч тонн в 1976 году до 51 тысяч тонн в 2002 году.
В медицине
Используется для защиты пациентов от излучения рентгеновских аппаратов.
В геологии
Основная статья: Геохронология
Измерение содержания изотопов свинца используется для определения возраста минералов и горных пород в абсолютной геохронологии. Обобщённая сводка геохронологических методов приведена в работе. Уран-торий-свинцовый метод датирования основан на уравнениях распада изотопов урана и тория.
В большинстве природных объектов на Земле одинаково и практически не зависит от вида и интенсивности протекания природных геологических процессов (единственным исключением является природный ядерный реактор в Окло, Габон, Африка).
Экономические показатели
Цены на свинец в слитках (марка С1) в 2006 году составили в среднем 1,3—1,5 долл./кг.
Страны, крупнейшие потребители свинца в 2004 году, в тысячах тонн (по данным ILZSG):
| Китай | 1770 |
| ЕС | 1553 |
| США | 1273 |
| Корея | 286 |
Свинцовые грузила
Физиологическое действие
Свинец и его соединения токсичны. Особенно ядовиты водорастворимые, например, ацетат свинца II и летучие, например, тетраэтилсвинец, соединения. Токсичны и пары расплавленного свинца.
При остром отравлении наступают боли в животе, в суставах, судороги, обмороки. Свинец может накапливаться в костях, вызывая их постепенное разрушение, концентрируется в печени и почках.
Особенно опасно воздействие свинца на детей: при длительном воздействии он вызывает умственную отсталость и хронические заболевания мозга.
До принятия многими странами законодательных актов запрета применения тетраэтилсвинца в качестве антидетонационной присадки в моторные топлива, существенное загрязнение окружающей среды свинцом вызывалось выхлопами автомобильных двигателей, так как это металлоорганическое соединение свинца добавлялось в топливо с целью повышения октанового числа — так называемое этилирование бензина. В России этилированный бензин был запрещён с 15 ноября 2002 года.
ПДК соединений свинца в атмосферном воздухе — 0,003 мг/м³, в воде — 0,03 мг/л, почве — 20,0 мг/кг. Выброс свинца в Мировой океан — 430—650 тысяч тонн в год.
Свинец (Pb от лат. Plumbum) – химический элемент, который находится в IV группе Таблицы Менделеева. Свинец имеет множество изотопов, среди которых более 20 обладают радиоактивными свойствами. Изотопы свинца являются продуктами распада урана и тория, поэтому содержание свинца в литосфере постепенно увеличивалось в течение миллионов лет и сейчас составляет около 0,0016% по массе, но он более распространен, чем его ближайшие родственники, такие как золото и ртуть. Свинец легко выделяется из рудных месторождений. Основные источники свинца — галенит, англезит и церуссит. В руде со свинцом очень часто соседствуют другие металлы, например, цинк, кадмий и висмут. В самородном виде свинец встречается исключительно редко.
Свинец — интересные исторические факты
Этимология слова «свинец» до сих пор точно не выяснена и является предметом очень интересных исследований. Свинец очень похож на олово, очень часто их путали, поэтому в большинстве западнославянских языков свинец это олово. Зато слово “свинец” встречается в литовском (svinas) и латышском (svin) языках. Свинец в переводе на английский lead, на голландский lood. Видимо отсюда и пошло слово “лудить”, т.е. покрывать изделие слоем олова (или свинца). Не до конца понятно также происхождение латинского слова Plumbum, от которого произошло английское слово plumber – водопроводчик. Дело в том, что когда-то водопроводные трубы “запечатывали” свинцом, “пломбировали” (франц. plomber “запечатывать свинцом”). Кстати, отсюда же всем известное слово “пломба”. Но на этом путаница не заканчивается, греки всегда называли свинец «молибдос», отсюда и латинское «molibdaena», незнающему человеку легко спутать это название с наименованием химического элемента молибден. Так в древности называли блестящие минералы оставляющие тёмный след на светлой поверхности. Этот факт оставил свой след в немецком языке: “карандаш” по-немецки называется Bleistift, т.е. свинцовый стержень.
Человечество знакомо со свинцом с незапамятных времен. Археологами найдены свинцовые изделия выплавленные 8000 лет тому назад. В Древнем Египте из свинца даже отливали статуи. В Древнем Риме из свинца были изготовлены водопроводные трубы, именно он предопределил первую в истории экологическую катастрофу. Римляне не имели никакого представления о вреде свинца, им нравился податливый, прочный и простой в работе металл. Считалось даже, что свинец, добавленный в вино, улучшает его вкус. Поэтому почти каждый римлянин был отравлен свинцом. О симптомах отравления свинцом мы расскажем ниже, а пока лишь укажем, что одним из них является расстройство рассудка. Видимо отсюда и берут свое начало все эти безумные выходки знатных римлян и бесчисленные сумасшедшие оргии. Некоторые исследователи даже считают, что свинец явился чуть ли основной причиной падения Древнего Рима.
В древности гончары мололи свинцовую руду, разводили водой и обливали полученной смесью глиняные предметы. После обжига такие сосуды покрывались тонким слоем блестящего свинцового стекла.
Англичанин Джордж Равенскрофт в 1673 году усовершенствовал состав стекла, добавив к исходным компонентам оксид свинца и таким образом получил легкоплавкое блестящее стекло, которое было очень похоже на натуральный горный хрусталь. А в конце 18 века Георг Страсс при производстве стекла сплавил вместе белый песок, поташ и оксид свинца, получив такое чистое и блестящее стекло, что его сложно было отличить от алмаза. Отсюда и пошло название “стразы”, по сути подделка под драгоценные камни. К сожалению, среди современников Страсс прослыл мошенником и его изобретение находилось в забвении до тех пор, пока в начале XX века Даниэль Сваровски не смог сделать из производства страз целую индустрию моды и направление искусства.
После появления и широкого распространения огнестрельного оружия, свинец начал использоваться для производства пуль и дроби. Из свинца изготавливали типографские литеры. Свинец ранее входил в состав белой и красной красок, ими писали почти все старинные художники.
Химические свойства свинца кратко
Свинец — металл матового серого цвета. Однако его свежий срез хорошо блестит, но к сожалению почти моментально покрывается грязноватой оксидной плёнкой. Свинец очень тяжелый металл, он тяжелее железа в полтора раза, а алюминия в четыре. Недаром в русском языке слово “свинцовый” является в некоторой мере синонимом тяжести. Свинец очень легкоплавкий металл, он плавится уже при 327 ° С. Ну, этот факт известен всем рыбакам, которые с легкостью выплавляют нужные по весу грузила. Также свинец очень мягок, его можно резать обычным стальным ножом. Свинец очень малоактивный металл, провести с ним реакцию или растворить его не составляет никакого труда даже при комнатной температуре.
Органические производные свинца являются очень ядовитыми веществами. К сожалению, одно из них, тетраэтилсвинец, широко использовалось как присадка к бензину, позволяющая повысить октановое число. Но зато к счастью, тетраэтилсвинец больше не применяется в такой ипостаси, химики и производственники научились повышать октановое число более безопасными способами.
Влияние свинца на организм человека и симптомы отравления
Любые соединения свинца очень ядовиты. Металл проникает в организм вместе с едой или со вдыхаемым воздухом и разносится кровью. Причем вдыхание паров свинцовых соединений и пыли намного более опасно, чем присутствие его в пище. Свинец имеет свойство накапливаться в костях, частично замещая в этом случае кальций. При повышении концентрации свинца в организме развивается анемия, поражается головной мозг, что приводит к снижению интеллекта, а у детей может вызвать необратимые задержки в развитии. Достаточно растворить один миллиграмм свинца в литре воды и она станет не только непригодной, но и опасной для питья. Такое низкое количество свинца представляет также определенную опасность, ни цвет ни вкус воды не изменяется. Основные симптомы отравления свинцом:
- серая кайма на деснах,
- вялость,
- апатия,
- потеря памяти,
- слабоумие,
- проблемы со зрением,
- раннее старение.
Применение свинца
Всё же, несмотря на токсичность, отказаться от использования свинца пока нет никакой возможности ввиду его исключительных свойств и дешевизны. Свинец в основном используется для производства аккумуляторных пластин, на эти нужды в настоящее время тратится около 75% добываемого на планете свинца. Свинец используется как оболочка для электрических кабелей, благодаря своей пластичности и неподверженности коррозии. Этот металл широко используется в химической и нефтеперерабатывающей промышленности, например, для облицовки реакторов в которых получают серную кислоту. Свинец обладает свойством задерживать радиоактивное излучение, этим тоже широко пользуются в энергетике, медицине и химии. В свинцовых контейнерах, к примеру, транспортируют радиоактивные элементы. Свинец идет в производство сердечников пуль и шрапнели. Также этот металл находит свое применение в производстве подшипников.
Pb, химический элемент IV группы периодической системы Менделеева; атомный номер 82, атомная масса 207,2. С. — тяжёлый металл голубовато-серого цвета, очень пластичный, мягкий (режется ножом, царапается ногтем). Природный С. состоит из 5 стабильных изотопов с массовыми числами 202 (следы), 204 (1,5%), 206 (23,6%), 207 (22,6%), 208 (52,3%). Последние три изотопа — конечные продукты радиоактивных превращений 238U, 235U и 232Th (см. Радиоактивные ряды). При ядерных реакциях образуются многочисленные радиоактивные изотопы С. Историческая справка. С. был известен за 6—7 тыс. лет до н. э. народам Месопотамии, Египта и других стран древнего мира. Он служил для изготовления статуй, предметов домашнего обихода, табличек для письма. Римляне пользовались свинцовыми трубами для водопроводов. Алхимики называли С. сатурном и обозначали его знаком этой планеты (см. Знаки химические). Соединения С. — «свинцовая зола» PbO, свинцовые белила 2PbCO3•Pb (OH)2 применялись в Древней Греции и Риме как составные части лекарств и красок. Когда было изобретено огнестрельное оружие, С. начали применять как материал для пуль. Ядовитость С. отметили ещё в 1 в. н. э. греческий врач Диоскорид и Плиний Старший, Распространение в природе. Содержание С. в земной коре (кларк) 1,6·10-3% по массе. Образование в земной коре около 80 минералов, содержащих С. (главный из них галенит PbS), связано в основном с формированием гидротермальных месторождений (См. Гидротермальные месторождения) (см. Полиметаллические руды). В зонах окисления полиметаллических руд образуются многочисленные (около 90) вторичные минералы: сульфаты (англезит PbSO4), карбонаты (церуссит PbCO3), фосфаты [пироморфит Pb5(PO4)3Cl]. В биосфере С. в основном рассеивается, его мало в живом веществе (5·10-5%), морской воде (3·10-9%). Из природных вод С. отчасти сорбируется глинами и осаждается сероводородом, поэтому он накапливается в морских илах с сероводородным заражением и в образовавшихся из них чёрных глинах и сланцах, Физические и химические свойства. С. кристаллизуется в гранецентрированной кубической решётке (а = 4,9389 Å), аллотропических модификаций не имеет. Атомный радиус 1,75 Å, ионные радиусы: Pb2+ 1,26 Å, Pb4+ 0,76 Å: плотность 11,34 г/см3 (20°С); tnл 327,4 °С; tkип 1725 °С; удельная теплоёмкость при 20°С 0,128 кдж/(кг·К) [0,0306 кал/г·°С]; теплопроводность 33,5 вт/(м·К)[0,08 кал/(см·сек·оС)]; температурный коэффициент линейного расширения 29,1·10-6 при комнатной температуре; твёрдость по Бринеллю 25—40 Мн/м2 (2,5—4 кгс/мм2); предел прочности при растяжении 12—13 Мн/м2, при сжатии около 50 Мн/м2; относительное удлинение при разрыве 50—70%. Наклёп не повышает механических свойств С., т. к. температура его рекристаллизации лежит ниже комнатной (около —35 °С при степени деформации 40% и выше). С. диамагнитен, его магнитная восприимчивость — 0,12·10-6. При 7,18 К становится сверхпроводником.
Конфигурация внешних электронных оболочек атома Pb 6s2 6р2, в соответствии с чем он проявляет степени окисления +2 и +4. С. сравнительно мало активен химически. Металлический блеск свежего разреза С. постепенно исчезает на воздухе вследствие образования тончайшей плёнки PbO, предохраняющей от дальнейшего окисления. С кислородом образует ряд окислов Pb2O, PbO, PbO2, Pb3O4 и Pb2O3 (см. Свинца окислы).
В отсутствие O2 вода при комнатной температуре на С. не действует, но он разлагает горячий водяной пар с образованием окиси С. и водорода. Соответствующие окислам PbO и PbO2 гидроокиси Pb (OH)2 и Pb (OH)4 имеют амфотерный характер.
Соединение С. с водородом PbH4 получается в небольших количествах при действии разбавленной соляной кислоты на Mg2Pb. PbH4 — бесцветный газ, который очень легко разлагается на Pb и H2. При нагревании С. соединяется с галогенами, образуя галогениды PbX2 (X — галоген). Все они малорастворимы в воде. Получены также галогениды PbX4: тетрафторид PbF4 — бесцветные кристаллы и тетрахлорид PbCl4 — жёлтая маслянистая жидкость. Оба соединения легко разлагаются, выделяя F2 или Cl2; гидролизуются водой. С азотом С. не реагирует. Азид свинца Pb (N3)2 получают взаимодействием растворов азида натрия NaN3 и солей Pb (II); бесцветные игольчатые кристаллы, труднорастворимые в воде; при ударе или нагревании разлагается на Pb и N2 со взрывом. Сера действует на С. при нагревании с образованием сульфида PbS — чёрного аморфного порошка. Сульфид может быть получен также при пропускании сероводорода в растворы солей Pb (II); в природе встречается в виде свинцового блеска — Галенита.
В ряду напряжений Pb стоит выше водорода (нормальные электродные потенциалы соответственно равны — 0,126 в для Pb ⇔ Pb2++ 2e и + 0,65 в для Pb ⇔ Pb4++ 4e). Однако С. не вытесняет водород из разбавленной соляной и серной кислот, вследствие перенапряжения (См. Перенапряжение) H2 на Pb, а также образования на поверхности металла защитных плёнок труднорастворимых хлорида PbCl2 и сульфата PbSO4. Концентрированные H2SO4 и HCl при нагревании действуют на Pb, причём получаются растворимые комплексные соединения состава Pb (HSO4)2 и H2[PbCl4]. Азотная, уксусная, а также некоторые органические кислоты (например, лимонная) растворяют С. с образованием солей Pb (II). По растворимости в воде соли делятся на растворимые (ацетат, нитрат и хлорат свинца), малорастворимые (хлорид и фторид) и нерастворимые (сульфат, карбонат, хромат, фосфат, молибдат и сульфид). Соли Pb (IV) могут быть получены электролизом сильно подкисленных H2SO4 растворов солей Pb (II); важнейшие из солей Pb (IV) — сульфат Pb (SO4)2 и ацетат Pb (C2H3O2)4. Соли Pb (IV) склонны присоединять избыточные отрицательные ионы с образованием комплексных анионов, например плюмбатов (PbO3)2- и (PbO4)4-, хлороплюмбатов (PbCl6)2-, гидроксоплюмбатов [Pb (OH)6]2- и др. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа X2[Pb (OH)4].
Получение. Металлический С. получают окислительным обжигом PbS с последующим восстановлением PbO до сырого Pb («веркблея») и рафинированием (очисткой) последнего. Окислительный обжиг концентрата ведётся в агломерационных ленточных машинах непрерывного действия (см. Агломерация). При обжиге PbS преобладает реакция: 2PbS + 3O2 = 2PbO + 2SO2. Кроме того, получается и немного сульфата PbSO4, который переводят в силикат PbSiO3, для чего в шихту добавляют кварцевый песок. Одновременно окисляются и сульфиды других металлов (Cu, Zn, Fe), присутствующие как примеси. В результате обжига вместо порошкообразной смеси сульфидов получают агломерат — пористую спекшуюся сплошную массу, состоящую преимущественно из окислов PbO, CuO, ZnO, Fe2O3. Куски агломерата смешивают с коксом и известняком и эту смесь загружают в ватержакетную печь (См. Ватержакетная печь), в которую снизу через трубы («фурмы») подают воздух под давлением. Кокс и окись углерода восстанавливают PbO до Pb уже при невысоких температурах (до 500 °С). При более высоких температурах идут реакции:
CaCO3 = CaO + CO2
2PbSiO3 + 2CaO + С = 2Pb + 2CaSiO3 + CO2.
Окислы Zn и Fe частично переходят в ZnSiO3 и FeSiO3, которые вместе с CaSiO3 образуют шлак, всплывающий на поверхность. Окислы С. восстанавливаются до металла. Сырой С. содержит 92—98% Pb, остальное — примеси Cu, Ag (иногда Au), Zn, Sn, As, Sb, Bi, Fe. Примеси Cu и Fe удаляют Зейгерованием. Для удаления Sn, As, Sb через расплавленный металл продувают воздух. Выделение Ag (и Au) производится добавкой Zn, который образует «цинковую пену», состоящую из соединений Zn c Ag (и Au), более лёгких, чем Pb, и плавящихся при 600—700 °С. Избыток Zn удаляют из расплавленного Pb пропусканием воздуха, водяного пара или хлора. Для очистки от Bi к жидкому Pb добавляют Ca или Mg, дающие трудноплавкие соединения Ca3Bi2 и Mg3Bi2. Рафинированный этими способами С. содержит 99,8—99,9% Pb. Дальнейшая очистка производится электролизом, в результате чего достигается чистота не менее 99,99%. Применение. С. широко применяют в производстве свинцовых Аккумуляторов, используют для изготовления заводской аппаратуры, стойкой в агрессивных газах и жидкостях. С. сильно поглощает γ-лучи и рентгеновские лучи, благодаря чему его применяют как материал для защиты от их действия (контейнеры для хранения радиоактивных веществ, аппаратура рентгеновских кабинетов и др.). Большие количества С. идут на изготовление оболочек электрических кабелей, защищающих их от коррозии и механических повреждений. На основе С. изготовляют многие Свинцовые сплавы. Окись С. PbO вводят в хрусталь и оптическое Стекло для получения материалов с большим показателем преломления. Сурик, хромат (жёлтый крон) и основной карбонат С. (свинцовые белила) — ограниченно применяемые пигменты. Хромат С. — окислитель, используется в аналитической химии. Азид и стифнат (тринитрорезорцинат) — инициирующие взрывчатые вещества. Тетраэтилсвинец — антидетонатор (См. Антидетонаторы). Ацетат С. служит индикатором для обнаружения H2S. В качестве изотопных индикаторов используются 204Pb (стабильный) и 212Pb (радиоактивный).
С. А. Погодин.
С. в организме. Растения поглощают С. из почвы, воды и атмосферных выпадений. В организм человека С. попадает с пищей (около 0,22 мг), водой (0,1 мг), пылью (0,08 мг). Безопасный суточный уровень поступления С. для человека 0,2—2 мг. Выделяется главным образом с калом (0,22—0,32 мг), меньше с мочой (0,03—0,05 мг). В теле человека содержится в среднем около 2 мг С. (в отдельных случаях — до 200 мг). У жителей промышленно развитых стран содержание С. в организме выше, чем у жителей аграрных стран, у горожан выше, чем у сельских жителей. Основное депо С. — скелет (90% всего С. организма): в печени накапливается 0,2—1,9 мкг/г; в крови — 0,15—0,40 мкг/мл; в волосах — 24 мкг/г, в молоке —0,005—0,15 мкг/мл; содержится также в поджелудочной железе, почках, головном мозге и др. органах. Концентрация и распределение С. в организме животных близки к показателям, установленным для человека. При повышении уровня С. в окружающей среде возрастает его отложение в костях, волосах, печени. Биологические функции С. не установлены.
Ю. И. Раецкая.
Отравления С. и его соединениями возможны при добыче руд, выплавке С., при производстве свинцовых красок, в полиграфии, гончарном, кабельном производствах, при получении и применении тетраэтилсвинца и др. Бытовые отравления возникают редко и наблюдаются при употреблении в пищу продуктов, которые длительно хранили в глиняной посуде, покрытой глазурью, содержащей свинцовый сурик или глёт. С. и его неорганические соединения в виде аэрозолей проникают в организм в основном через дыхательные пути, в меньшей степени — через желудочно-кишечный тракт и кожу. В крови С. циркулирует в виде высокодисперсных коллоидов — фосфата и альбумината. Выделяется С. в основном через кишечник и почки. В развитии интоксикации играют роль нарушение порфиринового, белкового, углеводного и фосфатного обменов, дефицит витаминов С и B1, функциональные и органические изменения центральной и вегетативной нервной системы, токсическое влияние С. на костный мозг. Отравления могут быть скрытыми (т. н. носительство), протекать в лёгкой, средней тяжести и тяжёлой формах.
Наиболее частые признаки отравления С.: кайма (полоска лиловато-аспидного цвета) по краю дёсен, землисто-бледная окраска кожных покровов; ретикулоцитоз и другие изменения крови, повышенное содержание порфиринов в моче, наличие в моче С. в количествах 0,04—0,08 мг/л и более и т. д. Поражение нервной системы проявляется астенией, при выраженных формах — энцефалопатией, параличами (преимущественно разгибателей кисти и пальцев рук), полиневритом. При т. н. свинцовой колике возникают резкие схваткообразные боли в животе, запор, продолжающиеся от нескольких ч до 2—3 нед; нередко колика сопровождается тошнотой, рвотой, подъёмом артериального давления, температуры тела до 37,5—38 °С. При хронической интоксикации возможны поражения печени, сердечно-сосудистой системы, нарушение эндокринных функций (например, у женщин — выкидыши, дисменорея, меноррагии и др.). Угнетение иммунобиологической реактивности способствует повышенной общей заболеваемости.
Лечение: специфические (комплексонообразователи и др.) и общеукрепляющие (глюкоза, витамины и др.) средства, физиотерапия, санаторно-курортное лечение (Пятигорск, Мацеста, Серноводск). Профилактика: замена С. менее токсичными веществами (например, цинковые и титановые белила вместо свинцовых), автоматизация и механизация операций в производстве С., эффективная вытяжная вентиляция, индивидуальная защита рабочих, лечебное питание, периодическая витаминизация, предварительные и периодические медицинские осмотры.
Препараты С. используют в медицинской практике (только наружно) как вяжущие и антисептические средства. Применяют: свинцовую воду (при воспалительных заболеваниях кожи и слизистых оболочек), простой и сложный свинцовые пластыри (при гнойно-воспалительных заболеваниях кожи, фурункулах) и др.
Л. А. Каспаров.
Лит.: Андреев В. М., Свинец, в кн.: Краткая химическая энциклопедия, т. 4, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963; Чижиков Д. М., Металлургия свинца, в кн.: Справочник металлурга по цветным металлам, т. 2, М., 1947; Вредные вещества в промышленности, под ред. Н. В. Лазарева, 6 изд., ч. 2, Л., 1971; Тарабаева Г. И., Действие свинца на организм и лечебно-профилактические мероприятия, А.-А., 1961; Профессиональные болезни, 3 изд., М., 1973,
Большая советская энциклопедия. — М.: Советская энциклопедия.
1969—1978.

- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
СТРУКТУРА

СВОЙСТВА

ЗАПАСЫ И ДОБЫЧА

Для получения свинца в основном используют руды, содержащие галенит. Сначала методом флотации получают концентрат, содержащий 40—70 процентов свинца. Затем возможно несколько способов переработки концентрата в веркблей (черновой свинец): прежде широко распространённый метод шахтной восстановительной плавки, разработанные в СССР метод кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых продуктов (КИВЦЭТ-ЦС), метод плавки Ванюкова (плавка в жидкой ванне). Для плавки в шахтной (ватержакетной) печи предварительно производят агломерационный обжиг концентрата, а затем его загружают в шахтную печь, где происходит восстановление свинца из оксида.
Веркблей, содержащий более 90 процентов свинца, подвергается дальнейшему очищению. Сначала для удаления меди применяют зейгерование и последующую обработку серой. Затем щелочным рафинированием удаляют мышьяк и сурьму. Далее выделяют серебро и золото с помощью цинковой пены и отгоняют цинк. Обработкой кальцием и магнием удаляют висмут. В результате содержание примесей падает до менее чем 0,2 %[
ПРОИСХОЖДЕНИЕ

В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на земле, где в породах больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана.
ПРИМЕНЕНИЕ

Висмутат свинца, сульфид свинца PbS, иодид свинца применяются в качестве катодного материала в литиевых аккумуляторных батареях. Хлорид свинца PbCl2 в качестве катодного материала в резервных источниках тока. Теллурид свинца PbTe широко применяется в качестве термоэлектрического материала (термо-э.д.с. 350 мкВ/К), самый широкоприменяемый материал в производстве термоэлектрогенераторов и термоэлектрических холодильников. Двуокись свинца PbO2 широко применяется не только в свинцовом аккумуляторе, но и также на её основе производятся многие резервные химические источники тока, например — свинцово-хлорный элемент, свинцово-плавиковый элемент и другие.
Свинцовые белила, основной карбонат Pb(OH)2•PbCO3, плотный белый порошок, — получается из свинца на воздухе под действием углекислого газа и уксусной кислоты. Использование свинцовых белил в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S. Свинцовые белила применяют также для производства шпатлёвки, в технологии цемента и свинцовокарбонатной бумаги.
Арсенат и арсенит свинца применяют в технологии инсектицидов для уничтожения насекомых — вредителей сельского хозяйства (непарного шелкопряда и хлопкового долгоносика).
Борат свинца Pb(BO2)2•H2O, нерастворимый белый порошок, используют для сушки картин и лаков, а вместе с другими металлами — в качестве покрытий стекла и фарфора.
Хлорид свинца PbCl2, белый кристаллический порошок, растворим в горячей воде, растворах других хлоридов и особенно хлорида аммония NH4Cl. Его применяют для приготовления мазей при обработке опухолей.
Хромат свинца PbCrO4 известен как хромовый жёлтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В промышленности хромат применяют в основном в производстве жёлтых пигментов.
Нитрат свинца Pb(NO3)2 — белое кристаллическое вещество, хорошо растворимое в воде. Это вяжущее ограниченного применения. В промышленности его используют в спичечном производстве, крашении и набивке текстиля, окраске рогов и гравировке.
Поскольку свинец хорошо поглощает γ-излучение, он используется для радиационной защиты в рентгеновских установках и в ядерных реакторах. Кроме того, свинец рассматривается в качестве теплоносителя в проектах перспективных ядерных реакторов на быстрых нейтронах.
Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 85—90 % Sn и 15—10 % Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67 % Pb и 33 % Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского шрифта, а сплавы свинца, сурьмы и олова — для фигурного литья и подшипников. Сплавы свинца с сурьмой обычно применяют для оболочек кабелей и пластин электрических аккумуляторов. Было время, когда на оболочки кабелей шла значительная часть производимого в мире свинца, благодаря хорошим влагозащитным свойствам таких изделий. Однако впоследствии свинец в существенной мере вытеснили из этой области алюминий и полимеры. Так, в странах Запада использование свинца на оболочки кабелей упало с 342 тысяч тонн в 1976 году до 51 тысяч тонн в 2002 году. Соединения свинца используются в производстве красителей, красок, инсектицидов, стеклянных изделий и как добавки к бензину в виде тетраэтилсвинца (C2H5)4Pb (умеренно летучая жидкость, пары которой в малых концентрациях имеют сладковатый фруктовый запах, в больших — неприятный запах; Тпл = 130 °C, Ткип = +80 °С/13 мм рт. ст.; плотность 1,650 г/см³; nD2v = 1,5198; не растворяется в воде, смешивается с органическими растворителями; высокотоксичен, легко проникает через кожу; ПДК = 0,005 мг/м³; ЛД50 = 12,7 мг/кг (крысы, перорально)) для повышения октанового числа.
Используется для защиты пациентов от излучения рентгеновских аппаратов.
Свинец (англ. Lead) – Pb
| Молекулярный вес | 207.20 г/моль |
| Происхождение названия | от латинского plumbum |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/A.05-20 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.21.1 |
| Dana (8-ое издание) | 1.1.1.4 |
| Hey’s CIM Ref | 1.30 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | серый, обычно покрыт белым налётом гидроцеруссита |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 1,5 |
| Прочность | ковкий, тягучий, режется ножом |
| Излом | зазубренный, крючковатый |
| Плотность (измеренная) | 11.37 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | диамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | серо-белый с коричневатым оттенком и коричневато красным внутренним отражением |
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) – гексаоктаэдральный |
| Пространственная группа | Fm3m |
| Сингония | кубическая |
| Параметры ячейки | a = 4.9506Å |
| Двойникование | по (111) |
Интересные статьи:
Глоссарий. Химия
Свинец
Свине́ц — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение названия
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы: švinas (литовский), svins (латышский), а также в восточнославянских — украинском (свинець) и белорусском (свінец).
Латинское plumbum, употребляемое, помимо остальных, Петронием Арбитром дало английское слово plumber — водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Физические свойства
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К) при температуре 0 °C. Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.
Свинец широко используют для защиты от гамма-излучения, как элемент с большим атомным номером (и следовательно большим количеством электронов на один атом), достаточно распространённый в природе, не радиоактивный.
Плотность — 11,3415 г/см³ (при 20 °C)
Температура плавления — 327,4 °C (621,32 °F; 600,55 K)
Температура кипения — 1740 °C (3164 °F; 2013,15 K)
Химические свойства
Свинец не очень активен химически. На металлическом разрезе свинца виден металлический блеск, постепенно исчезающий из-за образования тонкой плёнки PbO.
С кислородом образует ряд соединений Pb2О, PbO, Pb2О3, Pb3О4, PbO2. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре при взаимодействии свинца и горячего водяного пара получаются оксиды свинца и водород.
Оксидам PbO и PbO2 соответствуют амфотерные гидроксиды Pb(ОН)2 и Pb(ОН)4.
При реакции Mg2Pb и разбавленной HCl получается небольшое количество PbH4. PbH4 — газообразное вещество без запаха, которое очень легко разлагается на свинец и водород. При большой температуре галогены образовывают со свинцом соединения вида PbX2 (X — соответствующий галоген). Все эти соединения мало растворяются в воде. Могут быть получены галогениды и типа PbX4. Свинец с азотом прямо не реагирует. Азид свинца Pb(N3)2 получают косвенным путём: взаимодействием растворов солей Pb(II) и соли NaN3. Сульфиды свинца можно получить при нагревании серы со свинцом, образуется сульфид PbS. Сульфид получают также пропусканием сероводорода в растворы солей Pb(II). В ряду напряжений свинец стоит левее водорода, но свинец не вытесняет водород из разбавленных HCl и H2SO4, из-за перенапряжения Н2 на Pb, а также на поверхности металла образуются плёнки труднорастворимых хлорида PbCl2 и сульфата PbSO4, защищающие металл от дальнейшего действия кислот. Концентрированные кислоты типа H2SO4 и HCl при нагревании действуют на Pb и образуют с ним растворимые комплексные соединения состава Pb(HSO4)2 и Н2[PbCl4]. Азотная, а также некоторые органических кислоты (например, лимонная) растворяют свинец с получением солей Pb(II). По растворимости в воде соли свинца делятся на нерастворимые (например, сульфат, карбонат, хромат, фосфат, молибдат и сульфид), малорастворимые (хлорид и фторид) и растворимые (к примеру, ацетат, нитрат и хлорат свинца). Соли Pb(IV) могут быть получены электролизом сильно подкисленных серной кислотой растворов солей Pb(II). Соли Pb(IV) присоединяют отрицательные ионы с образованием комплексных анионов, например, плюмбатов (PbO3)2- и (PbO4)4-, хлороплюмбатов [PbCl6]2-, гидроксоплюмбатов [Pb(ОН)6]2- и других. Концентрированные растворы едких щелочей при нагревании реагируют со свинцом с выделением водорода и гидроксоплюмбитов типа [Pb(ОН)4 X2].
Потенциал ионизации Еион=7,42 эВ.
Источник: Википедия
Другие заметки по химии
Химический элемент с атомным номером 82
Химический элемент с атомным номером 82
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Свинец | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | () | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | серый металлик | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Pb) | 207,2 (1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Свинец в таблице Менделеева | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 14 (углеродная группа) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | p-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Постпереходный металл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Xe ] 4f 5d 6s 6p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 32, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | твердое тело | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 600,61 K ( 327,46 ° C, 621,43 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 2022 K (1749 ° C, 3180 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около rt ) | 11,34 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при т.пл. ) | 10,66 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 4,77 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 179,5 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 26,650 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | −4, −2, −1, + 1, +2, +3, +4 (амфотерный оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,87 (+2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 175 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 146 ± 5 мкм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| радиус Ван-дер-Ваальса | 202 мкм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | первозданная | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гранецентрированный кубический (fcc)  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 1190 м / с (при rt ) (отожженный) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 28,9 мкм / (м · К) (при 25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 35,3 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 208 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | диамагнитный | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | -23,0 × 10 см / моль (при 298 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 16 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 5,6 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 46 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коэффициент Пуассона | 0,44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Жесткость по Бринеллю ess | 38–50 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7439-92-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | на Ближнем Востоке (7000 г. до н.э. ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы свинца | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Содержание изотопов сильно различается в зависимости от образца | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Свинец является химическим веществом элемент с символом Pb(от латинского plumbum) и атомным номером 82. Это тяжелый металл, который плотнее, чем большинство обычных материалов. Свинец мягкий и ковкий, а также имеет относительно низкую точку плавления. В свежем виде свинец серебристый с оттенком синего; он тускнеет до тускло-серого цвета при контакте с воздухом. Свинец имеет наивысший атомный номер из всех стабильных элементов, и три его изотопа являются конечными точками основных ядерных цепочек распада более тяжелых элементов.
Свинец — это относительно инертный металл после перехода. Его слабый металлический характер иллюстрируется его амфотерным характером; свинец и оксиды свинца реагируют с кислотами и основаниями и имеют тенденцию к образованию ковалентных связей. Соединения свинца обычно находятся в степени окисления +2 , а не в состоянии +4, обычном для более легких членов углеродной группы. Исключения в основном ограничиваются органическими соединениями. Подобно более легким членам группы, свинец имеет тенденцию связываться с самим собой ; он может образовывать цепочки и многогранные структуры.
Свинец легко извлекается из руды ; доисторические люди Западной Азии знали об этом. Галена — основная руда свинца, которая часто содержит серебро. Интерес к серебру помог повсеместно добывать и использовать свинец в Древнем Риме. Производство свинца снизилось после падения Рима и не достигало сопоставимых уровней до промышленной революции. В 2014 году годовое мировое производство свинца составило около десяти миллионов тонн, более половины из которых приходилось на переработку. Высокая плотность свинца, низкая температура плавления, пластичность и относительная инертность к окислению делают его полезным. Эти свойства в сочетании с его относительным обилием и низкой стоимостью привели к его широкому использованию в строительстве, сантехнике, батареях, пуль и выстрелах <141.>, веса, припои, оловянные, плавкие сплавы, белые краски, этилированный бензин и радиационная защита.
В конце 19 века была признана токсичность свинца, и с тех пор его использование во многих областях было прекращено. Однако во многих странах по-прежнему разрешена продажа продуктов, которые подвергают людей воздействию свинца, включая некоторые типы красок и пуль. Свинец — это нейротоксин, который накапливается в мягких тканях и костях; он повреждает нервную систему и нарушает функцию биологических ферментов, вызывая неврологические расстройства, такие как повреждение мозга и поведенческие проблемы.
Содержание
- 1 Физические свойства
- 1.1 Атомарное
- 1.2 Объемное
- 1.3 Изотопы
- 2 Химия
- 2.1 Неорганические соединения
- 2.1.1 Свинец (II)
- 2.1.2 Свинец (IV)
- 2.1.3 Другие степени окисления
- 2.2 Органолид
- 2.1 Неорганические соединения
- 3 Происхождение и распространение
- 3.1 В космосе
- 3.2 На Земле
- 4 Этимология
- 5 История
- 5.1 Предыстория и ранняя история
- 5.2 Классическая эпоха
- 5.2.1 Путаница с оловом и сурьмой
- 5.3 Средние века и эпоха Возрождения
- 5.4 За пределами Европы и Азии
- 5.5 Промышленная революция
- 5.6 Современная эпоха
- 6 Производство
- 6.1 Первичный
- 6.1.1 Двухэтапный процесс
- 6.1.2 Прямой процесс
- 6.1.3 Альтернативы
- 6.2 Вторичный
- 6.1 Первичный
- 7 Приложения
- 7.1 Элементная форма
- 7.2 Соединения
- 8 Биологические эффекты
- 8.1 Токсичность
- 8.2 Эффекты
- 8.3 Источники воздействия
- 8.4 Обработка
- 9 Воздействие на окружающую среду
- 10 Ограничение и устранение
- 11 См. Также
- 12 Примечания
- 13 Ссылки
- 14 Библиография
- 1 5 Дополнительная литература
- 16 Внешние ссылки
Физические свойства
Атомный
Атом свинца имеет 82 электронов, расположенных в электронная конфигурация [Xe ] 4f5d6s6p. Сумма первой и второй энергий ионизации свинца — полная энергия, необходимая для удаления двух 6p-электронов — близка к таковой для олова, верхнего соседа свинца в углеродной группе .. Это необычно; энергии ионизации обычно падают вниз по группе, поскольку внешние электроны элемента становятся все более удаленными от ядра и более экранируются меньшими орбиталями. Сходство энергий ионизации вызвано сокращением лантаноидов — уменьшением радиусов элемента с лантана (атомный номер 57) до лютеция (71) и относительно небольшие радиусы элементов от гафния (72) и далее. Это происходит из-за плохой экранирования ядра 4f-электронами лантаноида. Сумма первых четырех энергий ионизации свинца превышает энергию олова, что противоречит предсказанию периодических тенденций. Релятивистские эффекты, которые проявляются в более тяжелых атомах, способствуют такому поведению. Одним из таких эффектов является эффект инертной пары : 6s-электроны свинца не хотят участвовать в связывании, что делает расстояние между ближайшими атомами в кристаллическом свинце необычно большим.
Более легкие углеродные группы конгенеров свинца образуют стабильные или метастабильные аллотропы с тетраэдрически координированной и ковалентно связанной кубической алмазной структурой. Уровни энергии их внешних s- и p-орбиталей достаточно близки, чтобы обеспечить смешивание в четыре гибридных sp-орбиталей. В свинце эффект инертной пары увеличивает расстояние между его s- и p-орбиталями, и разрыв не может быть преодолен за счет энергии, которая будет высвобождена дополнительными связями после гибридизации. Вместо кубической структуры алмаза свинец образует металлические связи, в которых только p-электроны делокализованы и разделяются между ионами Pb. Свинец, следовательно, имеет гранецентрированную кубическую структуру, как и двухвалентные металлы аналогичного размера металлы кальций и стронций.
Основная часть
Чистый Свинец имеет яркий серебристый вид с оттенком синего. При контакте с влажным воздухом он тускнеет и приобретает тусклый вид, оттенок которого зависит от преобладающих условий. Характерные свойства свинца включают высокую плотность, пластичность, пластичность и высокую устойчивость к коррозии из-за пассивации.

Плотноупакованная гранецентрированная кубическая структура свинца и высокий атомный вес приводят к плотности 11,34 г / см, что выше, чем у обычных металлов, таких как железо (7,87 г / см), медь (8,93 г / см) и цинк (7,14 г / см). Эта плотность является источником идиомы летать, как свинцовый шар. Некоторые более редкие металлы имеют более высокую плотность: вольфрам и золото имеют плотность 19,3 г / см, а осмий — самый плотный из известных металлов — имеет плотность 22,59 г / см. см, что почти вдвое больше, чем у свинца.
Свинец — очень мягкий металл с твердостью по Моосу 1,5; его можно поцарапать ногтем. Он довольно податлив и несколько пластичен. Модуль объемной упругости свинца — показатель легкости его сжимаемости — составляет 45,8 ГПа. Для сравнения, у алюминия 75,2 ГПа; медь 137,8 ГПа; и низкоуглеродистая сталь 160–169 ГПа. У свинца предел прочности на разрыв при 12–17 МПа низкий (у алюминия в 6 раз выше, у меди в 10 раз и у низкоуглеродистой стали в 15 раз); он может быть усилен добавлением небольшого количества меди или сурьмы.
. Температура плавления свинца при 327,5 ° C (621,5 ° F) очень низкая по сравнению с большинством металлов. Его температура кипения 1749 ° C (3180 ° F) является самой низкой среди элементов углеродной группы. удельное электрическое сопротивление свинца при 20 ° C составляет 192 наноом — метров, что почти на порядок выше, чем у других промышленных металлы (медь — 15,43 нОм · м; золото — 20,51 нОм · м; алюминий — 24,15 нОм · м). Свинец является сверхпроводником при температурах ниже 7,19 К ; это самая высокая критическая температура из всех сверхпроводников типа I и третья по величине из элементных сверхпроводников.
Содержание изотопов сильно различается в зависимости от образца |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес Ar, стандартный (Pb) |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Изотопы
Природный свинец состоит из четырех стабильных изотопов с массовыми числами 204, 206, 207 и 208, а также т расы пяти короткоживущих радиоизотопов. Большое количество изотопов согласуется с четным атомным номером свинца. Свинец имеет магическое число протонов (82), для которого модель ядерной оболочки точно предсказывает особенно стабильное ядро. Свинец-208 имеет 126 нейтронов, еще одно магическое число, которое может объяснить, почему свинец-208 необычайно стабилен.
Свинец с его высоким атомным номером является самым тяжелым элементом, природные изотопы которого считаются стабильными; Свинец-208 — самое тяжелое стабильное ядро. (Ранее это различие относилось к висмуту с атомным номером 83, пока в 2003 году не было обнаружено, что его единственный первичный изотоп, висмут-209, распадается очень медленно.) Четыре стабильных изотопы свинца теоретически могут подвергаться альфа-распаду до изотопов ртути с выделением энергии, но ни для одного из них этого не наблюдалось; их прогнозируемый период полураспада составляет от 10 до 10 лет (по крайней мере, в 10 раз больше нынешнего возраста Вселенной).
Три стабильных изотопа находятся в трех из четырех основных цепочек распада : свинец-206, свинец-207 и свинец-208 являются конечными продуктами распада урана-238, уран-235 и торий-232 соответственно. Эти цепочки распада называются урановой цепью, актиниевой цепью и ториевой цепью. Их изотопные концентрации в образце естественной породы сильно зависят от присутствия этих трех исходных изотопов урана и тория. Например, относительное содержание свинца-208 может колебаться от 52% в нормальных образцах до 90% в ториевых рудах; по этой причине стандартный атомный вес свинца дается только с точностью до одного десятичного знака. Со временем отношение свинца-206 и свинца-207 к свинцу-204 увеличивается, так как первые два дополняются радиоактивным распадом более тяжелых элементов, а второй — нет; это позволяет проводить датирование свинцом. По мере распада урана на свинец их относительные количества меняются; это основа для уран-свинцового датирования. Свинец-207 проявляет ядерный магнитный резонанс, свойство, которое использовалось для изучения его соединений в растворе и твердом состоянии, в том числе в человеческом теле.

Отдельно. из стабильных изотопов, которые составляют почти весь свинец, существующий в природе, есть следовые количества нескольких радиоактивных изотопов. Один из них — свинец-210; Хотя его период полураспада составляет всего 22,3 года, небольшие количества встречаются в природе, потому что свинец-210 образуется в результате длительного цикла распада, который начинается с урана-238 (который присутствует на Земле в течение миллиардов лет). Свинец-211, -212 и -214 присутствуют в цепочках распада урана-235, тория-232 и урана-238, соответственно, поэтому следы всех трех изотопов свинца обнаруживаются естественным образом. Незначительные следы свинца-209 возникают в результате очень редкого кластерного распада радия-223, одного из дочерних продуктов природного урана-235, и цепочки распада нептуния-237, следы которых образуются при захвате нейтронов в урановых рудах. Свинец-210 особенно полезен для определения возраста образцов путем измерения его отношения к свинцу-206 (оба изотопа присутствуют в одной цепочке распада).
Всего было синтезировано 43 изотопа свинца, с массовыми числами 178–220. Свинец-205 является наиболее стабильным радиоизотопом с периодом полураспада около 1,73 × 10 лет. Вторым по стабильности является свинец-202, период полураспада которого составляет около 52 500 лет, что больше, чем у любого из естественных радиоизотопов в следовых количествах.
Химия

Свинец в массе, подвергающийся воздействию влажного воздуха, образует защитный слой различного состава. Карбонат свинца (II) является обычным компонентом; сульфат или хлорид также может присутствовать в городских или морских условиях. Этот слой делает свинец в массе химически инертным на воздухе. Свинец в тонком порошке, как и многие металлы, пирофорен и горит голубовато-белым пламенем.
Фтор реагирует со свинцом при комнатной температуре с образованием фторида свинца (II). Реакция с хлором аналогична, но требует нагревания, поскольку образующийся хлоридный слой снижает реакционную способность элементов. Расплавленный свинец реагирует с халькогенами с образованием халькогенидов свинца (II).
Металлический свинец устойчив к серной и фосфорной кислоте, но не соляная или азотная кислота ; результат зависит от нерастворимости и последующей пассивации соли продукта. Органические кислоты, такие как уксусная кислота, растворяют свинец в присутствии кислорода. Концентрированные щелочи растворяют свинец и образуют плюмбиты.
Неорганические соединения
Свинец демонстрирует два основных состоянияокисления: +4 и +2. Четырехвалентное состояние является общим для углеродной группы. Двухвалентное состояние редко встречается для углерода и кремния, незначительно для германия, важно (но не преобладает) для олова и является более важным из двух состояний окисления для свинца. Это связано с релятивистскими эффектами, в частности с эффектом инертной пары, который проявляется, когда существует большая разница в электроотрицательности между свинцом и оксидом, галогенид или нитрид анионы, приводящие к значительному частичному положительному заряду на свинце. Результатом является более сильное сокращение орбитали свинца 6s, чем в случае орбитали 6p, что делает его довольно инертным по отношению к ионным соединениям. Эффект инертной пары, используемые в соединении, которые соединяются друг с другом, образует ковалентные связи с элементами аналогичной электроотрицательности, такие как электрические соединения свинца. В них орбитали 6s и 6p остаются одинакового размера, и sp-гибридизация по-прежнему является энергетически выгодной. Свинец, как и пластик, в таких соединениях, как четырехвалентный.
Существует относительно большая разница в электроотрицательности свинца (II) при 1,87 и свинца (IV) при 2,33. Это различие знаменует собой изменение тенденции к увеличению степени окисления +4 по углеродной группе; олово, для сравнения, имеет значения 1,80 в степени окисления +2 и 1,96 в состоянии +4.

Свинец (II)
Соединения свинца (II) — характеристика неорганической химии свинца. Даже сильные окислители, такие как фтор и хлор, реагируют со свинцом с образованием только PbF 2 и PbCl 2. Ионы свинца (II) обычно бесцветны в растворе и частично гидролизуются с образованием Pb (OH) и, наконец, [Pb 4 (OH) ] (в котором гидроксил Ионы как мостиковые лиганды ), но не являются восстановителями, как ионы олова (II). Методы для определения присутствия иона Pb в воде обычно основываются на осаждении хлорида свинца (II) с использованием разбавленной соляной кислоты. Смазочно-охлаждающая жидкость в воде, растворенная в воде, растворенная в воде, растворенная в воде, растворенная в воде.
Моноксид свинца существует в двух полиморфы, бледность α-PbO (красный) и massicot β-PbO (желтый), причем последний стабилен только выше примерно 488 ° C. Глет — наиболее часто используемое неорганическое соединение свинца. Нет гидроксида свинца (II); повышение pH растворов солей свинца (II) приводит к гидролизу и конденсации. Свинец обычно реагирует с более тяжелыми халькогенами. Сульфид свинца представляет собой полупроводник, фотопроводник и чрезвычайно чувствительный детектор инфракрасного излучения. Два других халькогенида, селенид свинца и теллурид свинца, также являются светопроводящими. Они необычны тем, что их цвет становится светлее при движении вниз по группе.

Дигалогениды свинца хорошо изучены; это включает диастатид и смешанные галогениды, такие как PbFCl. Относительная нерастворимость составляет полезную основу для гравиметрического определения фтора. Дифторид был первым твердым ионопроводящим соединением, которое было обнаружено (в 1834 году Майклом Фарадеем ). Другие дигалогениды разлагаются под воздействием ультрафиолета или видимого света, особенно дииодид. Известны многие псевдогалогениды свинца (II), такие как и тиоцианат. Свинец (II) образует большое количество галогенидных координационных комплексов, таких как [PbCl 4 ], [PbCl 6 ] и [Pb 2Cl9]nцепной анион.
Сульфат свинца (II) нерастворим в воде, как и сульфаты других тяжелых двухвалентных катионов . Нитрат свинца (II) и ацетат свинца (II) хорошо растворимы, и это используется в синтезе других соединений свинца.
Свинец (IV)
Немного неорганические соединения свинца (IV) известны. Они образуются только в окисляющих растворах и обычно не используются в стандартных условиях. Оксид свинца (II) при дальнейшем окислении дает смешанный оксид Pb 3O4. Он описывается как оксид свинца (II, IV) или структурно 2PbO · PbO 2 и наиболее известным соединением свинца со смешанной валентностью. Диоксид свинца является сильным окислителем, способным окислять соляную кислоту до газообразного хлора. Это связано с тем, что ожидаемый PbCl 4, который мог бы образоваться, нестабилен и спонтанно разлагается на PbCl 2 и Cl 2. Аналогично оксиду свинца диоксид свинца способен образовывать анионы свинца. Дисульфид свинца и диселенид свинца стабильны только при высоких давлениях. Тетрафторид свинца, желтый кристаллический порошок, является стабильным, но менее стабильным, чем дифторид. Тетрахлорид свинца (желтое масло) разлагается при комнатной температуре, тетрабромид свинца еще менее стабилен, и существование тетраиодида свинца вызывает сомнения.

Другие степени окисления
Некоторые соединения свинца существуют в формальных степенях окисления кроме +4 или +2. Свинец (III) может быть получен в качестве промежуточного звена между свинцом (II) и свинцом (IV) в более крупных целях комплексах свинца; эта степень окисления нестабильна, поскольку и ион свинца (III), и более крупные комплексы, являются его, являются радикалами. То же самое относится к свинцу (I), который может быть обнаружен в таких радикалах.
Известно множество смешанных оксидов свинца (II, IV). Когда PbO 2 нагревается на воздухе, он становится Pb 12O19при 293 ° C, Pb 12O17при 351 ° C, Pb 3O4при 374 ° C и, наконец, PbO при 605 ° C… Другой полуторный оксид, Pb 2O3, может быть получен при высоком давлении вместе с использованием нестехиометрическими фазами. Многие из них демонстрируют дефектные структуры флюорита, в которых некоторые атомы кислорода заменены вакансиями: можно считать, что PbO имеет такую структуру, в которой отсутствуют все чередующиеся слои элементов кислорода.
Отрицательное окисление состояний может встречаться как фаза Zintl, как свободные анионы свинца, как в Ba 2 Pb, причем свинец формально является свинцом (-IV), или в чувствительных к кислороду кольцевых или многогранные кластерные ионы, такие как тригонально-бипирамидальный ион Pb5, где два атома свинца являются свинцом (-I), а три — свинцом (0). В таких анионах каждый атом находится в полиэдрической вершине и вносит два электрона в каждую ковалентную связь вдоль их sp-гибридных орбиталей, причем два других атома являются внешней неподеленной парой. Их можно получить в жидком аммиаке путем восстановления свинца натрием.

Органолид
Свинец может образовывать многосвязные цепи, свойство, которое он разделяет с его более легкими гомологами в углеродной группе. Его способность делать это намного меньше, потому что энергия связи Pb — Pb более чем в три с половиной раза ниже, чем у связи C — C. Сам по себе свинец может образовывать связи металл-металл порядка трех. С помощью обычных органических соединений, которые образуют обычные органические соединения (из-за того, что Pb-C довольно слабая), образует соединение между ними. Это делает металлоорганическую химию свинца гораздо менее обширной, чем химию олова. Свинец преимущественно образует свинецорганические (IV) соединения, даже если исходить из неорганических реагентов свинца (II); известно очень мало свинецорганических (II) соединений. Наиболее хорошо охарактеризованными исключениями являются Pb [CH (SiMe 3)2]2и Pb (η-C 5H5)2.
). Ведущий аналог простейшего органического соединения, метан, составляет плюмбан. Плюмбан может быть получен в результате реакции металлическим свинцом и атомарным водородом. Два простых производных, тетраметилсвинец и тетраэтилсвинец, являются лучшими известными Эти соединения относительно стабильны: тетраэтилсвинец начинает разлагаться только при нагревании или воздействии солнечного света или ультрафиолетового света. Металлоорганических соединений, таких как тетраэтилсвинец. Окислительная природа многих соединений свинца успешно используется: тетраацетат свинца является важным лабораторным реагентом для окисления в организме. ический синтезе. Тетраэтилсвинец, однажды добавленный в бензин, производился в больших количествах, чем любое другое металлоорганическое соединение. фунты менее химически стабильны. Для многих соединений не существует аналога свинца.
Происхождение и распространение
| Атомное. число | Элемент | Относительное. количество |
|---|---|---|
| 42 | Молибден | 0,798 |
| 46 | Палладий | 0,440 |
| 50 | Олово | 1,146 |
| 78 | Платина | 0,417 |
| 80 | Ртуть | 0,127 |
| 82 | Свинец | 1 |
| 90 | Торий | 0,011 |
| 92 | Уран | 0,003 |
В космосе
Содержание свинца на частицу в Солнечной системе составляет 0,121 частей на миллиард (частей на миллиард). Этот показатель в два с половиной раза выше, чем у платины, в восемь раз больше, чем у ртути, и в семнадцать раз больше, чем у золота. Количество свинца во вселенной медленно увеличивается, поскольку все из нестабильны атомы постепенно распадаются на свинец. Содержание свинца в Солнечной системе с момента ее образования 4,5 миллиарда лет назад увеличилось примерно на 0,75%. Таблица содержания в солнечной системе показывает, что свинец, несмотря на распространение других элементов с атомным номером больше 40.
Первородный свинец, включающий изотопы свинец-204, свинец-206, свинец-207 и свинец-208 — в основном образовался в результате повторяющихся процессов захвата нейтронов, происходящих в звездах. Двумя режимами захвата являются s- и r-процессы.
В s-процессе (s означает «медленный») захваты разделяются годами или десятилетиями, что позволяет меньше стабильные ядра претерпевают бета -распад. Стабильное ядро таллия-203 может захватить нейтрон и стать таллием-204; он подвергается бета-распаду с образованием стабильного свинца-204; при захвате другого нейтрона он становится свинцом-205, период полураспада которого составляет около 15 миллионов лет. Дальнейшие захваты приводят к свинцу-206, свинцу-207 и свинцу-208. При захвате другого нейтрона свинец-208 становится свинцом-209, который быстро распадается на висмут-209. При захвате другого нейтрона висмут-209 становится висмутом-210, и этот бета-распадом превращается в полоний-210, который альфа-распадом до свинца-206. Таким образом, цикл заканчивается на свинце-206, свинце-207, свинце-208 и висмуте-209.

В r-процессе (r означает «быстрый») захваты проходят быстрее, чем ядра могут распадаться. Это происходит в средах с высокой плотностью нейтронов, таких как сверхновая или с влиянием двух нейтронных звезд. Поток нейтронов может создать порядок 10 нейтронов на квадратный сантиметр в секунду. R-процесс не формирует столько свинца, как s-процесс. Он имеет тенденцию останавливаться, когда богатые нейтронами ядра достигают 126 нейтронов. В этот момент нейтроны располагаются в полных оболочках в атомном ядре, и энергетическая становится труднее link их большее количество. Когда поток нейтронов спадает, эти ядра бета-распада распадаются на стабильные изотопы осмия, иридия и платины.
На Земле
Свинец классифицируется как халькофил по классификации Гольдшмидта, что означает, что он обычно встречается в сочетании с серой. Он редко встречается в своей естественной металлической форме. Многие свинцовые минералы относительно легкие и на протяжении истории Земли оставались в коре вместо того, чтобы погрузиться глубже в недра Земли. Этим объясняется относительно высокое содержание свинца в земной коре — 14 частей на миллион; это 38-й по содержанию элемент в земной коре.
Основным свинцовым минералом является галенит (PbS), который в основном встречается в цинковых рудах. Большинство других свинцовых минералов так или иначе связаны с галенитом; буланжерит, Pb 5Sb4S11, представляет собой смешанный сульфид, полученный из галенита; англезит, PbSO 4, является продуктом окисления галенита; и церуссит или белая свинцовая руда, PbCO 3, является продуктом разложения галенита. Мышьяк, олово, сурьма, серебро, золото, медь и висмут являются обычными примесями в минералах свинца.

Мировые ресурсы свинца превышают два миллиарда тонн. Значительные месторождения находятся в Австралии, Китае, Ирландии, Мексике, Перу, Португалии, России и США. Мировые запасы — ресурсы, которые экономически целесообразно добыть — в 2016 году составили 88 миллионов тонн, из которых Австралия — 35 миллионов, Китай — 17 миллионов, Россия — 6,4 миллиона.
Типичные фоновые концентрации свинца не превышают 0,1 мкг / м в атмосфере; 100 мг / кг в почве; и 5 мкг / л в пресной и морской воде.
Этимология
Современное английское слово «свинец» имеет германское происхождение; оно происходит от среднеанглийского leed и староанглийского lēad (с macron над «е», означающим, что гласный звук этой буквы длинный). Древнеанглийское слово происходит от гипотетического реконструированного протогерманского * lauda- («свинец»). Согласно лингвистической теории, от этого слова произошли потомки во многих германских языках с точно таким же значением.
Нет единого мнения о происхождении протогерманского * lauda-. Одна из гипотез предполагает, что оно происходит от протоиндоевропейского * lAudh- («свинец»; заглавная буква гласной эквивалентна макрону). Другая гипотеза предполагает, что оно заимствовано из прото-кельтского * ɸloud-io- («свинец»). Это слово связано с латинским plumbum, которое дало элементу его химический символ Pb. Слово * ɸloud-io- считается источником протогерманского * bliwa- (что также означает «свинец»), от которого произошло немецкое слово Blei.
Название химического элемента не связаны с глаголом того же написания, который происходит от протогерманского * layijan- («вести»).
История
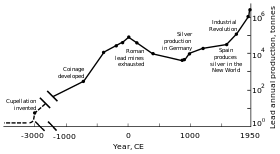
Предыстория и ранняя история
Металлические свинцовые бусины , датируемые 7000–6500 гг. До н.э., были найдены в Малой Азии и могут представлять собой первые пример выплавки металла . В то время свинец практически не применялся из-за его мягкости и тусклого вида. Основной причиной распространения производства свинца была его связь с серебром, которое можно получить путем сжигания галенита (распространенного минерала свинца). Древние египтяне были первыми, кто использовал минералы свинца в косметике, и это применение распространилось на Древнюю Грецию и далее; египтяне могли использовать свинец для грузил в рыболовных сетях, глазури, очков, эмали и для украшений. Различные цивилизации Плодородного полумесяца использовали свинец в качестве письменного материала, валюты и строительного материала. Свинец использовался в древнекитайском королевском дворе как стимулятор, как валюта и противозачаточное средство ; цивилизация долины Инда и мезоамериканцы использовали его для изготовления амулетов; а народы Восточной и Южной Африки использовали свинец в волочении проволоки.
Классическая эпоха
Поскольку серебро широко использовалось в качестве декоративного материала и средства обмена, месторождения свинца начали разрабатываться в Малой Азии из 3000 г. до н. Э.; позже месторождения свинца были разработаны в Эгейском и Лаурионе. Эти три региона коллективно доминировали в добыче свинца до c. 1200 г. до н.э. Начиная примерно с 2000 г. до н.э., финикийцы разрабатывали месторождения на Пиренейском полуострове ; к 1600 г. до н.э. добыча свинца существовала на Кипре, Греция и Сардинии.

Территориальная экспансия Рима в Европе и Средиземноморье, а также развитие горнодобывающей промышленности, приводящей к использованию новейших технологий свинца в классическую эпоху, с расчетным годовым объемом производства 80 000. Римляне их свинец в основном как побочный продукт при выплавке. Добыча свинца происходила в Центральной Европе, Британии, Балканах., Греция, Анатолия и Испания, на долю последней 40% мирового производства.
Обычно использовались свинцовые таблетки в качестве материала для букв., Отлитые в плоские песчаные формы, со сменными мотивами, использовались вере умершего, использовались в древней Иудее. Свинец использовался для изготовления пращовых пуль с 5 века до нашей эры. Во времена Римской империи широко применялись свинцовые пули, которые были эффективны на расстоянии от 100 до 150 метров. Балеарские пращники, использовавшиеся в качестве наемников в карфагенской и римской армиях, были известны своей дальностью стрельбы и точностью.
Свинец использовался для изготовления водопроводных труб в Римской империи ; латинское слово, обозначающее металл, свинец, является английским словом «сантехника ». Простота работы и устойчивость к коррозии обеспечили его широкое применение в других областях, включаятутику, кровлю, валюту и войну. Писатели того времени, такие как Катон Старший, Колумелла и Плиний Старший, рекомендовали свинцовые (или покрытые свинцом) сосуды для приготовления подсластители и консерванты добавлены в вино и пищу. Свинец придавал приятный вкус из-за образования «сахара свинца» (ацетата свинца (II)), тогда как сосуды из меди или бронзы могли придавать горький вкус из-за образования зелени.
Этот металл был наиболее часто используемым материалом в классической античности, и его уместно отнести к (римскому) свинцовому веку. Свинец был для римлян тем же, чем пластик для нас.
Хайнц Эшнауэр и Маркус Штопплер. «Вино — энологический банк образцов», 1992
Римский автор Витрувий сообщил об опасности для здоровья ведущие и современные авторы предположили, что отравление свинцом сыграло важную роль в упадке Римской империи. Другие исследователи раскритиковали такие утверждения, отметив, например, что не все боли в животе вызваны отравлением свинцом. Согласно археологическим исследованиям, римские свинцовые трубы повышали уровень свинца в водопроводной воде, но такой эффект «вряд ли был действительно вредным». Когда отравление свинцом действительно происходило, жертв называли «сатурнианскими», темными и циничными, в честь омерзительного отца богов Сатурн. По ассоциации свинец считался отцом всех металлов. Его статус в римском обществе был низким, поскольку он был легко доступен и дешев.

Путаница с оловом и сурьмой
В классическую эпоху (и даже до 17 века) олово часто не отличался от свинца: римляне называли свинец plumbum nigrum («черный свинец») и tin plumbum Candidum («светлый свинец»). Связь свинца и олова прослеживается и в других языках: слово олово в чешском переводится как «свинец», а в русском его родственное слово олово ( олово) означает «жесть». Кроме того, свинец имел тесную связь с сурьмой: оба элемента обычно встречаются в виде сульфидов (галенит и антимонит ), часто вместе. Плиний неправильно писал, что при нагревании стибнит дает свинец, а не сурьму. В таких странах, как Турция и Индия, первоначально персидское название сурма стало обозначать либо сульфид сурьмы, либо сульфид свинца, а в некоторых языках, таких как русский, дало свое название сурьма (сурьма).
Средневековье. и эпоха Возрождения
Добыча свинца в Западной Европе снизилась после падения Западной Римской империи, при этом Аравийская Иберия была единственным регионом, имеющим значительную добычу. Наибольшее производство свинца происходило в Южной и Восточной Азии, особенно в Китае и Индии, где добыча свинца быстро росла.

В Европе производство свинца начало расти в XI и XII веках, когда он снова стал использоваться для кровли и трубопроводов. Начиная с 13 века свинец использовали для создания витражей. В европейских и арабских традициях алхимии свинец (символ в европейской традиции) считался нечистым основным металлом которое путем разделения, очищения и уравновешивания составляющих его сущностей могло быть преобразовано в чистое и нетленное золото. В тот период свинец все чаще использовался для фальсификации вина. Использование такого вина было запрещено для использования в христианских обрядах папской буллой в 1498 году, но его продолжали пить и приводили к массовым отравлениям вплоть до конца 18 века. Свинец был ключевым материалом в деталях печатного станка , изобретенного около 1440 года; Печатные работники обычно вдыхали свинцовую пыль, вызывая отравление свинцом. Примерно в то же время было изобретено огнестрельное оружие, и свинец, несмотря на то, что он был дороже железа, стал основным материалом для изготовления пуль. Он был менее разрушительным для железных стволов, имел более высокую плотность (что позволяло лучше сохранять скорость), а его более низкая температура плавления облегчала производство пуль, поскольку их можно было изготовить с помощью дровяного огня. Свинец в виде венецианской церузы широко использовался в косметике западноевропейской аристократией, поскольку побеленные лица считались признаком скромности. Позже эта практика распространилась на белые парики и подводку для глаз и исчезла только с Французской революцией в конце 18 века. Подобная мода появилась в Японии в 18 веке с появлением гейш, практика, которая продолжалась и в 20 веке. Белые лица женщин «стали олицетворением их женских достоинств японских женщин», при этом свинец обычно используется в отбеливателе.
За пределами Европы и Азии
В Новом Свете Производство свинца было зафиксировано вскоре после прибытия европейских поселенцев. Самые ранние записи относятся к 1621 году в английской колонии Вирджиния, через четырнадцать лет после ее основания. В Австралии первый рудник, открытый колонистами на континенте, был свинцовым рудником в 1841 году. В Африке добыча и выплавка свинца были известны в Желобе Бенуэ и нижнем бассейне Конго, где свинец использовался для торговли с европейцами и в качестве валюты к 17 веку, задолго до схватки за Африку.

Промышленная революция
Во второй половине 18 века Великобритания, а затем континентальная Европа и США пережили промышленную революцию. Это был первый раз, когда объемы производства свинца превысили показатели Рима. Великобритания была ведущим производителем, потеряв этот статус к середине 19 века с истощением своих рудников и развитием добычи свинца в Германии, Испании и США. К 1900 году Соединенные Штаты были лидером по производству свинца в мире, а другие неевропейские страны — Канада, Мексика и Австралия — начали значительное производство; производство за пределами Европы превышало внутренний. Большая часть спроса на свинец приходилась на сантехнику и покраску — свинцовые краски использовались регулярно. В это время больше людей (из рабочего класса) подвергались воздействию металла, и случаи отравления свинцом участились. Это привело к исследованию эффектов потребления свинца. Доказано, что свинец более опасен в виде дыма, чем в виде твердого металла. Отравление свинцом и подагра были связаны; Британский врач Альфред Баринг Гаррод отметил, что треть его пациентов с подагрой были сантехниками и малярами. Последствия хронического употребления свинца, включая психические расстройства, также изучались в XIX веке. Первые законы, направленные на сокращение отравления свинцом на фабриках, были приняты в 1870-х и 1880-х годах в Соединенном Королевстве.

Современная эпоха
Еще одно свидетельство угрозы, исходящей от свинца для человека, было обнаружено в конце 19-го и начале 20-го веков. Механизмы вреда были лучше поняты, свинцовая слепота была задокументирована, и этот элемент был постепенно выведен из общественного использования в Соединенных Штатах и Европе. Соединенное Королевство ввело обязательные производственные инспекции в 1878 году и назначило первого медицинского инспектора фабрик в 1898 году; в результате было сообщено о 25-кратном сокращении случаев отравления свинцом с 1900 по 1944 год. Большинство европейских стран запретили свинцовую краску, которая обычно использовалась из-за ее непрозрачности и водостойкости, для внутренних работ к 1930 году.
Последним серьезным воздействием свинца на человека было добавление тетраэтилсвинца к бензину в качестве антидетонационного агента, практика, которая зародилась в Соединенных Штатах в 1921 году. Она была прекращена в США и Европейском союзе к 2000 году.
В 1970-х годах в США и странах Запада Европейские страны приняли законодательство по снижению загрязнения воздуха свинцом. Воздействие было значительным: хотя исследование, проведенное Центрами по контролю и профилактике заболеваний в США в 1976–1980 годах, показало, что 77,8% населения имели повышенный уровень свинца в крови, в 1991–1994 гг. исследование того же института показало, что доля людей с таким высоким уровнем снизилась до 2,2%. Основным продуктом, изготовленным из свинца к концу 20 века, была свинцово-кислотная батарея.
. С 1960 по 1990 год производство свинца в Западном блоке выросло примерно на 31%. Доля Восточного блока в мировом производстве свинца увеличилась с 10% до 30% с 1950 по 1990 год, при этом Советский Союз был крупнейшим производителем в мире в середине 1970-х годов. и 1980-е годы, и Китай начал крупное производство свинца в конце 20-го века. В отличие от европейских коммунистических стран, Китай к середине 20-го века практически не был индустриализирован; в 2004 году Китай обогнал Австралию как крупнейший производитель свинца. Как и во время европейской индустриализации, свинец оказывает негативное влияние на здоровье в Китае.
Производство
Первичное производство свинца с 1840 года
По состоянию на 2014 год производство свинца во всем мире увеличивается за счет его использование в свинцово-кислотных аккумуляторах. Существует две основные категории продукции: первичная из добытых руд и вторичная из лома. В 2014 году 4,58 миллиона метрических тонн были получены от первичного производства и 5,64 миллиона тонн от вторичного производства. В тройку лидеров по производству добытого свинцового концентрата в этом году входили Китай, Австралия и США. В тройку лидеров по производству рафинированного свинца вошли Китай, США и Индия. Согласно отчету «Запасы металлов в обществе» за 2010 год Международной группы ресурсов, общее количество свинца, которое используется, складывается, выбрасывается или рассеивается в окружающей среде в глобальном масштабе., составляет 8 кг на душу населения. Большая часть этого приходится на более развитые страны (20–150 кг на душу населения), а не в менее развитых странах (1–4 кг на душу населения).
Процессы производства первичного и вторичного свинца схожи. Некоторые предприятия первичного производства в настоящее время дополняют свою деятельность ломом свинца, и эта тенденция, вероятно, усилится в будущем. При использовании соответствующих технологий свинец, полученный во вторичных процессах, неотличим от свинца, полученного в первичных процессах. Свинцовый лом из строительной отрасли обычно довольно чистый и переплавляется без переплавки, хотя иногда требуется рафинирование. Таким образом, производство вторичного свинца обходится дешевле с точки зрения потребности в энергии, чем производство первичного, часто на 50% и более.
Первичный
Большинство свинцовых руд содержат низкий процент свинца (богатые руды обычно имеют содержание 3–8%), которые необходимо сконцентрировать для экстракции. Во время начальной обработки руды обычно подвергаются дроблению, измельчению, пенной флотации и сушке. Полученный концентрат, который имеет содержание свинца 30–80% по массе (обычно 50–60%), затем превращается в (нечистый) металлический свинец.
Это можно сделать двумя основными способами: двухстадийный процесс, включающий обжиг с последующей экстракцией в доменной печи, проводимый в отдельных сосудах; или прямой процесс, при котором экстракция концентрата происходит в одном сосуде. Последний стал наиболее распространенным маршрутом, хотя первый по-прежнему имеет большое значение.
| Страна | Добыча. (тыс.. тонн) |
|---|---|
| 2400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| Другие страны | 170 |
Двухстадийный процесс
Сначала сульфидный концентрат обжигают на воздухе для окисления сульфида свинца:
- 2 PbS (s) + 3 O 2 (г) → 2 PbO (s) + 2 SO 2 (г) ↑
Поскольку исходный концентрат не был чистым сульфидом свинца, обжиг дает не только желаемый оксид свинца (II), но смесь оксиды, сульфаты и силикаты свинца и других металлов, содержащихся в руде. Этот нечистый оксид свинца восстанавливается в доменной печи с коксом до (опять же нечистого) металла:
- 2 PbO (s) + C (s) → 2 Pb (s) + CO 2 (g) ↑
Примеси — это в основном мышьяк, сурьма, висмут, цинк, медь, серебро и золото. Обычно их удаляют в серии пирометаллургических процессов. Расплав обрабатывают в отражательной печи воздухом, паром и серой, которая окисляет примеси, за исключением серебра, золота и висмута. Окисленные загрязнения всплывают в верхнюю часть расплава и снимаются. Металлическое серебро и золото удаляются и экономично извлекаются с помощью процесса Паркса, в котором цинк добавляется к свинцу. Цинк, который не смешивается со свинцом, растворяет серебро и золото. Раствор цинка можно отделить от свинца, а серебро и золото извлечь. Обесеребренный свинец освобождают от висмута с помощью процесса Беттертона – Кролла, обрабатывая его металлическим кальцием и магнием. Образовавшийся шлак висмута может быть удален.
В качестве альтернативы пирометаллургическим процессам очень чистый свинец может быть получен путем электролитической обработки расплавленного свинца с использованием процесса Беттса. Аноды из нечистого свинца и катоды из чистого свинца помещают в электролит из фторосиликата свинца (PbSiF 6). При приложении электрического потенциала загрязненный свинец на аноде растворяется и оседает на катоде, оставляя большинство примесей в растворе. Это дорогостоящий процесс, и поэтому он в основном предназначен для аффинажа слитков с высоким содержанием примесей.
Прямой процесс
В этом процессе получают свинцовые слитки и шлак непосредственно из свинцовых концентратов. Концентрат сульфида свинца плавится в печи и окисляется, образуя монооксид свинца. Углерод (в виде кокса или угольного газа ) добавляется к расплавленной загрузке вместе с флюсующими агентами. Таким образом, монооксид свинца восстанавливается до металлического свинца в среде шлака, богатого монооксидом свинца.
Если исходный материал богат свинцом, до 80% исходного свинца может быть получено в виде слитков; остальные 20% образуют шлак, богатый монооксидом свинца. В случае низкосортного сырья весь свинец может быть окислен до шлака с высоким содержанием свинца. Металлический свинец также получают из шлаков с высоким содержанием свинца (25–40%) путем сжигания или впрыска топлива под флюсом, восстановления с помощью электрической печи или их комбинации.
Альтернативы
Исследования по более чистому и менее энергоемкому процессу извлечения свинца продолжаются; Главный недостаток состоит в том, что либо слишком много свинца теряется в виде отходов, либо альтернативные методы приводят к высокому содержанию серы в образующемся металлическом свинце. Гидрометаллургическая экстракция, при которой аноды нечистого свинца погружаются в электролит, а чистый свинец осаждается на катоде, является методом, который может иметь потенциал, но в настоящее время неэкономично, за исключением случаев, когда электроэнергия очень дешевая.
Вторичное
Плавка, которая является важной частью первичного производства, часто пропускается во время вторичного производства. Это выполняется только тогда, когда металлический свинец подвергся значительному окислению. Процесс аналогичен процессу первичного производства в доменной печи или вращающейся печи, с существенной разницей в большей вариативности выхода: доменные печи производят твердый свинец (10% сурьма), а в отражательных и вращающихся печах — полумягкий свинец (3–4% сурьмы). процесс Isasmelt — это более новый метод плавки, который может выступать в качестве дополнения к первичному производству; Из аккумуляторной пасты из отработанных свинцово-кислотных аккумуляторов (содержащих сульфат свинца и оксиды свинца) сульфат удаляется обработкой щелочью, а затем обрабатывается в угольной печи в присутствии кислорода, что дает нечистый свинец, а сурьму — самая обычная примесь. Рафинирование вторичного свинца аналогично рафинированию первичного свинца; некоторые процессы рафинирования могут быть пропущены в зависимости от переработанного материала и его потенциального загрязнения.
Из источников свинца для переработки наиболее важными являются свинцово-кислотные батареи; Свинцовые трубы, листы и оболочки кабелей также имеют большое значение.
Области применения

Вопреки распространенному мнению, грифели карандашей в деревянных карандаши никогда не делались из свинца. Когда карандаш возник как инструмент для письма с графитовой оберткой, конкретный тип используемого графита назывался plumbago (буквально, акт для свинцового или свинцового макета).
Elemental форма
Металлический свинец имеет несколько полезных механических свойств, включая высокую плотность, низкую температуру плавления, пластичность и относительную инертность. Многие металлы превосходят свинец в некоторых из этих аспектов, но, как правило, они менее распространены и их труднее извлечь из материнских руд. Токсичность свинца привела к прекращению его использования в некоторых случаях.
Свинец использовался для пуль с момента их изобретения в средние века. Это недорого; его низкая точка плавления означает, что боеприпасы для стрелкового оружия и дробовики могут быть отлиты с минимальным техническим оборудованием; и он более плотный, чем другие обычные металлы, что позволяет лучше сохранять скорость. Он остается основным материалом для пуль, легированных другими металлами в качестве отвердителей. Высказывались опасения, что свинцовые пули, используемые для охоты, могут нанести вред окружающей среде.
Высокая плотность свинца и устойчивость к коррозии использовались в ряде связанных приложений. Используется как балласт в килях парусников; его плотность позволяет ему занимать небольшой объем и минимизировать водонепроницаемость, тем самым уравновешивая кренящее воздействие ветра на паруса. Он используется в дайвинге грузовых поясах для противодействия плавучести дайвера. В 1993 году основание Пизанской башни было укреплено 600 тоннами свинца. Из-за своей коррозионной стойкости свинец используется в качестве защитной оболочки для подводных кабелей.

Свинец находит множество применений в строительной индустрии; Свинцовые листы используются в качестве архитектурных металлов в кровельных материалах, облицовке, гидроизоляции, желобах и соединениях желобов, а также на парапетах крыш. Свинец до сих пор используется в статуях и скульптурах, в том числе для арматуры. В прошлом его часто использовали для балансировки колес автомобилей ; по экологическим причинам это использование постепенно прекращается в пользу других материалов.
Свинец добавляют в медные сплавы, такие как латунь и бронза, для улучшения обрабатываемости и за его смазочные качества. Практически нерастворимый в меди свинец образует твердые глобулы в дефектах по всему сплаву, таких как границы зерен . В низких концентрациях, а также действуют как смазка, глобулы препятствуют образованию стружки при обработке сплава, тем самым улучшая обрабатываемость. В подшипниках используются медные сплавы с повышенным содержанием свинца. Свинец обеспечивает смазку, а медь обеспечивает несущую поддержку.
Высокая плотность, атомный номер и формуемость свинца составляют основу использования свинца в качестве барьера,поглощающего звук, вибрацию и излучение. Свинец не имеет собственных резонансных частот; в результате листовой свинец используется в качестве звукоизоляционного слоя в стенах, полах и потолках звуковых студий. Трубы для органа часто изготавливаются из свинцового сплава, смешанного с различным контроля тон каждой трубы. Свинец является общепризнанным защищающим от излучения в ядерной науке и в рентгеновских помещениях из-за его плотности и высокой коэффициент затухания. Расплавленный свинец использовался в качестве теплоносителя для быстрых реакторов со свинцовым теплоносителем.
Наибольшее применение свинца в начале 21 века находилось в свинцово-кислотных батареях. Свинец в батареях не контактирует напрямую с людьми, поэтому опасения по поводу токсичности меньше. Люди, работающие на заводах по производству аккумуляторов, могут подвергаться воздействию свинцовой пыли и вдыхать ее.} Реакции в аккумуляторе между свинцом, диоксидом свинца и серной кислотой надежный источник напряжения. Суперконденсаторы со свинцово-кислотными батареями были установлены в приложениях киловаттного и мегаваттного масштаба в Австралии, Японии и США для регулирования частоты, сглаживания и переключения солнечной энергии, сглаживания ветра и других приложений. Эти батареи имеют более низкую плотность энергии и эффективность заряда-разряда, чем литий-ионные батареи, но они значительно дешевле.

Свинец используется в высоковольтных силовых кабелях в качестве материала для предотвращения попадания воды диффузия в изоляцию; это сокращается по мере отказа от использования свинца. Его использование в припое для электроники постепенно прекращается в некоторых странах, чтобы сократить количество опасных отходов. Свинец — один из трех металлов, тесте используется в Oddy для музейных материалов, помогающий обнаруживать органические кислоты, альдегиды и кислые газы.
Соединения
Помимо того, что они являются основным потребителем свинцового металла, свинцово-кислотные батареи также являются основным потребителем соединений свинца. Реакция накопления энергии, используемая в этих устройствах, включает сульфат свинца и диоксид свинца :
- Pb (s) + PbO. 2(s) + 2H. 2SO. 4(водный) → 2PbSO.. 4(s) + 2H. 2O (l)
Другие соединения соединений свинца очень специализированы и часто исчезают. Красители на основе свинца используются в керамической глазури и стекле, особенно для красных и желтых оттенков. Хотя использование свинцовых красок постепенно прекращается в Европе и Северной Америке, они по-прежнему используются в менее развитых странах, таких как Китай, Индия или Индонезия. Тетраацетат свинца и диоксид свинца используются в качестве окислителей в органической химии. Свинец часто используется в покрытии поливинилхлорида электрические шнуров. Его можно использовать для обработки фитилей свечей, чтобы обеспечить более длительный и равномерный горение. Из-за его токсичности европейские и североамериканские производители используют такие альтернативы, как цинк. Свинцовое стекло состоит из 12–28% оксида свинца, что изменяет его оптические характеристики и снижает пропускание ионизирующего излучения. радиация. Свинцовые полупроводники, такие как теллурид свинца и селенид свинца, используются в фотоэлектрических элементах и инфракрасных детекторах.
Биологические эффекты
| Опасности | |
|---|---|
| Пиктограммы GHS |    |
| Сигнальное слово GHS | Опасно |
| Краткая характеристика опасности GHS | H302, H332, H351, H360Df, H373, H410 |
| Меры предосторожности GHS | P201, P261, P273, P304, P340, P312, P308, P313, P391 |
| NFPA 704 (огненный алмаз) |  0 2 0 0 2 0 |
Свинец не имеет подтвержденной биологической роли, нет подтвержденного безопасного уровня воздействия. Канадско-американское исследование 2009 года «вредные последствия для психического здоровья» даже на уровнях, которые незначительными или не представляющими никакого риска. Его распространенность в организме человека — в среднем 120 мг для взрослого — среди тяжелых металлов, тем не менее, больше цинк (2500 мг) и железо (4000 мг). Соли свинца очень эффективно усваиваются организмом. Небольшое количество свинца (1%) хранится в костях; остальное выводится с мочой и калом в течение нескольких недель после воздействия. Только около трети свинца выводится из организма ребенка. Постоянное воздействие может привести к биоаккумуляции свинца.
Токсичность
Свинец — очень ядовитый металл (при вдыхании или проглатывании), поражающий почти все органы и системы в организме. тело человека. При концентрации в воздухе 100 мг / м3 он опасен для жизни и здоровья. Большая часть проглоченного свинца попадает в кровоток. Основная причина его токсичности — это его склонность мешать правильному функционированию ферментов. Это достигается путем связывания с сульфгидри группами, обнаруженными во многих ферментативных реакциях кофакторами во многих ферментативных реакциях. Среди важнейших металлов, которые взаимодействует свинец, — кальций, железо и цинк. Высокий уровень кальция и железа, как правило, обеспечивает некоторую защиту от отравления свинцом; низкие уровни повышенную восприимчивость.
Эффекты
Свинец может вызвать повреждения мозга и почек и, в конечном итоге, смерть. Имитируя кальций, свинец может преодолевать гематоэнцефалический барьер. Он разрушает миелин оболочки нейронов, уменьшает их количество, препятствует маршрутам нейротрансмиссии и снижает рост нейронов. В организме человека свинец ингибирует порфобилиногенсинтазу и феррохелатазу, предотвращает как образование порфобилиногена, так и включение железа в протопорфирин. IX, последняя стадия синтеза гема. Это вызывает неэффективный синтез гема и микроцитарную анемию.
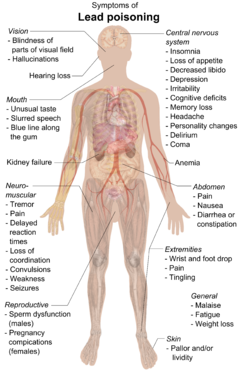
Симптомы отравления свинцом включают нефропатию, колические -подобные боли в животе и, возможно, слабость в организме. животе. пальцы, запястья или лодыжки. Небольшое повышение артериального давления, особенно у людей среднего и пожилого возраста, может вызвать анемию. Несколько исследований, в основном поперечных, показывают связь между повышенным воздействием свинца и снижением вариабельности сердечного ритма. У беременных женщин высокие уровни воздействия свинца вызвать выкидыш. Было показано, что хроническое воздействие высокого уровня снижает фертильность у мужчин.
В развивающемся мозге ребенка свинец препятствует образованию синапсов в коре головного мозга, нейрохимия развитие (в том числе нейротрансмиттеров) и организация ионных каналов. Воздействие в раннем детстве связано с повышенным риском нарушения сна и чрезмерной сонливости в более позднем детстве. Высокий уровень в крови с задержкой полового созревания у девочек. Повышение и снижение воздействия переносимого по сжиганию тетраэтилсвинца в бензине в течение 20-го века было связано с историческим ростом и снижением уровня преступности, гипотеза, которая не является общепринятой.
Источники воздействия
Воздействие свинца является глобальной проблемой, поскольку добыча и выплавка свинца, а также производство / утилизация / переработка аккумуляторов широко распространены во многих странах. Свинец попадает в организм при вдыхании, проглатывании или абсорбции через кожу. Почти весь вдыхаемый свинец всасывается в организм; при проглатывании показатель составляет 20–70%, при этом у детей процент выше, чем у взрослых.
Отравление обычно возникает в результате проглатывания пищи или воды, загрязненных свинцом, и реже после случайного проглатывания загрязненной почвы, пыли, или краски на основе свинца. Продукты с морской водой могут содержать свинец, если они попадают в близлежащие промышленные воды. Фрукты и овощи могут быть загрязнены высоким содержанием свинца в почве, в которой они были выращены. Почва может быть загрязнена из-за накопления твердых частиц свинца в трубах, свинцовой краски и остаточных выбросов этилированного бензина.
Использование этилированного бензина. свинец для водопроводных труб — проблема в районах с мягкой или кислой водой. Жесткая вода образует нерастворимые слои в трубах, тогда как мягкая и кислая вода растворяет свинцовые трубы. Растворенный диоксид углерода в переносимой воде может привести к образованию растворимого бикарбоната свинца ; кислородсодержащая вода может растворять свинец аналогично гидроксиду свинца (II). Питье такой воды может вызвать проблемы со здоровьем из-за токсичности растворенного свинца. Чем тверже вода, тем больше бикарбоната кальция и сульфата она будет содержать, и тем больше внутренняя поверхность труб будет покрыта защитным слоем карбоната свинца. или сульфат свинца.

Проглатывание нанесенной краски на основе свинца является основным источником воздействия на детей: прямой источник грызет старое окрашенное окно пороги. В качестве альтернативы, когда нанесенная сухая краска портится, она отслаивается, превращается в пыль и попадает в организм через контактные руки в рот или через загрязненную пищу, воду или спирт. Прием некоторых домашних средств может привести к контакту со свинцом или его соединениями.
Вдыхание является вторым основным воздействием. Сигаретный дым содержит, помимо других токсичных веществ, радиоактивный свинец-210.
Воздействие на кожу может быть значительным для людей, работающих с органическими соединениями свинца. Скорость всасывания неорганического свинца в кожу ниже.
Лечение
Лечение отравления свинцом обычно включает введение димеркапрола и сукцимера. В острых случаях может потребоваться использование динатрия эдетата кальция, хелата кальция и динатриевой соли этилендиаминтетрауксусной кислоты (EDTA ). Он имеет большее сродство к свинцу, чем кальций, в результате чего хелат свинца образуется в результате обмена и выводится с мочой, оставляя безвредный кальций.
Воздействие на окружающую среду

Добыча, производство, использование и удаление свинца и его продуктов вызвали значительное загрязнение почв и вод Земли. Выбросы свинца в атмосферу достигли своего пика во время промышленной революции и периода использования этилированного бензина во второй половине двадцатого века. Выбросы свинца происходят из природных источников (т. Е. Концентраций свинца природного происхождения), промышленного производства, сжигания и переработки, а также мобилизации ранее захороненного свинца. Повышенные концентрации свинца сохраняются в почвах и отложениях в постиндустриальных и городских районах; промышленные выбросы, в том числе связанные с сжиганием угля, продолжаются во многих частях мира, особенно в развивающихся странах.
Свинец может накапливаться в почвах, особенно в почвах с высоким содержанием органических веществ, где он остается от сотен до тысяч лет. Свинец в окружающей среде может конкурировать с другими металлами, обнаруженными на поверхности растений и на их поверхности, потенциально ингибируя фотосинтез, и в достаточно высоких концентрациях, отрицательно влияя на рост и выживание растений. Загрязнение почвы и растений может позволить свинцу подняться по пищевой цепи, поражая микроорганизмы и животных. У животных свинец проявляет токсичность для многих органов, повреждая нервную почечную, репродуктивную кроветворную и сердечно-сосудистую системы после приема внутрь, вдыхания или абсорбции через кожу. Рыба поглощает свинец как из воды, так и из донных отложений; биоаккумуляция в пищевой цепочке представляет опасность для рыб, птиц и морских млекопитающих.
Антропогенный свинец включает свинец от дробовиков и грузил. Они являются одними из самых мощных источников загрязнения свинцом наряду с объектами производства свинца. Свинец был запрещен для дроби и грузила в США в 2017 году, хотя этот запрет действовал только в течение месяца, и аналогичный запрет рассматривается в Европейском союзе.
Аналитические методы определения свинца в среда включает спектрофотометрию, рентгеновскую флуоресценцию, атомную спектроскопию и электрохимические методы. На основе ионофора S, S’-метиленбис (N, N-диизобутил дитиокарбамат ) был разработан специальный ион-селективный электрод. Важным биомаркером отравления свинцом является уровень δ-аминолевулиновой кислоты в плазме, сыворотке и моче.
Ограничение и исправление

К середине 1980-х годов использование свинца в промышленности значительно сократилось. В Соединенных Штатах экологические нормы уменьшили или отменили использование свинца в изделиях, не относящихся к аккумуляторным батареям, включая бензин, краски, припои и водные системы. На угольных электростанциях были установлены устройства для контроля твердых частиц для улавливания выбросов свинца. В 1992 году Конгресс США потребовал от Агентства по охране окружающей среды снизить уровень свинца в крови детей страны. Использование свинца было дополнительно ограничено Директивой Европейского Союза об ограничении использования опасных веществ 2003 года. Значительное сокращение отложения свинца произошло в Нидерландах после национального запрета на использование свинцовой дроби для охоты и спортивной стрельбы в 1993 году: с 230 тонн в 1990 году до 47,5 тонн в 1995 году.
В Соединенных Штатах допустимый предел воздействия для свинца на рабочем месте, включая металлический свинец, неорганические соединения свинца и свинцовые мыла были установлены на уровне 50 мкг / м в течение 8-часового рабочего дня, а предел уровня свинца в крови — 5 мкг на 100 г крови. в 2012 году. Свинец по-прежнему может содержаться в вредных количествах в керамограните, виниле (например, используемом для изготовления трубок и изоляции электрических шнуров) и китайской латуни. Старые дома все еще могут содержать свинцовую краску. Белая свинцовая краска была изъята из продажи в промышленно развитых странах, но остаётся специализированное использование других пигментов, таких как желтый хромат свинца. При снятии старой краски шлифованием образует пыль, которую можно вдыхать. Некоторые органы власти санкционировали программы по снижению выбросов свинца на территории, где проживают маленькие дети.
Свинцовые отходы, в зависимости от юрисдикции и окружающей среды, обрабатываются как бытовые отходы (для облегчения работы по борьбе с выбросами свинца) или опасные отходы, требующие стандартной обработки или хранения. Свинец попадает в дикую природу в местах отстрела, и для борьбы с загрязнением свинцом разработан ряд методов управления свинцом, такими как охрана окружающей среды и снижение качества общества. Миграция свинца может увеличиваться в кислых почвах; Чтобы противостоять воздействию почвы, рекомендуется использовать почву для заражения почвы.
Провести исследования о том, как свинец из биосистем с помощью биологических средств исследуются рыбьи кости на предмет их содержания. способность биоремедиата свинца в загрязненной почве. Грибок Aspergillus versicolor эффективно поглощает ионы свинца из промышленных отходов перед попаданием в водоемы. Некоторые бактерии были исследованы на предмет их способности удалять свинец из окружающей среды, включая сульфатредуцирующие бактерии Desulfovibrio и Desulfotomaculum, оба из которых очень эффективны в водные среды.
См. также
- Томас Миджли-младший — обнаружил, что добавление тетраэтилсвинца к бензину предотвращает «детонацию» в двигатели внутреннего сгорания
Примечания
Ссылки
Библиография
Эта статья была отправлена в WikiJournal of Science для внешней академической экспертной оценки в 2019 г. (рецензент сообщает ). Обновленный контент был повторно интегрирован на страницу Википедии под лицензией CC-BY-SA-3.0 (). Рецензированная версия записи: Болдырев Михаил Александрович; и другие. (2018), «Ведущий: свойства, история и приложения», WikiJournal of Science, 1 (2): 7, doi : 10.15347 / WJS / 2018.007, Викиданные Q56050531
Дополнительная литература
- Astrid, S.; Helmut, S.; Сигель, Р. К. О., ред. (2017). Свинец: его влияние на окружающую среду и здоровье. Ионы металлов в науках о жизни. 17 . Де Грюйтер. ISBN 978-3-11-044107-9.Содержание
- Casas, J.S.; Сордо, Дж., Ред. (2006). Химия свинца, аналитические аспекты. Воздействие на окружающую среду и здоровье. Эльзевир. ISBN 978-0-444-52945-9.
Внешние ссылки
| Найдите лид в Викисловарь, бесплатном режиме. |
| На Викискладе есть материалы, связанные с Свинец. |
- Свинец в Британской энциклопедии
- Токсикология тяжелых металлов: вывод свинца, Американское общество клинической патологии





















