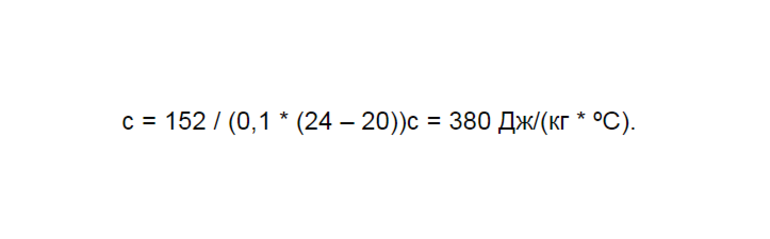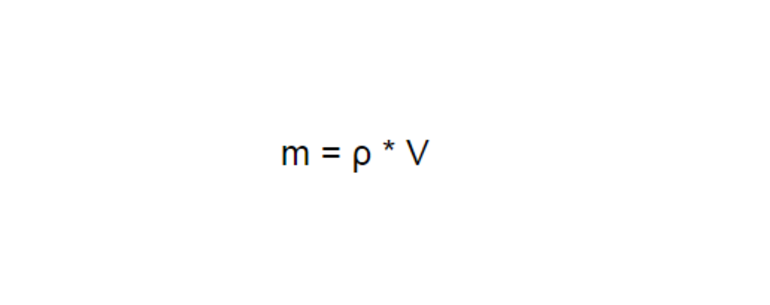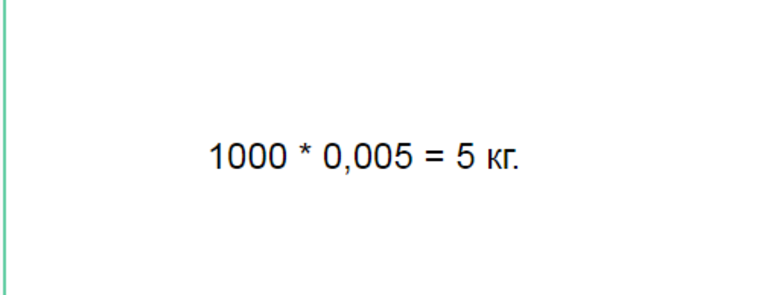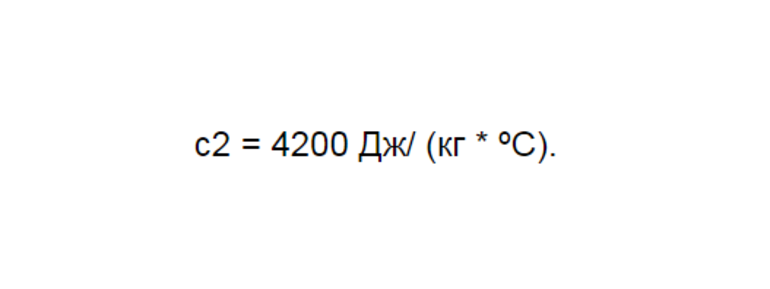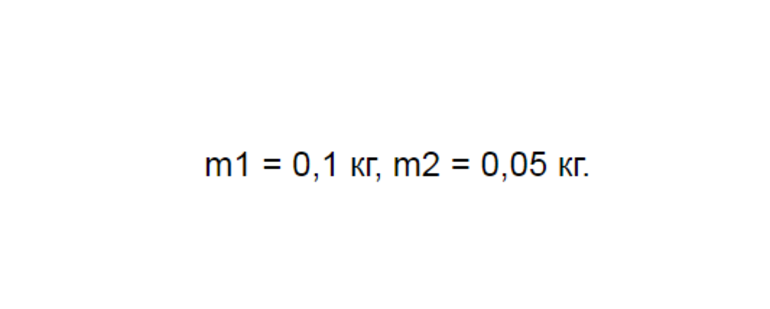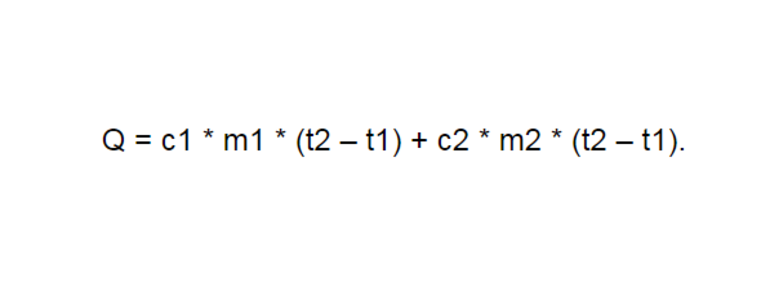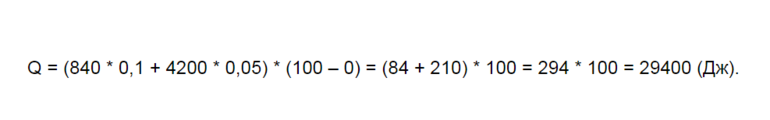Нагревание и охлаждение
Эти два процесса знакомы каждому. Вот нам захотелось чайку, и мы ставим чайник, чтобы нагреть воду. Или ставим газировку в холодильник, чтобы охладить.
Логично предположить, что нагревание — это увеличение температуры, а охлаждение — ее уменьшение. Все, процесс понятен, едем дальше.
Но не тут-то было: температура меняется не «с потолка». Все завязано на таком понятии, как количество теплоты. При нагревании тело получает количество теплоты, а при нагревании — отдает.
Количество теплоты — энергия, которую получает или теряет тело при теплопередаче.
Виу-виу-виу! Внимание!
Обнаружено новое непонятное слово — теплопередача.
Минуточку, давайте закончим с количеством теплоты.
В процессах нагревания и охлаждения формулы для количества теплоты выглядят так:
Нагревание
Q = cm(tконечная — tначальная)
Охлаждение
Q = cm(tначальная — tконечная)
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует и изменение температуры, о котором мы сказали выше, и удельная теплоемкость, речь о которой пойдет дальше.
А вот теперь поговорим о видах теплопередачи.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Виды теплопередачи
Теплопередача — процесс передачи теплоты (обмена энергией).
Здесь все совсем несложно, видов всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Если мы греемся у камина, то получаем тепло конвекцией или излучением?🤔
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Удельная теплоемкость: понятие и формула для расчета
Формулы количества теплоты для нагревания и охлаждения мы уже разбирали, но давайте еще раз:
Нагревание
Q = cm(tконечная — tначальная)
Охлаждение
Q = cm(tначальная — tконечная)
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует такая величина, как удельная теплоемкость. По сути своей — это способность материала получать или отдавать тепло.
С точки зрения математики удельная теплоемкость вещества — это количество теплоты, которое надо к нему подвести, чтобы изменить температуру 1 кг вещества на 1 градус Цельсия:
Удельная теплоемкость вещества
c= Q/m(tконечная — tначальная)
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Также ее можно рассчитать через теплоемкость вещества:
Удельная теплоемкость вещества
c= C/m
c — удельная теплоемкость вещества [Дж/кг*˚C]
C — теплоемкость вещества [Дж/˚C]
m — масса [кг]
Величины теплоемкость и удельная теплоемкость означают практически одно и то же. Отличие в том, что теплоемкость — это способность всего вещества к передаче тепла. То есть формулу количества теплоты для нагревания тела можно записать в таком виде:
Количество теплоты, необходимое для нагревания тела
Q = C(tконечная — tначальная)
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Онлайн-курсы физики в Skysmart не менее увлекательны, чем наши статьи!
Таблица удельных теплоемкостей
Удельная теплоемкость — табличная величина. Часто ее указывают в условии задачи, но при отсутствии в условии — можно и нужно воспользоваться таблицей. Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
|
Газы |
C, Дж/(кг·К) |
|
Азот N2 |
1051 |
|
Аммиак NH3 |
2244 |
|
Аргон Ar |
523 |
|
Ацетилен C2H2 |
1683 |
|
Водород H2 |
14270 |
|
Воздух |
1005 |
|
Гелий He |
5296 |
|
Кислород O2 |
913 |
|
Криптон Kr |
251 |
|
Ксенон Xe |
159 |
|
Метан CH4 |
2483 |
|
Неон Ne |
1038 |
|
Оксид азота N2O |
913 |
|
Оксид азота NO |
976 |
|
Оксид серы SO2 |
625 |
|
Оксид углерода CO |
1043 |
|
Пропан C3H8 |
1863 |
|
Сероводород H2S |
1026 |
|
Углекислый газ CO2 |
837 |
|
Хлор Cl |
520 |
|
Этан C2H6 |
1729 |
|
Этилен C2H4 |
1528 |
|
Металлы и сплавы |
C, Дж/(кг·К) |
|
Алюминий Al |
897 |
|
Бронза алюминиевая |
420 |
|
Бронза оловянистая |
380 |
|
Вольфрам W |
134 |
|
Дюралюминий |
880 |
|
Железо Fe |
452 |
|
Золото Au |
129 |
|
Константан |
410 |
|
Латунь |
378 |
|
Манганин |
420 |
|
Медь Cu |
383 |
|
Никель Ni |
443 |
|
Нихром |
460 |
|
Олово Sn |
228 |
|
Платина Pt |
133 |
|
Ртуть Hg |
139 |
|
Свинец Pb |
128 |
|
Серебро Ag |
235 |
|
Сталь стержневая арматурная |
482 |
|
Сталь углеродистая |
468 |
|
Сталь хромистая |
460 |
|
Титан Ti |
520 |
|
Уран U |
116 |
|
Цинк Zn |
385 |
|
Чугун белый |
540 |
|
Чугун серый |
470 |
|
Жидкости |
Cp, Дж/(кг·К) |
|
Азотная кислота (100%-ная) NH3 |
1720 |
|
Бензин |
2090 |
|
Вода |
4182 |
|
Вода морская |
3936 |
|
Водный раствор хлорида натрия (25%-ный) |
3300 |
|
Глицерин |
2430 |
|
Керосин |
2085…2220 |
|
Масло подсолнечное рафинированное |
1775 |
|
Молоко |
3906 |
|
Нефть |
2100 |
|
Парафин жидкий (при 50С) |
3000 |
|
Серная кислота (100%-ная) H2SO4 |
1380 |
|
Скипидар |
1800 |
|
Спирт метиловый (метанол) |
2470 |
|
Спирт этиловый (этанол) |
2470 |
|
Топливо дизельное (солярка) |
2010 |
Задача
Какое твердое вещество массой 2 кг можно нагреть на 10 ˚C, сообщив ему количество теплоты, равное 7560 Дж?
Решение:
Используем формулу для нахождения удельной теплоемкости вещества:
c= Q/m(tконечная — tначальная)
Подставим значения из условия задачи:
c= 7560/2*10 = 7560/20 = 378 Дж/кг*˚C
Смотрим в таблицу удельных теплоемкостей для металлов и находим нужное значение.
|
Металлы и сплавы |
C, Дж/(кг·К) |
|
Алюминий Al |
897 |
|
Бронза алюминиевая |
420 |
|
Бронза оловянистая |
380 |
|
Вольфрам W |
134 |
|
Дюралюминий |
880 |
|
Железо Fe |
452 |
|
Золото Au |
129 |
|
Константан |
410 |
|
Латунь |
378 |
|
Манганин |
420 |
|
Медь Cu |
383 |
|
Никель Ni |
443 |
|
Нихром |
460 |
|
Олово Sn |
228 |
|
Платина Pt |
133 |
|
Ртуть Hg |
139 |
|
Свинец Pb |
128 |
|
Серебро Ag |
235 |
|
Сталь стержневая арматурная |
482 |
|
Сталь углеродистая |
468 |
|
Сталь хромистая |
460 |
|
Титан Ti |
520 |
|
Уран U |
116 |
|
Цинк Zn |
385 |
|
Чугун белый |
540 |
|
Чугун серый |
470 |
Ответ: латунь
Уде́льная теплоёмкость — физическая величина, численно равная количеству теплоты, которое необходимо передать телу массой 1 кг для того, чтобы его температура изменилась на 1 Кельвин. Удельная теплоемкость обозначается буквой c и измеряется в Дж/кг*Кельвин.
Единицей СИ для удельной теплоёмкости является джоуль на килограмм-кельвин. Следовательно, удельную теплоёмкость можно рассматривать как теплоёмкость единицы массы вещества. На значение удельной теплоёмкости влияет температура вещества. К примеру, измерение удельной теплоёмкости воды даст разные результаты при 20 °C и 60 °C.
Формула расчёта удельной теплоёмкости: 




Значения удельной теплоёмкости некоторых веществ
| Элемент | Агрегатное состояние | Удельная теплоёмкость Дж/(г·K) |
|---|---|---|
| воздух (сухой) | газ | 1,005 |
| воздух (100 % влажность) | газ | 1,0301 |
| алюминий | твёрдое тело | 0,930 |
| бериллий | твёрдое тело | 1,8245 |
| латунь | твёрдое тело | 0,377 |
| олово | твёрдое тело | 0,218 |
| медь | твёрдое тело | 0,385 |
| сталь | твёрдое тело | 0,500 |
| алмаз | твёрдое тело | 0,502 |
| этанол | жидкость | 2,460 |
| золото | твёрдое тело | 0,129 |
| графит | твёрдое тело | 0,720 |
| гелий | газ | 5,190 |
| водород | газ | 14,300 |
| железо | твёрдое тело | 0,444 |
| свинец | твёрдое тело | 0,130 |
| чугун | твёрдое тело | 0,540 |
| вольфрам | твёрдое тело | 0,134 |
| литий | твёрдое тело | 3,582 |
| ртуть | жидкость | 0,139 |
| азот | газ | 1,042 |
| Нефтяные масла (фракция нефти) зависит от углеводородных составляющих | жидкость | 1,67 — 2,01 |
| кислород | газ | 0,920 |
| кварцевое стекло | твёрдое тело | 0,703 |
| вода 373К (100 °C) | газ | 2,020 |
| сусло пивное | жидкость | 3,927 |
| вода | жидкость | 4,183 |
| лёд | твёрдое тело | 2,060 |
| Значения приведены для стандартных условий, если это не оговорено особо. |
| Вещество | Агрегатное состояние | Удельная теплоёмкость кДж*(кг−1·K−1) |
Объёмная теплоёмкость кДж*(дм³−1·K−1) |
|---|---|---|---|
| асфальт | твёрдое тело | 0,92 | 1,2 |
| полнотелый кирпич | твёрдое тело | 0,84 | 1,344 |
| силикатный кирпич | твёрдое тело | 1 | 1,7 |
| бетон | твёрдое тело | 0,88 | 1,7 |
| кронглас (стекло) | твёрдое тело | 0,67 | 1,709 |
| флинт (стекло) | твёрдое тело | 0,503 | 2,1 |
| оконное стекло | твёрдое тело | 0,84 | 2,1 |
| гранит | твёрдое тело | 0,790 | 2,1 |
| гипс | твёрдое тело | 1,09 | 2,507 |
| мрамор, слюда | твёрдое тело | 0,880 | 2,4 |
| песок | твёрдое тело | 0,835 | 1,2 |
| сталь | твёрдое тело | 0,47 | 3,713 |
| почва | твёрдое тело | 0,80 | |
| древесина | твёрдое тело | 1,7 | 1 |
См. также
- Теплоёмкость
- Объёмная теплоёмкость
- Скрытая теплота
Примечания
Литература
Ссылки
|
|
|
|
В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
Для того чтобы нагреть на определённую величину тела, взятые при одинаковой температуре, изготовленные из различных веществ, но имеющие одинаковую массу, требуется разное количество теплоты.
Пример:
для нагревания (1) кг воды на (1°C) требуется количество теплоты, равное (4200) Дж. А если нагревать (1) кг цинка на (1°C), то потребуется всего (400) Дж.
Удельная теплоёмкость вещества — физическая величина, численно равная количеству теплоты, которое необходимо передать веществу массой (1) кг для того, чтобы его температура изменилась на (1~°C).
([c]=1frac{Дж}{кг cdot °C}).
Пример:
по таблице удельной теплоёмкости твёрдых веществ находим, что удельная теплоёмкость алюминия составляет (c(Al)=920 frac{Дж}{кг cdot °C}). Поэтому при охлаждении (1) килограмма алюминия на (1) градус Цельсия ((°C)) выделяется (920) джоулей энергии. Столько же необходимо для нагревания (1) килограмма на алюминия на (1) градус Цельсия ((°C)).
Ниже представлены значения удельной теплоёмкости для некоторых веществ.
Твёрдые вещества
|
Вещество |
(c), Дж/(кг·°C) |
| Алюминий |
(920) |
| Бетон |
(880) |
| Дерево |
(2700) |
|
Железо, сталь |
(460) |
| Золото |
(130) |
| Кирпич |
(750) |
| Латунь |
(380) |
| Лёд |
(2100) |
| Медь |
(380) |
| Нафталин |
(1300) |
| Олово |
(230) |
| Парафин |
(3200) |
| Песок |
(970) |
| Платина |
(130) |
| Свинец |
(120) |
| Серебро |
(240) |
| Стекло |
(840) |
| Цемент |
(800) |
| Цинк |
(400) |
| Чугун |
(550) |
| Сера |
(710) |
Жидкости
|
Вещество |
(c), Дж/(кг·°C) |
| Вода |
(4200) |
| Глицерин |
(2400) |
| Керосин |
(2140) |
|
Масло подсолнечное |
(1700) |
|
Масло трансформаторное |
(2000) |
| Ртуть |
(120) |
|
Спирт этиловый |
(2400) |
|
Эфир серный |
(2300) |
Газы (при постоянном давлении и температуре (20°C))
|
Вещество |
(c), Дж/(кг·°C) |
| Азот |
(1000) |
| Аммиак |
(2100) |
| Водород |
(14300) |
|
Водяной пар |
(2200) |
| Воздух |
(1000) |
| Гелий |
(5200) |
| Кислород |
(920) |
|
Углекислый газ |
(830) |
Удельная теплоёмкость реальных газов, в отличие от идеальных газов, зависит от давления и температуры. И если зависимостью удельной теплоёмкости реальных газов от давления в практических задачах можно пренебречь, то зависимость удельной теплоёмкости газов от температуры необходимо учитывать, поскольку она очень существенна.
Обрати внимание!
Удельная теплоёмкость вещества, находящегося в различных агрегатных состояниях, различна.
Пример:
вода в жидком состоянии имеет удельную теплоёмкость, равную (4200) Дж/(кг·°C), в твёрдом состоянии (лёд) — (2100) Дж/(кг·°C), в газообразном состоянии (водяной пар) — (2200) Дж/(кг·°C).
Вода — вещество особенное, обладающее самой высокой среди жидкостей удельной теплоёмкостью. Но самое интересное, что теплоёмкость воды снижается при температуре от (0°C) до (37°C) и снова растёт при дальнейшем нагревании (рис. (1)).
Рис. (1). График удельной теплоёмкости воды
В связи с этим вода в морях и океанах, нагреваясь летом, поглощает из окружающей среды огромное количество теплоты. А зимой вода остывает и отдаёт в окружающую среду большое количество теплоты. Это явление оказывает влияние на климат данного региона. Летом здесь нет изнуряющей жары, а зимой — лютых морозов.
Высокая удельная теплоёмкость воды нашла широкое применение в различных областях: от медицинских грелок до систем отопления и охлаждения.
Задумывались ли вы, почему воду используют при тушении пожаров? Из-за большой теплоёмкости. При соприкосновении с горящим предметом вода забирает у него большое количество теплоты. Оно значительно больше, чем при использовании такого же количества любой другой жидкости.
Помимо непосредственного отвода тепла, вода гасит пламя ещё и косвенным образом. Водяной пар, образующийся при контакте с огнём, окутывает горящее тело, предотвращая поступление кислорода, без которого горение невозможно.
Какой водой эффективнее тушить огонь: горячей или холодной? Горячая вода тушит огонь быстрее, чем холодная. Дело в том, что нагретая вода скорее превратится в пар, а значит, и отсечёт поступление воздуха к горящему объекту.
Источники:
Рис. 1. Автор: Epop — собственная работа. Общественное достояние, https://commons.wikimedia.org/w/index.php?curid=10750129.
Тепло, необходимое для повышения температуры данной единицы массы вещества
В термодинамике, удельная теплоемкость (символ c p) вещества — это теплоемкость образца вещества, деленная на массу образца. Неформально, это количество энергии, которое необходимо добавить в форме тепла к одной единице массы вещества, чтобы вызвать увеличение на одну единицу в температура. СИ единицей удельной теплоемкости является джоуль на кельвин и килограмм, Дж / (К · кг). Например, при температуре 25 ° C (удельная теплоемкость может изменяться в зависимости от температуры) количество тепла, необходимое для повышения температуры 1 кг воды на 1 K (эквивалент 1 ° C), составляет 4179,6 джоулей, что означает, что удельная теплоемкость воды составляет 4179,6 Дж · кг · К.
Удельная теплоемкость часто зависит от температуры и различается для каждого состояния вещества. Жидкая вода имеет одну из самых высоких удельных теплоемкостей среди обычных веществ, около 4182 Дж / (К · кг) при 20 ° C; но лед при температуре чуть ниже 0 ° C составляет всего 2093 Дж / (К · кг). Удельная теплоемкость железа, гранита и водородного газа составляет около 449, 790 и 14300 Дж / (К · кг) соответственно. В то время как вещество претерпевает фазовый переход, например плавление или кипение, его удельная теплоемкость технически бесконечна, потому что тепло переходит в изменение своего состояния, а не на повышение его температуры.
Удельная теплоемкость вещества, особенно газа, может быть значительно выше, когда ему позволяют расширяться при нагревании (удельная теплоемкость при постоянном давлении), чем при нагревании в закрытом сосуде, который предотвращает расширение ( удельная теплоемкость при постоянном объеме). Эти два значения обычно обозначаются c P { displaystyle c_ {P}}


Однако в некоторых контекстах термин удельная теплоемкость (или удельная теплоемкость) может относиться к отношению между удельной теплоемкостью вещества при данной температуре и эталонного вещества при эталонной температуре, например воды при 15 ° C; во многом похоже на удельный вес.
Удельная теплоемкость относится к другим интенсивным измерениям теплоемкости с другими знаменателями. Если количество вещества измеряется как число моль, вместо этого получается молярная теплоемкость (единица СИ — джоуль на кельвин на моль, Дж / (К · моль). Если количество берется как объем образца (как это иногда делается в инженерии), получается объемная теплоемкость (единица СИ — джоуль на кельвин на кубический метр, Дж / К / м).
Одним из первых ученых, использовавших эту концепцию, был Джозеф Блэк, врач 18 века и профессор медицины в Университет Глазго. Он измерил удельную теплоемкость многих веществ, используя термин теплоемкость.
Содержание
- 1 Определение
- 1.1 Варианты
- 1.2 Применимость
- 2 Измерение
- 3 Единицы
- 3.1 Международная система
- 3.2 Имперские инженерные единицы
- 3.3 Калории
- 4 Физическая основа удельной теплоемкости
- 4.1 Одноатомные газы
- 4.2 Многоатомные газы
- 5 Термодинамическое происхождение
- 5.1 Состояние вещества в однородном образце
- 5.2 Сохранение энергии
- 5.3 Связь с уравнением состояния
- 5.4 Связь между теплоемкостями
- 5.5 Расчет из первых принципов
- 5.5.1 Идеальный газ
- 6 См. Также
- 7 Ссылки
- 8 Дополнительная литература
- 9 Внешние ссылки
Определение
Удельная теплоемкость вещества, обычно обозначаемая c { displaystyle c}


- c = CM = 1 M ⋅ d Q d T { displaystyle c = { frac {C} {M}} = { frac {1} {M}} cdot { frac { mathrm {d} Q} { mathrm {d} T}}}
где d Q { displaystyle mathrm {d} Q}

Подобно теплоемкости объекта, удельная теплоемкость вещества может варьироваться, иногда существенно, в зависимости от начальной температуры e T { displaystyle T}


Эти параметры обычно указываются при указании удельной теплоемкости вещества. Например, «Вода (жидкость): cp { displaystyle c_ {p}}

Однако зависимость c { displaystyle c}


Удельная теплоемкость — это интенсивное свойство вещества, внутренняя характеристика, которая не зависит от размера или формы рассматриваемого количества. (Квалификатор «специфический» перед экстенсивным свойством часто указывает на интенсивное свойство, производное от него.)
Варианты
Инжекция тепловой энергии в вещество, помимо повышения его температуры, обычно вызывает увеличение его объема и / или его давления, в зависимости от того, как удерживается образец. Выбор последнего влияет на измеренную удельную теплоемкость даже для того же начального давления p { displaystyle p}

- Если давление поддерживается постоянным (например, при атмосферном давлении окружающей среды), а образец расширяется, расширение создает работу как силу от давление смещает корпус или окружающую жидкость. Эта работа должна производиться за счет выделяемой тепловой энергии. Полученная таким образом удельная теплоемкость измеряется при постоянном давлении (или изобарическом ) и часто обозначается cp { displaystyle c_ {p}}
, cp. { displaystyle c _ { mathrm {p}}}
и т. д.
- С другой стороны, если расширение предотвращается — например, достаточно жестким корпусом или увеличением внешнее давление, чтобы противодействовать внутреннему — работа не производится, и тепловая энергия, которая ушла бы на нее, должна вместо этого вносить вклад во внутреннюю энергию образца, включая повышение его температуры на дополнительную величину. Удельная теплоемкость, полученная таким образом, называется при постоянном объеме (или изохорной ) и обозначается c V { displaystyle c_ {V}}
, cv { displaystyle c_ {v}}
cv { displaystyle c _ { mathrm {v}}}
и т. д.
Значение c V { displaystyle c_ {V} }

Применимость
Удельную теплоемкость можно определить и измерить для газов, жидкостей и твердых общий состав и молекулярная структура. К ним относятся газовые смеси, растворы и сплавы или гетерогенные материалы, такие как молоко, песок, гранит и бетон, если рассматривать их в достаточно большом масштабе.
Удельная теплоемкость также может быть определена для материалов, состояние или состав которых изменяется при изменении температуры и давления, если эти изменения обратимы и постепенны. Таким образом, например, концепции могут быть определены для газа или жидкости, которые диссоциируют при повышении температуры, до тех пор, пока продукты диссоциации быстро и полностью рекомбинируют при ее падении.
Удельная теплоемкость не имеет значения, если вещество претерпевает необратимые химические изменения или если имеет место фазовый переход, такой как плавление или кипение, при резкой температуре в пределах диапазона температур по меркам.
Измерение
Удельная теплоемкость вещества обычно определяется в соответствии с определением; а именно, путем измерения теплоемкости образца вещества, обычно с помощью калориметра, и деления на массу образца. Для оценки теплоемкости вещества могут применяться, например, несколько методов.
Удельную теплоемкость газов можно измерить при постоянном объеме, поместив образец в жесткий контейнер. С другой стороны, измерение удельной теплоемкости при постоянном объеме может быть чрезмерно трудным для жидкостей и твердых тел, поскольку часто требуется непрактичное давление, чтобы предотвратить расширение, которое может быть вызвано даже небольшим повышением температуры. Вместо этого общепринятой практикой является измерение удельной теплоемкости при постоянном давлении (позволяющем материалу расширяться или сжиматься по своему желанию), отдельно определять коэффициент теплового расширения и сжимаемость материала, и вычислить удельную теплоемкость при постоянном объеме из этих данных в соответствии с законами термодинамики.
Единицы
Международная система
Единицей измерения удельной теплоемкости в системе СИ является джоуль. на кельвин на килограмм (Дж / К / кг, Дж / (кг К), ДжК кг и т. д.). Поскольку приращение температуры на один градус Цельсия совпадает с приращением в один кельвин, это то же самое, что и джоуль на градус Цельсия на килограмм (Дж / ° C / кг). Иногда в качестве единицы массы используется грамм вместо килограмма: 1 Дж / К / кг = 0,001 Дж / К / г.
Удельная теплоемкость вещества (на единицу массы) имеет размер L · Θ · T, или (L / T) / Θ. Следовательно, единица СИ Дж / К / кг эквивалентна метру в квадрате на секунду в квадрате на кельвин (м Кс).
Имперские инженерные подразделения
Специалисты в строительстве, гражданском строительстве, химическом машиностроении и других технических дисциплинах, особенно в Соединенные Штаты могут использовать так называемые английские инженерные единицы, которые включают Имперские фунты (фунт = 0,45359237 кг) в качестве единица массы, градус Фаренгейта или Ренкина (° F = 5/9 K, около 0,555556 K) в качестве единицы приращения температуры и британская тепловая единица (БТЕ ≈ 1055,06 Дж), как единица тепла.
В этих контекстах единицей удельной теплоемкости является БТЕ / ° F / фунт = 4177,6 Дж / К / кг. Первоначально БТЕ была определена таким образом, чтобы средняя удельная теплоемкость воды составляла 1 БТЕ / ° F / фунт.
Калории
В химии количество тепла часто измеряется в калориях. Как ни странно, две единицы с таким названием, обозначаемые «кал» или «кал», обычно используются для измерения количества тепла:
- «малая калория» (или «грамм-калория», «кал») составляет 4,184 Дж., в яблочко. Первоначально он был определен таким образом, чтобы удельная теплоемкость жидкой воды составляла 1 кал / C ° / г.
- «Большая калория» (также «килокалория», «килограмм-калория» или «пищевая калория») ; «ккал» или «кал») — это 1000 малых калорий, то есть ровно 4184 Дж. Первоначально он был определен таким образом, чтобы удельная теплоемкость воды составляла 1 кал / C ° / кг.
Хотя эти единицы все еще используются в некоторых контекстах (например, килограмм калорий в питании ), их использование теперь устарела в технических и научных областях. Когда тепло измеряется в этих единицах, единицей удельной теплоемкости обычно является
-
- 1 кал / ° C / г («малая калория») = 1 кал / ° C / кг = 1 ккал / ° C / кг («большая калорийность»). калория «) = 4184 Дж / К / кг.
В обоих единицах удельная теплоемкость воды составляет приблизительно 1. Комбинации кал / ° C / кг = 4,184 Дж / K / кг и ккал / ° C / г = 4184000 Дж / К / кг не используются широко.
Физическая основа теплоемкости
Температура образца вещества отражает среднюю кинетическую энергию составляющих его частиц (атомов или молекул) относительно его центра масса. Однако не вся энергия, передаваемая образцу вещества, пойдет на повышение его температуры, примером чего служит теорема о равнораспределении.
Одноатомные газы
Квантовая механика предсказывает, что при комнатной температуре и обычном давлении изолированный атом в газе не может хранить сколько-нибудь значимое количество энергии, кроме как в виде кинетической энергии. Таким образом, теплоемкость на моль одинакова для всех одноатомных газов (таких как благородные газы). Точнее, c V, m = 3 R / 2 ≈ { displaystyle c_ {V, mathrm {m}} = 3R / 2 приблизительно {}}


Следовательно, удельная теплоемкость (на единицу массы, а не на моль) одноатомного газа будет обратно пропорциональна его (размерному) атомному весу A { displaystyle A }
- c V ≈ { displaystyle c_ {V} приблизительно {}}
12470 Дж / К / кг / A cp ≈ { displaystyle / A quad quad quad c_ {p} приблизительно {}}
20785 Дж / К / кг / A { displaystyle / A}
Для благородных газов, от гелия до ксенона, эти вычисленные значения:
| Газ | He | Ne | Ar | Kr | Xe |
|---|---|---|---|---|---|
A { displaystyle A} |
4.00 | 20.17 | 39.95 | 83.80 | 131,29 |
c V { displaystyle c_ {V}} (Дж / К / м) (Дж / К / м) |
3118 | 618,3 | 312,2 | 148,8 | 94,99 |
cp { displaystyle c_ {p}} (Дж / К / кг) (Дж / К / кг) |
5197 | 1031 | 520,3 | 248,0 | 158,3 |
Многоатомные газы
С другой стороны, молекула многоатомного газа (состоящая из двух или более атомов, связанных вместе) может накапливать тепловую энергию в других формах, помимо своей кинетической энергии. Эти формы включают вращение молекулы и колебание атомов относительно ее центра масс.
Эти дополнительные степени свободы или «режимы» вносят вклад в удельную теплоемкость вещества. А именно, когда в газ с многоатомными молекулами впрыскивается тепловая энергия, только часть ее идет на увеличение их кинетической энергии и, следовательно, температуры; остальное перейдет в те другие степени свободы. Чтобы достичь такого же повышения температуры, моль этого вещества должен быть передан большей тепловой энергии, чем моль одноатомного газа. Следовательно, теплоемкость многоатомного газа зависит не только от его молекулярной массы, но и от числа степеней свободы, которые имеют молекулы.
Квантовая механика далее утверждает, что каждая вращательная или колебательная мода может принимать только или теряют энергию в определенном дискретном количестве (квантах). В зависимости от температуры средняя тепловая энергия, приходящаяся на молекулу, может быть слишком маленькой по сравнению с квантами, необходимыми для активации некоторых из этих степеней свободы. Эти режимы называются «замороженными». В этом случае удельная теплоемкость вещества будет увеличиваться с температурой, иногда ступенчато, по мере того, как больше режимов размораживаются и начинают поглощать часть подводимой тепловой энергии.
Например, молярная теплоемкость азота N. 2при постоянном объеме равна c V, m = { displaystyle c_ {V, mathrm {m}} = {}}


Это значение удельной теплоемкости азота практически постоянно от ниже -150 ° C до примерно 300 ° C. В этом температурном диапазоне две дополнительные степени свободы, соответствующие колебаниям атомов, растяжению и сжатию связи, все еще «заморожены». Примерно при этой температуре эти режимы начинают «размораживаться», и в результате c V { displaystyle c_ {V}}
.
Термодинамическое определение
Теоретически удельную теплоемкость вещества можно также получить из его абстрактного термодинамического моделирования с помощью уравнения состояния и ап.
Состояние вещества в однородном образце
Для применения теории рассматривается образец вещества (твердое, жидкое или газовое), для которого можно определить удельную теплоемкость; в частности, что он имеет однородный состав и фиксированную массу M { displaystyle M}



Состояние материала затем может быть определено тремя параметрами: его температура T { displaystyle T}








Эти переменные не независимы. Разрешенные состояния определяются уравнением состояния, связывающим эти три переменные: F (T, P, V) = 0. { displaystyle F (T, P, V) = 0.}



для некоторых простых материалов, таких как идеальный газ, из базовой теории можно вывести уравнение состояния F = 0 { displaystyle F = 0}

Сохранение энергии
Абсолютное значение этой величины не определено, и (для целей термодинамики) состояние «нулевой внутренней энергии» может быть выбрано произвольно. Однако согласно закону сохранения энергии, любое бесконечно малое увеличение M d U { displaystyle M mathrm {d} U}




- d Q — P d V = M d U { displaystyle mathrm {d} QP mathrm {d} { boldsymbol { mathrm {V}}} = M mathrm {d} U}
следовательно,
- d QM — P d V = d U { displaystyle { frac { mathrm {d} Q} {M}} — P mathrm {d} V = mathrm {d} U}
Если объем образца (следовательно, удельный объем материала) поддерживается постоянным во время нагнетания количества тепла d Q { displaystyle mathrm {d} Q}


- d QM d T = d U d T { displaystyle { frac { mathrm {d} Q} {M mathrm { d} T}} = { frac { mathrm {d} U} { mathrm {d} T}}}
где d T { displaystyle mathrm {d} T}

Для теплоемкости при постоянном давлении полезно определить удельную энтальпию системы как сумму H (T, P, V) = U (T, P, V) + PV { Displaystyle H (T, P, V) = U (T, P, V) + PV}
- d H = d U + V d P + P d V { displaystyle mathrm {d} H = mathrm {d} U + V mathrm {d} P + P mathrm {d} V}
, следовательно,
- d QM + V d P = d H { displaystyle { frac { mathrm {d} Q} {M}} + V mathrm {d} P = mathrm {d} H}
Если давление остается постоянным, второй член в левой части равен нулю и
- d QM d T = d H d T { displaystyle { frac { mathrm {d} Q} {M mathrm {d} T}} = { frac { mathrm {d} H} { mathrm {d} T}}}
Левая часть — это удельная теплоемкость при постоянном давлении c P { displaystyle c_ {P}}
Связь с уравнением состояния
В общем, бесконечно малые величины d T, d P, d V, d U { displaystyle mathrm {d} T, mathrm { d} P, mathrm {d} V, mathrm {d} U}
- {d T ∂ F ∂ T (T, P, V) + d P ∂ F ∂ P (T, P, V) + d V ∂ F ∂ V (T, P, V) = 0 d T ∂ U ∂ T (T, P, V) + d P ∂ U ∂ P (T, P, V) + d V ∂ U ∂ V (T, P, V) = d U { displaystyle left { { begin {array} {lcl} displaystyle mathrm {d} T { frac { partial F} { partial T}} (T, P, V) + mathrm {d} P { frac { частичный F} { partial P}} (T, P, V) + mathrm {d} V { frac { partial F} { partial V}} (T, P, V) = 0 \ [ 2ex] displaystyle mathrm {d} T { frac { partial U} { partial T}} (T, P, V) + mathrm {d} P { frac { partial U} { partial P }} (T, P, V) + mathrm {d} V { frac { partial U} { partial V}} (T, P, V) = mathrm {d} U end {array }} right.}
Здесь (∂ F / ∂ T) (T, P, V) { displaystyle ( partial F / partial T) (T, P, V)}



Этот анализ также выполняется независимо от того, как приращение энергии d Q { displaystyle mathrm {d} Q}
Соотношение между теплоемкостями
Для любого удельного объема В { displaystyle V}






- F (T, p V (T), V) = 0 { displaystyle F (T, p_ {V} (T), V) = 0 quad quad {}}
и F (T, P, v P (T)) = 0 { displaystyle {} quad quad F (T, P, v_ {P} (T)) = 0}
для любых значений T, P, V { displaystyle T, P, V}




Тогда из фундаментального термодинамического соотношения следует, что
- c P (T, P, V) — c V (T, P, V) = T [dp V d T (T)] [dv P d T (T)] { displaystyle c_ {P} (T, P, V) -c_ {V} (T, P, V) = T left [{ frac { mathrm {d} p_ {V}} { mathrm {d} T}} (T) right] left [{ frac { mathrm {d} v_ {P}} { mathrm {d} T}} (T) right]}
Это уравнение можно переписать как
- c P (T, P, V) — c V (T, P, V) = VT α 2 β T, { displaystyle c_ { P} (T, P, V) -c_ {V} (T, P, V) = VT { frac { alpha ^ {2}} { beta _ {T}}},}
где
- α { displaystyle alpha}
— это коэффициент теплового расширения,
- β T { displaystyle beta _ {T}}
— изотермическая сжимаемость,
в зависимости от состояния (T, P, V) { displaystyle (T, P, V)}
коэффициент теплоемкости, или индекс адиабаты, представляет собой отношение c P / c V { displaystyle c_ {P} / c_ {V}}
.
Расчет из первых принципов
Метод интеграла по путям Монте-Карло представляет собой численный подход к определению значений теплоемкости, основанный на квантовых динамических принципах. Однако хорошие приближения можно сделать для газов во многих состояниях, используя более простые методы, описанные ниже. Для многих твердых тел, состоящих из относительно тяжелых атомов (атомный номер>железа), при некриогенных температурах теплоемкость при комнатной температуре приближается к 3R = 24,94 джоулей на кельвин на моль атомов (закон Дюлонга – Пети, R — газовая постоянная ). Приближения низких температур как для газов, так и для твердых тел при температурах ниже их характерных температур Эйнштейна или температур Дебая можно сделать с помощью методов Эйнштейна и Дебая, обсуждаемых ниже.
Идеальный газ
Для идеального газа, оценка частных производных выше в соответствии с уравнением состояния, где R — газовая постоянная для идеального газа
- PV = n RT, { displaystyle PV = nRT,}
- CP — CV = T (∂ P ∂ T) V, n (∂ V ∂ T) P, N, { Displaystyle C_ {P} -C_ {V} = T left ({ frac { partial P} { partial T}} right) _ {V, n} left ({ frac { partial V} { partial T}} справа) _ {P, n},}
- P = n RTV ⇒ (∂ P ∂ T) V, n = n RV, { displaystyle P = { frac {nRT} {V}} Rightarrow left ({ frac { partial P} { partial T}} right) _ {V, n} = { frac {nR} {V}},}
- V = n RTP ⇒ (∂ V ∂ T) P, n = n RP. { displaystyle V = { frac {nRT} {P}} Rightarrow left ({ frac { partial V} { partial T}} right) _ {P, n} = { frac {nR} {P}}.}
Подставляем
- T (∂ P ∂ T) V, n (∂ V ∂ T) P, n = T n RV n RP = n RTV n RP = P n RP = n R, { displaystyle T left ({ frac { partial P} { partial T}} right) _ {V, n} left ({ frac { partial V} { partial T}} right) _ {P, n} = T { frac {nR} {V}} { frac {nR} {P}} = { frac {nRT} {V}} { frac {nR} {P}} = P { frac {nR} {P}} = nR,}
это уравнение сводится просто к соотношению Майера :
- CP, m — CV, m = R. { displaystyle C_ {P, m} -C_ {V, m} = R.}
Различия в теплоемкости, как определено вышеупомянутым соотношением Майера, точны только для идеального газа и будут другими для любого реального газа.. ->
См. Также
Физический портал
- Удельная теплота плавления (Энтальпия плавления)
- Удельная теплота испарения (Энтальпия испарения)
- Френкель строка
- Коэффициент теплоемкости
- Уравнение теплопроводности
- Коэффициент теплопередачи
- История термодинамики
- Метод Джобака (Оценка теплоемкости)
- Скрытая теплота
- Свойства материала (термодинамика)
- Квантовая статистическая механика
- R-показатель (изоляция)
- Удельная теплота испарения
- Удельная теплота плавления
- Статистическая механика
- Тепловая масса
- Термодинамические базы данных для чистых веществ
- Уравнения термодинамики
- Объемная теплоемкость
Ссылки
Дополнительная литература
- Emmerich Wilhelm Trevor M. Letcher, Eds., 2010, Heat Capacities: Liquids, Solutions and Vapors, Cambridge, UK: Royal Химическое общество, ISBN 0-85404-176-1. Совсем недавний обзор избранных традиционных аспектов заглавной темы, включая недавнее введение специалиста в ее теорию, Эммерих Вильгельм, «Тепловые мощности: Введение, концепции и избранные применения» (Глава 1, стр. 1-27), главы по традиционные и более современные экспериментальные методы, такие как фотоакустические методы, например, Jan Thoen Christ Glorieux, «Фототермические методы определения теплоемкости», а также главы, посвященные новым исследовательским интересам, в том числе теплоемкости белков и других полимерных материалов. системы (гл. 16, 15), жидких кристаллов (гл. 17) и т.д.
Внешние ссылки
- (2012-05may-24) Теория фононов проливает свет на термодинамику жидкости, теплоемкость — Физика Мир Фононная теория термодинамики жидкости | Scientific Reports
Определение термина
Физическая величина, характеризующая, сколько тепловой энергии требуется на единицу вещества, и есть удельная теплоемкость, или энтальпия. Также она позволяет определить, сколько тепла необходимо отвести от единицы того или иного соединения, чтобы изменить на 1 градус его температуру. Неважно, по какой системе измеряется этот параметр:
- Кельвина;
- Цельсия;
- Фаренгейта.
Единицей измерения удельной теплоемкости является джоуль, поделенный на килограмм и градус Кельвина. Есть и особая, внесистемная единица, представляющая собой показатель калорий, который имеет вид произведения килограммов и градусов Цельсия. Обозначается теплоемкость удельного типа посредством специальных индексов. Допустим, в ситуации, когда наблюдаются постоянные отметки давления, используется индекс p. Когда постоянство сохраняет объем, его место занимает буква v. Единица, в которой измеряется удельная теплоёмкость — килоджоуль.
Молярная теплоёмкость – отдельный показатель. Это количество тепловой энергии, которое показывает требующееся для нагрева 1 моль вещества на каждый градус. Во время плавления выделяется также определенный объем тепловой энергии. Теплопроводность — разновидность теплопередачи, когда энергия перемещается от нагретой области вещества к более холодной, посредством передвижения частиц. На уроках физики проводится объяснение физического смысла теплоёмкости. Ее размерность обозначена так:
Физическая величина может быть охарактеризована различными способами. В частности, допускается формулировка, согласно которой ее можно представить в виде комбинации теплоемкости вещества к его массе.
Теплоемкость, в свою очередь, это физическая величина. Она отображает объем тепла, который надо подвести либо отвести от вещества для изменения показателя его температуры. Если это объект, масса которого превышает 1 кг, определять этот показатель надо, как для единичного значения.
Примеры для тех или иных веществ
Путем экспериментов удалось выяснить, что показатель является различным для тех или иных веществ. Например, в отношении воды имеется показатель 4,187 кДж. Наибольшим он является у водорода. Для него установлено нормальное значение 14,300 кДж. Наименьшее оно у золота — 0,129 кДж.
Благодаря современным достижениям науки можно увеличить скорость обнаружения интересующих значений и свойств. Если раньше приходилось искать по справочнику соответствующую таблицу, то теперь на любом телефоне появилась опция для поиска через интернет. Наиболее примечательные вещества, теплоёмкость которых представляет интерес чаще всего это:
- воздушные массы (идеальные и реальные газы) — 1,005 кДж;
- металл алюминий — 0,930 кДж;
- медь — 0,385 кДж.
Лабораторная работа
На школьных уроках определяется теплоемкость в отношении твердых веществ. Ее удаётся подсчитать при сравнении с тем показателем, который уже известен. Таблица удельной теплоемкости создана специально для удобства подсчетов.
Берут воду и твердый объект в нагретом состоянии, после чего производят замер температуры обоих. Отпускают твердое тело в жидкость и дожидаются момента теплового равновесия. Чтобы организовать такой эксперимент, необходим колориметр. Соответственно, имея такой прибор, можно пренебрегать небольшими потерями энергии.
В дальнейшем записывается формула объёма тепла, которая переходит в воду при взаимодействии с твёрдым объектом. Второе равенство отображает энергию, передаваемую твёрдым веществом при снижении температуры. Указанные показатели равны. После вычислений можно выявить теплоемкость компонентов, из которых состоит твердый объект. При этом обычно смотрят на данные таблицы, пытаясь таким образом определить, из какого вещества оно было сделано.
Первая задача
Допустим, металл меняет свои показатели температуры в пределах 20-24°. Внутренняя энергия этого вещества увеличивается одновременно на 152 кДж. Необходимо рассчитать, сколько составляет теплоёмкость металлического объекта при условии, что его масса составляет 100 г.
Для решения этой задачи надо воспользоваться специальной формулой. Достаточно подставить имеющиеся значения, но перед этим следует перевести массу в килограммы. Если этого не сделать, ответ будет неверным. В каждом килограмме насчитывается 1000 г. По этой причине 100 г необходимо поделить на 1000. Получается значение, равное 0,1 кг.
После произведенных подсчетов с использованием формулы получается такой результат:
Другие условия
Согласно 2 задаче, даётся энергия внесистемной единицы. Следует выявить температуру, при которой вода в количестве 5 л остынет, если её первоначально возьмут при температуре кипения. При этом она выделяет 1684 кДж тепла. Это количество переводится в джоули = 1680000 Дж.
Чтобы найти ответ, надо воспользоваться формулой, в которой используется масса. С другой стороны, в задаче она не приводится. Но несмотря на это, указан объем жидкости, соответственно, для нахождения критерия допустимо подставить уравнение с коэффициентами:
Плотность ее составляет 1000 кг на м3. Но надо подставлять объём в кубических метрах. Для перевода исходного значения надо поделить его на 1000. Получается число, равное 0,005 м3.
Производятся дальнейшие расчеты, и на выходе получается выражение:
В дальнейшем применяется формула:
Получается отметка, равная 20 ºС.
Другая задача: имеется стакан, в который налито 50 г воды. Сам он имеет массу 100 г. Температура жидкости первоначально имеет показатели 0°. Необходимо найти объем тепла, необходимого для доведения воды до кипения.
Для решения этой задачи надо ввести подходящие параметры. Можно дать условное обозначение характеристикам, которые касаются стакана, в виде единицы. Всё, что касается воды, обозначается индексом 2. Далее следует найти цифры, соответствующие теплоемкости, через таблицу. Если это тара, выполненная из лабораторного стекла, то у нее будут показатели с1 = 840 Дж/ (кг * ºС). Точный показатель для воды будет иметь вид:
Масса в этой задаче приводится в граммах. После перевода получаются показатели:
Начальная температура равна 0°. Необходимо найти параметры, соответствующие температуре кипения — 100°. Стакан нагревается одновременно с жидкостью, которая наполнена им. Поэтому начальное количество теплоты необходимо получить при складывании несколько показателей. Это параметр, получаемый при нагревании стекла, а второй показатель обнаруживается после нагрева воды. Составляется формула такого вида:
Сюда подставляются имеющееся значения, после чего она принимает следующий облик:
Те или иные материалы с одинаковой массой предполагают разные объемы тепла, необходимые для нагрева. Этот показатель обычно больше у металлов, нежели у древесины, например, алюминия или поверхности из штукатурки. То есть вид материала влияет на этот показатель в той же степени, что и масса. Чтобы нагреть бетон в объеме 1 кг требуется примерно 1000 Дж.
Показатели воздуха
Теплоемкость воздуха отличается, в зависимости от сопутствующих условий. Её величина влияет на объём тепла, который требуется для подведения при постоянном давлении к 1 кг воздуха. При этом задается цель — увеличить температуру на градус. Если газ имеет температуру 20°С, то необходимо подведение 1005 джоулей тепла, чтобы нагреть 1 кг этого вещества.
По мере роста температуры повышается удельная теплоемкость. Но здесь имеет место нелинейная зависимости. Средняя теплоемкость почти не меняется, если не отмечается воздействия экстремального холода и других критичных явлений. Но от температуры окружающего пространства зависит удельная теплоемкость вещества не так явно, если сравнивать с вязкостью. Иногда такие связи изображают в виде графиков для лучшего понимания.
При нагреве газов теплоемкость способна возрастать в 1,2 раз.
У влажного воздуха такой параметр является более высоким, нежели у сухого. Вода по сравнению с ним имеет большие значения теплоемкости. Соответственно, когда капли воды висят в воздухе, его теплоемкость становится больше.
>
Содержание материала
- Удельная теплоемкость вещества
- Видео
- Инструкция по расчёту параметра
- Виды теплопередачи
- Теплопроводность
- Конвекция
- Излучение
- Как рассчитать теплоемкость продуктов питания
- Табличные значения удельной теплоемкости
- Понятие теплоемкости, как измеряется, график зависимости температуры от времени
- Таблица удельных теплоемкостей
Удельная теплоемкость вещества
Удельная теплоемкость вещества — это физическая величина, численно равная количеству теплоты, которое необходимо передать телу массой $1 space кг$ для того, чтобы его температура изменилась на $1 degree C$
Рассмотрим на примерах, как удельная теплоемкость характеризует вещество.
Возьмем $1 space кг$ воды и нагреем его на $1 degree C$ (рисунок 1).
Для этого нам понадобится $4200 space Дж$. Именно это количество теплоты и будет определять удельную теплоемкость воды.
А теперь нагреем на $1 degree C$ кусок свинца массой $1 space кг$ (рисунок 2).
В этот раз нам потребуется затратить $140 space Дж$. Это значение ожидаемо отличается от количества теплоты, затраченное на нагревание воды. Тем не менее, это количество теплоты так же будет характеризовать удельную теплоемкость свинца.
Видео
Инструкция по расчёту параметра
Рассчитать с вещества достаточно просто и чтобы это сделать нужно, выполнить следующие шаги:
- Взять расчётную формулу: Теплоемкость = Q/(m*∆T)
- Выписать исходные данные.
- Подставить их в формулу.
- Провести расчёт и получим результат.
В качестве примера произведём расчёт неизвестного вещества массой 480 грамм обладающего температурой 15ºC, которая в результате нагрева (подвода 35 тыс. Дж) увеличилась до 250º.
Согласно инструкции приведённой выше производим следующие действия:
Выписываем исходные данные:
- Q = 35 тыс. Дж;
- m = 480 г;
- ΔT = t2–t1 =250–15 = 235 ºC.
Берём формулу, подставляем значения и решаем:
с=Q/(m*∆T)=35тыс.Дж/(480 г*235º)=35тыс.Дж/(112800 г*º)=0,31 Дж/г*º.
Виды теплопередачи
Теплопередача — процесс передачи теплоты (обмена энергией).
Здесь все совсем несложно, видов всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Если мы греемся у камина, то получаем тепло конвекцией или излучением?🤔
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Как рассчитать теплоемкость продуктов питания
При расчёте емкости питания уравнение примет следующий вид:
с=(4.180*w)+(1.711*p)+(1.928*f)+(1.547*c)+(0.908 *a), где:
- w – количество воды в продукте;
- p – количество белков в продукте;
- f – процентное содержание жиров;
- c – процентное содержание углеводов;
- a – процентное содержание неорганических компонентов.
Определим теплоемкость плавленого сливочного сыра Viola. Для этого выписываем нужные значения из состава продукта (масса 140 грамм):
- вода – 35 г;
- белки – 12,9 г;
- жиры – 25,8 г;
- углеводы – 6,96 г;
- неорганические компоненты – 21 г.
Затем находим с:
- с=(4.180*w)+(1.711*p)+(1.928*f)+(1.547*c)+(0.908*a)=(4.180*35)+(1.711*12,9)+(1.928*25,8) + (1.547*6,96)+(0.908*21)=146,3+22,1+49,7+10,8+19,1=248 кДж /кг*ºC.
Табличные значения удельной теплоемкости
Существуют уже известные значения удельной теплоемкости различных веществ. Они представлены таблице 1.
| Вещество | $c, frac{Дж}{кг cdot degree C}$ | Вещество | $c, frac{Дж}{кг cdot degree C}$ |
| Золото | 130 | Песок | 820 |
| Ртуть | 140 | Стекло | 840 |
| Свинец | 140 | Кирпич | 880 |
| Олово | 230 | Алюминий | 920 |
| Серебро | 250 | Масло подсолнечное | 1700 |
| Медь | 400 | Лед | 2100 |
| Цинк | 400 | Керосин | 2100 |
| Латунь | 400 | Эфир | 2350 |
| Железо | 460 | Дерево (дуб) | 2400 |
| Сталь | 500 | Спирт | 2500 |
| Чугун | 540 | Вода | 4200 |
| Графит | 750 | Гелий | 5200 |
Вода имеет почти самую большую теплоемкость в таблице — $4200 frac{Дж}{кг cdot degree C}$. Это означает, что вода, находящаяся в морях и океанах, поглощает большое количество теплоты, нагреваясь летом. Зимой воды начинает остывать и отдавать большое количество теплоты. Поэтому, в местностях, которые расположены в непосредственной близости от воды, летом не бывает очень жарко, а зимой не бывает очень холодно. По этой же причине воду широко используют в технике (например, охлаждение деталей во время их обработки) и быту (отопительный системы помещений).
Песок имеет небольшую теплоемкость — $820 frac{Дж}{кг cdot degree C}$. Он быстро нагревается и быстро остывает. Поэтому в пустыне днем очень жарко, а ночью температура может опуститься почти ниже $0 degree C$.
Понятие теплоемкости, как измеряется, график зависимости температуры от времени
Под понятием «теплоемкости» подразумевается то количество теплоты, которое поглощается либо выделяется телом при его нагревании (либо охлаждении) на 1 Кельвин. Это физическое понятие, зависящее от соотношения количества теплоты, которое в термодинамической системе поглощается либо выделяется, незначительно изменяя температуру, к данному изменению.
Таблица удельных теплоемкостей
Удельная теплоемкость — табличная величина. Часто ее указывают в условии задачи, но при отсутствии в условии — можно и нужно воспользоваться таблицей. Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
|
Газы |
C, Дж/(кг·К) |
|
Азот N2 |
1051 |
|
Аммиак NH3 |
2244 |
|
Аргон Ar |
523 |
|
Ацетилен C2H2 |
1683 |
|
Водород H2 |
14270 |
|
Воздух |
1005 |
|
Гелий He |
5296 |
|
Кислород O2 |
913 |
|
Криптон Kr |
251 |
|
Ксенон Xe |
159 |
|
Метан CH4 |
2483 |
|
Неон Ne |
1038 |
|
Оксид азота N2O |
913 |
|
Оксид азота NO |
976 |
|
Оксид серы SO2 |
625 |
|
Оксид углерода CO |
1043 |
|
Пропан C3H8 |
1863 |
|
Сероводород H2S |
1026 |
|
Углекислый газ CO2 |
837 |
|
Хлор Cl |
520 |
|
Этан C2H6 |
1729 |
|
Этилен C2H4 |
1528 |
|
Металлы и сплавы |
C, Дж/(кг·К) |
|
Алюминий Al |
897 |
|
Бронза алюминиевая |
420 |
|
Бронза оловянистая |
380 |
|
Вольфрам W |
134 |
|
Дюралюминий |
880 |
|
Железо Fe |
452 |
|
Золото Au |
129 |
|
Константан |
410 |
|
Латунь |
378 |
|
Манганин |
420 |
|
Медь Cu |
383 |
|
Никель Ni |
443 |
|
Нихром |
460 |
|
Олово Sn |
228 |
|
Платина Pt |
133 |
|
Ртуть Hg |
139 |
|
Свинец Pb |
128 |
|
Серебро Ag |
235 |
|
Сталь стержневая арматурная |
482 |
|
Сталь углеродистая |
468 |
|
Сталь хромистая |
460 |
|
Титан Ti |
520 |
|
Уран U |
116 |
|
Цинк Zn |
385 |
|
Чугун белый |
540 |
|
Чугун серый |
470 |
|
Жидкости |
Cp, Дж/(кг·К) |
|
Азотная кислота (100%-ная) NH3 |
1720 |
|
Бензин |
2090 |
|
Вода |
4182 |
|
Вода морская |
3936 |
|
Водный раствор хлорида натрия (25%-ный) |
3300 |
|
Глицерин |
2430 |
|
Керосин |
2085…2220 |
|
Масло подсолнечное рафинированное |
1775 |
|
Молоко |
3906 |
|
Нефть |
2100 |
|
Парафин жидкий (при 50С) |
3000 |
|
Серная кислота (100%-ная) H2SO4 |
1380 |
|
Скипидар |
1800 |
|
Спирт метиловый (метанол) |
2470 |
|
Спирт этиловый (этанол) |
2470 |
|
Топливо дизельное (солярка) |
2010 |
Задача
Какое твердое вещество массой 2 кг можно нагреть на 10 ˚C, сообщив ему количество теплоты, равное 7560 Дж?
Решение:
Используем формулу для нахождения удельной теплоемкости вещества:
c= Q/m(tконечная — tначальная)
Подставим значения из условия задачи:
c= 7560/2*10 = 7560/20 = 378 Дж/кг*˚C
Смотрим в таблицу удельных теплоемкостей для металлов и находим нужное значение.
|
Металлы и сплавы |
C, Дж/(кг·К) |
|
Алюминий Al |
897 |
|
Бронза алюминиевая |
420 |
|
Бронза оловянистая |
380 |
|
Вольфрам W |
134 |
|
Дюралюминий |
880 |
|
Железо Fe |
452 |
|
Золото Au |
129 |
|
Константан |
410 |
|
Латунь |
378 |
|
Манганин |
420 |
|
Медь Cu |
383 |
|
Никель Ni |
443 |
|
Нихром |
460 |
|
Олово Sn |
228 |
|
Платина Pt |
133 |
|
Ртуть Hg |
139 |
|
Свинец Pb |
128 |
|
Серебро Ag |
235 |
|
Сталь стержневая арматурная |
482 |
|
Сталь углеродистая |
468 |
|
Сталь хромистая |
460 |
|
Титан Ti |
520 |
|
Уран U |
116 |
|
Цинк Zn |
385 |
|
Чугун белый |
540 |
|
Чугун серый |
470 |
Ответ: латунь




 и т. д.
и т. д. cv { displaystyle c _ { mathrm {v}}}
cv { displaystyle c _ { mathrm {v}}} и т. д.
и т. д. 12470 Дж / К / кг / A cp ≈ { displaystyle / A quad quad quad c_ {p} приблизительно {}}
12470 Дж / К / кг / A cp ≈ { displaystyle / A quad quad quad c_ {p} приблизительно {}} 20785 Дж / К / кг / A { displaystyle / A}
20785 Дж / К / кг / A { displaystyle / A}






![{displaystyle left{{begin{array}{lcl}displaystyle mathrm {d} T{frac {partial F}{partial T}}(T,P,V)+mathrm {d} P{frac {partial F}{partial P}}(T,P,V)+mathrm {d} V{frac {partial F}{partial V}}(T,P,V)=0\[2ex]displaystyle mathrm {d} T{frac {partial U}{partial T}}(T,P,V)+mathrm {d} P{frac {partial U}{partial P}}(T,P,V)+mathrm {d} V{frac {partial U}{partial V}}(T,P,V)=mathrm {d} Uend{array}}right.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc8cf5749fa03699f3476f5ee6027f8cdc8d5791)
 и F (T, P, v P (T)) = 0 { displaystyle {} quad quad F (T, P, v_ {P} (T)) = 0}
и F (T, P, v P (T)) = 0 { displaystyle {} quad quad F (T, P, v_ {P} (T)) = 0}
![{displaystyle c_{P}(T,P,V)-c_{V}(T,P,V)=Tleft[{frac {mathrm {d} p_{V}}{mathrm {d} T}}(T)right]left[{frac {mathrm {d} v_{P}}{mathrm {d} T}}(T)right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/04f90f594f938b14485e0150c149c2087ed85b3a)

 — это коэффициент теплового расширения,
— это коэффициент теплового расширения, — изотермическая сжимаемость,
— изотермическая сжимаемость,