Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
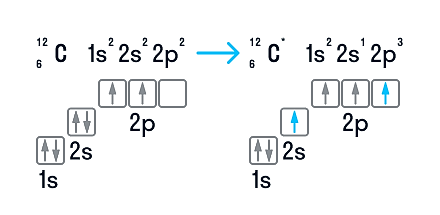
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
-
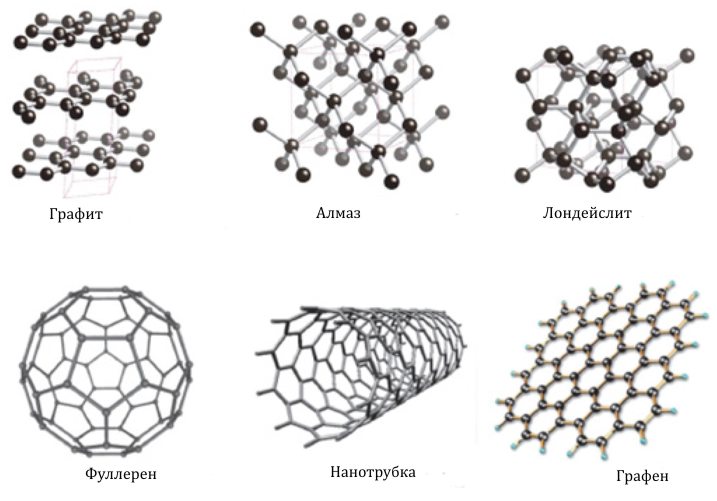
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
-
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
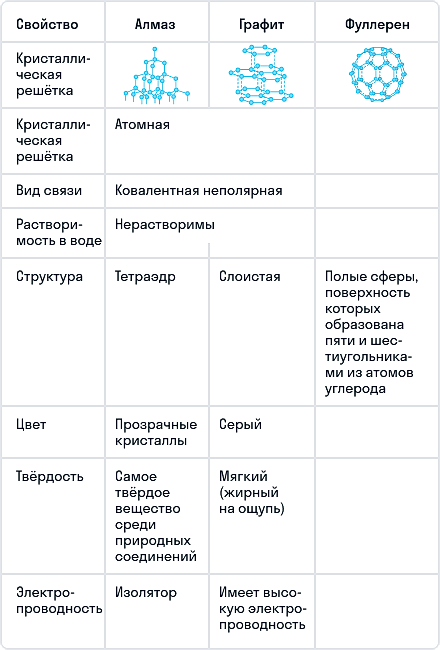
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
-
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
-
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
-
Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
В атмосфере находится в виде диоксида углерода СО2 (~0,03%). В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
Химические свойства углерода
Взаимодействие со фтором
Углерод обладает низкой реакционной способностью и из галогенов реагирует только со фтором:
С + 2F2 = CF4.
Взаимодействие с кислородом
При нагревании взаимодействует с кислородом, образуя оксиды СО и СО2:
2С + О2 = 2СО;
С + О2 = СО2.
Взаимодействие с другими неметаллами
Реагирует с серой:
С + 2S = CS2.
Не взаимодействует с азотом и фосфором.
Углерод взаимодействует с водородом и кремнием в присутствии никелевого катализатора:
C + Si = SiC;
C + 2H2 = CH4.
Взаимодействие с металлами
Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
Взаимодействие с водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2.
Восстановительные свойства
Углерод способен восстанавливать многие металлы из их оксидов (карботермия):
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
Вопросы для самопроверки
-
Что такое углерод? Дайте характеристику его положения в Периодической системе химических элементов Д. И. Менделеева.
-
Как распределяются электроны по энергетическим уровням в атоме углерода? Напишите электронную конфигурацию углерода.
-
Углерод является окислителем в реакции с:
-
Кислородом
-
Хлором
-
Водородом
-
Серой
-
-
Возможно ли взаимопревращение алмаза и графита? Объясните почему.
-
В виде каких соединений углерод находится в природе?
-
Для какого аллотропного видоизменения углерода характерна совместимость с тканями человеческого организма?
-
Опишите физические свойства графена и карбина.
-
Для чего используют карботермию?
-
Чем обусловлено наличие аллотропных видоизменений углерода?
-
В чем заключается различие между нейтральным состоянием атома углерода и возбужденным? Какие возможны степени окисления?
Красота химии — в том, что она изучает окружающий нас мир. Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.
| Углерод | |
|---|---|
| матово-чёрный (графит), либо прозрачный (алмаз) | |
 |
|
| Название, символ, номер | Углерод / Carboneum (С), 6 |
| Атомная масса (молярная масса) |
[12,0096; 12,0116] а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s2 2p2 |
| Радиус атома | 77 пм |
| Ковалентный радиус | 77,0 пм |
| Радиус иона | 16 (+4e) 260 (-4e) пм |
| Электроотрицательность | 2,55 (шкала Полинга) |
| Степени окисления | 4, 3, 2, 1, 0, -1, -2, -3, -4 |
| Энергия ионизации (первый электрон) |
1085,7 (11,25) кДж/моль (эВ) |
| Плотность (при н. у.) | 2,25 (графит) г/см³ |
| Температура кипения | 5003 K; 4830 °C |
| Критическая точка | 4600 К, 10,8 МПа |
| Молярная теплоёмкость | 8,54 (графит) Дж/(K·моль) |
| Молярный объём | 5,3 см³/моль |
| Структура решётки | гексагональная (графит/графен), кубическая (алмаз) |
| Параметры решётки | a=2,46; c=6,71 (графит); а=3,567 (алмаз) |
| Отношение c/a | 2,73 (графит) |
| Температура Дебая | 1860 (алмаз) K |
| Теплопроводность | (300 K) 1,59 Вт/(м·К) |
| Номер CAS | 7440-44-0 |
Углерод (C, лат. carboneum) — химический элемент, символизируемый буквой C и имеющий атомный номер 6. Элемент является четырехвалентным неметаллом, т. е. имеет четыре свободных электрона для формирования ковалентных химических связей. Он располагается в 14-й (по устаревшей классификации — в 4-й) группе периодической системы. Три изотопа данного элемента встречаются в окружающем нас мире. Изотопы 12C и 13C являются стабильными, в то время как 14C- радиоактивный (период полураспада данного изотопа составляет 5,730 лет). Углерод был известен ещё в античном мире.
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, называемых органическими, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия.
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Физические свойства
- 2.1 Изотопы углерода
- 3 Аллотропные модификации углерода
- 3.1 Кристаллический углерод
- 3.2 Аморфный углерод
- 3.3 Кластерные формы
- 3.4 Структура
- 3.5 Графит и алмаз
- 3.6 Жидкий углерод
- 3.7 Углерод III
- 3.8 Ультрадисперсные алмазы (наноалмазы)
- 3.9 Карбин
- 3.10 Фуллерены и углеродные нанотрубки
- 3.11 Аморфный углерод (строение)
- 3.12 Графен
- 3.13 Углеродное кольцо
- 4 Нахождение в природе
- 5 Химические свойства
- 5.1 Неорганические соединения
- 5.2 Органические соединения
- 6 Применение
- 7 Токсическое действие
История
Углерод в виде древесного угля применялся в древности для выплавки металлов. Издавна известны аллотропные модификации углерода — алмаз и графит.
На рубеже XVII—XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером и Георгом Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Поздние флогистики, Реомюр, Бергман и другие, уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ. В книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье.
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 год германский император Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — в алхимическом периоде считался видоизменённым свинцовым блеском и назывался plumbago; только в 1740 г. Потт обнаружил отсутствие в графите какой-либо примеси свинца. Шееле исследовал графит (1779) и, будучи флогистиком, счёл его сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона.
Двадцать лет спустя Гитон де Морво путём осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Происхождение названия
В XVII—XIX веках в русской химической и специализированной литературе иногда применялся термин «углетвор» (Шлаттер, 1763; Шерер, 1807; Севергин, 1815); с 1824 года Соловьёв ввёл название «углерод». Соединения углерода имеют в названии часть карбо(н) — от лат. carbō (род. п. carbōnis) «уголь».
Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Изотопы углерода
Основная статья: Изотопы углерода
Природный углерод состоит из двух стабильных изотопов — 12C (98,93 %) и 13C (1,07 %) и одного радиоактивного изотопа 14C (β-излучатель, Т½= 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14N (n, p) 14C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На образовании и распаде 14C основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
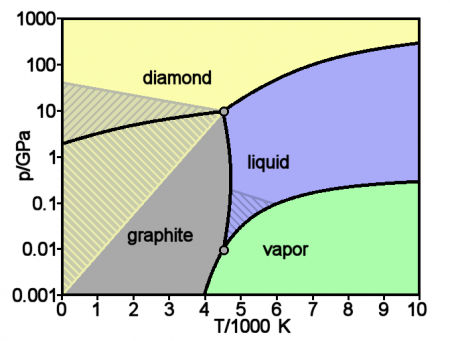
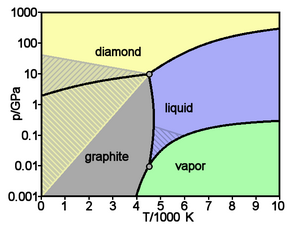
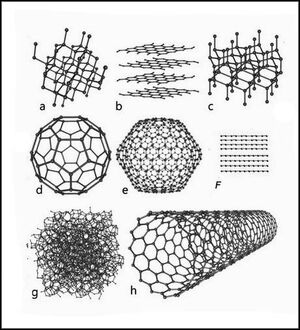
Аллотропные модификации углерода
Упрощённая фазовая диаграмма углерода, заштрихованы области где аллотропные модификации могут быть метастабильны. (diamond — алмаз, graphite — графит, liquid — жидкость, vapor — газ)
Схемы строения различных модификаций углерода
a: алмаз, b: графит, c: лонсдейлит
d: фуллерен — бакибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
Основная статья: Аллотропия углерода
Кристаллический углерод
- Алмаз
- Графен
- Графит
- Карбин
- Лонсдейлит
- Наноалмаз
- Фуллерены
- Фуллерит
- Углеродное волокно
- Углеродные нановолокна
- Углеродные нанотрубки
Аморфный углерод
- Активированный уголь
- Древесный уголь
- Ископаемый уголь: антрацит и Ископаемый уголь.
- Кокс каменноугольный, нефтяной и др.
- Стеклоуглерод
- Техуглерод
- Сажа
- Углеродная нанопена
На практике, как правило, перечисленные выше аморфные формы являются химическими соединениями с высоким содержанием углерода, а не чистой аллотропной формой углерода.
Кластерные формы
- Астралены
- Диуглерод
- Углеродные наноконусы
Структура
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода:
- тетраэдрическая, образуется при смешении одного s- и трёх p-электронов (sp3-гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ-связями с атомами углерода или иными в вершинах тетраэдра. Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, например, в метане и других углеводородах.
- тригональная, образуется при смешении одной s- и двух p-электронных орбиталей (sp2-гибридизация). Атом углерода имеет три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ-связей, используется для образования π-связи с другими атомами. Такая геометрия углерода характерна для графита, фенола и др.
- дигональная, образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π-связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — карбин.
Графит и алмаз
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. Термодинамический расчёт линии равновесия графит — алмаз на фазовой р, Т-диаграмме был выполнен в 1939 году О. И. Лейпунским. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается взрывообразно. ΔН0 перехода — 1,898 кДж/моль. Прямой переход графита в алмаз происходит при 3000 K и давлении 11—12 ГПа. При нормальном давлении углерод сублимируется при 3780 K.
Жидкий углерод
Жидкий углерод существует только при определённом внешнем давлении. Тройные точки: графит — жидкость — пар Т = 4130 K, р = 10,7 МПа и графит — алмаз — жидкость Т ≈ 4000 K, р ≈ 11 ГПа. Линия равновесия графит — жидкость на фазовой р, Т-диаграмме обладает положительным наклоном, переходящим по мере приближения к тройной точке графит — алмаз — жидкость в отрицательный, что связано с уникальными свойствами атомов углерода создавать углеродные молекулы, состоящие из различного количества атомов (от двух до семи). Наклон линии равновесия алмаз — жидкость, в отсутствие прямых экспериментов в области очень высоких температур (> 4000—5000 K) и давлений (> 10—20 ГПа), долгие годы считался отрицательным. Проведённые японскими исследователями прямые эксперименты и обработка полученных экспериментальных данных с учётом аномальности высокотемпературной теплоёмкости алмаза показали, что наклон линии равновесия алмаз — жидкость положителен, т. е. алмаз тяжелее своей жидкости (в расплаве он будет тонуть, а не всплывать как лёд в воде).
В мае 2019 года в журнале Physical Review Letters опубликована работа российских учёных из Объединенного института высоких температур РАН А. М. Кондратьева и А. Д. Рахеля, в которой физики первыми, впервые в мире детально изучили и измерили свойства жидкой формы углерода. Результаты физического эксперимента позволили получить новые данные, которые были недоступны исследователям в условиях компьютерного моделирования. Тонкая пластина высокоориентированного пиролитического графита с гексагональной осью, перпендикулярной его поверхности, была зажата между двумя пластинами особого материала и нагрета при давлении от 0,3 до 2,0 ГигаПаскалей. Оказалось, что температура плавления графита при этих условиях составляет 6300–6700 Кельвинов, что более чем на 1000° выше значений, предсказанных теоретически и на математических моделях. Исследователи впервые в мире точно измерили физические показатели процесса плавления углерода и свойства его жидкой фазы (удельное сопротивление, энтальпию плавления, изохорную теплоёмкость и многие другие показатели этого загадочного вещества. Они также обнаружили, что скорость звука в жидком углероде возрастает при уменьшении плотности.
Углерод III
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решёткой типа вюрцита — лонсдейлит (а = 0,252 нм, с = 0,412 нм, пространственная группа Р63/mmc), плотность 3,51 г/см³, то есть такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
В 1980-е годы в СССР было обнаружено, что в условиях динамической нагрузки углеродсодержащих материалов могут образовываться алмазоподобные структуры, получившие название ультрадисперсных алмазов (УДА). В настоящее время всё чаще применяется термин «наноалмазы». Размер частиц в таких материалах составляет единицы нанометров. Условия образования УДА могут быть реализованы при детонации взрывчатых веществ со значительным отрицательным кислородным балансом, например, смесей тротила с гексогеном. Такие условия могут быть реализованы также при ударах небесных тел о поверхность Земли в присутствии углеродсодержащих материалов (органика, торф, уголь и пр.). Так, в зоне падения Тунгусского метеорита в лесной подстилке были обнаружены УДА.
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (−C≡C−), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9—2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно или тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 1960-х годов в Институте элементоорганических соединений Академии наук СССР. Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.
Фуллерены и углеродные нанотрубки
Углерод известен также в виде кластерных частиц C60, C70, C80, C90, C100 и подобных (фуллерены), а также графенов, нанотрубок и сложных структур — астраленов.
Аморфный углерод (строение)
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активный уголь.
Графен
Основная статья: Графен
Графен — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp² связей в гексагональную двумерную кристаллическую решётку.
Углеродное кольцо
В 2019 г. впервые синтезирован один экземпляр молекулы, представляющей собой кольцо из 18 атомов углерода. В нем чередуются одинарные и тройные химические связи.
Нахождение в природе
Было оценено, что Земля в целом состоит из 730 ppm углерода, с содержанием 2000 ppm в ядре и 120 ppm в мантии и коре. Так как масса Земли 5,972⋅1024 kg, то это предполагает наличие 4360 миллионов гигатонн углерода.
Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода CO2, в воздухе 0,046 % CO2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~17,5 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
Кругооборот углерода в природе включает биологический цикл, выделение CO2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоёв океанических вод, а также при дыхании, брожении, гниении. Биологический цикл состоит в том, что углерод в виде CO2 поглощается из тропосферы растениями в процессе фотосинтеза. Затем из биосферы он вновь возвращается в геосферу, частично через организмы животных и человека, и в виде CO2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
В природе встречается минерал шунгит, в котором содержится как твёрдый углерод (≈25 %), так и значительные количества оксида кремния (≈35 %).
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких температурах соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—501 °C, 600—700 °C и 800—1000 °C.
Степень окисления бывает от −4 до +4. Сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует с неметаллами при нагревании
| Реагент | Уравнение | Описание |
|---|---|---|
| O2 | 2C + O2 →to 2CO↑ 2CO + O2 →to 2CO2↑ |
Продуктами горения углерода являются CO и CO2(монооксид углерода и диоксид углерода соответственно).
Известен также неустойчивый недооксид углерода C3O2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды (например, C12O9, C5O2, C12O12). Углекислый газ реагирует с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты.
На Земле наиболее широко распространены карбонаты кальция (минеральные формы — мел, мрамор, кальцит, известняк и др.) и магния (минеральная форма доломит). |
| S Se |
C + S →to CS2 C + Se →to CSe2 |
При реакции углерода с серой получается сероуглерод CS2, известны также CS и C3S2.
Получен селенид углерода CSe2. |
| H2 F2 |
C + 2H2 → to,P, cat CH4↑ C + 2F2 →>900oC CF4 |
Из углерода можно получить метан в присутствии оксидов железа, однако гораздо практичнее получать метан из синтез газа.
Графит и аморфный углерод начинают реагировать с водородом при температуре 1200 °C, с фтором при 900 °C. |
| Si | C + Si →to SiC | При сплавлении получается карбид кремния. |
| N2 | 2C + N2 →to (CN)2 | При пропускании электрического разряда между угольными электродами в атмосфере азота образуется циан.
При высоких температурах взаимодействием углерода со смесью H2 и N2 получают синильную кислоту:
Также такой же реакцией получают циан
|
| P | Не реагирует |
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения.
| Уравнение | Описание |
|---|---|
| C + H2O →to CO↑ + H2↑ | Важна в промышленности реакция углерода с водяным паром для получения синтез газа |
| 3C + S + 2KNO3 →to K2S + 3CO2↑ + N2↑ | Горение чёрного пороха. |
| 5C + 4KNO3 → 2K2CO3 + 3CO2↑ + 2N2↑ C + 2KNO3 → 2KNO2 + CO2↑ |
С калиевой селитрой углерод проявляет восстановительные свойства. |
| 3C + BaSO4 → BaS + 2CO↑ + CO2↑ | Восстанавливает сульфат бария |
| C + MxOy →to M + CO↑ C + CaO → 2500oC CaC2 + CO↑ |
При сплавлении углерод восстанавливает оксиды металлов до металлов. Данное свойство широко используется в металлургической промышленности. |
С большинством металлов углерод образует карбиды, например:
- 4Al + 3C →t Al4C3
- Ca + 2C →t CaC2
Органические соединения
Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры, углеводы и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.
Применение
Графит используют в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его невероятно высокая температура плавления позволяет делать из него тигли для заливки металлов. Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды.
Алмаз благодаря исключительной твердости — незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бурмашин. Кроме этого, ограненные алмазы — бриллианты — используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая себестоимость добычи алмазов ($97,47 за один карат) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности, углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.)
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является CO2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Токсическое действие
Углерод поступает в окружающую среду в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5 — 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)⋅109 Бк/сут 14CO2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14C, вошедшего в состав биологических молекул (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами (14C (β) → 14N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0⋅104 Бк/л, предельно допустимое поступление через органы дыхания 3,2⋅108 Бк/год.
|
Изотопы углерода |
|---|
|
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Характеристика углерода
Положение в ПСХЭ
Углерод (C) располагается во 2 периоде, в IV группе, главной подгруппе, имеет порядковый номер 6.
Атомные числа
A (массовое число) = 12
P (число протонов) = 6
N (число нейтронов) = A — Z = 12 — 6 = 6
ē (число электронов) = 6
Электронное строение атома
C
+6
2
4
6C 1s2 2s2 2p2
Валентные электроны
| 6C | ↑↓ | ↑ | ↑ | |||
| 2s | 2p |
| 6C* | ↑ | ↑ | ↑ | ↑ | ||
| 2s | 2p |
Степени окисления
минимальная: -4
максимальная: +4
Свойства простого вещества
Углерод – p-элемент, неметалл.
Высший оксид
CO2 – оксид углерода (IV).
Проявляет кислотные свойства:
CO2 + 2NaOH ⟶ Na2CO3 + H2O
Высший гидроксид
H2CO3 – угольная кислота.
Проявляет кислотные свойства:
H2CO3 + 2NaOH ⟶ Na2CO3 + 2H2O
Водородное соединение
CH4
Углерод — химический элемент № (6). Он расположен в IVА группе втором периоде Периодической системы.
C6+6)2e)4e
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления (–4), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: ( +2) или (+4).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ. В земной коре распространены карбонаты (например,
CaCO3
образует мел, мрамор, известняк). Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений, главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Существует несколько аллотропных видоизменений, образованных атомами углерода. Наиболее распространены алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Рис. (1). Кристаллическая решётка алмаза
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Рис. (2). Алмаз
Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.
Рис. (3). Кристаллическая решётка графита
Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления ((3700) °С).
Рис. (4). Графит
Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.
Рис. (5). Уголь
Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные, и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
- Взаимодействие с металлами.
Углерод реагирует с металлами при высокой температуре с образованием карбидов:
В этой реакции углерод выступает как окислитель.
- Взаимодействие с водородом.
Реакция происходит при сильном нагревании. Образуется метан. Углерод — окислитель.
- Взаимодействие с кислородом.
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
- Взаимодействие с оксидами металлов.
Углерод способен восстанавливать металлы из их оксидов:
Применение простых веществ
Алмаз применяется:
- для обработки твёрдых поверхностей;
- для резки стекла;
- для изготовления буров и свёрл;
- для изготовления ювелирных украшений.
Графит используется:
- при изготовлении карандашей;
- как твёрдая смазка в подшипниках;
- для изготовления электродов;
- в качестве замедлителя нейтронов в ядерных реакторах;
- для получения искусственных алмазов.
Сажа:
- входит в состав типографской краски, крема для обуви;
- используется как наполнитель для производства резины.
Уголь используется:
- в противогазах, промышленных и бытовых фильтрах;
- для очистки сахарного сиропа, спирта и т. д.;
- в медицине.
Кокс применяется в металлургической промышленности.
Источники:
Рис. 1. Кристаллическая решётка алмаза https://image.shutterstock.com/image-vector/illustration-chemical-carbon-has-several-600w-1717122967.jpg
Рис. 2. Алмаз https://cdn.pixabay.com/photo/2014/10/24/08/09/diamond-500872_960_720.jpg
Рис. 3. Кристаллическая решётка графита https://image.shutterstock.com/image-vector/illustration-chemical-carbon-has-several-600w-1717122967.jpg
Рис. 4. Графит https://www.shutterstock.com/ru/image-photo/galena-called-lead-glance-natural-mineral-1360577696
Рис. 5. Уголь https://cdn.pixabay.com/photo/2015/11/20/20/45/charcoal-powder-1053836_960_720.jpg
https://ru.wikipedia.org/wiki/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4
| Углерод/Carboneum (С) | |
|---|---|

Углерод встречается как:
|
|
| Свойства атома | |
| Атомная масса (молярная масса) |
12,011 (природная смесь нуклидов) а. е. м. (г/моль) |
| Радиус атома | 77(sp³), 73(sp²), 69(sp) пм |
| Энергия ионизации (первый электрон) |
1086,5 (11,25) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s22p2 |
| Химические свойства | |
| Ковалентный радиус | 77 пм |
| Радиус иона | 16 (+4e) 260 (-4e)пм |
| Электроотрицательность (по Полингу) |
2,55 |
| Электродный потенциал | — |
| Степени окисления | 4, 2, -4 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,25 (графит) г/см³ |
| Удельная теплоёмкость | 8,517Дж/(K·моль) |
| Теплопроводность | 1,59 Вт/(м·K) |
| Температура плавления | (1 atm) 3800 (графит) K,
(3527 °C, 6381 °F) |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 4300 K(4027°C,7281°F) |
| Теплота испарения | n/a кДж/моль |
| Молярный объём | 5,3см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная (графит), кубическая (алмаз) |
| Период решётки | n/a Å |
| Отношение c/a | 1860,00 |
| Температура Дебая | n/a K |
Углерод (от лат. carbo — уголь; химический символ — C) — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса 12,0107.
История
Углеро́д в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны алмаз и графит. Элементарная природа углерода установлена А. Лавуазье в конце 1780-х годов.
Происхождение названия
Международное название происходит от латинского carbo — уголь, связанного с древним корнем kar — огонь. Этот же корень в латинском cremare — гореть, а возможно, и в русском «гарь», «жар», «угореть» (в древнерусском «угорати» — обжигать, опалять). Отсюда — и «уголь».
Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими и химическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа. Основные физические свойства собственно углерода смотри в таблице.
Изотопы углерода
Подробнее в статье изотопы углерода
Природный углерод состоит из двух стабильных нуклидов — 12С (98,892 %) и 13С (1,108 %)и одного радиоактивного нуклида 14С (β-излучатель, Т½= 5730 лет), состредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14N (n, p) 14C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
На образовании и распаде 14С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
Аллотропные модификации углерода
Упрощенная фазовая диаграмма углерода, заштрихованы области где аллотропные модификации могут быть метастабильны. (diamond — алмаз, graphite — графит, liquid — жидкость, vapor — газ) Схемы строения различных модификаций углерода:
a: алмаз;
b: графен;
c: графит;
d: фуллереныC60 — букибол C60;
e: фуллерены C540;
F: карбин;
g: технический углерод;
h: углеродные нанотрубки.
- графит
- алмаз
- карбин
- лонсдейлит
- фуллерены
- углеродные нанотрубки
- графен
- аморфный углерод
- уголь
- техуглерод
- сажа
Электронное строение атома углерода
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода.
- тетраэдрическая, образуется при смешении одного s- и трех p-электронов (sp³-гибридизация). Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ-связями с атомами углерода или иными в вершинах тетраэдра. Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, например, в метане и других углеводородах.
- тригональная, образуется при смешении одной s- и двух p-электронных орбиталей (sp²-гибридизация). Атом углерода имеет три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу. Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ-связей, используется для образования π-связи с другими атомами. Такая геометрия углерода характерна для графита, фенола и др.
- дигональная, образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π-связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — карбин.
Графит и алмаз
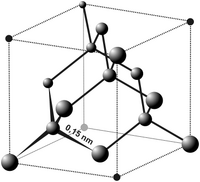
Элементарная ячейка (углерода) алмаза
Основные и хорошо изученные кристаллические модификации углерода — алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается за секунды. ΔН0 перехода — 1,898 кДж/моль. При нормальном давлении углерод сублимируется при 3 780 K. Жидкий углерод существует только при определенном внешнем давлении. Тройные точки: графит-жидкость-пар Т = 4130 K, р = 12,5 ГПа. Прямой переход графита в алмаз происходит при 3000 K и давлении 11—12 ГПа.
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1 200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа вюрцита — лонсдейлит (а = 0,252 нм, с = 0,412 нм, пространственная группа Р63/ттс), плотность 3,51 г/см³, т. е. такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
В 1980-е гг. в СССР было обнаружено, что в условиях динамического нагружения углеродсодержащих материалов могут образовываться алмазоподобные структуры, получившие название ультрадисперсных алмазов (УДА). В настоящее время всё чаще применяется термин «наноалмазы». Размер частиц в таких матералах составляет единицы нанометров. Условия образования УДА могут быть реализованы при детонации взрывчатых веществ с значительным отрицательным кислородным балансом, напрмер смесей тротила с гексогеном. Такие условия могут быть реализованы также при ударах небесных тел о поверхность Земли в присутствии углеродсодержащих материалов (органика, торф, уголь и пр.). Так, в зоне падения Тунгусского метеорита в лесной подстилке были обнаружены УДА.
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или ССl4 в низкотемпературной плазме.
Фуллерены и углеродные нанотрубки
Углерод известен также в виде кластерных частиц С60, С70 и подобных (фуллерены), а также графенов и нанотрубок.
Аморфный углерод
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активный уголь.
Нахождение в природе
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %). Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов — в почву и в виде СО2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4, −4, редко +2 (СО, карбиды металлов), +3 (C2N2, галогенцианы); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами с образованием карбидов.
Продукты горения — оксид углерода СО и диоксид СО2. Известен также неустойчивый оксид С3О2 (температура плавления −111 °C, температура кипения 7 °C) и некоторые другие оксиды. Графит и аморфный углерод начинают реагировать с Н2 при 1200 °C, с F2 — соответственно 900 °C, а при комнатной температуре CO2 с водой образует угольную кислоту — H2CO3 (CO2 (по массе %): 0,335 (0 °С); 0,169 (20 °С) частично взаимодействуя с водой образует угольную кислоту).[1] Она реагирует со многими металлами с образованием карбонатов. На Земле наиболее широко распространены карбонаты кальция и магния.
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в среде N2 образуется циан, при высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту. С серой углерод дает сероуглерод CS2, известны также CS и C3S2. С большинством металлов, бором и кремнием углерод образует карбиды. Важна в промышленности реакция углерода с водяным паром: С + Н2О = СО + Н2 (см. Газификация твердых топлив). При нагревании углерод восстанавливает оксиды металлов до металлов, что широко используется в металлургии.
Органические соединения
Благодаря способности углерода образовывать полимерные цепочки, существует огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Применение
| Железоуглеродистые сплавы |
|---|
| Фазы железоуглеродистых сплавов |
|
Феррит (твердый раствор внедрения C в α-железе с объемно-центрированной кубической решеткой) |
| Структуры железоуглеродистых сплавов |
|
Ледебурит (эвтектическая смесь кристаллов цементита и аустенита, превращающегося при охлаждении в перлит) |
| Стали |
|
Конструкционная сталь (до 0,8 % C) |
| Чугуны |
|
Белый чугун (хрупкий, содержит ледебурит и не содержит графит) |
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент.
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа пожирают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возврашением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов(нефть, природный газ) — один из важнейших источников энергии для человечества.
Углерод в сталелитейной промышленности один из важнеших компонентов сплавов железо-углерод (производсво чугуна и стали).
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, алмаз неизменно является самым дорогим драгоценным камнем.
Исключительно высокая теплопроводность алмаза (до 2000 Вт/м•К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области. В то же время определенные успехи в области выращивания алмазных пленок уже сейчас позволят говорить вполне серьёзно о смене «кремниевой эры» в микроэлектронике на «Алмазную эпоху» и в тысячи и десятки тысяч раз увеличить быстродействие ЭВМ, а в сочетании с нанотехнологиями и применением оптических способов управления такими процессорами поднять быстродействие от современного уровня свыше миллиарда раз (9—10 порядков!).
Токсическое действие
Углерод входит в состав атмосферных аэрозолей, в результате чего может изменяться региональный климат, уменьшаться количество солнечных дней. Частицы углерода поглощают солнечное излучение, что может вызвать нагревание поверхности Земли. Углерод поступает в окружающую среду в виде сажи в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5 — 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)•109 Бк/сут 14СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14С, вошедшего в состав молекул белков (особенно в ДНК и РНК), определяется радиационным воздействием бета частиц и ядер отдачи азота (14С (β) → 14N) и трансмутационным эффектом — изменением химического состава молекулы в результате превращения атома С в атом N. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0•104 Бк/л, предельно допустимое поступление через органы дыхания 3,2•108 Бк/год.
См. также
- Графит
- Кремний
- Германий
- Графен
Ссылки
- ↑ http://www.diclib.com/cgi-bin/d1.cgi?l=ru&base=bse&page=showid&id=74130
- Углерод на Webelements
- Углерод в Популярной библиотеке химических элементов
Литература
- Химия гиперкоординированного углерода, пер с англ., М., 1990.
- Kirk — Othmer encyclopedia, 3 ed., vol.4, N.-Y., 1978, p.556-709.
- Химия природных энергоносителей и углеродных материалов Т. В. Бухаркина, Н. Г. Дигуро
| 1 | H |
|
He | |||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| Iа | IIа | IIIб | IIIб: лантаноиды и актиноиды | IVб | Vб | VIб | VIIб | VIIIб | Iб | IIб | IIIа | IVа | Vа | VIа | VIIа | VIIIа | ||||||||||||||||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
| Группа | 14 | Температура плавления | Возгорается при 3825 ° C, 6917 ° F, 4098 K |
| Период | 2 | Точка кипения | Возгорается при 3825 ° C, 6917 ° F, 4098 K |
| Блокировать | п | Плотность (г см -3 ) | 3,513 (ромб); 2.2 (графит) |
| Атомный номер | 6 | Относительная атомная масса | 12,011 |
| Состояние при 20 ° C | Твердый | Ключевые изотопы | 12 С, 13 С, 14 С |
| Электронная конфигурация | [Он] 2с 2 2п 2 | Количество CAS | 7440-44-0 |
Использование и свойства элемента Углерод
Объяснение изображения
Три короны представляют три основные формы элемента в природе и статус углерода как «короля элементов» в периодической таблице.
Внешность
Существует ряд чистых форм этого элемента, включая графит, алмаз, фуллерены и графен. Алмаз – бесцветное, прозрачное, кристаллическое твердое вещество и самый твердый из известных материалов. Графит черный, блестящий, но мягкий. Наноформы, фуллерены и графен, выглядят как черные или темно-коричневые, похожие на сажу порошки.
Использует
Углерод является уникальным среди элементов по своей способности образовывать прочно связанные цепи, запечатанные атомами водорода. Эти углеводороды, добываемые естественным путем в виде ископаемого топлива (уголь, нефть и природный газ), в основном используются в качестве топлива. Небольшая, но важная фракция используется в качестве сырья для нефтехимической промышленности, производящей полимеры, волокна, краски, растворители, пластмассы и т. Д.Примеси углерода в виде древесного угля (из древесины) и кокса (из угля) используются при выплавке металлов. Это особенно важно в черной металлургии.Графит используется в карандашах, для изготовления щеток электродвигателей и футеровки печей. Активированный уголь используется для очистки и фильтрации. Он содержится в респираторах и кухонных вытяжках.Углеродное волокно находит множество применений как очень прочный, но легкий материал. В настоящее время он используется в теннисных ракетках, лыжах, удочках, ракетах и самолетах.Промышленные алмазы используются для резки горных пород и бурения. Алмазные пленки используются для защиты поверхностей, таких как бритвенные лезвия.Недавнее открытие углеродных нанотрубок, других фуллеренов и листов графена толщиной до атома произвело революцию в разработке оборудования в электронной промышленности и в нанотехнологиях в целом.150 лет назад естественная концентрация углекислого газа в атмосфере Земли составляла 280 частей на миллион. В 2013 году в результате сжигания ископаемого топлива с кислородом было 390 ppm. Атмосферный углекислый газ пропускает видимый свет, но предотвращает утечку инфракрасного излучения (естественный парниковый эффект). Это сохраняет температуру Земли достаточно теплой, чтобы поддерживать жизнь. Однако наблюдается усиление парникового эффекта из-за антропогенного повышения уровня углекислого газа в атмосфере. Это влияет на живые существа по мере изменения нашего климата.
Биологическая роль
Углерод необходим для жизни. Это потому, что он способен образовывать огромное количество цепочек разной длины. Когда-то считалось, что молекулы жизни на основе углерода можно получить только из живых существ. Считалось, что они содержат «искру жизни». Однако в 1828 г. из неорганических реагентов синтезировали мочевину и объединили разделы органической и неорганической химии.Живые существа получают почти весь углерод из углекислого газа, либо из атмосферы, либо растворенного в воде. Фотосинтез зеленых растений и фотосинтетического планктона использует энергию солнца для расщепления воды на кислород и водород. Кислород выделяется в атмосферу, пресную воду и моря, а водород соединяется с углекислым газом с образованием углеводов.Некоторые углеводы используются вместе с азотом, фосфором и другими элементами для образования других мономерных молекул жизни. К ним относятся основания и сахара для РНК и ДНК и аминокислоты для белков.Живые существа, которые не фотосинтезируют, должны полагаться на потребление других живых существ в качестве источника молекул углерода. Их пищеварительная система расщепляет углеводы на мономеры, которые они могут использовать для построения собственных клеточных структур. Дыхание обеспечивает энергию, необходимую для этих реакций. При дыхании кислород присоединяется к углеводам, снова образуя углекислый газ и воду. Энергия, выделяемая в этой реакции, становится доступной для клеток.
Природное изобилие
Углерод содержится в Солнце и других звездах, образованных из обломков предыдущей сверхновой. Он образуется в результате ядерного синтеза более крупных звезд.Он присутствует в атмосферах многих планет, обычно в виде двуокиси углерода. На Земле концентрация углекислого газа в атмосфере в настоящее время составляет 390 частей на миллион и продолжает расти.Графит естественным образом встречается во многих местах. Алмаз находится в виде микроскопических кристаллов в некоторых метеоритах. Природные алмазы находятся в минеральном кимберлите, источники которого находятся в России, Ботсване, ДР Конго, Канаде и Южной Африке.В сочетании углерод содержится во всех живых существах. Он также находится в окаменелых останках в виде углеводородов (природный газ, сырая нефть, горючие сланцы, уголь и т. Д.) И карбонатов (мел, известняк, доломит и т. Д.).
История химического элемента Углерод
Химические свойства
| Атомный радиус, несвязанный (Å) | 1,70 | Ковалентный радиус (Å) | 0,75 |
| Сродство к электрону (кДж моль -1 ) | 121,776 | Электроотрицательность (шкала Полинга) | 2,55 |
| Энергия ионизационной (кДж моль -1 ) | 1- й 1086.4542- й 2352,6313- й4620,4714 чт 6222,7165 чт 37830,6486 чт 47277,1747 чт -8 чт- |
Состояния окисления и изотопы Углерод
| Общие состояния окисления | 4, 3, 2, 1, 0, -1, – 2, -3, -4 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 12 С | 12.000 | 98,93 | – | – | |
| 13 С | 13.003 | 1.07 | – | – | |
| 14 С | 14.003 | – | 5715 г | β- |
Данные о давлении и температуре
| Удельная теплоемкость (Дж кг −1 K −1 ) | 709 (графит) | Модуль Юнга (ГПа) | Неизвестно | |||||||
| Модуль сдвига (ГПа) | Неизвестно | Объемный модуль (ГПа) | 542 (алмаз); 33 (графит) | |||||||
| Давление газа | ||||||||||
| Температура (K) | 400600800100012001400160018002000 г.22002400 | |||||||||
| 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 г. | 2200 | 2400 |
| Давление (Па) | ———– | |||||||||
| – | – | – | – | – | – | – | – | – | – | – |
Связанные энтальпии
| Ковалентная связь Энтальпия (кДж моль -1 ) Найти в C – C 345,6 Общее C = C 610 Общее C≡C 835,1 Общее C – N 304,6 Общее C = N 615 Общее C≡N 889,5 Общее C – F 485 CF 4 C – Si 301 (CH 3 ) 4 Si C – Cl 339 Общее C – Cl 327,2 CCl 4 C – I 218 Общее C – I 213 CH 3 I C – Br 285 Общее C – H 413 Общее C – H 415,5 CH 4 C – O 357,7 Общее C = O 803 CO 2 C = O 695 HCHO C = O 736 альдегиды C = O 749 кетоны C – O 335,6 СН 3 ОН | ||
| Ковалентная связь | Энтальпия (кДж моль -1 ) | Найти в |
| C – C | 345,6 | Общее |
| C = C | 610 | Общее |
| C≡C | 835,1 | Общее |
| C – N | 304,6 | Общее |
| C = N | 615 | Общее |
| C≡N | 889,5 | Общее |
| C – F | 485 | CF 4 |
| C – Si | 301 | (CH 3 ) 4 Si |
| C – Cl | 339 | Общее |
| C – Cl | 327,2 | CCl 4 |
| C – I | 218 | Общее |
| C – I | 213 | CH 3 I |
| C – Br | 285 | Общее |
| C – H | 413 | Общее |
| C – H | 415,5 | CH 4 |
| C – O | 357,7 | Общее |
| C = O | 803 | CO 2 |
| C = O | 695 | HCHO |
| C = O | 736 | альдегиды |
| C = O | 749 | кетоны |
| C – O | 335,6 | СН 3 ОН |
Написание
Опубликовано
Автор:
/
Нет комментариев
Написание слова
Углерод — слово пишется через букву «е», так как оно относится к сложносокращенным словам, в которых соединительными гласными между основами могут быть только буквы «о» и «е».
Примеры употребления
Углерод в виде древесного угля известен очень давно.
Химический элемент углерод входит в состав всех живых существ.
К соединениям минерального характера, в состав которых входит углерод, относятся породы антрацита, каменного угля и другие.
Нашли ошибку? Выделите фрагмент текста и нажмите одновременно «левый Ctrl»+«Enter».
Читайте также:



Óãëåðîä (Ñ) íàõîäèòñÿ â IV ïîäãðóïïå ïåðèîäè÷åñêîé òàáëèöû Ä.È. Ìåíäåëååâà. Íà âíåøíåì óðîâíå 4 íåñïàðåííûõ ýëåêòðîíà. Óãëåðîä – íåìåòàëë. Îáëàäàåò âîññòàíîâèòåëüíûìè ñâîéñòâàìè.
Àëëîòðîïèÿ óãëåðîäà.
Óãëåðîä ñóùåñòâóåò â íåñêîëüêèõ àëëîòðîïíûõ ìîäèôèêàöèÿõ:
— ãðàôèò (èìååò ñëîèñòóþ ñòðóêòóðó, î÷åíü ïëàñòè÷åí),
— àëìàç (ñàìîå òâåðäîå ñîåäèíåíèå),
— Ñ60 (ôóëëåðåí).
Èç ãðàôèòà ìîæíî ïîëó÷èòü àëìàç ïóòåì äëèòåëüíîãî íàãðåâà ïðè âûñîêèì äàâëåíèåì. È àëìàç è ãðàôèò èìåþò ðàçëè÷íûå êðèñòàëëè÷åñêèå ðåøåòêè, âñëåäñòâèå ÷åãî íàáëþäàþòñÿ ðàçëè÷èÿ â ñâîéñòâàõ.
Õèìè÷åñêèå ñâîéñòâà óãëåðîäà.
1. Âçàèìîäåéñòâèå ñ êèñëîðîäîì:
Ñ + Î2 + ÑÎ2,
 íåäîñòàòêå êèñëîðîäà îáðàçóþòñÿ ìîíîîêñèäû:
2Ñ +Î2 = 2ÑÎ,
2. Ñî ñëîæíûìè âåùåñòâàìè:
Ñ + Î2 = 2ÑÎ,
Ñ + ÑÎ2 = 2ÑÎ,
3. Ïðè îáû÷íîé òåìïåðàòóðå âçàèìîäåéñòâóåò ñî ôòîðîì, ïðè íàãðåâàíèè – ñ õëîðîì, ñåðîé è àçîòîì:
4C + S8 = 4CS2,
2C + N2 = C2N2,
Ñ êðåìíèåì óãëåðîä îáðàçóåò êàáðîðóíä – ñîåäèíåíèå ïî òâåðäîñòè ñðàâíèìîå ñ àëìàçîì:
Si + C = SiC,
4. Ðàçáàâëåííûå êèñëîòû íå äåéñòâóþò íà óãëåðîä, à êîíöåíòðèðîâàííûå îêèñëÿþò:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O,
5. Óãëåðîä ó÷àñòâóåò â ðåàêöèÿõ â êà÷åñòâå âîññòàíîâèòåëÿ:
CuO + C = C + CO,
6. Ïðè íàãðåâå âçàèìîäåéñòâóåò ñ îêñèäàìè àêòèâíûõ ìåòàëëîâ, îáðàçóÿ êàðáèäû:
CaO + 3C = CaC2 + CO,
7. Ïðè âçàèìîäåéñòâèè ñ ìåòàëëàìè óãëåðîä âûñòóïàåò â êà÷åñòâå îêèñëèòåëÿ:
Ca + 2C = CaC2.
Êàëüêóëÿòîðû ïî õèìèè |
|
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè |
Õèìè÷åñêèå ýëåìåíòû |
|
| Õèìè÷åñêèå ýëåìåíòû Ïåðèîäè÷åñêîé ñèñòåìû Ìåíäåëååâà, ñâîéñòâà, âàëåíòíîñòü õèìè÷åñêèõ ýëåìåíòîâ | |
| Õèìè÷åñêèå ýëåìåíòû |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ |
|
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ |
Ñîåäèíåíèÿ õèìè÷åñêèõ ýëåìåíòîâ |
|
| Àëêàíû, âîäà, ãàëîãåíû, ìûëà, æèðû, ãèäðîêñèäû; îêñèäû, õëîðèäû, ïðîèçâîäíûå õèìè÷åñêèõ ýëåìåíòîâ òàáëèöû Ìåíäåëååâà | |
| Ñîåäèíåíèÿ õèìè÷åñêèõ ýëåìåíòîâ |
Âîäà. Ñâîéñòâà âîäû. |
|
| Âîäà íàèáîëåå øèðîêî ðàñïðîñòðàí¸ííîå ñîåäèíåíèå íà íàøåé ïëàíåòå. | |
| Âîäà. Ñâîéñòâà âîäû. |
Éîä. Ñâîéñòâà éîäà. |
|
| Éîä ( I 2 ) íàõîäèòñÿ â 7-îé ãðóïïå ïåðèîäè÷åñêîé òàáëèöû Ä. | |
| Éîä. Ñâîéñòâà éîäà. |
Общая характеристика углерода
Углерод находится в природе как в свободном состоянии, так и в виде многочисленных соединений. Свободный углерод встречается в виде алмаза и графита. Кроме ископаемого угля, в недрах Земли находятся большие скопления нефти. В земной коре встречаются в огромных количествах соли угольной кислоты, особенно карбонат кальция. В воздухе всегда имеется диоксид углерода. Наконец, растительные и животные организмы состоят из веществ, в образовании которых участие принимает углерод. Таким образом, этот элемент – один из распространенных на Земле, хотя общее его содержание в земной коре составляет всего около 0,1% (масс.).
Атомная и молекулярная масса углерода
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии углерод существует в виде одноатомных молекул С, значения его атомной и молекулярной масс совпадают. Они равны 12,0064.
Аллотропия и аллотропные модификации углерода
В свободном состоянии углерод существует в виде алмаза, кристаллизующегося в кубической и гексагональной (лонсдейлит) системе, и графита, принадлежащего к гексагональной системе (рис. 1). Такие формы углерода, как древесный уголь, кокс или сажа имеют неупорядоченную структуру. Также есть аллотропные модификации, полученные синтетическим путем – это карбин и поликумулен – разновидности углерода, построенные из линейных цепных полимеров типа -C= C- или = C = C= .
Рис. 1. Аллотропные модификации углерода.
Известны также аллотропные модификации углерода, имеющие следующие названия: графен, фуллерен, нанотрубки, нановолокна, астрален, стеклоуглерож, колоссальные нанотрубки; аморфный углерод, углеродные нанопочки и углеродная нанопена.
Изотопы углерода
В природе углерод существует в виде двух стабильных изотопов 12С (98,98%) и 13С (1,07%). Их массовые числа равны 12 и 13 соответственно. Ядро атома изотопа углерода 12С содержит шесть протонов и шесть нейтронов, а изотопа 13С – такое же количество протонов и пять нейтронов.
Существует один искусственный (радиоактивный) изотоп углерода 14Сс периодом полураспада равным 5730 лет.
Ионы углерода
На внешнем энергетическом уровне атома углерода имеется четыре электрона, которые являются валентными:
1s22s22p2.
В результате химического взаимодействия углерод может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
С0 –2e → С2+;
С0-4e → С4+;
С0+4e → С4-.
Молекула и атом углерода
В свободном состоянии углерод существует в виде одноатомных молекул С. Приведем некоторые свойства, характеризующие атом и молекулу углерода:
|
Энергия ионизации атома, эВ |
11,25 |
|
Относительная электроотрицательность |
2,55 |
|
Радиус атома, нм |
0,077 |
Сплавы углерода
Наиболее известные сплавы углерода во всем мире – это сталь и чугун. Сталь – это сплав железа с углеродом, содержание углерода в котором не превышает 2%. В чугуне (тоже сплав железа с углеродом) содержание углерода выше – от 2-х до 4%.
Примеры решения задач
Ответ:
Правильное написание слова — углерод
Ударение и произношение — углер`од
Значение слова -химический элемент, важнейшая составная часть всех органических веществ
Выберите, на какой слог падает ударение в слове — НОВОРОЖДЁННЫЙ ?
или
Слово состоит из букв:
У,
Г,
Л,
Е,
Р,
О,
Д,
Похожие слова:
железоуглеродистый
обезуглеродить
сероуглерод
сероуглеродный
углеродистый
углеродный
Рифма к слову углерод
новгород, брод, народ, род, город, сумасброд, кислород, свод, вывод, пчеловод, выгод, переход, молод, эпизод, взвод, повод, приход, отвод, холод, выход, доход, пагод, плод, господ, под, синод, год, обход, невзгод, голод, проход, подвод, ход, вход, исход, развод, сход, период, завод, поход
Толкование слова. Правильное произношение слова. Значение слова.